-
Medical journals
- Career
Fertilitu šetřící terapie u ektopické gravidity
Authors: Borek Sehnal 1; J. Hanáček 2; J. Matěcha 1; Michael Fanta 3
Authors‘ workplace: Gynekologicko-porodnická klinika 1. LF UK a FN Bulovka, Praha 1; Ústav pro péči o matku a dítě, 3. LF UK, Praha 2; Gynekologicko-porodnická klinika 1. LF UK a VFN v Praze 3
Published in: Ceska Gynekol 2023; 88(1): 20-26
Category: Review Article
doi: https://doi.org/10.48095/cccg202320Overview
Cíl: Přehled současných znalostí o možnostech fertilitu šetřící terapie v případě ektopického těhotenství. Metodika a výsledky: Ektopické těhotenství je definováno jako implantace embrya mimo dutinu děložní, a to nejčastěji ve vejcovodu. Tato diagnóza je velmi častá u mladých žen. Ektopické těhotenství lze léčit pomocí následujících tří přístupů, které lze kombinovat: expektačně, farmakologicky nebo chirurgicky. Při chirurgické léčbě může být provedena fertilitu šetřící salpingostomie. Medikamentózní (farmakologická) léčba spočívá v aplikaci metotrexátu s úspěšností 75–96 % v závislosti na vstupní hladině volné beta podjednotky lidského choriového gonadotropinu (b-hCG). Jedná se o léčbu bezpečnou, s minimem nežádoucích účinků. Neexistuje standardizovaná hranice sérové hodnoty b-hCG nebo velikosti masy ektopické gravidity pro výběr expektační, chirurgické nebo farmakologické léčby. Značný nárůst počtu císařských řezů v posledních desetiletích vedl ke zvýšení výskytu těhotenství v děložní jizvě po císařském řezu. Existuje několik možností, jak řešit tuto diagnózu, ale žádná není jednoznačně preferována. Tato problematika je v článku také diskutována. Závěr: Cílem léčby ektopické gravidity je zvolit bezpečnou a efektivní terapii s nízkým výskytem nežádoucích účinků a se zachováním maximální možnosti fertility žen. Při výběru správného postupu jsou nejdůležitější vhodně nastavená indikační kritéria.
Klíčová slova:
bezpečnost – farmakologická léčba – účinnost – gravidita v jizvě po císařském řezu – ektopické těhotenství – cervikální gravidita
Úvod
Mimoděložní těhotenství (GEU – graviditas extrauterina) je definováno jako implantace oplodněného oocytu mimo dutinu děložní, resp. mimo endometrium. Proto je správnější název ektopická gravidita (EG), protože mezi GEU patří i v gravidita implantovaná v děložním rohu (kornuální) a v děložním hrdle (cervikální). Incidence EG se v běžné populaci pohybuje ve frekvenci 1 případ na 50–100 porodů [1], v ČR je každý rok hlašeno 1–2 000 připadů GEU. Počet úmrtí byl v USA mezi lety 1991 a 1999 vypočítán na 31,9 na 100 000 případů mimoděložního těhotenství (riziko úmrtí bylo 6,8krát vyšší u černošek než u bělošek) [1]. Příznaky EG se většinou projeví po 7týdenní amenoree, dominantní je bolest břicha (97 %) a vaginální krvácení (79 %) [2]. Nejspolehlivějším jednorázovým diagnostickým nástrojem je provedení transvaginálního ultrasonografického vyšetření (TVUS) se spolehlivostí okolo 75 %, což potvrdila i původní česká práce [3]. Jiná česká retrospektivní studie uvádí dokonce 82% úspěšnost správné diagnózy ektopických gravidit už při prvním TVUS [4]. Opakováním TVUS zvláště v kombinaci se sledováním dynamiky sérové hladiny volné beta podjednotky lidského choriového gonadotropinu (b-hCG) se senzitivita záchytu zvyšuje na 87–99 % a specificita na 94–99 % [5]. U žen s EG lze zvolit jeden ze tří postupů, které lze i vzájemně kombinovat:
1. expektační postup, observace;
2. chirurgická léčba, operace;
3. farmakologická léčba, podání léčivých přípravků.
Expektační postup u tubární ektopické gravidity
Ektopická gravidita je v 95–97 % lokalizována ve vejcovodu, z toho v 70–80 % v její ampulární části. Expektační postup je možné použít u hemodynamicky stabilní, asymptomatické ženy s klesající sérovou hladinou b-hCG < 1 000 IU/l [6]. Jiné práce doporučují maximální vstupní hodnotu b-hCG od < 200 UI/l do < 1 500 IU/l [7,8]. Sérové hladiny b-hCG je nutné sériově vyšetřovat až do negativity, zpočátku každých 48 hod. Pacientka by měla být řádně poučena, musí souhlasit s pravidelnými kontrolami, znát možnost potenciálního selhání metody a vše stvrdit podpisem informovaného souhlasu [6]. Pokud hladina b-hCG neklesá, je třeba zvolit některý z aktivních přístupů. K ruptuře vejcovodu může dojít i při nízkých sérových hladinách b-hCG. I když se podle některých mezinárodních protokolů expektační přístup nedoporučuje, existuje stále více důkazů o tom, že je bezpečný a může být při správném nastavení indikačních kritérií použit až u 1/3 pacientek s mimoděložním těhotenstvím s mírou úspěšnosti 47–82 % [9–11].
Chirurgická léčba tubární ektopické gravidity
Chirurgický přístup je u tubární EG v ČR nejčastější. V rozvinutých zemích, mezi něž patří ČR, by všechny operace pro GEU měly být provedeny endoskopicky (existují výjimky, např. selhání techniky nebo interně anesteziologická kontraindikace). Při chirurgické léčbě se nejčastěji operatér rozhodne vejcovod odstranit (salpingektomie), ale lze provést i tzv. konzervativní fertilitu šetřící operaci se zachováním postiženého vejcovodu (salpingostomie) [12]. Samotné provedení salpingostomie nebývá technicky obtížné. Použít lze monopolární i bipolární koagulaci, která by se ale na druhou stranu měla použít v těchto případech co nejméně. Náročnější může být kompletní odstranění těhotenské tkáně uvnitř vejcovodu. Může se využít proplach tuby laparoskopickou kanylou nebo proplach vejcovodu z dutiny děložní pomocí hysteroskopu [12]. Sutura tuby v místě stomie se nedoporučuje [12]. Další alternativa při chirurgické léčbě, lokální aplikace metotrexátu nebo hyperosmolárního roztoku do místa nidovaného plodového vejce, byla prakticky opuštěna. Tuto techniku lze ale využít v případě cervikální gravidity, zvláště v případě nidace GEU v jizvě po císařském řezu.
Vždy záleží na konkrétních podmínkách a především na zkušenostech operatéra, kterou techniku zvolí. Laparoskopická salpingostomie, kterou poprvé popsali Bruhat et al v roce 1978, byla uvedena do praxe s potenciální perspektivou vyšší pravděpodobnosti spontánní intrauterinní gravidity po operaci [13]. Nicméně mnoho studií předpoklad vyšší schopnosti spontánně otěhotnět po salpingostomii nepotvrdily [1,14,15]. Metaanalýza randomizovaných prospektivních kontrolních studií neukázala rozdíly ve frekvenci spontánních intrauterinních gravidit mezi skupinami po salpingostomii a salpingektomii (p = 0,61) na rozdíl od metaanalýzy retrospektivních studií, kde byla frekvence spontánních intrauterinních gravidit vyšší u žen po salpingostomii (p = 0,002) [14]. Odlišné výsledky mezi randomizovanými kontrolními studiemi a retrospektivními studiemi lze vysvětlit odlišnými indikačními kritérii při operaci pro tubární EG u retrospektivních studiích. Salpingektomie byly v těchto studiích prováděny většinou u žen s velkou masou ektopické gravidity a/nebo s devastovaným vejcovodem a také u žen starších s menší touhou další gravidity, zatímco salpingostomie byly indikovány u mladších žen s intaktním, mírně rozšířeným vejcovodem. Pokud se tyto faktory eliminovaly, výsledky všech studií byly srovnatelné a nezaznamenaly významné rozdíly v plodnosti po obou typech operačního výkonu [14].
Jednoznačná výhoda salpingektomie spočívá v téměř 100% eliminaci rizika přetrvávající a opakované ektopické gravidity. Podle některých studií může přetrvávat choriová tkáň v tubě po salpingostomii ve 4–15 % [16]. Po salpingektomii většinou není nutné kontrolovat hladiny hCG, čímž odpadnou další kontroly ve zdravotnickém zařízení. Podle doporučeného postupu britské odborné společnosti (RCOG – Royal College of Obstetricians and Gynaecologists – Guideline No. 21) je při operačním řešení tubární ektopické gravidity jednoznačně preferována laparoskopie před laparotomií (nejvyšší stupeň doporučení A podle EBM – evidence-based medicine – medicíny založené na důkazech) a salpingektomie je preferována před salpingostomí zvláště v případě intaktního druhostranného vejcovodu (stupeň doporučení B podle EBM) [8]. Provedení salpingostomie se může zvážit u žen s anamnézou rizikových faktorů neplodnosti nebo s poškozením kontralaterálního vejcovodu (stupeň doporučení C podle EBM), ale sérové hodnoty b-hCG by měly být sledovány po operaci až do negativity. Pacientky by měly být také poučeny o malé pravděpodobnosti nutnosti systémové aplikace metotrexátu či provedení salpingektomie při neklesání hodnot b-hCG [8].
Farmakologická léčba tubární ektopické gravidity
K farmakologické léčbě ektopické gravidity se nejčastěji používá metotrexát. Metotrexát (MTX – antagonista a antimetabolit kyseliny listové) inaktivuje dihydrofolát reduktázu a de novo syntézu purinů a pyrimidinů, a tím i buněčné DNA. Brání růstu rychle rostoucích buněk vč. buněk trofoblastu a po intravenózním podání se vyloučí v 90 % v nezměněné podobě během 24 hod [17]. První práce o úspěšné medikamentózní terapii ektopické gravidity byla publikována v roce 1982 [18]. Při správném výběru pacientek má tato metoda srovnatelnou úspěšnost s laparoskopicky provedenou salpingostomií, a to jak z hlediska další průchodnosti vejcovodu, tak i úspěšnosti další nitroděložní gravidity. Stejně i riziko další ektopické gravidity je u obou postupů shodné [6].
Výběr vhodné skupiny pacientek je zásadní pro úspěšnost farmakologické terapie. Většinou se jako indikační kritéria pro farmakologickou léčbu EG uvádí hemodynamicky stabilní, asymptomatická pacientka, sérová hodnota hladiny b-hCG < 5 000 IU/l (podle některých prací < 10 000 IU/l), největší rozměr ektopické gravidity do 3–4 cm při měření TVUS, gestační věk < 9 týdnů nebo délka embrya do 10 mm, nevitální plodová tkáň bez akce srdeční, nepřítomnost hemoperitonea (event. přítomnost volné tekutiny v pánvi do 100 ml), normální laboratorní renální a jaterní parametry a nepřítomnost jiných kontraindikací k podání MTX (kojení, koexistující intrauterinní gravidita, imunodeficience pacientky, aktivní plicní onemocnění, vředová choroba gastroduodenální) [6,14,19–26]. Pacientka musí být před terapií MTX poučena o nutnosti dalšího sledování vč. laboratorních odběrů a o možnosti selhání terapie s nutností provedení laparoskopie, někdy i při poklesu hladin b-hCG. Proto je nutné z organizačního i demografického hlediska zajistit nepřetržitou rychlou dostupnost akutní zdravotní péče.
Metotrexát může být podáván buď systémově (intravenózně, intramuskulárně, perorálně), nebo lokálně pomocí jehly přímo do místa ektopické gravidity. Dávka MTX používaná k léčbě ektopické gravidity (50 mg/m2 povrchu těla nebo 1 mg/kg hmotnosti) je relativně malá. Existují dva nejpoužívanější protokoly podávání MTX, které spočívají v intramuskulárním podání jedné nebo více dávek [6]. Obecně je preferován režim jednodávkový pro nižší množství nežádoucích účinků, snazší monitorování během léčby, nižší cenu a srovnatelnou úspěšnost ve srovnání s vícedávkovým schématem. I u jednodávkového režimu se může podání MTX opakovat v intervalu 1 týdne. Druhá dávka je potřeba asi u 15–20 % pacientek, tři dávky u < 1 % žen [19]. Při neadekvátním poklesu hodnoty b-hCG po třetí dávce je indikováno chirurgické řešení. Mezi jednodávkovým a vícedávkovým režimem není rozdíl v následné průchodnosti vejcovodů, úspěšnosti dalších těhotenství a opakování EG. Antimetabolitem MTX je kyselina folinová – leukovorin. Ten je podáván pacientkám v rámci vícedávkového schématu [6]. Postup při systémové aplikaci MTX ve FN Bulovka zobrazuje tab. 1.
Table 1. Postup při farmakologické léčbě tubární ektopické gravidity nebo gravidity nejasné lokalizace ve FN Bulovka.
Tab. 1. Procedure for the pharmacological treatment of tubal ectopic pregnancy or pregnancy of unclear localization at the Bulovka Hospital.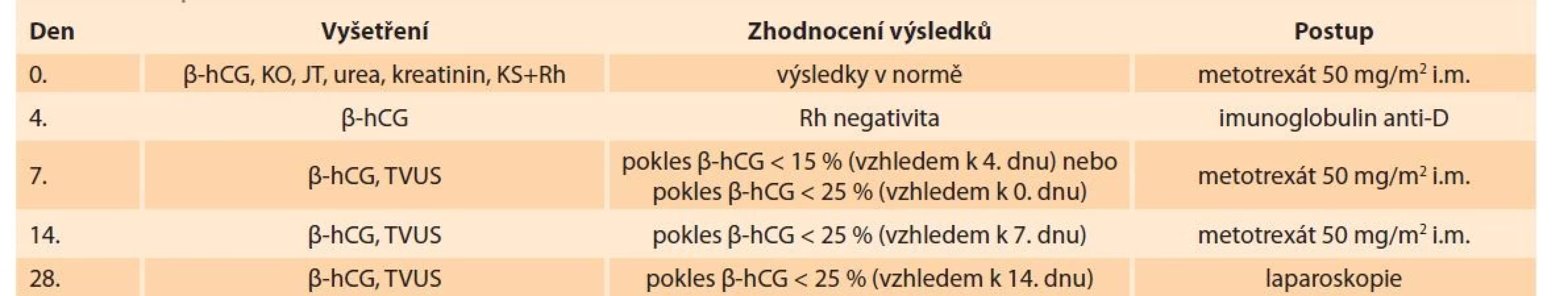
β-hCG – volná beta podjednotka lidského choriového gonadotropinu, JT – jaterní testy (AST, ALT, GMT), KO – krevní obraz, KS+Rh – krevní skupina + Rh faktor, TVUS – transvaginální ultrasonografické vyšetření Hladinu b-hCG je třeba ambulantně sledovat až do nulové hodnoty, které se dosáhne obvykle za 2–3 týdny, ale při vyšších vstupních hodnotách až za 6–8 týdnů [19]. Navíc během prvních několika dnů po aplikaci MTX dochází k vzestupu hladiny b-hCG v důsledku vyšší produkce buňkami syncytiotrofoblastu, i když produkce buňkami cytotrofoblastu ustává. Pacientka by neměla být během terapie zbytečně vyšetřována ani palpačně, ani ultrazvukem, neboť při tlaku hrozí ruptura ektopické gravidity. Ultrazvukové vyšetření je indikováno při zvyšující se hladině b-hCG nebo při podezření na rupturu ektopické gravidity. Bolesti v podbřišku, které nejsou známkou ruptury, se často objevují za 6–7 dní od začátku aplikace a trvají většinou 1–2 dny. Dále pacientka musí být poučena o potřebě sexuální abstinence a měla by omezit pobyt na přímém slunci, po podávání MTX hrozí riziko rozvoje dermatitidy.
Asi 30 % pacientek s jednodávkovým protokolem podání MTX má nežádoucí účinky, které jsou obvykle mírné [19]. Nejčastěji se vyskytuje stomatitida, konjunktivitida a meteorizmus. Elevace jaterních testů se normalizuje do 2 týdnů po ukončení terapie. Po podání MTX nebyla zaznamenána vyšší incidence vrozených malformací plodu ani negativní vliv na další koncepci. Podle doporučeného postupu britské odborné společnosti RCOG (Royal College of Obstetricians and Gynaecologists) může být léčba GEU systémovou aplikací MTX nabídnuta vhodným adeptkám, ale až po jednoznačném stanovení diagnózy s vyloučením menší intrauterinní vitální gravidity (stupeň doporučení B podle EBM). Hemodynamicky stabilním ženám s klesajícími hodnotami a s iniciální hodnotou b-hCG < 1 500 IU/l může být nabídnut expektační management bez terapeutické intervence (stupeň doporučení B podle EBM) [8].
Cervikální gravidita a gravidita v jizvě po císařském řezu
Při cervikální graviditě dochází k nidaci plodového vejce do stromatu děložního hrdla. Incidence cervikální gravidity se uvádí 1 případ na 10 000 porodů [27]. Nicméně s nárůstem používání metod asistované reprodukce a především počtu císařských řezů se neustále zvyšuje výskyt gravidity v jizvě po císařském řezu (CSP – cesarean scar pregnancy), kdy dochází k implantaci gestačního váčku přímo do oblasti jizvy na děloze [28]. Kazuistiky CPS byly publikovány i v české literatuře [28–30]. Incidence CPS se podle literatury odhaduje na 1 případ na každých 1 800–2 216 gravidit [20,31]. U žen s anamnézou alespoň jednoho císařského řezu tvoří CPS dokonce 6 % všech ektopických gravidit a při vyšším počtu císařských řezů se riziko CPS dále zvyšuje [20]. Terapie cervikální gravidity a CSP je prakticky identická a v obou případech je zásadní správná ultrasonografická diagnostika, kdy je třeba tento typ ektopické gravidity odlišit od probíhajícího spontánního abortu nitroděložního těhotenství. Léčba cervikální gravidity vč. CSP umožňuje zachovat fertilitu v naprosté většině případů, i když při CSP hrozí ruptura dělohy s rizikem závažného krvácení a negativním vlivem na budoucí fertilitu [32]. Jako jeden z možných postupů se popisuje i expektační management s předpokladem budoucího spojení gestačního váčku s děložní dutinou a pokračováním gravidity. Dle současných poznatků je CSP prekurzorem invazivního růstu placenty s vytvořením tzv. placenta accreta spectrum (PAS), která má stejný histologický podklad jako placenta accreta s pevnou invazí placentárních klků do fibrózní tkáně jizvy [32]. Při donošení takové gravidity je často zapotřebí provést postpartální hysterektomii [33]. Podle metaanalýzy z roku 2017 více než polovina žen s CPS (57 %) po observačním postupu porodilo živý plod, ale u 63 % z nich bylo nutné provést hysterektomii z důvodu placenta accreta nebo ruptury dělohy ve II. trimestru [34]. V jiném přehledovém článku popisujícím šest případů CPS s expektačním postupem došlo u třech žen k ruptuře dělohy s nutností provedení hysterektomie [20]. Z těchto důvodů je tento přístup v současnosti minoritní, lze ho však zvažovat při průkazu nevitální gravidity s klesajícími hodnotami b-hCG [20,33,34].
Lze zvolit i farmakologickou léčbu. Systémové podání MTX je v tomto případě často neúčinné, protože jizva je tvořena fibrózní tkání bez cévního zásobení, což významně omezuje přístup účinné látky do místa nidace ektopické gravidity. Preferovanou alternativou je lokální aplikace MTX přímo do plodového vejce pod kontrolou ultrazvuku. Výhodou přímé aplikace MTX do gestačního váčku je vysoká lokální koncentrace léčiva a možnost alespoň částečně struktury plodového vejce odsát [20,33].
Ve FN Bulovka se nejčastěji využívá cílená lokální aplikaci MTX do oblasti plodového vejce (i opakovaná v 7denních intervalech) při pravidelných ultrazvukových kontrolách a sledování sérových hodnot b-hCG. V případě nedostatečného poklesu hladiny b-hCG se lokální aplikace opakuje nebo se MTX aplikuje intramuskulárně. Při této formě terapie dochází ve srovnání s chirurgickým řešením CSP k pozvolnějšímu poklesu hladin b-hCG během 21–140 dnů (medián 40 dnů) a ultrazvukový obraz masy v jizvě může přetrvávat až několik měsíců [31].
Práce publikovaná v roce 1998 zahrnuje 52 žen s cervikální graviditou léčených primárně pomocí MTX (lokálně, systémově nebo obojí). Celkově byla zaznamenána úspěšnost terapie 61,5 %, a pokud nebyla přítomna akce srdeční plodu, dosáhla úspěšnost dokonce 90,9 % [35]. Timor-Tritsch et al doporučují aplikaci 25 mg MTX do oblasti embrya, 25 mg MTX do oblasti placenty a 25 mg MTX intramuskulárně. Tento přístup byl úspěšný i při vysokých hodnotách b-hCG [31]. Metaanalýza zahrnující 63 studií zabývajících se léčbou CSP uvádí úspěšnost terapie MTX 56 % po systémovém podání, 60 % po lokálním a 77 % po kombinované terapii MTX [34].
Operační řešení cervikální gravidity vč. CSP spočívá ve využití rozmanitých chirurgických přístupů. Instrumentální revize dutiny děložní (RCUI – revisio cavi uteri instrumentalis) zvyšuje riziko komplikací, zejména perforaci dělohy, poranění močového měchýře a život ohrožujícího krvácení. Hysteroskopie je bezpečnější, ale vyžaduje minimální nepostiženou sílu myometria > 2 ml [36]. Riziko komplikací vč. krvácení snižuje kombinace se systémovou aplikací MTX či s embolizací uterinních arterií. Tato kombinovaná terapie by měla být využita zejména u gravidit s hladinou b-hCG > 15 000 IU/l [37]. Výhodou chirurgického laparoskopického přístupu je možnost rekonstrukce dolního děložního segmentu v jedné době. Z dalších terapeutických možností literatura uvádí lokální aplikaci KCl. Zajímavou alternativou je zavedení dvoubalonkového katétru do oblasti cervikální gravidity na dobu 1–5 dnů pod ultrazvukovou kontrolou [33]. Jedná se o jednoduchou techniku, která nepotřebuje žádnou další podpůrnou terapii a efektivně staví krvácení s útlumem vitálních projevů gravidity. Touto metodou byly úspěšně léčeny tři vitální cervikální gravidity a sedm vitálních CSP s mediánem gestačního stáří 6+6 (6+1 až 7+4). Sledování sérové hodnoty b-hCG do nulové hodnoty trvalo v průměru 49 dnů (28–97 dnů) [33]. V případě cervikální gravidity a gravidity v jizvě po císařském řezu jsou doporučení podle EBM neprůkazná. V obou případech je efekt systémové aplikace MTX či úspěšnosti chirurgické intervence hodnocen nejnižším stupněm doporučení D podle EBM [8].
Diskuze
Standardním chirurgickým výkonem při nejčastější lokalizaci EG ve vejcovodu je v ČR laparoskopická salpingektomie, a to i v případech neakutních situací bez známek krvácení do dutiny břišní či bez ruptury vejcovodu. V roce 1978 byla publikována technika laparoskopické salpingostomie se zachováním vejcovodu s perspektivou vyšší pravděpodobností dalšího spontánního otěhotnění [13,14]. O výhodách a nevýhodách salpingektomie vs. salpingostomie se diskutuje již řadu let. Podle dostupných důkazů převládá konsenzus, že salpingektomie dlouhodobě nesnižuje u žen se zdravou kontralaterální tubou plodnost [14]. Dalším diskutovaným faktorem je kvalita cévního zásobení ovaria po salpingektomii. Např. Chan et al prokázali, že cévní zásobení ovaria po salpingektomii se zdá být částečně narušené ve srovnání s neoperovanou stranou, a spekulují, že menší přísun krve může mít za následek sníženou funkci ovaria [38]. Gelbaya et al zjistili významné snížení hladiny folikuly stimulujícího hormonu (FSH) a estradiolu (E2) v den aplikace hCG u pacientek léčených metodami asistované reprodukce s anamnézou salpingektomie [39]. Na druhou stranu v prospektivní studii zahrnující 102 pacientek Lass et al nepozorovali žádný negativní účinek na celkový počet získaných oocytů po stimulaci ovarií u žen po salpingektomii, i když celkový počet odebraných oocytů byl z ovaria na straně po salpingektomií menší než z kontralaterálního vaječníku [40]. K obdobnému názoru dospěli i Dar et al, když konstatovali, že salpingektomie nezměnila ovariální odpověď na stimulaci v cyklech IVF (in vitro fertilizace) [41]. Metaanalýza zabývající se touto problematikou nezjistila u žen po salpingektomii statisticky významné rozdíly v hladinách antimülleriánského hormonu, FSH a estradiolu. Provedení salpingektomie nemělo vliv ani na ovariální rezervu ve smyslu snížení celkového počtu foliklů (AFC – antral follicle count), ani na snížení počtu získaných oocytů po stimulaci [15]. Pouze celkové dávky gonadotropinu při stimulaci vaječníků při léčbě neplodnosti byly vyšší ve skupině po salpingektomii, ale doba stimulace (doba podání gonadotropinů) byla v obou skupinách obdobná [15]. Velká retrospektivní analýza v USA zjistila, že z 62 588 žen s diagnostikovaným tubárním GEU mezi roky 2006 a 2015 podstoupilo 49 090 (78,4 %) operaci (salpingektomie nebo salpingostomie) a 13 498 (21,6 %) ženám byl aplikován MTX. Rozbor operací odhalil pokles konzervativní salpingostomie z 13,0 % v roce 2006 na 6,0 % v roce 2015, a s tím adekvátní nárůst provedení salpingektomie (p < 0,001) [1]. Podle recentních literárních údajů nesnižuje salpingektomie dlouhodobě u zdravých žen plodnost a nemá žádný negativní vliv na ovariální rezervu a ovariální odpověď při stimulaci ve srovnání se ženami po salpingostomii [14,15]. Proto u žen operovaných pro tubární ektopickou graviditu a se zdravou kontralaterální tubou by měla být povedena salpingektomie [14]. Jednoznačnou podporu má provedení salpinektomie také u pacientek zařazených do léčby metodami asistované reprodukce [12].
Až 35 % žen s ektopickou graviditou splňuje podmínky pro farmakologickou terapii [22]. Účinnost a bezpečnost MTX v léčbě GEU byla opakovaně publikována [19–26]. Podle metaanalýzy zahrnující 1 327 žen s ektopickou graviditou byla úspěšnost terapie MTX stanovena na 89 % (vícedávkový režim 92,7 %, jednodávkový 88,1 %) [19]. Úspěšnost léčby pomocí MTX je nepřímo úměrná sérové koncentraci b-hCG a v literatuře se udává mezi 75 % a 96 % v závislosti na vstupní hladině b-hCG [23,24]. Při hodnotě b-hCG < 5 000 mUI/l se úspěšnost léčby pohybuje kolem 96 %, při hodnotách 5 000–9 999 UI/l klesá na 85 % [13,19,21,25]. Například v retrospektivní studii z Brazílie bylo 41,2 % pacientek léčených MTX indikováno k chirurgické léčbě. Relativně nízkou úspěšnost léčby MTX lze vysvětlit vysokou vstupní hodnotou b-hCG, která dosáhla v průměru 18 434 UI/l [7].
V původní české práci bylo analyzováno 56 pacientek léčených MTX v dávce 1 mg/kg intramuskulárně. Z toho 48 (86 %) pacientek mělo klinicky i laboratorně potvrzenu diagnózu EG a osm (14 %) pacientek bylo léčeno pro perzistentní těhotenství neznámé lokalizace. U celkem 41 (73 %) pacientek byla terapie MTX úspěšná, negativní hodnoty b-hCG < 5 IU/l bylo dosaženo v průměru za 27 (± 7) dnů [42]. Jedna dávka byla dostatečná u 22 žen (54 %), dvě dávky obdrželo 17 žen (41 %) a tři dávky dvě (5 %) ženy. U 15 (27 %) pacientek byla indikována laparoskopie z indikace neadekvátní pokles b-hCG (devět žen, 60 %), subjektivní zhoršení stavu (pět žen, 33 %) a zvětšení hematosalpingu při ultrazvukovém vyšetření (jedna žena, 7 %). Ani v jednom případě nebyla peroperačně zjištěna ruptura tuby s hemoperitoneem [42]. Analýza dat z USA z období 2006–2015 odhalila, že při léčbě tubární ektopické gravidity se použití MTX významně zvýšilo z 14,5 % případů v roce 2006 na 27,3 % v roce 2015, zatímco chirurgická léčba ve stejném období poklesla z 85,5 % na 72,7 % (p < 0,001) [1]. U žen s anamnézou tubární ektopické gravidity je udáváno riziko opakování GEU asi v 8–15 %, přičemž nebyl zaznamenán rozdíl mezi chirurgickou a medikamentózní terapií [6]. Otázkou také zůstává, za jak dlouho může žena po léčbě MTX opět otěhotnět. Starší literatura doporučuje neotěhotnět po dobu 6 měsíců, ale otěhotnění za 3 měsíce po ukončení aplikace není rizikové [8]. Někteří autoři doporučují rutinní užívání kyseliny folinové [19].
Stejné postupy (observační, chirurgický, farmakologický) lze použít i v případě vzácné kornuální (intersticiální) gravidity. Jedná se o zvláštní formu tubární gravidity, kdy plodové vejce niduje v istmické části vejcovodu, tzn. v místě průchodu vejcovodu svalovinou v rohu děložním [43]. V české literatuře je popsán i případ donošení plodu při této formě gravidity do 36. týdne s porodem zdravého plodu císařským řezem [43].
Volba nejvhodnější terapie gravidity v jizvě po císařském řezu je kontroverzní. Nejspolehlivější je chirurgické vytětí (laparoskopické, laparotomické, vaginální) a resutura defektu, při nichž se udává > 96% úspěšnost s minimálním rizikem krvácení < 4 % [34]. Také hysteroskopická resekce je poměrně spolehlivá, podle metaanalýzy pouze u 12 % případů bylo nutné použít i jinou formu terapie z důvodů nedostatečného poklesu hodnoty b-hCG [34]. Prostá instrumentální revize dutiny děložní a hrdla byla zatížena 28% rizikem krvácení, které se ale při současné embolizaci uterinních arterií snížilo na 4 % [34]. RCUI je v kombinaci s embolizací uterinních arterií bezpečnou alternativou, připojení hysteroskopie významně nezvyšuje úspěšnost léčby (RR 0,91; 95% IS: 0,81–1,03) [44]. Farmakologická léčba CSP je podle literatury často neúčinná [34]. Podle Cochranovy databáze se účinnost farmakologické léčby MTX při kombinaci s embolizací uterinních arterií nezvyšuje (RR 1,00; 95% IS: 0,90–1,12), a to ani při chemoembolizaci uterinních arterií (RR 0,87; 95% IS: 0,54–1,38) [44]. Bylo ale prokázáno, že při embolizaci uterinních arterií se významně snižuje krevní ztráta [44].
Závěr
Terapie ektopické gravidity není jen otázkou akutního, život zachraňujícího výkonu. Snahou je najít bezpečnou a efektivní terapii s nízkým výskytem nežádoucích účinků a zachováním fertility žen. Vhodně vybrané skupině žen můžeme nabídnout fertilitu zachovávající operační řešení, farmakologickou terapii se systémovou nebo lokální aplikací MTX a v ojedinělých případech i observační postup. Při volbě nejlepšího postupu jsou nejdůležitější správně nastavená indikační kritéria.
ORCID autorů
B. Sehnal 0000-0003-2622-2181
J. Hanáček 0000-0002-7976-9079
J. Matěcha 0000-0002-3813-4720
M. Fanta 0000-0002-8759-2533
Doručeno/Submitted: 13. 6. 2022
Přijato/Accepted: 13. 9. 2022
MUDr. Borek Sehnal, Ph.D.
Gynekologicko-porodnická klinika
1. LF UK a FN Bulovka
Budínova 67/2
180 81 Praha 8
Sources
1. Hsu JY, Chen L, Gumer AR et al. Disparities in the management of ectopic pregnancy. Am J Obstet Gynecol 2017; 217 (1): 49.e1–49.e10. doi: 10.1016/j.ajog.2017.03.001.
2. Tay JI, Moore J, Walker JJ. Ectopic pregnancy. BMJ 2000; 320 (7239): 916–919. doi: 10.1136/ bmj.320.7239.916.
3. Derbak A. Mimoděložní těhotenství v ultrazvukovém obraze. Kazuistiky. Retrospektivní analýza. Ceska Gynekol 2016; 81 (1): 63–70.
4. Kubešová B, Líbalová P, Simonová V et al. Retrospektivní analýza efektivity, diagnostiky ektopické gravidity transvaginálním ultrazvukovým vyšetřením. Ceska Gynekol 2013; 78 (4): 338–341.
5. Fischerova D, Paškova A, Břeťak M. Těhotenství neznámé lokalizace. In: Calda, P, Břešták M, Fischerova D (eds). Ultrazvuková diagnostika v těhotenství a gynekologii. 2. vyd. Praha: Aprofema 2010 : 428–434.
6. Zdeňková A, Fanta M, Calda P. Metotrexát v léčbě ektopické gravidity. Actual Gyn 2015; 7 : 27–32.
7. Cordeiro DE, Alves JA, Araujo Júnior E et al. Ectopic pregnancies: a retrospective cohort analysis in a tertiary reference center in the Northeast Region of Brazil. Ceska Gynekol 2018; 83 (6): 434–439.
8. Elson CJ, Salim R, Potdar N et al. Diagnosis and management of ectopic pregnancy. On behalf of the Royal College of Obstetricians and Gynaecologists. BJOG 2016; 123: e15–e55.
9. Mavrelos D, Nicks H, Jamil A et al. Efficacy and safety of a clinical protocol for expectant management of selected women diagnosed with a tubal ectopic pregnancy. Ultrasound Obstet Gynecol 2013; 42 (1): 102–107. doi: 10.1002/uog. 12401.
10. van Mello NM, Mol F, Verhoeve HR et al. Methotrexate or expectant management in women with an ectopic pregnancy or pregnancy of unknown location and low serum hCG concentrations? A randomized comparison. Hum Reprod 2013; 28 (1): 60–67. doi: 10.1093/humrep/des373.
11. Shalev E, Peleg D, Tsabari A et al. Spontaneous resolution of ectopic tubal pregnancy: natural history. Fertil Steril 1995; 63 (1): 15–19. doi: 10.1016/s0015-0282 (16) 57289-6.
12. Zaremba R, Mára M, Razak I et al. Hysteroskopicky asistovaná laparoskopická salpingostomie při řešení tubární gravidity. Ceska Gynekol 2018; 83 (1): 50–52.
13. Bruhat MA, Pouly JL. Endoscopic treatment of ectopic pregnancies. Curr Opin Obstet Gynecol 1993; 5 (2): 260–266.
14. Cheng X, Tian X, Yan Z et al. Comparison of the fertility outcome of salpingotomy and salpingectomy in women with tubal pregnancy: a systematic review and meta-analysis. PLoS One 2016; 11 (3): e0152343. doi: 10.1371/journal.pone.0152343.
15. Luo Y, Shi Y, Liu D et al. The effect of salpingectomy on the ovarian reserve and ovarian response in ectopic pregnancy: a systematic review and meta-analysis. Medicine (Baltimore) 2019; 98 (47): e17901. doi: 10.1097/MD.000000 0000017901.
16. Wang X, Huang L, Yu Y et al. Risk factors and clinical characteristics of recurrent ectopic pregnancy: a case-control study. J Obstet Gynaecol Res 2020; 46 (7): 1098–1103. doi: 10.1111/jog.14253.
17. Cecchino GN, Araujo Júnior E, Elito Júnior J. Methotrexate for ectopic pregnancy: when and how. Arch Gynecol Obstet 2014; 290 (3): 417–423. doi: 10.1007/s00404-014-3266-9.
18. Tanaka T, Hayashi H, Kutsuzawa T et al. Treatment of interstitial ectopic pregnancy with methotrexate: report of a successful case. Fertil Steril 1982; 37 (6): 851–852. doi: 10.1016/s0015 - 0282 (16) 46349-1.
19. Barnhart KT, Gosman G, Ashby R et al. The medical management of ectopic pregnancy: a meta-analysis comparing “single dose” and “multidose” regimens. Obstet Gynecol 2003; 101 (4): 778–784. doi: 10.1016/s0029 - 7844 (02) 03158-7.
20. Rotas MA, Haberman S, Levgur M. Cesarean scar ectopic pregnancies: etiology, diagnosis and management. Obstet Gynecol 2006; 107 (6): 1373–1381. doi: 10.1097/01.AOG.0000 218690.24494.ce.
21. Sagiv R, Debby A, Feit H et al. The optimal cutoff serum level of human chorionic gonadotropin for efficacy of methotrexate treatment in women with extrauterine pregnancy. Int J Gynaecol Obstet 2012; 116 (2): 101–104. doi: 10.1016/j.ijgo.2011.09.023.
22. Van Den Eeden SK, Shan J, Bruce C et al. Ectopic pregnancy rate and treatment utilization in a large managed care organization. Obstet Gynecol 2005; 105 (5 Pt 1): 1052–1057. doi: 10.1097/01.AOG.0000158860.26939.2d.
23. Guvendag Guven ES, Dilbaz S, Dilbaz B et al. Comparison of single and multiple dose methotrexate therapy for unruptured tubal ectopic pregnancy: a prospective randomized study. Acta Obstet Gynecol Scand 2010; 89 (7): 889–895. doi: 10.3109/00016349.2010.486825.
24. Nowak-Markwitz E, Michalak M, Olejnik M et al. Cutoff value of human chorionic gonadotropin in relation to the number of methotrexate cycles in the successful treatment of ectopic pregnancy. Fertil Steril 2009; 92 (4): 1203–1207. doi: 10.1016/j.fertnstert.2008.07.1775.
25. Menon S, Colins J, Barnhart KT. Establishing a human chorionic gonadotropin cutoff to guide methotrexate treatment of ectopic pregnancy: a systematic review. Fertil Steril 2007; 87 (3): 481–484. doi: 10.1016/j.fertnstert.2006.10. 007.
26. Soliman KB, Saleh NM, Omran AA. Safety and efficacy of systemic methotrexate in the treatment of unruptured tubal pregnancy. Saudi Med J 2016; 27 (7): 1005–1010.
27. Vela G, Tulandi T. Cervical pregnancy: the importance of early diagnosis and treatment. J Minim Invasive Gynecol 2007; 14 (4): 481–484. doi: 10.1016/j.jmig.2006.11.012.
28. Zahálková L, Kacerovský M. Ektopická gravidita v jizvě po císařském řezu. Ceska Gynekol 2016; 81 (6): 414–419.
29. Karásek V. Gravidita v jizvě po císařském řezu – kazuistika. Ceska Gynekol 2015; 80 (5): 382–385.
30. Kučera E, Křepelka P, Krofta L et al. Ektopická gravidita v jizvě po císařském řezu. Ceska Gynekol 2007; 72 (3): 207–213.
31. Timor-Tritsch IE, Monteagudo A. Unforeseen consequences of the increasing rate of cesarean deliveries: early placenta accreta and cesarean scar pregnancy. A review. Am J Obstet Gynecol 2012; 207 (1): 14–29. doi: 10.1016/j.ajog.2012.03.007.
32. Timor-Tritsch IE, Monteagudo A, Cali G et al. Cesarean scar pregnancy and early placenta accreta share common histology. Ultrasound Obstet Gynecol 2014; 43 (4): 383–395. doi: 10.1002/uog.13282.
33. Timor-Tritsch IE, Monteagudo A, Bennett TA et al. A new minimally invasive treatment for cesarean scar pregnancy and cervical pregnancy. Am J Obstet Gynecol 2016; 215 (3): 351.e1–351.e8. doi: 10.1016/j.ajog.2016.03.010.
34. Maheux-Lacroix S, Li F, Bujold E et al. Cesarean scar pregnancies: a systematic review of treatment options. J Minim Invasive Gynecol 2017; 24 (6): 915–925. doi: 10.1016/ j.jmig.2017.05.019.
35. Hung TH, Shau WY, Hsieh TT et al. Prognostic factors for an unsatisfactory primary methotrexate treatment of cervical pregnancy: a quantitative review. Hum Reprod 1998; 13 (9): 2636–2642. doi: 10.1093/humrep/13.9.2636.
36. Shao MJ, Hu MX, Xu XJ et al. Management of cesarean scar pregnancies using an intrauterine or abdominal approach based on the myometrial thickness between the gestational mass and the bladder wall. Gynecol Obstet Invest 2013; 76 (3): 151–157. doi: 10.1159/000351875.
37. Sun YY, Xi XW, Yan Q et al. Management of type II unruptured cesarean scar pregnancy: comparison of gestational mass excision and uterine artery embolization combined with methotrexate. Taiwan J Obstet Gynecol 2015; 54 (5): 489–492. doi: 10.1016/j.tjog.2015.08. 002.
38. Chan CC, Ng EH, Li CF et al. Impaired ovarian blood flow and reduced antral follicle count following laparoscopic salpingectomy for ectopic pregnancy. Hum Reprod 2003; 18 (10): 2175–2180. doi: 10.1093/humrep/deg411.
39. Gelbaya TA, Nardo LG, Fitzgerald CT et al. Ovarian response to gonadotropins after laparoscopic salpingectomy or the division of fallopian tubes for hydrosalpinges. Fertil Steril 2006; 85 (5): 1464–1468. doi: 10.1016/j.fertnstert.2005.10.036.
40. Lass A, Ellenbogen A, Croucher C et al. Effect of salpingectomy on ovarian response to superovulation in an in vitro fertilization-embryo transfer program. Fertil Steril 1998; 70 (6): 1035–1038. doi: 0.1016/s0015-0282 (98) 00357-4.
41. Dar P, Sachs GS, Strassburger D et al. Ovarian function before and after salpingectomy in artificial reproductive technology patients. Hum Reprod 2000; 15 (1): 142–144. doi: 10.1093/ humrep/15.1.142.
42. Racková J, Driák D, Neumannová H et al. Použití metotrexátu u ektopické gravidity a tehotenství neznámé lokalizace. Ceska Gynekol 2016; 81 (2): 141–146.
43. Mašková H. Donošená vysoká kornuální gravidita. Prakt Gyn 2011; 15 (3–4): 202–203.
44. Long Y, Zhu H, Hu Y et al. Interventions for non-tubal ectopic pregnancy. Cochrane Database Syst Rev 2020; 7 (7): CD011174. doi: 10.1002/14651858.CD011174.pub2.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicine
Article was published inCzech Gynaecology

2023 Issue 1-
All articles in this issue
- Tissue expression analysis of cervical mucus proteome
- Acute recurrent pancreatitis during 3rd trimester of pregnancy
- The fertility sparing therapy in ectopic pregnancy
- Preterm premature rupture of membranes
- Traditional and contemporary views on the functional morphology of the fallopian tubes and their importance for gynecological practice
- Cryopreservation of ovarian tissue as a method for fertility preservation in women
- Experiences in the reconstruction of untreated severe obstetrical injuries including anal sphincter injuries
- Oxytocin and Further Uterotonic Peptide Agents: Their Early Research in Prague
- Seznam recenzentů
- Zápis z jednání volební komise pro volbu výboru Onkogynekologické sekce České gynekologické a porodnické společnosti ČLS JEP
- Epidermolysis in a newborn of a mother affected by covid-19 in the 3rd trimester of pregnancy
- Czech Gynaecology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Cryopreservation of ovarian tissue as a method for fertility preservation in women
- Preterm premature rupture of membranes
- The fertility sparing therapy in ectopic pregnancy
- Traditional and contemporary views on the functional morphology of the fallopian tubes and their importance for gynecological practice
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

