-
Medical journals
- Career
Předčasný odtok plodové vody před termínem porodu
Authors: V. Fulová; Radovan Pilka
Authors‘ workplace: Porodnicko-gynekologická klinika LF UP a FN Olomouc
Published in: Ceska Gynekol 2023; 88(1): 27-32
Category: Review Article
doi: https://doi.org/10.48095/cccg202327Overview
Cíl: Cílem předložené práce je shrnutí současných znalostí o patofyziologii předčasného porodu v souvislosti s předčasným odtokem plodové vody. Metodika: Analýza literárního přehledu a vlastních zkušeností zabývající se problematikou předčasného odtoku plodové vody. Závěr: Nejvýznamnějším faktorem ovlivňujícím neonatální morbiditu a mortalitu je gestační stáří. Časná novorozenecká sepse se s vysokým rizikem vyskytuje po předčasném odtoku plodové vody spojeným se zánětlivými komplikacemi.
Klíčová slova:
předčasný odtok plodové vody před termínem porodu – intraamniální infekce
Úvod
Předčasný odtok plodové vody před termínem porodu (PPROM – preterm prelabor rupture of membranes) je definován jako porušení plodových obalů s odtokem plodové vody před 37. týdnem těhotenství, předcházející min. 2 hod nástupu pravidelné děložní činnosti [1]. Komplikuje > 3 % všech porodů. Přibližně ve 30 % je PPROM příčinou předčasného porodu, a podílí se tak významně na perinatální morbiditě i mortalitě. PPROM lze rozdělit podle gestačního stáří na časný (od 24+0 až 33+6 týdne těhotenství) a na pozdní (od 34+0 až 36+6 týdne těhotenství). Největší počet případů tvoří PPROM mezi 34. a 37. týdnem těhotenství (tzv. pozdní PPROM).
Etiologie PPROM není známá, ale faktory zvyšující riziko předčasného odtoku plodové vody jsou zkrácené děložní hrdlo či intraamniální infekce [2]. Počet předčasných porodů závisí i na věku rodičky, jak je ukázáno v tabulce, kterou zpracoval Český statistický úřad pro ČR (tab. 1).
Table 1. Předčasně narozené děti v ČR v závislosti na věku rodičky v letech 2011–2020.
Tab. 1. Prematurely born children in the Czech Republic depending on the age of the mother in the years 2011–2020.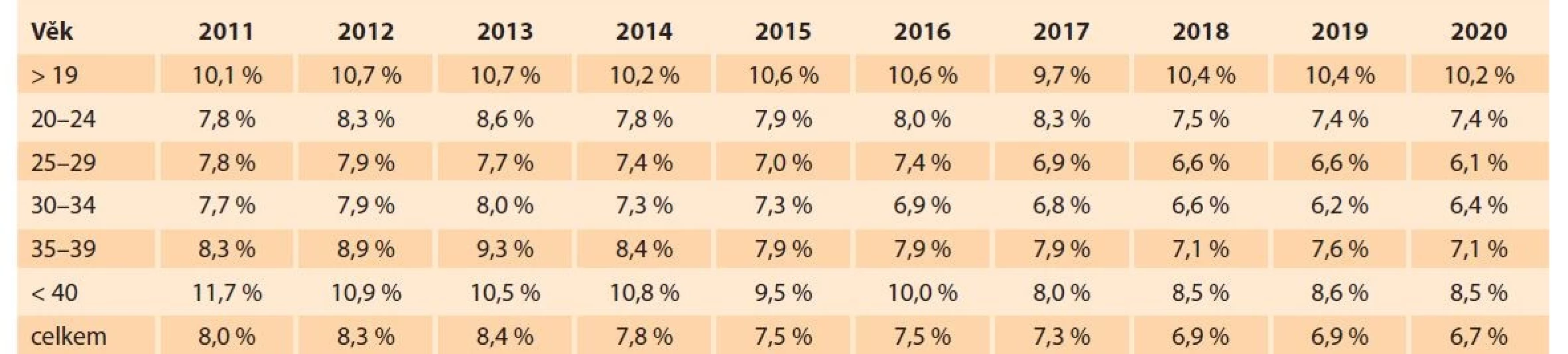
Zdroj: Český statistický úřad. S PPROM mohou souviset vaskulární léze v placentě, příp. i patologické transformace spirálních arterií, ateróza a deciduální vaskulopatie, tedy fibrinoidní nekróza a trombóza deciduálních cév [3]. Klíčovou roli v etiologii PPROM má však infekce v choriodeciduálním prostoru a zánět. Biochemické procesy u žen s PPROM jsou provázeny nárůstem matrixmetaloproteináz (MMP) v plodové vodě a poklesem jejich inhibitorů. Během předčasného porodu stimulují tvorbu MMP především prozánětlivé cytokiny a prostaglandiny [4]. Tyto procesy vedou k porušení celistvosti plodových membrán, lokálnímu zánětu a ascendentní bakteriální kolonizaci s rozvojem intraamniální zánětlivé invaze (MIAC – microbial invasion of the amniotic cavity) [5].
Intraamniální infekce
Intraamniální infekce závisí na gestačním stáří a komplikuje PPROM u 20–50 % případů [6]. Nejčastěji se vyskytující bakterie v plodové vodě jsou genitální mykoplazmata (Ureaplasma urealyticum, Ureaplasma parvum a Mycoplasma hominis). Tyto mikroorganizmy jsou součástí poševní flóry a běžně kolonizují i choriodeciduální prostor. U pacientek s PPROM tvoří 70–80 % všech mikrobiálních nálezů v plodové vodě [7]. Intenzita zánětu, který genitální mykoplazmata vyvolají, je závislá na jejich množství v plodové vodě. Velké množství mykoplazmat vede k velmi závažnému a intenzivnímu intraamniálnímu zánětu [8]. Na rozdíl od ostatních bakterií vyvolají genitální mykoplazmata zánětlivou odpověď, která však není spojena s produkcí prostaglandinů, a tedy jejich přítomnost v plodové vodě většinou nevyvolává nástup děložní činnosti. Slabý intraamniální zánět vyvolá jen malé množství genitálních mykoplazmat a při nálezu genitálních mykoplazmat v plodové vodě z druhotrimestrální aminocentézy z genetické indikace nemusí vést ke vzniku histologické chorioamnionitidy (HCA) a nemusí být vždy spojen se špatným těhotenským výsledkem [9].
HCA souvisí s vysokou koncentrací zánětlivých mediátorů v plodové vodě, vč. přirozených inhibitorů cytokinů (solubilní TNF receptory p55 a p75) a proinflamatorních cytokinů (TNF-a, IL-1ß, IL-6 a IL-8) [10]. Mikrobiologické vyšetření se provádí po odběru vzorku plodové vody transabdominální amniocentézou. Intrauterinní infekce je pak jednou z příčin, které vedou k nástupu předčasné děložní aktivity a k PPROM. HCA tedy úzce souvisí s PPROM, zhoršuje perinatální morbiditu [11] a zvyšuje riziko předčasného porodu [12]. Uplatňují se bakteriální fosfolipázy [13], bakteriální endotoxiny [14] a cytokiny (např. IL-1 – interleukin 1) [15], tumor necrosis faktor a (TNFa) a interleukin 6 (IL-6) [16]. Diagnóza HCA je stanovena až na podkladě difuzní infiltrace placentárních tkání leukocyty, protože většinou probíhá bez zřejmých klinických příznaků [17]. IL-6 je především mediátorem zánětu, inflamatorní cytokin, který se účastní patogeneze různých onemocnění [18]. Produkují ho zejména makrofágy, fibroblasty, endometriální stromální buňky a také trofoblasty [19]. Cytokiny jsou produkovány infiltrujícími makrofágy a fetálními krevními elementy v decidui a v chorionu [6]. Zvýšené hladiny IL-6 ve fetální krvi korelují se zvýšeným rizikem vzniku závažných perinatálních postižení plodu typu bronchopulmonální dysplazie či periventrikulární leukomalacie [20]. Také je třeba vzít v úvahu roli neutrofilů plodu, které poskytují důležitou obranu proti bakteriím. Z důvodu nezralosti fetálních neutrofilů je narušena jejich funkce. U předčasně narozených novorozenců je schopnost zabíjet bakterie extracelulárně snížena [6].
Chorioamnionitida a mateřské a novorozenecké výsledky
Chorioamnionitida je spojena s vysokým rizikem časné novorozenecké sepse a nekrotizující enterokolitidou u novorozenců. Histologická chorioamnionitida (difuzní infiltrace placenty, plodových obalů či pupečníku neutrofily, nejtěžší formou je funisitida, přítomnost neutrofilů v pupečníku) souvisí s poškozením mozku u předčasně narozených dětí. Po PPROM v II. trimestru bakterie rychle kolonizují povrchy amniotické membrány, chorionu, decidua, kůže plodu a sliznice i pupeční šňůru [6].
Souvislost PPROM s poruchami hemostázy
U pacientek s PPROM byla prokázaná vyšší střední plazmatická koncentrace trombin-antitrombinových (TAT) komplexů ve srovnání s těhotnými s normálním průběhem těhotenství [21,22]. Jedním z mechanizmů PPROM je tedy aktivace koagulační kaskády, která vede ke zvýšené tvorbě trombinu a může být důsledkem deciduálního krvácení, které vede k tvorbě retroplacentární sraženiny nebo k intraamniotické infekci, která může vyvolat deciduální krvácení a subklinickou abrupci stejně jako zvýšené intraamniotické TAT komplexy [23,24]. Dále může aktivace koagulační kaskády vést ke zvýšení mateřské systémové zánětlivé odpovědi, která může aktivovat vnější cestu koagulace v důsledku exprese a uvolňování tkáňového faktoru (TF) aktivovanými monocyty [25,26]. Tyto mechanizmy vedou ke zvýšené tvorbě trombinu, která je spojena se stimulací sekrece matricových metaloproteináz (MMP) deciduálními buňkami (tj. MMP-1 a MMP-3, které mohou degradovat extracelulární matrix chorioamniotických membrán) [27,28]. Dále může dojít k aktivaci myometria a tvorbě děložních kontrakcí, které mohou vést k předčasnému porodu s rupturou, nebo bez ruptury membrán a následnému předčasnému porodu [29,30]. Tkáňový faktor je součástí účinného hemostatického mechanizmu v děložní stěně, který je aktivován v průběhu normálního těhotenství během implantace a po porodu. Tento hemostatický mechanizmus však může být aktivován i v důsledku patologického deciduálního krvácení u těhotenství komplikovaných abrupcí placenty a intraamniotickou infekcí [31,32].
Těhotenské komplikace souvisí tedy se změnami koncentrací TF a inhibitoru tkáňového faktoru (TFPI) v plazmě matky a v placentě. Plazmatické koncentrace TF a volného TFPI u matky jsou vyšší u žen s preeklampsií než u pacientek s normálním těhotenstvím [33]. Koncentrace placentárního TF a exprese mRNA jsou vyšší u pacientek s těžkou preeklampsií než u pacientek s normálním těhotenstvím [34]. Naproti tomu placenty pacientek s gestačními vaskulárními komplikacemi (preeklampsie, eklampsie, fetální růstová restrikce, abrupce placenty a smrt plodu) mají nižší koncentrace celkového TFPI a exprese mRNA v placentách než u pacientek s normálním těhotenstvím [35].
U pacientek s PPROM byla v plazmě prokázaná zvýšená tvorba trombinu jako důsledek aktivace koagulační kaskády a významně vyšší střední plazmatická koncentrace TF než u žen s normálním těhotenstvím. Naopak střední plazmatická koncentrace TFPI byla významně nižší u pacientek s předčasným PROM než u pacientek s normálním těhotenstvím [36].
Genetické predispozice
Významnou oblast k předčasnému porodu představuje i ověření genetické predispozice a související studium kandidátních genů, např. studium polymorfizmu cytokinů, TLR (toll like receptors) a sRAGE (soluble receptor for advanced glycation end products). Ženy s bakteriální vaginózou a současně s mutací genu pro TNFa mají 10krát vyšší riziko předčasného porodu než ženy s bakteriální vaginózou bez výše uvedené mutace [37]. Významnou úlohu v etiopatogenenezi mnoha závažných stavů má trombofilie, která je spojena se zvýšeným rizikem nejen předčasného porodu, ale i mateřské a perinatální morbidity a mortality. Trombofilní stavy se významně uplatňují v etiopatogenezi preeklampsie, intrauterinního úmrtí a růstové retardace plodu, abrupce placenty, předčasných porodů a recidivujících spontánních potratů [38–41]. Trombofilie je vrozená nebo získaná porucha hemostatického mechanizmu charakterizovaná zvýšenou tendencí ke krevnímu srážení a trombotizaci [38]. Vrozená forma souvisí s mutací genů kódujících faktor V-Leiden (Leidenská mutace), protrombin G20210A, dále o hyperhomocysteinemii, o autozomálně dědičný deficit antitrombinu (AT), proteinu C a proteinu S. Leidenská mutace je nejčastějším diagnostikovaným geneticky podmíněným trombofilním stavem. Vyskytuje se až u 5 % evropské populace. Vrozené trombofilní stavy jsou odpovědné za značnou část závažných stavů v průběhu těhotenství, porodu a šestinedělí. Riziko tromboembolie je přibližně 8krát vyšší u nositelek těchto poruch ve srovnání se zdravou populací těhotných [38,42,43].
Kromě trombózy hlubokého žilního systému dolních končetin a plicní embolie může docházet k trombóze např. sagitálního sinu, případně mezenterické nebo portální žíly. Těhotné s vrozenou trombofilií mají signifikantně vyšší riziko intrauterinního úmrtí plodu a intrauterinní růstové retardace. Získané formy poruchy hemostatického mechanizmu souvisí s malignitami, nefrotickým syndromem, protrahovanou imobilizací, myeloproliferativními onemocněními nebo pooperačními stavy. Specifické postavení má antifosfolipidový syndrom [38]. Těhotné s antifosfolipidovým syndromem mají vyšší výskyt těhotenských komplikací, jako je preeklampsie, předčasný odtok plodové vody, těhotenská ztráta a předčasný porod před 34. týdnem. Při přítomnosti antifosfolipidových protiálátek je vyšší pravděpodobnost nepříznivého výsledku těhotenství. Těhotné s těmito rizikovými faktory by měli být pečlivě sledovány během těhotenství [44].
Diagnostika
V posledních desetiletích bylo vyvinuto několik technik pro hodnocení PROM. Tyto metody zahrnují nitrazinový test, Fernův test, test pro stanovení fetálního fibronektinu (fFN) v cervikovaginálním sekretu, intraamniotické injekce barviva a různé rychlé imunotesty pro detekci proteinových markerů přítomných ve vaginální tekutině.
Ideální test by měl být neinvazivní, rychlý, přesný, cenově dostupný, jednoduše použitelný a snadno dostupný.
Konvenční diagnostické testy zahrnují nitrazinový test a Fernův test. Nitrazinový test je konvenční test, který se používá od roku 1938 pro hodnocení PROM. Tento přístup využívá testování pH uniklé plodové vody, ale může vést k nejednoznačným výsledkům, zejména pokud dojde k úniku plodové vody po hodině nebo déle. Fernův test je mikroskopická metoda, která byla poprvé popsána pro diagnostiku PROM v roce 1946. Je založen na zobrazení plodové vody v podobě arborizovaných krystalů ve „vzoru palmových listů“, kdy se používají k hodnocení mikroskopické techniky. Diagnostickou přesnost Fernova testu ovlivňuje přítomnost krve, cervikálního hlenu, semenné tekutiny nebo antiseptického roztoku v plodové vodě. Nález fFN v cervikovaginálním sekretu může být známkou degradace extracelulární matrix ve II. a III. trimestru. Tento test je vysoce citlivý, ale s nízkou specificitou pro diagnózu PROM. S využitím tohoto testu se dá předvídat předčasný porod od 24. do 30. týdne těhotenství [45].
Diagnóza PPROM je z 90 % případů stanovena pomocí anamnestického údaje o odtoku plodové vody a průkazem depa plodové vody v zadní klenbě poševní při vyšetření v zrcadlech. Také je možno použít Temešváryho test (založený na změně pH v pochvě) či specifické testy na průkaz plodové vody ve vaginální tekutině, např. insulin-like growth factor binding protein-1 (Actim-PROM test) či placentární alfa-mikroglobulin-1 (Amnisure® test), které mají jak vysokou senzitivitu, tak specificitu pro detekci PPROM. Citlivě detekují přítomnost plodové vody i aktivaci neporušených plodových obalů (také proto jsou v mírných modifikacích používány u pacientek se symptomy předčasného porodu k predikci rizika porodu do 7 dnů. Proto je vždy nutné tyto vyšetřovací metody dávat do korelace s ultrazvukovým vyšetřením pro průkaz oligohydramnia či anhydramnia k potvrzení diagnózy [46].
Management PPROM
Ve většině případů diagnostikujeme PPROM na základě klinického vyšetření a semikvantitativního ultrazvukového hodnocení (určení počtu plodů, polohy plodu, lokalizaci placenty, množství plodové vody, odhadovanou hmotnost plodu). Zlatým standardem pro diagnostiku je pozorování úniku plodové vody. Odebereme materiál pro mikrobiologický rozbor ke stanovení vagino-rektální kolonizace beta hemolytickým streptokokem. Diagnóza chorioamnionitidy je založena na přítomnosti jednoho z následujících příznaků:
- fetální tachykardie;
- horečka (> 37,8 °C);
- tachykardie matky (> 100 tepů/min);
- vysoká hodnota leukocytů matky (> 15 000 leukocytů/mm).
Provádíme následující laboratorní vyšetření:
- kompletní krevní obraz;
- C-reaktivní protein (CRP);
- analýzu moči;
- kultivaci moči.
Ultrazvukové vyšetření ke stanovení biometrie plodu, reziduálního objemu plodové vody, abnormalit placenty. Ve většině případů vidíme oligohydramnion, který je definován jako maximální vertikální osa plodové vody do hloubky < 2 cm nebo index plodové vody (AFI – amniotic fluid index) < 5 cm. Kdykoli je to možné, volíme odklad porodu minimálně o 48 hod. Pokud je gestační věk > 24 týdnů a < 35 týdnů a nejsou žádné známky chorioamnionitidy, abrupce placenty, úmrtí plodu nebo postupující porod, volíme expektační management. Vzhledem k vysokému riziku infekce považujeme antibiotickou terapii za povinnou. Z léčby empirické při znalosti mikrobiologického výsledku přecházíme na cílenou antibiotickou terapii dle citlivosti [5,47]. Také je zahájena indukce plicní zralosti plodu kortikoidy. Pokud dojde k nástupu děložní činnosti, je přidána tokolytická terapie po dobu 48 hod. Po ukončení indukce plicní zralosti plodu kortikoidy porod již netlumíme a při nástupu pravidelné děložní činnosti ukončujeme těhotenství dle indikačních kritérií. Pokud nedojde k nástupu pravidelné děložní činnosti, kontrolujeme klinický stav těhotné denně pomocí měření tělesné teploty, odběru CRP a leukocytů z periferní krve matky. Při nárůstu těchto hodnot či při klinických známkách choriamnionitidy těhotenství ukončujeme indukovaným porodem či císařským řezem.
Klinické známky chorioamnionitidy, hypoxie plodu nebo závažného vaginálního krvácení jsou indikací k ukončení těhotenství. Způsob ukončení těhotenství závisí na porodnickém nálezu, stavu těhotné a plodu. V ostatních případech PPROM před týdnem těhotenství 34+0 je vhodné postupovat konzervativně. U těhotných s PPROM v týdnu těhotenství 22+0 až 24+0, tzv. šedá zóna, je nutné postupovat individuálně po předchozí konzultaci s neonatologem, těhotnou a její rodinou [5].
Závěr
Prospektivní studie některých autorů prokazují, že ženy, které mají v anamnéze předčasný porod mezi 23. a 27. týdnem, mají 27,1% riziko opakování předčasného porodu. Ženy s anamnézou PPROM měly v následující graviditě 13,5% riziko předčasného porodu pro PPROM a 13krát větší riziko PPROM před 28. týdnem gestace [48,49]. Současné práce ukazují, že nejdůležitějším prediktorem neonatální morbidity je nízké gestační stáří, nikoli riziko rozvoje časné neonatální sepse [50]. Tento fakt je zásadním argumentem pro aplikaci expektačního postupu u pacientek s PPROM. Tento management je celosvětově uznávaným standardem [51]. Je doporučena hospitalizace v perinatologickém centru a následná neonatologická intenzivní péče.
ORCID autorů
V. Fulová 0000-0001-9411-695X
R. Pilka 0000-0001-8797-1894
Doručeno/Submitted: 21. 7. 2022
Přijato/Accepted: 29. 7. 2022
MUDr. Veronika Fulová
Porodnicko-gynekologická klinika
LF UP a FN Olomouc
I. P. Pavlova 185/6
779 00 Olomouc
Sources
1. Kacerovský M. Předčasný odtok plodové vody před termínem porodu. 2018 [online]. Dostupné z: https: //www.labor-aktuell.cz/predcasny-odtok-plodove-vody-pred-terminem - porodu.
2. Meller CH, Carducci ME, Ceriani Cernadas JM et al. Preterm premature rupture of membranes. Arch Argent Pediatr 2018; 116 (4): e575–e581. doi: 10.5546/aap.2018.eng.e575.
3. Kim YM, Chaiworapongsa T, Gomez R et al. Failure of physiologic transformation of the spiral arteries in the placental bed in preterm premature rupture of membranes. Am J Obstet Gynecol 2002; 187 (5): 1137–1142. doi: 10.1067/mob.2002.127720.
4. Mercer MB. Preterm premature rupture of the membranes. Obstet Gynecol 2003; 101 (1): 179–193. doi: 10.1016/s0029-7844 (02) 02366-9.
5. Kacerovský M, Kokrdová Z, Koucký M et al. Předčasný odtok plodové vody před termínem porodu. Ceska Gynekol 2017; 82 (2): 166–167.
6. Tchirikov M, Schlabritz-Loutsevitch N, Maher J et al. Mid-trimester preterm premature rupture of membranes (PPROM): etiology, diagnosis, classification, international recommendations of treatment options and outcome. J Perinat Med 2018; 46 (5): 465–488. doi: 10.1515/ jpm - 2017-0027.
7. Kacerovsky M, Musilova I, Khatibi A et al. Intraamniotic inflammatory response to bacteria: analysis of multiple amniotic fluid proteins in women with preterm prelabor rupture of membranes. J Matern Fetal Neonatal Med 2012; 25 (10): 2014–2019. doi: 10.3109/147 67058.2012.671873.
8. Kacerovsky M, Pliskova L, Bolehovska R et al. The microbial load with genital mycoplasmas correlates with the degree of histologic chorioamnionitis in preterm PROM. Am J Obstet Gynecol 2011; 205 (3): 213.e1–213.e7. doi: 10.1016/j.ajog.2011.04.028.
9. Menon R, Peltier MR, Eckardt J et al. Diversity in cytokine response to bacteria associated with preterm birth by fetal membranes. Am J Obstet Gynecol 2009; 201 (3): 306.e1–306.e6. doi: 10.1016/j.ajog.2009.06.027.
10. Arntzen KJ, Kjøllesdal AM, Halgunset J et al. TNF, IL-1, IL-6, IL-8 and soluble TNF receptors in relation to chorioamnionitis and premature labor. J Perinat Med 1998; 26 (1): 17–26. doi: 10.1515/jpme.1998.26.1.17.
11. Smith G, Rafuse C, Anand N et al. Prevalence, management, and outcomes of preterm prelabour rupture of the membranes of women in Canada. J Obstet Gynaecol Can 2005; 27 (6): 547–553. doi: 10.1016/s1701-2163 (16) 30711-3.
12. Guzick DS, Winn K. The association of chorioamnionitis with preterm delivery. Obstet Gynecol 1985; 65 (1): 11–16.
13. Sbarra AJ, Selvaraj RJ, Cetrulo CL et al. Infection and phagocytosis as possible mechanisms of rupture in premature rupture of the membranes. Am J Obstet Gynecol 1985; 153 (1): 38–43. doi: 10.1016/0002-9378 (85) 90586-1.
14. Seo K, McGregor JA, French JI. Preterm birth is associated with increased risk of maternal and neonatal infection. Obstet Gynecol 1992; 79 (1): 75–80.
15. Romero R, Brody DT, Oyarzun E et al. Infection and labor. III. Interleukin-1: a signal for the onset of parturition. Am J Obstet Gynecol 1989; 160 (5 Pt 1): 1117–1123. doi: 10.1016/0002 - 9378 (89) 90172-5.
16. Romero R, Mazor M, Sepulveda W et al. Tumor necrosis factor in preterm and term labor. Am J Obstet Gynecol 1992; 166 (5): 1576–1587. doi: 10.1016/0002-9378 (92) 91636-o.
17. Cobo T, Kacerovsky M, Palacio M et al. Intra-amniotic inflammatory response in subgroups of women with preterm prelabor rupture of the membranes. PLoS One 2012; 7 (8): e43677. doi: 10.1371/journal.pone.0043677.
18. Heinrich PC, Castell JV, Andus, T. Interleukin-6 and the acute phase response. Biochem J 1990; 265 (3): 621–636. doi: 10.1042/bj2650621.
19. Kameda T, Matsuzaki N, Sawai K et al. Production of interleukin-6 by normal human trophoblast. Placenta 1990; 11 (3): 205–213. doi: 10.1016/s0143-4004 (05) 80266-8.
20. Weeks JW, Reynolds L, Taylor D et al. Umbilical cord blood interleukin-6 levels and neonatal morbidity. Obstet Gynecol 1997; 90 (5): 815–818. doi: 10.1016/S0029-7844 (97) 00421-3.
21. Chaiworapongsa T, Espinoza J, Yoshimatsu J et al. Activation of coagulation system in preterm labor and preterm premature rupture of membranes. J Matern Fetal Neonatal Med 2002; 11 (6): 368–373. doi: 10.1080/jmf.11.6.368.373.
22. Rosen T, Kuczynski E, O’Neill LM et al. Plasma levels of thrombin-antithrombin complexes predict preterm premature rupture of the fetal membranes. J Matern Fetal Med 2001; 10 (5): 297–300. doi: 10.1080/714904361.
23. Lockwood CJ, Toti P, Arcuri F et al. Mechanisms of abruption-induced premature rupture of the fetal membranes: thrombin-enhanced interleukin-8 expression in term decidua. Am J Pathol 2005; 167 (5): 1443–1449. doi: 10.1016/ S0002-9440 (10) 61230-8.
24. Gómez R, Romero R, Nien JK et al. Idiopathic vaginal bleeding during pregnancy as the only clinical manifestation of intrauterine infection. J Matern Fetal Neonatal Med 2005; 18 (1): 31–37. doi: 10.1080/14767050500217863.
25. Gervasi MT, Chaiworapongsa T, Naccasha N et al. Maternal intravascular inflammation in preterm premature rupture of membranes. J Matern Fetal Neonatal Med 2002; 11 (3): 171–175. doi: 10.1080/jmf.11.3.171.175.
26. Østerud B, Bjorklid E. Sources of tissue factor. Semin Thromb Hemost 2006; 32 (1): 11–23. doi: 10.1055/s-2006-933336.
27. Mackenzie AP, Schatz F, Krikun G et al. Mechanisms of abruption-induced premature rupture of the fetal membranes: thrombin enhanced decidual matrix metalloproteinase-3 (stromelysin-1) expression. Am J Obstet Gynecol 2004; 191 (6): 1996–2001. doi: 10.1016/S0002 - 9440 (10) 61230-8.
28. Rosen T, Schatz F, Kuczynski E et al. Thrombin-enhanced matrix metalloproteinase-1 expression: a mechanism linking placental abruption with premature rupture of the membranes. J Matern Fetal Neonatal Med 2002; 11 (1): 11–17. doi: 10.1080/jmf.11.1.11.17.
29. Elovitz MA, Saunders T, Ascher-Landsberg J et al. Effects of thrombin on myometrial contractions in vitro and in vivo. Am J Obstet Gynecol 2000; 183 (4): 799–804. doi: 10.1067/mob. 2000.108897.
30. Elovitz MA, Baron J, Phillippe M. The role of thrombin in preterm parturition. Am J Obstet Gynecol 2001; 185 (5): 1059–1063. doi: 10.1067/mob.2001.117638.
31. Lockwood CJ, Toti P, Arcuri F et al. Mechanisms of abruption-induced premature rupture of the fetal membranes: thrombin-enhanced interleukin-8 expression in term decidua. Am J Pathol 2005; 167 (5): 1443–1449. doi: 10.1016/S0002-9440 (10) 61230-8.
32. Cobo T, Jacobsson B, Kacerovsky M et al. Systemic and local inflammatory response in women with preterm prelabor rupture of membranes. PLoS One 2014; 9 (1): e85277. doi: 10.1371/journal.pone.0085277.
33. Abdel Gader AM, Al-Mishari AA, Awadalla SA et al. Total and free tissue factor pathway inhibitor in pregnancy hypertension. Int J Gynaecol Obstet 2006; 95 (3): 248–253. doi: 10.1016/ j.ijgo.2006.07.014.
34. Di Paolo S, Volpe P, Grandaliano G et al. Increased placental expression of tissue factor is associated with abnormal uterine and umbilical Doppler waveforms in severe preeclampsia with fetal growth restriction. J Nephrol 2003; 16 (5): 650–657.
35. Aharon A, Lanir N, Drugan A et al. Placental TFPI is decreased in gestational vascular complications and can be restored by maternal enoxaparin treatment. J Thromb Haemost 2005; 3 (10): 2355–2357. doi: 10.1111/j.1538-7836. 2005.01564.x.
36. Erez O, Espinoza J, Chaiworapongsa T et al. A link between a hemostatic disorder and preterm PROM: a role for tissue factor and tissue factor pathway inhibitor. J Matern Fetal Neonatal Med 2008; 21 (10): 732–744. doi: 10.1080/14767050802361807.
37. Romero R, Chaiworapongsa T, Kuivaniemi H. Bacterial vaginosis, the inflammatory response and the risk of preterm birth: a role for genetic epidemiology in the prevention of preterm birth. Am J Obstet Gynecol 2004; 190 (6): 1509–1519. doi: 10.1016/j.ajog.2004.01.002.
38. Procházka M, Procházková J, Ľubušký M et al. Trombofilní stavy v porodnictví – I. část. Prakt Gyn 2004; 4 (4): 12–17.
39. Alfirevic Z, Mousa HA, Martlew V et al. Postnatal screening for thrombophilia in women with severe pregnancy complications. Obstet Gynecol 2001; 97 (5 Pt 1): 753–759. doi: 10.1016/s0029-7844 (01) 01190-5.
40. Kupferminc MJ, Fait G, Many A et al. Severe preeclampsia and high frequency of thombophilic mutations. Obstet Gynecol 2000; 96 (1): 45–49. doi: 10.1016/s0029-7844 (00) 00 861-9.
41. Kvasnička J, Živný J. Trombotické stavy v těhotenství a v šestinedělí. Moderní gynekologie a porodnictví 1999; 8 (2): 144–151.
42. Friedrich PW, Sanson BJ, Simioni P et al. Frequency of pregnancy – related venous thromboembolism in antikoagulant factor deficient women: implications for profylaxis. Ann Intern Med 1996; 125 (12): 955–960. doi: 10.7326/ 0003-4819-125-12-199612150-00003.
43. Lockwood CJ. Heritable coagulopathies in pregnancy. Obstet Gynecol Surv 1999; 54 (12): 754–765. doi: 10.1097/00006254-199912000 - 00004.
44. Yang J, Liang M. Risk factors for pregnancy morbidity in women with antiphospholipid syndrome. J Reprod Immunol 2021; 145 : 103315. doi: 10.1016/j.jri.2021.103315.
45. Ghafoor S. Current and emerging strategies for prediction and diagnosis of prelabour rupture of the membranes: a narrative review. Malays J Med Sci 2021; 28 (3): 5–17. doi: 10.21315/mjms2021.28.3.2.
46. Kacerovsky M, Musilova I, Khatibi A et al. Intraamniotic inflammatory response to bacteria: analysis of multiple amniotic fluid proteins in women with preterm prelabor rupture of membranes. J Matern Fetal Neonatal Med 2012; 25 (10): 2014–2019. doi: 10.3109/14767058.2012. 671873.
47. Bohilțea RE, Cioca AM, Dima V et al. Expectant management of PPROM improves neonatal outcome – a retrospective study of 562 patients. J Clin Med 2022; 11 (1): 214. doi: 10.3390/jcm11010214.
48. Kacerovsky M, Tosner J, Andrys C et al. Amniotic fluid heat shock protein 70 concentration in preterm premature rupture of membranes. Ceska Gynekol 2009; 74 (2): 85–91.
49. Caughey AB, Robinson JN, Norwitz ER. Contemporary diagnosis and management of preterm premature rupture of membranes. Rev Obstet Gynecol 2008; 1 (1): 11–22.
50. Tsiarlas P, Kacerovsky M, Musilová P et al. The association between histological chorioamnionitis, funisitis and neonatal outcome in women with preterm prelabor rupture of membranes. J Matern Fetal Neonatal Med 2013; 26 (13): 1332–1336. doi: 10.3109/14767058.2013.784 741.
51. Buchanan S, Crowther C, Morris J. Preterm prelabour rupture of the membranes: a survey of current practice. Aust N Z J Obstet Gynaecol 2004; 44 (5): 400–403. doi: 10.1111/j.1479-828X.2004.00256.x.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicine
Article was published inCzech Gynaecology

2023 Issue 1-
All articles in this issue
- Tissue expression analysis of cervical mucus proteome
- Acute recurrent pancreatitis during 3rd trimester of pregnancy
- The fertility sparing therapy in ectopic pregnancy
- Preterm premature rupture of membranes
- Traditional and contemporary views on the functional morphology of the fallopian tubes and their importance for gynecological practice
- Cryopreservation of ovarian tissue as a method for fertility preservation in women
- Experiences in the reconstruction of untreated severe obstetrical injuries including anal sphincter injuries
- Oxytocin and Further Uterotonic Peptide Agents: Their Early Research in Prague
- Seznam recenzentů
- Zápis z jednání volební komise pro volbu výboru Onkogynekologické sekce České gynekologické a porodnické společnosti ČLS JEP
- Epidermolysis in a newborn of a mother affected by covid-19 in the 3rd trimester of pregnancy
- Czech Gynaecology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Cryopreservation of ovarian tissue as a method for fertility preservation in women
- Preterm premature rupture of membranes
- The fertility sparing therapy in ectopic pregnancy
- Traditional and contemporary views on the functional morphology of the fallopian tubes and their importance for gynecological practice
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

