-
Medical journals
- Career
Antibakteriální účinky přírodních látek – silice
: Sherif T. S. Hassan; Michaela Majerová; Miroslava Šudomová; Kateřina Berchová
: Čes. slov. Farm., 2015; 64, 243-253
: Review Articles
Vzhledem k tomu, že problém bakteriální rezistence se stal vážným celosvětovým problémem, bylo nutné hledat nové účinné látky, které mohou překonat tento problém a zlepšit léčebnou účinnost bakteriálních infekcí. Množství silic rostlinného původu prokázala výrazné antibakteriální účinky. Cílem tohoto článku bylo shrnout silice, které vykazovaly pozoruhodné antibakteriální účinky proti různým bakteriálním infekcím včetně stafylokokových infekcí, Helicobacter pylori infekce, kožní infekce, tuberkulózy a zubní bakteriální infekce. Byl diskutován synergický efekt silic v kombinaci s antibiotiky, jakož i jejich role v léčbě bakteriálních infekcí. Silice mohou být použity jako modely pro další studie in vivo a u klinických studií.
Klíčová slova:
antibakteriální látky • silice • rostliny • bakteriální rezistence • bakteriální infekce • synergismusÚvod
Léčivé rostliny mají již po staletí velmi důležitou roli v léčbě různých onemocnění, včetně infekčních chorob. Spousta sloučenin pocházejících z přírodních zdrojů má v dnešní medicíně nezastupitelnou roli a v terapii se využívají samostatně, v kombinaci anebo slouží jako předloha pro chemickou syntézu léčiv. Velké množství chemických léčiv má svůj původ právě v přírodních látkách. Stále probíhající studie hledají, identifikují a testují další potencionálně využitelné sloučeniny pocházející z rostlinných zdrojů.
V dnešní době, kdy dochází k rozsáhlému a někdy i zbytečnému nadužívání antibakteriálních látek, kdy se stále snižuje citlivost mikroorganismů k dostupným preparátům a kdy rezistence bakterií narůstá každým dnem, je nezbytné zabývat se studiem nových molekul s potenciální antibakteriální aktivitou. Některé studie se zabývají chemickou obměnou již existujících účinných molekul, ke kterým se však bakterie stávají v krátké době méně citlivé1).
Vzhledem k primitivnímu a velmi krátkému životnímu cyklu jsou mikroorganismy velmi adaptabilní vůči okolním podmínkám a nové generace, které vznikají v řádu minut, si nesou genetickou informaci s rezistencí a s jinými výhodami oproti starším generacím. Dalo by se říci, že bakterie mají a vždy budou mít náskok před námi a naší léčbou, proto je důležité neustále hledat nové sloučeniny s antibakteriální aktivitou2).
Přehled si klade za cíl vyhledávat dosavadní poznatky a studie o antibakteriálně působících silicích v původních vědeckých publikacích, a vytvořit tak aktuální seznam látek, které by mohly sloužit jako nadějné molekuly pro další studium potenciálních antibakteriálních léčiv. Publikační podklady byly vyhledány v databázích PubMed a Web of Knowledge pod klíčovými slovy: bacterial resistance, essential oils, bacterial infections, antibacterial agents, plants.
Silice
Silice jsou sekundární metabolity rostlin. Jedná se o strukturně velmi heterogenní sloučeniny. Mohou to být látky se silným aroma i látky bez vůně. V převážné většině jde o látky lipofilní, prakticky nerozpustné ve vodě. Většinou jsou kapalné, bezbarvé, skladováním velmi lehce oxidují a tmavnou. Mívají menší hustotu než voda, čehož se využívá při jejich extrakci. Silice mají velmi široké spektrum biologických vlastností, jako jsou účinky protizánětlivé, zklidňující, antinociceptivní, antioxidační, psychotropní, expektorační. Vzhledem ke své multifunkčnosti mají nezastupitelnou roli v medicíně a aromaterapii3).
Mechanismus antibakteriálního účinku silic
Mechanismus účinku silic proti patogenním bakteriím je poměrně složitý proces, který není zcela vysvětlen a objasněn. Je zřejmé, že antibakteriální účinky silic úzce souvisejí s hydrofilními a lipofilními vlastnostmi daných komponent. Terpeny, které vykazují lipofilní charakter, působí inhibičně na enzymy katalyzující vznik bakteriálních membrán.
Některé složky silic působí jako „vypínač“, interferují s translokací protonů přes membránové váčky a blokují fosforylaci adenosin-difosfátu, čímž narušují primární energetický metabolismus bakteriální buňky. Silice – obsahující jako funkční skupinu fenolický alkohol nebo aldehyd – narušují membránu mikroorganismů. Některé sloučeniny zasahují do enzymatických pochodů buněk potlačením enzymatické aktivity nebo zastavením produkce potřebných enzymů, čímž způsobí smrt citlivé buňky.
Silice dále inhibují syntézu DNA, RNA, proteinů a polysacharidů v buněčné stěně bakterií. Některé sloučeniny přírodního charakteru mají i více mechanismů účinku najednou a kombinací různých silic dochází k synergismu a zesílení antibakteriální aktivity4).
Bakteriální buňky můžeme obecně rozdělit dle struktury buněčné stěny pomocí Gramova barvení do dvou velkých skupin, a to na gram-pozitivní, které se barví do tmavě fialova a na gram-negativní, které se pomocí Gramova barvení zbarvují za použití safraninu do červena5).
Další dostupné studie uvádějí větší antibakteriální efekt silice ke gram-pozitivním bakteriím než ke gram-negativním. Vnější buněčná membrána gram-negativních bakterií má schopnost získat hydrofilní charakter, který brání kontaktu povrchu bakteriální buňky s hydrofobní složkou silic. Rozdílně reagují gram-pozitivní bakterie, kde buněčná membrána vykazuje lipofilní vlastnosti. Silice mohou s povrchem takové bakterie snadno interagovat a tato interakce vede k porušení bakteriální membrány, změně iontové propustnosti, k lýze a smrti patogenní buňky6).
Gram-pozitivní bakterie mají v buněčné stěně silnou vrstvu peptidoglykanu, která je protkaná kyselinou lipoteichoovou, buněčná stěna gram-negativních bakterií obsahuje jen málo peptidoglykanu bez kyseliny lipoteichoové, ale velmi silnou vrstvu lipoproteinů a polysacharidů, která znesnadňuje průnik silic do buňky. Antibakteriální působení silic tedy závisí na druhu patogenního mikroorganismu a na jeho bakteriální stěně7).
Silice s antibakteriální aktivitou k multirezistentním bakteriím
Rostoucí rezistence mikroorganismů k běžně dostupným antibakteriálním látkám představuje výzvu pro vědce celého světa najít alternativní způsoby léčby infekcí způsobených odolnými bakteriemi. Mezi nejčastěji testované bakterie patří hlavně methicilin rezistentní Staphylococcus aures (MRSA), který může způsobovat závažná onemocnění, jako jsou pneumonie, sepse, endokarditida nebo meningitida zejména u hospitalizovaných pacientů. Tabulka 1 uvádí některé silice, u kterých byla objevena aktivita proti tomuto mikroorganismu. Mezi další nebezpečné bakterie patří Enterobacter aerogenes, Escherichia coli a Pseudomonas aeruginosa. Citlivost těchto patogenů se značně zvyšuje při použití kombinace běžně užívaných léků jako beta-laktamová antibiotika, chloramfenikol a chinolony s geraniolem8).
1. Silice s antibakteriální aktivitou k MRSA 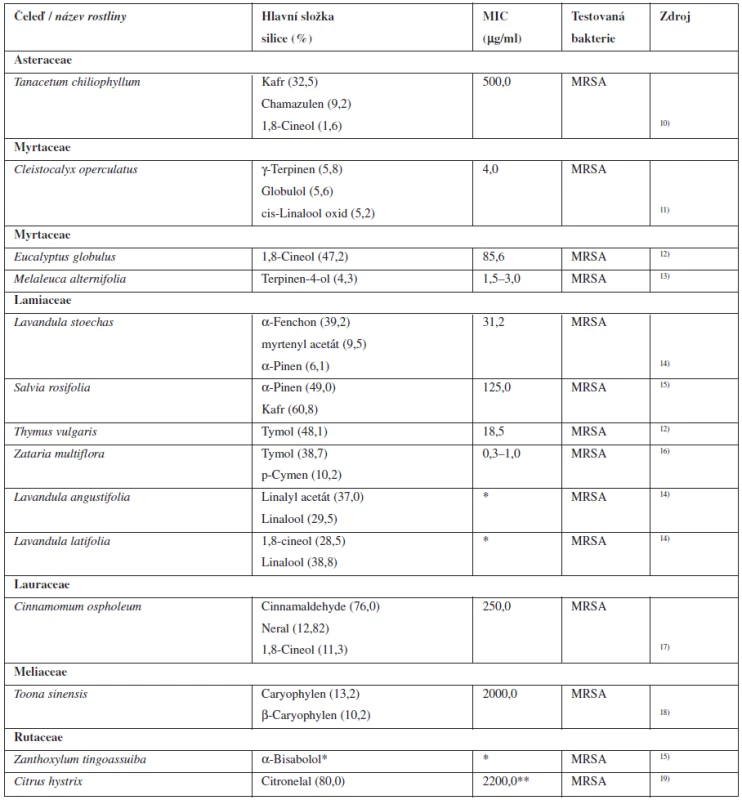
*Citlivost MRSA byla zkoumána jen diskovou difuzní metodou a chybí údaj o MIC. **Hodnota MIC se rovná hodnotě MBC pro MRSA. MIC – minimální inhibiční koncentrace, MBC – minimální baktericidní koncentrace Silice z Melaleuca alternifolia (Myrtaceae) obsahuje kromě jiných složek antibakteriálně aktivní terpinen-4-ol, který vykazuje aktivitu proti MRSA, a mohl by tak představovat zajímavou alternativu léčby kožních infekcí způsobených touto bakterií. Tato látka však musí být podávána jen ve vyšších koncentracích, které jsou schopny vyvolat silný bakteriostatický nebo baktericidní efekt, protože použití koncentrací, které jsou příliš nízké k poškození bakteriální buňky, vede ke vzniku odolnosti vůči této silici a výsledný antimikrobiální efekt se snižuje. Tato silice je dle studií velmi dobře snášena, avšak chybí informace o její systémové farmakokinetice a farmakodynamice u lidí9).
Silice s antibakteriální aktivitou k bakteriím způsobujícím kožní infekce
Mezi mikroorganismy, které nejčastěji způsobují různé kožní infekce, patří hlavně Propionibacterium acnes, Propionibacterium granulosum a Stapylococcus epidermidis. Mezi silice působící proti těmto bakteriím patří hlavně linalool, α-terpineol, limonen15).
Djabou et al. v roce 2013 publikovali studii zabývající se složením silice pěti druhů rodu Teucrium (T. marum, T. massiliense, T. chamaedrys, T. scorodonia a T. flavum). Zajímavé je, jak je složení silice diametrálně rozdílné v případě jednoho rostlinného rodu. Slabou antibakteriální aktivitu ke kožním patogenům vykazují všechny zkoumané druhy rodu Teucrium, nejsilněji však působí Teucrium massiliense20). Přehled vybraných rostlin a silic uvádí tabulka 2.
2. Silice s antibakteriální aktivitou k bakteriím způsobujícím kožní infekce 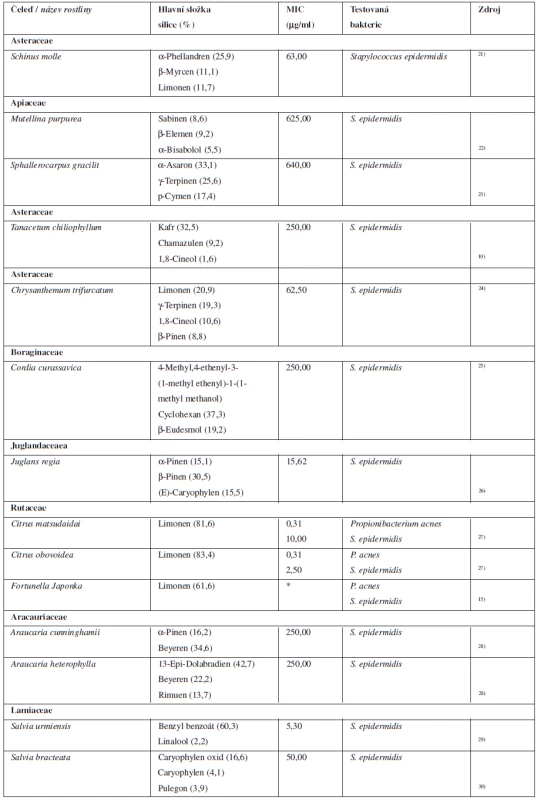

*Údaje neuvedeny v použité literatuře. MIC – minimální inhibiční koncentrace Silice s antibakteriální aktivitou k Helicobacter pylori
Helicobacter pylori je gram-negativní bakterie kolonizující žaludek mnoha lidí. Na jedné straně může tato kolonizace probíhat bez příznaků, ale na straně druhé může způsobit velmi nepříjemné zdravotní problémy jako žaludeční vředy a gastritidu37).
Tyto komplikace jsou běžně léčeny inhibitory protonové pumpy v kombinaci s antibiotiky. Mezi inhibitory protonové pumpy používané v současné době v České republice patří omeprazol, lansoprazol, pantoprazol a esomeprazol a mezi antibiotika používaná k eradikaci se používají kombinace amoxicilinu a klaritromycinu, případně nitroimidazolů (metronidazol, ornidazol). Ovšem hlavně u pacientů z vyspělých zemí současná léčba selhává a celosvětově jsou hlášeny případy, kdy je Helicobacter pylori k této léčbě rezistentní38). V tabulce 3 jsou shrnuty nadějné silice, které in vitro vykazují antibakteriální aktivitu k této bakterii.
3. Silice s antibakteriální aktivitou k Helicobacter pylori 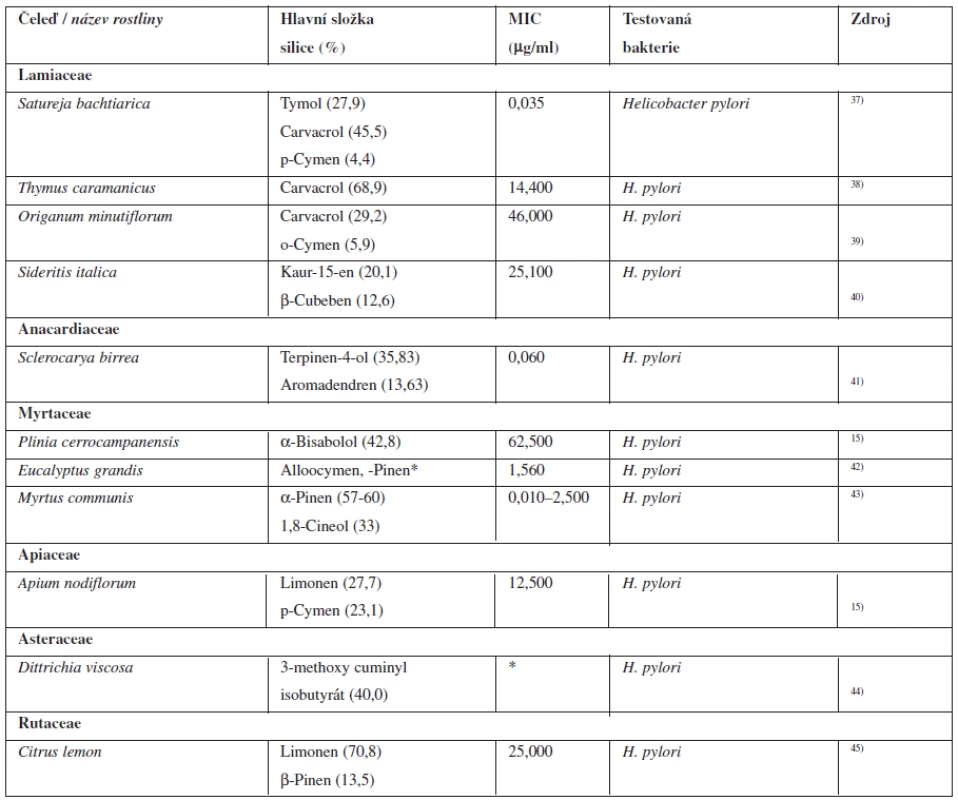
*Údaje neuvedeny v použité literatuře. MIC – minimální inhibiční koncentrace Silice s antibakteriální aktivitou k bakteriím způsobujícím zubní kaz
Kariogenní mikroorganismy v dutině ústní při přebytku kariogenního substrátu, zejména nízkomolekulárních sacharidů, produkují organické kyseliny, zejména laktát a pyruvát. Působí-li kyseliny dostatečně dlouho na zubní tkáň, dochází k demineralizaci. Na povrchu zubu se vytváří zubní plak, který je složen ze slin, bakteriálních metabolických produktů, zbytků potravy a bakterií. Mezi bakterie tvořící plak patří Streptococcus mutans, Streptococcus sobrinus, Streptococcus cricetus a Streptococcus pyogenes. Schopnost syntetizovat extracelulární polysacharidy glukany za přítomnosti sacharózy pomocí glukosyltransferas umožňuje velmi pevnou adhezi těchto mikroorganismů na zubním povrchu a tvorbu plaku46).
Některé silice mají schopnost inhibovat růst těchto mikroorganismů a předcházet vzniku biofilmu. Některé silice mají dokonce větší účinnost než chlorhexidin, který se používá jako antimikrobiální látka při prevenci zubního kazu. Konkrétně se jedná o silice rostliny Rosmarinus officinalis (Lamiaceae) a Mentha piperita (Lamiaceae), kde je hlavní složkou silice menthol (47,5 %), kdy hodnota MBC (minimální baktericidní koncentrace) byla pro Satureja mutans 4krát nižší než MIC (minimální inhibiční koncentrace) chlorhexidinu a pro Satureja pyogenes 2krát nižší než hodnota MIC chlorhexidinu15).
Nikolić et al. prováděli studii pěti rostlin z čeledi Lamiaceae, kde byla porovnána MIC silic z rostlinných drog (Mentha piperita, Mentha pulegium, Lavandula angustifolia, Satureja montana a Salvia lavandulifolia) s MIC Hexoralu (obsahující chlorhexidin) a MIC Streptomycinu. Silice měly mnohem menší hodnotu MIC než Hexoral, kde byla MIC 650,0 μg/ml pro Satureja pyogenes a 1560,0 μg/ml pro Satureja mutans. Nejúčinnější byla silice ze Satureja montana, kde hodnota MIC pro Satureja mutans byla 60,0 μg/ml a pro Satureja pyogenes 166,7 μg/ml. Žádná z testovaných silic ovšem nedosáhla nižší hodnoty MIC než Erytromycin, kde se hodnota MIC pro Satureja mutans rovnala 20,0 μg/ml, pro Satureja pyogenes 40,0 μg/ml47).
V tabulce 4 jsou shrnuty silice, které se mohou podílet na předcházení vzniku zubních kazů.
4. Silice s antibakteriální aktivitou k bakteriím způsobujícím zubní kaz 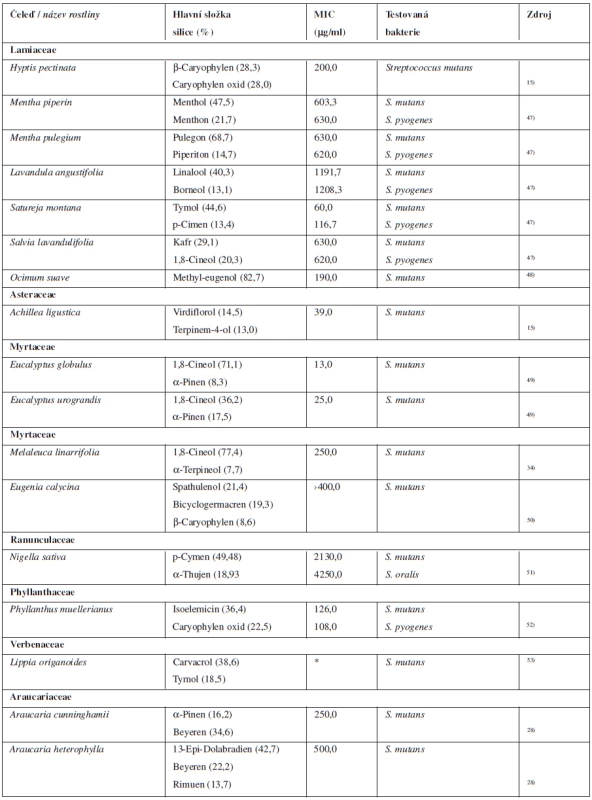
*Hodnota MIC v literatuře neuvedena, antibakteriální aktivita ověřena pomocí diskové difuzní metody. MIC – minimální inhibiční koncentrace Silice s antibakteriální aktivitou k Mycobacterium tuberculosis
Mycobacterium tuberculosis je gram-pozitivní patogen zodpovědný za vznik tuberkulózy. Tuberkulóza (TBC) je jednou z nejsmrtelnějších infekčních onemocnění na světě. Mnohdy je brána jako nemoc minulosti, protože ve vyspělých zemích má incidence onemocnění klesající tendenci. Hlavním problémem se stávají rozvojové země například v Africe, kde je TBC vedle malárie jednou ze tří nejčastějších příčin úmrtí HIV pozitivních jedinců. Každý rok onemocní touto nemocí 8 milionů pacientů na celém světě a přibližně 2–3 miliony pacientů zemře.
Zdrojem nákazy TBC je v dnešní době ve většině případů infikovaný jedinec vylučující patogenní mykobakterie. Branou vstupu infekce je většinou dýchací ústrojí, velmi vzácně trávicí trakt nebo poraněná kůže. U velké části infikovaných osob se onemocnění nemusí projevit a dotyčný je přenašečem. Až když se oslabí imunitní systém, například při HIV nebo ve stáří, dostaví se klinické příznaky onemocnění.
Nemoc nejčastěji postihuje plíce, ale může postihnout i jiné části těla, například kosti, močové ústrojí a nervový systém. Mezi nejčastější příznaky onemocnění patří neutišitelný kašel, vysoké teploty, bolesti na hrudi, úbytek na váze.
V současné době byl evidován výskyt rezistentních a multirezistentních kmenů, proti kterým nezabírají běžně dostupné léky. Proto je nutné hledat nové sloučeniny, které by mohly v budoucnu pomoci v boji s tímto smrtícím patogenem54). Tabulka 5 shrnuje přírodní látky z řad silic, které vykazují antibakteriální aktivitu k Mycobacterium tuberculosis.
5. Silice s antibakteriální aktivitou k Mycobacterium tuberculosis 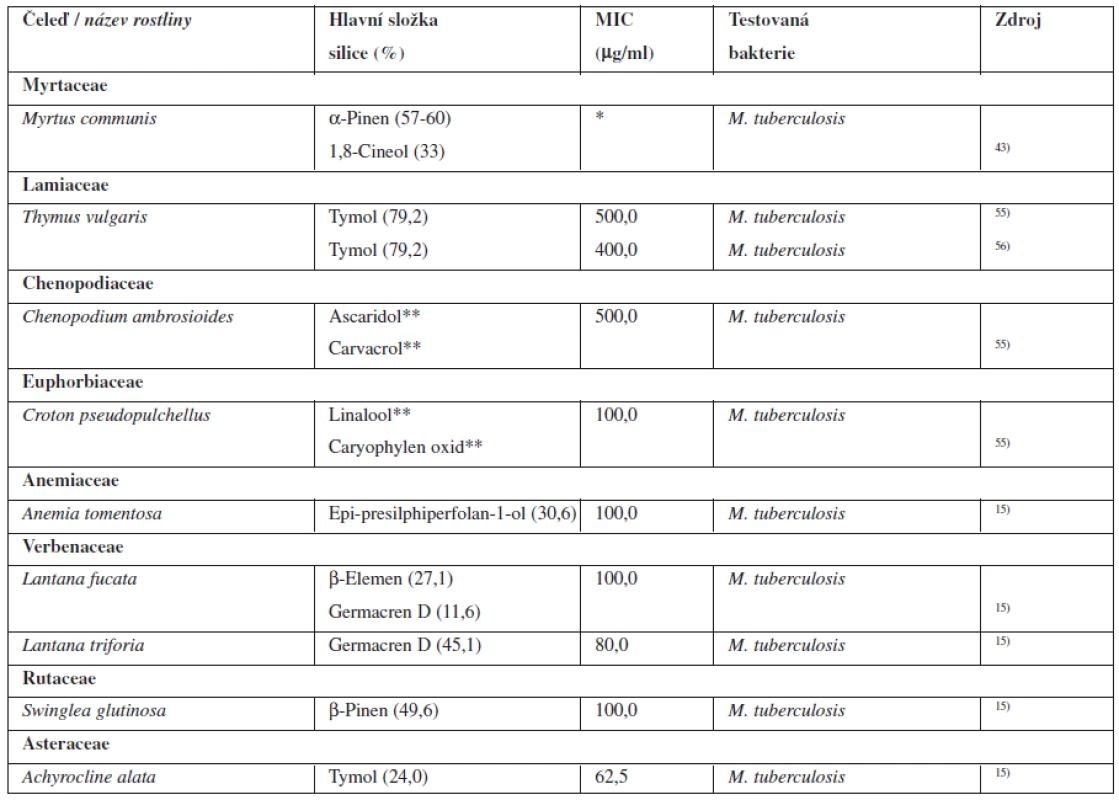
*MIC ověřena pouze diskovou difuzní metodou. **Procentuální složení silice neuvedeno v použité literatuře. MIC – minimální inhibiční koncentrace Lall a Meyer testovali asi 180 rostlin z jižní Afriky, které by mohly být použity v boji proti Mycobacterium tuberculosis. Asi u 30 % se projevila určitá antibakteriální aktivita proti tomuto mikroorganismu. Mezi těmito drogami byly i rostliny obsahující jako účinné látky silice. Antibakteriální aktivitu prokázala například silice z Foeniculum vulgare (Apiaceae) obsahující hlavně anethol, silice z Heteromorpha trifoliata (Apiaceae) obsahující hlavně α-pinen a germacren D, silice z Artemisia afra (Asteraceae) obsahující 1,8-cineol, α i β-thujon a kafr, silice ze Senecio quinquelobus (Asteraceae) obsahující 1,8-cineol, silice z Myrothamus flabeliformus (Myrothamnaceae) obsahující kafr, α-pinen a 1,8-cineol. U extraktů výše uvedených siličných drog však doposud nebyla stanovena MIC a není zatím ani publikováno detailní složení silice a hlavní účinná složka. Víme však, že prokazují antibakteriální aktivitu k Mycobacterium tuberculosis, a mohou tak být předmětem dalšího zkoumání55).
Synergický efekt některých silic v kombinaci s antibiotiky
Velký počet silic vykazuje silný synergický efekt s běžně používanými antibiotiky. Ke stanovení synergické antimikrobiální aktivity in vitro se v praxi používá frakční inhibiční koncentrace (FIC). FIC pro látku A vypočítáme jako poměr MIC (A + B)/MIC (A) a FIC pro látku B poměrem MIC (B + A)/MIC (B). Pro vyjádření stupně synergismu se používá Index frakční inhibiční koncentrace (FICi), který se rovná součtu FIC (A) + FIC (B). Dle hodnoty FICi určíme míru synergismu, úplný synergismus (FICi ≤ 0,5), parciální synergismus (0,5 < FICi ≤ 0,75), bez efektu (0,75 < FICi ≤ 2) nebo antagonismus (FICi > 2).
Silice ze Zataria multiflora (Lamiaceae) s hlavní složkou tymol (38,7 %) vykazuje synergismus s vancomycinem k MRSA s FICi (0,185) a k MRSA s FICi (0,320). Směs silice a vancomycinu by tedy mohla vést k vývoji nové účinné antibakteriální kombinace k léčbě MRSA16).
Další studie ukázala synergický efekt silice z Thymus maroccanus (Lamiaceae) s hlavní složkou carvacrol (76,35 %) s několika běžně užívanými antibiotiky (ciprofloxacin, gentamicin, pristinamycin, cefixim) proti různým patogenům (Escherichia coli, Salmonella sp., Enterobacter cloacae, Klebsiella pneumoniae, Vibrio cholerae, Pseudomonas aeruginosa, Bacillus subtilis, Bacillus cereus, Micrococcus luteus, Staphylococcus aureus). Kombinace silice s ciprofloxacinem vykazuje u všech patogenů úplný synergismus, kombinace s gentamicinem vykazuje úplný synergismus kromě patogenů Salmonella sp., Vibrio cholerae a Micrococcus luteus, kde je synergismus parciální. Parciální synergismus vykazuje kombinace s pristinamycinem u Vibrio cholerae, Pseudomonas aeruginosa a Staphylococcus aureus. Bez efektu zůstala kombinace s cefiximem u Enterobacter cloacae, Klebsiella pneumoniae a Micrococcus luteus. Žádná z kombinací nevykazuje antagonismus a hodnoty MIC jsou až 16krát menší než hodnoty samotné antimikrobiální látky57).
Diterpeny silice z Lycopus europaeus (Lamiaceae) mají aditivní antibakteriální efekt v kombinaci s tetracyclinem k Staphylococcus aureus. Totarol, ferulenol jako hlavní složky silice z Ferula communis (Apiaceae) působí synergicky s hydrazidem kyseliny isonikotinové na patogeny rodu Mycobacterium (M. intracellulare, M. smegmatis, M. xenopei, M. Chelonei). Kyselina isopimaricová z Pinus nigra (Pinaceae) působí s reserpinem aditivně proti MRSA58). U rostliny Pelargonium graveolans (Geraniaceae) s hlavní složkou silice citronellolem a geraniolem se zkoumal synergický efekt s Norfloxacinem, testováno bylo pět bakteriálních kmenů (Bacillus cereus, Bacillus subtilis, Escherichia coli, Staphylococcus aureus ATCC 6538 a Staphylococcus aureus ATCC 29213). U tří z pěti bakteriálních kmenů tato kombinace vykazuje úplný synergismus, a to u Staphylococcus aureus ATCC 29213 s indexem FICi 0,38, u Staphylococcus aureus 6538 s indexem FICi 0,37 a u Bacillus cereus s indexem FICi 0,50, u zbylých dvou bakteriálních kmenů se jedná o synergismus částečný59).
Velmi výhodná je také kombinace Amoxicilinu a silice z Tetraclinis artuculata (Cupressaceae) s hlavní složkou oleje α-campholenalem (16,34 %) a trans-pinocarveolem (15,45 %). Toto spojení silice a antibiotika vykazuje nejvyšší aktivitu proti Listeria monocytogenes (FICi = 0,5), Staphylococcus aureus (FICi = 0,2) a Salmonella enterica (FICi = 0,5), proti Escherichia coli a Pseudomonas aeruginosa nevykazuje tato kombinace efekt žádný, ale proti žádnému testovanému bakteriálnímu kmenu není prokázán antagonismus60). Další velmi významný aditivní antibakteriální efekt vykazuje spojení silice Lippia origanoides (Verbenaceae) s aminoglykosidy neomycinem a amikacinem. Kombinace byla zkoušena na MRSA a výsledky jsou obdivuhodné, spojení silice s neomycinem snížilo hodnotu MIC 10krát MIC 2500 μg/ml klesla na MIC 248 μg/ml a kombinace s amikacinem snížila minimální inhibiční koncentraci ze 788 μg/ml na 78 μg/ml61).
Závěr
Rezistence bakterií k dostupné léčbě se stává globálním problémem. Je proto velmi důležité zaměřit se na studium a vývoj nových účinných léčiv. Jednou z variant je studium přírodních látek, které se pro své léčivé účinky používaly již v dobách, kdy lidstvo nemělo ani povědomí o tom, co je to bakterie či účinná látka. Rostliny obsahují velké množství sekundárních metabolitů, které využívají mimo jiné i k ochraně proti infekcím.
Cílem této práce bylo vyhledání nejnovějších poznatků o antibakteriální aktivitě silic. Jednotlivé silice jsou seřazeny do tabulek a na základě hodnot MIC a MBC můžeme orientačně porovnávat jejich aktivitu. Velké množství silic vykazuje antibakteriální účinek proti různým původcům infekčních onemocnění. Studie se však zabývají hlavně aktivitou in vitro, a tak tyto přírodní sloučeniny, než dostanou své místo ve farmakoterapii, čeká ještě dlouhá cesta testování. Problémem není jen nedostatek informací o toxicitě, farmakodynamice a farmakokinetice, ale také značná nestabilita silice. Tím se zvyšují nároky na extrakci, skladování a uchovávání.
Silice v porovnání s dostupnými antibiotiky většinou vykazují nižší antibakteriální aktivitu, ale jelikož často mají odlišný mechanismus účinku, vykazují účinek i k rezistentním bakteriálním kmenům. Spousta studií prokazuje synergický efekt silice s běžně užívanými antibiotiky, což by mohlo vést ke snížení jejich spotřeby a zmenšení rychlosti nárůstu bakteriální rezistence.
Práce byla podpořena grantovým projektem IGA ČZU Praha, FŽP-20154247/2015.
Střet zájmů: žádný.
Došlo 20. července 2015
Přijato 8. října 2015
Ing. Sherif T. S. Hassan • M. Majerová
Ústav přírodních léčiv, Farmaceutická fakulta
Veterinární a farmaceutická univerzita Brno
Palackého tř. 1/3, 612 42 Brno, Česká republika
e-mail: sherif.hassan@seznam.cz
S. T. S. Hassan • K. Berchová
Katedra aplikované ekologie, Fakulta životního prostředí
Česká zemědělská univerzita v Praze
M. Šudomová
Ústav archeologie a muzeologie
Filozofická fakulta Masarykovy univerzity, Brno
Sources
1. Hassan S. T. S., Masarčíková R., Berchová K. Bioactive natural products with anti-herpes simplex virus properties. J. Pharm. Pharmacol. 2015; 67(10), 1325–1336.
2. Pidot S. J., Coyne S., Kloss F., Hertweck C. Antibiotics from neglected bacterial sources. Int. J. Med. Microbiol. 2014; 304(1), 14–22.
3. Tomko J., a kol. Farmakognózia. 2. vydanie. Martin: Osveta 1999.
4. Nowak A., Kalemba D., Krala L., Piotrowska M., Czyzowska A. The effects of thyme (Thymus vulgaris) and rosemary (Rosmarinus officinalis) essential oils on Brochothrix thermosphacta and on the shelf life of beef packaged in high-oxygen modified atmosphere. Food Microbiol. 2012; 32(1), 212–216.
5. Votava M. Lékařská mikrobiologie obecná. 1. vydání. Brno: Neptun 2001.
6. Fadli M., Chevalier J., Saad A., Mezrioui N. E., Hassani L., et al. Essential oils from Moroccan plants as potential chemosensitisers restoring antibiotic activity in resistant Gram-negative bacteria. Int. J. Antimicrob. Agents 2011; 38(4), 325–330.
7. Kalemba D., Kunicka A. Antibacterial and antifungal properties of essential oils. Curr Med. Chem. 2003; 10(10), 813–829.
8. Warnke P. H., Becker S. T., Podschun R., Sivananthan S., Springer I. N., et al. The battle against multi-resistant strains: renaissance of antimicrobial essential oils as a promising force to fight hospital-acquired infections. J. Craniomaxillofac. Surg. 2009; 37(7), 392–397.
9. Haba E., Bouhdid S., Torrego-Solana N., Marqués A. M., Espuny M. J., et al. Rhamnolipids as emulsifying agents for essential oil formulations: Antimicrobial effect against Candida albicans and methicillin-resistant Staphylococcus aureus. Int. J. Pharm. 2014; 476(1–2), 134–141.
10. Polatoğğlu K., Demirci B, Demirci F, Gören N, Başşer K. H. C. Biological activity and essential oil composition of two new Tanacetum chiliophyllum (Fisch. & Mey.) Schultz Bip. var. chiliophyllum chemotypes from Turkey. Ind. Crops Prod. 2012; 39, 97–105.
11. Dung N. T., Kim J. M., Kang S. C. Chemical composition, antimicrobial and antioxidant activities of the essential oil and the ethanol extract of Cleistocalyx operculatus (Roxb.) Merr and Perry buds. Food Chem. Toxicol. 2008; 46(12), 3632–3639.
12. Tohidpour A, Sattari M, Omidbaigi R, Yadegar A, Nazemi J. Antibacterial effect of essential oils from two medicinal plants against Methicillin-resistant Staphylococcus aureus (MRSA). Phytomedicine 2010; 17(2), 142–145.
13. Thomsen N. A., Hammer K. A., Riley T. V., Van Belkum A, Carson C. F. Effect of habituation to tea tree (Melaleuca alternifolia) oil on the subsequent susceptibility of Staphylococcus spp. to antimicrobials, triclosan, tea tree oil, terpinen-4-ol and carvacrol. Int J Antimicrob Agents. 2013; 41(4), 343–351.
14. Moon T., Wilkinson J., Cavanagh H. M. A. Antibacterial activity of essential oils, hydrosols and plant extracts from Australian grown Lavandula spp. Int. J. Aromather. 2006; 16(1), 9–14.
15. Lang G., Buchbauer G. A review on recent research results (2008–2010) on essential oils as antimicrobials and antifungals. A review. Flavour Fragr. J. 2012; 27 : 13–39.
16. Mahboubi M., Bidgoli F. G. Antistaphylococcal activity of Zataria multiflora essential oil and its synergy with vancomycin. Phytomedicine 2010; 17(7), 548–550.
17. Chang S. T., Chen P. F., Chang S. C. Antibacterial activity of leaf essential oils and their constituents from Cinnamomum osmophloeum. J. Ethnopharmacol. 2001; 77(1), 123–127.
18. Wu J. G., Peng W., Yi J., Wu Y. B., Chen T. Q. Chemical composition, antimicrobial activity against Staphylococcus aureus and a pro-apoptotic effect in SGC-7901 of the essential oil from Toona sinensis (A. Juss.) Roem. leaves. J. Ethnopharmacol. 2014; 154(1), 198–205.
19. Srisukha V., Tribuddhara C., Nukoolkarn V., Bunyapraphatsara N., Chokephaibulkit K., et al. Antibacterial activity of essential oils from Citrus hystrix (makrut lime) against respiratory tract pathogens. Science Asia 2012; 38, 212–217.
20. Djabou N., Lorenzi V., Guinoiseau E., Andreani S., Giuliani M. C., et al. Phytochemical composition of Corsican Teucrium essential oils and antibacterial activity against foodborne or toxi-infectious pathogens. Food Control. 2013; 30(1), 354–363.
21. Martins Mdo R., Arantes S., Candeias F., Tinoco M. T., Cruz-Morais J. Antioxidant, antimicrobial and toxicological properties of Schinus molle L. essential oils. J. Ethnopharmacol. 2014; 151(1), 485–492.
22. Sieniawska E., Los R., Baj T., Malm A., Glowniak K. Antimicrobial efficacy of Mutellina purpurea essential oil and α-pinene against Staphylococcus epidermidis grown in planktonic and biofilm cultures. Ind. Crops Prod. 2013; 51, 152–157.
23. Gao C., Tian C., Lu Y., Xu J., Luo J., et al. Essential oil composition and antimicrobial activity of Sphallerocarpus gracilis seeds against selected food-related bacteria. Food Control. 2011 : 22(3–4), 517–522.
24. Sassi A. B., Harzallah-Skhirib F., Chraiefc I., Bourgougnond N., Hammami M., et al. Chemical composition and antimicrobial activities of the essential oil of (Tunisian) Chrysanthemum trifurcatum (Desf.) Batt. and Trab. Flowerheads. Comptes Rendus Chimie 2008; 11(3), 324–330.
25. Hernandez T., Canales M., Teran B., Avila O., Duran A., et al. Antimicrobial activity of the essential oil and extracts of Cordia curassavica (Boraginaceae). J. Ethnopharmacol. 2007; 111(1), 137–141.
26. Rather M. A., Dar B. A., Dar M. Y., Wani B. A., Shah W. A., et al. Chemical composition, antioxidant and antibacterial activities of the leaf essential oil of Juglans regia L. and its constituents. Phytomedicine 2012; 19(13), 1185–1190.
27. Espina L., Somolinos M., Lorán S., Conchello P., García D., et al. Chemical composition of commercial citrus fruit essential oils and evaluation of their antimicrobial activity acting alone or in combined processes. Food control 2011; 22(6), 896–902.
28. Verma R. S., Padaliaa R. C., Goswamia P., Vermab S. K., Chauhan A., et al. Chemical composition and antibacterial activity of foliage and resin essential oils of Araucaria cunninghamii Aiton ex D.Don and Araucaria heterophylla (Salisb.) Franco from India. Ind. Crops Prod. 2014; 61, 410–416.
29. Farjam M. H. Comparative study of the antimicrobial activity of essential oil and two different extract from Salvia urmiensis Bunge. Asian Pac. J. Trop. Biomed. 2012; 2(3), 1680–1682.
30. Cardile V., Russo A., Formisano C., Rigano D., Senatore F., et al. Essential oils of Salvia bracteata and Salvia rubifolia from Lebanon: Chemical composition, antimicrobial activity and inhibitory effect on human melanoma cells. J. Ethnopharmacol. 2009; 126(2), 265–272.
31. Lertsatitthanakorn P, Taweechaisupapongb S, Aromdeea C, Khunkittia W. In vitro bioactivities of essential oils used for acne control. Int. J. Aromather. 2006; 16(1), 43–49.
32. Scopel R, Falcão M. A., Lucas A. M., Almeida R. N., Gandolfi P. H. K., Cassel E., et al. Supercritical fluid extraction from Syzygium aromaticum buds: Phase equilibrium, mathematical modeling and antimicrobial activity. J. Supercrit. Fluids 2014; 92, 223–230.
33. van Vuuren S. F., Docrat Y., Kamatou G. P. P., Viljoen A. M. Essential oil composition and antimicrobial interactions of understudied tea tree species. S. Afr. J. Bot. 2014 : 92, 7–14.
34. Padalia R. C., Vermaa R. S., Chauhana A., Goswamia P., Vermab S. K., et al. Chemical composition of Melaleuca linarrifolia Sm. from India: a potential source of 1,8-cineole. Ind. Crops Prod. 2015; 63, 264–268.
35. Chen X., Zhang Y., Zu Y., Fu Y., Wang W. Composition and biological activities of the essential oil from Schisandra chinensis obtained by solvent-free microwave extraction. LWT-Food Science and Technology 2011; 44(10), 2047–2052.
36. Santos G. K. N., Dutrab K. A., Barrosa R. A., da Cãmarab C. A. G., Lira D. D., et al. Essential oils from Alpinia purpurata (Zingiberaceae): Chemical composition, oviposition deterrence, larvicidal and antibacterial activity. Ind. Crops Prod. 2012; 40, 254–260.
37. Falsafi T., Moradi P., Mahboubi M., Rahimi E., Momtaz H., et al. Chemical composition and anti-Helicobacter pylori effect of Satureja bachtiarica Bunge essential oil. Phytomedicine 2015; 22(1), 173–177.
38. Pročke M. Současný pohled na eradikaci Helicobacter pylori. Zdravi.e15.cz [online]. 2010, 5. http://zdravi.e15.cz/clanek/priloha-lekarske-listy/soucasny-pohled-na-eradikaci-helicobacter-pylori-450196
39. Ozen F., Ekinci F. Y., Korachi M. The inhibition of Helicobacter pylori infected cells by Origanum minutiflorum. Ind. Crops Prod. 2014; 58, 329–334.
40. Basile A., Senatore F., Gargano R., Sorbo S., del Pezzo M., et al. Antibacterial and antioxidant activities in Sideritis italica (Miller) Greuter et Burdet essential oils. J. Ethnopharmacol. 2006; 107(2), 240–248.
41. Njume C., Afolayan A. J., Green E., Ndip R. N. Volatile compounds in the stem bark of Sclerocarya birrea (Anacardiaceae) possess antimicrobial activity against drug-resistant strains of Helicobacter pylori. Int. J. Antimicrob. Agents 2011; 38(4): 319–324.
42. Adeniyi B. A., Onwubuchea B. C., Anyiama F. M., Ekundayob O, Mahad G. B. Anti-Helicobacter pylori activities of Eucalyptus grandis: Effects on susceptibility, urease activity and cell surface hydrophobicity. Pharm. Biol. 2009; 47(1), 13–17.
43. Aleksic V., Knezevic P. Antimicrobial and antioxidative activity of extracts and essential oils of Myrtus communis L. Microbiol. Res. 2014; 169(4), 240–254.
44. Miguel G., Faleiro L., Cavaleiro C., Salgueiro L., Casanova J. Susceptibility of Helicobacter pylori to essential oil of Dittrichia viscosa subsp. revoluta. Phytother. Res. 2008; 22(2), 259–263.
45. Rozza A. L., Moraes Tde M., Kushima H., Tanimoto A., Marques M. O., et al. Gastroprotective mechanisms of Citrus lemon (Rutaceae) essential oil and its majority compounds limonene and β-pinene: involvement of heat-shock protein-70, vasoactive intestinal peptide, glutathione, sulfhydryl compounds, nitric oxide and prostaglandin E₂. Chem. Biol. Interact. 2011; 189(1–2), 82–89.
46. Zubní kaz – odborný článek. In: Nechcikazy.cz [online] 2012. http://www.nechcikazy.cz/zubni-kaz-odborny-clanek. (20.2.2015)
47. Nikolić M., Jovanović K. K., Marković T., Marković D., Gligorijević N., et al. Chemical composition, antimicrobial, and cytotoxic properties of five Lamiaceae essential oils. Ind. Crops Prod. 2014; 61, 225–232.
48. Runyoro D., Ngassapa O., Vagionas K., Aligiannis N., Graikou K., et al. Chemical composition and antimicrobial activity of the essential oils of four Ocimum species growing in Tanzania. Food Chem. 2010; 119(1), 311–316.
49. Goldbeck J. C., Nascimento J. E. D., Jacob R. G., Fiorentini A. M., da Silva W. P. Bioactivity of essential oils from Eucalyptus globulus and Eucalyptus urograndis against planktonic cells and biofilms of Streptococcus mutans. Ind. Crops Prod. 2014; 60, 304–309.
50. Sousa R. M. F., de Morais S. A. L., Vieira R. B. K., Napolitano D. R., Napolitano V. B., et al. Chemical composition, cytotoxic, and antibacterial activity of the essential oil from Eugenia calycina Cambess. leaves against oral bacteria. Ind. Crops Prod. 2015; 65, 71–78.
51. Harzallah H. J., Kouidhi B., Flamini G., Bakhrouf A., Mahjoub T. Chemical composition, antimicrobial potential against cariogenic bacteria and cytotoxic activity of Tunisian Nigella sativa essential oil and thymoquinone. Food Chem. 2011; 129(4), 1469–1474.
52. Brusotti G., Cesari I., Gilardoni G., Tosi S., Grisoli P., et al. Chemical composition and antimicrobial activity of Phyllanthus muellerianus (Kuntze) Excel essential oil. J Ethnopharmacol. 2012; 142(3), 657–662.
53. Oliveira D. R., Leitão G. G., Bizzo H. R., Lopes D, Alviano D. S., et al. Chemical and antimicrobial analyses of essential oil of Lippia origanoides H.B.K. Food Chem. 2007; 101(1), 236–240.
54. Potrepčiaková S., a kol. Tuberkulóza. Practicus.eu [online] 2008, 4. http://web.practicus.eu/Documents/Practicus-04-2008/24-tuberkuloza.pdf (20. 2. 2015).
55. Lall N., Meyer J. J. In vitro inhibition of drug-resistant and drug-sensitive strains of Mycobacterium tuberculosis by ethnobotanically selected South African plants. J. Ethnopharmacol. 1999; 66(3), 347–354.
56. Sartoratto A., Machado A. L. M., Delarmelina C., Figueir G. M., Duarte M. C. T., et al. Composition and antimicrobial activity of essential oils from aromatic plants used in Brazil. Braz. J. Microbiol. 2004; 35, 275–280.
57. Fadli M., Saad A., Sayadi S., Chevalier J., Mezrioui N. E., et al. Antibacterial activity of Thymus maroccanus and Thymus broussonetii essential oils against nosocomial infection-bacteria and their synergistic potential with antibiotics. Phytomedicine 2012; 19(5), 464–471.
58. Hemaiswarya S., Kruthiventi A. K., Doble M. Synergism between natural products and antibiotics against infectious diseases. Phytomedicine 2008; 15(8), 639–652.
59. Rosato A., Vitali C., de Laurentis N., Armenise D., Antonietta Milillo M. Antibacterial effect of some essential oils administered alone or in combination with Norfloxacin. Phytomedicine 2007; 14(11), 727–732.
60. Djouahri A., Saka B., Boudarene L., Benseradj F., Aberrane S., et al. In vitro synergistic/antagonistic antibacterial and anti-inflammatory effect of various extracts/essential oil from cones of Tetraclinis articulata (Vahl) Masters with antibiotic and anti-inflammatory agents. Ind. Crops. Prod. 2014; 56, 60–66.
61. Barreto H. M. de Lima I. S, Coelho K. M. R. N., Osório L. R., Mourão R. D. A., et al. Effect of Lippia origanoides H.B.K. essential oil in the resistance to aminoglycosides in methicillin resistant Staphylococcus aureus. Eur. J. Integr. Med. 2014; 6(5), 560–564.
Labels
Pharmacy Clinical pharmacology
Article was published inCzech and Slovak Pharmacy

2015 Issue 6-
All articles in this issue
- Antibacterial activity of natural compounds – essential oils
- Cholinergic system of the heart
- Body surface area and body weight of Czech adult cancer population
- Stable gold nanoparticles – synthesis, bioconjugation and application
- Determination of antigripal drugs (pheniramine, phenylephrine) in biological samples by on-line CITP-CZE coupled with tandem mass spectrometry
- Development of the hydrocortisone butyrate qualitative determination method
- Estimation of lipohydrophilic properties of molecules with potential β3-agonistic activity
- Determination of the colorants in vitamin E by HPLC with photodiode array detection
- Analysis of flavonoids in grape leaves by HPLC-DAD-MS/MS
- Antioxidative protection of inactivated rabies vaccine with squalene adjuvant by β-carotene
- From an old drug to a new one: Synthesis of valproate from 5,5-dipropylbarbituric acid
- Synthesis and antimicrobial activity of novel sulfonamide derivatives
- Synthesis and antioxidant activity of phenylcarbamic acid derivatives acting on the cardiovascular system
- Synthesis and biological activity of selected cinnamic acid derivatives
- Synthesis and biological properties of chosen symmetrical amides and thioamides of terephthalic acid
- Synthesis of quinoline derivatives using a nano-Pd/Cu catalyst in the search of new fluorophores
- Synthesis of triclosan derivatives and their antimycobacterial effect
- The development of a dental drug in the form of medicated chewing gum
- Czech and Slovak Pharmacy
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Antibacterial activity of natural compounds – essential oils
- Body surface area and body weight of Czech adult cancer population
- Cholinergic system of the heart
- From an old drug to a new one: Synthesis of valproate from 5,5-dipropylbarbituric acid
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

