-
Medical journals
- Career
Limity zkoušky verbální fluence v diferenciální diagnostice neurologických onemocnění
Authors: Z. Hummelová 1,2; E. Janoušová 3
Authors‘ workplace: I. neurologická klinika LF MU a FN u sv. Anny v Brně 1; Ústav ochrany a podpory zdraví, MU, Brno 2; Institut biostatistiky a analýz, MU, Brno 3
Published in: Cesk Slov Neurol N 2014; 77/110(4): 487-492
Category: Short Communication
Overview
Zkoušky verbální fluence jsou jednoduché testy, které kladou nároky zejména na mentální flexibilitu, na schopnost rychle organizovat informace do sémanticky příbuzných skupin, na efektivní vybavovací strategie, a v neposlední řadě i na kvalitu pracovní paměti. Na základě výzkumů zobrazovacích a funkčních metod mozku se odborná veřejnost shoduje, že zatímco poškození frontálních laloků vykazuje spíše nekonzistentní obraz deficitu v oblasti lexikální verbální fluence, poškození temporálních oblastí bývá úžeji spojeno s deficity v oblasti verbální fluence sémantické. Rozhodli jsme se ověřit, nakolik lze v rámci běžné klinickopsychologické praxe využít tyto závěry k diferenciální diagnostice mezi jednotlivými neurologickými onemocněními. Zkoumaný soubor byl tvořen čtyřmi skupinami pacientů: pacienti s epilepsií frontálního laloku, pacienti s levostrannou temporální epilepsií, pacienti s pravostrannou temporální epilepsií a pacienti s Parkinsonovou nemocí, kdy v každé skupině bylo 25 subjektů. Na základě využití neparametrického Kruskalova ‑ Wallisova testu bylo zjištěno, že se skupiny pacientů statisticky významně nelišily v hodnotách sémantické ani lexikální verbální fluence.
Klíčová slova:
sémantická verbální fluence – lexikální verbální fluence – epilepsie – Parkinsonova nemocÚvod
Zkoušky verbální fluence (VF) se řadí v klinickopsychologické i výzkumné praxi k poměrně často užívaným, a to jak ve formě samostatného testu, tak i v rámci testových baterií. První zmínky o testu verbální fluence můžeme vystopovat do roku 1938 k Thurstonově testu verbální fluence. Ten byl součástí tzv. Primary Mental Abilities Test a úkolem testované osoby bylo co nejrychleji psát slova začínající určitým písmenem [1,2]. V 60. letech minulého století byla posléze zkouška s přispěním A. L. Bentona přepracována do současné formy, kdy testovaná osoba slova jmenuje, a uvedena pod názvem Controlled Oral Word Association (COWA). V této podobě se stala součástí komplexních baterií pro hodnocení afázií, mj. Neurosenzory Center Comprehensive Examination for Aphasia nebo Multilingual Aphasia Examination [3]. Adaptaci a standardizaci zkoušek verbální fluence na české podmínky se u nás věnoval zejména M. Preiss [4,5]. V současné době je zkouška například součástí Neuropsychiatrické baterie Psychiatrického centra Praha [5], podrobněji je též popsána v odborné publikaci kolektivu autorů pod vedením M. Preisse a H. Kučerové s názvem Neuropsychologie v psychiatrii [6].
Zkoušky VF jsou jednoduché a časově nenáročné testy, kdy je úkolem vyšetřované osoby jmenovat po dobu 1 min co nejvíce slov dle určitého kritéria. V této souvislosti rozlišujeme VF sémantickou (slova jsou jmenována dle kategorií: zvířata, oblečení, zelenina…) a VF lexikální (neboli fonemickou: slova jsou jmenována dle počátečního písmena – v české verzi testu jsou nejčastěji užívanými podnětovými písmeny v rámci zkoušky písmena N, K, P). Hodnotí se počet slov, který testovaná osoba vygeneruje, sledovány jsou chyby a perseverace.
Stran statistických charakteristik vykazují zkoušky VF poměrně kvalitní reliabilitu. Například hodnoty test ‑ retest reliability pro lexikální verbální fluenci udávají Ross et al [7] 0,84, Spreen a Strauss [3] v rozmezí 0,70 až 0,88, obdobně i Harrison et al [2] udávají hodnotu 0,82. Výzkumy též dokládají dobrou senzitivitu testu, a to například u pacientů s Parkinsonovou nemocí [8], u pacientů s poraněním mozku (a to zejména v návaznosti na frontální a temporální oblasti) [1,3,9,10], u pacientů s degenerativním onemocněním mozku (sémantická demence, frontální varianta frontotemporální demence, demence při Alzheimerově nemoci, Huntingtonova choroba) [1,3,10 – 12], nebo u pacientů s epilepsií [8,9,13]. Konkrétně Lezak et al [10] uvádějí pro skupinu pacientů s Alzheimerovou nemocí (při využití optimálních cut‑off skórů) až 100% senzitivitu, 90,9% specificitu pro sémantickou VF a 81,8% senzitivitu, 84,1% specificitu pro lexikální VF pro spolehlivé diferencování těchto pacientů od kontrolních skupin.
Kritickou roli pro kvalitní výkon v testu VF hraje zejména mentální flexibilita jedince, jeho schopnost rychle organizovat informace do sémanticky příbuzných skupin, schopnost mít k dispozici efektivní vybavovací strategie, a v neposlední řadě i kvalita pracovní paměti. Předpokládá se, že generování slov dle písmen klade větší nároky na kvalitní vyhledávací strategie jedince, exekutivní procesy a pracovní paměť, zatímco vybavování sémantické, kdy je daná kategorie zřejmá, je více závislé na kvalitních vybavovacích strategiích ze sémantické paměti [3,9,10,14,15].
Mezi další faktory, které ovlivňují výkony ve zkoušce VF, řadíme mj. lokalizaci a lateralizaci případného mozkového poškození. V návaznosti na určitou formu „funkční disociace“ mezi lexikální a sémantickou VF se předpokládá, že jsou tyto dva „subtypy“ verbální fluence částečně zajišťovány odlišnými neuronálními sítěmi v mozku, což potvrzují nedávné studie pracující se zobrazovacími a funkčními metodami [11,12,14 – 17]. V zásadě se odborná veřejnost shoduje, že zatímco poškození frontálních laloků vykazuje spíše nekonzistentní obraz deficitu v oblasti lexikální VF, poškození temporálních oblastí bývá úžeji spojeno s deficity v oblasti VF sémantické než lexikální. Stran lateralizace zkoušek VF ve vztahu k mozkovým oblastem převažuje názor, že zkoušky jsou primárně lateralizovány do dominantní hemisféry (u naprosté většiny populace levé). Avšak informace z některých studií s tímto faktem nekorelují [8,10,11,15] a hovoří o spoluúčasti pravé hemisféry. Mezi další faktory ovlivňující výkony v těchto zkouškách řadíme mentální kapacitu jedince (často hodnocenou počtem let vzdělání nebo úrovní intelektového nadání) a věk.
Cílem naší studie bylo ověřit, zda mohou v běžné klinické praxi výkony ve zkouškách VF napomoci k diferenciální diagnostice mezi vybranými neurologickými onemocněními. Jinými slovy, zda se u daných neurologických onemocnění budou pacienti odlišovat ve výkonech v tomto testu.
Soubor a metodika
Zkoumaný soubor byl tvořen 100 pacienty. Z toho bylo 51 žen a 49 mužů ve věkovém rozmezí 17 až 67 let, průměrný věk byl 38 let (SD = 14). Podrobnější charakteristiky souboru jsou uvedeny v tab. 1 – 3. Soubor byl tvořen čtyřmi skupinami pacientů: pacienti s epilepsií frontálního laloku (FLE), pacienti s levostrannou temporální epilepsií (TLEsin), pacienti s pravostrannou temporální epilepsií (TLEdx) a pacienti s Parkinsonovou nemocí (PN). Každá skupina sestávala z 25 pacientů. Vstupní kritéria pro zařazení pacientů do zkoumaného souboru byla následující: diagnózy onemocnění pacientů byly klinicky potvrzené (neurologické vyšetření, zobrazovací metody, EEG). Stran pacientů s epilepsií se jednalo o epilepsie fokální, do souboru nebyli zařazeni pacienti např. s epilepsií posttraumatickou. Pacienti zařazení do souboru nevykazovali známky demence, byli bez klinicky významné depresivní nebo úzkostné symptomatologie v době vyšetření a bez známek psychiatrického onemocnění, bez předchozího neurochirurgického či neuromodulačního zákroku.
Table 1. Charakteristika datového souboru stran rozložení pohlaví v jednotlivých skupinách. 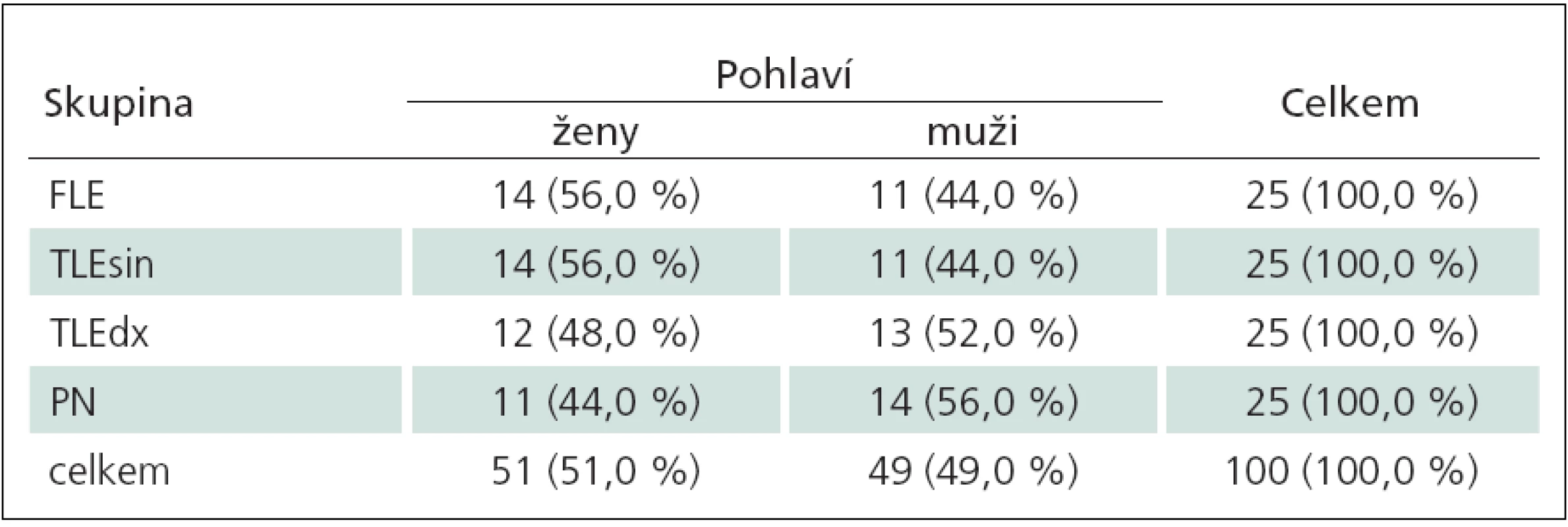
FLE – skupina pacientů s epilepsií frontálního laloku, TLEsin – skupina pacientů s levostrannou temporální epilepsií, TLEdx – skupina pacientů s pravostrannou temporální epilepsií, PN – skupina pacientů s Parkinsonovou nemocí. Table 2. Sumarizace sledovaných proměnných podle pohlaví. 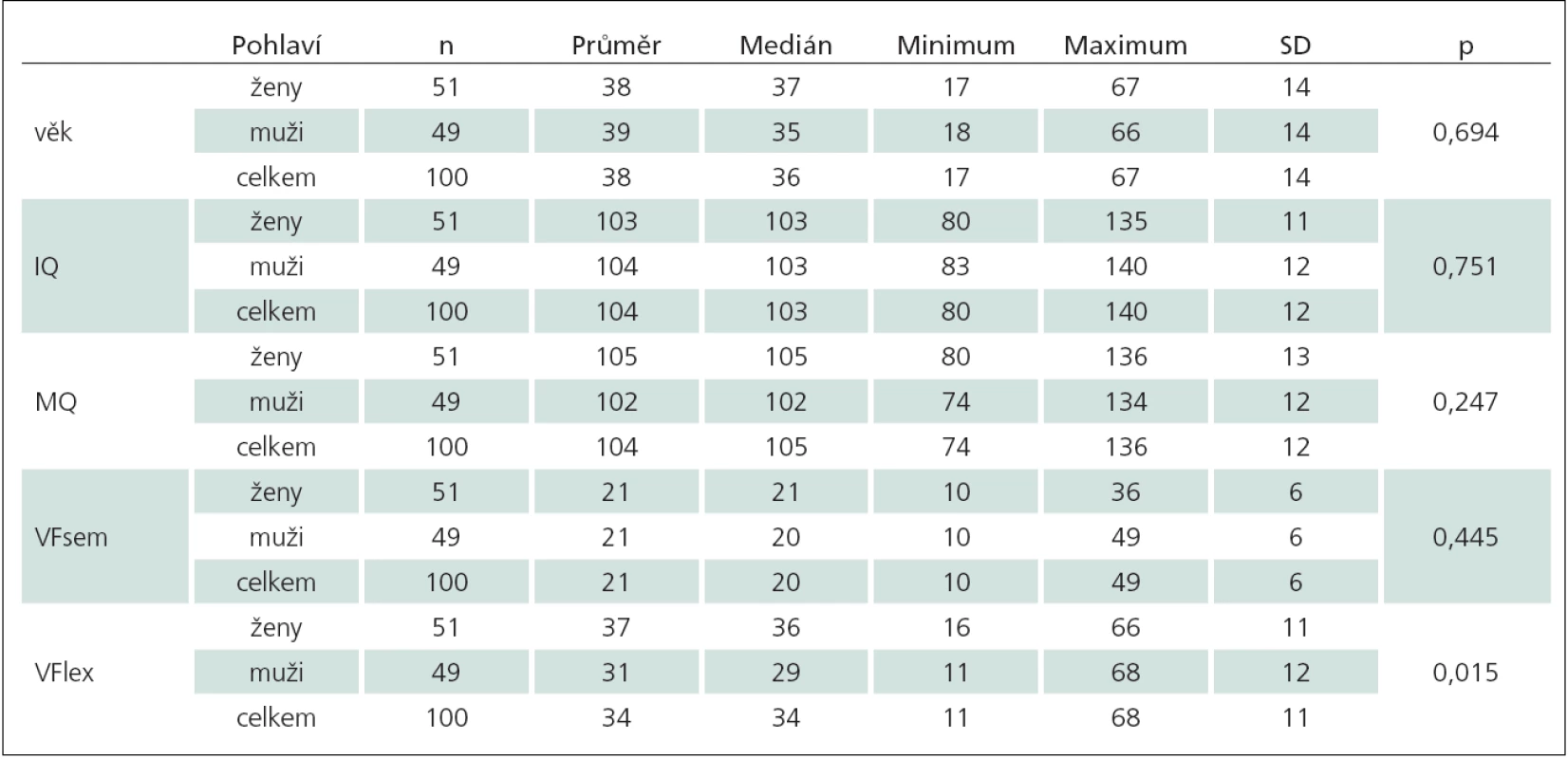
IQ – intelektový kvocient, MQ – paměťový kvocient, VFsem – verbální fluence sémantická, VFlex – verbální fluence lexikální, SD – směrodatná odchylka, p – p-hodnota (Mannův-Whitneyův test). Table 3. Sumarizace sledovaných proměnných podle typu onemocnění. 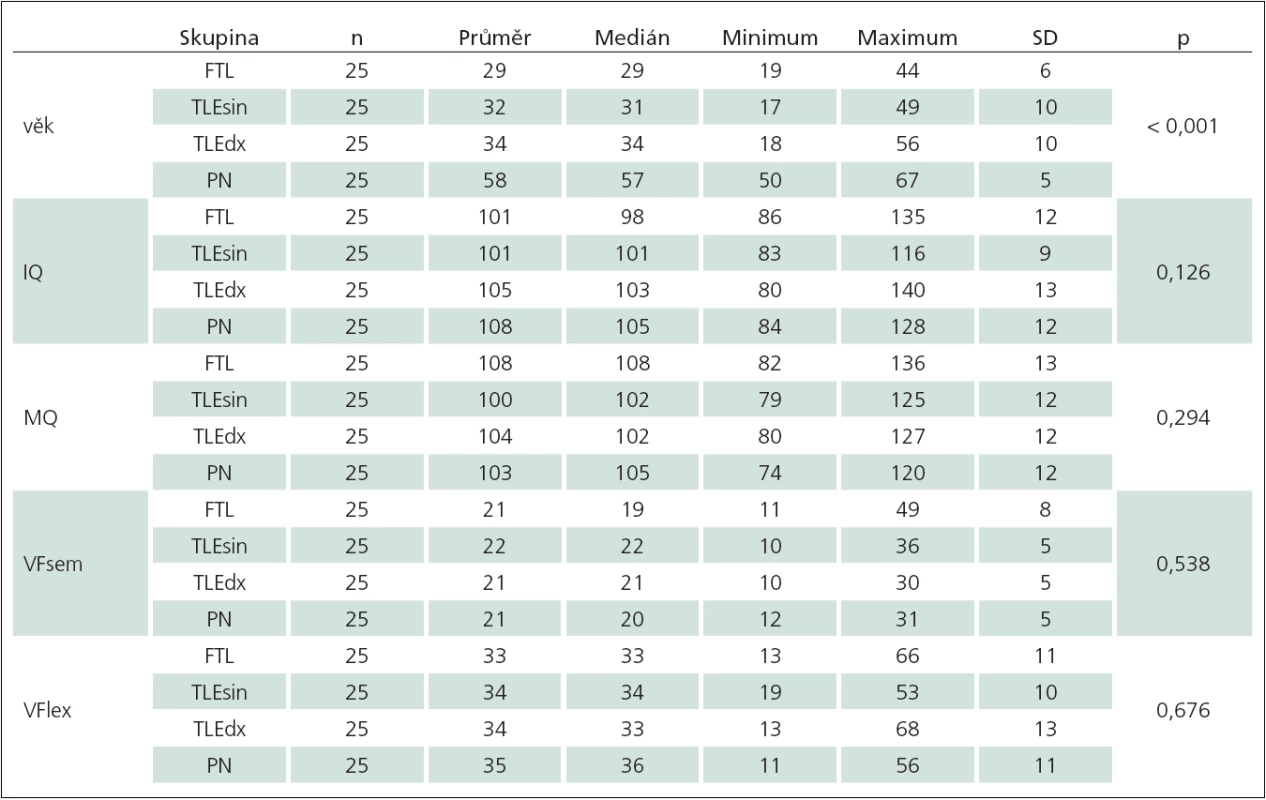
FLE – skupina pacientů s epilepsií frontálního laloku, TLEsin – skupina pacientů s levostrannou temporální epilepsií, TLEdx – skupina pacientů s pravostrannou temporální epilepsií, PN – skupina pacientů s Parkinsonovou nemocí, IQ – intelektový kvocient, MQ – paměťový kvocient, VFsem – verbální fluence sémantická, VFlex – verbální fluence lexikální, SD – směrodatná odchylka, p – p-hodnota (Kruskalův-Wallisův test). Všichni pacienti podstoupili neuropsychologické vyšetření, které zahrnovalo zkoušky VF (sémantické – kategorie „zvířata“; lexikální – písmena N, K, P). Pro sémantickou VF byla užita metodika a normy dle Spreena a Strausse [3], přičemž zde uvedené normy byly publikovány i samostatně autory Tombaughem et al [1] a vytvořeny na souboru 1 300 probandů. Pro lexikální VF byla užita metodika a normy uvedené v Neuropsychiatrické baterii Psychiatrického centra Praha [5]. Dále byla hodnocena úroveň intelektového nadání a paměťových schopností (Wechslerovými škálami). V rámci našeho souboru jsme pracovali pouze s celkovými hodnotami úrovně intelektového nadání (IQ) a paměťových schopností (MQ), vnímali jsme je jako orientační pro posouzení vhodnosti zařazení pacienta do zkoumaného souboru. Dosažený stupeň vzdělání zohledňován nebyl, přesto měli všichni pacienti ukončené základní vzdělání nebo vyšší. Všichni pacienti byli praváci (hodnoceno Testem laterality autorů Matějčka a Žlaba). Realizovaná studie byla retrospektivní, bylo čerpáno z dokumentace pacientů.
Statistická analýza dat zahrnovala ověření vztahu spojitých proměnných (věku, IQ, MQ a VF) a pohlaví pomocí neparametrického Mannova ‑ Whitneyova testu. Rozdíl ve věku, IQ, MQ a VF u jednotlivých skupin pacientů byl ověřován pomocí neparametrického Kruskalova ‑ Wallisova testu. Vztah typu onemocnění a pohlaví byl popsán pomocí četnosti jednotlivých skupin a procentuálního zastoupení. Pro hodnocení vztahu typu onemocnění a pohlaví byl použit Fisherův exaktní test. Vztah dvou spojitých charakteristik (např. VF a IQ) byl popsán pomocí Spearmanova korelačního koeficientu. Neparametrické statistické testy byly použity z důvodu nesplněného předpokladu normálního rozdělení u sledovaných proměnných. K analýze byl použit software IBM SPSS Statistics 21.0 a všechna srovnání byla provedena na hladině významnosti α = 0,05.
Výsledky
U zkoumaného souboru byla provedena základní popisná statistika (tab. 1 – 3). Tab. 1 ukazuje, že se skupiny pacientů neliší v zastoupení mužů a žen (Fisherův exaktní test, p = 0,829), z čehož plyne, že skupiny pacientů jsou srovnatelné. Ze srovnání sledovaných proměnných podle pohlaví (tab. 2) vyplývá, že u mužů a žen není rozdíl ve věku, IQ, MQ a sémantické VF. Muži a ženy se liší pouze v lexikální VF (Mannův ‑ Whitneyův test, p = 0,015), přičemž medián lexikální VF je vyšší u žen (36) než u mužů (29). Skutečnost, že ženy vykazují vyšší výkony v oblasti lexikální VF, je klinicky znám a zohledňují ji i normy k testu.
Srovnání sledovaných proměnných podle typu onemocnění (tab. 3) ukazuje, že se skupiny pacientů neliší v hodnotách IQ, MQ, sémantické VF ani lexikální VF. Testy VF, a to jak sémantické, tak i lexikální, tedy nedokáží odlišit jednotlivé skupiny pacientů (to znamená s epilepsií frontálního laloku, s levostrannou temporální epilepsií, s pravostrannou temporální epilepsií a s Parkinsonovou nemocí). Skupiny pacientů se liší pouze ve věku (Kruskalův ‑ Wallisův test, p < 0,001), konkrétně pacienti s PN jsou starší (medián věku 57 let) než pacienti s FLE, TLEsin, TLEdx (medián věku 29, 31, resp. 34 let). Vyšší věk pacientů s PN je však zcela odůvodnitelný vzhledem k obvykle vyššímu věku počátku tohoto onemocnění.
Vztahy sledovaných proměnných u jednotlivých skupin pacientů byly sumarizovány pomocí Spearmanových korelačních koeficientů v tab. 4. Ve skupině pacientů TLEsin byla zjištěna statisticky významná pozitivní korelace mezi úrovní paměti a sémantickou VF (Spearmanův korelační koeficient r = 0,658; p < 0,001). V ostatních skupinách nebyla korelace úrovní paměti a sémantické VF statisticky významná. Zjištěný fakt je v souladu s předpoklady o funkční provázanosti dominantních temporálních oblastí se sémantickou VF. U pacientů s PN jsme nezaznamenali žádné korelace, jejichž statistická významnost by byla nižší než 0,01. Statisticky významná byla pouze korelace sémantické VF s IQ (Spearmanův korelační koeficient r = 0,481; p = 0,015). Obecně u pacientů s epilepsií bylo zachyceno více statisticky významných korelací oproti skupině pacientů s Parkinsonovou nemocí. Domníváme se, že tento rozdíl může být ovlivněn mj. charakterem onemocnění ve vztahu k mozkovým strukturám a věkem manifestace onemocnění.
Table 4. Hodnoty Spearmanova korelačního koeficientu mezi jednotlivými proměnnými v rámci skupin pacientů. 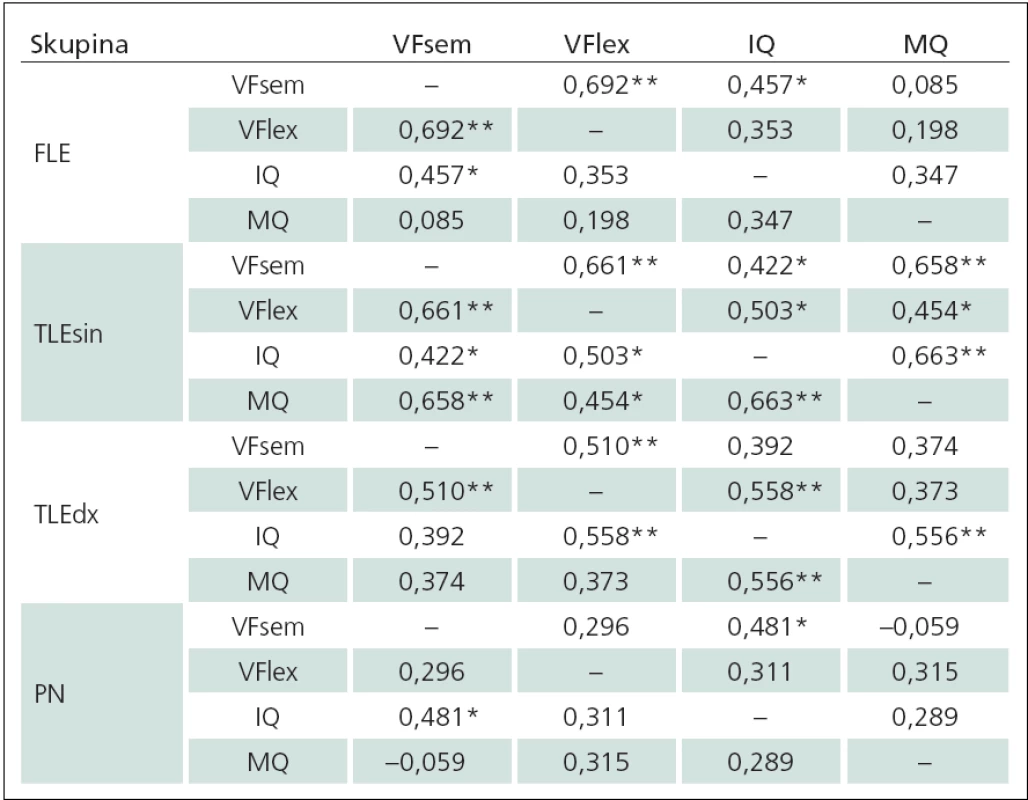
**korelace je signifikantní na hladině významnosti 0,01, *korelace je signifikantní na hladině významnosti 0,05, FLE – skupina pacientů s epilepsií frontálního laloku, TLEsin – skupina pacientů s levostrannou temporální epilepsií, TLEdx – skupina pacientů s pravostrannou temporální epilepsií, PN – skupina pacientů s Parkinsonovou nemocí, VFsem – verbální fluence sémantická, VFlex – verbální fluence lexikální, IQ – intelektový kvo cient, MQ – paměťový kvocient. Diskuze
Nálezy nepřítomnosti statisticky významných rozdílů ve zkouškách VF u skupin pacientů FLE, TLEsin, TLEdx a PN se mohou zdát na první pohled překvapivé, jelikož v souladu s výše uvedenými poznatky by bylo možné předpokládat, že pacienti ve skupinách FLE a PN by mohli vykazovat tendenci k nižším výkonům v oblasti lexikální VF, oproti tomu pacienti ve skupině TLEsin by spíše mohli vykazovat tendenci k nižším výkonům v oblasti sémantické VF. Avšak při detailnějším studiu literárních zdrojů je zřejmé, že naše výsledky v podstatě odráží nesourodost jejich závěrů. Nutno přiznat, že předpoklady o neuroanatomických a funkčních souvislostech vychází v posledních letech zejména ze studií pracujících se zobrazovacími a funkčními metodami. A právě výsledky těchto studií nabízí ne zcela konzistentní závěry. Například kromě standardně zmiňované klíčové role frontálních oblastí (prefrontálních, dorzolaterálních, ale i laterálních) a temporálních oblastí (zejména mediálních) – jak v dominantní, tak i nedominantní hemisféře, některé studie pozorovaly významnou aktivaci i v oblastech parietálních a okcipitálních [11,14,15]. Obdobně i studie pracující s hodnocením VF u pacientů s epilepsií přináší rozporuplné závěry. Například Troyer et al [9] uvádějí, že pacienti s FLE v řadě studií vykazovali ve zkouškách lexikální VF podobné deficity jako pacienti s posteriorními kortikálními lézemi (tedy i v temporálních oblastech), stejně jako pacienti s difúzním mozkovým poškozením. Podobně nesourodé závěry jsou prezentovány i u pacientů s FLE a TLE, kdy po epileptochirurgickém zákroku vykazovali tito pacienti pouze nesignifikantní deficity ve zkouškách VF nebo byl snížen jejich výkon jak v sémantické, tak i lexikální VF [8,12].
Otázkou zůstává, proč test v některých výzkumech nedostatečně diferencuje mezi skupinami pacientů, u kterých bychom rozdíly ve výkonech očekávali. Domníváme se, že výsledek nejen reflektuje výše zmíněné rozpory v odborných názorech na to, nakolik, za jakých okolností a které neuroanatomické koreláty odráží deficitní výkony v testech VF, ale také se tímto bodem dostáváme k otázce ekologické validity poznatků získaných z těchto výzkumů. Na jedné straně stojí výsledky výzkumů, které se snaží zachytit neuroanatomické koreláty testu VF s využitím zobrazovacích a funkčních metod za jasně definovaných výzkumných okolností a paradigmat se soustředěním týmu na danou výzkumnou úlohu – tudíž v jaksi „sterilním“ prostředí. Na straně druhé máme limity běžné klinické praxe, kdy jsou výkony pacienta v testu závislé na řadě situačních faktorů (na straně vyšetřovaného, vyšetřujícího i situaci jako takové) a neuropsycholog se propracovává k následné úvaze o lokalizaci, lateralizaci nebo diferenciálně‑diagnostickému hodnocení kognitivních deficitů „zprostředkovaně“ přes výsledky testů a klinických metod a nemá možnost „nahlédnout“ do běžících procesů v mozku. Na zvážení se tudíž nabízí názor, nakolik jsou zkoušky VF citlivé spíše na mozkové poškození jako takové, než na poškození specifických mozkových oblastí.
Dalším limitujícím faktorem pro využití testu VF v rámci diferenciální diagnostiky může být i doposud standardně využívaný způsob hodnocení výkonů zkoumané osoby v testu. Hodnocen je počet slov, který zkoumaná osoba vygeneruje. Přikláníme se k názoru, že způsob hodnocení by měl být optimálně rozšířen o hodnocení schopnosti testované osoby „přepínat“ mezi subkategoriemi (tzv. switching – funkčně spojované s frontálními oblastmi) a o hodnocení schopnosti generovat slova v rámci subkategorií (tzv. clustering – funkčně spojované s temporálními oblastmi).
Závěr
V naší studii jsme dospěli k zjištění, že zkoušky VF (sémantické a lexikální) nedokázaly diferencovat mezi skupinami pacientů s epilepsií frontálního laloku, s levostrannou temporální epilepsií, s pravostrannou temporální epilepsií a s Parkinsonovou nemocí. Přesto bychom rádi závěrem zdůraznili, že navzdory výše uvedenému se domníváme, že zkoušky VF jistě zůstávají užitečným nástrojem v klinické praxi, avšak je potřeba citlivě přistupovat k jejich interpretaci. Ta by měla být vždy realizována individuálně pro každého pacienta a v kontextu výsledků dalších neuropsychologických testů a klinických vyšetření.
Autorky deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Mgr. Zuzana Hummelová
I. neurologická klinika
LF MU a FN u sv. Anny v Brně
Pekařská 53
656 91 Brno
e-mail: zuzana.fanfrdlova@fnusa.cz
Přijato k recenzi: 9. 1. 2014
Přijato do tisku: 11. 4. 2014
Sources
1. Tombaugh TN, Kozak J, Rees L. Normative data stratified by age and education for two Measures of verbal fluency: FAS and animal naming. Arch Clin Neuropsychol 1999; 14(2): 167 – 177.
2. Harrison JE, Buxton P, Husain M, Wise R. Short test of semantic and phonological fluency: normal performance, validity and test ‑ retest reliability. Br J Clin Psychol 2000; 39(2): 181 – 191.
3. Spreen O, Strauss E. Controlled Oral Word Association (COWA). In: A Compendium of Neuropsychological Tests. Administration, Norms, and Commentary. 2nd ed. New York, Oxford: Oxford University Press 1998 : 447 – 464.
4. Preiss M, Kalivodová Z, Kundrátová I, Mrlinová L, Ježková T, Kubů M et al. Test verbální fluence – vodítka pro všeobecnou dospělou populaci. Psychiatrie 2002; 6(2): 74 – 77.
5. Preiss M, Rodriguez M, Kawaciuková R, Laing H. Verbální fluence. In: Neuropsychologická baterie Psychiatrického centra Praha. 2. přepracované vydání. Praha: Psychiatrické centrum Praha 2007 : 37 – 40.
6. Preiss M, Kučerová H et al. Verbální fluence. In: Neuropsychologie v psychiatrii. Praha: Grada Publishing 2006 : 389 – 392.
7. Ross TP, Calhoun E, Cox T, Wenner C, Kono W, Pleasant M. The reliability and validity of qualitative scores for the Controlled Oral Word Association Test. Arch Clin Neuropsychol 2007; 22(4): 475 – 488.
8. Henry JD, Crawford JR. Verbal fluency deficits in Parkinson’s disease: a meta-analysis. J Int Neuropsychol Soc 2004; 10(4): 608 – 622.
9. Troyer AK, Moscowitch M, Winocur G, Alexander MP,Stuss D. Clustering and switching on verbal fluency: the effects of focal frontal ‑ and temporal ‑ lobe lesions. Neuropsychologia 1998; 36(6): 499 – 504.
10. Lezak MD, Howieson DB, Loring DW. Verbal functions and language skills. In: Neuropsychological assessment. 4th ed. Oxford: Oxford University Press 2004 : 501 – 530.
11. Laisney M, Matuszewski V, Mézenge F, Belliard S,de la Sayette V, Eustache F et al. The underlying mechanisms of verbal fluency deficit in frontotemporal dementia and semantic dementia. J Neurol 2009; 256(7): 1083 – 1094. doi: 10.1007/ s00415 ‑ 009 ‑ 5073 ‑ y.
12. Schönknecht ODP, Toro P, Hunt A, Henze M, Haberkorn U, Schröder J. Neural correlates of cognition deficits in mild cognitive impairment and Alzheimer’s disease. Mind and Brain 2011; 2(1): 1 – 8.
13. Sarkis RA, Busch RM, Floden D, Chapin JS, Kenney CK, Jehi L et al. Predictors of decline in verbal fluency after frontal lobe epilepsy surgery. Epilepsy Behav 2013; 27(2): 326 – 329. doi: 10.1016/ j.yebeh.2013.02.015.
14. Birn RM, Kenworthy L, Case L, Caravella R, Jones TB,Bandettini PA et al. Neural systems supporting lexical search guided by letter and semantic category cues: a self ‑ paced overt response fMRI study of verbal fluency. Neuroimage 2010; 49(1): 1099 – 1107. doi: 10.1016/ j.neuroimage.2009.07.036.
15. Nagels A, Kircher T, Dietsche B, Backes H, Marquetand J, Krug A. Neural processing of overt word generation in healthy individuals: the effect of age and word knowledge. Neuroimage 2012; 61(4): 832 – 840. doi: 10.1016/ j.neuroimage.2012.04.019.
16. Heinzel S, Metzger FG, Ehlis A, Korell R, Alboji A,Haeussinger FB et al. Aging‑related cortical reorganization of verbal fluency processing: a functional near ‑ infrated spectroscopy study. Neurobiol Aging 2013; 34(2): 439 – 450. doi: 10.1016/ j.neurobiolaging.2012.05.021.
17. Tupak SV, Badewien M, Dresler T, Hahn T, Ernst LH,Herrmann MJ et al. Differential prefrontal and frontotemporal oxygenation patterns during phonemic and semantic verbal fluency. Neuropsychologia 2012; 50(7): 1565 – 1569. doi: 10.1016/ j.neuropsychologia.2012.03.009.
Labels
Paediatric neurology Neurosurgery Neurology
Article was published inCzech and Slovak Neurology and Neurosurgery

2014 Issue 4-
All articles in this issue
- Vyšetření senzitivity
- Postižení nervového systému z nutriční nedostatečnosti po bariatrických operacích
- Genetická variabilita u poruchy pozornosti s hyperaktivitou (ADHD)
- Anaplastické oligodendrogliomy – nadešel čas pro personalizovanou medicínu?
- Přínos opakování nepotvrzujícího testu mnohočetné latence usnutí (MSLT) pro stanovení diagnózy narkolepsie
- Rozdíly v postižení prostorové orientace u demencí neurodegenerativní etiologie
- Hodnocení písma u pacientů s Parkinsonovou nemocí
- AMETYST – observační studie fáze 4 sledující vliv intramuskulárně podávaného interferonu beta‑1a u pacientů s klinicky izolovaným syndromem/ klinicky definitivní roztroušenou sklerózou
- Dědičné ulceromutilující senzitivní neuropatie – klinická, elektrofyziologická a molekulárně genetická studie tří rodin
- Limity zkoušky verbální fluence v diferenciální diagnostice neurologických onemocnění
- Validace dotazníkové sady pro diagnostiku syndromu neklidných nohou v populaci českých těhotných žen
- Nálezy v mozkomíšním moku u dětí s akutním paretickým postižením
- Dlouhodobé sledování kognitivních, emočních a behaviorálních změn u pacientky s roztroušenou sklerózou – kazuistika
- Spinální arteriovenózní malformace – dvě kazuistiky
- Totální avulze bulbu kombinovaná s poraněním chiazmatu – kazuistika
- Prospektivní paměť a její vyšetření – validace Testu paměti pro záměry
- Význam (CA)n repetitivní sekvence genu pro beta‑3 podjednotku GABA(A) receptoru při manifestaci tinnitu
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Vyšetření senzitivity
- Genetická variabilita u poruchy pozornosti s hyperaktivitou (ADHD)
- Spinální arteriovenózní malformace – dvě kazuistiky
- Přínos opakování nepotvrzujícího testu mnohočetné latence usnutí (MSLT) pro stanovení diagnózy narkolepsie
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

