-
Medical journals
- Career
Antiangiogenní bioterapie a chemoterapie v terapii karcinomu prsu: přehled literatury a kazuistika
Authors: M. Sochor 1; P. Chlebus 2
Authors‘ workplace: Centrum pro klinickou a radiační onkologii, Krajská nemocnice Liberec, a. s., Liberec 1; Radiodiagnostické oddělení, Krajská nemocnice Liberec, a. s., Liberec 2
Published in: Klin Onkol 2013; 26(2): 91-98
Category: Case Report
Overview
Karcinom prsu je s incidencí 120/100 000 žen suverénně nejčastějším zhoubným nádorovým onemocněním žen. Přes stále vzrůstající incidenci si mortalita udržuje stabilní hodnotu, na čemž se podílí vliv screeningu záchytem časných stadií, adjuvantní léčba a pokroky v cílené terapii. V současnosti vnímáme karcinom prsu jako soubor fenotypicky zcela odlišných podjednotek, podmíněných genetickými a epigenetickými vlivy. Jednotlivé z 5 základních podskupin (luminální A, B, bazaloidní, HER-2 pozitivní, claudin-low) se významně liší svojí prognózou a léčebnými možnostmi. Podskupina bazaloidních nádorů bez pozitivity hormonálních receptorů a HER-2 antigenu (triple-negativní karcinom prsu) je prognosticky a léčebně velice nepříznivá skupina. Vyloučeny jsou možnosti hormonální a anti-HER terapie a efekt chemoterapie je omezený a krátce trvající. Výzkum se u této podskupiny nádorů prsu v posledních letech zaměřil na ovlivnění angiogeneze a opravných systémů DNA poškození. Léčebné ovlivnění angiogeneze vychází z konceptu jejího podílu na rozvoji a udržení nádorového procesu. Nejdéle používanou a z hlediska studií a klinické praxe prozkoumanou léčbou je působení na hlavní dráhu angiogeneze, na vaskulární endoteliální růstový faktor. V posledních několika letech se diskutuje skutečný efekt u metastatického karcinomu prsu. Prvotní příznivé výsledky pilotních klinických studií na výrazné prodloužení období bez progrese přinášejí zklamání, protože se nepřenesly do prodloužení celkového přežití. Následující kazuistika prezentuje pacientku s metastatickým triple-negativním karcinomem prsu s kombinovanou chemobioterapií capecitabin + bevacizumab. V další části sdělení následuje diskuze nad možnými příčinami rozporuplných výsledků antiangiogenní terapie u karcinomu prsu, nové směry výzkumu a současné znalosti o možnostech predikce jejího účinku.
Klíčová slova:
angiogeneze – metastatický karcinom prsu – bevacizumab – antiangiogenní terapie – prognostické faktoryKazuistika
Prezentovaná pacientka se narodila v roce 1950, v předchorobí s léčenou hypertenzí a hypotyreózou. Onkologické onemocnění bylo zjištěno samovyšetřením na jaře 1992. Pacientka podstoupila ablaci levého prsu a exenteraci axily v dubnu 1992. Histologicky se jednalo o nádor velikosti 18 × 20 mm, gelatinózní, špatně diferencovaný karcinom, v axile pozitivní 1 uzlina. Dle TNM klasifikace pT2 pN1 M0, stadium IIB. Pooperačně bylo aplikováno 7 sérií chemoterapie CMF, dále ozářena hrudní stěna a svodná lymfatika dávkou 2/50 Gy a byla zařazena do studie ATLAS s terapií tamoxifenem. Následně byla dispenzarizována pomocí pravidelných klinických kontrol s kontrolami mamografem, ultrazvukem axil, hrudní stěny a břicha a rentgeny plic. Pro zjištěnou elevaci nádorových markerů v listopadu 2009 (C153 hodnota 50,1) bylo provedeno CT hrudníku a břicha s nálezem mnohočetných jaterních metastáz v obou lalocích a 2 ložisek v parenchymu pravé plíce. Dle RECIST kritérií byly nalezeny 2 měřitelné léze v pravé plíci se součtem maximálních rozměrů 85 mm (obr. 1). Vzhledem k době od primární diagnózy karcinomu prsu (období bez nemoci – DFI 210 měsíců) jsme provedli transparietální CT navigovanou biopsii z většího ložiska v pravé plíci. Histologicky byla potvrzena metastáza gelatinózního karcinomu, triple-negativní (ER–, PgR–, HER-2 1+). Vzhledem k tehdejším možnostem jsme léčbu zahájili v první linii kombinací capecitabin + bevacizumab (capecitabin 1 000 mg/m2 2krát denně perorálně den 1–14 cyklu, bevacizumab 15 mg/kg i.v. den 1 cyklu, opakování à 21 dnů). Pacientka chodila na pravidelné kontroly, efektivita léčby se hodnotila pomocí CT hrudníku a břicha každé 3 měsíce dle RECIST kritérií, dále při každé sérii nežádoucí účinky dle NCI-CTCAE v3.0. První kontrolní CT vyšetření v březnu 2010 prokázalo stabilizaci v oblasti jater, na plicích se dle RECIST jednalo o zmenšení na sumu 65 mm (–23,5 %), které splňovalo kritéria stabilizace choroby (obr. 2). Po 3. sérii chemoterapie v lednu 2010 došlo k rozvoji hand-foot syndromu (HFS) na stupeň 1, zahájili jsme podpůrnou lokální terapii. Do konce února 2010 (4. série) byla progrese HFS na stupeň 3. Provedli jsme proto redukci dávky capecitabinu na 75 % výchozí dávky a pokračovali v lokální terapii. Během 1 měsíce došlo k normalizaci HFS na stupeň 1. Další kontrolní CT vyšetření bylo provedeno v červnu 2010, opět trvající stabilizace nemoci v oblasti jater. Na CT hrudníku byla suma velikosti cílových lézí 59 mm (–30,5 %), což již splňovalo kritéria parciální regrese (obr. 3). V dalším průběhu došlo koncem května 2010 (8. série) opět k progresi HFS na stupeň 3, proto jsme zredukovali dávku capecitabinu na 50 % výchozí dávky. Opět přibližně během 1 měsíce se stav upravil na stupeň 1. V dalším sledovaném období nedocházelo ke změnám klinického stavu, tolerance chemobioterapie byla vynikající, hypertenze stabilizovaná na antihypertenzivech, která byla nasazena již v předchorobí. Pravidelná CT vyšetření byla bez vývoje, trvala stabilizace nemoci s dosaženou parciální regresí. Koncem července 2011 se zhoršil hand-foot syndrom opět na stupeň 3, proto jsme capecitabin po celkovém počtu 28 sérií ukončili a nadále pokračovali v monoterapii bevacizumabem à 21 dnů. Poslední kontrolní CT bylo provedeno v prosinci 2012, nadále trvá stabilizace nemoci s dosaženou parciální regresí (obr. 4). Klinicky pacientka ve vynikajícím stavu (PS 0), žijící aktivní život, bez známek nemoci, HFS již zcela vyhojený, bez nežádoucích účinků terapie, hypertenze stabilizovaná. Celková doba léčby je přes 36 měsíců, období bez progrese (progression free survival – PFS) je do prosince 2012 36 měsíců, trvání parciální regrese je detekováno 31 měsíců. Pacientka doposud absolvovala celkem 52 sérií léčby, z toho 28 sérií kombinovaně capecitabin + bevacizumab a poté monoterapie bevacizumabem. Další plánované přešetření CT je plánováno na první třetinu března 2013.
Image 1. Vstupní CT vyšetření plic z prosince 2009 před zahájením terapie. Vstupně 2 cílové léze o součtu rozměrů dle RECIST 85 mm. 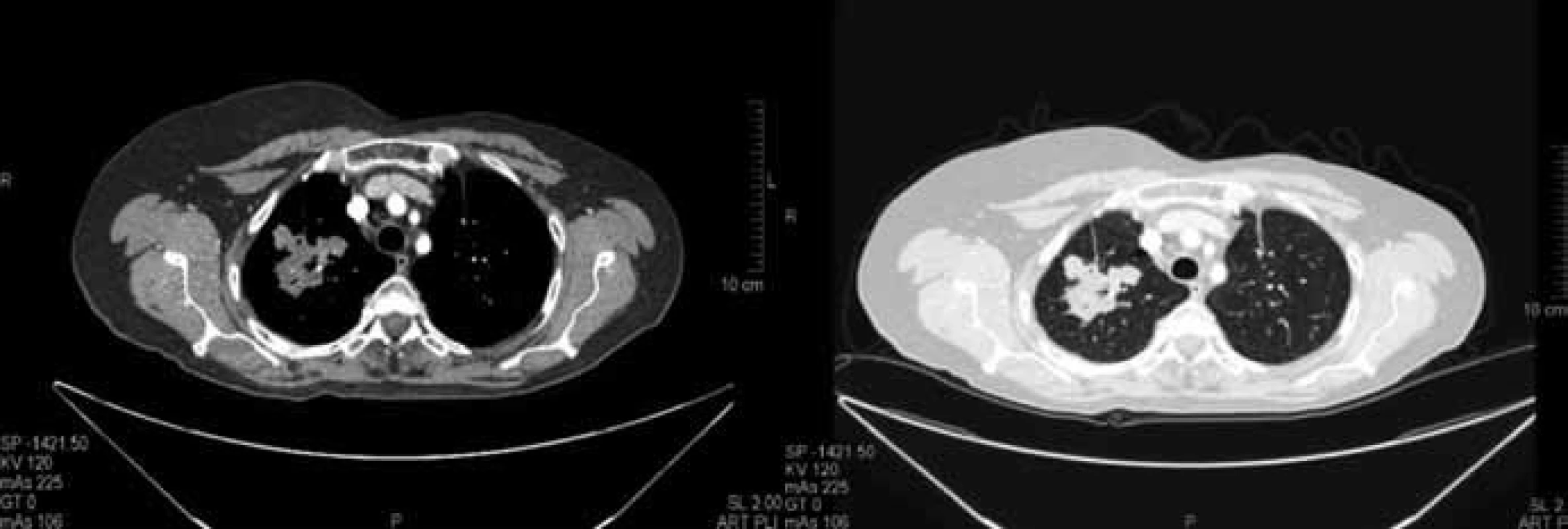
Image 2. Kontrolní CT vyšetření plic po 3 měsících chemobioterapie v březnu 2010. Součet cílových lézí dle RECIST 65 mm (–23,5 %) splňující kritéria stabilizace nemoci (SD). 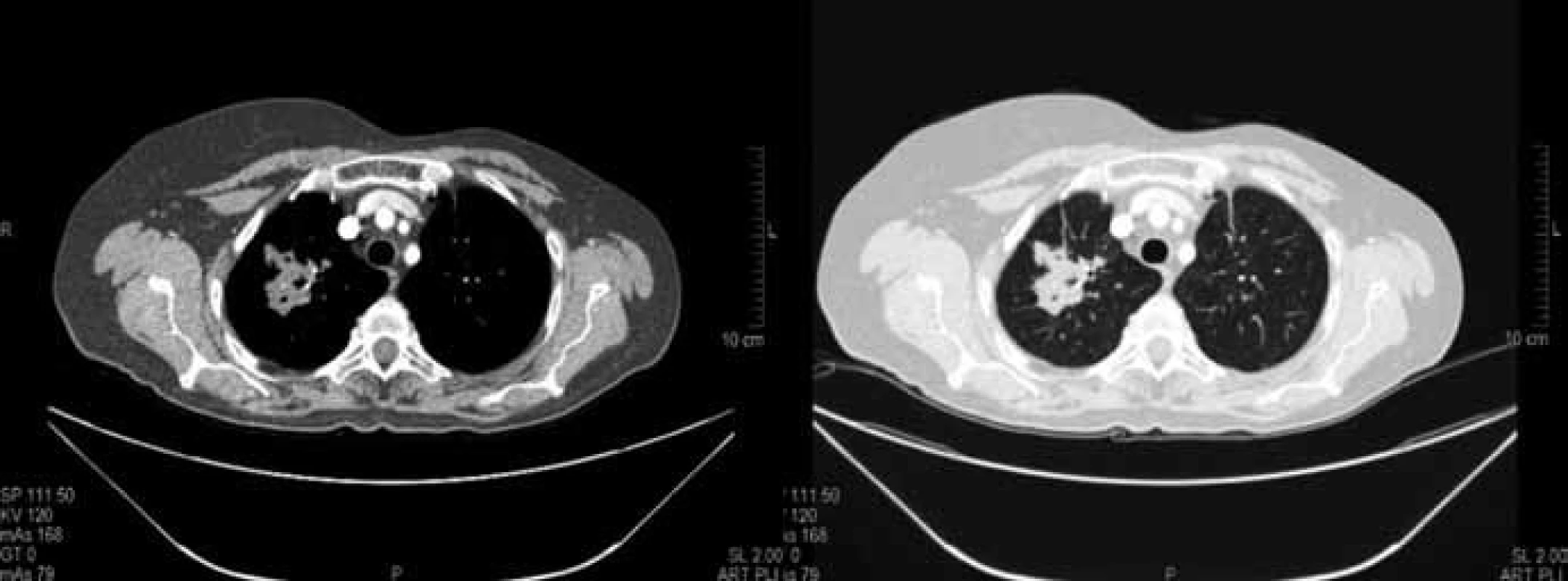
Image 3. Kontrolní CT vyšetření plic po 6 měsících chemobioterapie v červnu 2010. Součet cílových lézí dle RECIST 59 mm (–30,5 %) splňující kritéria parciální regrese (PR). 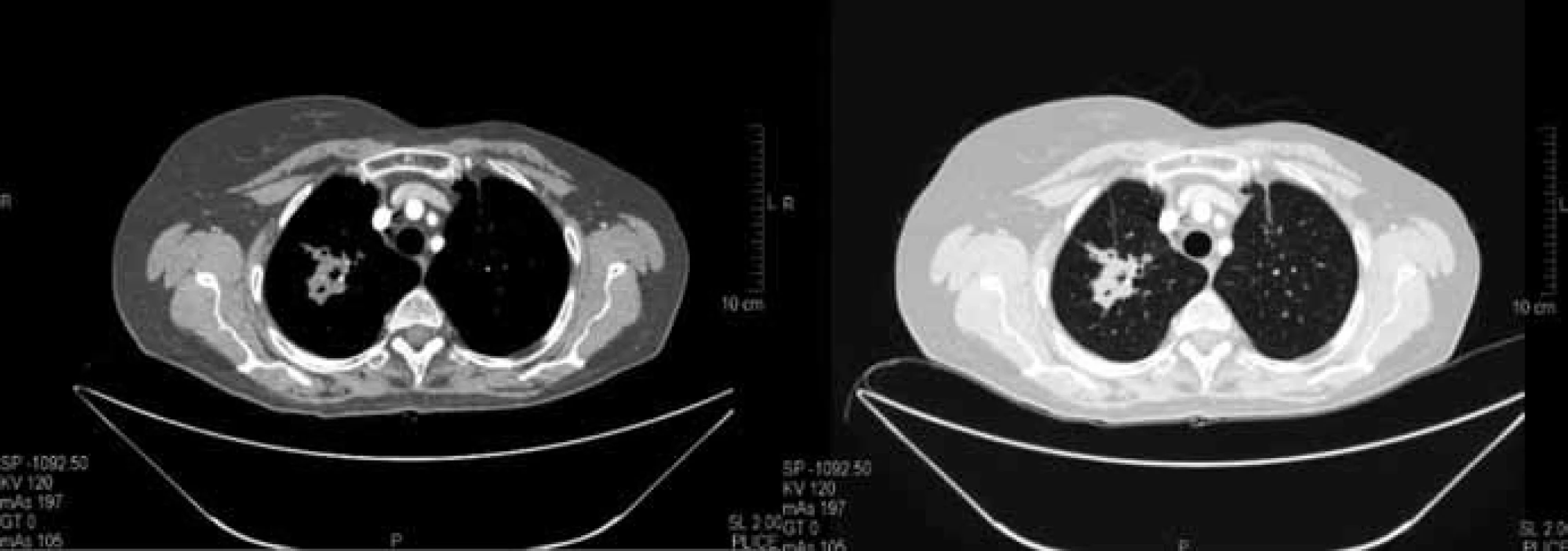
Image 4. Kontrolní CT vyšetření plic v prosinci 2012 po 36 měsících antiangiogenní chemobioterapie. Trvající stabilizace nemoci s dosaženou parciální regresí. 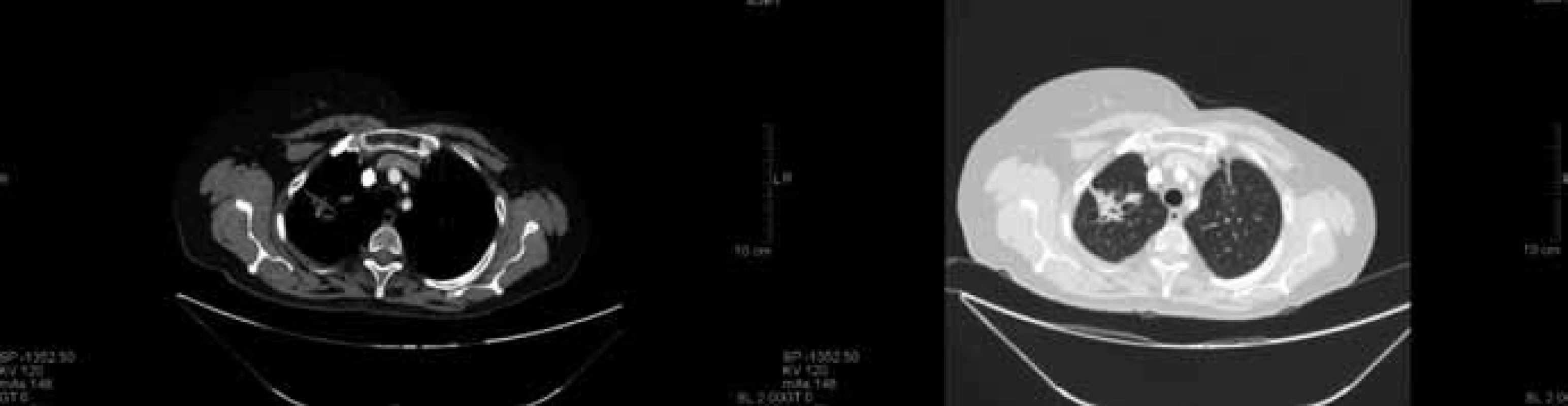
Přehled literatury a diskuze
Antiangiogenní léčba cílená proti vaskulárnímu endoteliálnímu růstovému faktoru (vascular endothelial growth factor – VEGF) v kombinaci s chemoterapií je zcela etablovanou modalitou v terapii metastatického kolorektálního karcinomu v první a druhé linii léčby. Role a optimální indikace u karcinomu prsu je v posledních letech významně diskutována. Probíhá celá řada klinických studií, které mají za cíl určit roli blokády VEGF v různých stadiích a u různých fenotypů karcinomu prsu. Dále probíhá výzkum experimentální a preklinický, který se snaží dále definovat roli angiogeneze u karcinomu prsu, opět v závislosti na stadiu a fenotypu. V neposlední řadě se pozornost upírá ke stanovení prediktivních faktorů účinnosti, toxicity a rezistence anti VEGF terapie.
Schválení bevacizumabu v první linii léčby metastatického karcinomu prsu (metastatic breast cancer – MBC) proběhlo v únoru 2008 na základě prodloužení období bez progrese (PFS) v rameni s bevacizumabem o 5 měsíců ve studii E2100 [1]. Následné randomizované studie (RCT) III. fáze AVADO a RIBBON-1 a metaanalýza všech 3 studií již nepotvrdily výsledky registrační studie a došlo u nich k prodloužení PFS o 1–2 měsíce, bez vlivu na celkové přežití (overall survival – OS) [1]. Důsledkem potom bylo vyjmutí indikace bevacizumabu z léčby karcinomu prsu ze strany FDA. V následujícím přehledu budou diskutovány současné znalosti výzkumu role anti VEGF terapie u karcinomu prsu, pozice bevacizumabu dle pokročilosti choroby, fenotypu a možnosti predikce účinku této terapie. Zároveň budou krátce diskutována možná vysvětlení diskrepance mezi studiemi, preklinickými experimenty a klinickou praxí.
Role anti VEGF terapie dle klinického stadia a fenotypu
Angiogeneze je jedním ze základních pilířů progresivního růstu a metastazování nádorů [2]. Jedná se o komplexní proces, ve kterém stojí na jedné straně proangiogenní faktory (VEGF, PDGF, TGF-beta) a inhibitory angiogeneze (angiostatin, trombospondin-1, interferon alfa). Angiogenní fenotyp s převahou proangiogenních faktorů je tak základním podkladem dalšího růstu nádorového procesu. Jedná se o komplikovaný děj, který není stacionární po celou dobu vývoje nádoru, ať už primárního tumoru, nebo metastáz, ale je to proces, který se pružně přizpůsobuje vnitřním podmínkám v organizmu a reaguje na zevní podněty a zásahy (např. selekční vliv terapie). VEGF je hlavním angiogenním faktorem, jako jediný je exprimován po celou dobu života nádorové buňky. Prognostický význam exprese VEGF je nezávislý na postižení uzlin a aplikované terapii a koreluje s DFS a OS [3–5]. Další studie u časného karcinomu prsu asociovaly zvýšenou expresi VEGF s kratším RFS a OS, nezávisle na pozitivitě lymfatických uzlin [6,7]. V nedávné publikaci Linderholm et al demonstrovali zvýšené hladiny intratumorálního VEGF u triple-negativních karcinomů prsu, s přímým vlivem na kratší OS [8]. Vliv angiogeneze je například u nádorů ledvin zásadní, a to jak u časných, tak metastatických stadií. Hladiny exprese VEGF jsou u karcinomu prsu v porovnání s karcinomem ledviny výrazně nižší. Experimentální práce ukazují na paradoxně vyšší hladiny exprese VEGF v okolní nenádorové tkáni a exprese inhibitorů angiogeneze byla vyšší ve tkáni nádorové [9]. Dalším faktorem, který se v souvislosti s karcinomem prsu objevuje, je kompenzace a převaha náhradních angiogenních cest nezávislých na VEGF. Zmiňuje se selekční tlak anti VEGF terapie na zvýšení počtu VEGF nezávislých buněčných klonů, které indukují a udržují nádorovou angiogenezi [6]. Rezistenci k antiangiogenní terapii dle Bergerse dělíme na primární (intrinzickou) a sekundární (adaptivní). V prvním případě nedosáhneme efektu stabilizace nebo zmenšení nádoru, ale ani zlepšení kvality života. Druhý typ rezistence je postupný, po primárním výrazném efektu dochází postupně opět k růstu nádoru, nejspíše nahrazením jinými cestami angiogeneze [10]. Velice zajímavá jsou potom data o vlivu hormonů a HER-2 na VEGF. Estradiol a progesteron zvyšují VEGF expresi přímo přes estrogen response elements (ERE) v buněčném jádře vazbou na promotér genu VEGF (přes ER alfa) [11]. Experimentálně i klinicky byl potvrzen vliv HER-2 amplifikace na indukci zvýšené exprese VEGF (cestou mTOR/p70S6K) a zvýšení agresivity a metastatického potenciálu [7,12]. Tyto experimentální a klinické údaje jsou podkladem kombinované anti VEGF s anti-HER-2 a hormonální terapií. V současné době probíhá řada studií kombinované terapie u různých stadií a v různých liniích léčby a jejich výsledky jsou očekávané s velkým zájmem.
Studie s anti VEGF terapií u časného karcinomu prsu
Teoretické podklady pro studie s antiangiogenní terapií u časných karcinomů prsu v adjuvantním nebo neoadjuvantním podání jsou následující. Během progrese karcinomu prsu od časných do metastatických forem dochází k aktivaci více cest angiogeneze [6,13]. Je proto nepravděpodobné, že blokáda jednoho faktoru u těchto předléčených a refrakterních onemocnění může mít klinický efekt, a je možné očekávat benefit včasného použití antiangiogenní terapie [14]. U primárních nádorů je VEGF nejvíce exprimovaným angiogenním faktorem [6]. Je produkován v časných stadiích vývoje primárních nádorů a vysoce exprimován v duktálních karcinomech in situ, angiogeneze je výrazná ještě před stromagenezí [15,16]. Preklinická data podporují roli nádorových kmenových buněk v rozvoji nádorů, včetně výrazného vlivu na angiogenezi, a lze očekávat citlivost vůči antiangiogenní terapii [17]. Z dalších experimentálních a klinických studií je ovšem spíše pravděpodobná prevence rozvoje makrometastatické formy než eradikace mikrometastatické nemoci, a efekt je tak vázán na dobu podávání antiangiogenní terapie. Roli této terapie u časných forem mohou definovat probíhající a proběhlé klinické studie u neoadjuvantního a adjuvantního podání.
Neoadjuvantní studie
Neoadjuvantní chemoterapie je v současnosti uznaným postupem v komplexní léčbě karcinomu prsu. Umožňuje zvýšit procento prs záchovných operací, in vivo zjistit citlivost vůči chemoterapii a patologická kompletní remise (pCR) je ukazatelem dlouhodobého přežití [18]. Pilotní studie fáze II kombinující bevacizumab s různými chemoterapeutickými režimy stanovily procento pCR mezi 9–33 % u HER-2 negativních nádorů a mezi 53–65 % pro nádory HER-2 pozitivní v kombinací s trastuzumabem [19]. Hodnocení operačních komplikací se mezi sledovanými rameny statisticky nelišilo, vyjma častějších raných infekcí u plastik a implantátů. Klinických studií fáze III v současné době probíhá celá řada, kombinují různé chemoterapeutické režimy, trastuzumab a hormonální terapii. Mezi největší patří studie NSABP-B-40, která se zaměřila na HER-2 negativní pacientky a zkoumala procento pCR po přidání capecitabinu nebo gemcitabinu k docetaxelu a bevacizumabu. Přidání capecitabinu nebo gemcitabinu nemělo vliv na procento pCR, skupina s bevacizumabem měla signifikantně zvýšené procento pCR (28,2 % vs 34,5 %, p = 0,02) [20]. Efekt přidání bevacizumabu byl dále prohlouben u hormonálních receptorů (HR) negativních pacientek (23,2 %/HR+ vs 51,5 %/HR–/). Další proběhlou neoadjuvantní studií je GBG 44, která zkoumala význam přidání bevacizumabu k režimu EC-T u HER-2 negativních pacientek. Celkové procento pCR po přidání bevacizumabu v neselektované populaci bylo 18,4 %, pro triple negativní pacientky potom 39,3 % (HR pozitivní 7,7 %) [21]. V obou studiích byl ve shodě potvrzen větší efekt v podobě pCR pro pacientky vyššího grade. Obě studie zatím mají výsledky pouze na úrovni pCR a PFS, na celkové přežití bude nutné ještě několik let čekat. Z přehledů proběhlých studií však vyplývá, že mezi dosažením pCR a relapsy s celkovým přežitím nejlépe koreluje ve skupině HER-2 pozitivních a triple-negativních karcinomů prsu (triple-negative breast cancer – TNBC) [22,23]. Neoadjuvantní studie představují ideální příležitost ke studiu biologické podstaty antiangiogenní terapie u karcinomu prsu. Část ze studií primárně hodnotí i různé biomarkery tkáňové nebo cirkulující, a mohou tak dále rozšířit současné znalosti o možnostech predikce efektu této terapie u karcinomu prsu.
Adjuvantní studie
Po pilotních studiích fáze II, které stanovily vyhovující tolerovatelnost bevacizumabu, byla zahájena řada randomizovaných studií fáze II a III, které mají určit roli bevacizumabu v adjuvantní léčbě. Zajímavý design má studie fáze II z Dana Farber Cancer Institute, která zkoumá efekt chemoterapie a antiangiogenní terapie u pacientek s reziduální nemocí po předchozí neoadjuvantní terapii [24]. Tato studie má zatím krátký follow-up k hodnocení dlouhodobého efektu. Krátkodobě lze hodnotit toxicitu, která byla výraznější ve větvi s kombinací capecitabinu a bevacizumabu v porovnání s kombinací metronomického cyklofosfamidu a metotrexátu s bevacizumabem. Probíhající studie ABCDE zkoumá vliv adjuvantní terapie bevacizumabem, metronomickým cyklofosfamidem a metotrexátem po dobu 6 měsíců u pacientek s reziduální invazivní chorobou po neoadjuvantní chemoterapii. Jedna z větví má udržovací terapii bevacizumabem prodlouženou na dobu 3 let. K tomuto designu vedla studie NSABP C-08 u kolorektálního karcinomu s kombinací FOLFOX-6 a bevacizumabu udržovaného v léčbě po dobu 1 roku, ve které se studijní a kontrolní ramena v parametru přežití bez nemoci (DFS) sblížila po 30 měsících. Studie E5103 (HER-2 negativní) má v jednom ze svých studijních ramen také udržovací terapii bevacizumabem po dobu 6 měsíců po skončení chemobioterapie s bevacizumabem. Mezi nejvýznamnější adjuvantní studie fáze III patří studie BEATRICE, která zařazuje triple-negativní pacientky. Tato skupina je léčebně velice špatně ovlivnitelná, zároveň však v podskupinových analýzách vykazuje největší benefit z léčby bevacizumabem. Jako další významnou studii fáze III je nutné jmenovat NSABP-B-44/BETH, která randomizuje pacientky s HER-2 pozitivním karcinomem prsu a srovnává význam kombinace bevacizumabu a trastuzumabu s chemoterapií. Další adjuvantní studie probíhají, zatím bez známých výsledků, a jsou dostupné na stránkách US National Institute of Health clinical trials registry (ClinicalTrials.gov). Vzhledem ke kurativnímu záměru léčby časných nádorů je – vedle efektu na zlepšení přežití – významná dlouhodobá toxicita léčby. Ve většině studií a metaanalýz je toxicita významnější v ramenech s bevacizumabem, ale je většinou stupně 2 a 3, snadno terapeuticky ovlivnitelná a bez zvýšení mortality. Vedle prediktivních faktorů účinnosti a rezistence je proto nutné hledat také markery toxicity této terapie [24,26].
Studie s anti VEGF terapií u metastatického karcinomu prsu
První linie terapie
Historicky první randomizovanou studií III. fáze v první linii léčby MBC byla studie E2100, která porovnávala význam přidání bevacizumabu k paclitaxelu. Primární cíl období bez progrese byl statisticky signifikantně splněn (PFS 11,8 vs 5,9 měsíce), významný byl i rozdíl v odpovědi (ORR 36,9 % vs 21,2 %), celkové přežití se mezi rameny nelišilo (OS 26,7 vs 25,2 měsíce) [1]. Další studie u neselektované populace AVADO (docetaxel +/–bevacizumab) a RIBBON-1 (antracyklin, taxan, capecitabin +/–bevacizumab) prokázaly benefit ve smyslu prodloužení PFS pouze o 0,7–2,9 měsíce, opět s lepší celkovou odpovědí, ale bez vlivu na délku celkového přežití. Metaanalýza všech těchto studií prokázala 36% snížení rizika progrese nebo smrti po zařazení bevacizumabu k chemoterapii v první linii léčby karcinomu prsu [27]. Je nutné zdůraznit, že medián HR byl konzistentní mezi všemi 3 studiemi a vzhledem k tomu, že se velikost studované populace a statistická síla studie plánuje podle HR, není hodnocení mediánu PFS jako hlavního markeru efektu terapie metodologicky zcela správné. Metaanalýza dále potvrdila, že prodloužení období bez progrese se nepřenáší do celkového přežití, problematické hodnocení OS je ovšem dané velkým procentem pacientek, které mají následné linie léčby po této první linii, případně crossover, a tyto mohou výrazně měnit celkové přežití [27]. Závěrem lze konstatovat, že u neselektované populace je přidání bevacizumabu v první linii léčby MBC korunováno pouze malým benefitem ve smyslu prodloužení období bez progrese a je nutné hledat podskupiny a fenotypy, u kterých bude efekt výraznější, včetně možného vlivu na OS. V současnosti probíhá řada studií u metastatického karcinomu prsu s využitím bevacizumabu v první linii léčby. Jako zajímavé a preklinickými údaji podložené se zdají studie s kombinací hormonální (studie GEICAM/2006-11/GBG-51, CALGB 40503) nebo anti HER-2 terapie (studie AVAREL, E1105) v kombinaci s bevacizumabem (ClinicalTrials.gov). Navazují tak na výše uvedené zkřížené vazby mezi drahami VEGF, HER-2 a hormonálními receptory [7,11,12].
Druhá linie terapie
První randomizovaná studie III. fáze porovnávala význam a bezpečnost přidání bevacizumabu ke capecitabinu; i přes zvýšení odpovědi (RR 19,8 % vs 9,1 %) nedošlo k prodloužení PFS (4,86 vs 4,17 měsíce), respektive OS (15,1 vs 14,5 měsíce) [28]. Jako jedna z hlavních příčin selhání anti VEGF terapie ve druhé linii byla zmiňována aktivace více cest angiogeneze u této předléčené a pokročilé populace [6]. Jako další faktor se zmiňuje vliv předchozí chemoterapie na angiogenní fenotyp, například paclitaxel a docetaxel mají antiangiogenní vlastnosti, a dochází tak k multiplikaci náhradních cest angiogeneze nezávislých na VEGF [29]. Další randomizovanou studií je RIBBON-2 kombinující různé chemoterapeutické režimy s přidáním nebo bez přidání bevacizumabu v léčbě druhé linie MBC. Předběžná data svědčí pro splnění stanoveného cíle PFS (HR = 0,78; p = 0,0072), další výsledky celkového přežití není zatím možné vzhledem k době sledování hodnotit. Studie je uzavřena a definitivní data budou zveřejněna v průběhu roku 2013.
Vysvětlení rozdílného působení anti VEGF terapie u karcinomu prsu
Jako první faktor se zmiňuje vliv nežádoucích účinků léčby bevacizumabem na konečné výsledky. Metaanalýza 16 RCT s terapií bevacizumabem u metastatických nádorů všech typů potvrdila skoro 2krát častější fatální nežádoucí účinky (FAE) ve skupině s bevacizumabem (2,5 % vs 1,7 %) [30]. Zároveň však následné podskupinové analýzy potvrdily nejnižší FAE ve skupině MBC a léčbou vyvolaná mortalita a morbidita se nelišila mezi studijními rameny a byla nezávislá na dávce bevacizumabu [28]. Jako hlavní faktor toxicity byl stanoven vliv chemoterapeutického režimu podávaného spolu s bevacizumabem. Výše zmíněná metaanalýza 3 velkých RCT u MBC prokázala, že léčbou vyvolaná mortalita se mezi jednotlivými rameny studií nelišila [27]. Podle těchto dat nelze proto vliv toxicity bevacizumabu na konečné výsledky u MBC přeceňovat.
Existují preklinické studie, které dokumentují vliv anti VEGF inhibice na zvýšení invazivity a metastatického potenciálu [31,32]. Dále existují i preklinická data, která dokumentují akceleraci kinetiky revaskularizace a rychlou progresi nádorů a metastáz po ukončení antiangiogenní terapie [33]. V klinické praxi byl pozorován podobný fenomén u terapie renálního a kolorektálního karcinomu. Tyto údaje vedly k teorii vysvětlující, proč při prodloužení PFS není prodlouženo celkové přežití [34]. Recentní data z metaanalýzy 5 RCT s více než 4 200 pacienty s nádory prsu, ledviny, kolorekta a slinivky léčených bevacizumabem nepotvrdila akceleraci nebo více agresivní chování po ukončení anti VEGF terapie [35]. Diskrepanci mezi preklinickými údaji a klinickou praxí lze vysvětlit zaměřením studií. Preklinické a experimentální studie studují definované populace primárních nádorů nebo buněčných linií, kdežto klinické studie zaměřují svou pozornost na refrakterní metastatické nádory.
Třetím okruhem, který se diskutuje, je vliv samotné chemoterapie, která je s antiangiogenní terapií podávána. Zkoumá se vliv léku, jeho dávkování, léčebné schéma a trvání terapie. Například registrační studie E2100 používala paclitaxel v týdenním dávkovacím režimu, který se zdá bližší určitému pojetí metronomické terapie. Následná studie AVADO kombinovala bevacizumab s 3týdenním docetaxelem. Je řada důkazů o pozitivním vlivu metronomické chemoterapie v kombinaci s antiangiogenní terapií a jejich vzájemné potenciaci [36,37]. Zajímavá klinická data přinesla studie II. fáze s kombinací metronomického cyklofosfamidu a capecitabinu s bevacizumabem, celkový klinický benefit byl 68 % [38]. Tato studie je v současnosti následována RCT III. fáze k potvrzení výsledků (ClinicalTrials.gov). Metronomickou terapii lze vzhledem k nízké akutní toxicitě podávat v kombinaci s bevacizumabem dlouhodobě. Klinické a preklinické zkušenosti přitom podporují dlouhodobé podávání bevacizumabu [39]. Vliv chemoterapie na nežádoucí účinky a efekt léčby byl potvrzen mnoha metaanalýzami proběhlých studií, kde se jevil chemoterapeutický partner bevacizumabu významnějším faktorem než dávka a interval bevacizumabu [30].
Další faktor, který je v souvislosti s anti VEGF terapií uváděný, navazuje na předchozí odstavec. Jedná se o správné načasování aplikace anti VEGF terapie a dále o fenotyp karcinomu prsu (HER-2 a HR). Preklinické a experimentální studie prokázaly význam inhibice VEGF//VEGFR osy na potlačení růstu primárních nádorů a mikrometastáz. Studie AVANT a NSABP C-08 u časných nádorů (adjuvantní aplikace u kolorektálního karcinomu) přinesly zklamání a nedošlo k prodloužení období bez nemoci (DFS). Studie s adjuvantním podáním u karcinomu prsu byly zmíněné výše a se zájmem se očekává hodnocení jejich výsledků (studie BEATRICE, BETH, ECOG 5103, ABCDE). Výše popsané neoadjuvantní studie byly bez vlivu na zvýšené procento pCR v neselektované populaci, ale pouze v podskupině triple negativních nádorů [40]. Další neoadjuvantní studie s podskupinou TNBC probíhají (CALGB 40603). Dále probíhají studie kombinované terapie bevacizumabem a trastuzumabem u HER-2 pozitivního MBC (AVAREL, E1105) a u hormonálně dependentního MBC (GEICAM/2006-11//GBG-51, CALGB 40503). Podkladem pro časné studie jsou experimentální data z primárních nádorů a modelů kancerogeneze karcinomu prsu. Pro pozdní a metastatické nádory zatím experimentální data chybí, nebo jejich modely nejsou natolik propracované. Existují však i preklinické modely viscerálních metastáz; tento model byl zkoušen s kombinací UFT a cyklofosfamidu a osvědčil svoji relevanci a je určitým návodem, jak formulovat budoucí experimentální studie u pokročilých a metastatických nádorů [41]. Tento model navíc inicioval provedení studie II. fáze s metronomickým cyklofosfamidem, capecitabinem v kombinaci s bevacizumabem [38]. Tyto modely mohou sloužit také pro experimenty a následné klinické studie kombinací více různých biologických (cílených) terapií [42]. U časných nádorů nemáme zatím ve všem jasno, protože existují data o urychlení angiogeneze u myší léčených krátkou dobu pooperačně antiangiogenní terapií (sunitinib) [31]. To vyvolává další otázky ohledně využití antiangiogenní terapie u nádorů v časném stadiu [43].
Aktuální znalosti hledání prediktivních biomarkerů účinnosti anti VEGF terapie
V současnosti existuje shoda o tom, že účinnost antiangiogenní terapie u karcinomu prsu nejde napříč celou populací, ale benefit existuje pouze pro určité podskupiny. Proto je nutné hledat prediktivní biomarkery, které mohou předpovědět její účinnost, případně takové biomarkery, které umožní časné stanovení rozvíjející se sekundární (získané) rezistence [44]. Účinek anti VEGF terapie je dán závislostí na této signalizační cestě a vlivu dalších signálních cest (bFGF, Ang-1), ať už primární, nebo sekundární [45]. Dalším faktorem, který určuje aktivitu bevacizumabu, je to, že angiogenní fenotyp se mění od primárních po metastatické nádory a je ovlivněn podanou terapií [46]. Jako prediktivní biomarkery se v současnosti zkoumá význam různých radiologických, molekulárních a buněčných markerů, jejich validita a klinický význam [47]. Současné hodnocení efektu protinádorové terapie zobrazovacími metodami (CT, MRI, UZ) pomocí RECIST kritérii není ideální. Antiangiogenní terapie a biologická terapie obecně nevede vždy ke zmenšení nádoru, i přes její nesporný klinický efekt. A naopak jsou někdy pozorované velké „regrese“ opadnutím edému kolem nádoru. V neposlední řadě je nutné i zohlednění nekrózy uvnitř nádoru nebo metastáz. Existují proto alternativní metody hodnocení, např. stanovením změn denzity nádoru [48]. Dále se využívají metody dynamického kontrastního vyšetření (CT, MRI, PET) s hodnocením mikrovaskulatury, krevního průtoku, krevního objemu, cévní permeability a velikosti a oxygenace tumoru [49]. Nejvíce je prostudováno hodnocení MRI pomocí tzv. Ktrans parametru, který stanovuje funkčnost nádorové vaskulatury [50]. Mezi další možnosti patří využití bevacizumabu vázaného na radiofarmakum s hodnocením pomocí PET/SPECT vyšetření [51]. I přes nadějné výsledky nových zobrazovacích metod není žádná z nich validovaná a nelze podle nich řídit anti VEGF terapii.
Další skupinou potenciálních prediktivních markerů jsou cirkulující působky a buněčné elementy. I přes nadějné výsledky některých studií není dle metaanalýzy čtyř velkých studií III. fáze hodnocení cirkulujícího VEGF prediktivní z hlediska protinádorové aktivity bevacizumabu [52,53]. Vysvětlení kontroverzních výsledků může být dáno nestandardizovaným odběrem, manipulací, zpracováním, stanovením a hodnocením VEGF. Mezi další studované cirkulující proteiny patří bFGF, interleukiny, HGF, PlGF, angiogenin, TGFbeta, SDF-1, ICAM-1, VCAM-1, E-selektin, sVEGFR-1,2,3. Výsledky některých studií jsou slibné, ale je nutná validace na velkých nezávislých souborech a sjednocení metodiky preanalytiky a analytických metod [54–56,68]. Mezi další cirkulující biomarkery patří hodnocení endotelových buněk (CEC) a jejich prekurzorů (CEP). Zatím se jako nejnadějnější jeví hladiny VCAM-1 a E-selektinu a stanovení endotelových prekurzorů [57,58]. Vzhledem ke vlivům okolního prostředí, které může cirkulující působky modifikovat nezávisle na terapii, jsou větší naděje vkládány do hodnocení biomarkerů v nádorové tkáni a vaskulatuře [46].
Mezi další zkoumané biochemické markery patří stanovení působků spjatých s angiogenezí přímo v nádorové tkáni a vaskulatuře. Význam exprese VEGF na predikci účinku anti VEGF terapie je komplikovaný přítomností VEGF ve zdravé tkáni a dále heterogenitou exprese uvnitř jednoho nádoru vlivem hypoxických oblastí. Druhou možností je hodnocení polymorfizmu genů zodpovědných za tvorbu faktorů angiogeneze. Nejdále je stanovení genového polymorfizmu VEGF (VEGF-2578AA, VEGF-1154AA) se vztahem k celkovému přežití [59]. Dále koreloval tento genotyp s nižší expresí VEGF v nádorové tkáni. Jako zajímavý nález lze zmínit významně nižší výskyt hypertenze u pacientů nesoucích VEGF genotyp VEGF-634 CC a VEGF-1498 TT (14,8 % vs 0 % vs 8 %). Dalšími studovanými jsou polymorfizmy VEGFR-1, VEGFR-2, IL-8, CXCR2 [60]. Opět je nezbytná jejich prospektivní validace na velkých nezávislých souborech k potvrzení statistické síly. Význam hodnocení změn mikrovaskulární denzity v nádorové tkáni je předmětem diskuze, bez konkluzivních závěrů [61]. Zajímavá se zdá také endotelová exprese DLL-4, PDGF-C a neuropilinu-1 jako biomarkerů anti VEGF rezistence v preklinických modelech [47].
Posledním potenciálním prediktivním markerem je farmakodynamický význam některých nežádoucích účinků anti VEGF terapie. Hypertenze je nejčastější nežádoucí účinek terapie bevacizumabem. Jedna studie prokázala korelaci mezi rozvojem a tíží hypertenze a účinkem terapie bevacizumabem na PFS a OS [59]. Metaanalýza dostupných velkých studií tento efekt neprokázala [62]. V současnosti nelze podle výskytu hypertenze řídit anti VEGF terapii.
Budoucnost výzkumu v onkologii
V posledních letech je stále více diskutován design klinických studií. Prvním okruhem jsou cíle studie, celkové přežití je stále ve většině studií primární nebo sekundární sledovaný parametr. Problémem hodnocení OS je vliv následné léčby po progresi na studovanou terapii a crossover, které mohou výrazně tento parametr měnit [63]. Sherill et al studovali vztah mezi PFS a OS a závěry u karcinomu prsu, na rozdíl od karcinomu plic a kolorekta, byly nekonzistentní [64]. Závěr je takový, že využitelnost OS jako jediného validního cíle klinických studií v éře následné efektivní léčby není udržitelná [64,65]. Navíc by bylo nutné zařadit mnohonásobně více pacientů (jednotky tisíc) k průkazu benefitu v parametru OS [66]. Dalším zmiňovaným parametrem je kvalita života (QoL). Cílem paliativní onkologické terapie je udržení anebo zlepšení QoL. Je proto důležité tento parametr sledovat a hodnotit. Problémem klinických studií je primární vyloučení pacientů v horším stavu výkonnosti, a následné hodnocení efektu studované léčby na změny QoL je tak zpochybnitelné. Je proto nutné zařadit do klinických studií i pacienty v horším celkovém stavu, aby bylo možné změny a benefit v parametru QoL hodnotit a studie přiblížit skutečné pacientské populaci [67].
Závěr
Antiangiogenní terapie u metastatického karcinomu prsu představuje i přes regulační omezení efektivní léčbu pro vybrané skupiny pacientek, s dobrým bezpečnostním profilem a řešitelnou toxicitou. Jejímu rozvoji v současnosti nejvíce brání neexistence validních prediktivních biomarkerů, jaké známe z jiných terapií (HER-2 antigen, KRAS mutace, EGFR mutace atd.). Dále potom porozumění molekulární podstatě a stanovení primární a sekundární rezistence k anti VEGF terapii. V podskupinových analýzách souborů lze sledovat pozitivní efekt u pacientek s nádory bez exprese hormonálních receptorů a antigenu HER-2 (triple-negativní). Tyto pacientky mají kvůli biologické povaze nádoru léčebné možnosti omezené pouze na chemoterapii. V neposlední řadě je potřeba zaměřit výzkum antiangiogenní terapie na časná a mikrometastatická stadia na straně jedné a do vyšších linií léčby metastatického karcinomu prsu a dále v kombinaci s jinými typy terapie (hormonální léčba, cílená terapie) na straně druhé. Spolu s definováním stadia a odpovídajícího chemoterapeutického a biologického partnera bevacizumabu je nutný další výzkum prediktivních biomarkerů účinnosti a toxicity. Jedině tak bude možné využít skutečný potenciál této bezesporu základní protinádorové terapie, cílící na jednu ze šesti základních cest rozvoje nádorových onemocnění [2].
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do bi omedicínských časopisů.
MUDr. Marek Sochor
Centrum pro klinickou a radiační onkologii
Krajská nemocnice Liberec
Husova 10
463 11 Liberec
e-mail: sochor.marek73@gmail.com
Obdrženo: 12. 12. 2012
Přijato: 31. 1. 2013
Sources
1. Miller K, Wang M, Gralow J et al. Paclitaxel plus bevacizumab versus paclitaxel alone for metastatic breast cancer. N Engl J Med 2007; 357(26): 2666–2676.
2. Hanahan D, Weinberg RA. The hallmarks of cancer. Cell 2000; 100(1): 57–70.
3. Gasparini G, Toi M, Gion M et al. Prognostic significance of vascular endothelial growth factor protein in node-negative breast carcinoma. J Natl Cancer Inst 1997; 89(2): 139–147.
4. Linderholm B, Grankvist K, Wilking N et al. Correlation of vascular endothelial growth factor content with recurrences, survival and first relapse site in primary node-positive breast carcinoma after adjuvant treatment. J Clin Oncol 2000; 18(7): 1423–1431.
5. Foekens JA, Peters HA, Grebenchtchikov N et al. High tumor levels of vascular endothelial growth factor predict poor response to systemic therapy in advanced breast cancer. Cancer Res 2001; 61(14): 5407–5414.
6. Relf M, LeJeune S, Scott PA et al. Expression of the angiogenic factors vascular endothelial cell growth factor, acidic and basic fibroblast growth factor, tumor growth factor beta-1, platelet-derived endothelial cell growth factor, placenta growth factor, and pleiotrophin in human primary breast cancer and its relation to angiogenesis. Cancer Res 1997; 57(5): 963–969.
7. Konecny EG, Meng YG, Untch M et al. Association between HER-2/neu and vascular endothelial growth factor expression predicts clinical outcome in primary breast cancer patients. Clin Cancer Res 2004;10(5): 1706–1716.
8. Linderholm BK, Hellborg H, Johansson U et al. Significiantly higher levels of vascular endothelial growth factor (VEGF) and shorter survival times for patients with primary operable triple-negative breast cancer. Ann Oncol 2009; 20(10): 1639–1646.
9. Boneberg EM, Legler DF, Hoefer MM et al. Angiogenesis and lymphangiogenesis are downregulated in primary breast cancer. Br J Cancer 2009; 101(4): 605–614.
10. Bergers G, Hanahan D. Modes of resistance to anti-angiogenic therapy. Nat Rev Cancer 2008; 8(8): 592–603.
11. Mueller MD, Vigne JL, Minchenko A et al. Regulation of vascular endothelial growth factor (VEGF) gene transcription by estrogen receptors alfa and beta. Proc Natl Acad Sci USA 2000; 97(20): 10972–10977.
12. Klos KS, Wyszomierski SL, Sun M et al. ErbB2 increases vascular endothelial growth factor protein synthesis via activation of mammalian target of rapamycin/p70S6K leading to increased angiogenesis and spontaneous metastasis of human breast cancer cells. Cancer Res 2006; 66(4): 2028–2037.
13. Ferrara N, Gerber HP, LeCouter J. The biology of VEGF and its receptors. Nat Med 2003; 9 : 669–676.
14. Moore A. Breast-cancer therapy – looking back to the future. N Engl J Med 2007; 357(15): 1547–1549.
15. Brown LF, Berse B, Jackman RW et al. Expression of vascular permeability factor (vascular endothelial growth factor) and its receptor in breast cancer. Hum Pathol 1995; 26(1): 86–91.
16. Pavlakis K, Messini I, Vrekoussis T et al. The assessment of angiogenesis and fibroblastic stromagenesis in hyperplastic and pre-invasive breast lesions. BMC Cancer 2008; 8 : 88.
17. Eyler CE, Rich JN. Survival of the Fittest: Cancer stem cells in therapeutic resistance and angiogenesis. J Clin Oncol 2008; 26(17): 2839–2845.
18. Kaufmann M, von Minckwitz G, Smith R et al. International expert panel on the use of primary (preoperative) systemic treatment of operable breast cancer: review and recommendations. J Clin Oncol 2003; 21(13): 2600–2608.
19. Derleth C, Mayer IA. Antiangiogenic therapies in early-stage breast cancer. Clin Breast Cancer 2010; 10 (Suppl 1): E23–E31.
20. Bear HD, Tang G, Rastogi P et al. Bevacizumab added to neoadjuvant chemotherapy for breast cancer. N Engl J Med 2012; 366(4): 310–320.
21. von Minckwitz G, Eidtmann H, Rezai M et al. German Breast Group; Arbeitsgemeinschaft Gynäkologische Onkologie–Breast Study Groups. Neoadjuvant chemotherapy and bevacizumab for HER2-negative breast cancer. N Engl J Med 2012; 366(4): 299–309.
22. Untch M, Fasching PA, Konecny GE et al. Pathologic complete response after neoadjuvant chemotherapy plus trastuzumab predicts favorable survival in human epidermal growth factor receptor 2-overexpressing breast cancer: results of the TECHNO trial of the AGO and CGC study groups. J Clin Oncol 2011; 29(25): 3351–3357.
23. Liedtke C, Mazouni C, Hess KR et al. Response to neoadjuvant therapy and long-term survival in patients with triple-negative breast cancer. J Clin Oncol 2008; 26(8): 1275–1281.
24. Mayer EL, Miller K, Rugo H et al. A pilot study of adjuvantn bevacizumab and chemotherapy after neoadjuvant chemotherapy for high-risk breast cancer. J Clin Oncol 2008; 26 (Suppl 15): s11, Abstract 519.
25. Scappaticci FA, Skillings JR, Holden SN et al. Arterial thromboembolic events in patients with metastatic carcinoma treated with chemotherapy and bevacizumab. J Natl Cancer Inst 2007; 99(16): 1232–1239.
26. Nalluri SR, Chu D, Keresztes R et al. Risk of venous thromboembolism with the angiogenesis inhibitor bevacizumab in cancer patients: a meta-analysis. JAMA 2008; 300(19): 2277–2285.
27. O‘Shaughnessy J, Miles D, Gray RJ et al. A meta-analysis of overall survival data from three randomized trials of bevacizumab (BV) and first-line chemotherapy as treatment for patients with metastatic breast cancer (MBC). J Clin Oncol 2010; 28 (Suppl): 15s, Abstract 1005.
28. Miller KD, Chap LI, Holmes FA et al. Randomized pha-se III trial of capecitabine compared with bevacizumab plus capecitabine in patients with previously treated metastatic breast cancer. J Clin Oncol 2005; 23(4): 792–799.
29. Muta M, Yanagawa T, Sai Y et al. Effect of low-dose paclitaxel and docetaxel on endothelial progenitor cells. Oncology 2009; 77(3–4): 182–191.
30. Ranpura V, Hapani S, Wu S. Treatment-related mortality with bevacizumab in cancer patients: a meta-analysis. JAMA 2011; 305(58): 487–494.
31. Ebos JM, Lee CR, Cruz-Munoz W et al. Accelerated metastasis after short-term treatment with a potent inhibitor of tumor angiogenesis. Cancer Cell 2009; 15(3): 232–239.
32. Páez-Ribes M, Allen E, Hudock J et al. Antiangiogenic therapy elicits malignant progression of tumors to increased local invasion and distant metastasis. Cancer Cell 2009; 15(3): 220–231.
33. Mancuso MR, Davis R, Norberg SM et al. Rapid vascular regrowth in tumors after reversal of VEGF inhibition. J Clin Invest 2006; 116(10): 2610–2621.
34. Ebos JM, Kerbel RS. Antiangiogenic therapy: Impact on invasion, disease progression, and metastasis. Nat Rev Clin Oncol 2011; 8(4): 210–221.
35. Miles D, Harbeck N, Escudier B et al. Disease course patterns after discontinuation of bevacizumab: pooled analysis of randomized phase III trials. J Clin Oncol 2011; 29 : 83–88.
36. Pasquier E, Kavallaris M, André N. Metronomic chemotherapy: New rationale for new directions. Nat Rev Clin Oncol 2010; 7(8): 455–465.
37. Kerbel RS, Kamen BA. The anti-angiogenc basis of metronomic chemotherapy. Nat Rev Cancer 2004; 4(6): 423–436.
38. Dellapasqua S, Bertolini F, Bagnardi V et al. Metronomic cyclophosphamide and capecitabine combined with bevacizumab in advanced breast cancer. J Clin Oncol 2008; 26(30): 4899–4905.
39. Bagri A, Berry L, Gunter B et al. Effects of anti-VEGF treatment duration on tumor growth, tumor regrowth, and treatment efficacy. Clin Cancer Res 2010; 16(15): 3887–3900.
40. Von Minckwitz G, Rezai M, Fasching PA et al. Neoadjuvant chemotherapy with or without bevacizumab: primary efficacy endpoint analysis of the GEPARQUINTO study (CBG 44). Cancer Res 2010; 70 (Suppl): 86, Abstract 235.
41. Munoz R, Man S, Shaked Y et al. Highly efficacious nontoxic preclinical treatment for advanced metastatic breast cancer using combination oral UFT-cyclophosphamide metronomic chemotherapy. Cancer Res 2006; 66(7): 3386–3391.
42. Rosen LS, Ashurts HL, Chap L. Targeting signal transduction pathways in metastatic breast cancer: A comprehensive review. Oncologist 2010; 16(3): 216–235.
43. Schneider BP, Sledge GW Jr. Anti-VEGF therapy as adjuvant therapy: Clouds on the horizon? Breast Cancer Res 2009; 11(3): 303.
44. Ocaña A, Amir E, Vera F et al. Addition of bevacizumab to chemotherapy for treatment of solid tumors: similar results but different conclusions. J Clin Oncol 2011; 29(3): 254–256.
45. Casanovas O, Hicklin DJ, Bergers D et al. Drug resistance by evasion of antiangiogenic targeting of VEGF signaling in late-stage pancreatic islet tumors. Cancer Cell 2005; 8(4): 299–309.
46. Jain RK, Duda DG, Willet CG et al. Biomarkers of response and resistance to antiangiogenic therapy. Nat Rev Clin Oncol 2009; 6(6): 327–338.
47. Jubb AM, Harris AL. Biomarkers to predict the clinical efficacy of bevacizumab in cancer. Lancet Oncol 2010; 11(12): 1172–1183.
48. Chun YS, Vauthey JN, Boonsirikamchai P et al. Association of computed tomography morphologic criteria with pathologic response and survival in patients treated with bevacizumab for colorectal liver metastases. JAMA 2009; 302(21): 2338–2344.
49. Miller JC, Pien HH, Sahani D et al. Imaging angiogenesis: applications and potential for drug development. J Natl Cancer Inst 2005; 97(3): 172–187.
50. O‘Connor JP, Jackson A, Asselin MC et al. Quantitative imaging biomarkers in the clinical development of targeted therapeutics current and future perspectives. Lancet Oncol 2008; 9(8): 766–776.
51. Nagengast WB, deVries EG, Hospers GA et al. In vivo VEGF imaging with radiolabeled bevacizumab in human ovarian tumor xenograft. J Nucl Med 2007; 48(8): 1313–1319.
52. Poon RT, Fan ST, Wong J. Clinical implications of circulating angiogenic factors in cancer patients. J Clin Oncol 2001; 19(4): 1207–1225.
53. Bernaards C, Hedge P, Chen D et al. Circulating vascular endothelial growth factor (VEGF) as a biomarker for bevacizumab-based therapy in metastatic colorectal, non-small cell lung, and renal cell cancer: analysis of pha-se III studies. J Clin Oncol 2010; 28 (Suppl): 15s, Abstract 10519.
54. Rüegg C, Meuwly JY, Driscol R et al. The quest for surrogate markers of angiogenesis: a paradigm for translational research in tumor angiogenesis and anti-angiogenesis trials. Curr Mol Med 2003; 3(8): 673–691.
55. Dowlati A, Gray R, Sandler AB et al. Cell adhesion molecules, vascular endothelial growth factor, and basic fibroblast growth factor in patients with non-small cell lung cancer treated with chemotherapy with or without bevacizumab: an Eastern Cooperative Oncology Study Group. Clin Cancer Res 2008; 14(5): 1407–1412.
56. Duda DG, Cohen KS, Ancukiewicz M et al. A comparative study of circulating endothelial cells (CECs) and circulating progenitor cells (CPCs) kinetics in four multidisciplinary phase II studies of antiangiogenic agents. J Clin Oncol 2008; 26 (Suppl): 15s, Abstract 3544.
57. Baar J, Silverman P, Lyons J et al. A vasculature-targeting regimen of preoperative docetaxel with or without bevacizumab for locally advanced breast cancer: impact on angiogenic biomarkers. Clin Cancer Res 2009; 15(10): 3583–3590.
58. Gao D, Nolan D, McDonnell K et al. Bone marrow-derived endothelial progenitor cells contribute to angiogenic switch in tumor growth and metastatic progression. Biochim Biophys Acta 2009; 1796(1): 33–40.
59. Schneider BP, Wang M, Radovich M et al. ECOG 2100. Association of vascular endothelial growth factor and vascular endothelial growth factor receptor-2 genetic polymorphisms with outcome in trial of paclitaxel plus bevacizumab in advanced breast cancer: ECOG 2100. J Clin Oncol 2008; 26(28): 4672–4678.
60. Schultheis AM, Lurje G, Rhodes KE et al. Polymorphisms and clinical outcome in recurrent ovarian cancer treated with cyclophosphamide and bevacizumab. Clin Cancer Res 2008; 14(22): 7554–7563.
61. Hlatky L, Hahnfeldt P, Folkma J. Clinical application of antiangiogenic therapy: microvessel density, what it does and doesn‘t tell us. J Natl Cancer Inst 2002; 94(12): 883–893.
62. Hurwitz H, Douglas PS, Middleton JP et al. Analysis of early hypertension (HTN) and clinical outcome with bevacizumab (BV). J Clin Oncol 2010; 28 (Suppl): 15s, abstr 3039.
63. Smith I. Goals of treatment for patients with metastatic breast cancer. Semin Oncol 2006; 33 (1 Suppl 2): S2–S5.
64. Sherrill B, Amonkar M, Wu Y et al. Relationship between effects of time-to-disease progression and overall survival in studies of metastatic breast cancer. Br J Cancer 2008; 99(10): 1572–1578.
65. Verma S, McLeod D, Batist G et al. In the end what matters most? A review of clinical endpoints in advanced breast cancer. The Oncologist 2011; 16(1): 25–35.
66. Broglio KR, Berry DA. Detecting an overall survival benefit that is derived from progression free survival. J Natl Cancer Inst 2009; 101(23): 1642–1649.
67. Alvarez RH, Guarneri V, Icli F et al. Bevacizumab treatment for advanced breast cancer. Oncologist 2011; 16(12): 1684–1697.
29. Miles DW, de Haas SL, Dirix L et al. Plasma biomarker analyses in the AVADO phase III randomized study of first-line bevacizumab plus docetaxel in patients with HER2-negative metastatic breast cancer. Cancer Res 2010; 70 (Suppl): 235s, Abstract P2-16-04.
Labels
Paediatric clinical oncology Surgery Clinical oncology
Article was published inClinical Oncology

2013 Issue 2-
All articles in this issue
- Prognostické faktory karcinomu děložního hrdla
- Antiangiogenní bioterapie a chemoterapie v terapii karcinomu prsu: přehled literatury a kazuistika
- Postavení radioterapie v léčbě maligních lymfomů – doporučení Kooperativní lymfomové skupiny
- Epidemiologická a klinicko-patologická charakteristika pacientů s renálním karcinomem: analýza 544 případů z jednoho centra
- Castlemanova choroba: retrospektivní studie léčebných výsledků u 10 pacientů z jednoho centra
- Kazuistika: Výskyt grade IV neutropenie a febrilní neutropenie u pacientky s generalizovaným karcinomem prsu léčené paliativní chemoterapií cyklofosfamid/Myocet
- Spontánní remise akutní myeloidní leukemie – klinické případy jednoho centra
- Adjuvatní radioterapie karcinomu prsu s využitím Active breathing control – moderate inspiration breath-hold – kazuistika
- Adjuvant! Online: Pozor na rozdíly!
- Clinical Oncology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Prognostické faktory karcinomu děložního hrdla
- Spontánní remise akutní myeloidní leukemie – klinické případy jednoho centra
- Kazuistika: Výskyt grade IV neutropenie a febrilní neutropenie u pacientky s generalizovaným karcinomem prsu léčené paliativní chemoterapií cyklofosfamid/Myocet
- Postavení radioterapie v léčbě maligních lymfomů – doporučení Kooperativní lymfomové skupiny
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

