-
Medical journals
- Career
Prognostické faktory karcinomu děložního hrdla
: L. Mouková 1; R. Nenutil 2; P. Fabian 2; Josef Chovanec 1
: Oddělení gynekologické onkologie, Masarykův onkologický ústav, Brno 1; Oddělení onkologické patologie, Masarykův onkologický ústav, Brno 2
: Klin Onkol 2013; 26(2): 83-90
: Review
Standardizované terapeutické onkogynekologické postupy vycházejí z klasických prognostických faktorů, jako jsou velikost nádoru, hloubka stromální invaze, histopatologický typ nádoru, lymfovaskulární nádorová invaze, metastatické postižení lymfatických uzlin. Bohužel síla těchto prognostických faktorů nedokáže ve skupině pacientek indikovaných ke konzervativním výkonům jednoznačně určit bezpečnost tohoto postupu ve vztahu k rekurenci onemocnění. Právě zde vzniká obrovský prostor pro nové prognostické faktory, především biomolekulární (proteiny: p63 a TAp63, p16, p21, p27, COX-2, geny: hTERC a MYCC). Mimo to komplexní zhodnocení prognostických faktorů u karcinomu děložního hrdla a stanovení nových biomarkerů chování nádoru může v budoucnu ulehčit predikci rizika šíření mimo primární lokalizaci. Tyto informace mohou přispět k individualizaci chirurgické, radioterapeutické, případně systémové léčby.
Klíčová slova:
karcinom děložního hrdla – prognostické faktory – lymfovaskulární nádorová invaze – metastázy lymfatických uzlin – velikost nádoru – protein – expreseÚvod
Incidence karcinomu děložního hrdla se v České republice pohybuje kolem 19/100 000 žen. Infekce lidským papilomavirem (human papillomavirus – HPV) je považována za hlavní etiologický faktor vzniku tohoto onemocnění. Přes dosavadní pokroky v diagnostických metodách a standardizaci terapeutických postupů zůstávají hodnoty incidence a mortality v naší republice za posledních 20 let přibližně stejné. Standardizované terapeutické onkogynekologické postupy vycházejí z klasických prognostických faktorů, jako velikost nádoru, hloubka stromální invaze, histopatologický typ nádoru, metastatické postižení lymfatických uzlin, velikost resekční linie, šíření nádoru do parametrií. Nalezením nových prognostických biomolekulárních markerů by bylo možno blíže specifikovat rozsah či prognózu onemocnění již v předoperačním období v časných stadiích těchto zhoubných nádorů. Biomarkery by bylo možno stanovit např. pomocí imunohistochemických metod z biopticky odebraného vzorku nádorové tkáně cervikálního karcinomu v rámci stagingových vyšetření. Jejich vzájemnou analýzou bychom mohli získat detailnější informace o předpokládaném biologickém chování nádoru, upřesnit rozsah nádorového postižení, event. predikovat přítomnost metastatického postižení lymfatických uzlin ještě před zahájením léčby. Terapie by tak mohla být každé pacientce individuálně „šita na míru“. V případě agresivní povahy nádoru s pozitivně vyjádřenými biomolekulárními markery by bylo možno indikovat razantnější postup s následným intenzivnějším follow-up. Naopak u nádorů s příznivými hodnotami biomolekulárních markerů by byla volena méně radikální léčba s možností snížení pooperační morbidity. Tato předoperační diagnostika by byla přínosem zejména u mladších žen ve snaze o fertilitu zachovávající výkony. U pokročilých stadií nemoci by bylo možno díky novým biomarkerům predikovat odpověď na zvolenou léčbu s její následnou modifikací (obr. 1, obr. 4, tab. 1).
1. Karcinom děložního hrdla stadia IB1 – nález při gynekologickém vyšetření. Foto Masarykův onkologický ústav. 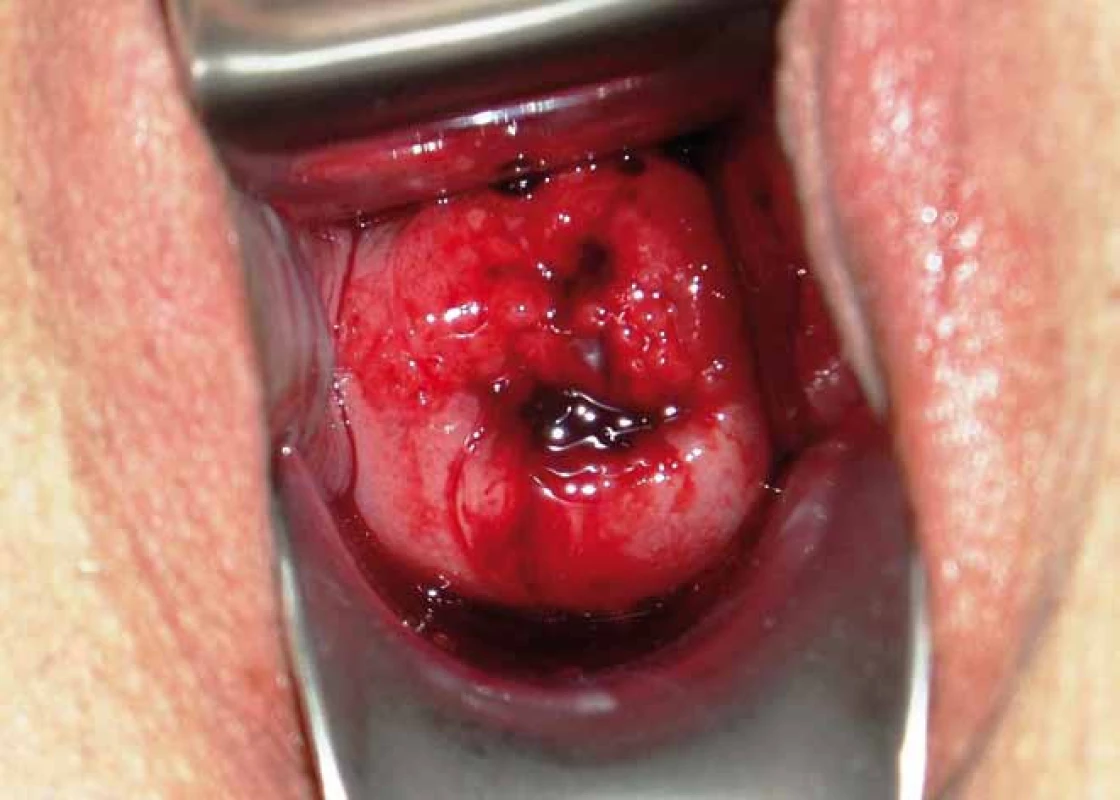
1. Klasifikace TNM a FIGO zhoubných nádorů děložního hrdla. 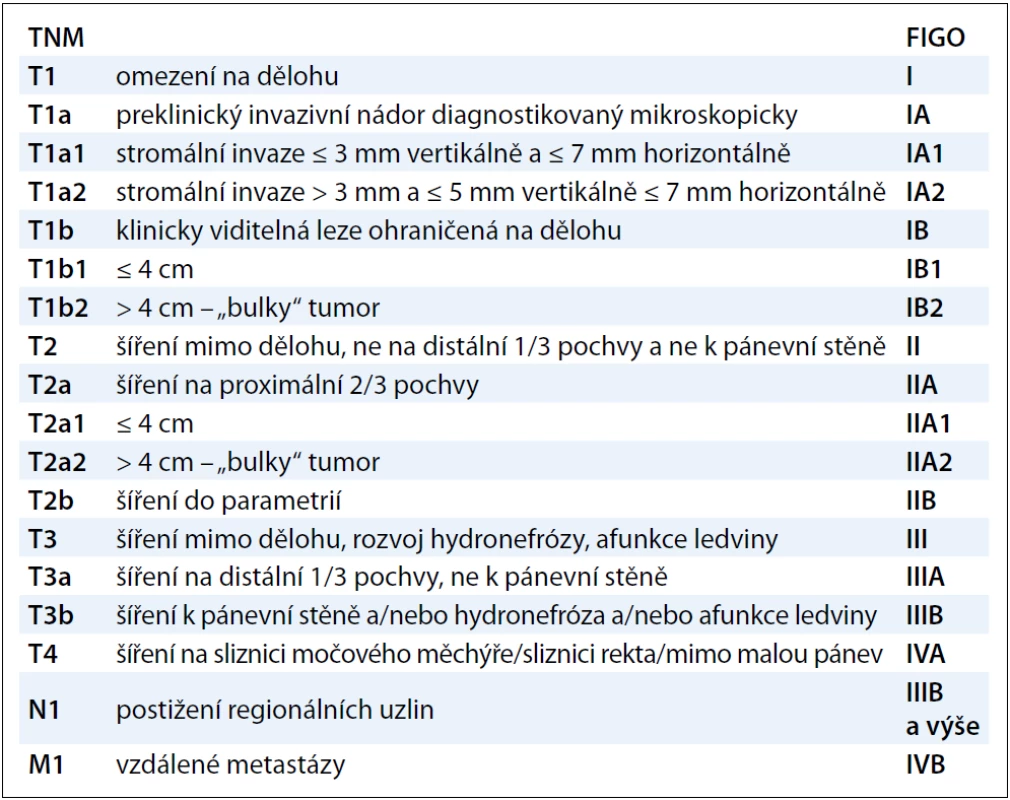
Klasické prognostické faktory
Velikost tumoru
Velikost nádoru děložního hrdla je těsně spjata s prognózou onemocnění a postižením lymfatických uzlin. Prognostický význam má i podíl velikosti tumoru k velikosti děložního hrdla a vzdálenost nádoru od okraje hrdla, resp. pericervikální fascie. K negativním faktorům patří i šíření nádoru do děložního istmu a těla [1]. Jordan et al ve své studii uvedli nulové riziko metastatického postižení při velikosti nádorového ložiska do 1 mm, při velikosti tumoru 1–3 mm vznik metastáz v 1–2 % případů a u nádorů velikosti 3–5 mm metastazování do regionálních lymfatických uzlin v 6–8 % [2]. Alvarez et al sledovali desetiletou prognózu pacientek po radikálních operacích, které měly metastaticky postiženy maximálně 2 lymfatické uzliny. U pacientek s primárním nádorem pod 1 cm byla kompletní remise v 90 %. U nádorů velikosti do 4 cm popsal desetileté přežití u 56–70 % žen, u nádorů nad 4 cm přežilo pouze 13 % pacientek. Obecně je prokázána u „bulky“ tumorů děložního hrdla ve stadiu Ib2 a IIa větší incidence metastatického postižení regionálních lymfatických uzlin a přítomnost vzdálených metastáz [3,4].
Hloubka stromální invaze
Hloubku stromální invaze (cervical stromal invasion – CSI) řadíme k dalším prognostickým faktorům. 2/3 infiltrace stromatu děložního hrdla jsou považovány za výrazný rizikový faktor.
Raspagliesi et al u nádorové invaze pod 3 mm neprokázali metastatické postižení lymfatických uzlin či rekurenci nemoci [5]. Ostor et al rozdělili pacientky do dvou skupin. Při hloubce nádorové stromální invaze 0–3 mm byla rekurence a poměr úmrtí 0,8 a 0,2 %, zatímco u stromální invaze velikosti 3,1–5 mm byla rekurence a poměr úmrtí 4 a 2 % [6]. Signifikantní souvislost s metastatickým postižením lymfatických uzlin prokázal Milam et al při hloubce nádorové stromální invaze nad 4 mm s pozitivní lymfangioinvazí [7].
Histologický grading tumoru
Dle histopatologického stupně diferenciace dělíme nádory na G1 – dobře diferencované, G2 – středně diferencované, G3 – špatně diferencované a Gx, kdy nelze stupeň hodnotit. Prognostický význam je udáván spíše u adenokarcinomů děložního hrdla. Berek et al sledovali 5leté přežití u pacientek s adenokarcinomy, které dosáhly kompletní remise u nádorů G1 v 84,2 %, u G2 v 77,8 %, u G3 v 50 % [3,8]. U spinocelulárního karcinomu má grading rovněž určitý prognostický význam. Často se však kombinuje s dalšími ukazateli do multiparametrických skórovacích systémů (např. s morfologií invazivní fronty, zánětlivou odpovědí a zejména přítomností cévní invaze), aby jeho prognostická hodnota byla zvýšena (Lindahl et al, Graflund et al) [9,10].
Histopatologický typ nádoru
Z maligních epitelových nádorů je v 60–80 % velký podíl spinocelulárních (dlaždicobuněčných) karcinomů. Adenokarcinomy tvoří 10–15 %. Vzácně jsou zastoupeny např. adenoskvamózní karcinomy, adenoidně cystické karcinomy, nádory s neuroendokrinní sekrecí. U invazivních spinocelulárních karcinomů rozlišujeme rohovějící a nerohovějící typy, dále pak bazaloidní, verukózní, kondylomatózní, papilární, lymphoepithelioma-like dlaždicový a skvamotranzicionální karcinom. Verukózní a kondylomatózní karcinomy mají poměrně dobrou prognózu. Naopak bazaloid-ní spinocelulární karcinomy se chovají velmi agresivně. Z adenokarcinomů se vyskytuje nejčastěji v 50–60 % mucinózní adenokarcinom. Dle histologické struktury se dělí ještě na další typy – endocervikální, intestinální, z prstenčitých buněk, viloglandulární a minimálně deviovaný (= adenoma malignum). Endometroidní adenokarcinom zastupuje cca 30 % adenokarcinomů endocervixu. Jeho odlišení od primárního endometroidního adenokarcinomu děložního těla může někdy způsobovat diagnostické obtíže. V 5 % se vzácně vyskytují serózní a světlobuněčný adenokarcinom. Z mezonefrických reziduí mohou vznikat ojediněle mezonefrické adenokarcinomy. K dalším maligním epitelovým tumorům patří vzácné formy – adenoskvamózní karcinom (5–25 % karcinomů děložního hrdla), adenoidně cystický karcinom se špatnou prognózou, prognosticky příznivý adenoidně bazocelulární karcinom, nediferencovaný karcinom, karcinoid, atypický karcinoid, malobuněčný karcinom a velkobuněčný neuroendokrinní karcinom. K maligním mezenchymálním nádorům řadíme velmi vzácné leiomyosarkomy, embryonální rhabdomyosarkomy, endometriální stromální sarkomy, nediferencované endocervikální sarkomy, angiosarkomy, alveolární sarkomy měkkých tkání a další extrémně vzácné typy tumorů. Smíšené maligní epitelové a mezenchymální nádory obsahují vzácnou skupinu nádorů – maligní smíšené mülleriánské nádory, adenosarkomy a nádory podobné Wilmsovu tumoru ledviny [11]. Yasuda et al srovnávali ve své histopatologické studii nádorů děložního hrdla stadia Ib1 adenoskvamózní karcinomy (ASC), adenokarcinomy (ADC) a spinocelulární karcinomy (SCC). Popsali incidenci metastatického postižení ASC 21,4 %, ADC 13,6 % a SCC 15,8 %. Prognóza 5letého přežití ve studii byla u adenoskvamózních karcinomů 82,4 %, u ADC 92,4 % a SCC 94,0 % [12].
Lymfovaskulární nádorová invaze
Lymfovaskulární invaze (lymphovascular space invasion – LVSI) je nezávislým rizikovým prognostickým faktorem a přímo koreluje s metastatickým postižením lymfatických uzlin a stagingem [13,14]. Detekce se provádí pomocí imunohistochemického vyšetření (obr. 2). Delgado et al ve své prospektivní studii u 542 pacientek prokázali souvislost mezi bezpříznakovým přežitím (disease-free interval – DFI) a přítomností nádorové lymfangioinvaze. Pacientky bez přítomné nádorové lymfangioinvaze dosahovaly delšího časového intervalu DFI oproti ženám s pozitivní LVSI [15]. Morice et al popisovali 5leté celkové přežití u 97 % pacientek s negativní LVSI a u 78 % žen s pozitivní LVSI [16]. Roman et al poukázali na přímou úměru mezi kvantitou nádorové lymfovaskulární invaze a metastatickým postižením lymfatických uzlin [17]. Na základě preoperativní LVSI z biopsie v souvislosti s hloubkou nádorové invaze nad 4 mm Milam et al verifikovali přímou úměru s metastatickým postižením lymfatických uzlin [7].
2. Imunohistochemické značení lymfatických cév detekcí podoplaninu pomáhá odlišit lymfovaskulární invazi spinocelulárního karcinomu (čepy značené*) od čepů s retrakčními artefakty (značeno +). D2.40, Dako, 400krát zvětšení, foto Masarykův onkologický ústav. 
Postižení lymfatických uzlin
Regionální lymfatické uzliny u karcinomu děložního hrdla se nacházejí v oblasti paracervikální, parametriální, při a. iliaca interna, a. iliaca externa, v obturatorní fose a při a. iliaca communis. V rámci radikality operačního výkonu pro stanovení klasifikace pN je zapotřebí získat při pánevní lymfadenektomii minimálně 10 a více lymfatických uzlin. O prognóze rozhoduje počet postižených uzlin, velikost metastáz a přítomnost vzdálených metastáz [1,3]. Za metastázu je považována velikost nádorového postižení lymfatické uzliny > 2 mm. Jako mikrometastázu hodnotíme velikost nádorového postižení 0,2–2 mm a o clusterech či izolovaných nádorových buňkách (isolated tumor cells – ITC) hovoříme při velikosti ≤ 0,2 mm. V současné době je snahou peroperačně detekovat sentinelovou lymfatickou uzlinu (sentinel node biopsy – SNB), tedy první uzlinu, do které je odváděna lymfa z nádorové tkáně (obr. 3). Pokud je sentinelová uzlina bez nádorové infiltrace, lze předpokládat, že nedošlo k šíření tumoru mimo primární lokalizaci. V případě histologicky prokázané přítomnosti mikrometastáz, event. izolovaných nádorových buněk v SNB, nastává otázka, jak přistupovat k pacientkám s tímto nálezem ve smyslu adjuvantní léčby. Rob et al v Guideline gynekologických zhoubných nádorů doporučují adjuvantní radioterapii u skupiny N1 s nálezem více než jedné mikrometastázy v jedné lymfatické uzlině [18]. Metastatické postižení pánevních lymfatických uzlin patří mezi významný prognostický faktor, který snižuje 5leté přežití na 50 %. V případě postižení paraaortálních lymfatických uzlin klesá 5leté přežití až na 20 %. Delgado et al ve studii zahrnující 545 žen prokázali nepřímou úměru mezi stoupajícím počtem pozitivních lymfatických uzlin a dobou 5letého přežití. Při postižení 1 lymfatické uzliny popsal přežití 62 % žen, u 2 pozitivních lymfatických uzlin 36 % žen, u 3 a 4 pozitivních lymfatických uzlin 20 % žen. Při pozitivitě 5 a více lymfatických uzlin bylo již 5leté přežití nulové [3,14,15].
3. Pohled do pánve s vizualizací sentinelové uzliny v interilické oblasti vpravo po předchozím barvení Patent Blau a Tc99. Foto Masarykův onkologický ústav. 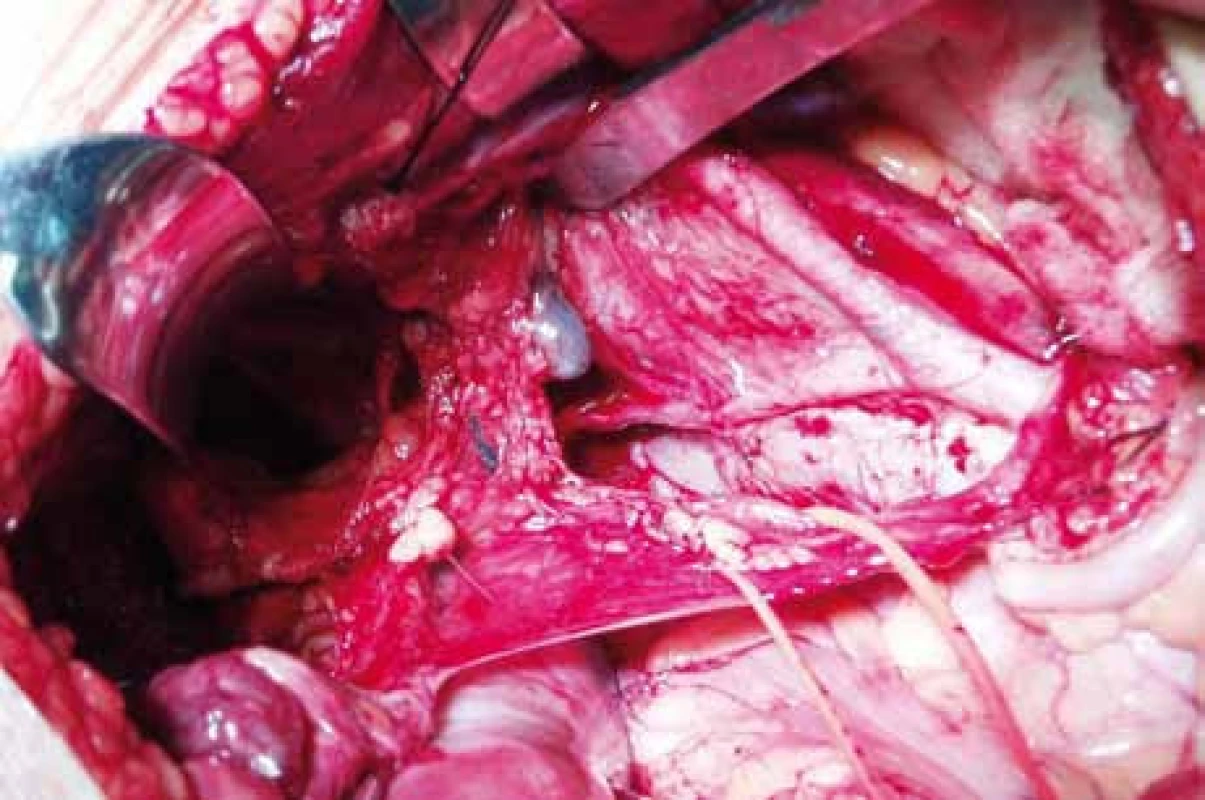
Velikost resekčního lemu
Raspagliesi et al se zabývali vzdáleností resekční linie v souvislosti s prognózou u pacientek po konizaci pro mikroinvazivní spinocelulární karcinom. Prognosticky významnou vzdáleností mezi kraniální hranicí tumoru a apexem konusu (apical clearance) bylo ve studii 10,6 mm a vzdálenost mezi tumorem a laterální stěnou konusu (lateral clearance) 6,5 mm. Raspagliesi et al prokázali statistický význam mezi hodnotou apikální clearance a rekurencí [4].
Intratumorózní mikrovaskulární denzita
Cantu De León et al popsali v retrospektivní studii u spinocelulárních karcinomů děložního hrdla mikrovaskulární intratumorózní denzitu (microvascular density – MVD) v korelaci s ostatními prognostickými faktory. MVD nad 20 byla přítomna u 68 % pacientek s rekurencí onemocnění. Ve skupině bez rekurence byl průkaz MVD u 39 % pacientek [19].
Biomolekulární faktory
Progrese nádorových buněk je v buněčném cyklu regulována pomocí pozitivních regulátorů – cyklin dependentních kináz (CDKs – CDK1, CDK2, CDK4, CDK6) s jejich aktivačními koenzymy (cyklin A, B, D, E) a negativních regulátorů – inhibitorů cyklin dependentních kináz (CDKIs). Mechanizmus působení cyklinů ve své studii shrnují např. Young Tae a Min Zhao. CDKs jsou regulovány nadbytkem cyklinů, fosforylací pomocí kináz, defosforylací pomocí buněčných fosfatáz a interakcí s CDKIs. CDKIs dělíme do dvou skupin – skupina CIP/KIP (zahrnuje proteiny p21, p27, p57) a skupina INK4 (zahrnuje p15, p16, p18 a p19). INK4 specificky inhibují cyklin D komplex pomocí CDK4 a CDK6. KIP působí vazbou na cyklin E, cyklin A přes CDK2 a cyklin B přes CDK1 [20]. Bahnassy et al sledovali prognostické faktory karcinomu děložního hrdla v souvislosti s vyjádřením exprese jednotlivých proteinů. V analýze popsali snížení celkového přežití v souvislosti s velikostí tumoru, diferenciací, postižením lymfatických uzlin, stadiem FIGO, Ki-67, cyklinem D1, p53 a p27. Dle výsledku studie v časných fázích karcinomů děložního hrdla asociovaných s lidským papilomavirem – HPV typem 16 a 18 – prokázali aberaci v p27, cyklinu E, CDK4 a p16, zatímco pozdní fáze je spojována s abnormalitami v dráze cyklin D1 a p53. Imunohistochemický průkaz proteinu p16 a cyklinu E by tak mohl napomoci v časné diagnostice karcinomu děložního hrdla [21].
Protein p27
Protein p27 patří do skupiny CDK inhibitorů, které negativně regulují buněčný cyklus. Protein inaktivuje cyklin-CDK komplex a brání přechodu z G1 fáze do S fáze. Za normálních podmínek je p27 silně vyjádřen u neproliferativních buněk a jeho primární funkcí je kontrolovat proliferaci. Jeho exprese narůstá pod vlivem růstových inhibičních signálů, jako např. transformační růstový faktor ß (TGF-ß). Protein p27 se účastní i regulace buněčné odpovědi na extracelulární signály. Byla prokázána jeho role při buněčné diferenciaci, mezibuněčné adhezi a apoptóze [22]. Koncentrace proteinu p27 klesá, pokud buňka dosáhne S fáze a p27 je degradován proteolýzou pomocí ubiquitin navázaných proteáz, části z kontrolních mechanizmů aktivity p27. Během proteolýzy je p27 inaktivovaný fosforylací na Thr-187 cyklin E-CDK2 komplexem, který slouží pro ubiquitizaci F-box proteinu SKP2 (S-fáze kináza asociovaný protein 2) a jeho kofaktoru Cks 1. SKP 2 byl detekován jako protoonkogen, jehož overexprese může řídit nárůst p27 proteolýzy, a přičinit se tak o maligní transformaci buňky a progresi dysplazie v karcinom. Protein p27 je taktéž inaktivován adenovirovým E1A, MYCC a E7 onkoproteinem vysoce rizikových lidských papilomavirů [23,24]. Goff et al ve své studii prokázali pokles exprese p27 pod 50 % u 31 % případů karcinomů děložního hrdla v souvislosti s nárůstem přítomnosti lymfovaskulární nádorové invaze. Pokles p27 nesouvisel s horší prognózou [25].
Protein p21
Protein p21 je CDK inhibitor. U neproliferujících buněk je často redukován či chybí. U proliferujících buněk může být zapojený v kontrole CDK aktivity. V buněčné odpovědi na poškození DNA se podílí na zastavení buněčného cyklu v G1/S fázi s aktivací reparačních mechanizmů, v opačném případě na spuštění apoptózy. Protein p21 je pod transkripční kontrolou proteinu p53 a je považován za jeho hlavní mediátor. Není potřebný k p53 dependentní apoptóze. Váže i proliferační buněčný jaderný antigen (PCNA). Kim et al a Huang et al považují p21 za důležitý modulátor rezistence na chemoterapii a radioterapii. Jeho vysoké hladiny mohou indukovat růst a zabránit apoptóze. Autoři dále udávají roli p21 při konečné diferenciaci buněk. Protein p21 může být vázán a inaktivován onkogenem E7 u HPV typu 16 [20,26]. Van de Putte et al v norské studii detekovali u časných stadií spinocelulárních cervikálních karcinomů vysokou expresi p21 ve 20 % a p16 u 43 % případů, zatímco pokles či nízkou expresi p27 prokázali u 80 % pacientek [22].
Protein p16
Protein p16 je geneticky mapován v oblasti 9p21 chromozomu a patří mezi negativní regulátory buněčného cyklu. Působí přes cyklinD-cdk4/6RB. Kim et al přisuzují proteinu p16 význam v buněčném stárnutí. Řada genetických mechanizmů (mutace, homozygotní delece, hypermetylace atd.) vede k inaktivaci tohoto proteinu, což hraje roli u mnoha zhoubných nádorů. Autoři popisují zvýšenou hladinu p16 již u dysplastických změn a tato narůstá s progresí léze do invazivního cervikálního karcinomu. Jeho exprese může být přímým důsledkem inaktivace antionkogenu pRb působením papilomavirového proteinu E7 [20]. Alterace genu p16 byly nalezeny u mnoha familiárně se vyskytujících nádorů. Protein p16 dle studií ovlivňuje také angiogenezi [22].
Protein p53
Tumor supresorový gen p53 se nachází v oblasti 17p13 chromozomu kódující nukleární fosfoprotein p53, který reguluje buněčný růst ve fázi G1 a G2, reparaci DNA a apoptózu. Na rozdíl od většiny karcinomů ostatních lokalizací je mutace genu p53 u nádorů děložního hrdla vzácná. Yee et al popisují mutaci pouze u 1–6 % karcinomů [27]. Skupina vysoce rizikových lidských papilomavirů prostřednictvím svého časného genu E6 kóduje onkoprotein E6. Díky zprostředkované vazbě E6-AP na protein p53 přes ubiquitin označí protein p53 k degradaci s následnou ztrátou jím zajišťované části kontroly buněčné proliferace a genomové integrity. Inaktivace proteinu p53 hraje hlavní roli v karcinogenezi děložního hrdla [28,29]. Lee-Wen Huang et al popsali souvislost mezi expresí p53 a FIGO stadiem onemocnění. Ve stadiu I byla exprese p53 prokázána u 23,9 %, ve stadiu II u 53,6 %, ve stadiu III a IV u 87,0 % karcinomů. Samotná overexprese tohoto genu není přímo v souvislosti s ostatními klinicko-patologickými faktory, nicméně v komplexu s nimi svědčí pro horší prognózu onemocnění [26]. Přímou úměru intenzity exprese p53 s histopatologickým stadiem cervikálních lézí popsali ve své studii i Berlin Grace et al [30].
Protein p63
Dle nejnovější dostupné literatury se p63 významně podílí na mnoha buněčných funkcích – buněčné proliferaci, diferenciaci, procesu stárnutí a apoptóze. Jeho gen je lokalizován v oblasti 3q27–29. Bergholz et al popsali produkty genu TP63 jako mnohočetné isoformy, které buď mají N-terminální p53-homologní transaktivační doménu – TAp63 (transkripčně aktivní varianta), či tato doména může chybět – ∆Np63. Podle přítomnosti transaktivační domény se zásadně liší spektrum proteinem ovlivňovaných genů. Melino se ve své práci zaměřuje na protichůdné vlastnosti těchto složek. TAp63 má funkci nádorového supresoru, který indukuje buněčnou smrt, ∆Np63 má naopak onkogenní vlastnosti a zvýšenou expresi u karcinomů. Poměr TAp63 a ∆Np63 ovlivňuje chemosenzitivitu. Klinické studie naznačují, že deficit proteinu p63, zejména složky TAp63, by mohl být kauzálním faktorem metastatického šíření. K deregulaci TAp63 přispívá vazba mutovaného proteinu p53 [31–33].
Cyklooxygenáza-2
Cyklooxygenáza (COX) je enzym, který se podílí na přeměně kyseliny arachidonové na prostaglandiny a tromboxany. V organizmu se vyskytuje ve 2 formách. Funkcí COX-1 je syntéza prostaglandinů. COX-2 hraje roli v inhibici buněčné apoptózy s následnou proliferací nádorových buněk s podporou angiogeneze. Její koncentrace stoupá při působení zánětlivých faktorů. Zvýšená exprese COX-2 je dle recentních studií spojena se špatnou prognózou v souvislosti s agresivnějším chováním nádoru, chemorezistencí a kratším DFI. Jako prognosticky nepříznivý se dle imunohistochemických měření jeví poměr COX-2 tumoru ku COX-2 ve stromatu větší než 1 (Ferrandina et al) [34–38].
Vaskulární endoteliální růstový faktor
Vaskulární endoteliální růstový faktor (vascular endothelial growth factor – VEGF) je glykoprotein hrající důležitou roli v angiogenezi tumoru, maligní transformaci a nádorovém růstu. Zvyšuje vaskulární permeabilitu a působí jako endoteliální buněčný mitogen. Skupina australských vědců pod vedením Lebrechta et al detekovala přímou úměru mezi sérovým VEGF a velikostí tumoru. Souvislost s postižením lymfatických uzlin či histologickým gradingem nebyla ve studii prokázána [39]. Zablokování proteinu p53 může být důležitým krokem v up-regulaci VEGF. Vysoká exprese VEGF by mohla naznačovat horší prognózu onemocnění [40,41].
Transformační růstový faktor beta-1
TGF-beta-1 (transforming growth factor) je dimerický protein, který působí jako růstový inhibitor. Kim et al se zabývali supresí MYCC genu díky TGF-beta-1, čímž se inhiboval buněčný cyklus. Předpokládá se, že pokles TGF-beta-1 má tak určitý podíl na progresi nádoru [42].
Hormonální receptory
Zatímco Kwasniewska et al ve své práci poukazují na vyšší expresi hormonálních receptorů ve stromálních buňkách bez ohledu na přítomnost HPV infekce, histopatologický typ nádoru a grading, Monsonego et al tyto souvislosti naopak pozorují [43,44]. Monsonego et al analyzovali přítomnost estrogenových a progesteronových receptorů u cervikálních HPV – asociovaných lézí. U kondylomat v oblasti skvamózní metaplazie čípku a high grade cervikální intraepiteliální neoplazie (cervical intraepithelial neoplasia – CIN) byla detekována vysoká exprese hormonálních receptorů, zejména progesteronových (4,518 fmol/g tkáně). Naopak u spinocelulárního karcinomu byla exprese progesteronových receptorů velmi nízká. Vysoká hladina progesteronových receptorů korelovala s nálezem CIN vysokého stupně a s HPV typem 16 a 18 asociovaných lézí. Estrogenové receptory korelovaly s přítomností HPV typem 6 a 11 asociovaných lézí. Detekované hladiny byly nezávislé na věku, fázi hormonálního cyklu či užívání hormonální antikoncepce. Autoři předpokládají, že hormonální receptory, zejména progesteronové, mohou nepřímo působit na HPV infikované buňky epitelu a podílet se jako kofaktory u HPV asociovaných cervikálních neoplazií [44]. Webster et al se ve své práci zaměřili na vliv estrogenů a progesteronů, které zvyšovaly stupeň indukované apoptózy pomocí HPV-16 E2 a E7 proteinů. HPV-16 E2 zodpovídá za replikaci a modulaci virové genové exprese a HPV-16 E7 za buněčnou transformaci. Antagonista estrogenového receptoru 3-hydroxytamoxifen blokuje tento účinek. Hormony na jedné straně působí protektivně up-regulací buněčné smrti, na druhé straně vlivem na lidský papilomavirus či buněčnou genovou expresi mohou vést ke karcinogenezi [45].
Chromozomální abnormality
Častými chromozomálními abnormalitami vyskytujícími se u nádorů bývají ztráty (delece) 3p, 11q, 13q, 6q, 4p nebo zmnožení (amplifikace) 3q, 1q, 8q, 15q, 5p, Xq genetického materiálu. U karcinomu děložního hrdla je nejčastější změnou zmnožení dlouhého raménka chromozomu 3 (3q), jehož region obsahuje gen pro RNA komponentu lidské telomerázy – gen hTERC (3q26) a gen MYCC (8q24). Tyto změny byly detekovány i u některých cervikálních intraepiteliálních neoplazií – CIN II a CIN III [46–49]. Průkaz amplifikace může být tedy považován za jeden z prediktivních faktorů maligní transformace a progrese prekanceróz v karcinomy děložního hrdla.
Gen hTERC
Telomeráza je ribonukleoprotein zodpovědný za udržování konců chromozomů (telomer) a hraje důležitou roli během buněčného dělení. Skládá se ze dvou podjednotek, a to hTERC (human telomerase RNA), která je důležitá pro syntézu telomer, a hTERT (human telomerase reverse transcriptase) katalyzující syntézu telomer. Gen hTERC se nachází v oblasti 3q26. Zmnožení tohoto úseku je považováno za „hybný motor“ v progresi prekancerózy v karcinom. Heselmeyer et al detekovali amplifikaci 3q26 u 70 % karcinomů děložního hrdla [50]. Li et al se zabývali průkazem amplifikace hTERC u prekancerózních změn děložního hrdla a benigních nálezů cervixu. U normálních a zánětlivých buněk byla amplifikace hTERC v 6,1 %, u CIN I v 10,0 %, u CIN II v 66,7 %, u CIN III v 72,5 % a u cervikálních karcinomů ve 100 % případů. Užití fluorescenční in situ hybridizace průkazu amplifikace měla vyšší specifitu diagnostiky vysokého stupně cervikálních intraepiteliálních neoplazií a cervikálních karcinomů než cytologická vyšetření stěrů děložního hrdla a HPV testace [47]. Gao et al prokázali pozitivní korelaci mezi amplifikací genu hTERC a cytologickým a histologickým gradingem. U pacientek s CIN I byla amplifikace přítomna u 28,6 % žen, s CIN II v 61,1 %, s CIN III v 75,0 % a u spinocelulárních karcinomů v 91,7 %. Přítomnost vysokého počtu kopií korelovala se stupněm high grade cervikální léze [48]. Li et al se snažili nalézt souvislosti mezi amplifikací hTERC, HPV infekcí, abnormálními cytologickými stěry a cervikální intraepiteliální neoplazií. Přítomnost amplifikace hTERC u CIN I byla nalezena v 5,4 % případů, CIN II v 50,0 %, CIN III v 77,8 % a ve 100 % invazivních cervikálních karcinomů. Přítomnost HPV infekce byla prokázána v souboru u 17,1 % pacientek. HPV pozitivní ženy měly vyjádřenou amplifikaci genu hTERC v 19,7 % oproti skupině HPV negativních s amplifikací v 6,5 % případů [49].
Gen MYCC
Transkripční faktor MYCC je kódován protoonkogenem MYC. Nachází se v oblasti 8q24 a podílí se na buněčné proliferaci a diferenciaci. MYCC aktivuje promotor TERC. Předpokládá se, že E6 reaguje přímo s MYCC a tento komplex aktivuje expresi hTERC [51]. Abba et al poukázali na souvislost zmnožení MYCC s narůstajícím histologickým gradingem lézí a našli těsnou souvislost s výskytem HPV infekce typu 16 a amplifikací MYCC. Autoři předpokládají, že amplifikace MYCC má podíl nejen na progresi nádoru, ale i na buněčné transformaci [52]. Taktéž Golijow et al potvrdili souvislost mezi amplifikací genu MYCC a histologickým gradingem preinvazivních intraepiteliálních lézí děložního hrdla v souvislosti s vlivem MYCC na progresi a buněčnou transformaci [53]. Riou et al v souboru časných stadií cervikálních karcinomů detekovali souvislost amplifikací MYCC s vyšším rizikem relapsu onemocnění. Overexprese MYCC byla ve studii 6krát vyšší u pacientek se vzdálenými metastázami [54,55]. Na druhou stranu se objevily studie, např. Ngana et al, v nichž byl analyzován vztah mezi pan-ras, MYCC a proteinem p53 u spinocelulárních karcinomů děložního hrdla ve stadiu IB a IIA. Přímá souvislost s prognózou zde nebyla prokázána [56].
Závěr
Komplexním zhodnocením klasických histopatologických faktorů v kombinaci s detekcí nových validních biomolekulárních markerů bychom mohli blíže predikovat biologické chování nádoru a prognózu pacientek s karcinomem děložního hrdla. U vysoce rizikových žen by tak mohla být primárně volena agresivnější terapie a intenzivnější follow-up. U pacientek v nízkém riziku by pak mohla být snížena radikalita léčby a mohlo by být dosaženo menší morbidity se zachováním kvality života. Můžeme očekávat, že další výzkum v této oblasti přinese nové charakteristiky karcinomu děložního hrdla a nová prognostická kritéria použitelná v široké praxi.
4. Preparát dělohy s karcinomem děložního hrdla a 3cm poševní manžetou. Foto Masarykův onkologický ústav. 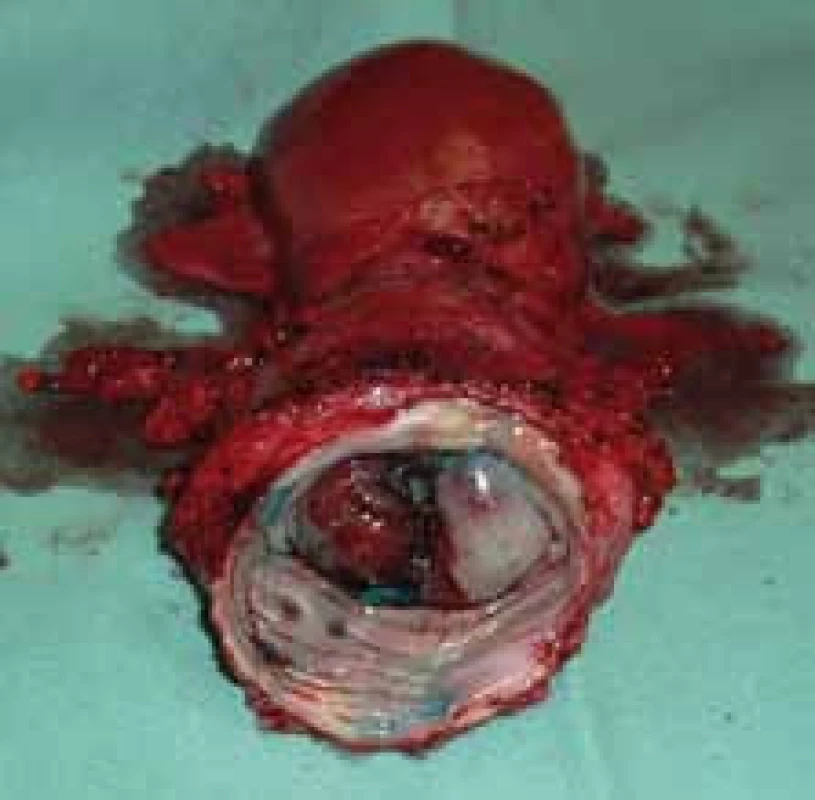
Poděkování
Autoři děkují za přečtení textu a kritické připomínky panu náměstkovi pro vědu, výzkum a výuku MUDr. Marku Svobodovi, Ph.D.
Podpořeno MZ ČR – RVO (MOÚ, 00209805) a grantovým projektem IGA NT 11089-4/2010.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do bi omedicínských časopisů.
MUDr. Lucie Mouková, Ph.D.
Oddělení gynekologické onkologie
Masarykův onkologický ústav
Žlutý kopec 7
656 53 Brno
e-mail: moukova@mou.cz
Obdrženo: 18. 2. 2013
Přijato 24. 3. 2013
Sources
1. Freitag P. Rizikové a prognostické faktory. In: Cibula D, Petruželka L et al (eds). Onkogynekologie. 1. vyd. Praha: Grada 2009 : 400.
2. Jordan JA, Singer A, Jones H III et al (eds). The cervix. 2nd ed. Malden: Blackwell 2006.
3. Šafář P. Cervikální karcinom. Moderní gynekologie a porodnictví 2000; 9 : 4.
4. Alvarez RD, Soong SJ, Kinney WK et al. Identification of prognostic factors and risk groups in patients found to have nodal metastasis at the time of radical hysterectomy for early-stage squamous carcinoma of the cervix. Gynecol Oncol 1989; 35(2): 130–135.
5. Raspagliesi F, Ditto A, Quattrone P et al. Prognostic Factors in microinvasive cervical squamous cell cancer: long-term results. Int J Gynecol Cancer 2005; 15(1): 88–93.
6. Östör AG, Rome RM. Micro-invasive squamous cell carcinoma of the cervix. A clinico-pathologic study of 200 cases with long-term follow-up. Int J Gynecol Cancer 1994; 4(4): 257–264.
7. Milam MR, Frumovitz M, Dos Reis R et al. Preoperative lymph-vascular space invasion in associated with nodal metastases in women with early-stage cevical cancer. Gynecol Oncol 2007; 106(1): 12–15.
8. Berek JS, Hacker NF, Fu YS et al. Adenocarcinoma of the uterine cervix: histologic variables associated with lymph node metastasis and survival. Obstet Gynecol 1985; 65(1): 46–52.
9. Lindahl B, Ranstam J, Willén R. Prospective malignancy grading of invasive squamous carcinoma of the uterine cervix. Prognostic significance in a long-term follow-up. Anticancer Res 2007; 27(4C): 2829–2832.
10. Graflund M, Sorbe B, Hussein A et al. The prognostic value of histopathologic grading parameters and microvessel density in patients with early squamous cell carcinoma of the uterine cervix. Int J Gynecol Cancer 2002; 12(1): 32–41.
11. Dundr P. Histopatologická klasifikace. In: Cibula D, Petruželka L et al (eds). Onkogynekologie. 1. vyd. Praha: Grada 2009 : 394–399.
12. Yasuda S, Kjima A, Maeno Y et al. Poor prognosis of patients with stage Ib1 adenosquamous cell carcinoma of the uterine cervix with pelvic lymphonode metastasis. Kobe J Med Sci 2006; 52(1): 9–15.
13. Creasman WT, Kohler MF. Is lymph vascular space involvement an independent prognostic factor in early cervical cancer? Gynecol Oncol 2004; 92(2): 525–529.
14. Delgado G. Lymphovascular space involvement in cervical cancer: an independent risk factor. Gynecol Oncol 1998; 68(3): 219.
15. Delgado G, Bundy B, Zaino R et al. Prospective surgical-pathologic study of disease-free interval in patients with stage Ib squamous carcinoma of the cervix: a Gynecologic Oncology Group study. Gynecol Oncol 1990; 38(3): 352–357.
16. Morice P, Piovesan P, Rey A et al. Prognostic value of lymphovascular space invasion determined with hematoxylin-eosin staining in early cervical carcinoma: results of a multivariate analysis. Ann Oncol 2003; 14(10): 1511–1517.
17. Roman LD, Felix JC, Muderspach LI et al. Influence of quality of lymphovascular space invasion on the risk of nodal metastases in women with early stage squamous cancer of the cervix. Gynecol Oncol 1998; 68(3): 220–225.
18. Rob L, Svoboda B, Robová H et al. Guideline gynekologických zhoubných nádorů 2004/2005: Primární komplexní léčba operabilních stádií zhoubných nádorů děložního hrdla. Oncogynekologie.com. http://www.onkogynekologie.com/wp-content/uploads/2011/03/C53.pdf.
19. Cantu De León D, Lopez-Graniel C, Frias Mendivil M et al. Significance of microvascular density (MVD) in cervical cancer recurrence. Int J Gynecol Cancer 2003; 13(6): 856–862.
20. Kim YT, Zhao M. Abberant cell cycle regulation in cervical carcinoma. Yonsei Med J 2005; 46(5): 597–613.
21. Bahnassy AA, Zekri AR, Saleh M et al. The possible of cell cycle regulators in multistep process of HPV-asociated cervical carcinoma. BMC Clin Pathol 2007; 7 : 4.
22. van de Putte G, Holm R, Lie AK et al. Expression of p27, p21 and p16 protein in early squamous cervical cancer and its relation to prognosis. Gynecol Oncol 2003; 89(1): 140–147.
23. Chen TP, Chen cm, Chang HW et al. Increased expression of SKP2 and phospho-MAPK/ERK1/2 and decreased expression of p27 during tumor progression of cervical neoplasia. Gynecol Oncol 2007; 104(3): 516–523.
24. Dellas A, Schultheiss E, Leivas MR et al. Association of p27Kip1, cycline E and c-MYC expression with progression and prognosis in HPV-positive cervical neoplasms. Anticancer Res 1998; 18(6A): 3991–3998.
25. Goff BA, Sallin J, Garcia R et al. Evaluation of p27 in preinvasive and invasive malignancies of the cervix. Gynecol Oncol 2003; 88(1): 40–44.
26. Huang LW, Chou YY, Chao SL et al. p53 and p21 expression in precancerous lesions and carcinomas of the uterine cervix: overexpression of p53 predicts poor disease outcome. Gynecol Oncol 2001; 83(2): 348–354.
27. Yee C, Krishnan-Hewlett I, Baker CC et al. Presence and expression of human papillomavirus sequences in human cervical cell lines. Am J Pathol 1985; 119(3): 361–366.
28. Ahn WS, Bae SM, Lee KH et al. Recombinant adenovirus-p53 gene transfer and cell-specific growth supression of human cervical cancer cells in vitro and in vivo. Gynecol Oncol 2004; 92(2): 611–621.
29. Gross GE, Barraso R (eds). Human papilloma virus infection: A clinical atlas. Ullstein: Mosby 1997.
30. Grace VM, Shalini JV, Sree Lekha TT et al. Co-overexpression of p53 and bcl-2 protein in HPV-induced squamous cell carcinoma of the uterine cervix. Gynecol Oncol 2003; 91(1): 51–58.
31. Melino G. p63 is a suppressor of tumorigenesis and metastasis interacting with mutant p53. Cell Death Differ 2011; 18(9): 1487–1499. doi:10.1038.81.
32. Bergholz J, Xiao ZX. Role of p63 in Development Tumorigenesis and Cancer Progression. Cancer Microenviron, 2012. www.ncbi.nlm.nih.gov/pubmed/22847008.
33. Houghton O, McCluggage WG. The expression and diagnostic utility of p63 in the female genital tract. Adv Anat Pathol 2009; 16(5): 316–321.
34. Distefano M, Ferrandina G, Smaniotto D et al. Concomitant radiochemotherapy plus surgery in locally advanced cervical cancer: update of clinical outcome and cyclooxygenase-2 as predictor of treatment susceptibility. Oncology 2004; 67(2): 103–111.
35. Ferrandina MG, Lauriola L, Distefano M et al. Increased cyclooxygenase-2 (COX-2) expression is associated with chemotherapy resistance and poor survival in cervical cancer patients. J Clin Oncol 2002; 20(4): 973–981.
36. Ferrandina G, Lauriola L, Zannooni GF et al. Expression of cyclooxygenase-2 (COX-2) in tumor and stroma compartments in cervical cancer: clinical implications. Br J Cancer 2002; 87(10): 1145–1152.
37. Chen YJ, Wang LS, Wang PH et al. High cyclooxygenase-2 expresion in cervical adenocarcinoma. Gynecol Oncol 2003; 88(3): 379–385.
38. Kim MH, Seo SS, Song YS et al. Expression of cyclooxygenase-1 and -2 associated with expression of VEGF in primary cervical cancer and metastatic lymph nodes. Gynecol Oncol 2003; 90(1): 83–90.
39. Lebrecht A, Ludwig E, Huber A et al. Serum vascular endothelial growth factor and serum leptin in patients with cervical cancer. Gynecol Oncol 2002; 85(1): 32–35.
40. Lee JS, Kim HS, Jung JJ et al. Expression of vascular endothelial growth factor in adenocarcinomas of the uterine cervix and Its relation to angioenesis and p53 and c-erb-2 protein expression. Gynecol Oncol 2002; 85(3): 469–475.
41. Kisser A, Weich HA, Bandner G et al. Mutant p53 potentiates protein kinase C induction of vascular endothelial growth factor expression. Oncogene 1994; 9(3): 963–969.
42. Kim JW, Kim HS, Kim IK et al. Transforming growth factor-beta 1 induces apoptosis through down-regulation of c-MYC gene and overexpression of p27Kip1 protein in cervical carcinoma. Gynecol Oncol 1998; 69(3): 230–236.
43. Kwasniewska A, Postawski K, Gozdzicka-Jozefiak A et al. Estrogen and progesterone receptor expression in HPV-positive and HPV-negative cervical carcinomas. Oncol Rep 2011; 26(1): 153–160.
44. Monsonego J, Magdelenat H, Catalan F et al. Estrogen and progesterone receptors in cervical human papillomavirus related lesions. Int J Cancer 1991; 48(4): 533–539.
45. Webster K, Taylor A, Gaston K. Oestrogen and progesterone increase the levels of apoptosis induced by the human papillomavirus type E2 and E7 proteins. J Gen Virol 2001; 82(Pt 1): 201–213.
46. Guijon FB, Greulich-Bode K, Paraskevas M et al. Premalignant cervical lesions are characterized by dihydrofolate reductase gene amplification and c-MYC overexpression: possible biomarkers. J Low Genit Tract Dis 2007; 11(4): 265–272.
47. Li Y, Ye F, Lü WG et al. Detection of human telomerase RNA gene in cervical cancer and precancerous lesions: comparison with cytological and human papillomavirus DNA test findings. Int J Gynecol Cancer 2010; 20(4): 631–637.
48. Gao L, Zhu Y, Liu SP et al. Detection of human telomerase RNA component gene by fluorescent in situ hybridization for screening of cervical lesions. Zhonghua Bing Li Xue Za Zhi 2011; 40(2): 104–107.
49. Li YB, Wulan N, Liu ZH et al. Amplification and clinical significance of hTERC gene in the cervical exfoliated cells from natural population in Shenzhen. Zhonghua Liu Xing Bing Xue Za Zhi 2009; 30(9): 946–950.
50. Heselmeyer K, Macville M, Schröck E et al. Advanced-stage cervical carcinomas are defined by a recurent pattern of chromosomal aberration revealing high genetic instability and a consistent gain of chromosome arm 3q. Genes Chromosomes Cancer 1997; 19(4): 233–240.
51. Veldman T, Liu X, Yuan H et al. Human papillomavirus E6 and MYC proteins associate in vivo and bind to and cooperatively activate the telomerase reverse transcriptase promoter. Proc Natl Acad Sci USA 2003; 100(14): 8211–8216.
52. Abba MC, Laguens RM, Dulout FN et al. The c-MYC activation in cervical carcinomas and HPV 16 infections. Mutat Res 2004; 557(2): 151–158.
53. Golijow CD, Abba MC, Mourón SA et al. c-MYC gene amplification detected in preinvasive inraepithelial cervical lesions. Int J Gynecol Cancer 2001; 11(6): 462–465.
54. Riou GF, Bourhis J, Le MG. The c-MYC proto-oncogene in invasive carcinomas of the uterine cervix: clinical relevance of overexpression in early stages of the cancers. Anticancer Res 1990; 10(5A): 1225–1231.
55. Iwasaka T, Yokoyama M, Oh-uchida M et al. Detection of human papillomavirus genome and analysis of expresson of c-MYC and Ha-ras oncogenes in invasie cervical carcinomas. Gynecol Oncol 1992; 46(3): 298–303.
56. Ngan HY, Cheung AN, Liu SS et al. Abnormal expression of pan-ras, c-MYC and tp53 in squamous cell carcinoma of cervix: correlation with HPV and prognosis. Oncol Rep 2001; 8(3): 556–561.
Labels
Paediatric clinical oncology Surgery Clinical oncology
Article was published inClinical Oncology

2013 Issue 2-
All articles in this issue
- Prognostic Factors for Cervical Cancer
- Antiangiogenic Biotherapy and Chemotherapy in Breast Cancer: Review of Literature and Case Report
- The Role of Radiotherapy in the Treatment of Malignant Lymphomas – Recommendations of the Czech Lymphoma Study Group
- Epidemiological and Clinico-Pathological Characteristics of Patients with Renal Carcinoma: A Single Institution Analysis of 544 Cases
- Castleman Disease: Retrospective Single-Center Study of Therapeutic Results in 10 Patients
- A Case Report: Neutropenia Grade IV and Febrile Neutropenia in a Metastatic Breast Cancer Patient Treated With Palliative Chemotherapy Cyclophosphamide/Myocet
- Spontaneous Remission of Acute Myeloid Leukemia – a Single Center Case Reports
- Breast Cancer Adjuvant Radiotherapy Using Active Breathing Control-Moderate Inspiration Breath-Hold – a Case Report
- Adjuvant! Online: Mind the Gap!
- Clinical Oncology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Prognostic Factors for Cervical Cancer
- Spontaneous Remission of Acute Myeloid Leukemia – a Single Center Case Reports
- A Case Report: Neutropenia Grade IV and Febrile Neutropenia in a Metastatic Breast Cancer Patient Treated With Palliative Chemotherapy Cyclophosphamide/Myocet
- The Role of Radiotherapy in the Treatment of Malignant Lymphomas – Recommendations of the Czech Lymphoma Study Group
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

