-
Medical journals
- Career
Extrasystoly – Arytmie a možnosti léčby v kontextu chlopenních vad
Authors: P. Heinc; F. Kováčik; O. Moravec; J. Přeček; M. Táborský
Authors‘ workplace: FN Olomouc ; I. interní klinika – kardiologická
Published in: Kardiol Rev Int Med 2013, 15(3): 163-167
Category:
Overview
Antiarytmická léčba nemá téměř žádná specifika u jednotlivých chlopenních vad, ale je podmíněna spíše stupněm srdečního selhání v přítomnosti chlopenní vady. V tomto sdělení je rozvedena strategie antiarytmické léčby extrasystolie a nejčastější setrvalé arytmie – fibrilace síní – v kontextu chlopenních vad.
Klíčová slova:
extrasystoly – fibrilace síní – chlopenní vady – strategie antiarytmické léčbyÚvod
V roce 2012 byly publikovány nové evropské doporučené postupy pro nemocné s chlopenními srdečními vadami. Tato doporučení jsou celkem podrobná, nicméně arytmické komplikace chlopenních vad prakticky vůbec nezmiňují [1]. Je to podmíněno tím, že antiarytmická (AA) léčba nemá téměř žádná specifika u jednotlivých chlopenních vad, ale závisí spíše na stupni srdečního selhání (SS) v přítomnosti chlopenní vady. Nejčastější setrvalá arytmie ze všech poruch rytmu u chlopenních vad je fibrilace síní (FS). Přítomnost chlopenní vady je zjišťována asi ve 20 – 30 % případů nemocných s FS [2,3]. U nemocných s chlopenní vadou dochází v důsledku zvýšené zátěže myokardu postupně ke vzniku SS levé komory. Výskyt FS roste jednak s věkem [4], ale také se stupněm SS, a přítomnost FS dvojnásobně zvyšuje mortalitu bez závislosti na dalších známých prediktorech mortality [5,6]. FS i chlopenní vady vedou ve svém důsledku ke stejné komplikaci ve smyslu SS, proto je třeba optimalizovat léčbu obou základních onemocnění v prevenci vzniku SS. Progrese SS je následně nejčastější a hlavní příčinou vzniku jak supraventrikulárních, tak i komorových arytmií.
Patofyziologický podklad arytmií u chlopenních vad
Dlouhodobé přetěžování srdečního svalu vede k maladaptivním změnám myokardiálních buněk, a tím dochází k patologické remodelaci levé komory s její dilatací a poruchou kontraktility. Pokud nedojde k časnému léčebnému ovlivnění této remodelace, pak se rozvinou systémové reakce na systolickou dysfunkci levé komory, zejména aktivace sympatiku a renin‑angiotenzin‑aldosteronového systému [7]. Všechny tyto reakce zhoršují klinické projevy SS, snižují funkční kapacitu a vedou k elektrické nestabilitě myokardu a předčasnému úmrtí na podkladě SS nebo komorové arytmie. Při již omezené srdeční rezervě při systolickém selhávání velmi záleží na kontraktilitě síní a synchronizované kontrakci komor. Zvýšený enddiastolický tlak v komorách vede současně k přetížení síní a stejným mechanizmem vede dlouhodobé přetížení síní k jejich dilataci a remodelaci, v jejímž důsledku jsou vytvořeny podmínky pro vznik i perzistenci FS. Vznik FS nebo vznik blokády levého raménka Tawarova způsobují další hemodynamickou zátěž, což může vést k akutnímu zhoršení SS. Přerušení remodelace levé komory a zastavení systémových reakcí je základem velmi efektivní léčby SS a dominantním faktorem v prevenci arytmických komplikací u chlopenních vad.
Extrasystoly
Nejčastěji přítomné komorové či síňové extrasystoly nemají zvláštní vliv na hemodynamiku ani v přítomnosti chlopenních vad. Hemodynamický vliv mají jen setrvalejší tachyarytmie, které vedou k poklesu systémového tlaku nebo vedou k výraznému snížení srdečního výdeje.
Síňová ektopie
Největší zátěž pro levou síň představuje z chlopenních vad mitrální stenóza. Při Holterově monitoraci pacientů s mitrální stenózou byly detekovány supraventrikulární arytmie v 83 % sledovaných (u 53 % se jednalo o síňové tachykardie, u 22 % o FS a u 8 % o flutter síní). Síňové extrasystoly (SVES) se vyskytly v 94 % případů. Hlavním zjištěním však bylo, že 95 % arytmií bylo asymptomatických [8]. Základním požadavkem pro farmakoterapii všech arytmií je jejich symptomatičnost a sekundárně jejich hemodynamický dopad. Ovlivnění jednotlivých i nakupených ektopií z pohledu hemodynamiky není potřebné, nicméně četnější síňová ektopie, zvláště v přítomnosti chlopenních vad, může předznamenávat negativní prognostický význam ve smyslu potenciálního budoucího vzniku FS. V takových případech není vhodná AA léčba, ale naopak je vhodné časné zahájení podpůrné (tzv. up ‑ stream) léčby k prevenci SS pomocí selektivních betablokátorů a ACE inhibitorů, což je současná prevence vzniku FS.
Komorová ektopie
K primární detekci všech typů arytmií slouží Holterova monitorace, jejíž základní význam spočívá ve stanovení četnosti a závažnosti arytmií v korelaci na symptomatologii a v posouzení efektivity AA léčby. Největší problematika komorové ektopie tkví ve značné spontánní variabilitě záznamů téhož jedince, která značně ovlivňuje pohled na AA léčbu co do efektivity, tak i do hodnocení proarytmogenního efektu antiarytmik. Aby se rozlišila spontánní variabilita počtu KES od variability počtu KES způsobené AA léčbou, byla stanovena kritéria pro hodnocení efektivity AA léčby podle délky intervalu, v jakém byla opakovaná Holterova monitorace provedena [9]. Pro procentuální potlačení komorové ektopie jsou požadována mírnější kritéria, pokud je opakovaná Holterova monitorace provedena v odstupu jednoho týdne, než pokud je Holterova monitorace provedena v odstupu tří měsíců až jednoho roku (tab. 1) [10]. Vzhledem k tomu, že proarytmogenní efekt se většinou objevuje brzy po nasazení AA léčby, opakovaná Holterova monitorace se většinou doporučuje provádět v odstupu jednoho týdne, proto stanovená kritéria pro hodnocení proarytmogenního efektu AA léčby jsou relativně jednotná (tab. 2).
Table 1. Hodnocení efektivity antiarytmické léčby dle Holterovy monitorace EKG. 
Table 2. Hodnocení proarytmogenního efektu antiarytmické léčby dle Holterovy monitorace EKG. 
Strategie antiarytmické léčby komorové ektopie
Ačkoli jsou antiarytmika efektní v potlačení komorové ektopie, většina z nich může snížit funkci levé komory a ohrozit život pacienta svým proarytmogenním efektem. Proto by měla být AA léčba indikována jen u symptomatických ektopií nebo u velmi četné polytopní ektopie a přitom by měla být vedena opatrně (zvláště při omezené funkci levé komory). Ve farmakoterapii KES se v naší praxi používají pouze antiarytmika ze skupiny I – III dle Vaughan ‑ Williamsovy klasifikace. Ze skupiny I se v našich podmínkách dominantně používá jen propafenon. Ze skupiny IIse mohou podávat všechny dostupné betablokátory, přitom platí zásada, že u nemocných s nízkou ejekční frakcí a/ nebo s klinickými známkami SS a/ nebo v přítomnosti SOS se podávají pouze selektivní betablokátory (metoprolol, bisoprolol, nebivolol) nebo carvedilol. Dávky se v těchto případech titrují od minimální až po doporučovanou dávku nebo po maximální tolerabilní dávku, přičemž metoprolol a bisoprolol se podávají pouze ve formě s pozvolným uvolňováním (tab. 3). Ze skupiny III se u nás v této indikaci dá použít jen sotalol a amiodaron. Ve farmakoterapeutické strategii obecně platí dvě zásady. Jednak se léčba začíná nejmenší doporučovanou dávkou a při nedostatečném efektu se jde až na maximální doporučovanou dávku; a druhou zásadou je, že se začíná s léčbou, která má nejméně vedlejších účinků, i když s tím souvisí i relativně menší AA efekt. Při této posloupnosti se začíná léčba betablokátory a pokud není dostatečný efekt, přechází se na propafenon, následně na sotalol a maximální efektivita může být dosažena amiodaronem při vědomí četnějších vedlejších účinků. Léčba amiodaronem by však měla být vyhrazena pouze pro výrazně symptomatické nebo hemodynamicky závažné polytopní komorové ektopie. AA farmakoterapie je u nemocných se SOS dominantně vedena dle výskytu závažnějších komorových arytmií než na základě výskytu jednotlivých KES nebo komplexních forem KES a důležitý je ohled na funkční zdatnost levé komory. Před nasazením AA farmakoterapie je třeba se ujistit o korelaci symptomatologie s komorovou ektopií pomocí Holterovy monitorace a po nasazení antiarytmika je třeba stejným způsobem ověřit skutečný efekt léčby, nebo naopak proarytmogenní efekt antiarytmik. V případě, že AA farmakoterapie není efektní stran odstranění závažné symptomatologie nebo dochází k poklesu ejekční frakce levé komory v důsledku četných KES a pokud jde o monofokální ektopii, je indikována radiofrekvenční ablace ektopického ložiska. Pokud je morfologie symptomatických nebo velmi četných KES dominantně monofokální a současně ukazuje na původ KES ve výtokovém traktu pravé či levé komory, lze volit radiofrekvenční ablaci jako metodu první volby před AA léčbou. U nemocných, kde selhala veškerá výše uvedená léčba a dochází k poklesu ejekční frakce levé komory v důsledku četné komorové ektopie (koronarograficky nutno vyloučit ischemický podklad), je indikována léčba amiodaronem.
Table 3. Počáteční a cílové dávky betablokátorů podávaných u nemocných se sníženou funkcí levé komory. 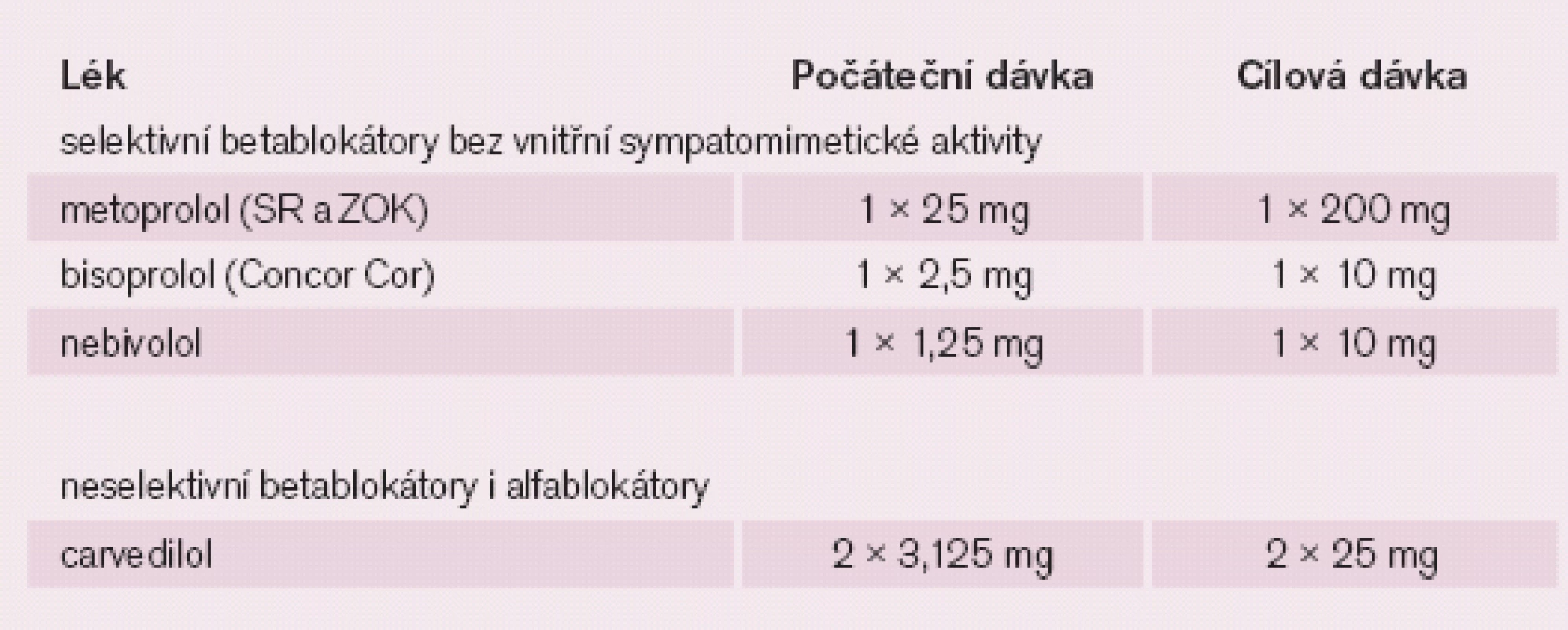
Antiarytmická léčba fibrilace síní v přítomnosti chlopenní vady
Základní léčba FS v přítomnosti chlopenní vady spočívá v minimalizaci symptomatiky a hlavně v prevenci komplikací, z nichž je kromě tromboembolizace nejobávanější právě SS, které dále eskaluje morbiditu a mortalitu. V počátečních stadiích chlopenních vad, kde je dobrá funkce levé komory, je primárně indikována farmakologická AA a podpůrná (up ‑ stream) léčba a teprve v případě selhání alespoň jednoho antiarytmika je vhodné indikovat ablační řešení. Pouze v přítomnosti těžké mitrální regurgitace je čerstvě vzniklá FS u jinak asymptomatických pacientů s dobrou funkcí levé komory (ejekční frakce levé komory ≥ 60 %) jedinou arytmickou indikací, kde je indikována operační náhrada mitrální chlopně na základě posledních evropských i našich „Doporučených postupů pro diagnostiku a léčbu chlopenních srdečních vad v dospělosti“. Pro indikaci ke kardiochirurgické korekci chlopenních vad nehrají jinak stěžejní symptomatika a echokardiografické parametry, které charakterizují míru přetížení, míru SS a přítomnost arytmií, v doporučeních žádnou roli, resp. neovlivňují tyto indikace, byť se můžou na symptomatice podílet. V současné době při indikaci náhrady chlopně protézou se v převážné většině provádí u nemocných s anamnézou FS tzv. MAZE operace, která kardiochirurgickou intervencí ovlivní arytmický substrát v levé síni. Díky tomuto operačnímu ovlivnění obou příčin přetížení levostranných oddílů se výrazně zlepšuje prognóza nemocných podstupujících operační korekci chlopenních vad.
U všech forem FS, zvláště pak v přítomnosti chlopenní vady, je třeba dát od samého počátku zvýšený důraz na prevenci SS. Proto by měla být již při prvotním zjištění FS zahájena podpůrná (up ‑ stream) farmakologická léčba ovlivňující FS, a tou je léčba ovlivňující renin‑angiotenzin‑aldosteronový systém. Za tím účelem se podávají inhibitory angiotenzin konvertujícího enzymu (ACEI) a blokátory AT1 receptorů pro angiotenzin II (AT1 blokátory), u nichž se ukázalo, že snižují výskyt FS [11]. ACEI snižují síňový tlak, redukují počet síňových předčasných stahů, redukují fibrotizaci síňového myokardu a snižují počet recidiv FS po elektrické kardioverzi. U nemocných po chirurgické revaskularizaci vede vysazení ACEI k častější recidivě FS a v kombinaci s ACEI se daří při současné AA medikaci častěji udržet sinusový rytmus [12].
Principy vlastní antiarytmické léčby fibrilace síní v přítomnosti chlopenní vady
Ve svém základu zahrnuje AA farmakoterapie dva základní léčebné principy:
- Kontrola rytmu – konverze na SR a udržení SR.
- Kontrola komorové frekvence při trvající FS.
Kontrola rytmu
Pokud je indikace akutní konverze FS na SR v přítomnosti chlopenní vady, což je v případě, kdy je arytmie hlavním faktorem odpovědným za akutní SS, hypotenzi nebo zhoršení anginy pectoris, pak se výhradně používá elektrická kardioverze. K těmto závažným klinickým stavům dochází především u pokročilejších stenotických chlopenních vad, kterým zásadně nevyhovuje vysoká srdeční frekvence. Elektrická kardioverze je indikována i v případě elektivní konverze FS na SR v přítomnosti chlopenní vady a farmakologická verze se v těchto případech nedoporučuje.
V případě, že se rozhodneme pro strategii dlouhodobé kontroly rytmu, pak je optimální provádět současně kontrolu frekvence, a v případě přítomnosti chlopenní vady je třeba vést léčbu základního srdečního onemocnění, které zřejmě ovlivňuje prognózu pacientů více než sama FS. V našich podmínkách se ke kontrole rytmu jako antiarytmika dominantně používají propafenon, sotalol, amiodaron a nově dronedaron. Jejich dávkování a vedlejší účinky ukazuje tab. 4 [13].
Table 4. Udržovací dávky a vedlejší účinky antiarytmik používaných k udržení sinusového rytmu. 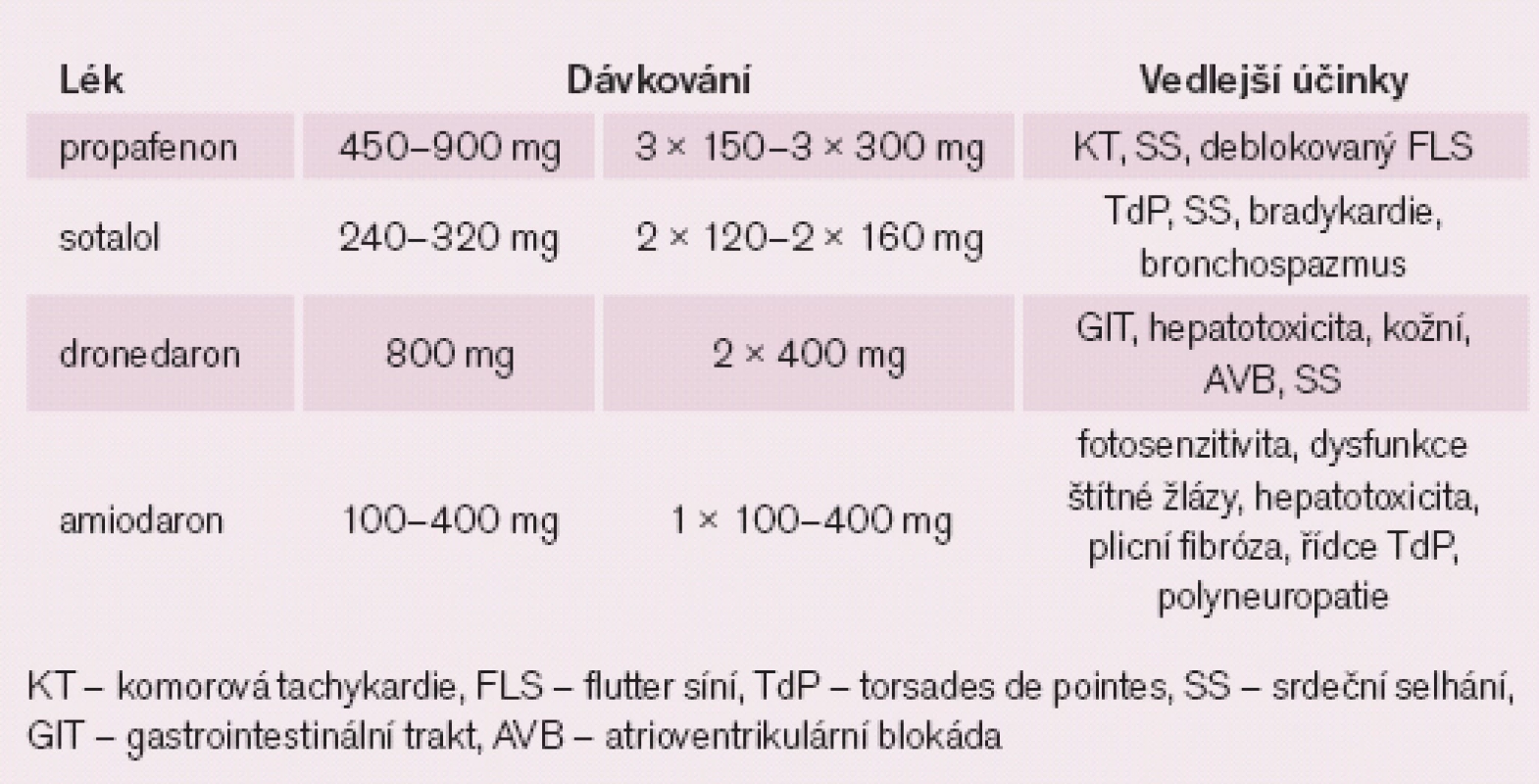
Propafenon se doporučuje ke kontrole rytmu jako lék první volby u nemocných bez SOS, lze jej podávat i u nemocných s lehkou chlopenní vadou při zachované dobré funkci levé komory, ale rozhodně by neměl být podáván u nemocných s výrazněji sníženou ejekční frakcí levé komory. S propafenonem by měly být vždy podávány také selektivní betablokátory k současné kontrole komorové frekvence v případě recidivy FS a v neposlední řadě také z důvodu prevence rozvoje SS.
Sotalol lze použít ke kontrole srdečního rytmu u nemocných se SOS, kde může mít podobnou účinnost v profylaxi recidivy FS jako amiodaron, ačkoli u neselektované populace je amiodaron účinnější. Výhodou sotalolu je jeho současný betablokující účinek, který dokáže v případě recidivy FS dobře kontrolovat komorovou frekvenci.
Amiodaron je v prevenci rekurence FS účinnější než propafenon, dronedaron i sotalol, a je tedy dobrou volbou u pacientů s rekurentními arytmiemi při léčbě výše uvedenými AA. Na rozdíl od ostatních AA může být bezpečně podán i u pacientů se SOS, a to včetně pacientů se SS [14]. Nevýhodou amiodaronu je řada extrakardiálních nežádoucích účinků při dlouhodobější léčbě.
Dronedaron má stejně jako propafenon a sotalol proti amiodaronu nižší schopnost zabránit recidivám FS, ale na rozdíl od amiodaronu má nižší počet nežádoucích účinků a nebyl u něj zatím prokázán proarytmický efekt [15]. U pacientů se symptomatickým SS (NYHA III – IV) a stejně tak u pacientů ve funkční klasifikaci NYHA II s hospitalizací pro SS v posledním měsíci zvyšuje mortalitu zhoršením SS (ne proarytmickým efektem ani ne zvýšením četnosti náhlé srdeční smrti) [16], proto je u této velké skupiny nemocných pro strategii kontroly rytmu i kontroly frekvence kontraindikován. Dronedaron je tedy indikován ke kontrole rytmu pouze u nemocných bez SOS, u hypertoniků bez hypertrofie levé komory a u nemocných s ischemickou chorobou srdeční. U nemocných s chlopenní vadou je indikace dronedaronu dána minimální závažností chlopenní vady a hlavně oběhovou stabilitou ve funkční klasifikaci NYHA I – II.
V případě volby strategie kontroly rytmu bychom měli začínat volbou co nejbezpečnějšího antiarytmika, ač méně účinného, a teprve následně vyzkoušet účinnější, ale méně bezpečnou terapii. U pacientů, u kterých je vznik arytmie jasně vázán na fyzický či psychický stres, bychom měli začít s betablokátorem. U nemocných s chlopenní vadou se AA léčba řídí funkční klasifikací dle NYHA třídy. U nemocných s funkční klasifikací NYHA I a II bez hospitalizace pro SS v posledním měsíci je možné zahájit AA profylaxi FS propafenonem, sotalolem či dronedaronem. U ostatních nemocných s projevy SS, kteří jsou ve funkční klasifikaci NYHA III – IV, nebo u dekompenzovaných nemocných ve funkční klasifikaci NYHA II je lékem volby amiodaron. Ve všech případech je při selhání antiarytmika první volby možno dále přejít k amiodaronu, který by měl být s ohledem na svou extrakardiální toxicitu prakticky vždy až lékem druhé volby.
Kontrola frekvence
V případě kontroly srdeční frekvence při běžící FS je optimální cílová klidová komorová frekvence 80 – 110/ min. Nižší frekvence je třeba dosáhnout u pacientů, kteří jsou při této komorové odpovědi symptomatičtí [17].
Ke kontrole frekvence komor se používají především selektivní betablokátory, jelikož jsou současně indikované k léčbě základního onemocnění (známky zvýšené sympatikotonie, prevence SS v přítomnosti SOS – např. chlopňové vady, přítomnost ischemické choroby srdeční). Kromě betablokátorů se ke kontrole srdeční frekvence používají také nondihydropyridinové kalciové blokátory (verapamil, diltiazem), které však mají negativní inotropní efekt, proto mohou být podávány jen u nemocných bez přítomných známek SS. U nemocných s chlopenní vadou by měly být podány jen v případě kontraindikace či netolerance selektivních betablokátorů. Ke kontrole srdeční frekvence lze podat také digoxin, který nemá negativní inotropní efekt, ale je třeba počítat s tím, že neposkytuje dostatečnou kontrolu srdeční frekvence při zátěži, proto je výhodné jeho podávání společně se selektivními betablokátory, především u pacientů se SS. Tato kombinace je v přítomnosti chlopňové vady optimální pro prevenci zatím nevyjádřeného SS a slouží k účinné blokaci AV převodu u významnějších stenotických vad, u kterých je vyšší frekvence komor výrazně symptomatická.
Nově schválený dronedaron není ke kontrole srdeční frekvence indikován, podobně jako sotalol, který sice souží i k tomuto účelu, nicméně pokud jsou při medikaci sotalolu recidivy perzistentní FS, pak je indikována změna sotalolu za selektivní betablokátor, stejně jako by tomu mělo být u dronedaronu.
Amiodaron je relativně účinný při kontrole srdeční frekvence a lze jej použít ke kontrole srdeční frekvence jako lék druhé volby také u permanentní FS, pokud není možné podat bezpečnější lék. Jeho řada extrakardiálních nežádoucích účinků je v tomto případě vyvážena jeho exkluzivitou u nemocných se SOS v přítomnosti SS.
U nemocných s pokročilou chlopenní vadou, kde není sinusový rytmus udržitelný a kde není dosažitelná ani adekvátní kontrola srdeční frekvence i přes kombinaci výše uvedených medikamentů, je třeba zvážit neselektivní radiofrekvenční ablaci AV uzlu a implantaci trvalého biventrikulárního kardiostimulátoru.
Závěr
Nová evropská doporučení pro nemocné s chlopenními srdečními vadami prakticky vůbec nezmiňují arytmické komplikace chlopenních vad. Je to podmíněno tím, že antiarytmická léčba všech tachyarytmií nemá u jednotlivých chlopenních vad téměř žádná specifika, ale je podmíněna spíše stupněm srdečního selhání v přítomnosti chlopenní vady. Proto by měl být u všech symptomatických tachyarytmií v přítomnosti chlopenní vady při antiarytmické léčbě kladen důraz na prevenci srdečního selhání. Dominantně by se měly preferovat selektivní betablokátory s pozvolným uvolňování a dle stupně srdečního selhání přistupovat ke specifické, čistě antiarytmické léčbě jednotlivých tachyarytmií.
Doručeno do redakce: 16. 7. 2013
Přijato po recenzi: 6. 8. 2013
doc. MUDr. Petr Heinc, Ph.D.
I. interní klinika – kardiologická
FN Olomouc
petr.heinc@fnol.cz
Sources
1. Vahanian A, Alfieri O, Andreotti F at al. Guidelines on the management of valvular heart disease (version 2012). Eur Heart J 2012; 33 : 2451 – 2496.
2. Camm AJ, Kirchhof P, Lip GY et al. Guidelines for the management of atrial fibrillation: the task force for the management of atrial fibrillation of the European Society of Cardiology (ESC). Eur Heart J 2010; 31 : 2369 – 2429.
3. Camm AJ, Lip GY, De Caterina R et al. 2012 focused update of the ESC Guidelines for the management of atrial fibrillation: an update of the 2010 ESC Guidelines for the management of atrial fibrillation. Developed with the special contribution ofthe European Heart Rhythm Association. Eur Heart J 2012; 33 : 2719 – 2747.
4. Lévy S, Breithardt G, Campbell RW et al. Atrial fibrillation: current knowledge and recommendations for management. Working Group on Arrhythmias of the European Society of Cardiology. Eur Heart J 1998; 19 : 1294 – 1320.
5. Kirchhof P, Auricchio A, Bax J et al. Outcome parameters for trials in atrial fibrillation: executive summary. Eur Heart J 2007; 28 : 2803 – 2817.
6. Stewart S, Hart CL, Hole DJ et al. A population‑based study of the long‑term risks associated with atrial fibrillation: 20‑year follow‑up of the Renfrew/ Paisley study. Am J Med 2002; 113 : 359 – 364.
7. Francis GS, Goldsmith SR, Levine TB et al. The neurohumoral axis in congestive heart failure. Ann Intern Med 1984; 101 : 370 – 377.
8. Ramsdale DR, Arumugam N, Singh SS at al. Holter monitoring in patients with mitral stenosis and sinus rhythm. Eur Heart J 1987; 8 : 164 – 170.
9. Heinc P. Kdy léčit komorové extrasystoly. Interní Med 2007; 9 : 448 – 452.
10. Schmidt G, Ulm K, Barthel P et al. Spontaneous variability of simple and complex ventricular premature contractions during long time intervals in patients with severe organic heart disease. Circulation 1988; 78 : 296 – 301.
11. Healey JS, Baranchuk A, Crystal E et al. Prevention of atrial fibrillation with angiotensin‑converting enzyme inhibitors and angiotensin receptor blockers: a meta‑analysis. J Am Coll Cardiol 2005; 45 : 1832 – 1839.
12. Komatsu T, Nakamura S, Suzuki O et al. Long‑term efficacy of combination therapy using antiarrhythmic agents and angiotensin converting enzyme inhibitor in patients with paroxysmal and persistent atrial fibrillation: importance of the timing of administration. J Cardiol 2003; 41 : 73 – 80.
13. Heinc P, Skála T, Táborský M et al. Strategie antiarytmické léčby fibrilace síní u nemocných s chlopenní vadou. Interv Akut Kardiol 2011; 10 : 62 – 66.
14. Connolly SJ. Evidence‑based analysis of amiodarone efficacy and safety. Circulation 1999; 100 : 2025 – 2034.
15. Hohnloser SH, Crijns HJ, van Eickels M et al. Effect of dronedarone on cardiovascular events in atrial fibrillation. N Engl J Med 2009; 360 : 668 – 678.
16. Kober L, Torp ‑ Pedersen C, McMurray JJ et al. Increased mortality after dronedarone therapy for severe heart failure. N Engl J Med 2008; 358 : 2678 – 2687.
17. Van Gelder IC, Groenveld HF, Crijns HJ et al. Lenient versus strict rate control in patients with atrial fibrillation. N Engl J Med 2010; 362 : 1363 – 1373.
Labels
Paediatric cardiology Internal medicine Cardiac surgery Cardiology
Article was published inCardiology Review

2013 Issue 3-
All articles in this issue
- Katetrizační implantace aortální chlopně (TAVI) – současnost a novinky v roce 2013
- Těhotenství u pacientek s chlopenními náhradami
- Těhotenství u pacientek s vrozenými srdečními vadami
- Extrasystoly – Arytmie a možnosti léčby v kontextu chlopenních vad
- Několik poznámek k historii kardiochirurgie
- Levosimendan a renální funkce
- Vybrané aspekty filozofie kardiologické péče
- Diagnostika aortální stenózy
- Nové směry v chirurgické léčbě aortální stenózy
- Vztah vlny L transmitrálního průtoku a vlny L’ pohybu mitrálního anulu k tlaku v zaklínění v plicnici u pacientů s dilatační kardiomyopatií
- Cardiology Review
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Diagnostika aortální stenózy
- Extrasystoly – Arytmie a možnosti léčby v kontextu chlopenních vad
- Katetrizační implantace aortální chlopně (TAVI) – současnost a novinky v roce 2013
- Několik poznámek k historii kardiochirurgie
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

