-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaBarakatov syndróm
Barakat syndrome
Barakat syndrome, also known as HDR syndrome, is a clinically heterogenous, autosomal dominant rare genetic disease, which frequency is unknown. It is primarily caused by deletion of chromosome 10p14 or mutation of GATA3 gene, located on chromosome 10. Although this syndrome is phenotypically defined by its triad of HDR: hypoparathyroidism (H), deafness (D), renal disease (R), the literature identifies cases with different components, consisting of HD, DR, HR (1). The syndrome was first described by Amin J. Barakat et al. in 1977 in siblings with hypocalcemia and proteinuria (2). So far, about 180 cases have been reported in the worldwide medical literature (3). In this report we present our own case report of patient with Barakat syndrome with hypoparathyrodism, unilateral deafness and renal impairment.
Keywords:
deafness – hypocalcemia – Barakat syndrome – GATA3 – HDR syndrome – hypoparathyroidism – chromosome 10p – renal disease
Autoři: Beáta Arciniegas Berkešová 1,2; Zoltán Borbély 2,3
Působiště autorů: Endokrinologická ambulancia Kliniky vnútorného lekárstva II, FNsP Nové Zámky 1; Klinika vnútorného lekárstva II, FNsP Nové Zámky 2; Nefrologická ambulancia Kliniky vnútorného lekárstva II, FNsP Nové Zámky 3
Vyšlo v časopise: Vnitř Lék 2023; 69(E-3): 16-19
Kategorie: Kazuistiky
doi: https://doi.org/10.36290/vnl.2023.036Souhrn
Barakatov syndróm, tiež známy aj ako HDR syndróm, je klinicky heterogénne, extrémne zriedkavé, autozómovo dominantne dedičné ochorenie, ktorého frekvencia výskytu nie je známa. Primárne je spôsobený deléciou chromozómu 10p14 alebo mutáciou GATA3 génu, ktorý je umiestnený na 10. chromozóme. Hoci fenotypovo je definovaný triádou
HDR: hypoparatyreóza (H), hluchota (deafness; D), postihnutie obličiek (renal involvement; R), v dostupnej literatúre boli identifikované aj prípady pozostávajúce z jeho jednotlivých komponentov HD, DR, HR (1). Syndróm bol prvýkrát opísaný Amin J. Barakatom v r. 1977 u súrodencov s hypokalciémiou a proteinúriou (2). Podľa dostupných údajov bolo doposiaľ v medicínskej literatúre publikovaných okolo 180 prípadov tohto ochorenia celosvetovo (3). V tomto článku prezentujeme vlastnú kazuistiku pacienta s Barakatovým syndrómom s hypoparatyreózou, unilaterálnou hluchotou a obličkovým postihnutím.
Klíčová slova:
hluchota – hypokalciémia – Barakatov syndróm – GATA3 – HDR syndróm – hypoparatyreóza – chromozóm 10p – obličková choroba
Úvod
Barakatov syndróm je známy aj ako HDR syndróm – hypoparatyreóza, hluchota, postihnutie obličiek (4). Jednotlivé príznaky sa môžu manifestovať v akomkoľvek veku a nemusia sa objaviť súčasne. Hypoparatyreóza sa opisuje až u 93 % pacientov, hluchota, zväčša bilaterálna, rôzneho rozsahu od miernej až po úplnú u 96%, postihnutie obličiek u 72 % a zahŕňa kongenitálne anomálie obličiek a uropoetického traktu (polycystické obličky, dysplázie, obličková aplázia, hypoplastické obličky, deformity kalicho‑panvičkového systému, vezikoureterálny reflux), chronickú obličkovú chorobu, nefrotický syndróm, hematúriu, proteinúriu a iné. Barakatov syndróm sa spája aj s postihnutím iných orgánov, z ktorých najčastejšími sú vrodené vývojové srdcové chyby, tvárové a očné abnormality, časté sú kalcifikáty bazálnych ganglií, psoriáza, poruchy rastu, postihnutie kognitívnych funkcií, boli publikované ojedinelé prípady pacientov s Barakatovým syndrómom s pylorostenózou, polycystickými ováriami, rekurentnými cievnymi mozgovými príhodami (5).
Kazuistika
Prezentujeme prípad 39-ročného pacienta, ktorý bol akútne prijatý na naše pracovisko pre protrahované hnačky, vracanie, bolesti hrdla, kašeľ, febrility v domácom prostredí. Pri príjme udával intenzívny tras horných končatín, parestézie a kŕče prstov rúk v trvaní cca 5 dní pred príjmom, nemožnosť samostatnej chôdze, len s oporou, inkontinenciu moču a stolice. Cestou urgentného príjmu bol vyšetrený neurológom, realizované CT vyšetrenie mozgu bolo bez akútnych ložiskových zmien, bez expanzívnych prejavov, ako vedľajším bol nález hrubých symetrických kalcifikačných zmien centrálnej časti cerebella, bazálnych ganglií a talamu, a naznačených kalcifikačných zmien centrum semiovale.
Pri príjme bol pacient pri vedomí, výrazne schvátený, so spastickým držaním tela, dyzartrický, kontakt s ním bol sťažený pre hypakúziu, prítomný bol tras horných končatín, viac vľavo, tras dolnej pery, bol výrazne zahlienený, sila stisku bola bilaterálne slabšia, prítomná bola stuhnutosť šije. Krvný tlak pri príjme bol 110/70 mmHg, pulzová frekvencia 90/min., na EKG bol zaznamenaný sínusový rytmus, fyziologická EKG krivka, telesná teplota bola 36,7 °C (po podaní metamizolu 500 mg intravenózne v RZP počas transportu), telesná výška 182 cm, hmotnosť 80 kg, BMI 24,2 kg/m².
Z osobných anamnestických údajov: pacient liečený na artériovú hypertenziu, obsedantno‑kompulzívnu poruchu, podľa heteroanamnestických údajov od rodičov mu bola v dvoch rokoch veku aplikovaná injekcia streptomycínu, odvtedy diagnostikovaná parciálna hluchota na ľavé ucho – aktuálne načúvací prístroj, údajne už od detstva bola prítomná asymetria tváre s poklesom ľavého očného viečka. Lieková anamnéza: amlodipín 5 mg 1-0-0, perindopril 4 mg 1-0-0, sertralín 100 mg 1-0-0, pyridoxín 1-1-1, diosmektit 1-1-1, pantoprazol 40 mg 1-0-0, difenoxylát 2,5 mg 1-1-1. Z rodinnej anamnézy stojí za zmienku, že u vtedy 19-mesačnej dcéry pacienta bola diagnostikovaná porucha sluchu a solitárna oblička. Matka pacienta mala vo veku 42 rokov diagnostikovaný karcinóm hrubého čreva, jej brat zomrel vo veku 41 rokov na karcinóm hrubého čreva, jej sestra mala v tom čase zistenú hematologickú malignitu (bližšie nešpecifikovanú) a karcinóm prsníka. Rakovina hrubého čreva bola diagnostikovaná aj u dvoch súrodencov maternálneho starého otca. V paternálnej línii boli zaznamenané len sporadické onkologické, kardiovaskulárne a neurodegeneratívne ochorenia. Rodičia si nie sú konsangvinity vedomí, nepochádzajú z rovnakých obcí.
V tabuľke uvádzame niektoré z vyšetrených laboratórnych parametrov a ich referenčné hodnoty (pre prehľadnosť tabuľky neuvádzame hodnoty parametrov s výsledkom v medziach referenčných noriem) (Tab. 1).
Tab. 1. Prehľad vybraných laboratórnych parametrov 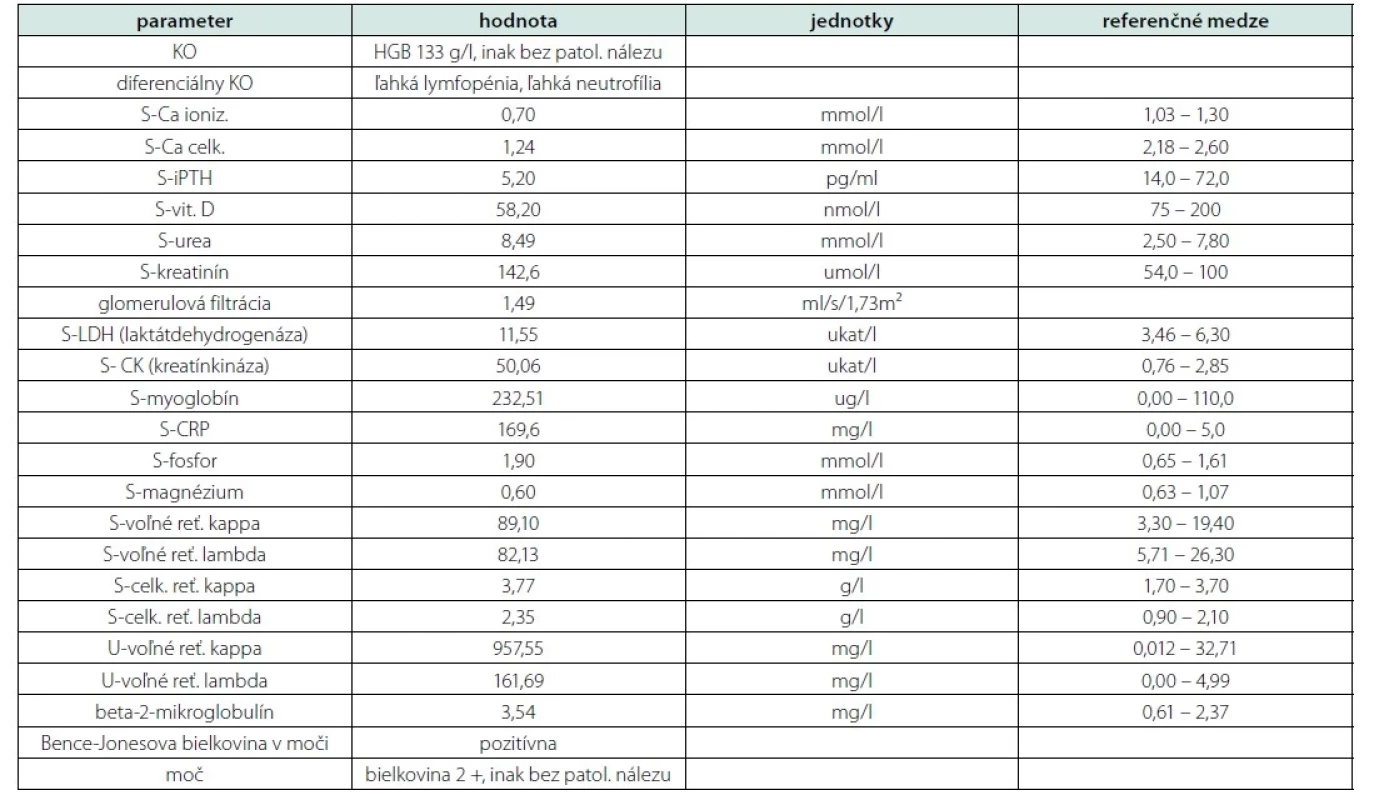
Od prijatia sme pacienta parenterálne hydratovali, v rámci diferenciálnej diagnostiky febrilít sme odobrali materiál na kultivačné vyšetrenia, empiricky sme zahájili antibiotickú liečbu treťogeneračným cefalosporínom (cefotaxime). Pre výraznú neurologickú symptomatológiu a podozrenie na možnú neuroinfekciu sme opakovane konzultovali neurológa, ktorý realizoval punkciu likvoru. Na základe mikrobiologického vyšetrenia likvoru sme podozrenie na neuroinfekciu nepotvrdili.
Neurologickú symptomatológiu po vylúčení neuroinfekcie sme preto dali do súvislosti so závažnou hypokalciémiou. Pri dôslednom monitoringu vitálnych funkcií sme zahájili parenterálnu substitúciu kalcia (calcium gluconicum) a magnézia (magnesium sulfuricum). Vzhľadom na nízku koncentráciu iPTH sme stav hodnotili ako primárnu hypoparatyreózu. Nakoľko pacient mal negatívnu anamnézu operácie alebo ožiarenia v oblasti krku, doplnili sme krčnú ultrasonografiu, ktorá bola bez patologického nálezu na štítnej žľaze, prištítnych telieskach, ako aj lymfatických uzlinách.
Pre pretrvávajúce febrility a nelepšenie stavu sme v ďalšom priebehu pridali do antibiotickej dvojkombinácie ciprofloxacín. Za účelom vylúčenia fokálnej infekcie (suspektné abscesové ložisko) sme doplnili CT vyšetrenie hrudníka, brušnej dutiny a malej panvy, kde boli popísané známky kolitídy, mierna poróza skeletu difúzne, suspektná cholecystolitiáza, steatóza pečene, nevýrazné pozápalové dystelektázy bazálnych segmentov pľúc (segmenty 10) bilaterálne s miernym zhrubnutím pleury. Pre klostrídiovú enterokolitídu (pozitivita glutamátdehydrogenázy a toxínu A) sme do liečby pridali metronidazol.
Vzhľadom na zvýšenú sérovú hladinu voľných ako aj celkových reťazcov kappa a lambda, zvýšenú hladinu beta-2-mikroglobulínu, ako aj prítomnosť Bence‑Jonesovej bielkoviny v moči sme konzultovali hematológa, realizovaná bola punkcia kostnej drene, na základe ktorej suspekcia z mnohopočetného myelómu nebola potvrdená.
Stav pacienta bol v ďalšom priebehu výrazne zlepšený, pacient bol afebrilný, s kompletne vymiznutou neurologickou symptomatológiou, pričom došlo k úplnej regresii trasu horných končatín, ako aj kŕčov prstov rúk, taktiež došlo k úprave reči (pacient bol bez dyzartrie), schopnosti samostatnej chôdze, došlo taktiež k obnoveniu schopnosti udržania moču a stolice. V takto klinicky zlepšenom stave sme pacienta na 16. deň hospitalizácie prepustili na perorálnej substitučnej liečbe kalciovým (calcium carbonicum 2-2-2) a magnéziovým preparátom (magnéziumlaktát 470 mg 1-1-1).
Po preštudovaní pacientovej dokumentácie sme sa dozvedeli, že pacient od detstva trpel recidivujúcimi hnačkami, intermitentnými kŕčovitými bolesťami brucha a kŕčmi kostrového svalstva, ako aj recidivujúcimi infekciami dýchacích ciest. Vo veku 3,5 roka bol hospitalizovaný na pediatrickom oddelení pre vracanie, hnačky, odmietanie perorálneho príjmu. Hladina kalciémie v dostupnej prepúšťacej správe uvedená nebola. Vo veku 4 rokov rodičia pacienta upozornili na zhoršenie sluchu, opakovane bol všeobecným lekárom odosielaný na otorinolaryngologické vyšetrenie, ktoré napokon pacient absolvoval vo veku 6 rokov s nálezom bilaterálnej percepčnej poruchy sluchu, od uvedeného veku mal pacient načúvací prístroj. Vo veku 11 rokov mu bola audiometrickým vyšetrením zistená symetrická strata sluchu v rečových frekvenciách 60 − 70 decibelov. V dostupnej dokumentácii bola prvýkrát zmienená hladina celkovej kalciémie v 13. roku veku pacienta (Ca 2,04 mmol/l), keď bol akútne prijatý na pediatrické oddelenie počas školského výletu, počas ktorého u neho došlo k rozvoju epizódy kŕčov prstov oboch rúk a slabosti pravej dolnej končatiny. Stav bol hodnotený ako tranzitórna hypokalcemická tetánia s odporúčaním užívania kalciového preparátu (bližšie neuvedené). Následne v dokumentácii nachádzame ďalšie ojedinelé vyšetrenia hladiny celkovej kalciémie − vo veku 15 rokov Ca 1,9 mmol/l, ďalej až vo veku 33 rokov Ca 1,76 mmol/l, Mg 0,68 mmol/l. Zmienka o vyšetrení hladiny vitamínu D či iPTH v dokumentácii uvedená nebola, taktiež nebola uvádzaná prípadná substitučná liečba hypokalciémie a hypomagneziémie. Vo veku 34 rokov bol pacient hospitalizovaný na internom oddelení pre akcelerované hodnoty krvného tlaku po tom, čo bol priamym účastníkom autonehody. Vyšetrená hladina celkovej kalciémie pri príjme bola 1,83 mmol/l, hladina magneziémie 0,69 mmol/l. V čase prepustenia boli hladiny kalciémie a magneziémie 2,23 mmol/l a 1,27 mmol/l v uvedenom poradí. Počas tejto hospitalizácie bolo realizované aj CT vyšetrenie mozgu, ktoré preukázalo bilaterálne početné infra - a supratentoriálne kalcifikácie. Pacient bol prepustený s odporúčaním substitúcie magnézia (magnéziumlaktát 500 mg 1-0-0). O nasledujúcom období až do času hospitalizácie na našom oddelení máme minimálne množstvo informácií z dokumentácie − pacient v tomto období opakovane navštevoval všeobecného lekára pre recidivujúce infekcie dýchacích ciest, pre zmeny nálad absolvoval psychiatrické vyšetrenie, kde bol stav hodnotený ako obsedantno‑kompulzívna porucha, s odporúčaním antidepresívnej liečby.
Na základe anamnestických údajov, klinického stavu, ako aj laboratórnych nálezov a pomocných vyšetrení, sme vyslovili podozrenie na Barakatov syndróm. Pacienta sme konzultovali na ambulancii lekárskej genetiky FN Nitra, kde pacient následne podstúpil genetické vyšetrenie. Metódami klasickej chromozómovej analýzy bol stanovený karyotyp bez numerickej a štrukturálnej chromozómovej anomálie, t. delécia v oblasti 10p14 chromozómu, asociovaná s HDR syndrómom, genetickou analýzou potvrdená nebola. Súčasne bola v kauzálnej súvislosti s Barakatovým syndrómom uskutočnená molekulárno‑genetická analýza génu GATA3. Uvedeným testovaním bola v exóne 4 daného génu identifikovaná prítomnosť potenciálne patologického variantu c.811 T>C (p. Ser271Pro) v heterozygotnom stave. Aj keď uvedený variant nie je doposiaľ evidovaný v dostupných databázach, na základe predikčných softvérov sa predpokladá jeho patologický efekt, t. asociácia s fenotypom pacienta. Barakatov syndróm bol teda genetickým vyšetrením potvrdený.
Diskusia
Barakatov syndróm bol prvýkrát opísaný Amin J. Barakatom v r. 1977. Neskôr sa v literatúre objavilo niekoľko kazuistík, ktoré potvrdili, že Barakatov syndróm je asociovaný so širokým fenotypovým spektrom (6-10), pozostávajúcim z hypoparatyreózy, senzorineurálnej hluchoty a renálneho postihnutia v rôznom rozsahu. Môže sa manifestovať v akomkoľvek veku, najčastejšie symptomatológiou súvisiacou s hypokalciémiou v zmysle tetánie, alebo afebrilných kŕčov. Strata sluchu je obvykle bilaterálna (no môže byť aj unilaterálna) v rozsahu od ľahkej až po závažnú stratu sluchu. Postihnutie obličiek zahŕňa nefrotický syndróm, cystické obličky, renálne dysplázie, hypoplázie alebo aplázie obličiek, deformity kalicho‑panvičkového systému, vezikoureterálny reflux, chronickú obličkovú chorobu, hematúriu, proteinúriu.
Nami prezentovaný pacient mal v rôznom rozsahu vyjadrené všetky prejavy z typickej triády HDR – parestézie a kŕče prstov horných končatín, tras horných končatín, stuhnutosť šije ako aj spasticita celého tela s neschopnosťou samostatnosti pri chôdzi, strata tonusu sfinkterov. Kalcifikácie v dôsledku hypoparatyreózy primárne vznikajú v bazálnych gangliách, nuclei dentati, v mozgovej kôre a centrum semiovale. U nášho pacienta bol CT nález hrubých kalcifikátov cerebella ako aj bazálnych ganglií a talamu, a naznačené kalcifikačné zmeny centrum semiovale. V dôsledku hypoparatyreózy sú u pacientov pozorované neurologické a psychiatrické odchýlky zahŕňajúce vertigo, porušené kognitívne funkcie, depresie. Nami prezentovaný pacient má v anamnéze obsedantno‑kompulzívnu poruchu a je roky v sledovaní a liečbe psychiatrom.
Porucha sluchu v zmysle senzorineurálnej hluchoty na ľavé ucho u nášho pacienta bola diagnostikovaná v detstve, a bola dávaná do súvislosti s podaním injekcie streptomycínu v dvoch rokoch veku. V kontexte s potvrdeným Barakatovým syndrómom stratu sluchu hodnotíme ako geneticky podmienenú. Pacient má v súčasnosti načúvací prístroj na ľavom uchu.
Ľahkú hyperazotémiu počas hospitalizácie u nášho pacienta sme pôvodne pripísali dehydratácii pri hnačkách, obličky v CT obraze boli bilaterálne ortotopické, bez parenchýmových a centrálnych zmien, odporučili sme však pravidelné kontroly obličkových funkcií a dispenzarizáciu nefrológom.
Pacient je v súčasnosti sledovaný v nefrologickej ambulancii nášho pracoviska pre chronickú obličkovú chorobu štádia G2A1 (KDIGO) a taktiež v našej endokrinologickej ambulancii. Pri opakovaných kontrolách sú hladiny kalciémie a magneziémie na substitučnej liečbe uspokojivé (dlhodobo v liečbe magnéziumlaktát 500 mg 1-1-1, calcium carbonicum 2-2-2, alfakalcidol 1ug 0-0-1). Pacient je toho času zamestnaný, fyzicky pracujúci, obmedzenia vyplývajúce z jeho ochorenia v bežnom osobnom a pracovnom živote, ani pri stresovej záťaži nepociťuje.
Záver
Rozhodli sme sa publikovať túto kazuistiku pre zriedkavosť tohto ochorenia. Podľa dostupných údajov bolo v medicínskej literatúre publikovaných celosvetovo okolo 180 prípadov pacientov s Barakatovým syndrómom (1).
Diagnostika Barakatovho syndrómu sa zakladá predovšetkým na klinickom obraze a laboratórnych vyšetreniach. DNA analýza môže odhaliť prítomnosť submikroskopickej delécie chromozómu 10p. Genetická analýza je indikovaná u pacientov s obličkovým ochorením v spojení s hypoparatyreózou alebo hluchotou (11). Diferenciálna diagnostika zahŕňa familiárnu idiopatickú hypoparatyreózu, progresívnu senzorineurálnu hluchotu bez obličkového postihnutia (12, 13), autozómovo recesívnu hypoparatyreózu s chronickou obličkovou chorobou a vývojovou poruchou, ako aj DiGeorgov syndróm (delécia 22q11).
Liečba je prevažne symptomatická a závisí od klinických príznakov a ich závažnosti v čase diagnózy. Hypokalciémia, a z nej vyplývajúce klinické prejavy, sú obvykle najzávažnejším problémom vyžadujúcim si liečbu. Možnosti liečby hluchoty spočívajú najmä v používaní načúvacích prístrojov, prípadne implantácii kochleárnych implantátov. Vzhľadom na možné široké spektrum postihnutia obličiek je taktiež nutná celoživotná dispenzarizácia nefrológom.
Pacient z našej kazuistiky je doposiaľ prvým publikovaným prípadom pacienta s Barakatovým syndrómom na Slovensku (v Českej republike bola v r. 2019 prvýkrát publikovaná kazuistika 6-ročnej pacientky s Barakatovým syndrómom na XXII. Medzinárodnom kongrese českých a slovenských osteológov), a ako autori veríme, že sa nám podarí zvýšiť povedomie o výskyte tohto zriedkavého ochorenia.
Článek přijat redakcí: 13. 1. 2023
Článek přijat po recenzích: 12. 4. 2023
MUDr. Beáta Arciniegas Berkešová
Klinika vnútorného lekárstva II b.
Zdroje
1. Barakat AJ, Raygada M, Rennert OM. Barakat syndrome revisited. Am J Med Genet A. 2018 Jun;176(6):1341-1348. doi: 10.1002/ajmg.a.38693. Epub 2018 Apr 16. PMID: 29663634.
2. Barakat AJ, D’Albora JB, Martin MM, Jose PA. Familial nephrosis, nerve deafness, and hypoparathyroidism. J Pediatr. 1977 Jul;91(1):61-4. doi: 10.1016/s0022-3476(77)80445-9.PMID: 874665.
3. Hypoparathyroidism‑sensorineural deafness‑renal disease syndrome. Dostupné z www: <http://orpha.net>
4. Joseph ADD, Sirisena ND, Kumanan T, Sujanitha V, Strelow V, Yamamoto R, Wieczorek S, Dissanayake VHW. Hypoparathyroidism, Sensorineural deafness and renal disease (Barakat syndrome) caused by a reduced gene dosage in GATA3: a case report and review of literature. BMC Endocr Disord. 2019 Oct 28;19(1):111. doi: 10.1186/s12902-019-0438-4. PMID: 31660939; PMCID: PMC6816161.
5. Taslipinar A, Kebapcilar L, Kutlu M, Sahin M, Aydogdu A, Uckaya G, Azal O, Bolu E, Ibrahim Aydin H. HDR syndrome (hypoparathyroidism, sensorineural deafness and renal disease) accompanied by renal tubular acidosis and endocrine abnormalities. Intern Med. 2008;47(11):1003-7. doi: 10.2169/internalmedicine.47.0917. Epub 2008 Jun 2. PMID: 18520110.
6. Muroya K, Hasegawa T, Ito Y, Nagai T, Isotani H, Iwata Y, Yamamoto K, Fujimoto S, Seishu S, Fukushima Y, Hasegawa Y, Ogata T. GATA3 abnormalities and the phenotypic spectrum of HDR syndrome. J Med Genet. 2001 Jun;38(6):374-80. doi: 10.1136/jmg.38. 6. 374. PMID: 11389161; PMCID: PMC1734904.
7. Hasegawa T, Hasegawa Y, Aso T, Koto S, Nagai T, Tsuchiya Y, Kim KC, Ohashi H, Wakui K, Fukushima Y. HDR syndrome (hypoparathyroidism, sensorineural deafness, renal dysplasia) associated with del(10)(p13). Am J Med Genet. 1997 Dec 31;73(4):416-8. doi: 10.1002/(sici)1096-8628(19971231)73 : 4<416:aid‑ajmg9>3. 0. co;2-l. PMID: 9415468.
8. Fujimoto S, Yokochi K, Morikawa H, Nakano M, Shibata H, Togari H, Wada Y. Recurrent cerebral infarctions and del(10)(p14p15.1) de novo in HDR (hypoparathyroidism, sensorineural deafness, renal dysplasia) syndrome. Am J Med Genet. 1999 Oct 29;86(5):427-9. doi: 10.1002/(sici)1096-8628(19991029)86 : 5<427:aid‑ajmg6>3. 0. co;2-i. PMID: 10508983.
9. Hasegawa T., Quoted in Online mendelian Inheritance in Man, Personal communication, John Hopkins University #146255, 1998
10. Nesbit MA, Bowl MR, Harding B, Ali A, Ayala A, Crowe C, Dobbie A, Hampson G, Holdaway I, Levine MA, McWilliams R, Rigden S, Sampson J, Williams AJ, Thakker RV. Characterization of GATA3 mutations in the hypoparathyroidism, deafness, and renal dysplasia (HDR) syndrome. J Biol Chem. 2004 May 21;279(21):22624-34. doi: 10.1074/jbc.M401797200. Epub 2004 Feb 24. PMID: 14985365.
11. Van Esch H, Groenen P, Nesbit MA, Schuffenhauer S, Lichtner P, Vanderlinden G, Harding B, Beetz R, Bilous RW, Holdaway I, Shaw NJ, Fryns JP, Van de Ven W, Thakker RV, Devriendt K. GATA3 haplo‑insufficiency causes human HDR syndrome. Nature. 2000 Jul 27;406(6794):419-22. doi: 10.1038/35019088. PMID: 10935639.
12. Yumita S, Furukawa Y, Sohn HE, Unakami H, Miura R, Yoshinaga K. Familial idiopathic hypoparathyroidism and progressive sensorineural deafness. Tohoku J Exp Med. 1986 Feb;148(2):135-41. doi: 10.1620/tjem.148.135. PMID: 3961795.
13. Watanabe T, Mochizuki H, Kohda N, Minamitani K, Minagawa M, Yasuda T, Niimi H. Autosomal dominant familial hypoparathyroidism and sensorineural deafness without renal dysplasia. Eur J Endocrinol. 1998 Dec;139(6):631-4. doi: 10.1530/eje.0.1390631. PMID: 9916869.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek Finerenon
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2023 Číslo E-3- S MUDr. Štěpánem Budkou o rizicích obezity pro fertilitu ze všech úhlů pohledu
- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- S prof. Vladimírem Paličkou o racionální suplementaci kalcia a vitaminu D v každodenní praxi
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
-
Všechny články tohoto čísla
- Barakatov syndróm
- Finerenon
- Co je nového v doporučeních ESC pro léčbu chlopenních vad?
- Komentář k článku „Jak přesvědčit pacienta odmítajícího kolonoskopické vyšetření – kvalitativní studie“ z psychologického hlediska
- Ústup retroperitoneální fibrózy po léčbě rituximabem, cyklofosfamidem a glukokortikoidy s následnou udržovací léčbou rituximabem
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Finerenon
- Barakatov syndróm
- Ústup retroperitoneální fibrózy po léčbě rituximabem, cyklofosfamidem a glukokortikoidy s následnou udržovací léčbou rituximabem
- Co je nového v doporučeních ESC pro léčbu chlopenních vad?
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



