-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Nově diagnostikovaný diabetes mellitus a úbytek hmotnosti jako manifestace karcinomu pankreatu
New onset of diabetes mellitus and weight loss as a manifestation of pancreatic cancer
The case report is about a 68-years-old man who developed a weight loss and diabetes mellitus as early symptoms of pancreatic cancer several months before the diagnosis. Unfortunately, the diagnosis was made too late, at the stage of generalized disease, when symptomatic treatment was the only possible way. The aim of the article is to warn about this possible way of pancreatic cancer manifestation, because only the diagnosis determined in time, when the tumor is localized, allows its resection - the only curative treatment method. For this reason, it is necessary to consider the presence of pancreatic cancer in the case of an atypical manifestation of diabetes.
Keywords:
Weight loss – Pancreatic cancer – diabetes mellitus
Autoři: Aleš Dvořák; Miroslav Souček
Působiště autorů: II. interní klinika, Fakultní nemocnice u sv. Anny v Brně
Vyšlo v časopise: Vnitř Lék 2022; 68(E-6): 23-27
Kategorie: Kazuistiky
doi: https://doi.org/10.36290/vnl.2022.087Souhrn
Kazuistika popisuje případ 68letého muže, u kterého se několik měsíců před stanovením diagnózy karcinomu pankreatu objevil jako časný příznak úbytek hmotnosti a diabetes mellitus. Diagnóza byla stanovena bohužel pozdě, až ve stadiu generalizovaného onemocnění, kdy nebylo možné pacienta léčit jinak než symptomaticky. Cílem článku je upozornit na tuto možnost manifestace karcinomu pankreatu. Pouze diagnóza stanovená včas v době lokalizovaného nádoru umožňuje resekci tumoru, která je jedinou kurativní léčebnou metodu. Z tohoto důvodu je nutné při netypické manifestaci diabetu pomýšlet také na možnou přítomnost karcinomu pankreatu.
Klíčová slova:
diabetes mellitus – karcinom pankreatu – úbytek hmotnosti
Úvod
V České republice v posledních letech setrvale roste počet pacientů s diagnózou diabetes mellitus (DM). Aktuálně je v naší zemi okolo 1 000 000 osob s tímto onemocněním. DM je při dlouhém trvání, a zvláště při špatné kompenzaci, spojen se vznikem komplikací. Ty dělíme na makrovaskulární (akcelerovaná ateroskleróza vedoucí k ischemické chorobě srdeční, cévní mozkové příhodě, ischemické chorobě dolních končetin) a mikrovaskulární (diabetická neuropatie, nefropatie a retinopatie). Přibližně 93 % představují pacienti s DM 2. typu. Jedná se o civilizační onemocnění související zejména se změnou životního stylu, která nastala v posledních desetiletích. Tyto faktory lze shrnout pod pojmem nezdravý životní styl (sedavý způsob života, nedostatek pohybové aktivity, nadměrný energetický příjem, obezita). Menší skupinou 5 % jsou pacienti s autoimunitním postižením inzulin produkujících B buněk pankreatu – diabetici 1. typu. Ostatní specifické formy diabetu jsou heterogenní skupina tvořící zbývající 2 % pacientů. Patří sem mimo jiné geneticky podmíněný MODY diabetes, DM v rámci endokrinopatií a dále tzv. pankreatoprivní DM (v americké literatuře často označovaný jako typ 3c) (1, 2).
Zástupci ze skupiny DM3c jsou diabetes při chronické pankreatitidě, po resekci pankreatu, při cystické fibróze, hemochromatóze a diabetes vyvolaný karcinomem pankreatu (KP). Ten však znamená pro pacienta výrazně horší prognózu ve srovnání s ostatními formami nově diagnostikovaného DM. Jeho podíl je 7–9 % z celkového počtu pacientů s DM 3c (2, 3). Patogeneze DM při KP se od ostatních zástupců této skupiny liší. Zde se nejedná o poškození B‑buněk pankreatu. Jde jak o poruchu glukózou stimulované sekrece inzulinu, tak i o periferní inzulinovou rezistenci, která je způsobena uvolňováním diabetogenních působků z nádoru. Tento fakt dokládá zlepšení glukózového metabolismu ověřené pomocí orálního glukózového tolerančního testu (oGTT) u pacientů po resekci KP (4). Zástupcem zmíněných faktorů je například cytokin MIF (faktor inhibující migraci makrofágů). Jeho zvýšené hladiny naproti tomu nebyly nalezeny u pacientů s tumorem pankreatu bez diabetu a pacientů s diabetem 2. typu bez tumoru pankreatu. Dalším je adrenomedullin – inhibitor sekrece inzulinu. Ten navíc aktivuje prostřednictvím hormon senzitivní lipázy lipolýzu v adipocytech, což vede ke snížení zásoby podkožního tuku a poklesu hmotnosti, který je pozorován jako symptom KP (3). Jako diabetogenní faktor byl dále popsán peptid homologní s S-100 kalcium vážícím proteinem a interleukin 6 (4). Pro DM 3c při KP jsou charakteristické abnormální koncentrace některých hormonů, které se podílejí na regulaci glykemie. V případě normálních bazálních plazmatických koncentracích se může porucha projevit v patologické hladině po stimulaci stravou. Nalézáme snížené hladiny pankreatického polypeptidu, inzulinu a inzulinotropního peptidu závislého na glukóze (3).
Tumor pankreatu je prognosticky jeden z nejhorších tumorů vůbec. Pětileté přežití se pohybuje kolem 5 %. Tento fakt dokládají křivky incidence a mortality, které se od sebe, na rozdíl od jiných nádorů, příliš nevzdalují. Incidence tohoto onemocnění se za posledních 40 let zdvojnásobila na hodnotu 22 a mortalita na 19 na 100 000 obyvatel za 1 rok. Naší zemi náleží v Evropě smutné prvenství v incidenci tohoto nádoru (5).
Přibližně 90 % tumorů pankreatu představuje duktální adenokarcinom (1). Rizikovými faktory jsou vyšší věk, obezita, nadměrný příjem alkoholu, nedostatek pohybové aktivity, kouření a také diabetes mellitus. Dále je to výskyt tumoru pankreatu u prvostupňového příbuzného, nosičství mutace BRCA 1 a 2, chronická pankreatitida, cystická fibróza, Peutz‑Jeghersův syndrom a Lynchův syndrom (6, 7).
Graf 1. Vývoj incidence a mortality, upraveno podle (5) 
U pacientů s DM má karcinogenní vliv hyperglykemie, která vede k oxidačnímu stresu, glykaci proteinů a chronickému zánětu. Nádorové buňky mají na svém povrchu receptory, které mohou být aktivovány glykovanými proteiny. Zmíněné pochody usnadňují nádoru jeho klíčové vlastnosti – proliferaci, invazivní růst a tvorbu metastáz. Hyperinzulinemie, která je součástí DM 2. typu u obézních pacientů, je pokládána za faktor podporující růst nádorových buněk obecně. Proliferaci nádorových buněk podporují i hormony produkované tukovou tkání – adipokiny (např. leptin). Jistě není překvapením, že jejich zvýšené hladiny nacházíme u obézních pacientů (3). V případě léčby inzulinem se jako rizikový faktor vzniku nádoru ukázalo prvních 5 let jejího trvání (8).
Tumor pankreatu nemá své specifické symptomy. Jeho příznaky se překrývají s jinými nádory i onemocněními benigní povahy. Patří sem bolest břicha, bolest v zádech, hubnutí až kachexie, průjem, zácpa, nauzea, zvracení, anemie, periferní flebitida a již zmíněná primomanifestace DM nebo prediabetu. Průběh může být i asymptomatický, dokud se neobjeví ikterus následkem obstrukce žlučových cest (3, 7). V době diagnózy je 20 % pacientů v klinickém stadiu I‑II a je u nich možná resekce nádoru. Naproti tomu u poloviny jsou v době diagnózy již přítomny metastázy. Nejčastěji jsou metastázami postiženy spádové mízní uzliny, játra, plíce, peritoneum (6).
K určení rozsahu onemocnění – stagingu, se využívá počítačová tomografie (CT) s použitím kontrastní látky nebo magnetická rezonance (MR). Odběr vzorku na histologické určení tumoru je, kromě samotné resekce tumoru, možný i metodou endoskopické sonografie (EUS) s aspirační biopsií tenkou jehlou. Další využití EUS je popis vztahu tumoru k okolním strukturám (6). Nádorový marker Ca 19-9 by neměl sloužit k diagnostice karcinomu pankreatu, jeho využití je spíše k monitorování efektu protinádorové terapie a odhalení relapsu onemocnění u pacientů v remisi. Jeho plazmatické hodnoty jsou zvýšené i při jiných hepatobiliárních onemocněních (biliární infekci nebo obstrukci žlučových cest nenádorové etiologie) či jiných tumorech (7).
Strategie léčby se odvíjí od stadia onemocnění a klinického stavu pacienta. Jedinou kurativní metodou je resekce nádoru (7). K operaci jsou indikováni pacienti s dobrým KS a lokalizovaným tumorem. Po ní je doporučeno pokračovat v adjuvantní chemoterapii. U lokálně pokročilého tumoru pacienti podstoupí nejdříve neoadjuvantní chemoterapii nebo radioterapii. V případě příznivého efektu této iniciální léčby následuje resekce nádoru. Pacienti s metastatickým postižením a dobrým KS jsou léčení paliativní chemoterapií, případně jsou chirurgicky řešeny komplikace způsobené tlakem nádoru na okolní orgány. Pacienti se špatným KS a generalizovaným tumorem jsou léčeni symptomaticky. V případě tumoru v hlavě pankreatu je často nutné pro obstrukční ikterus zajistit drenáž žlučových cest. U pacientů s dobrým KS a předpokládanou dobou přežití delší než půl roku vychází lépe operační řešení. Dalším možným způsobem zprůchodnění žlučových cest je ERCP a PTD (9).
Jsou používány následující způsoby chirurgického řešení – pankreaticoduodenectomie pro tumory hlavy, distální pankreatektomie pro tumory kaudy a totální pankreatektomie. Tyto metody zahrnují i resekci spádových lymfatických uzlin, první jmenovaná v některých případech i resekci horní mesenterické žíly a blízkých arterií. Druhá zmíněná operace zase splenektomii, před kterou je nutné podstoupit nezbytná očkování. Po totální pankreatektomii pacient přijde o exokrinní funkci pankreatu a stává se inzulin dependentním diabetikem (9).
V současné době používaný protokol chemoterapie FOLFIRINOX zahrnuje fluorouracil, folinovou kyselinu, irinotecan a oxaliplatinu. Dále je používána léčba gemcitabine a albumin‑paclitaxel. U pacientů s mutací BRCA 1 a 2 a PALB 2 se podává gemcitabin a cisplatina (10). Protokol FOLFIRINOX zlepšil dlouhodobé přežití pacientů s pankreatickým tumorem. Pokroku bylo dosaženo zvláště v oblasti neoadjuvantní léčby u pacientů s lokálně pokročilým tumorem. Díky němu se zvýšil počet nádorů vhodných k resekci. Dalším benefitem je časná léčba mikroskopických metastáz a prevence situace, kdy by pooperační komplikace zabránily podání chemoterapie (11). Pacientům s karcinomem pankreatu a prokázanou BRCA mutací je již možno podávat i cílenou léčbu inhibitory PARP proteinů – olaparib. Jedná se látku, která omezuje schopnost opravovat poškození DNA, což následně vede k apoptóze buňky. Další zástupce veliparib je zatím testován. U této skupiny látek byla prokázána i schopnost indukovat citlivost k chemoterapii a radioterapii. Dalším zkoušeným preparátem u pacientů s vhodným genetickým profilem nádoru je pembrolizumab, který se nyní používá například k léčbě maligního melanomu a nemalobuněčného plicního karcinomu (11, 12). Léčebné metody imunoterapie se u karcinomu pankreatu neprokázaly jako účinné, i když se např. u maligního melanomu a některých dalších malignit úspěšně používají (13).
Za nepříznivou prognózu, rychlou progresi onemocnění a špatnou odpověď karcinomu pankreatu k léčbě je do jisté míry zodpovědné samotné mikroskopické prostředí nádoru. Nádorové buňky spouští přes signální molekuly kaskádu dějů, na jejímž konci je aktivace buněk schopných potlačovat imunitní odpověď vůči tumoru. Tato vlastnost se v případě progrese onemocnění a rezistence k imunoterapii jeví jako klíčová (14).
Popis případu
V následující kazuistice si popíšeme případ 68letého muže, který se dosud léčil pouze s arteriální hypertenzí, na kterou užíval monoterapii lékem ze skupiny ACEi. Během prohlídky u praktického lékaře v srpnu 2021 byl diagnostikován diabetes mellitus a zároveň i nasazena terapie metforminem v dávce 500 mg 1× denně.
O měsíc později se pacient dostavil na doporučení praktického lékaře na příjmovou ambulanci 2. IK FNUSA s následujícími obtížemi – nově vzniklé žluté zbarvení očí a kůže, tmavá moč, světlá stolice a dyspeptické potíže. Zejména pocit plnosti po jídle. Dále bylo zjištěno, že vyšší glykemie na lačno byly přítomny již několik měsíců před nasazením léčby. Hodnoty spadaly do pásma prediabetu, při provedeném oGTT nebyl DM prokázán. Pacient rovněž udával úbytek hmotnosti 16 kg za 9 měsíců od začátku roku (z 90 kg na 74 při výšce 180 cm). V objektivním nálezu dominoval ikterus a hepatomegalie 5 cm pod žeberním obloukem. Dle laboratorních vyšetření přítomna hyperbilirubinemie – celkový 292,6 (norma 0–21), přímý 244,2 (norma 0–5) μmol/l a elevace jaterních testů – AST 2,3 (norma 0–0,85), ALT 7,23 (norma 0–0,83), ALP 10,3 (norma 0,72–1,92), GGT 6,55 (norma 0,17–1,19) μkat/l, glykovaný hemoglobin 48 (norma 20–42) mmol/mol. V moči bilirubin (3 arb.j.) a ketolátky (1 arb.j.). V krevním obraze lehká normocytární normochromní anemie s Hb 123 (norma 135 – 175) g/l. Ostatní laboratorní parametry v normě. Následovalo ultrazvukové vyšetření břicha. V játrech nalezena 2 ložiska odlišné echogenity v porovnání s ostatním parenchymem – vs. metastázy. V oblasti hlavy pankreatu ložisko utlačující žlučové cesty, které rozšířeny extra i intrahepatálně. Dále malé množství ascitu.
Pacient byl přijat na standardní oddělení. Provedeno ERCP, při kterém byl zaveden stent do ductus choledochus a odebrána stěrová cytologie. Následně proběhlo stagingové CT vyšetření, kde byl potvrzen tumor hlavy pankreatu s velikostí 36 mm a vícečetné metastázy jater. Metastatická ložiska do jiných orgánů nalezena nebyla. Výsledkem histologického vyšetření z cytologie odebrané při ERCP byl adenokarcinom pankreatobiliárního origa. Po iniciálním terapeutickém zákroku nedošlo k regresi ikteru. Proto bylo ERCP o 5 dní později opakováno. Přestože byly oba zavedené stenty průchodné, tak ani po druhém pokusu nedošlo ke zprůchodnění žlučových cest, které by bylo provázeno poklesem markerů obstrukce žlučových cest, regresí ikteru nebo dilatace žlučových cest na ultrazvuku. Celou situaci navíc komplikoval pacientův postupně se zhoršující klinický stav.
Případ byl referován na mezioborovém indikačním semináři. Chirurgické řešení metastatického tumoru nebylo indikováno. V tomto klinickém stadiu připadala do úvahy jen paliativní chemoterapie. Právě hyperbilirubinemie (ke konci převyšující 400 μmol/l) a špatný KS byly důvody, které chemoterapii kontraindikovaly. Z tohoto důvodu bylo od endosonografického vyšetření s odběrem bioptického vzorku upuštěno a dalším zvoleným postupem byla léčba symptomatická a hospicová.
Obr. 1. Šipka označuje tumor hlavy pankreatu, vlevo od něj stent, četné hypodenzity jater jsou metastázy (se souhlasem publikováno z archivu KZM FNUSA) 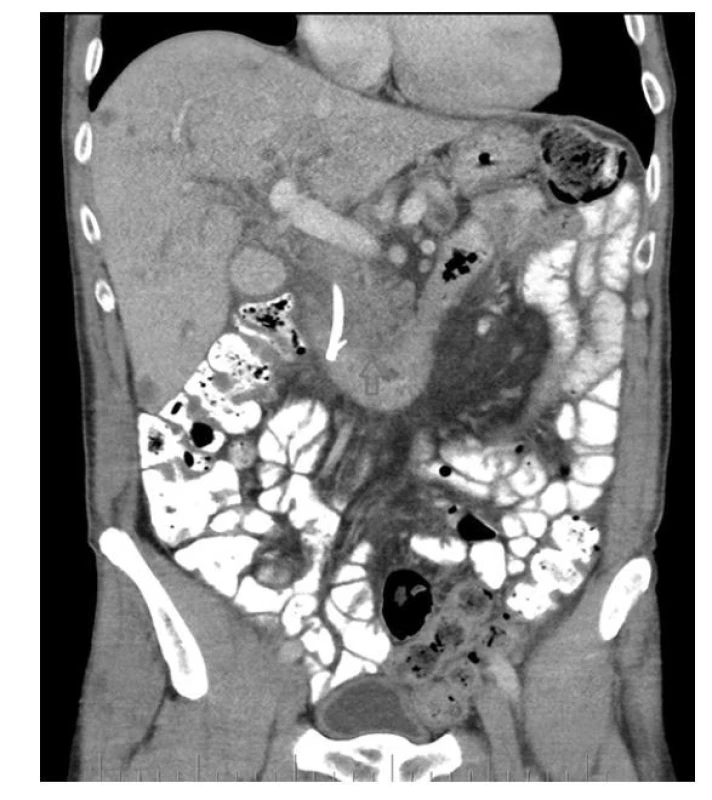
Diskuze
Tumor pankreatu je obtížné zachytit v časných stadiích a v době diagnózy je již bohužel většina pacientů postižena metastázami. Včasná diagnóza, která umožňuje resekci tumoru, je přitom jediným předpokladem úspěšné léčby (3). Plošný screening v populaci není realizovatelný s ohledem na nízkou incidenci tumoru ve srovnání s ostatnímu nádory, u kterých se rutinně provádí. Dalším problémem je chybějící levná a snadná screeningová metoda. U pacientů s genetickou zátěží, která zvyšuje riziko adenokarcinomu pankreatu (familiární výskyt tumoru pankreatu, nosičství mutace BRCA 1 a 2, Peutz‑Jeghersův syndrom a Lynchův Syndrom) by dle doporučení mělo být prováděno od 50 let věku 1× ročně sledování metodou endoskopické sonografie nebo magnetické rezonance, které nezatěžují pacienta ionizujícím zářením (7).
K časnější diagnóze KP je možné využít manifestaci DM 3c. Má to však své limity, protože ne každý pacient s KP má DM. Kontrola glykemie u pacientů nad 50 let každé 2 roky u praktických lékařů je doporučována k časné diagnóze DM. Zvýšená hodnota glykemie na lačno nebo náhodné glykemie během dne by měla vést k dalšímu došetření (oGTT), které může potvrdit diagnózu prediabetu nebo diabetu. Úkolem pro lékaře je potom správně určit, o jakou formu diabetu se jedná. Stanovit diagnózu diabetu 1. typu u dětí a mladistvých zpravidla není problém, i když k omylu může dojít při rozpoznávání diabetu typu MODY (maturity onset diabetes of the young). U starších osob se však diabetes 1. typu manifestuje někdy jako typ LADA (latent autoimmune diabetes of the adult) a kromě diabetu 2. typu může být snadno zaměněn s diabetem typu 3c. Diagnostické může být stanovení autoprotilátek, ale těch existuje několik forem a mohou být pozitivní jenom přechodně. Na možnost DM 3c se bohužel vždy nepomýšlí. Pokud je přítomen pokles hmotnosti a je současně vyloučen typ 1, je tu podezření na typ 3c. Toto platí i v případě prediabetu. Naproti tomu typický diabetes 2. typu je spojen s obezitou a nárůstem hmotnosti. Pravděpodobnost DM 2 zvyšuje také rodinná anamnéza tohoto onemocnění (3).
Následující skupiny pacientů by měly být došetřeny pro podezření na KP. Diabetes diagnostikovaný během posledních 2 let a pokles hmotnosti o 2 kg a více. Zvláště rizikový je věk 50 a více let. Dále pacienti, u kterých je iniciální tříměsíční léčba diabetu bez efektu, spolu se stagnací nebo poklesem hmotnosti. Pokud je úvodní léčba bez efektu a není přítomen pokles hmotnosti, měli bychom terapii posílit a vyhodnotit situaci za další 3 měsíce. Když opět nedojde ke zlepšení, a navíc je přítomen úbytek hmotnosti 2 kg a více, je tu podezření na KP. Vzhledem k tomu, že DM je sám rizikovým faktorem KP, je třeba brát vážně i zhoršení kompenzace u již diagnostikovaných diabetiků. A to v posledních 6 měsících, kdy je nově přítomen hmotnostní úbytek 2 kg a více. Tito pacienti by měli být odesláni na vyšší pracoviště, kde se provede test stanovení pankreatického polypeptidu. U DM 3c je jeho hladina obecně snížená. Ať už bazální nebo po stimulaci stravou. Pokud je test pozitivní nebo není k dispozici, dalším krokem je vyšetření zobrazovacími metodami (CT, MR, EUS). V případě suspektního nálezu na zobrazovacích metodách, ale negativním nálezu histologickém, je pacient dále sledován praktickým lékařem nebo diabetologem. Doporučený interval kontrol je 3 měsíce. Sleduje se hmotnost a parametry kompenzace DM. Dále je indikováno opakování zobrazovacích metod. EUS po 6 měsících, MR a CT po 12 měsících (3, 8, 15). Transabdominálním ultrazvukem je pankreas jako orgán uložený retroperitoneálně obtížně dosažitelný, jeho použití je v této situaci proto nevhodné (7).
Výše zmíněný přístup zvyšuje šanci na detekci KP v časnějších stadií, což je velmi důležité (2, 8). Průměrná doba od stanovení diagnózy DM do manifestace KP je 10 měsíců, dle některých zdrojů to může trvat až 3 roky (3, 8). Největší pravděpodobnost, že bude přítomen nádor, je u pacientů, kterým byla porucha metabolismu glukózy diagnostikována v posledních 12 měsících (3).
Správná diagnóza byla u pacienta v této kazuistice stanovena bohužel pozdě, až ve stadiu generalizovaného onemocnění. Tato okolnost spolu se špatným KS již neumožnily podání léčby a pacient nakonec zemřel. Příznaky, které se u něj vyskytovaly (nově diagnostikovaná porucha metabolismu glukózy spolu s úbytkem na váze), jsou alarmující a měly by vést k podezření na KP. Pacient sám hubnutí moc velký význam nepřikládal. Měl z něj naopak dobrý pocit, protože dle svých slov pár kilogramů shodit potřeboval a praktickému lékaři se s tím nesvěřil. O dyspeptických potížích se pacient také nezmínil. Zpočátku se navíc jednalo o potíže mírného charakteru. K jejich výraznému zhoršení až do stavu, kdy téměř nemohl jíst, došlo krátce před vyšetřením v nemocnici. V prvé řadě měl pacient praktického lékaře o svých obtížích sám informovat. Protože tak neučinil, bylo už jen na lékaři, aby zmíněné informace sám aktivně zjistil. Nebo případně vážil pacienta a měl hodnoty ke srovnání. Dle dostupných údajů se totiž glykemie v pásmu prediabetu vyskytovaly již několik měsíců před stanovením diagnózy. To je v kombinaci s poklesem hmotnosti příznak, který by měl vzbudit suspekci na KP. Nálezy, které byly pravděpodobně přítomny už při návštěvě u praktického lékaře, byly i hepatomegalie a zvýšené jaterní testy, přestože zjištěny nebyly. Pokud by díky tomu byla diagnóza KP odhalena ještě před rozvojem ikteru, byla by možnost podat alespoň paliativní chemoterapii. Příležitost pro časnější vyšetření a zlepšení šance na přežití pacienta v tomto případě tedy jistě byla.
Závěr
Počet pacientů s diagnózou diabetes mellitus neustále roste a je nutné mít na paměti, že se za tímto častým onemocněním může skrývat i mnohem závažnější choroba, jako je karcinom pankreatu. Týká se to především pacientů s nově zjištěným prediabetem při úbytku hmotnosti nebo osob s již zjištěným diabetem, jehož kompenzace se bez jinak vysvětlitelných příčin zhoršuje. Dále jsou to pacienti, u kterých se nezlepší kompenzace diabetu do půl roku od nasazení léčby, kdy po 3 měsících byla léčba posílena a zároveň se během tohoto půl roku objeví úbytek hmotnosti. Ve výše zmíněných případech by měl být pacient náležitě vyšetřen. Na včasné diagnostice se podílí především praktický lékař a diabetolog, ale také gastroenterolog či radiolog, kteří by měli být ochotni rizikového pacienta včas vyšetřit. Důležité je na tuto možnost manifestace pankreatického karcinomu nezapomínat a včas uskutečnit potřebná vyšetření.
KORESPONDENČNÍ ADRESA AUTORA:
MUDr. Aleš Dvořák
II. Interní klinika Fakultní nemocnice u sv. Anny v Brně
Pekařská 664/53, 656 91 Brno
Cit. zkr: Vnitř Lék. 2022;68(6):E23-E26
Článek přijat redakcí: 3. 5. 2022
Článek přijat po recenzích: 12. 8. 2022
Zdroje
1. Češka R et al. Interna 3. vydání. Praha/Kroměříž: Triton 2020, 964 stran. ISBN 978-80-7553-782-9
2. Frič P, Šedo A, Škrha J et al. Early detection of sporadic pancreatic cancer: time for change. Eur J Gastroenterol Hepatol. 2017 Aug;29(8):885-891.
3. Škrha J., Frič P., Bušek P. et al., Sporadic Pancreatic Cancer: Glucose Homeostasis and Pancreatogenic Type 3 Diabetes, in Advances in Pancreatic Cancer. London, United Kingdom: IntechOpen, 2018
4. Škrha P., Diabetes mellitus a karcinom pankreatu – příčina nebo následek? Vnitř Lék 2014; 60(9): 787–790.
5. Dušek L, Mužík J, Kubásek M et at. Epidemiologie zhoubných nádorů v České republice. [cit. 2022-6-10]. Dostupný z WWW: http://www.svod.cz.
6. McGuigan A, Kelly P, Turkington RC et al. Pancreatic cancer: A review of clinical diagnosis, epidemiology, treatment and outcomes. World J Gastroenterol. 2018 Nov 21;24(43):4846-4861.
7. Zhang L, Sanagapalli S, Stoita A. Challenges in diagnosis of pancreatic cancer. World J Gastroenterol. 2018 May 21;24(19)2047-2060.
8. Mueller AM, Meier CR, Jick SS et al. Characterization of the deterioration of diabetes control in patients with a subsequent diagnosis of pancreatic cancer: A descriptive study. Pancreatology. 2022 Apr;22(3):387-395.
9. Loveday BPT, Lipton L, Thomson BN. Pancreatic cancer: An update on diagnosis and management. Aust J Gen Pract. 2019 Dec;48(12):826-831.
10. Tempero MA. NCCN Guidelines Updates: Pancreatic Cancer. J Natl Compr Canc Netw. 2019 May 1;17(5.5):603-605.
11. Torphy RJ, Fujiwara Y, Schulick RD. Pancreatic cancer treatment: better, but a long way to go. Surg Today. 2020 Oct;50(10):1117-1125.
12. Zhu H, Wei M, Xu J et al. PARP inhibitors in pancreatic cancer: molecular mechanisms and clinical applications. Mol Cancer. 2020 Mar 2;19(1):49.
13. Morrison AH, Byrne KT, Vonderheide RH. Immunotherapy and Prevention of Pancreatic Cancer. Trends Cancer. 2018 Jun;4(6):418-428.
14. Ren B, Cui M, Yang G et al. Tumor microenvironment participates in metastasis of pancreatic cancer. Mol Cancer. 2018 Jul 30;17(1):108.
15. Sharma A, Kandlakunta H, Nagpal SJS et al. Model to Determine Risk of Pancreatic Cancer in Patients With New‑Onset Diabetes. Gastroenterology. 2018 Sep;155(3):730-739.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek EFIM Academy
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2022 Číslo E-6- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Klinické zkušenosti s použitím novějších antibiotik ve vnitřním lékařství
- Léčba nemocnění asociovaného s imunoglobulinem IgG4
- Nově diagnostikovaný diabetes mellitus a úbytek hmotnosti jako manifestace karcinomu pankreatu
- EFIM Academy
- European Summer School of Internal Medicine (12.–18. 6. 2022, El Escorial, Madrid, Španělsko)
- Vyhodnocení medikačních pochybení v nemocničním prostředí
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Vyhodnocení medikačních pochybení v nemocničním prostředí
- Klinické zkušenosti s použitím novějších antibiotik ve vnitřním lékařství
- Léčba nemocnění asociovaného s imunoglobulinem IgG4
- Nově diagnostikovaný diabetes mellitus a úbytek hmotnosti jako manifestace karcinomu pankreatu
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



