-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Incidentalomy štítné žlázy
Thyroid incidentalomas
Thyroid nodules are very common. Most of them are benign non-secerning incidentally found nodules – thyroid incidentalomas. Ultrasound (US) is an essential initial diagnostic tool in thyroid nodules management. Based on the US character, thyroid nodules should be classified to one of the US risk categories (TIRADS – Thyroid Imaging Reporting and Data System). Based on the US risk category and size, some nodules should be referred to fine needle aspiration with cytological evaluation of the sample (FNAC), some should be followed just by US, and some require no follow-up. Further management depends on the FNAC (Bethesda category) and US risk category. In most nodules (Bethesda category II, repeatedly Bethesda category I, some of the nodules of Bethesda category III), just defensive management is recommended (US and/or clinical follow-up, or no follow-up). Usually, only few cases require diagnostic (Bethesda categories III, IV and V) or therapeutic (Bethesda V and VI) surgery. In decision-making of management of nodules Bethesda category III and V, molecular testing for mutations associated with thyroid cancer and serum calcitonin could be useful.
Keywords:
thyroid cancer – ultrasound – molecular testing – thyroid nodule – TIRADS – fine needle aspiration biopsy – Bethesda classification
Autoři: Jan Jiskra
Působiště autorů: 3. interní klinika 1. LF UK a VFN, Praha
Vyšlo v časopise: Vnitř Lék 2022; 68(7): 465-474
Kategorie: Ve zkratce
doi: https://doi.org/10.36290/vnl.2022.098Souhrn
Tyreoidální uzly jsou velmi časté. Většina z nich je zjištěna náhodně, jsou benigní a bez hormonální nadprodukce – jde o tzv. tyreoidální incidentalomy. Každý tyreoidální uzel má být vyšetřen ultrazvukem (UZ) a podle rizika malignity zařazen do jedné z UZ kategorií (tzv. TIRADS – Thyroid Imaging Reporting and Data System). Podle rizika a velikosti uzlu se pak u některých uzlů indikuje aspirační biopsie tenkou jehlou (FNAB) nebo UZ kontroly. Na výsledku FNAB (Bethesda kategorie) a UZ kategorii (TIRADS) závisí další postup. Ve většině případů (Bethesda II, opakovaně Bethesda I, část Bethesda III) se volí konzervativní postup (sledování klinicky a UZ nebo jen klinicky, nebo vůbec). Jen někdy je nutná diagnostická operace (Bethesda III, IV a V) nebo operace jako terapeutický výkon (Bethesda V a VI). V některých případech, zejména u kategorií Bethesda III a V, může pomoci molekulárně genetické vyšetření ze vzorku FNAB a vyšetření kalcitoninu v krvi.
Klíčová slova:
ultrazvuk – karcinom štítné žlázy – tyreoidální uzel – TIRADS – aspirační biopsie tenkou jehlou – molekulární vyšetření – Bethesda klasifikace
Prevalence tyreoidálních uzlů je vysoká (až 76 % při vyšetření ultrazvukem) (1). Většina uzlů je dnes zjištěna náhodně, díky rostoucímu využití zobrazovacích metod v oblasti krku – jde o tzv. incidentalomy. Naprostá většina z nich jsou uzly benigního charakteru bez hormonální nadprodukce (> 95 %). Paralelně s tím v posledních dekádách stoupá i incidence papilárního karcinomu štítné žlázy (PTC), na čemž se významně podílí i tzv. přediagnostikování malých tumorů (do 1–2 cm), které mají relativně benigní charakter a klinicky by se nijak nemanifestovaly (overdiagnosis) (2). To potvrzuje i skutečnost, že zatímco křivka incidence PTC výrazně stoupá, mortalita zůstává stabilně nízká (Obr. 1) (3). U pacientů ≥ 60 let s papilárním mikrokarcinomem (≤ 1 cm) bylo i bez jakékoliv léčby během sledování (medián 75 měsíců) téměř nulové riziko progrese velikosti či extratyreoidální invaze tumoru (4). Z těchto důvodů je všeobecný trend ke konzervativnějšímu a méně invazivnímu managementu, což se týká jak diagnostiky, tak terapie. U každého pacienta s tyreoidálním uzlem/ uzly se má zhodnotit anamnéza a symptomy (klinické rizikové faktory), vyšetřit štítná žláza a krk (včetně lymfatických uzlin) palpačně, provést ultrazvuk (UZ) štítné žlázy a krku a vyšetřit TSH v séru.
Obr. 1. Vývoj incidence a mortality zhoubných nádorů štítné žlázy v letech 1975–2015. Upraveno podle Welsch et al. 2019 (3) 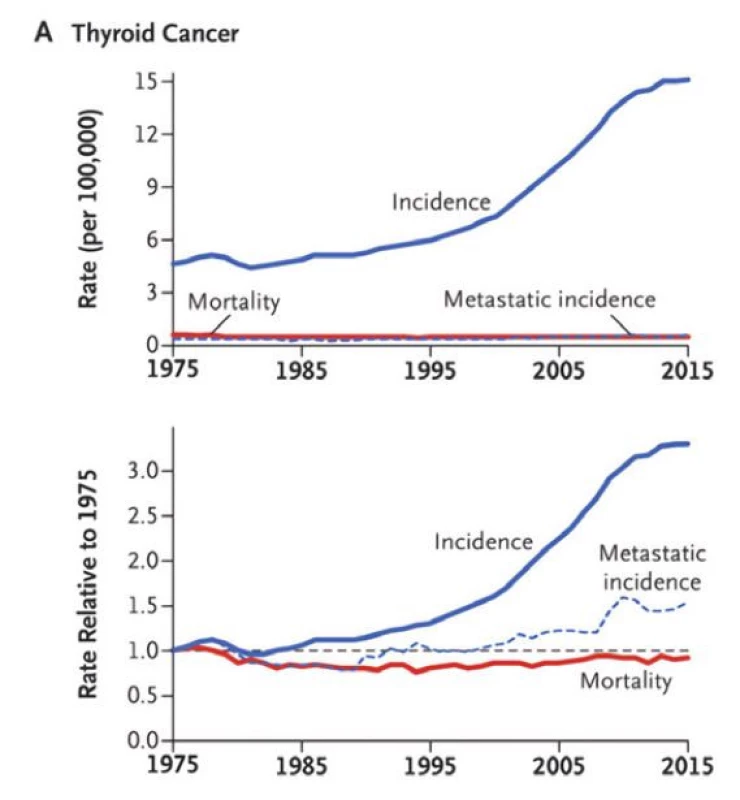
Kategorizace rizika malignity a management tyreoidálních uzlů dle UZ
Za podmínky dostatečné zkušenosti vyšetřujícího a kvalitního přístroje lze z ultrazvuku poměrně dobře odhadnout riziko malignity a určit, u kterých uzlů má být provedena punkce tenkou jehlou (FNAB) a cytologické vyšetření (FNAC). K tomuto účelu byly vypracovány různé stratifikační systémy, jejichž podstata je ale stejná: na základě přítomnosti určitých ultrazvukových charakteristik (kompozice, echogenita, orientace, tvar a okraj, ohraničení, echogenní ložiska a extratyreoidální propagace přímo nebo v podobě patologických lymfatických uzlin) je uzel zařazen do některé z pěti kategorií od téměř nulového rizika malignity (< 1 %, kategorie 1) až po vysoké riziko malignity (50–70 %, kategorie 5). Příklady uzlů v jednotlivých kategoriích jsou na obrázcích 2–7. S rostoucí kategorií a s přihlédnutím k věku a klinickým rizikovým faktorům (Tab. 1) se snižuje cut‑off pro velikost, od které má být provedena FNAB. Přehled těchto klasifikačních systémů (TIRADS – Thyroid Image‑Reporting and Data Systém) je v tabulce 2 a příklady v tabulkách 3, 4 a 5. Senzitivita a specificita jednotlivých systémů se příliš neliší, ačkoliv drobné rozdíly lze zaznamenat a každý systém má své výhody i nevýhody. V meta‑analýze 19 studií s 4696 zařazenými uzly byla u systémů American College of Radiology (ACR‑TIRADS), American Thyroid Association (ATA), Kwak‑TIRADS, Korean Thyroid Association/Korean Society of Thyroid Radiology (KTA/KSThR) a European Thyroid Association (EU‑TIRADS) senzitivita 84–94 % a specificita 44–68 % s tím, že v této meta‑analýze měl nejlepší diagnostickou přesnost systém ACR‑TIRADS (9).
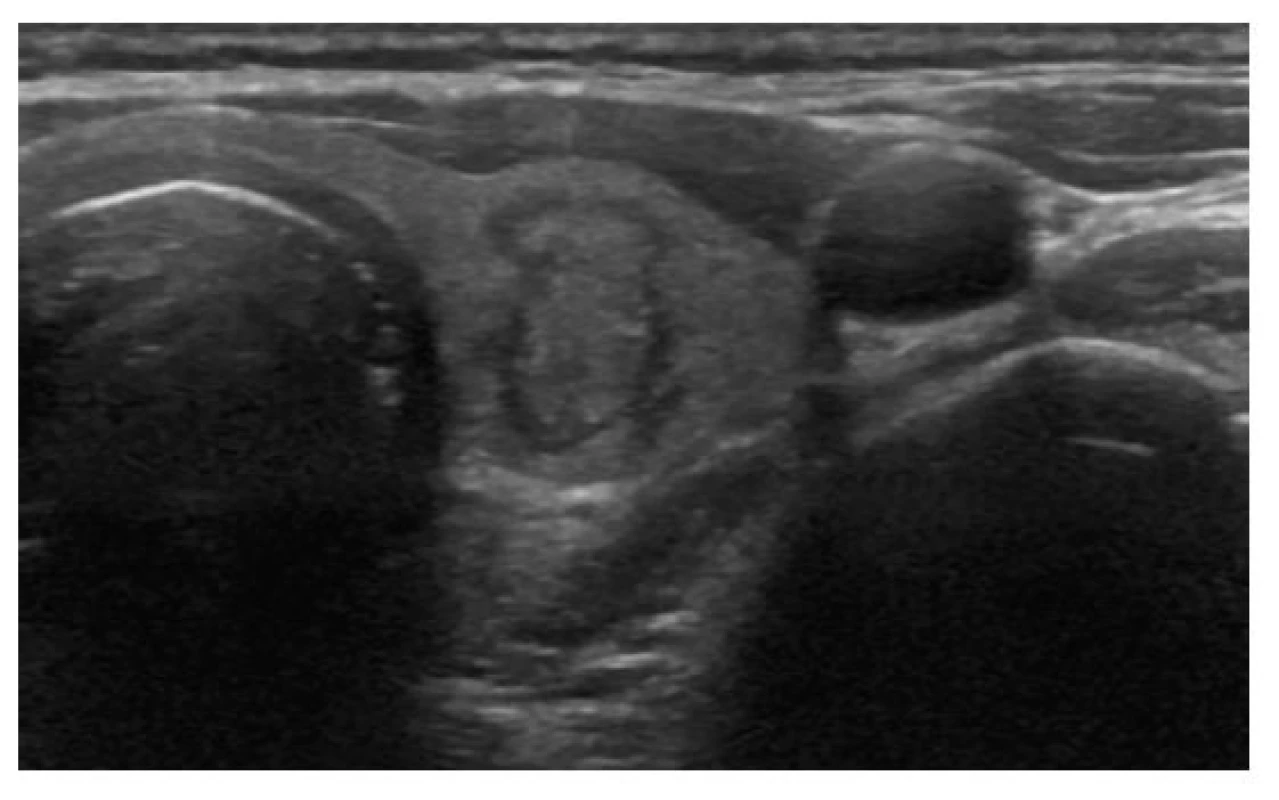
Obr. 2. Cystický/převážně cystický uzel 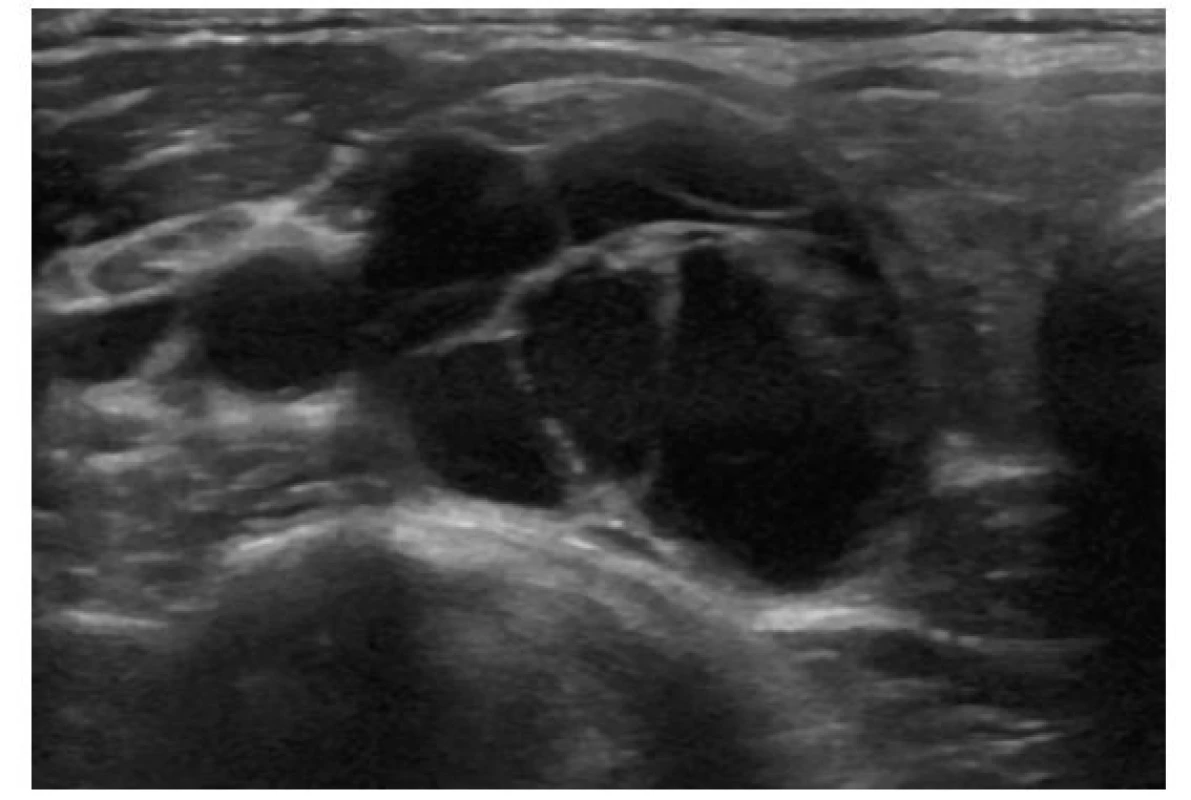
ATA/ČES ČLS JEP: benigní charakter
ACR-TIRADS: TR 1
EU-TIRADS: 2Obr. 3. Spongiformní uzel 
ATA/ČES ČLS JEP: velmi nízká suspekce
ACR-TIRADS: TR 2
EU-TIRADS: 2Obr. 4. Solidní pravidelný isoechogenní uzel 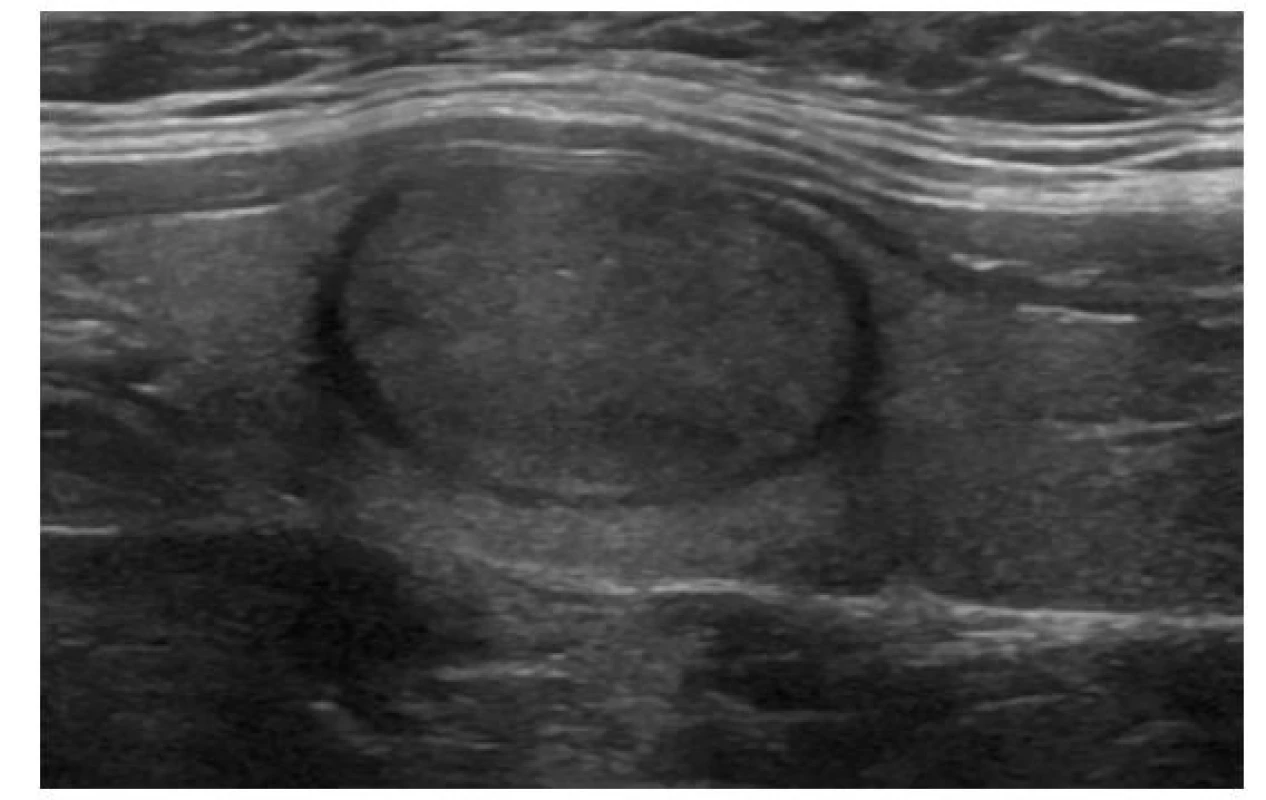
ATA/ČES ČLS JEP: nízká suspekce
ACR-TIRADS: TR 3
EU-TIRADS: 3Obr. 5. Solidně-cystický pravidelný isoechogenní uzel 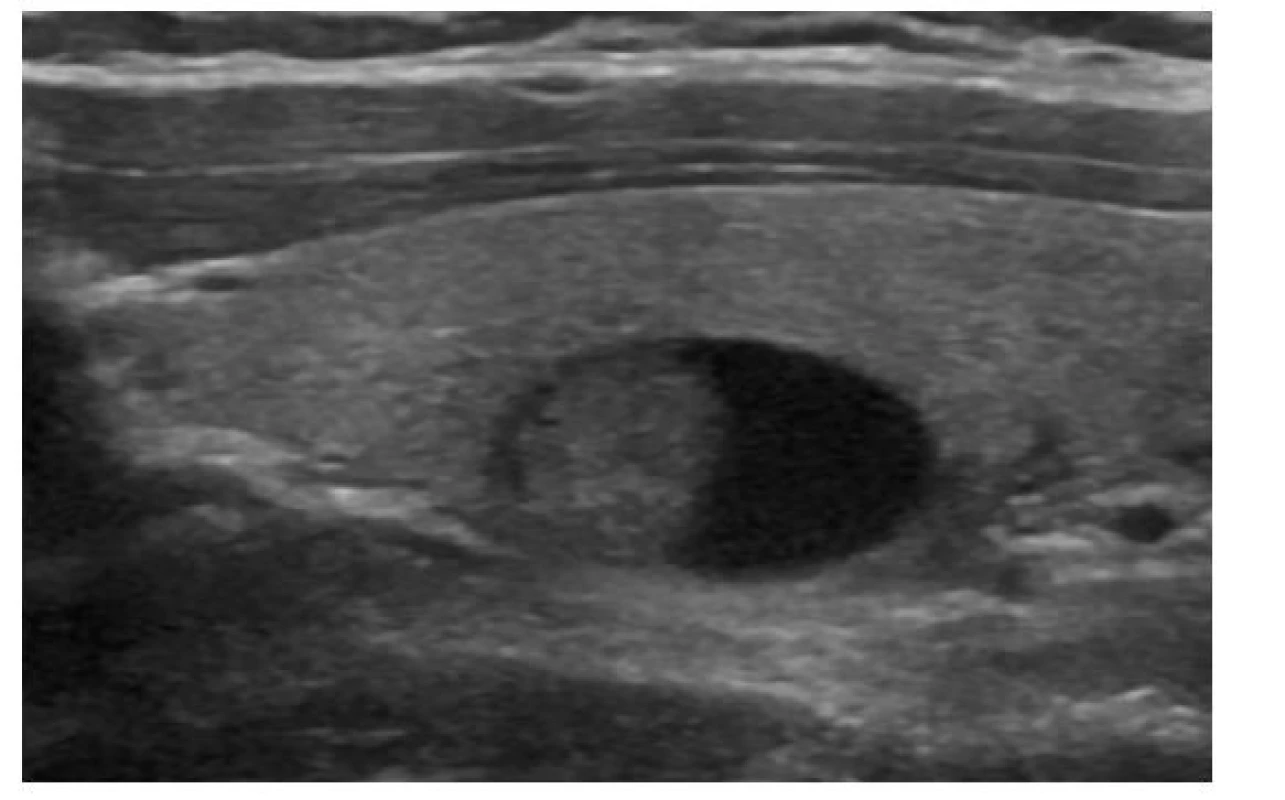
ATA/ČES ČLS JEP: nízká suspekce
ACR-TIRADS: TR 3
EU-TIRADS: 3Obr. 6. Solidní pravidelný hypoechogenní uzel 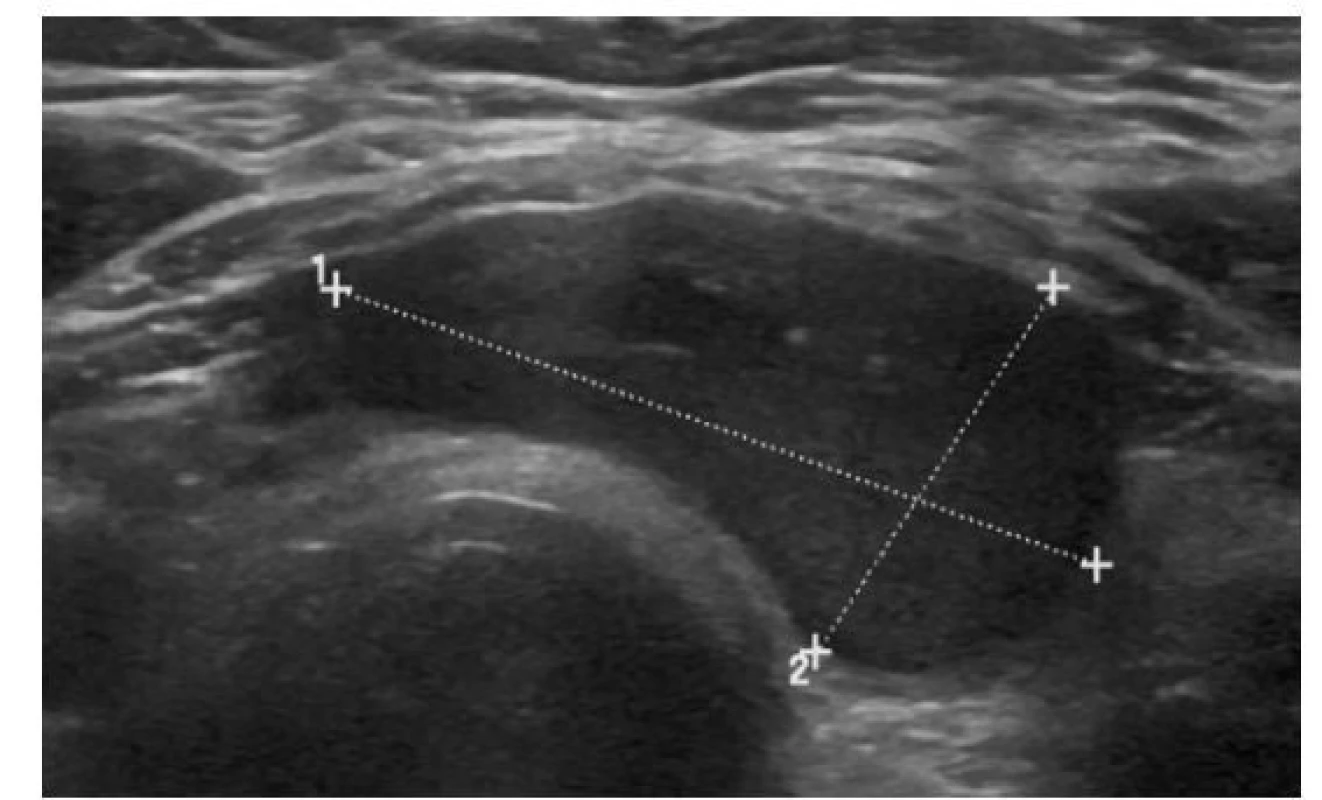
ATA/ČES ČLS JEP: střední suspekce
ACR-TIRADS: TR 4
EU-TIRADS: 4Obr. 7. Solidní nepravidelný hypoechogenní uzel s extratyreoidální invazí a mikrokalcifikacemi 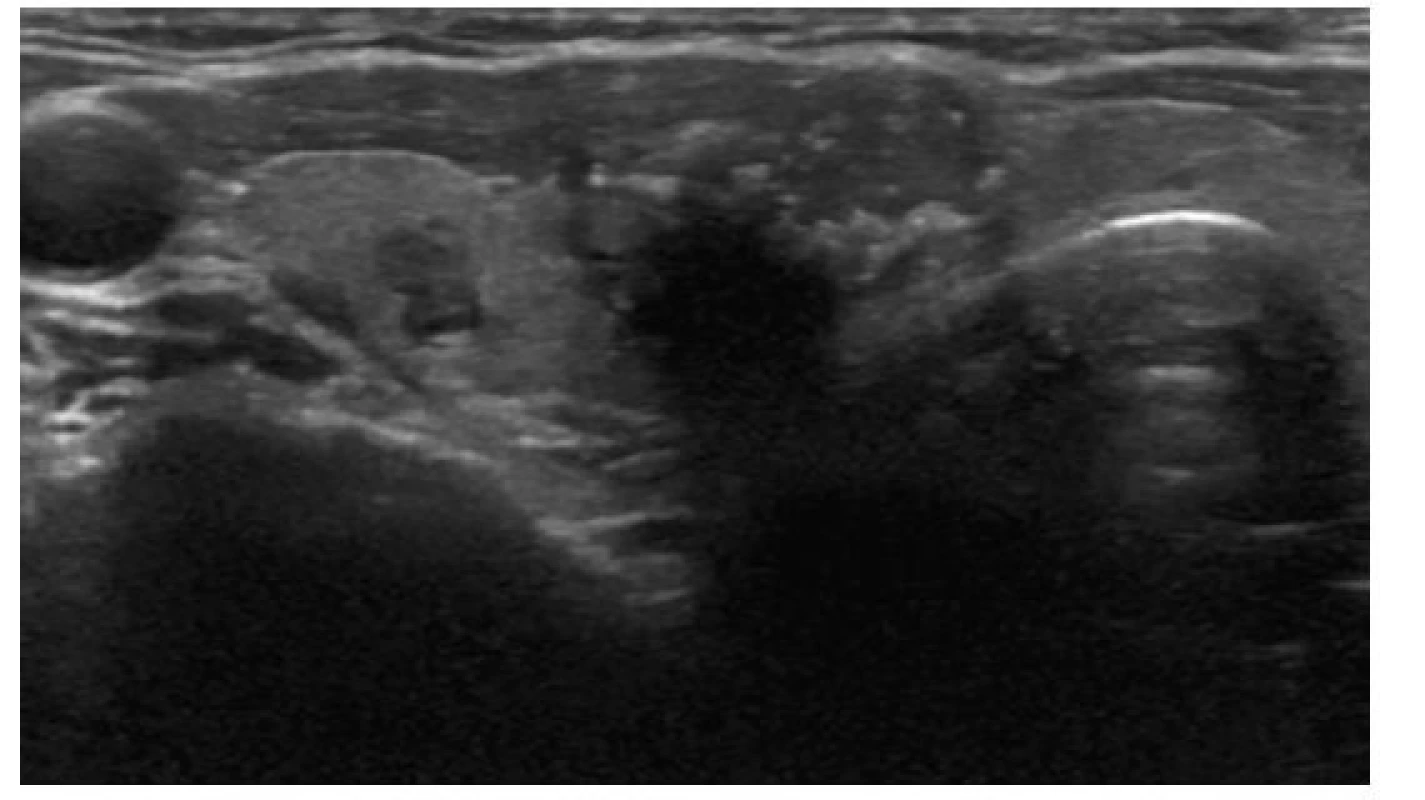
ATA/ČES ČLS JEP: vysoká suspekce
ACR-TIRADS: TR 5
EU-TIRADS: 5Tab. 1. Klinické rizikové faktory malignity tyreoidálního uzlu 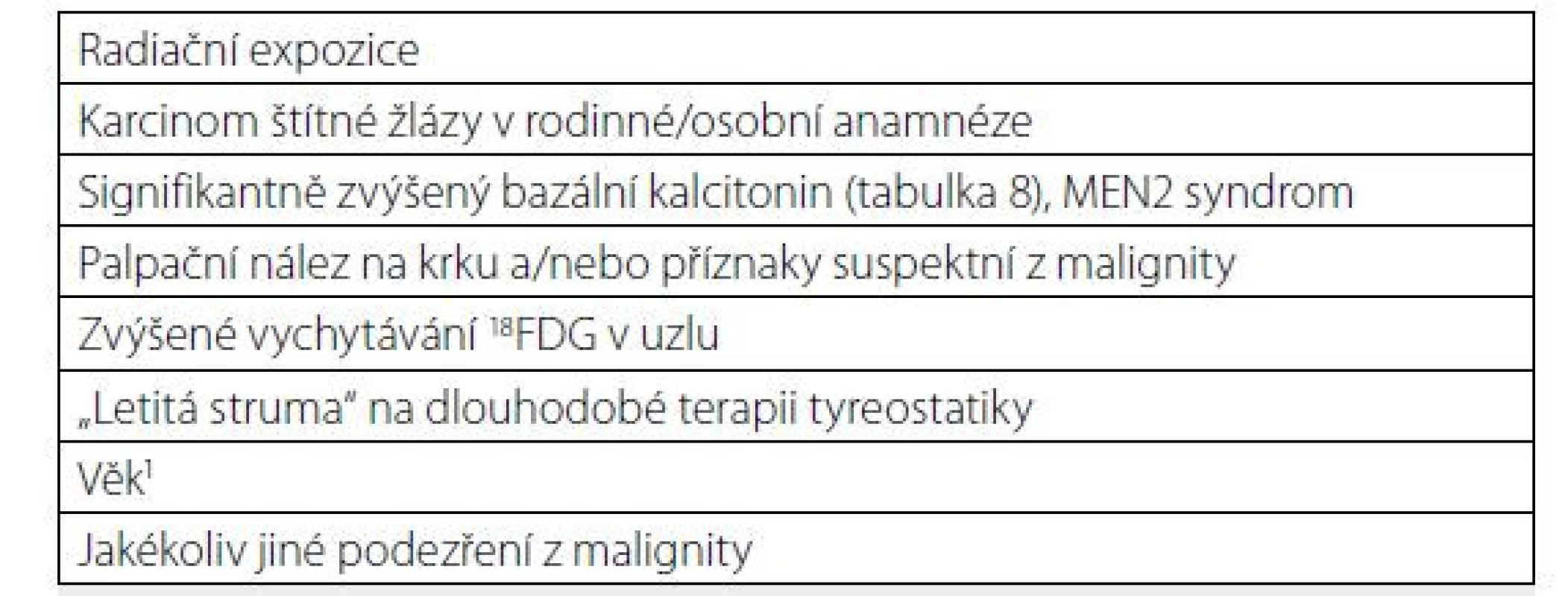
1U diferencovaných tyreoidálních mikrokarcinomů se klinicky signifikantní maligní charakter uzlu manifestuje častěji u mladších osob (< 40 let), naopak u starších osob (≥ 60 let) ve většině případů diferencovaný mikrokarcinom neprogreduje do klinicky signifikantního onemocnění (4) Tab. 2. Přehled klasifikačních systémů k odhadu rizika malignity tyreoidálního uzlu z ultrazvuku 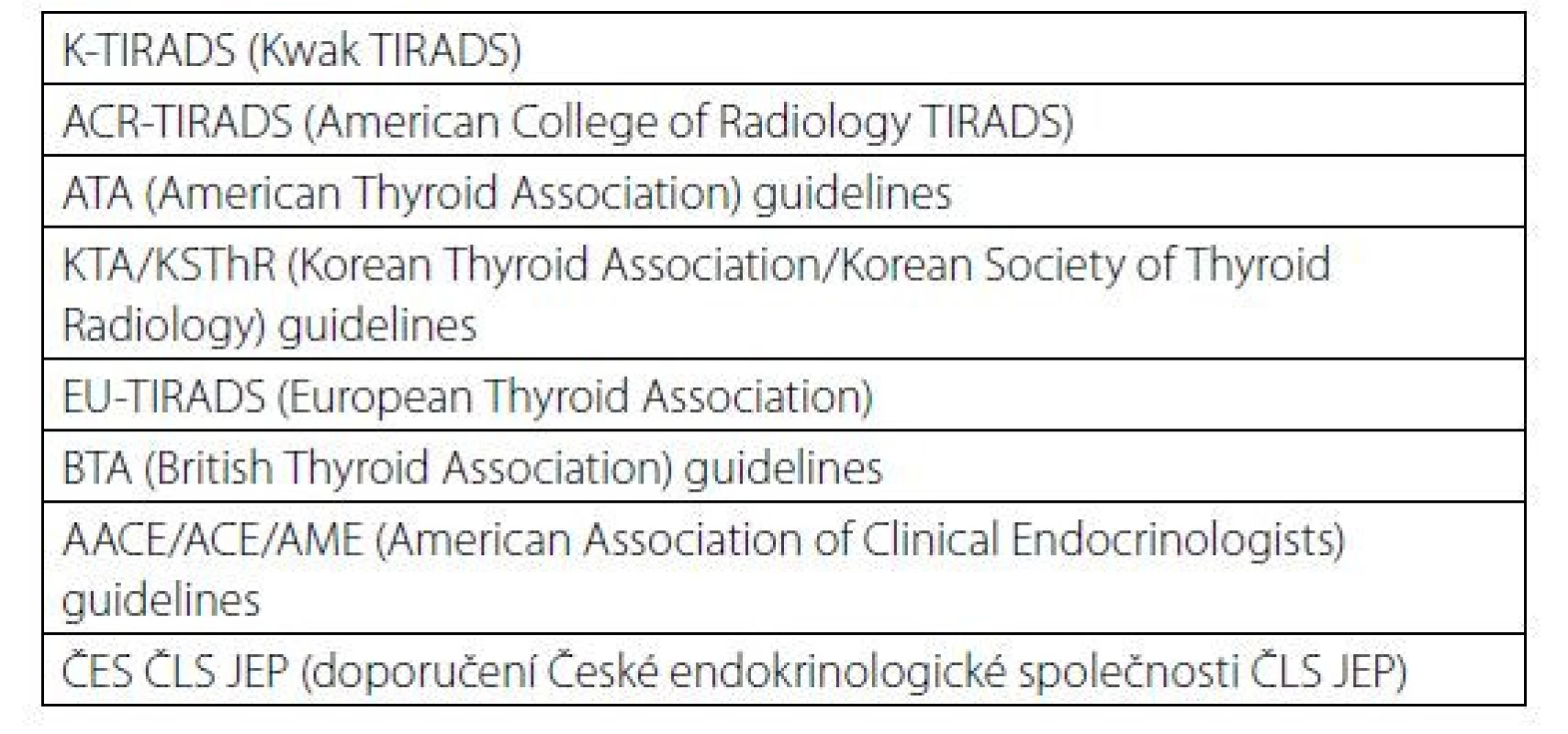
Tab. 3. Kategorizace a management tyreoidálních uzlů podle ATA a ČES ČLS JEP (5 a 6) 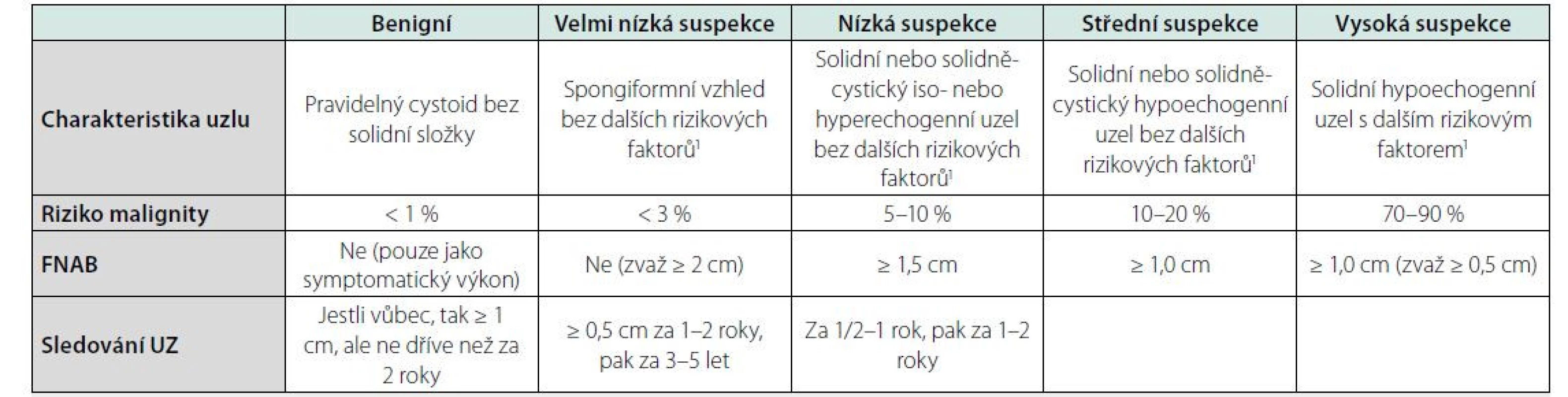
UZ: ultrazvuk, FNAB: biopsie štítné žlázy tenkou jehlou, ATA: American Thyroid Association, ČES ČLS JEP: Česká endokrinologická společnost ČLS JEP.
1mikrokalcifikace, přerušovaná kalcifikace na obvodu uzlu, uzel vyšší než široký v transverzální rovině, nepravidelný (makro- nebo mikrolobulární) okraj uzlu, přímá extratyreoidální propagace, patologické lymfatické uzliny na krku
Poznámky:
- Klasifikace podle ATA a ČES ČLS JEP nerozlišují mírně a zřetelně hypoechogenní uzly.
- U mnohočetných uzlů s velmi nízkou nebo nízkou suspekcí, které kompletně nahrazují normální parenchym, je riziko malignity nízké. V těchto případech se provádí FNAB největšího uzlu, pokud je > 2 cm, alternativním postupem jsou UZ kontroly bez FNAB (iniciálně za 1–2 roky a dále za 3–5 let).
- Při UZ sledování je důvodem k opakování FNAB změna charakteru uzlu směrem do vyšší kategorie nebo signifikantní růst uzlu (nárůst objemu minimálně o 50 % nebo zvětšení ve 2 rozměrech uzlu minimálně o 20 %, nejméně však o 2 mm v průběhu 6 měsíců), nebo jakékoliv jiné klinické podezření z malignity. Pomalejší růst je nesignifikantní a doporučuje se UZ kontrola za ½–1 rok a při další kontrole se event. progrese sčítá. Nicméně ATA guidelines upozorňují, že UZ sledování uzlů s nízkou a velmi nízkou suspekcí s cílem odhalit malignitu je sporné.Tab. 4. a. Skórovací systém podle ACR-TIRADS (7) 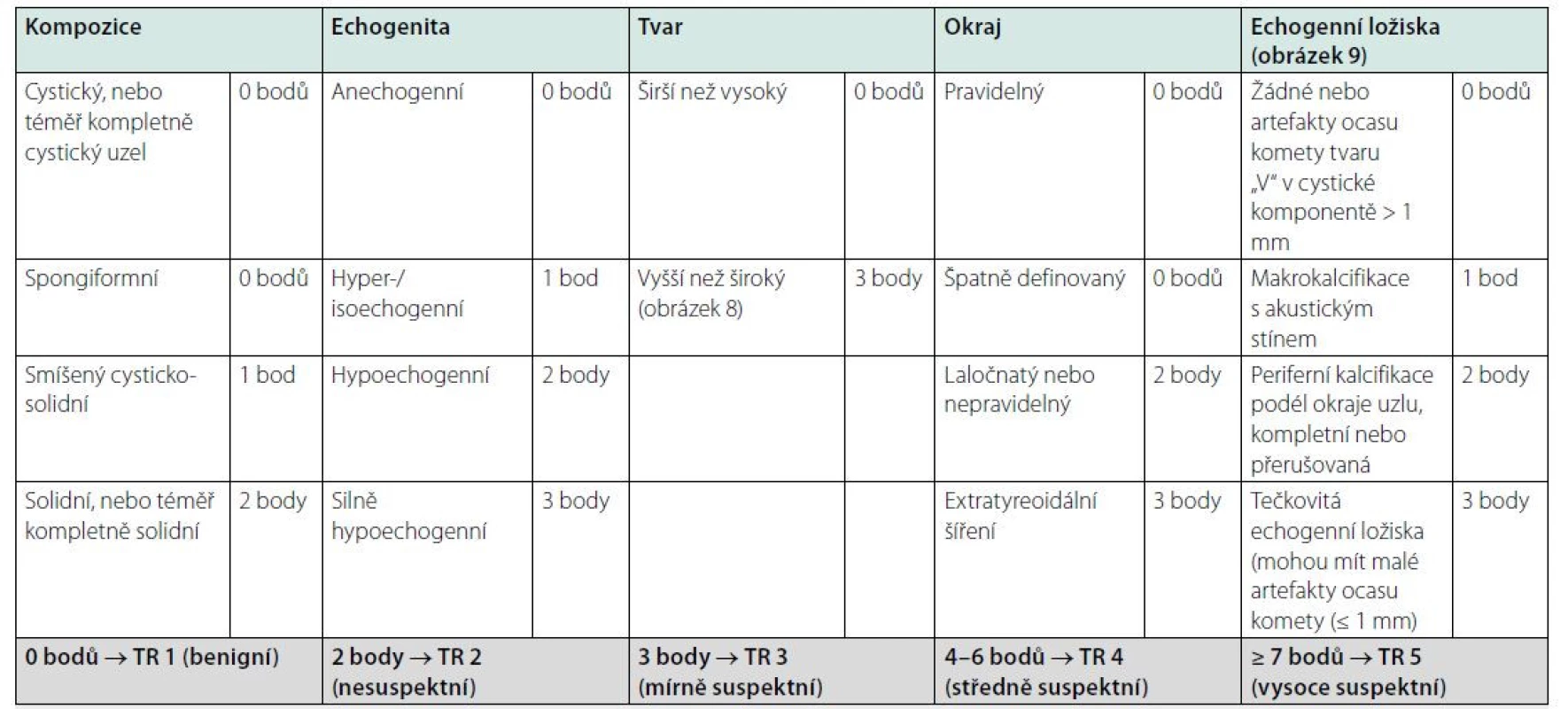
ACR: American College of Radiology, TIRADS: Thyroid Imaging Reporting and Data System Tab. 4b. Management tyreoidálních uzlů dle kategorií podle ACR-TIRADS (7) 
UZ: ultrazvuk, FNAB: biopsie štítné žlázy tenkou jehlou, ACR: American College of Radiology, TIRADS: Thyroid Imaging Reporting and Data System
1interval sledování kratší než 1 rok se nedoporučuje s výjimkou aktivního sledování diferencovaného karcinomu, který nebyl indikován k operaci
Poznámky:
- ACR-TIRADS neřeší mnohočetné uzly.
- Při UZ sledování se za signifikantní progresi považuje zvětšení ≥ 20 % alespoň ve dvou rovinách nebo o ≥ 50 % objemu během 5letého sledování. Pokud během 5 let k takovému nárůstu nedojde, doporučuje ACR-TIRADS ukončit UZ sledování.Tab. 5. Kategorizace a management tyreoidálních uzlů podle EU-TIRADS (8) 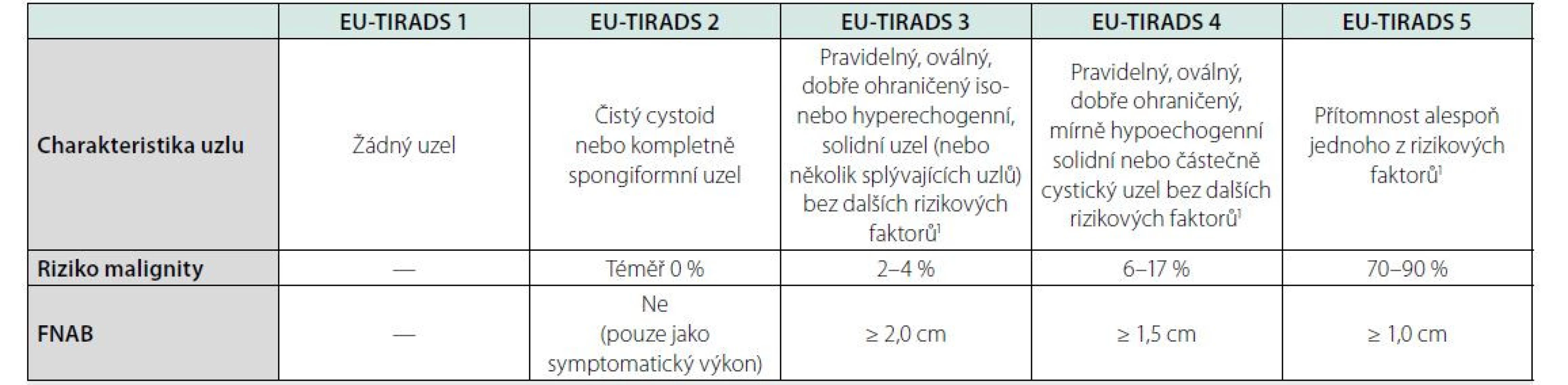
UZ: ultrazvuk, FNAB: biopsie štítné žlázy tenkou jehlou, TIRADS: Thyroid Imaging Reporting and Data System
1silně hypoechogenní uzel, mikrokalcifikace, není pravidelný oválný tvar, nepravidelný okraj uzlu, přímá extratyreoidální propagace, patologické lymfatické uzliny na krku
Poznámky:
- U mnohočetných uzlů EU-TIRADS doporučují: u uzlů kategorie 5 FNAB při velikosti > 1 cm, u uzlů kategorie 4 FNAB při velikosti > 1,5 cm a detailní popis při velikosti > 5 mm, u uzlů kategorie 3 FNAB při velikosti > 2,0 cm a detailní popis při velikosti > 10 mm, u mnohočetných uzlů popsat dle výše uvedeného doporučení 3 nejdůležitější uzly (na základě jejich velikost a charakteru)
- EU-TIRADS nedoporučují použití Dopplerovského ultrazvuku s cílem stratifikace rizika malignity.
- EU-TIRADS doporučují u uzlů elastografii jako doplňkovou metodu, z důvodu její vysoké negativní prediktivní hodnoty.
- EU-TIRADS nedoporučují další UZ sledování růstu s cílem predikce rizika malignity uzlu (studie neprokázaly, že růst je spolehlivým prediktorem malignity). Jiné nové potenciální znaky malignity, které se během UZ sledování mohou objevit (změna charakteru uzlu, extratyreoidální invaze, nové patologické lymfatické uzliny na krku) EU-TIRADS neřeší.Ačkoliv riziko klinicky manifestní malignity u většiny tyreoidálních uzlů stoupá s velikostí tumoru, je třeba mít na paměti, že velmi malé procento (< 5 %) papilárních mikrokarcinomů má od počátku agresivní chování s extratyreoidální invazí a často i vzdálenými metastázami již ve stadiu mikrokarcinomu. Odlišit agresivní varianty mikrokarcinomů od indolentních forem zobrazovací metody ani FNAB neumí. Přínosem by mohlo být molekulárně genetické vyšetření z FNAB, protože některé mutace (TERT promoter, PIK3CA, TP53, AKT1p53) jsou v kombinaci s BRAF mutací spojené s agresivním chováními i drobného tumoru (5). Tyto případy jsou však vzácné a rutinní vyšetření těchto mutací u drobných ložisek by nutně naráželo na problém s efektivitou.
U mnohočetných uzlů by měl být každý uzel posouzen zvlášť podle stejných pravidel jako u solitárních uzlů (individuální riziko malignity pro pacienta je u solitárních uzlů stejné jako u mnohočetných uzlů). Podle ATA a ČES ČLS JEP je u mnohočetných uzlů s nízkou nebo velmi nízkou suspekcí, které kompletně nahrazují normální parenchym (klasická polynodózní přestavba/struma), riziko malignity nízké a doporučuje se FNAB největšího uzlu, pokud je > 2 cm, alternativním postupem jsou UZ kontroly bez FNAB (iniciálně za 1–2 roky a dále za 3–5 let) (Tab. 3). Doporučení pro mnohočetné uzly podle EU‑TIRADS je v tabulce 5.
V tabulkách 3, 4 b a 5 je doporučení dalšího postupu v případech, kdy není indikována FNAB. Za zmínku stojí rozdíly v pohledu na další sledování uzlů, které nesplňují kritéria pro FNAB. Nejtěsnější UZ sledování doporučují guidelines ATA [a jejich verze upravená pro podmínky ČR (ČES ČLS JEP)], zatímco podle ETA (EU‑TIRADS) rutinní UZ sledování uzlů s cílem hodnotit maligní potenciál uzlu není odůvodněné s odkazem na rozporuplné výsledky studií, které neprokázaly, že by růst uzlu byl významným prediktorem malignity (10).
Management uzlů podle výsledku FNAB
Výsledek FNAB má být odečítajícím patologem zařazen do jedné z Bethesda kategorií (Tab. 6), a podle toho se volí další postup (Tab. 7). Zjednodušeně řečeno, ve většině případů (Bethesda II, opakovaně Bethesda I, část Bethesda III) se volí konzervativní postup (sledování klinicky a ultrazvukem, nebo jen klinicky, nebo vůbec), nebo se opakuje FNAB. Jen v někdy je nutná diagnostická operace (Bethesda III, IV a V) nebo operace jako terapeutický výkon (Bethesda V a VI). Celkově je prevalence malignity u tyreoidálních uzlů nízká a závisí také na tom, jak jsou nastavena kritéria pro indikaci k FNAB. Pokud jsou přísná (např. ATA, ČES ČLS JEP), je prevalence malignity < 5 %, pokud jsou mírnější (např. ACR‑TIRADS nebo EU‑TIRADS), pohybuje se mezi 5–10 %. V managementu tyreoidálních uzlů, zejména u kategorií III a V, může v některých případech pomoci molekulárně genetické vyšetření ze vzorku FNAB a vyšetření kalcitoninu v krvi (viz dále).
Tab. 6. Bethesda klasifikace cytologických nálezů u tyreoidálních uzlů 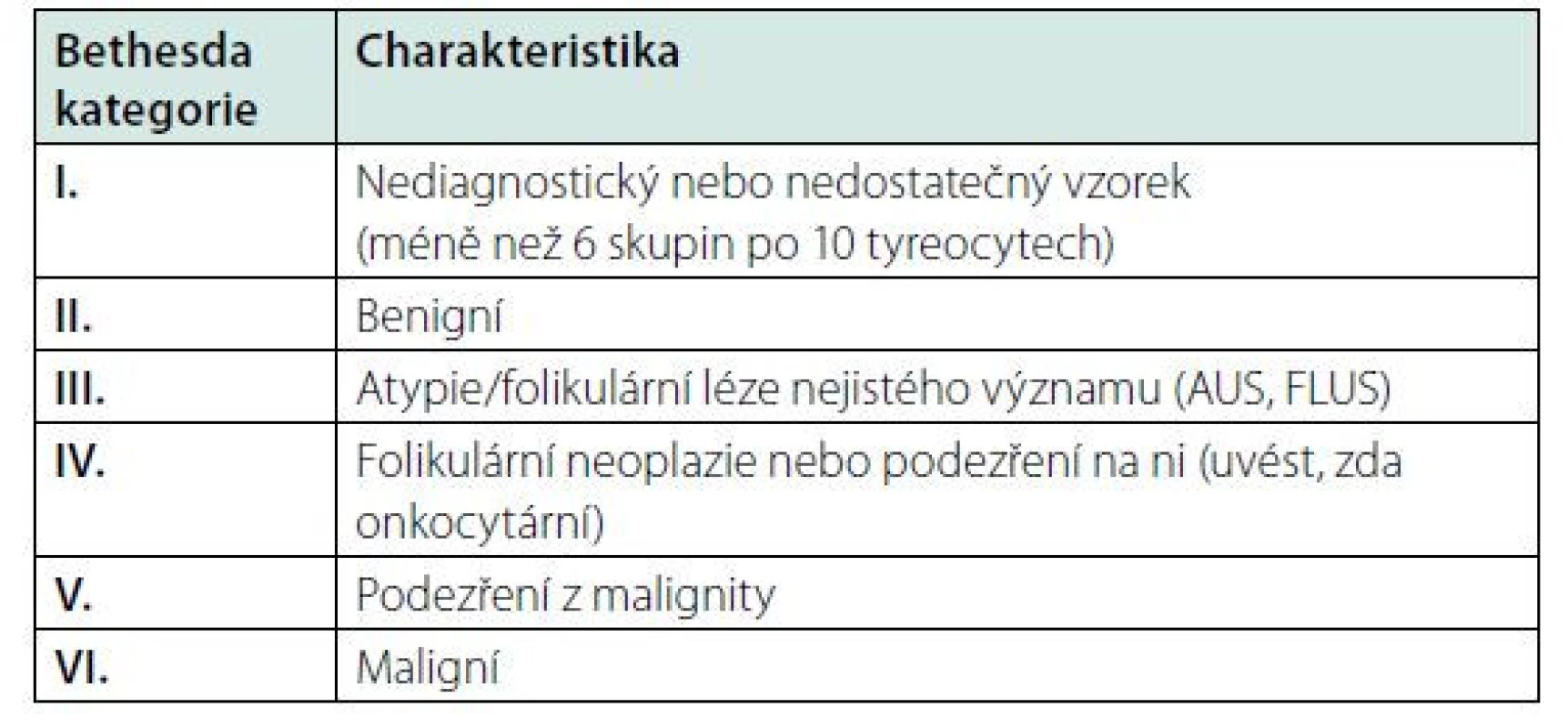
Tab. 7. Management tyreoidálních uzlů dle výsledku FNAB (upraveno podle 6 a 7) 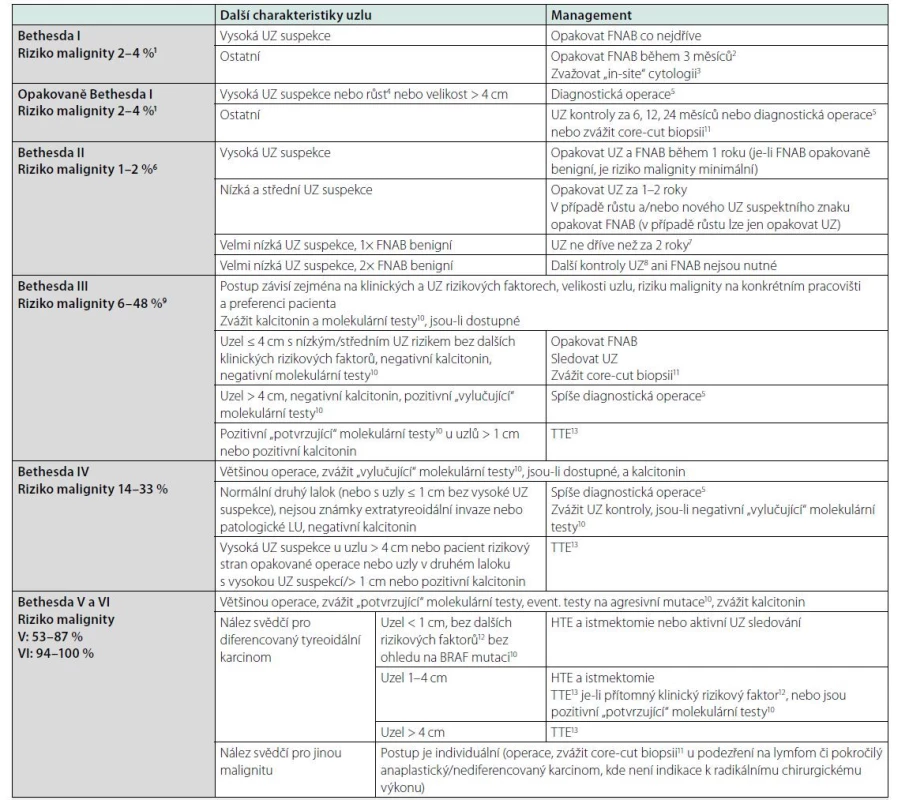
UZ: ultrazvuk, FNAB: biopsie štítné žlázy tenkou jehlou, ATA: American Thyroid Association, ČES ČLS JEP: Česká endokrinologická společnost ČLS JEP, HTE: hemithyroidektomie, TTE: totální tyreoidektomie, LU: lymfatické uzliny
1u uzlů, které byly operovány, bylo riziko malignity vyšší (9–32 %), což je ale ovlivněno selekčním zkreslením
2podle některých autorů je vhodné opakovat FNAB ne dříve, než na 3 měsíce, z důvodu možného rizika falešně pozitivního nálezu při reparativních změnách po předchozí punkci, dostatek důkazů pro tento postup ale není
3zhodnocení reprezentativnosti vzorku přítomným patologem během FNAB
4nárůst objemu minimálně o 50 % nebo zvětšení ve 2 rozměrech uzlu minimálně o 20 %, nejméně však o 2 mm v průběhu 6 měsíců
5diagnostickou operací je hemithyroidektomie a istmektomie, není‑li jiný důvod k totální tyreoidektomii
6pokud je FNAB ze stejného uzlu hodnocena ≥ 2× jako Bethesda kategorie II, je riziko malignity minimální
7efektivita UZ k hodnocení růstu jako indikátoru malignity je limitovaná, pokud už se kontrolní UZ provádí, tak ne dříve než za 2 roky, dále za 3–5 let, je‑li uzel stabilní, nebo dříve, je‑li progrese
8UZ provádíme pouze u symptomatických rostoucích uzlů, UZ kontroly s cílem hodnotit riziko malignity nejsou indikovány
9riziko malignity v kategorii Bethesda III je odlišné v jednotlivých centrech (průměrně 16 %) a významně závisí na erudici cytopatologa
10charakteristika a potenciální využití molekulárních markerů je v tabulce 9
11pokud je metoda dostupná a je technicky možné její bezpečné provedení, lze core‑cut biopsii výjimečně zvážit u výsledku Bethesda I a III s cílem vyhnout se chirurgickému výkonu a u výsledku Bethesda V a VI, když je podezření na jiný než diferencovaný tyreoidální karcinom (např. lymfom, anaplastický či málo diferencovaný karcinom, metastáza)
12rizikové faktory: extratyreoidální invaze na UZ, patologické LU, předchozí ozáření krku a horní poloviny těla, předchozí léčba pro tyreoidální karcinom nebo familiární výskyt, podle některých doporučení velikost > 2 cm, mutace TERT, TP53, PIK3CA nebo AKT1p53 pokud je vyšetření dostupné (jejich vyšetření není podmínkou)
13jsou‑li předoperačně nebo peroperačně patologické LU, tak disekce v příslušném a centrálním kompartmentu, profylaktická disekce v centrálním kompartmentu je předmětem pokračujících diskuzí, lze ji indikovat u uzlů > 1 cm s pozitivním nálezem několika mutací (BRAF mutace + některá z mutací spojených s agresivitou tumoru – TERT promoter, TP53, PIK3CA, AKT1p53), event. zvážit u uzlů > 1 cm s pozitivní BRAF mutací (není evidence based)Obr. 9. Echogenní ložiska v uzlech 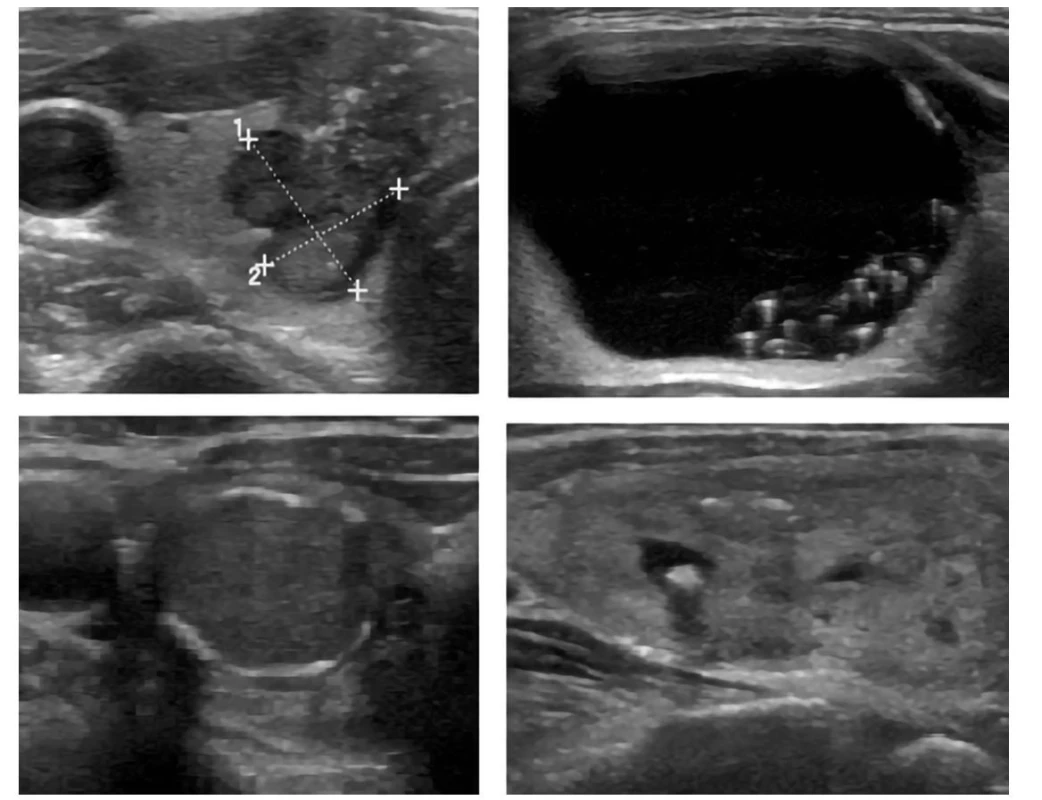
Vlevo nahoře: mikrokalcifikace
Vpravo nahoře: koloidní agregace s artefakty ocasu komety tvaru „V“
Vlevo dole: přerušovaná periferní kalcifikace
Vpravo dole: makrokalcifikace s akustickým stínemLaboratorní vyšetření u tyreoidálních uzlů
Funkční tyreoidální testy a tyreoidální protilátky
U každého pacienta s uzlem má být vyšetřen TSH (tyreoidální stimulační hormon) v krvi, a je‑li patologický, pak i volný tyroxin (FT4) a volný trijodtyronin (FT3). Je‑li uzel hyperfunkční a hyperakumulující na scintigrafii s 99mTc‑technecistanem (dnes spíše výjimečně), je riziko malignity minimální a léčíme hypertyreózu. Je‑li prokázána hypotyreóza, podáváme substituci levotyroxinem. Vyšší riziko malignity bylo v retrospektivních studiích u uzlů s TSH v horním pásmu normy (11), avšak léčba levotyroxinem s cílem snížit TSH do dolního pásma normy riziko malignity nesnižuje, a nelze ji u eutyroidních pacientů doporučit (12).
Pozitivní protilátky proti tyreoidální peroxidáze (TPOAb) i tyreoglobulinu (TgAb) byly v některých retrospektivních studiích asociovány s papilárními karcinomy, avšak přesvědčivé důkazy, že by autoimunitní tyreoiditida byla rizikovým faktorem tyreoidální malignity, nejsou k dispozici (13). Rutinní vyšetření protilátek se u eufunkčních pacientů s uzly jeví jako nadbytečné.
Kalcitonin
Z důvodu nedostatku dat nedal panel ATA 2015 doporučení pro ani proti rutinnímu vyšetření sérového bazálního kalcitoninu u tyreoidálních uzlů (5). Vyšetření bazálního kalcitoninu bez stimulačního testu není dostatečně specifické, přináší mnoho výsledků v nediagnostickém pásmu a podle některých studií vedlo ke zbytečným operacím. V současné době není dostupný pentagastrin, takže se ke stimulaci používá kalcium, avšak standardizace kalciového testu není optimální a jsou jen limitovaná data pro cut‑offs pro medulární karcinom (MTC) (tabulka 8) (5, 14 a 15). Rutinní vyšetřování bazálního kalcitoninu u všech uzlů nelze doporučit, avšak provádí se v případě klinického či cytologického podezření na MTC a lze jej zvážit u cytologicky nejasných případů (Bethesda III, V). Pokud je klinické podezření na MTC a dg. se nepodaří stanovit jinak (FNAB, sérový kalcitonin), lze i zvažovat vyšetření kalcitoninu z FNAB nebo molekulární vyšetření somatických mutací RET proto‑onkogenu (příčina až 50 % sporadických a téměř 100 % familiárních MTC) z FNAB.
Tab. 8. Referenční meze a cut-offs pro bazální a stimulovaný kalcitonin 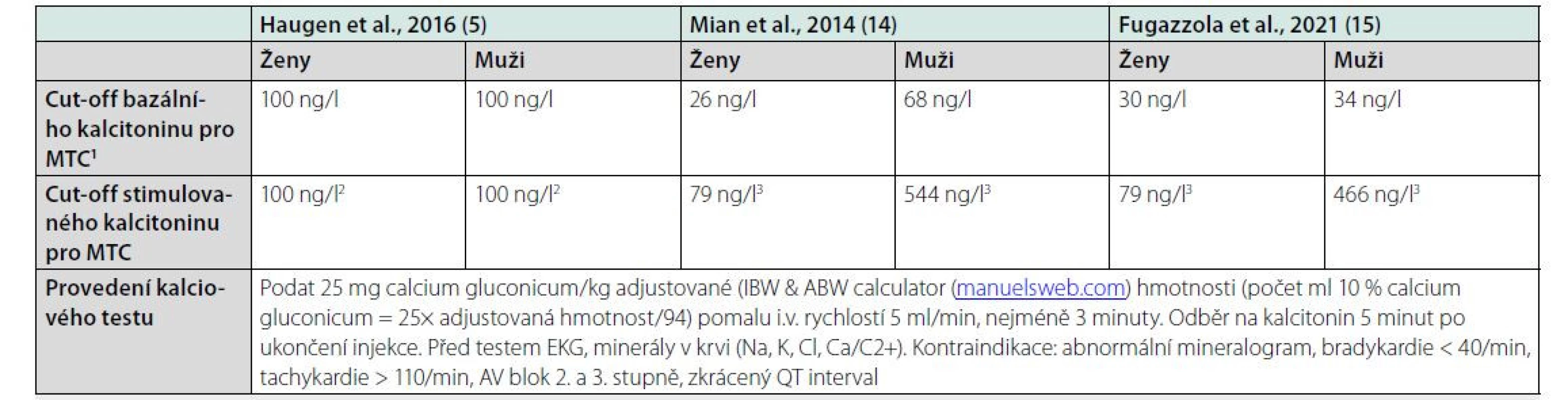
MTC: medulární karcinom štítné žlázy
1kalcitonin v pásmu mezi touto hodnotou a dvojnásobkem horního referenčního rozmezí pro ženy a muže není diagnostický pro MTC (může jít o hyperplazii C buněk) a je třeba doplnit stimulační test. Hyperplazie C buněk (CHH) je prekancerózou pouze u nositelů zárodečné mutace RET protonkogenu, v ostatních případech je její klinický význam nejasný
2pentagastrinem stimulovaný kalcitonin
3kalciem stimulovaný kalcitoninPředoperační molekulárně genetická diagnostika
Hlavní geny spojené s tyreoidální onkogenezí jsou BRAF, RAS, RET/PTC a PAX8/PPARγ. Mutace BRAF, RET/PTC, PAX8/PPARγ predikují tyreoidální malignitu s pravděpodobností > 95 %, zatímco RAS mutace se vyskytují i u 13–43 % u folikulárních adenomů. Kromě RAS lze tyto testy označit jako „potvrzující“. Dále existují testy, které využívají analýzu desítek až stovek genů s cílem vyloučit s dostatečnou senzitivitou a negativní prediktivní hodnotou malignitu u uzlů Bethesda kategorií III a IV (vylučující testy) a pak jejich různé kombinace (tabulka 9). Kromě toho existují geny (TERT promoter, PIK3CA, TP53, AKT1p53), jejichž pozitivní mutace jsou v kombinaci s BRAF mutací spojené s vyšší agresivitou diferencovaných karcinomů (5), a mohou být proto důvodem ke zvažování agresivnější léčby (např. preventivní disekce lymfatických uzlin v centrálním kompartmentu), ačkoliv data z prospektivních studií jsou limitovaná. Pohled na indikace a interpretace molekulárně genetického vyšetření z FNAB se významně liší v doporučení ATA (5) a ETA (16). Přes značný pokrok v této oblasti nelze v současné době považovat vyšetření molekulárních markerů ze vzorku FNAB za natolik validovanou a efektivní metodu (analýzy nákladové efektivity nejsou v ČR k dispozici), aby bylo možné ji doporučit do rutinní klinické praxe. Při managementu tyreoidálních uzlů hrají stále prvořadou roli klinické a sonografické faktory, nicméně molekulárně genetické vyšetření může v individuálních případech k optimálnímu postupu významně přispět.
Tab. 9. Možnosti předoperačního vyšetření molekulárních markerů 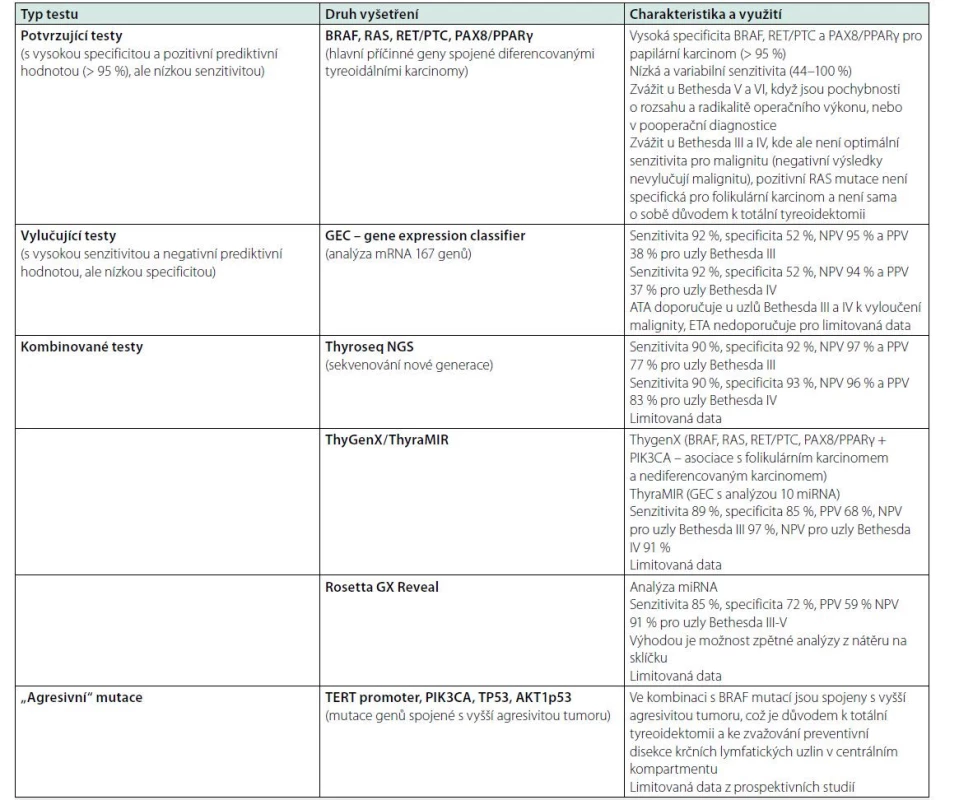
NPV: negativní prediktivní hodnota, PPV: pozitivní prediktivní hodnota Elastografie a další zobrazovací techniky
Elastografie se považuje za pomocnou metodu, která vychází z teoretického předpokladu, že benigní uzly jsou měkké a maligní tuhé (Obr. 10). Diagnostická přesnost elastografie byla v provedených studiích variabilní. Nevýhodou elastografie je velká interpersonální variabilita a fakt, že dostatečná spolehlivost metody je pouze u vybraných uzlů (obvykle u solidních uzlů v jinak normální štítné žláze). Pokud anatomické poměry a další faktory umožní její standardní provedení, má poměrně dobrou negativní prediktivní hodnotu (8) a podle našich zkušeností může být přínosná zejména u solidních uzlů velikosti 0,5–2 cm, u kterých jsou pochybnosti, zda indikovat FNAB, nebo není jasný další postup při nediagnostické FNAB. Elastografie nenahrazuje stratifikaci rizika na základně konvenčního B‑mode ultrazvuku (5).
Obr. 10. Elastografický obraz maligního (A) a benigního (B) tyreoidálního uzlu 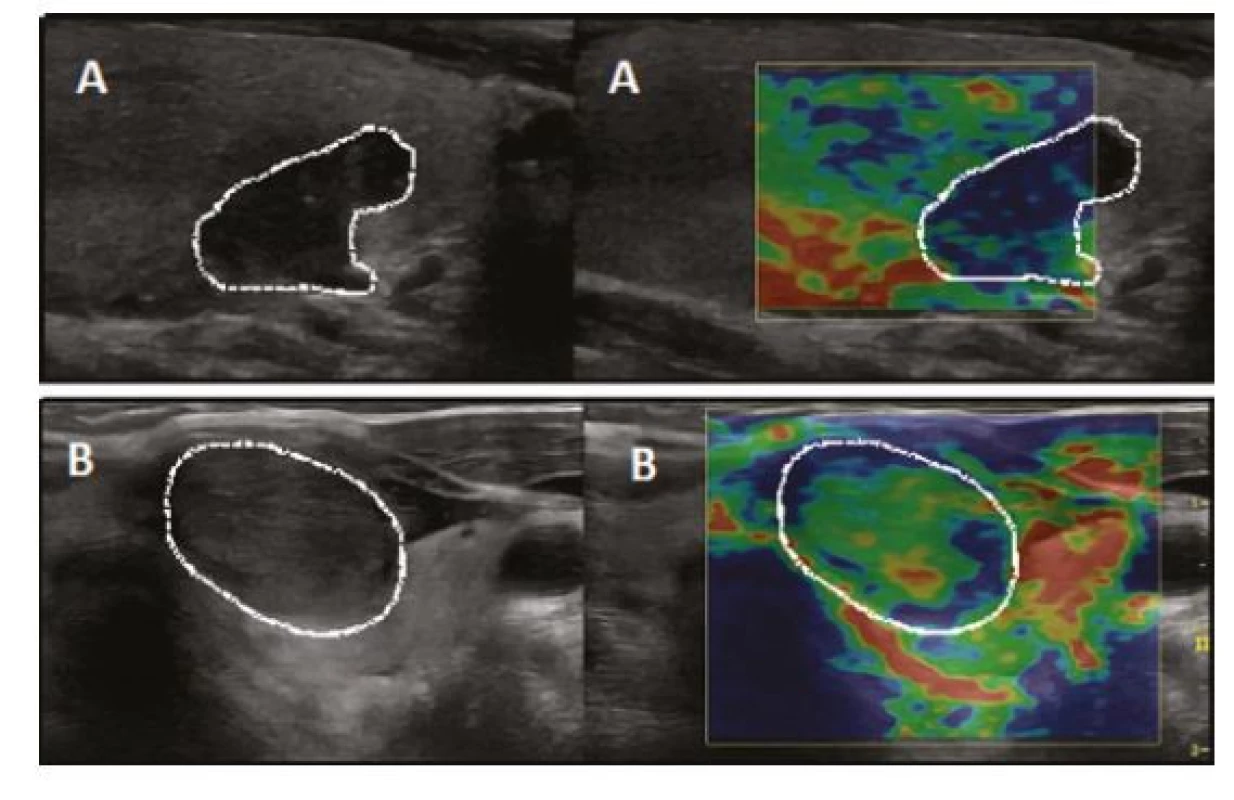
Naopak hodnocení vaskularizace dopllerovskou sonografií není u tyreoidálních uzlů dostatečně spolehlivé a ATA, ČES ČLS JEP, ACR‑TIRADS ani EU‑TIRADS (5, 6, 7, 8) je do stratifikačních systémů nezařazují. Význam má ověření úplné absence vaskularizace u benigních cystoidů.
V předoperačních diagnostice se doporučuje zvážit kontrastní CT nebo MR krku jako pomocnou metodu u pacientů s klinicky lokálně pokročilým tumorem (s klinicky zjevnou invazí do okolí a do krčních lymfatických uzlin). Naopak se k hodnocení rizika malignity tyreoidálních uzlů nedoporučuje provádět 18FDG‑PET‑CT.
Vyšetření lymfatických uzlin na krku ultrazvukem
Ultrazvuk lymfatických uzlin hodnotí velikost a strukturu. Z hlediska strukturálních změn rozlišujeme uzliny benigního, neurčitého a suspektního charakteru (Tab. 10, Obr. 11). Přibližné cut‑offs velikosti pro patologické lymfatické uzliny jsou v tabulce 11, nicméně velikost není jediným faktorem, který je nutné hodnotit. Metastázy tyreoidálního karcinomu se typicky nacházejí v kompartmentech VI, II, III, IV a V (Obr. 12). V předoperační diagnostice je u zvětšených suspektních lymfatických uzlin indikována FNAB z uzliny a cytologické vyšetření, event. stanovení tyreoglobulinu z uzliny. Na rozdíl od pacientů po tyreoidální ablaci, kde byl dle ATA 2015 cut‑off pro pozitivní tyreoglobulin v uzlině navržen jako 1 ng/ml, je v preoperační diagnostice vyšetření tyreoglobulinu z punktátu uzliny obtížně hodnotitelné. Podle jedné z prací byl cut‑off při normální štítné žláze 32 ng/ml, což ale nelze považovat za hodnotu obecně platnou (5).
Tab. 10. Ultrazvuková charakteristika krčních lymfatických uzlin 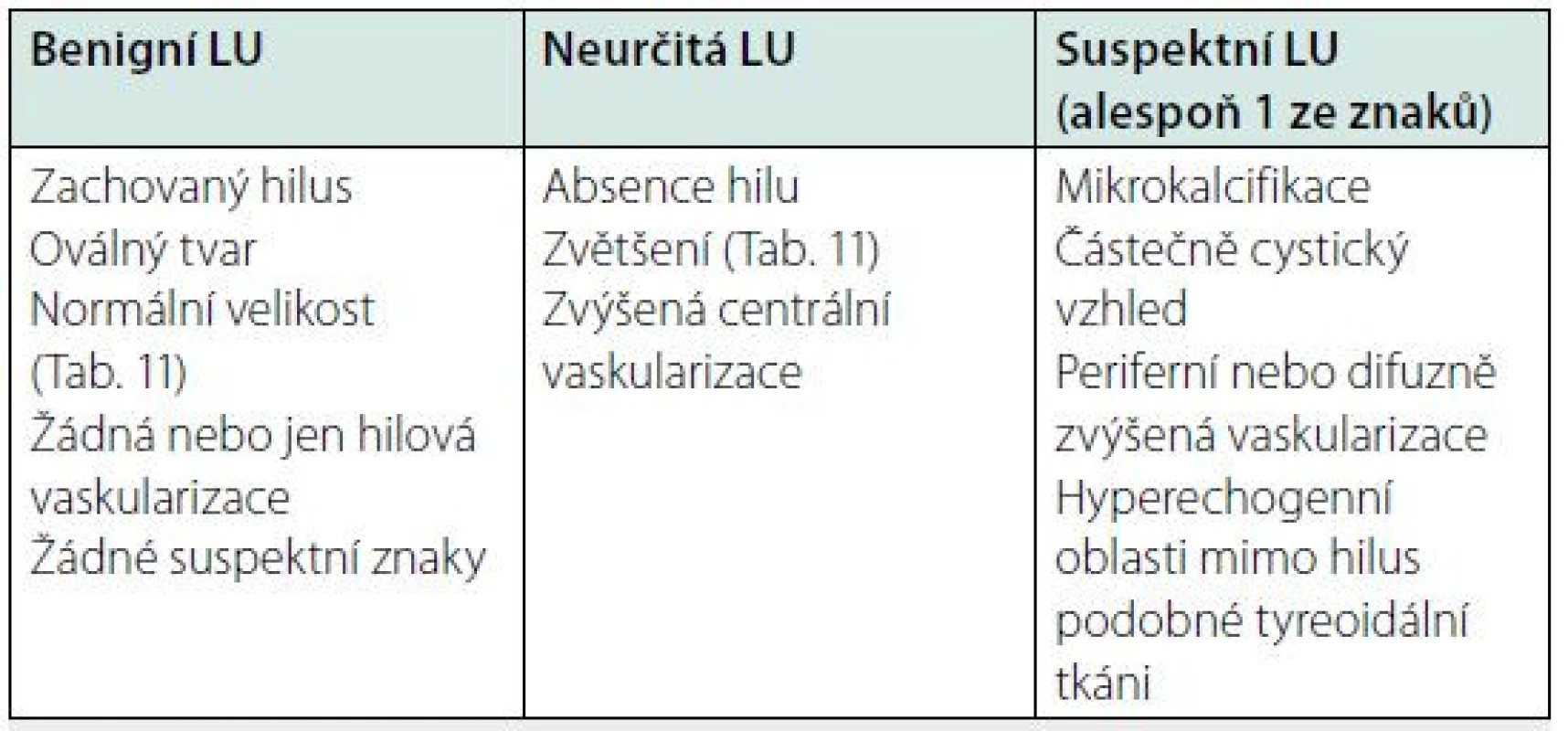
LU: lymfatická uzlina Obr. 11. Ultrazvukový obraz lymfatické uzliny benigního (A), neurčitého (B) a maligního (C) charakteru 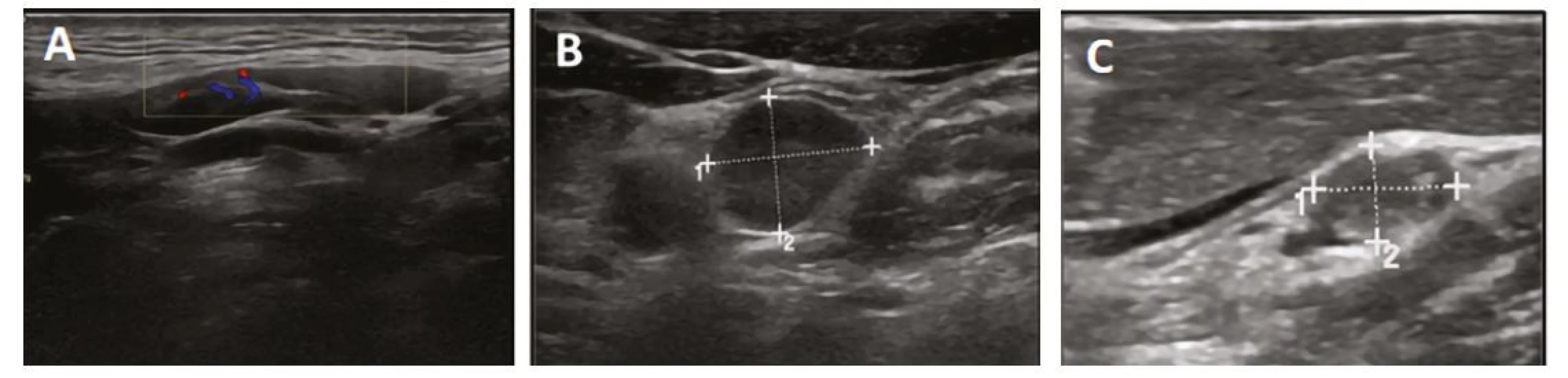
Tab. 11. Cut-offs velikosti pro patologické lymfatické uzliny na krku 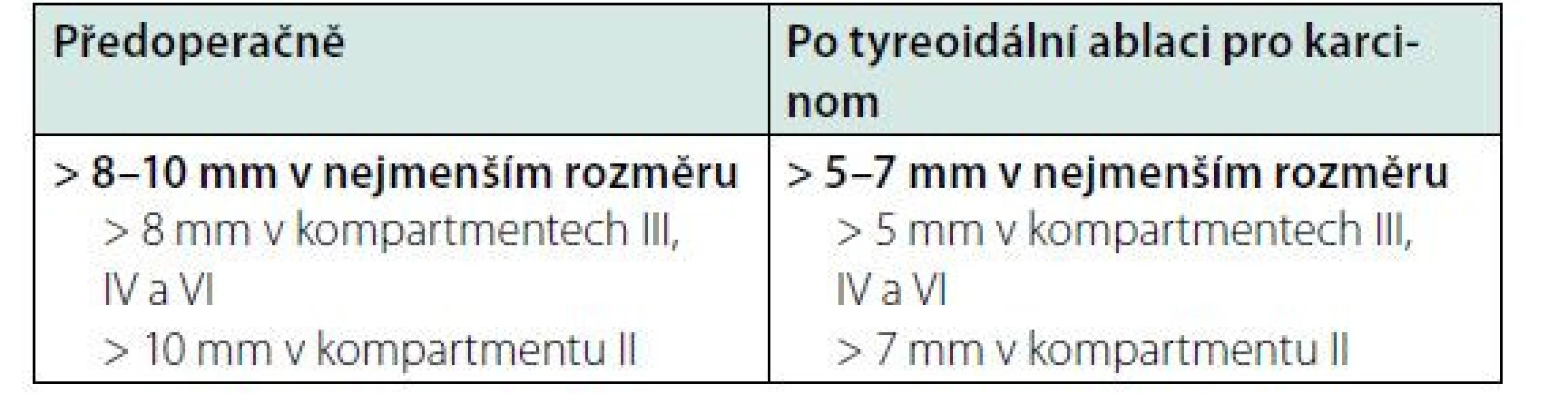
Obr. 12. Kompartmenty krčních lymfatických uzlin 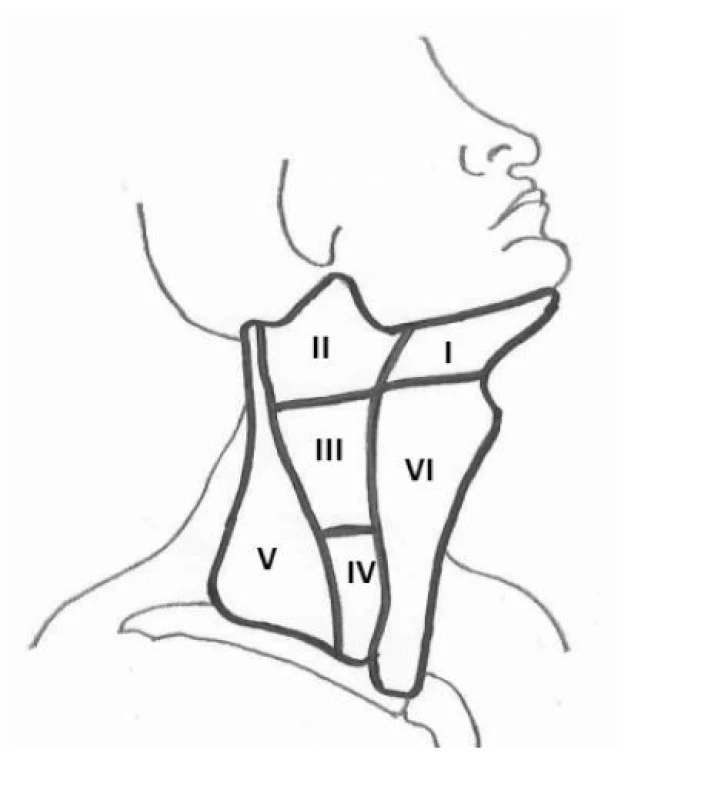
Terapie benigních tyreoidálních uzlů a cystoidů
Supresní ani euthyroxinemická terapie levotyroxinem se u eutyroidních pacientů s benigními uzly nedoporučuje, protože nejsou prokázány benefity a supresní léčba má navíc prokazatelná kardiální, kostní a psychiatrická rizika (12, 17, 18, 19, 20). U symptomatických převážně solidních benigních uzlů je stále na prvním místě chirurgické řešení, ačkoliv máme k dispozici i alternativních postupy, jako jsou radiofrekvenční či laserová ablace nebo ablace vysokofrekvenčním ultrazvukem. Tyto metody se však provádějí v Evropě pouze v několika centrech, není známá nákladová efektivita a pojišťovny v ČR je nehradí. Asymptomatické uzly se někdy doporučují operovat při velikosti > 4 cm, dostatečná data pro tento postup ale nejsou k dispozici. Symptomatické recidivující cystoidy a uzly s dominantní cystoidní složkou s benigním výsledkem FNAB se mohou sklerotizovat 96% alkoholem, a pokud je metoda dostupná, může být použita i jako výkon první volby.
KORESPONDENČNÍ ADRESA AUTORA:
doc. MUDr. Jan Jiskra, Ph.D.
3. interní klinika 1. LF UK a VFN, Praha
U Nemocnice 504, 128 00 Nové Město – Praha 2
Cit. zkr: Vnitř Lék. 2022;68(7):465-474
Článek přijat redakcí: 13. 7. 2022
Článek přijat po recenzích: 23. 8. 2022
Zdroje
1. Gharib H, Papini E, Paschke R et al. AACE/AME/ETA Task Force on Thyroid Nodules. American Association of Clinical Endocrinologists, Associazione Medici Endocrinologi, and European Thyroid Association Medical Guidelines for Clinical Practice for the Diagnosis and Management of Thyroid Nodules. Endocr Pract. 2010 May‑Jun;16(Suppl1):1-43.
2. Ahn HS, Kim HJ, Welch HG. Korea’s thyroid‑cancer „epidemic“- - screening and overdiagnosis. N Engl J Med. 2014 Nov 6;371(19):1765-7.
3. Welch HG, Kramer BS, Black WC. Epidemiologic Signatures in Cancer. N Engl J Med. 2019 Oct 3;381(14):1378-1386.
4. Ito Y, Miyauchi A, Kihara M, Higashiyama T et al. Patient age is significantly related to the progression of papillary microcarcinoma of the thyroid under observation. Thyroid. 2014 Jan;24(1):27-34.
5. Haugen BR, Alexander EK, Bible KC et al. 2015 American Thyroid Association Management Guidelines for Adult Patients with Thyroid Nodules and Differentiated Thyroid Cancer: The American Thyroid Association Guidelines Task Force on Thyroid Nodules and Differentiated Thyroid Cancer. Thyroid. 2016 Jan;26(1):1-133.
6. Jiskra J. Diagnostika a další péče o pacienty s tyreoidálními uzly: doporučení American Thyroid Association 2015 modifikované pro podmínky České republiky. Čas. Lék. Čes. 2017;156 : 241-251.
7. Smith D, Botz B. ACR Thyroid Imaging Reporting and Data System (ACR TI‑RADS). Reference article, Radiopaedia.org. (accessed on 11 Jun 2022) https://doi.org/10.53347/rID-52374
8. Russ G, Bonnema SJ, Erdogan MF et al. European Thyroid Association Guidelines for Ultrasound Malignancy Risk Stratification of Thyroid Nodules in Adults: The EU‑TIRADS. Eur Thyroid J. 2017 Sep;6(5):225-237.
9. Yang R, Zou X, Zeng H et al. Comparison of Diagnostic Performance of Five Different Ultrasound TI‑RADS Classification Guidelines for Thyroid Nodules. Front Oncol. 2020 Nov 16;10 : 598225.
10. Singh Ospina N, Maraka S, Espinosa DeYcaza A et al. Diagnostic accuracy of thyroid nodule growth to predict malignancy in thyroid nodules with benign cytology: systematic review and meta‑analysis. Clin Endocrinol (Oxf) 2016; 85 : 122-131.
11. Boelaert K, Horacek J, Holder RL et al. Serum thyrotropin concentration as a novel predictor of malignancy in thyroid nodules investigated by fine‑needle aspiration. J Clin Endocrinol Metab. 2006;91 : 4295-301.
12. Gharib H, Papini E, Garber JR et al. AACE/ACE/AME Task Force on Thyroid Nodules. American Association of Clinical Endocrinologists and Associazione Medici Endocrinologi medical guidelines for clinical practice for the diagnosis and management of thyroid nodules- - 2016 UPDATE. Endocr Pract. 2016;22 : 622-39.
13. Krátký J, Ježková J, Kosák M et al. Positive Antithyroid Antibodies and Nonsuppressed TSH Are Associated with Thyroid Cancer: A Retrospective Cross‑Sectional Study. Int J Endocrinol. 2018 Sep 6;2018 : 9793850.
14. Mian C, Perrino M, Colombo C et al. Refining calcium test for the diagnosis of medullary thyroid cancer: cutoffs, procedures, and safety. J Clin Endocrinol Metab. 2014 May;99(5):1656-64.
15. Fugazzola L, Di Stefano M, Censi S et al. Basal and stimulated calcitonin for the diagnosis of medullary thyroid cancer: updated thresholds and safety assessment. J Endocrinol Invest. 2021 Mar;44(3):587-597.
16. Paschke R, Cantara S, Crescenzi A et al. European Thyroid Association Guidelines regarding Thyroid Nodule Molecular Fine‑Needle Aspiration Cytology Diagnostics. Eur Thyroid J. 2017 Jul;6(3):115-129.
17. Hegedüs L, Bonnema SJ, Bennedbaek FN. Management of simple nodular goiter: current status and future perspectives. Endocr Rev. 2003;24 : 102-32.
18. Lillevang‑Johansen M, Abrahamsen B, Jørgensen HL. Duration of over - and under‑treatment of hypothyroidism is associated with increased cardiovascular risk. Eur J Endocrinol. 2019;180 : 407-16.
19. Abrahamsen B, Jørgensen HL, Laulund AS et al. The excess risk of major osteoporotic fractures in hypothyroidism is driven by cumulative hyperthyroid as opposed to hypothyroid time: an observational register‑based time‑resolved cohort analysis. J Bone Miner Res. 2015;30 : 898-905.
20. Brandt F, Thvilum M, Almind D et al. Hyperthyroidism and psychiatric morbidity: evidence from a Danish nationwide register study. Eur J Endocrinol. 2013;170 : 341-8.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek Hlavní téma – Nefrologie
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2022 Číslo 7- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Magnosolv a jeho využití v neurologii
- S prof. Vladimírem Paličkou o racionální suplementaci kalcia a vitaminu D v každodenní praxi
-
Všechny články tohoto čísla
- Hlavní téma – Nefrologie
- Současné možnosti zpomalení progrese chronického onemocnění ledvin
- Expertní stanovisko ke spolupráci diabetologů a internistů s nefrology v péči o nemocné s chronickým onemocněním ledvin
- Glomerulonefritidy asociované s infekcemi
- Novinky v léčbě renální anémie – erytropoetin vs. inhibitory prolylhydroxylázy?
- Covid-19 u nemocných po transplantaci ledviny
- Reaktivní, infekční nebo postinfekční artritida?
- Účinek inhibitoru SGLT2 empagliflozinu na stabilizaci průběhu srdečního selhání s možností dalších intervencí u pacienta s HFrEF
- Nové technologie ve vývoji hypolipidemik. Inclisiran (LEQVIO®)
- Léčba hypertenze starších osob a její úskalí
- Incidentalomy štítné žlázy
- Můžeme novou léčbou ovlivnit dosavadní terapií neřešený zánět a fibrózu u pacientů s DM2 a CKD?
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Reaktivní, infekční nebo postinfekční artritida?
- Incidentalomy štítné žlázy
- Novinky v léčbě renální anémie – erytropoetin vs. inhibitory prolylhydroxylázy?
- Současné možnosti zpomalení progrese chronického onemocnění ledvin
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání