-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
CAR T-lymfocyty: horká novinka v léčbě nádorů
CAR T-cells: hot news in cancer therapy
Cancer immunotherapy has become a standard therapeutic option in oncology over the past few decades. From the early anti-tumor vaccine experiments in the late nineteenth and early twentieth centuries, its journey led through the discovery of the allogeneic hematopoietic stem cell transplantation principles in the nineteen-seventies, introduction of monoclonal antibodies in the nineteen-nineties, their enhancing in the form of immunoconjugates and bispecific antibody constructs, up to today’s checkpoint inhibitors and chimeric antigen receptor T-cells (CAR T-cells). Not so long ago, a treatment with genetically modified lymphocytes may have seemed quite like science fiction, but nowadays, these “living drugs“ are already being administered to patients with hematological malignancies in the Czech Republic. Some may see CAR T-cells as a breakthrough treatment method and bright future of oncology, others perhaps just as an overhyped sensation, in which the cost far exceeds the efficacy. Either way, CAR T-cells will soon become a relatively routine treatment option for patients with resistant lymphoproliferative diseases. Our article aims to introduce this new interesting method to specialists outside the fields of hematology and oncology.
Keywords:
adoptive immunotherapy – axicabtagene ciloleucel – Cancer treatment – CAR T -cells – chimeric antigen receptor – tisagenlecleucel
Autoři: Štěpán Hrabovský
Působiště autorů: Interní hematologická a onkologická klinika LF MU a FN Brno, pracoviště Bohunice
Vyšlo v časopise: Vnitř Lék 2020; 66(7): 420-424
Kategorie: Přehledové články
Souhrn
Protinádorová imunoterapie se stala během posledních desetiletí již standardní součástí onkologického léčebného portfolia. Od prvních pokusů s protinádorovými vakcínami na konci 19. a v 1. polovině 20. století její cesta vedla přes objevení principů alogenní transplantace krvetvorných buněk v 70. letech, zavedení monoklonálních protilátek v letech 90., jejich zdokonalení ve formě imunokonjugátů a bispecifických protilátkových konstruktů až k dnešním checkpoint inhibitorům a T -lymfocytům s chimérickým antigenním receptorem (CAR T - lymfocyty). Ještě v nedávné době se léčba geneticky modifikovanými lymfocyty mohla zdát jako science-fiction, ale tyto „živé léky“ se již podávají pacientům s hematologickými malignitami i u nás v České republice. Někteří vidí v CAR T -lymfocytech přelomovou léčebnou metodu a světlou budoucnost onkologie, jiní snad jen přeceňovanou senzaci, jejíž nákladnost dalece převyšuje efektivitu. Tak či onak se CAR T -lymfocyty v nejbližší době dostanou do relativně rutinního používání v léčbě pacientů s rezistentními lymfoproliferacemi. Náš článek si klade za cíl přiblížit tuto zajímavou léčebnou metodu i čtenářům s odborným zaměřením mimo oblast hematologie a onkologie.
Klíčová slova:
adoptivní imunoterapie – axikabtagen ciloleucel – CAR T- lymfocyty – chimérický antigenní receptor – protinádorová léčba – tisagenlekleucel
Historie protinádorové imunoterapie
Pravděpodobně prvním zaznamenaným pokusem o protinádorovou imunoterapii jsou experimenty Williama B. Coleyho z New Yorku publikované v roce 1891. Pacientům s osteosarkomem aplikoval injekčně kultury pyogenního streptokoka, po čemž pozoroval u některých pacientů dokonce i dlouhodobě trvající kompletní remise (1). Efekt tohoto experimentu si dnes vysvětlujeme up -regulací produkce interleukinu 12 (IL-12) generalizovanou infekcí, zvýšením hladin interferonu γ (IFNγ) a tím stimulací protinádorové aktivity T - lymfocytů a NK buněk. I přes působivé výsledky byl Coley za tyto pokusy odbornou veřejnost kritizován, zčásti jistě proto, že část jeho pacientů zemřela na streptokokovou infekci. Svou metodu sice zdokonalil nahrazením živých bakterií za inaktivované, ale ve stínu začínající radioterapie tyto první krůčky imunoterapie na nějakou dobu upadly v zapomnění.
Myšlenka ovlivnění imunitního systému ve prospěch protinádorového efektu byla znovu oprášena v 50. letech 20. století, kdy manželé Grahamovi použili první moderní protinádorovou vakcínu u pacientek s gynekologickými nádory, z nichž 1/5 zaznamenala parciální remisi nebo alespoň zpomalení progrese nemoci (2). V 70. letech minulého století byly v University of Minnesota provedeny první alogenní transplantace krvetvorné tkáně u pacientů s hematologickými malignitami, tedy nahrazení pacientova imunitního systému nereagujícího proti tumoru imunitním systémem zdravého dárce.
Pionýrem specifické adoptivní imunoterapie se však stal až Steven A. Rosenberg z National Cancer Institute v Bethesdě, který v roce 1985 publikoval výsledky prvního použití in vitro interleukinem 2 (IL-2) aktivovaných leukocytů v léčbě metastatických nádorů (3). Tuto metodu poté zdokonalil použitím lymfocytů extrahovaných přímo z tumoru (tzv. tumor -infiltrujících lymfocytů – TIL), které již byly v prostředí tumoru přirozeně aktivovány antigeny specifickými pro daný tumor (4, 5).
Současně již v roce 1989 v izraelském Weizmann Institute of Science vznikl první návrh chimérického antigenního receptoru (CAR) a 4 roky poté byla kultivována první generace T - lymfocytů s tímto arteficiálním receptorem (6). Původní záměr metody, léčba infekce virem lidské imunodeficience (human immunodeficiency virus – HIV), se ale brzy ukázal být slepou uličkou (7, 8). Myšlenka využít CAR T - lymfocyty v léčbě nádorů na sebe nenechala dlouho čekat a v roce 2003 byla publikována první preklinická data o účinnosti CAR T - lymfocytů na myším modelu hematologických malignit (9–11). Po řadě studií I. a II. fáze byl pak v roce 2017 americkou Food and Drug Administration (FDA) schválen ke klinickému použití první komerční preparát CAR T - lymfocytů tisagenlekleucel a o několik měsíců později druhý preparát axikabtagen ciloleucel (Obr. 1). Oba prokázaly výrazné zvýšení počtu dosažených kompletních remisí a prodloužení celkového přežití oproti standardní chemoterapii u pacientů s opakovaně relabujícími agresivními lymfoproliferacemi (12, 13).
Obr. 1. Tisagenlekleucel (KymriahTM) a axikabtagen ciloleucel (Yescarta®). 
V zemích Evropské unie jsou oba léky dostupné od srpna roku 2018. Indikací tisagenlekleucelu je léčba relabované nebo refrakterní akutní B lymfoblastické leukemie (R/R B - ALL) dětí a mladých dospělých do věku 25 let v případě druhého relapsu nebo relapsu po alogenní transplantaci krvetvorných buněk a opakovaně relabujícího nebo refrakterního difuzního velkobuněčného B lymfomu dospělých (R/R DLBCL). Axikabtagen ciloleucel je schválen pro léčbu R/R DLBCL a relabujícího nebo refrakterního primárního mediastinálního velkobuněčného B lymfomu (R/R PMBCL) dospělých. Léčba prvního pacienta CAR T -lymfocyty v České republice proběhla v září roku 2019.
Co jsou CAR T -lymfocyty?
CAR T - lymfocyty jsou in vitro modifikované autologní T - lymfocyty pacienta, do kterých je vpraven gen pro chimérický antigenní receptor se specificitou proti definovanému povrchovému antigenu nádorové buňky. Oba v současnosti schválené preparáty CAR T - lymfocytů jsou cílené proti antigenu CD19. Ten je exprimován na povrchu všech vývojových stadií B -lymfocytů i na převážné většině malignit z B - lymfocytů vycházejících (14). V klinických studiích jsou již zkoušeny CAR T - lymfocyty cílené na nejrůznější další povrchové antigeny hematologických i solidních malignit, např. CD22, CD30, CD138, BCMA, EGFR, CEA, HER2, mezotelin, PD - L1 a řadu dalších (11). Dosavadní výsledky léčby CAR T - lymfocyty jsou velmi motivující. Již několik studií I. a II. fáze prokázalo 70–85 % navozených kompletních remisí u těžce předléčených pacientů s R/R ALL a 40–55 % u pacientů s R/R DLBCL (13, 15–17).
Samotný chimérický antigenní receptor první generace je proteinový konstrukt skládající se ze 4 částí:
- domény rozeznávající antigen odvozené z variabilní části imunoglobulinu,
- spojovacího hinge regionu,
- transmembránové domény,
- intracelulární domény odvozené z T - buněčného receptoru (T - cell receptor – TCR) (Obr. 2).
Obr. 2. Struktura jednotlivých generací chimérických antigenních receptorů 
CD3ζ – fragment T buněčného receptoru aktivující T-lymfocyt, IL12 – interleukin 12, IL-2Rβ– β řetězec receptoru interleukinu 2, JAK-STAT3/5 – signální dráha účastnící se aktivace T-lymfocytu Cytotoxický CAR T - lymfocyt s takto složeným receptorem je přímo aktivován navázáním na cílový antigen nádorové buňky a dokáže zničit postupně i stovky nádorových buněk. Oproti přirozeným cytotoxickým T -lymfocytům nepotřebuje ke své aktivaci rozpoznání lidského leukocytárního antigenu I. třídy (human leukocyte antigen – HLA) cílové buňky ani spolupráci jiných imunitních buněk (10).
Tisagenlekleucel i axikabtagen ciloleucel jsou léčivé přípravky obsahující CAR T - lymfocyty 2. generace, které mají v intracelulární doméně přidánu kostimulační doménu zlepšující expanzi buněk a jejich přetrvávání v hostitelském organismu.
Výroba CAR T -lymfocytů
Výroba CAR T - lymfocytů je velmi komplikovaná a organizačně i časově náročná. Od indikace pacienta k léčbě do podání infuze trvá celý proces 2–6 týdnů (Obr. 3). Právě časová náročnost může být u pacientů s agresivními lymfoproliferacemi hlavním faktorem limitujícím použitelnost této léčby. Prvním krokem výroby je odběr mononukleárních buněk z periferní krve pacienta pomocí přístrojové leukaferézy. Tyto buňky jsou odeslány do „továrny“ na CAR T -lymfocyty. Tato výrobní zařízení jsou v USA, Německu, Nizozemsku a Francii.
Obr. 3. Proces výroby CAR T-lymfocytů 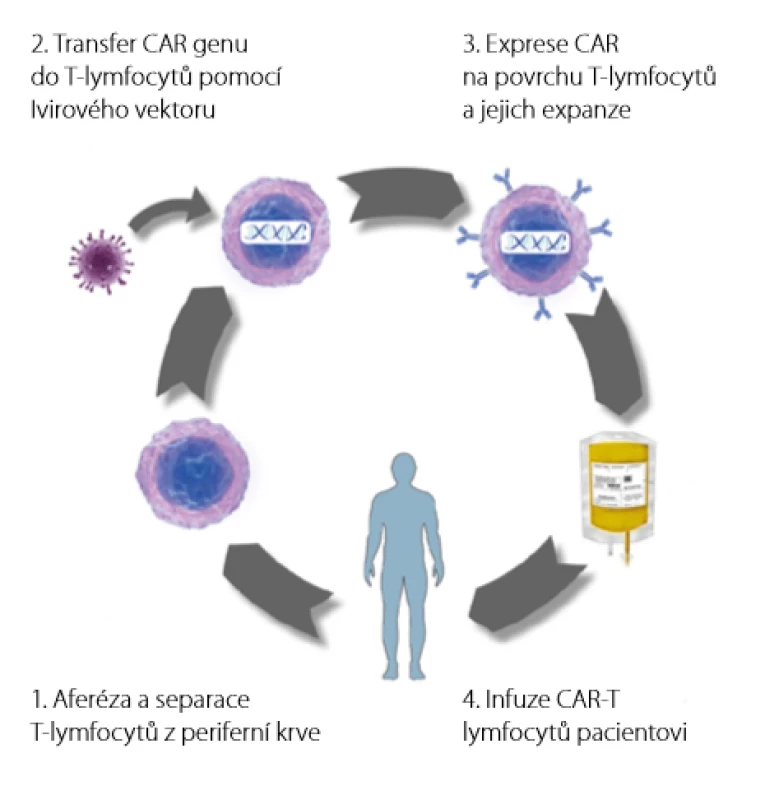
Ve výrobním zařízení jsou z mononukleárních buněk separací odděleny T -lymfocyty, do kterých je vpraven gen pro CAR. Vektorem přenosu genu je nejčastěji modifikovaný lentivirus nebo gamaretrovirus, zkoušeny jsou ale i další postupy jako přenesení genu syntetickým transpozonem (technologie Sleeping Beauty) nebo přímá elektroporace mRNA do T -lymfocytů (18, 19). Takto modifikované T -lymfocyty jsou poté aktivovány a namnoženy za přítomnosti směsi cytokinů a živin. Celý proces probíhá v jedné z automatických platforem, tzv. buněčných procesorů (Obr. 4). Hotový produkt je opět zmrazen na teplotu kapalného dusíku a odeslán na klinické pracoviště. Pacientovi je v mezidobí podána lymfodepleční chemoterapie, která prodlužuje následné přežívání CAR T - lymfocytů v hostitelském organismu. Samotné CAR T - lymfocyty jsou poté rozmrazeny a formou intravenózní infuze aplikovány pacientovi.
Obr. 4. Automatický buněčný procesor Miltenyi CliniMACS Prodigy®, jedna z platforem používaných k výrobě CAR T-lymfocytů 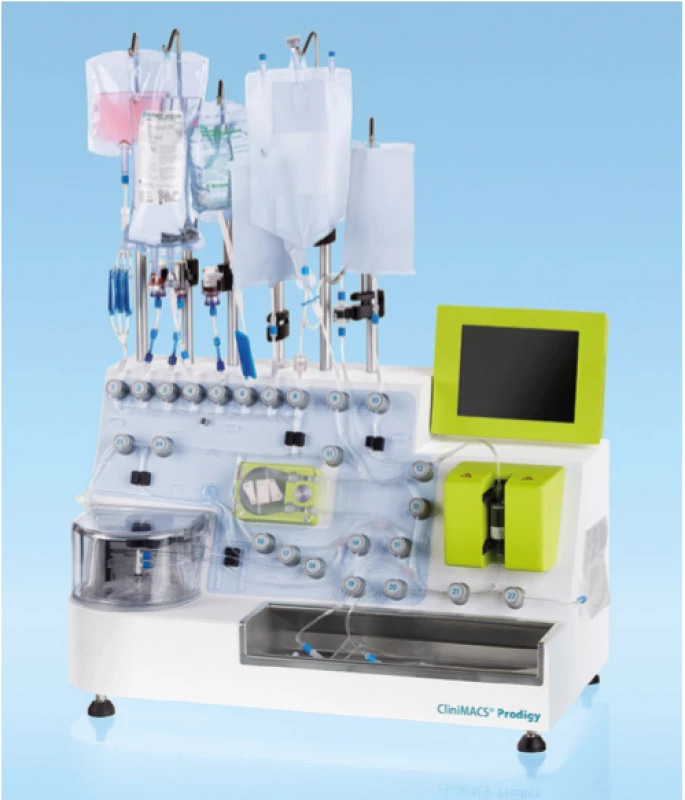
Nežádoucí účinky a komplikace
Léčba CAR T -lymfocyty s sebou nese riziko některých specifických a potenciálně velmi závažných komplikací. Prvním z nežádoucích účinků je syndrom z uvolnění cytokinů (cytokine release syndrome – CRS). Je způsoben suprafyziologickou odpovědí hostitelského organismu na imunoterapii, která vyúsťuje v aktivaci endogenních i infundovaných imunitních efektorových buněk a produkci prozánětlivých cytokinů. Projeví se několik dní po infuzi CAR T - lymfocytů horečkou, v závažnějších případech hypotenzí, respiračním selháním a selháváním dalších orgánů. Těžká forma CRS připomíná v mnoha aspektech septický šok. Základní terapií jsou kortikoidy, tocilizumab a podpůrná léčba selhávajících orgánových funkcí. Tocilizumab je monoklonální protilátka proti receptoru pro interleukin 6 (IL-6R), který hraje ústřední roli v patogenezi CRS.
Další specifickou komplikací je syndrom neurotoxicity asociovaný s imunitními efektorovými buňkami (immune effector cell -associated neurotoxicity syndrome - ICANS, nebo CAR T -related encephalopathy syndrome – CRES). Projevuje se také většinou v prvních dnech po infuzi CAR T - lymfocytů, příznaky mohou být velmi různorodé, typická je expresivní afazie, apraxie a tremor, může nastat dezorientace, paréza, kvantitativní porucha vědomí nebo epileptický záchvat. Hlavní léčbou jsou opět kortikoidy, případně antiepileptika, při souběhu s CRS se podává tocilizumab.
Mezi další komplikace patří aplazie zdravých B - lymfocytů, které jsou při léčbě anti -CD19 CAR T -lymfocyty zničeny spolu s maligními buňkami. Při chybění B -lymfocytů dochází ke hypogamaglobulinemii a zvýšenému riziku infekčních komplikací s nutností dlouhodobé substituce intravenózními imunoglobuliny (20, 21).
Budoucnost CAR T -lymfocytů
Nyní dostupné CAR T - lymfocyty jsou označovány jako 2. generace. Ve stadiu klinických studií jsou 3. generace CAR T - lymfocytů s kombinací více kostimulačních domén a 4. generace, tzv. TRUCK (T - cell Redirected Universal Cytokine Killing), které jsou schopny pomocí sekrece vlastního transgenního IL-12 zvýšit migraci naivních imunitních buněk do oblasti nádoru s cílem posílení imunitní reakce namířené proti nádorovým buňkám (22, 23). Pátá generace CAR T - lymfocytů má v intracelulární doméně β řetězec receptoru pro interleukin 2 (IL-2) s vazebným místem pro transkripční faktor STAT3. Tyto buňky jsou aktivovány třemi cestami prostřednictvím svého CD3, kostimulační domény i cytokinové signalizace dráhy JAK -STAT3/5 (24).
Jsou zkoušeny CAR T - lymfocyty se specificitou proti nejrůznějším povrchovým antigenům exprimovaným na hematologických i solidních tumorech. V budoucnu se tedy možná dočkáme účinných CAR T - lymfocytů proti mnohočetnému myelomu, akutní myeloidní leukemii, glioblastomu, mezoteliomu, karcinomu střeva, prostaty, prsu, plic, pankreatu i dalších (11, 25).
Stejně jako při léčbě monoklonálními protilátkami, i u CAR T - lymfocytů může dojít k imunitnímu úniku tumoru a vzniku rezistence k léčbě. Nejčastěji je to způsobeno down - regulací nebo úplnou ztrátou cílového antigenu maligní buňky. Klonální selekcí pak dojde k nahrazení původního citlivého klonu klonem rezistentním. Riziko vzniku rezistentního klonu lze snížit např. použitím CAR T -lymfocytů se 2 nebo více různými CAR namířenými proti různým antigenům přítomným na maligní buňce, nebo T - lymfocytů s jedním bispecifickým CAR, který se dokáže vázat na 2 různé antigeny, anebo podáním dvou samostatných populací CAR T - lymfocytů cílených na různé antigeny tumoru (10, 25–28). Ve vývoji jsou i CAR NK buňky (natural killer), které kromě aktivace CAR receptorem mohou být v tumoru aktivovány i přirozeně prostřednictvím svého Fc -receptoru mechanismem cytotoxicity závislé na protilátce (antibody - dependent cellular cytotoxicity – ADCC) (10, 29, 30).
Dalším problémem léčby CAR T - lymfocyty bývá toxicita mimo lokalitu tumoru. Zvýšení selektivity CAR T - lymfocytů lze dosáhnout rovněž jejich vybavením dvěma různými CAR, kdy je potřeba k aktivaci T - lymfocytu navázání obou CAR na maligní buňku. Jiným zkoumaným přístupem je zabudování buněčného aktivačního nebo sebevražedného genového „vypínače“ do CAR T - lymfocytu. Exprese tohoto genu a tím i aktivita CAR T -lymfocytů je pak regulována jinou, jinak v organismu neškodnou, exogenně podanou látkou (25, 31).
Zajímavým konceptem jsou univerzální CAR T -lymfocyty využívající silnou vazbu biotinu a avidinu. Pacientovi se tak podá jedna nebo více monoklonálních protilátek značených biotinem namířených proti antigenům daného tumoru a univerzální CAR T - lymfocyty, jejichž CAR obsahuje sekvenci avidinu vázající biotin (biotin - binding immunoreceptor – BBIR). Tato metoda výroby CAR T - lymfocytů je flexibilnější a ekonomicky výhodnější pro plošné využití (32).
Časová náročnost výroby CAR T - lymfocytů může výrazně limitovat možnost jejich použití u pacientů s agresivními malignitami. Možným řešením je vývoj alogenních CAR T - lymfocytů s deficitem svého původního TCR, které tak nezpůsobují reakci štěpu proti hostiteli a mohou být podány bez ohledu na neshodu v HLA systému. Takové CAR T - lymfocyty mohou být rovněž vyrobeny předem z krve zdravých dárců a pro pacienta dostupné v podstatě ihned (33).
CAR technologie by mohla být účinná i v léčbě neonkologických onemocnění, především autoimunitních. Treg lymfocyty (regulatory T - cells) hrají důležitou roli při regulaci imunitní reakce. Pomocí CAR Treg lymfocytů by mohlo být dosaženo účinné cílené imunotolerance v místě autoimunitního zánětu, např. při diabetu I. typu, roztroušené skleróze či nespecifických střevních zánětech (34).
Závěr
CAR T - lymfocyty nyní v hematologii a onkologii jsou, a jistě i v dalších letech až desetiletích budou, velmi skloňovaným pojmem. S registrací nových CAR T - lymfocytárních produktů, rozšířením jejich indikací na další typy malignit a snížením jejich zatím extrémní finanční nákladnosti lze očekávat jejich použití u stále většího množství pacientů. Skutečnou účinnost a uplatnitelnost této léčebné metody v reálných klinických podmínkách však bezesporu odhalí až čas.
Tato publikace vznikla na Masarykově univerzitě v rámci projektu číslo MUNI/A/1395/2019, podpořeného z prostředků účelové podpory na specifický vysokoškolský výzkum, kterou poskytlo MŠMT v roce 2020.
KORESPONDENČNÍ ADRESA AUTORA:
MUDr. Štěpán Hrabovský,
Interní hematologická a onkologická klinika LF MU a FN Brno,
pracoviště Bohunice,
Jihlavská 20,
625 00 Brno
Cit. zkr: Vnitř Lék 2020; 66(7): 420–424
Článek přijat redakcí: 18. 11. 2019
Článek přijat po recenzích k publikaci: 10. 1. 2020
Zdroje
1. Coley WB. Contribution to the Knowledge of Sarcoma. Ann Surg 1891; 14 : 199–220.
2. Graham JB, Graham RM. The effect of vaccine on cancer patients. Surg Gynecol Obstet 1959; 109 : 131–138.
3. Rosenberg SA, Lotze MT, Muul LM, et al. Observations on the systemic administration of autologous lymphokine - activated killer cells and recombinant interleukin-2 to patients with metastatic cancer. N Engl J Med 1985; 313 : 1485–1492.
4. Decker WK, da Silva RF, Sanabria MH, et al. Cancer Immunotherapy: Historical Perspective of a Clinical Revolution and Emerging Preclinical Animal Models. Front Immunol 2017; 8 : 829.
5. Rosenberg SA, Packard BS, Aebersold PM, et al. Use of tumor - infiltrating lymphocytes and interleukin-2 in the immunotherapy of patients with metastatic melanoma. A preliminary report. N Engl J Med 1988; 319 : 1676–1680.
6. Gross G, Waks T, Eshhar Z. Expression of immunoglobulin - T - cell receptor chimeric molecules as functional receptors with antibody -type specificity. Proc Natl Acad Sci USA 1989; 86 : 10024–10028.
7. Romeo C, Seed B. Cellular immunity to HIV activated by CD4 fused to T cell or Fc receptor polypeptides. Cell 1991; 64 : 1037–1046.
8. Roberts MR, Qin L, Zhang D, et al. Targeting of human immunodeficiency virus - infected cells by CD8+ T lymphocytes armed with universal T -cell receptors. Blood 1994; 84 : 2878–2889.
9. Brentjens RJ, Latouche JB, Santos E, et al. Eradication of systemic B -cell tumors by genetically targeted human T lymphocytes co - stimulated by CD80 and interleukin-15. Nat Med 2003; 9 : 279–286.
10. Firor AE, Jares A, Ma Y. From humble beginnings to success in the clinic: Chimeric antigen receptor - modified T - cells and implications for immunotherapy. Exp Biol Med (Maywood) 2015; 240 : 1087–1098.
11. Filley AC, Henriquez M, Dey M. CART Immunotherapy: Development, Success, and Translation to Malignant Gliomas and Other Solid Tumors. Front Oncol 2018; 8 : 453.
12. Maude SL, Laetsch TW, Buechner J, et al. Tisagenlecleucel in Children and Young Adults with B -Cell Lymphoblastic Leukemia. N Engl J Med 2018; 378 : 439–448.
13. Neelapu SS, Locke FL, Bartlett NL, et al. Axicabtagene Ciloleucel CAR T -Cell Therapy in Refractory Large B -Cell Lymphoma. N Engl J Med 2017; 377 : 2531–2544.
14. Robillard N, Wuillème S, Moreau P, et al. Immunophenotype of normal and myelomatous plasma -cell subsets. Front Immunol 2014; 5 : 137.
15. Maude SL, Frey N, Shaw PA, et al. Chimeric antigen receptor T - cells for sustained remissions in leukemia. N Engl J Med 2014; 371 : 1507–1517.
16. Schuster SJ, Bishop MR, Tam CS, et al. Tisagenlecleucel in Adult Relapsed or Refractory Diffuse Large B -Cell Lymphoma. N Engl J Med 2019; 380 : 45–56.
17. Lee DW, Kochenderfer JN, Stetler - Stevenson M, et al. T cells expressing CD19 chimeric antigen receptors for acute lymphoblastic leukaemia in children and young adults: a phase 1 dose -escalation trial. Lancet 2015; 385 : 517–528.
18. Monjezi R, Miskey C, Gogishvili T, et al. Enhanced CAR T - cell engineering using non-viral Sleeping Beauty transposition from minicircle vectors. Leukemia 2017; 31 : 186–194.
19. Zhao Y, Moon E, Carpenito C, et al. Multiple injections of electroporated autologous T cells expressing a chimeric antigen receptor mediate regression of human disseminated tumor. Cancer Res 2010; 70 : 9053–9061.
20. Brudno JN, Kochenderfer JN. Recent advances in CAR T - cell toxicity: Mechanisms, manifestations and management. Blood Rev 2019; 34 : 45–55.
21. Lee DW, Santomasso BD, Locke FL, et al. ASTCT Consensus Grading for Cytokine Release Syndrome and Neurologic Toxicity Associated with Immune Effector Cells. Biol Blood Marrow Transplant 2019; 25 : 625–638.
22. Zang YW, Gu XD, Xiang JB, et al. Clinical application of adoptive T cell therapy in solid tumors. Med Sci Monit 2014; 20 : 953–959.
23. Chmielewski M, Hombach AA, Abken H. Of CARs and TRUCKs: chimeric antigen receptor (CAR) T cells engineered with an inducible cytokine to modulate the tumor stroma. Immunol Rev 2014; 257 : 83–90.
24. Tokarew N, Ogonek J, Endres S, et al. Teaching an old dog new tricks: next -generation CAR T cells. Br J Cancer 2019; 120 : 26–37.
25. Bagley SJ, O‘Rourke DM. Clinical investigation of CAR T cells for solid tumors: lessons learned and future directions. Pharmacol Ther 2019; 16 : 107419.
26. Majzner R, Mackall CL. Tumor Antigen Escape from CAR T - cell Therapy. Cancer Discov 2018; 8 : 1219–1226.
27. Hegde M, Mukherjee M, Grada Z, et al. Tandem CAR T cells targeting HER2 and IL13Rα2 mitigate tumor antigen escape. J Clin Invest 2016; 126 : 3036–3052.
28. Huang L, Wang N, Li C, et al. Sequential infusion of anti - CD22 and Anti - CD19 chimeric antigen receptor T cells for adult patients with refractory/relapsed B - cell acute lymphoblastic leukemia. Blood 2017; 130 : 846.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek Hypoglykemie u nediabetiků
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2020 Číslo 7- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Biomarkery pro neendoskopické vyšetření sliznice jícnu
- Riziko kardiovaskulárních komplikací v závislosti na hladině glykemie: od diabetes mellitus k prediabetu
- ERCP u pacientů po choledochoduodenoanastomóze
- Kostní metabolismus u idiopatických střevních zánětů 1
- Přidělovaná ošetřovatelská péče jako jeden z indikátorů výskytu medikačního pochybení
- Adenokarcinom tenkého střeva diagnostikovaný pomocí video kapslové endoskopie u pacientky s celiakií: kazuistika a přehled literatury
- Koagulopatie asociovaná s onemocněním COVID-19
- Současná diagnostika a terapie sarkoidózy
- Obštrukčné spánkové apnoe a arteriálna hypertenzia: úloha črevného mikrobiómu
- CAR T-lymfocyty: horká novinka v léčbě nádorů
- Renální selhání u mnohočetného myelomu a jeho léčba
- Raritní koincidence chylothoraxu a hydrothoraxu při adenokarcinomu žaludku – kazuistika
- Kostní metabolismus u idiopatických střevních zánětů 2
- Metformin -asociovaná laktátová acidóza
- Tangierská nemoc v rodině s fenotypem familiární hypercholesterolemie
- Hypoglykemie u nediabetiků
- Screening a krátká intervence u uživatelů nelegálních drog
- Muž s dysthymií (převážně negativním hodnocením všeho prožitého) indukoval depresi u senzitivní blízké osoby
- Etické konotace léčby onemocnění covid-19
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Hypoglykemie u nediabetiků
- Metformin -asociovaná laktátová acidóza
- Koagulopatie asociovaná s onemocněním COVID-19
- CAR T-lymfocyty: horká novinka v léčbě nádorů
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



