-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Renální selhání u mnohočetného myelomu a jeho léčba
Renal failure in multiple myeloma and its treatment
Renal failure is a serious complication of multiple myeloma, and up to 50% of patients with this most frequent haematological malignancy may develop some form of renal impairment. The aetiology of renal damage is multifactorial, but increased production of free light chains that are filtered into the urine is crucial for the development of renal failure and could be associated with distal tubule involvement (myeloma kidney, light chain cast nephropathy) or with fully developed Fanconi syndrome in proximal tubule damage (proximal tubulopathy, light chain proximal tubulopathy). Glomerular damage most often manifests as AL amyloidosis or light chain deposition disease; both cause severe nephrotic syndrome. Early and adequate chemotherapy in association with symptomatic treatment can lead to rapid reduction of serum light chain concentration which is necessary to prevent development of renal failure. At present, effective therapeutic procedures can be used for this purpose, where especially a triple combination of treatment containing one of the proteasome inhibitors (bortezomib, carfilzomib or ixazomib) is able to elicit a haematological response within a few days. If there is a good haematological response to treatment, up to 50% of patients with renal failure will restore their renal function. Renal function repair can be accelerated by removing light chains from serum by dialysis with high-cutoff membrane (HCO-HD). Using this procedure can increase the chance of dialysis independence in more than 60% of patients with renal failure. Data from previously published studies on HCO-HD (MYRE or EuLITE study) have not yielded as optimistic results as originally expected, however, HCO-HD could be beneficial for some subgroup of patients with renal failure in myeloma kidney. Despite the fact that overall prognosis and survival of patients with multiple myeloma have dramatically improved, the condition with renal failure in these patients remains serious.
Keywords:
bortezomib – dialysis with high-cutoff membrane – Multiple myeloma – cast nephropathy – renal failure
Autoři: Romana Ryšavá
Působiště autorů: Klinika nefrologie 1. LF UK a VFN Praha
Vyšlo v časopise: Vnitř Lék 2020; 66(7): 425-431
Kategorie: Přehledové články
Souhrn
Renální selhání je závažnou komplikací mnohočetného myelomu a nějakou formu ledvinného postižení může vyvinout až 50 % pacientů s touto nejčastější hematologickou malignitou. Etiologie poškození ledvin je multifaktoriální, ale zásadní roli hraje zvýšená produkce volných lehkých řetězců, které se filtrují do moči a mohou způsobit renální selhání v případě masivního postižení distálního tubulu (myelomová ledvina, light chain cast nephropathy), nebo plně vyvinutý Fanconiho syndrom při poškození proximálního tubulu (proximální tubulopatie, light chain proximal tubulopathy). Glomerulární poškození se nejčastěji projevuje jako AL -amyloidóza či nemoc z ukládání lehkých řetězců; oboje se manifestuje nefrotickým syndromem. Kromě symptomatické léčby může včasná a adekvátní chemoterapie, zaměřená na rychlé snížení koncentrace lehkých řetězců v séru, zabránit rozvoji renálního selhání. V současné době lze za tímto účelem použít efektivní terapeutické postupy, kdy zejména trojkombinace léčby obsahující některý z proteazomových inhibitorů (bortezomib, karfilzomib či ixazomib) je schopna navodit hematologickou odpověď během několika dní. V případě dobré hematologické odpovědi na léčbu obnoví renální funkci až 50 % pacientů s renálním selháním. Reparaci ledvinné funkce je možné urychlit odstraňováním lehkých řetězců ze séra pomocí dialýzy s vysokopropustnou membránou (HCO – high - cutoff dialýza). Použitím této metody lze zvýšit šanci na odpoutání od dialýzy u více jak 60 % nemocných s renálním selháním. Data z dosud publikovaných studií s HCO dialýzou (např. studie MYRE) nepřinesla až tak optimistické výsledky, jak se původně čekalo, nicméně lze říci, že terapie s HCO dialýzou je pro některé nemocné se selháním ledvin při myelomové ledvině přínosem. I když se celková prognóza nemocných s mnohočetným myelomem a jejich přežívání dramaticky zlepšily, situace v případě přítomnosti selhání ledvin zůstává stále závažnou.
Klíčová slova:
bortezomib – dialýza s high -cutoff membránou – mnohočetný myelom – myelomová ledvina – renální selhání
Úvod
Mnohočetný myelom (MM), jinak také plazmocytom či Kahlerova choroba, je maligní onemocnění z plazmatických buněk s infiltrací kostní dřeně. Tvoří asi 1 % všech malignit a až 10 % všech zhoubných hematologických onemocnění. Incidence MM se pohybuje kolem 3–4 nemocných na 100 000 osob, zvyšuje se s věkem (u nemocných nad 70 let to může být 5–10 nemocných na 100 000) (1). Skoro polovina nemocných s nově diagnostikovaným MM má nějakou formu poškození ledvin, přičemž závažnou renální insuficienci (sérový kreatinin nad 170 µmol/l) má 20 % z nich a léčbu akutní dialýzou vyžaduje skoro 10 % nemocných (1, 2). MM je nejčastější malignitou způsobující poškození ledvin a až 2 % nemocných v pravidelném dialyzačním léčení (celosvětově více než 5 000 nových nemocných ročně) má selhání ledvin právě v souvislosti s MM (3). Pacienti s MM a ireverzibilním selháním ledvin mají prokazatelně kratší dobu přežití než ti s MM a bez selhání ledvin, ale včas zahájená adekvátní chemoterapie může vést k odpojení od dialýzy až u poloviny nemocných (1, 2). Pacienti s terminálním selháním ledvin v dialyzačním programu mají 2,77× vyšší riziko úmrtí než nemocní se selháním ledvin jiné etiologie (4).
Patologický podklad onemocnění tkví v nadměrné produkci imunoglobulinů plazmatickými buňkami. Nekontrolovaná proliferace klonu plazma tických buněk je zodpovědná nejen za produkci imunoglobulinů či jejich částí (lehkých řetězců – LC), ale vede i k poruše vyzrávání ostatních plazmocytů, a tím ke snížení syntézy vlastních pro tilátek s určitým stupněm humorálního imunodefi citu. Vedle kompletních imunoglobulinů (nejčastěji IgG – kolem 50 % všech MM, dále IgA – 20 %) se u MM často tvoří ve velkém množství monoklonální LC (κ či λ), jejichž volnou frakci můžeme detekovat v séru jako volné LC (sFLC – serum free light chain) (5). Izolovaná produkce LC se vyskytuje asi u 16–20 % všech MM. U řady nemocných s MM dochází k rozvoji Bence - Jonesovy proteinurie (BJP), stavu, kdy LC či jejich fragmenty přecházejí do moči pa cientů. Přítomnost monoklonální komponenty (také označované jako paraprotein) v séru a moči přináší řadu klinických problémů včetně poškození ledvin, a jejich vý znam stoupá s prodlužující se dobou přežití pacientů s MM.
Všechny typy imu noglobulinů, a zejména pak FLC, mohou způsobovat renální poškození (6). Jejich jak přímý, tak nepřímý (toxický, komplementem zprostředkovaný) efekt může vést ke glomerulární i tubulární dysfunkci. FLC nebo jejich fragmenty mohou tvořit intratubulární depozita ve formě válců (myelomová ledvina, light chain cast nephropathy – LCCN), mohou precipito vat jako krystaly v tubulárních buňkách (Fanconiho syndrom při proximální tubulopatii, light chain proximal tubulopathy – LCPT), deponovat se v tubulární a glomerulární bazální membráně a mezangiu ve formě granulárních depozit (nemoc z ukládání lehkých řetězců, light chain deposition disease – LCDD) nebo kondenzovat jako amyloidové fibrily ve stěně cév a glomerulů (AL -amyloidóza). Méně často se můžeme setkat s poškozením ledvin, které má charakter membranoproliferativní glomerulonefritidy (zejména má - li paraprotein charakter kryoglobulinu) či tubulointersticiální nefritidy (Tab. 1). Vzhledem ke klíčovému významu funkce ledvin pro průběh MM má včasné, efektivní a specifické léčení selhání ledvin velmi podstatný význam.
Tab. 1. Nejčastější typy postižení ledvin u mnohočetného myelomu (modifikováno podle (6, 22, 38, 39)) 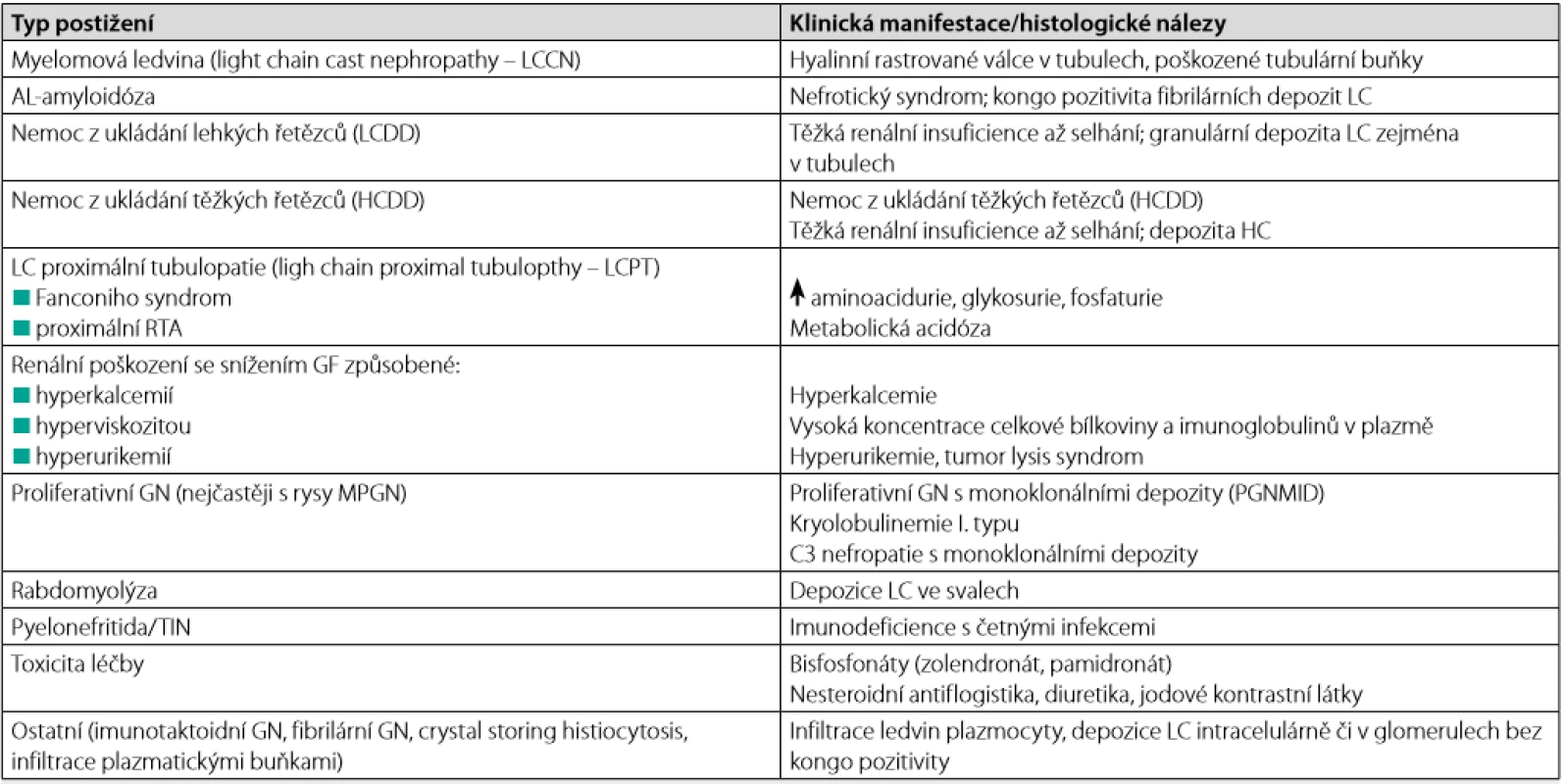
LC – light chain, HC – haevy chain, RTA – renální tubulární acidóza, GF – glomerulární filtrace, GN – glomerulonefritida, TIN – tubulointersticiální nefritida, MPGN – membranoproliferativní GN; PGNMID – proliferative GN with monoclonal immunoglobulin deposits Metabolismus lehkých řetězců v ledvinách
Ledviny jsou ústředním orgánem odpovědným za metabolismus LC. Tyto řetězce cirkulují v krvi ve formě monomerů (LC κ, molekulová hmotnost 22,5 kDa) či dimerů (LC λ, molekulová hmotnost 45 kDa) a jejich filtrace glomeruly závisí právě na jejich molekulové hmotnosti (40 % v případě LC κ, 20 % v případě LC λ) (7). Za nor málních okolností je 99 % profiltrovaných LC reab sorbováno (po vazbě na megalin/cubilinový receptorový systém) a hydrolyzováno epitelem proximálních tubulů (prostřednictvím klatrin - dependentního endozomo - lyzozomálního systému) na aminokyseliny a peptidy. Jakákoli forma tubulárního poškození snižuje reabsopci a degradaci LC, a tím zvyšuje jejich exkreci. Při vzniku LCCN hraje i přes možnou účast dalších patogenetických mechanismů ústřední roli zvýšená koncentrace LC v moči (mechanismem zvýšené filtrace z krve, ale i poruchou zpětné resorpce). Při těžším poškození tubulů dochází po reabsorpci k intracelulární precipitaci LC, ruptuře lyzozomů a buněčné smrti. FLC aktivují kaspázu 3 a 9 v buňkách proximálního tubulu a vedou k jejich apoptóze prostřednictvím kinázy ASK1 (apoptosis signal - regulating kinase 1) (8). Příčina rozdíl ného působení paraproteinu u jednotlivých onemocnění zůstává stále neobjasněna, je však zřejmé, že závisí (alespoň zčásti) na fyzikálních a chemických vlastnostech paraproteinu.
Myelomová ledvina
Myelomová ledvina (light chain cast nephropathy – LCCN) je nejčastějším typem poškození ledvin u MM (tvoří více než 30 % všech případů), ale současně způsobuje až 90 % všech akutních renálních selhání u nemocných s MM. Příliš velké množství FLC filtrujících se z krve do moči nestačí renální proximální tubuly zpětně resorbovat a FLC se hromadí v distálních tubulech, kde se váží přes specifickou, aminokyseliny vážící doménu (CDR3) na Tamm - Horsfallův protein (uromodulin). Zde pak tvoří shluky (válce) v luminu kanálků s následným rozvojem obstrukce, retrográdní dilatace a nekrózy tubulů a celého nefronu. Tyto změny jsou doprovázeny vznikem tubulointersticiálního zánětu (aktivace NF -κB a mitogen -aktivujících proteinkináz s následným uvolněním cytokinů a chemokinů atrahujících zánětlivými elementy) a produkcí profibrogenních faktorů, jako je TGFβ (transformig growth factor), a některých matrix proteináz, výsledkem čehož je vznik intersticiální fibrózy (9). Obstrukce tubulů je principiálně vratná, avšak pokud trvá po delší dobu, následuje atrofie tubulů a intersticiální fibróza. Akutní poškození ledvin tak přejde do nevratného terminálního selhání ledvin. Jako horní hranice sFLC, která je již velmi riziková pro rozvoj myelomové ledviny, se uvádí 500 mg/l. Proto je u všech nemocných s nejasným akutním selháním ledvin a koncentrací FLC nad 500 mg/l nutné tento typ poškození ledvin zvažovat (10).
V histologickém obraze je tato forma charakterizovaná nálezem velkých, laminovaných válců v distálních a sběrných ka nálcích, které jsou tvořeny hlavně monoklonálními LC, dále pak fibrinogenem, albuminem, uromodulinem a polyklonálními LC (11). Válce bývají obklo peny mnohojadernými buňkami, které vznikají nejspíše z makrofágů migrujících z inter sticia. Často v ledvinách nacházíme různý rozsah poškození i proximálního tubulár ního epitelu, manifestující se zejména akutní tu bulární nekrózou. Spolu s těmito změnami mohou být přítomny i známky intersticiální nefritidy. Imunofluorescenčním vyšetřením lze prokázat monoklonální depozita LC v buňkách proximálních tubulů, podél bazálních membrán tubulů i v intersticiu. Rozsah změn koreluje s počtem válců, ale nikoli s hladinou LC či sérovou koncentrací kreatininu.
AL -amyloidóza
Pro postižení ledvin u AL - amyloidózy je typické extracelulární ukládání LC (dominantně λ) v glomerulech či cévní stěně glomerulárních kapilár. Tato depozita se barví pozitivně konžskou červení a vykazují žlutozelené zbarvení při pozorování v polarizačním mikroskopu. Incidence AL - amyloidózy se pohybuje kolem 10 případů/1 milion. MM komplikuje v 10–15 % případů a dominantně postiženým orgánem jsou ledviny, což se projevuje těžkým nefrotickým syndromem. Pokud jsou depozity dominantně postiženy cévy, pak bývá proteinurie malá a nemocní mají spíše známky pokročilé renální insuficience (12).
Nemoc z ukládání lehkých řetězců
LCDD je onemocnění s dominantní depozicí LC κ (typ I a IV) především v ledvinách, ale i jiných orgánech. Tato depozita se nebarví
konžskou červení, mají většinou granulární vzhled a predominantně se ukládají ve formě lineárních depozit LC v bazálních membránách glomerulů či tubulů. Depozita LC v ledvinách mohou vést k transformaci mezangiálních buněk do myofibroblastů, které jsou zdrojem TGFβ, jenž je zodpovědný za zvýšenou produkci extracelulární matrix (13). U nemocných s LCDD se MM vyskytuje až v 65 %, přičemž postižení ledvin se může manifestovat jak nefrotickým syndromem, tak rychlým zhoršováním renální funkce s malými močovými nálezy (typický rozdíl oproti AL -amyloidóze).Další faktory ovlivňující renální funkci u MM
Na rozvoji renální insuficience až selhání se uplat ňuje řada různých patogenetických mechanismů (6). Nejčastější jsou hyperkalcemie, dehydratace a infekce. Uvedené mechanismy se mnohdy vzájemně potencují. Hyperkalcemie se vyskytuje až u 25 % pacientů s MM. Je důsledkem zvýšené kostní reab sorpce způsobené lokální aktivací osteoklastů, které jsou stimulovány celou řadou cytokinů (např. IL1β). Dalším faktorem je zvýšená viskozita krve při vysokých hladinách paraproteinu. Vyskytuje se hlavně u IgM paraproteinemie a je spojena s neu rologickými příznaky a krvácivými komplikacemi. Významným faktorem může být i podávání léků s nefrotoxickým účinkem – nejčastěji aminogly kozidových antibiotik a nesteroidních antirevmatik (NSA), často užívaných k léčbě algického syndromu u pacientů s osteolytickými lézemi skeletu. Zvláště nebezpečné je je jich podávání u pacientů s preexistujícím renálním onemocněním, kardiálním selháváním nebo při současné léčbě diuretiky. Aplikace radiodiagnostických látek je dnes mezi faktory přispívajícími ke vzniku renál ního selhání uváděna spíše historicky. Dostatečná prevence dehydratace v období přípravy před vyš etřením a použití nízkoosmolárních či izoosmolárních kontrastních látek riziko renálního poškození minimalizuje. Nebezpečné mohou být i některé bisfosfonáty podávané u hyperkalcemie a osteolytických lézí, které se mohou kumulovat u renálního selhání (např. zolendronát). Nezanedbatelným rizikovým faktorem usnadňujícím precipitaci LC v tubulech může být i hyperurikemie, které je u řady nemocných s MM přítomna.
Laboratorní diagnostika postižení ledvin u MM a klinická manifestace
U MM se můžeme se tkat se širokým spektrem poruch renálních funkcí. Funkční tubulární poruchy jsou výrazem mírnějšího poškození renálního parenchymu. Mohou předchá zet dlouhou dobu klinickým projevům základního onemocnění a jsou zřejmě relativně častou kompli kací, zřídka se však porucha proximálního tubulu manifestuje jako kompletní získaný Fanconiho syndrom. Ten, pokud k jeho plné manifestaci do jde, byl popsán takřka výlučně u BJP typu LC - κ. Proximální funkční syndromy nedosahují klinicky významné úrovně, stejně jako porucha acidifikační a koncentrační schopnosti v případě postižení dis tálního tubulu. Nefrotický syndrom není typický pro nemocné s MM (v některých souborech je udáván jen u 13 % nemocných), pokud není renální posti žení komplikováno současnou přítomností AL - amy loidózy. Rozvoj akutního renálního selhání je častěji popisován u pacientů s paraproteinem typu IgD či u nemocných s denní produkcí FLC vyšší než 10 g (2).
Prognóza celkového přežití je u MM zcela zásadním způsobem ovlivňována právě úrovní funkce ledvin. U pacientů s hodnotou kreatininu nižší než 130 μmol/l je medián přežití 44 měsíců; pokud dojde k akutnímu selhání ledvin, snižuje se až na 4 měsíce (2, 14). K tomu, aby se zabránilo ireverzibilnímu renálnímu poškození, je nutná rychlá diagnóza a především zahájení účinné léčby. Nejméně u po loviny pacientů vede adekvátní léčebný postup ke zlepšení či plné restituci renálních funkcí. Proces reparace renálních funkcí může být dlouhodobý, průměrně více než 100 dní. V současné době bylo pro MM navrženo několik prognostických schémat, podle kterých prognózu onemocnění ovlivňuje především množství nádo rové hmoty (posuzované podle množství produko vaného paraproteinu, resp. FLC, podle hladin β2 -mikroglobulinu, laktátdehydrogenázy a sérového albuminu) a citlivost nádoru na chemoterapii (15). Dysfunkci některých orgánů při postižení MM definují kritéria CRAB (hyperkalcemie, renální nedostatečnost, anémie a osteolytická ložiska ve skeletu) (16). Zdá se, že klíčovou roli pro vývoj onemocnění z jeho benigní formy (MGUS) do manifestního MM mají genetické abnormality, zejména translokace části chromozomu 14 (t(14;16) (q32.33;23)) či 4q16.3 (17). Tyto změny vedou k deregulaci klíčových genů s následnou transformací plazmatických buněk do maligního klonu. Mezi cytokiny, které významným způsobem zasahují do patogeneze MM, patří IL6, TNFα, ale také VEGF (vascular endothelial growth factor) a IGF1 (insulin growth factor).
Ke standardní detekci monoklonální komponenty v séru (ale i moči) slouží elektroforéza bílkovin (ELFO), která je ale schopna detekovat jen přítomnost monoklonálního proteinu produkovaného ve větším množství (senzitivita metody se pohybuje na dolní hranice kolem 500–2 000 mg/l). Metoda ale selhává v případě detekce FLC, jejichž koncentrace se pohybují kolem 10–20 mg/l. Zde je nutné použít některé z novějších metod, jako např. metody Freelite. Imunofixace séra (imunoelektroforéza) je metoda senzitivnější než ELFO (spodní limit detekce má senzitivitu kolem 150–500 mg/l), ale neumožňuje kvantifikovat množství produkovaného paraproteinu. Jako optimální pro záchyt monoklonální komponenty se proto jeví kombinace vyšetření imunofixace séra a koncentrace FLC s poměrem κ/λ v séru, která je schopna odhalit 91–98 % všech paraproteinemií (18, 19). Monitorace sFLC je dnes již rutinním vyšetřením. Koncentrace sFLC je závislá na renální funkci (exkrece ledvinami), a proto s klesající glomerulární filtrací stoupá koncentrace sFLC, ale jejich vzájemný poměr (rFLC) se mění jen málo (18, 20). Výrazně patologický poměr mezi LC pak vypovídá o závažnosti klonální produkce. Ukazuje se např., že rFLC < 0,125 a > 8 je u nemocných s doutnajícím (asymptomatickým) MM spojen s poloviční délkou přežívání v porovnání s těmi, kde je rFLC v referenčním rozmezí. Podobné rozdíly v přežívání pak byly zaznamenány i u nemocných se symptomatickým MM, kde špatná prognóza byla spojena s rFLC < 0,03 či > 32 (21).
Stanovení koncentrace FLC v moči je možné, nicméně v rutinní diagnostice se neprovádí. Důvodem je skutečnost, že kvantitativní posouzení množství LC v moči je ovlivněno renální funkcí a dále i velikostí proteinurie (při větší proteinurii interferuje zejména albumin se zpětným vstřebáváním FLC přes megalin/cubilový systém a tudíž vylučování FLC do moči je zvýšené). Oba tyto faktory mohou ovlivnit interpretaci nálezů. Navíc stanovení močových FLC nezvýší již tak vysokou senzitivitu kombinace testů imunofixace séra a sFLC.
Metodou umožňující přesnou detekci typu paraproteinu obsahujícího celé řetězce imunoglobulinů i jejich kvantifikaci je metoda Hevylite. Je schopna detekovat tyto typy paraproteinu i v malém množství, čehož se využívá nejen pro diagnostiku, ale i pro detekci tzv. zbytkové choroby. Výhodou metody je to, že při stanovení některých typů paraproteinu nedochází k interferenci s ostatními proteiny (např. s transferinem u IgA paraproteinemie), tak jak tomu může být u běžné elektroforézy séra. Metoda je schopna odlišit produkci monoklonálních imunoglobulinů od fyziologické polyklonální produkce a výsledky nejsou ovlivněny úrovní renální funkce (na rozdíl třeba od koncentrace β2-mikroglobulinu).
Léčba akutního renálního selhání u MM
Při léčbě akutního renálního selhání u MM je třeba dodržovat některé zásady, které mohou urychlit reparaci renální funkce.
- Vyloučit precipitující faktory, včetně vysazení možných nefrotoxických léků (antibiotika, NSA, diuretika). Rychlá úprava dehydratace je prvním, často rozhodujícím te rapeutickým zásahem. Cílem je zajistit denní diurézu kolem 3 l. Zásadní je také rychlá úprava hyperkalcemie. Podávání furosemidu může být v některých případech nebezpečné, zejména je -li nemocný současně dehydratovaný. Volíme proto i další postupy, mezi které patří intravenózně podávané kortikoidy (Dexona v dávce 40 mg/den 4 dny po sobě), intravenózní kalcitonin či bisfosfonáty (klodronát či pamidronát). Klodronát se u renálního selhání doporučuje redukovat na 50 % dávky, pamidronát není nutné redukovat. V extrémních případech (koncentrace sérového kalcia nad 4 mmol/l, event. i nižší hladiny spojené s klinickými projevy) je na místě akutní hemodialýza. Nutná je i korekce hyperurikemie, která se často zlepší adekvátní hydratací a podáváním vyšších dávek alopurinolu či rasburikázou.
- Alkalizace moči. Zajištění vylučování alkalické moči významným způsobem sníží tendenci LC k precipitaci a tvorbě válců v tubulech. Podle závažnosti stavu volíme buď intravenózní podávání natrium hydrogenkarbonátu či perorální substituci (Vitarsoda). Alkalizaci moči zajistí i preparát Uralyt či magistraliter připravené kalium citricum (cave na riziko hyperkalemie).
- Redukce sérových a močových koncentrací paraproteinu. Při znalosti diagnózy základního onemocnění za hajujeme urychleně cytostatickou terapii. Na rychlosti poklesu hladiny paraproteinu závisí případné obnovení renální funkce. Rozhodující jsou zejména první 3 týdny od vzniku onemocnění. Dříve používané režimy zahrnovaly zejména doxorubicin (většinou v kombinaci s vinkristinem a dexametazonem – VAD), či VAD doplněný o cyklofosfamid, a dále melfalan či cyklofosfamid v kombinaci s vysokodávkovaným dexametazonem (22). Zlatým standardem léčby MM dnes jsou režimy založené na inhibitorech proteasomu (bortezomib, karfilzomib, ixazomib) v kombinaci s vysokodávkovaným dexametazonem, doplněné často o cyklofosfamidem či doxorubicinem, a dále thalidomid a jeho deriváty, tzn. IMIDs (např. lenalidomid či pomalidomid), užívané většinou jako druhá linie terapie (23, 24). Tyto léky velmi rychle a účinně sníží produkci paraproteinu inhibicí nukleárního faktoru κB, stimulací apoptózy plazmatických buněk a blokádou některých cytokinů, zejména VEGF. Během několika málo dní lze pozorovat snížení či normalizaci hladiny paraproteinu v séru. V případě selhání ledvin se dnes léčebné režimy na bázi bortezomibu (např. cyklofosfamid, bortezomib, dexamethazon – CVD) považují za kombinaci první volby, a to nejen z důvodu rychlého nástupu účinku, ale i proto, že dávky bortezomibu není nutné redukovat při selhání ledvin (25). Trojkombinace chemoterapie obsahující bortezomib, dexametazon a cyklofosfamid/doxorubicin/thalidomid je navíc spojena s lepší renální odpovědí na léčbu, než když se použije jen dvojkombinace (většinou bortezomib s dexametazonem) (26).
- Symptomatická terapie renálního selhání, včetně metod extrakorporální očisty krve je někdy nezbytnou součástí komplexní léčby. Akutní HD je nutná zejména u anurických nemocných, kde hrozí hyperhydratace a v případě těžké hyperkalemie či hyperkalcemie.
- Plazmaferéza (PF). U pacientů s primomanifestací onemocnění či relapsem a vysokými koncentracemi paraproteinu hrozí vznik hyperviskózního syndromu (obvykle při koncentraci celkové bílkoviny nad 100 g/l). Při této komplikaci je jednoznačně indikováno provedení PF, která rychle sníží vysoké koncentrace bílkovin v séru. Použití této metody i v léčbě akutního renálního selhání zůstává nadále kontroverzní, přestože se tento postup jeví jako patofyziologicky smysluplný. Největší kontrolovaná studie s 97 pacienty neukázala žádný klinický přínos této metody v léčbě selhání ledvin (27). Důvodem nedostatečné efektivity je pravděpodobně skutečnost, že intravaskulární kompartment obsahuje pouze 20–30 % celkového objemu FLC v organismu (ostatní jsou deponovány extracelulárně, zejména v intersticiu) a navíc se během PF odstraní jen asi 65 % intravaskulárních FLC. To do značné míry vysvětluje, proč má PF jen omezený účinek. Pozdější práce Leunga et al ukázala, že PF může mít pozitivní vliv na reparaci renální funkce, a to za předpokladu, že nemocný má biopticky prokázanou myelomovou ledvinu a během léčby sériemi PF dojde k poklesu koncentrace sFLC alespoň o 50 % proti výchozí hodnotě (28). Použití PF v současné léčbě akutního renálního selhání u MM lze akceptovat za situace, kdy nelze použít jinou metodu odstranění paraproteinu (dialýza s HCO membránou) či tam, kde tato metoda nemá opodstatnění (paraprotein tvořený zejména kompletními molekulami imunoglobulinů s nízkou koncentrací FLC).
- Dialýza s HCO membránou. Všechny donedávna používané přístupy k extrakorporální eliminaci FLC u MM ve smyslu léčby nebo prevence myelomové ledviny se ukázaly jako málo efektivní. I při použití high - flux dialyzátorů (HF - HD; velikost pórů umožňuje prostup molekul o velikosti 10–12 kDa). FLC těmito póry neprochází, jelikož jejich molekulová hmotnost je větší (κ 22,5 kDa, λ 45 kDa). Relativně novým terapeutickým přístupem je dialýza s vysokopropustnou dialyzační membránou (High - Cutoff dialýza – HCO - HD, např. HCO1100-Theralite). Uspořádání této membrány a velikost jejích pórů umožňuje prostup molekul o hmotnosti až 45 kDa, čímž se daří dosahovat podstatně efektivnějšího odstraňování FLC v porovnání s jinými dialyzátory. Navíc při správném rozložení dialyzačního schématu lze odstraňovat velká množství FLC, aniž by docházelo k výskytu jinak obvyklých nevýhod plazmaferézy (ztráta bílkovin včetně koagulačních faktorů). Proteiny s molekulovou hmotností nad 60 kDa jsou v krevním řečišti velmi efektivně zadržovány. Dosažitelné absolutní množství filtrovaných FLC závisí na různých faktorech: výchozí koncentraci FLC v séru, dialyzačních průtokových parametrech, ploše dialyzátoru a časovému rozestupu mezi dialyzačními procedurami.
Při zkoumáních in vitro byla porovnávána dialyzační membrána HCO 1100 s HF filtry (cut -off hodnota do 12 kDa) a Super -HF filtry (cut -off hodnota do 20 kDa) při kontrolovaných podmínkách (29). V této studii bylo dosaženo s HCO - HD 96% eliminace FLC κ a 94% redukce FLC λ. Tato hodnota byla výrazně vyšší oproti všem ostatním dialyzačním membránám.
Původní klinické použití HCO - HD (HCO 1100) ukazovalo velmi pozitivní výsledky. Základním předpokladem úspěchu této léčby je paralelní podávání účinné chemoterapie. Účinek chemoterapie je potencován zlepšením funkce ledvin. Práce Hutchisona z roku 2007 a 2009 ukazují, že HCO - HD vede k obnovení renální funkce u více jak 80 % nemocných (v porovnání s 20 % při standardní léčbě low - fluxovými kapilárami), což znamená významné zlepšení kvality života nemocných a snížení jejich mortality (29, 30). Velkou šanci na reparaci renální funkce mají zejména ti nemocní, u kterých dojde k normalizaci sFLC během prvním 3 týdnů od zahájení léčby. V opačném případě lze očekávat vývoj ireverzibilních, zejména tubulointersticiálních změn. Podobná data přinesla i studie německých autorů, kde ale nezávislou renální funkci obnovilo jen 64,3 % nemocných léčených HCO - HD v porovnání s 29,4 % (p = 0,014) pacientů léčených konvenční dialýzou (31).
Velmi netrpělivě se čekalo na výsledky 2 randomizovaných studií, které porovnávaly efekt HCO - HD s HF - HD u nemocných se selháním ledvin. Výsledky studií jsou ale kontroverzní. Studie MYRE prokázala lepší efekt HCO -HD na výslednou renální funkci po 6 měsících (32), ale stejně jako studie EuLITE (33) neukázala, že by léčba s HCO kapilárou byla výrazně lepší než HF - HD po 30 dnech od zahájení léčby. Srovnání obou studií přináší Tab. 2. Studie se v některých charakteristikách (zejména podávaná chemoterapie a způsob vedení HCO -HD) liší, a tak je nelze přesně porovnat. Přestože někteří autoři na základě dostupných výsledků těchto dvou studií nabádají spíše k rezervovanému přístupu k léčbě HCO - HD (34), zdá se, že by tato léčbě přece jen mohla být určitou nadějí na lepší renální funkci u řady pacientů. To potvrzují i data z ČR, kde k reparaci renální funkce u souboru 35 nemocných došlo v 64,7 % případů (Ryšavá et al. abstrakt, 2nd IKMG meeting, 2015, La Rochelle) či data z jednoho centra v ČR, kde se 21/30 nemocných (70 %) odpoutalo od dialyzační léčby při použití HCO - HD (Lachmanová et al. abstrakt, 37. kongres ČNS, 2018, Praha). Na závaznější doporučení si nicméně budeme muset počkat do výsledku publikací dalších, větších studií.
Tab. 2. Charakteristika největších studií s high-cutoff dialýzou u nemocných s mnohočetným myelomem a selháním ledvin (upraveno podle (33)) 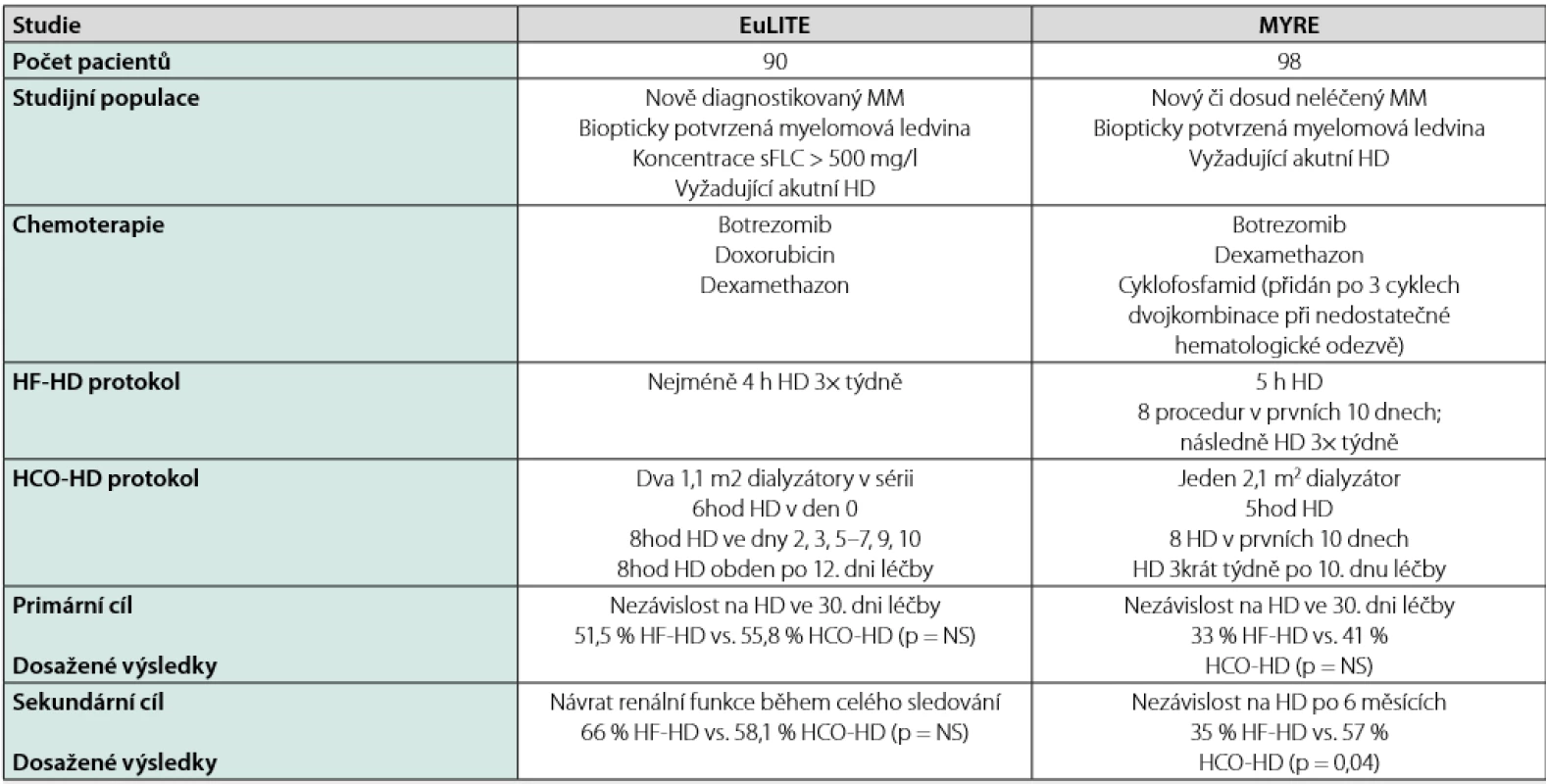
MM – mnohočetný myelom, sFLC – sérové volné lehké řetězce, HD – hemodialýza, HF-HD – high-flux HD, HCO-HD – high-cutoff HD Z hlediska bezpečnosti není léčba s HCO - HD spojena s žádnými kardiovaskulárními nebo nepředvídatelnými alergickými reakcemi. V důsledku zvláštního cut - off profilu membrány byla pozorována ztráta albuminu ve výši asi 20–40 g při každé dialýze. Tato ztráta byla úspěšně kompenzována podáním lidského albuminu na konci dialýzy. Aplikace dialyzační membrány HCO 1 100 se z hlediska přístrojového vybavení a vedení způsobu dialýzy (přístup k cévám, dialyzační modul a dialyzát) v zásadě neliší od standardní dialýzy. Vedle „normálního“ provádění dialýzy (eliminace uremických toxinů, vyrovnávání krevních elektrolytů a objemového snížení) se u této dialyzační membrány z krve navíc specificky a efektivně odstraňují právě FLC.
Prognóza nemocných s MM, léčba dialýzou a transplantabilita
Mezi faktory ovlivňující přežití v souboru 107 nemocných s akutním renálním selháním u MM patřilo použití chemoterapie a dobrá odpověď na léčbu (HR 0,21; P < 0,001), vstupní hodnota sérového albuminu > 35 g/l (HR 0,49, P = 0,02) a nezávislost na hemodialýze (HR 0,43; P = 0,005) po ukončení indukční léčby. Průměrná doba přežití jedinců v tomto souboru byla 10,2 měsíce (35). Zajímavá data přinesla i nedávno publikovaná řecká studie (26), která ukázala, že: (i) věk pod 65 let byl asociován s vyšší pravděpodobností obnovy renální funkce v porovnání se staršími jedinci (75 % vs. 38 %) a kratší dobou do renální odpovědi (51 vs. 336 dní), (ii) u nemocných nad 75 let byla renální odpověď zaznamenána jen v 27 %, (iii) u nemocných s koncentrací patologických FLC > 9 000 mg/l byl trend k menší pravděpodobnosti a delšímu času do obnovy renální funkce a (iv) pacienti, kteří dosáhli alespoň parciální hematologické odpovědi (nebo lepší) po 2 měsících léčby, měli větší pravděpodobnost obnovy renální funkce (68 % vs. 28 %).
Pokud dojde k terminálnímu renálnímu selhání a nemocní s MM jsou zařazeni do PDL (pravidelné dialyzační léčení), jsou z hlediska celkového přežití na hemodialýze (HD) i peritoneální dialýze (PD) data srovnatelná (22). U nemocných léčených HD je pozorován větší výskyt hypotenze a častější problémy s AV fistulí (zejména je - li současně přítomna AL-amyloidóza). Při léčbě PD je zase popisován větší výskyt infekčních komplikací. Na druhou stranu se předpokládá, že během PD dochází u těchto nemocných k odstraňování většího množství FLC ze séra, jelikož póry v peritoneu jsou větší než u běžných dialyzačních membrán a FLC se tedy snáze filtrují do peritoneálního roztoku. Celkové přežívání nemocných s MM v PDL ale nadále zůstává neuspokojivé, jen 50 % nemocných s MM přežívá v PDL déle než rok a jen asi 25 % déle než 3 roky. Rozdíly v přežívání mohou být ovlivněny typem léčby, kterou nemocní dostali v době vzniku onemocnění či jeho relapsu. Pokud byli léčeni konvenční chemoterapií (v té době ještě bez bortezomibu), pak se medián přežívání v PDL pohyboval kolem 8 měsíců. Pokud nemocní podstoupili vysokodávkovanou chemoterapii (včetně ASCT), pak měli 30% pravděpodobnost na 5leté přežití v PDL. Obecně lze říci, že pokud je u nemocných s MM dosaženo kompletní hematologické remise (bez ohledu na typ podané léčby), pak je jejich prognóza v PDL výrazně lepší a přežívání až o polovinu delší než u těch, kteří na léčbu neodpoví. Renální selhání by nemělo být důvodem k tomu, aby tito nemocní (pokud splňují ostatní kritéria) nebyli léčeni vysokodávkovanou chemoterapií a ASCT. Naopak existují data o tom, že celkové přežívání u HD -dependentních nemocných a období bez relapsu je u nich při použití vysokodávkované léčby stejné, jako u těch s normální renální funkcí (36, 37). Jediným rozdílem je dávka melfalanu podávaného v přípravném režimu, která se musí redukovat o 25–50 % (i s ohledem na věk). Pokud u nemocných v PDL přetrvává kompletní remise MM, lze u nich uvažovat i o transplantaci ledviny. Podmínkou je kompletní hematologická remise (negativní průkaz paraproteinu v séru, normální počet plazmatických buněk v kostní dřeni) a stabilizace či ústup osteolytických změn na skeletu. Ideální je, pokud remise trvá 3 roky, za minimum je považován 1 rok (5). Tito nemocní jsou po transplantaci ledviny ve zvýšeném riziku relapsu MM z důvodu užívání imunosuprese, a to zejména při použití některých antirejekčních léků (antithymocytární globulin). Tuto skutečnost je u nich potřeba zohlednit při léčbě akutních rejekcí a léčbu modifikovat (např. i použitím nestandardních postupů a léků, např. bortezomibu).
Zajímavou otázkou je i vznik MM de novo po transplantaci ledviny u nemocných s renálním selháním jiné etiologie. Incidence tohoto nádoru je v porovnání s jinými lymfoproliferacemi (Hodgkinova choroba, NHL či chronická lymfatická leukemie) obdobná, ale celkové přežívání je jednoznačně nejhorší. Podávání azatioprinu jako chronické antirejekční léčby je spojeno s menším rizikem vzniku MM než použití jiných imunosupresiv (38).
KORESPONDENČNÍ ADRESA AUTORA:
prof. MUDr. Romana Ryšavá, CSc.,
Klinika nefrologie 1. LF UK a VFN,
U Nemocnice 2,
128 08 Praha 2
Cit. zkr: Vnitř Lék 2020; 66(7): 425–431 Článek přijat redakcí: 3. 11. 2018 Článek přijat po recenzích k publikaci: 15. 11. 2019
Zdroje
1. Tsakiris DJ, Stel VS, Finne P, et al. Incidence and outcome of patients starting renal replacement therapy for end - stage renal disease due ti multiple myeloma or light - chain deposition disease: an ERA -EDTA Registry study. Nephrol Dial Transplant 2010; 25 : 1200–1206.
2. Knudsen LM, Hippe E, Hjorth M, et al. Renal function in newly diagnosed multiple myeloma - a demographic study of 1353 patients. The Nordic Myeloma Study Group. Eur J Haematol 1994; 53 : 207–212.
3. Dimopoulos MA, Terpos E, Chanan -Khan A, et al. Renal impairment in patients with multiple myeloma: a consensus statement on behalf of the International Myeloma Working Group. J Clin Oncol 2010; 28 : 4976–4984.
4. Wirk B. Renal failure in multiple myeloma: a medical emergency. Bone Marrow Transplantation 2011; 46 : 771–783.
5. Korbet SM, Schwartz MM. Multiple myeloma. J Am Soc Nephrol 2006; 17 : 2533–2545.
6. Heher EC, Rennke HG, Laubach JP, et al. Kidney disease and multiple myeloma. Clin J Am Soc Nephrol 2013; 8 : 2007–2017.
7. Wochner RD, Strober W, Waldmann TA. The role of the kidney in the catabolism of Bence Jones proteins and immunoglobulins fragments. J Exp Med 1967; 126 : 207–221.
8. Ying WZ, Wang PX, Sanders PW. Pivotal role of apoptosis signal - regulating kinase 1 in monoclonal free light chain -mediated apoptosis. Am J Patol 2012; 180 : 41–47.
9. Sengul S, Zwizinski C, Batuman V. Role of MAPK pathways in the light chain induced cytokine production in human proximal tubule cells. Am J Renal Physiol 2003; 284: F1245–F1254.
10. Cockwell P, Hutchison CA. Management options for cast nephropathy in multiple myeloma. Current Opinion in Nephrology and Hypertension 2010; 19 : 550–555.
11. Herrera GA, Sanders PW. Paraproteinemic renal diseases that involve the tubulo-interstitium. Contrb Nephrol 2007; 153 : 105–115.
12. Ryšavá R AL. amyloidosis with renal involvement. Kidney Blood Pres Res 2007; 30 : 359–364.
13. Zhu L, Herrera GA, Murphy -Ullrich JE, et al. Pathogenesis of glomerulosclerosis in light chain deposition disease. Role for transforming growth factor - beta. Am J Pathol 1995; 147 : 375–385.
14. Kyle RA, Gertz MA, Witzig TE, et al. Review of 1027 patients with newly diagnosed multiple myeloma. Mayo Clin Proc 2003; 78 : 21–33.
15. Rajkumar SV, Dimopoulos MA, Palumbo A. International Myeloma Working Group updated criteria for the diagnosis of multiple myeloma. Lancet 2014; 15: e538–e548.
16. Kyle RA, Rajkumar SV. Criteria for diagnosis, staging, risk stratification and responce assessment of multiple myeloma. Leukemia 2009; 23 : 3–9.
17. Palumbo A, Anderson K. Multiple myeloma. N Engl J Med 2011; 364 : 1046–1060.
18. Hutchison CA, Basnayake K, Cockwell P. Serum free light chain assessment in monoclonal gammapathy and kidney disease. Nat Rev Nephrol 2009; 5 : 621–627.
19. Bradwell AR, Harding SJ, Fourrier NJ, et al. Assessment of monoclonal gammapathies by nephelometric measurement of individual immunoglobulin kappa/lambda ratios. Clin Chem 2009; 55 : 1646–1655.
20. Hutchison CA, Plant T, Drayson M. Serum free light chain measurement aids the diagnosis of myeloma in patients with severe renal failure. BCM Nephrology 2008; 9 : 11–19.
21. Dispenzieri A, Kyle R, Merlini G, et al. International Myeloma Working Group guidelines for serum - free light chain analysis in multiple myeloma and related disorders. Leukemia 2009; 23 : 215–224.
22. Haubitz M, Peest D. Myeloma – new approaches to combined nephrological-haematological management. Nephrol Dial Transplant 2006; 21 : 582–590.
23. Ludwig H, Drach J, Graf H, et al. Reversal of acute renal failure by bortezomib - based chemotherapy in patients with multiple myeloma. Haematologica 2007; 92 : 1411–1414.
24. Kastritis E, Anagnostopoulos A, Roussou M, et al. Reversibility of renal failure in newly diagnosed multiple myeloma patients treated with high dose dexamethazone -containing regimes and tje impact of novel agents. Haematologica 2007; 92 : 546–549.
25. Chanan - Khan AA, Kaufman JL, Mehta J, et al. Activity and safety of bortezomib in multiple myeloma with advanced renal failure. Blood 2007; 109 : 2604–2606.
26. Dimopoulos MA, Roussou M, Gavriatopoulos M, et al. Outcomes of newly diagnosed myeloma patients requiring dialysis: renal recovery, importance of rapid response and survival benefit. Blood Cancer J 2017; 7: e571.
27. Clark WF, Stewart AK, Rock GA, et al. Plasma exchange when myeloma presents as acute renal failure: a randomized, controlled trial. Ann Intern Med 2005; 143 : 777–784.
28. Leung N, Gertz MA, Zeldenrust SR. Improvement of cast nephropathy with plasma exchange depends on the diagnosis and on reduction of serum free light chains. Kidney Int 2008; 73 : 1282–12888.
29. Hutchison CA, Cockwell P, Reid S, et al. Efficient removal of immunoglobulin free light chains by hemodialysis for mulitple myeleoma. In vitro and in vivo studies. J Am Soc Nephrol 2007; 18 : 886–895.
30. Hutchison CA, Bradwell AR, Cook M, et al. Treatment of Acute Renal Failure Secondary to Multiple Myeloma with Chemotherapy and Extended High Cut - Off Hemodialysis. Clin J Am Soc Nephrol 2009; 4 : 745–754.
31. Gerth HU, Pohlen M, Görlich D, et al. Impact of High - Cut - Off Dialysis on Renal Recovery in Dialysis -Dependent Multiple Myeloma Patients: Results from a Case -Control Study. Plos One 6; 11: e0154993.
32. Bridoux F, Carron PL, Pegourie B, et al. Effect of high - cutoff hemodialysis vs conventional hemodialysis on hemodialysis independence among patients with myeloma cast nephropathy. A randomized clinical trial. JAMA 2017; 318 : 2099–2110.
33. Hutchison CA, Cockwell P, Moroz V, et al. High cutoff versus high-flux haemodialysis for myeloma cast nephropathy in patients receiving bortezomib-based chemotherapy (EuLITE): a phase 2 randomised controlled trial. Lancet Haematol 2019; 6(4): e217-e228.
34. Finkel K, Fabbrini P. High cut -off hemodialysis for myeloma cast nephropathy – do we finally have an answer? J Onco -Nephrol 2017; 1 : 67–70.
35. Haynes RJ, Read S, Collins GP, et al. Presentation and survival of patients with severe acute kidney injury and multiple myeloma: a 20-year experience from a single centre. Nephrol Dial Transplant 2010; 25 : 419–426.
36. Parikh GC, Amjad AL, Saliba RM, et al. Autologous hematopoietic stem cell transplantation may reverse renal failure in patients with multiple myeloma. Biol Blood Marrow Transplant 2009; 15 : 812–816.
37. Raab MS, Breitkreutz I, Hundemer M, et al. The outcome of autologous stem cell transplantation in patients with plasma cell disorders and dialysis - dependent renal failure. Haematologica 2006; 11 : 1555–1558.
38. Caillard S, Agodoa LY, Bohen EM, et al. Myeloma, Hodgkin disease and lymphoid leukemia after renal transplantation: characteristics, risk factors and prognosis. Transplantation 2006; 81 : 888–895.
39. Bridoux F, Leung N, Hutchison C, et al. Diagnosis of monoclonal gammopathy of renal signifikance. Kidney Int 2015; 87 : 698–711.
40. Sethi S, Rajkumar SV, D’Agati VD. The complexity and heterogeneity of monoclonal immunoglobulin -associated renal diseases. J Am Soc Nephrol 2018; 29 : 1810–1823.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek Hypoglykemie u nediabetiků
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2020 Číslo 7- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Biomarkery pro neendoskopické vyšetření sliznice jícnu
- Riziko kardiovaskulárních komplikací v závislosti na hladině glykemie: od diabetes mellitus k prediabetu
- ERCP u pacientů po choledochoduodenoanastomóze
- Kostní metabolismus u idiopatických střevních zánětů 1
- Přidělovaná ošetřovatelská péče jako jeden z indikátorů výskytu medikačního pochybení
- Adenokarcinom tenkého střeva diagnostikovaný pomocí video kapslové endoskopie u pacientky s celiakií: kazuistika a přehled literatury
- Koagulopatie asociovaná s onemocněním COVID-19
- Současná diagnostika a terapie sarkoidózy
- Obštrukčné spánkové apnoe a arteriálna hypertenzia: úloha črevného mikrobiómu
- CAR T-lymfocyty: horká novinka v léčbě nádorů
- Renální selhání u mnohočetného myelomu a jeho léčba
- Raritní koincidence chylothoraxu a hydrothoraxu při adenokarcinomu žaludku – kazuistika
- Kostní metabolismus u idiopatických střevních zánětů 2
- Metformin -asociovaná laktátová acidóza
- Tangierská nemoc v rodině s fenotypem familiární hypercholesterolemie
- Hypoglykemie u nediabetiků
- Screening a krátká intervence u uživatelů nelegálních drog
- Muž s dysthymií (převážně negativním hodnocením všeho prožitého) indukoval depresi u senzitivní blízké osoby
- Etické konotace léčby onemocnění covid-19
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Hypoglykemie u nediabetiků
- Metformin -asociovaná laktátová acidóza
- Koagulopatie asociovaná s onemocněním COVID-19
- CAR T-lymfocyty: horká novinka v léčbě nádorů
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



