-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Pangenotypové režimy léčby chronické hepatitidy C
Pangenotypic treatment regimens for chronic hepatitis C
The treatment of chronic hepatitis C is currently based exclusively on the use of drugs from the direct-acting antiviral class. They are substances that inhibit one of the 3 most important enzymes of the virus replication cycle. Antiviral drugs are divided according to the target structure into 3 basic classes, further division is mainly based on the chemical structure of individual antivirals. A common feature of all the regimens is high efficiency and safety. Pangenotypic efficacy regimens are those that utilize a combination of 2 or 3 antiviral agents of different classes, and are effective for all HCV genotypes. Currently there are 3 such regimens available. Pangenotypic regimens probably represent the latest stage of development of treatment for chronic hepatitis C. The review discusses in detail the efficiency of different pangenotypic regimens in individual subgroups of patients with HCV infection. Attention is primarily paid to the data bases for their use.
Keywords:
antiviral agent – treatment
Autoři: Petr Urbánek
Působiště autorů: Interní klinika 1. LF UK a ÚVN – Vojenská fakultní nemocnice Praha
Vyšlo v časopise: Vnitř Lék 2019; 65(9): 553-563
Kategorie: Přehledné referáty
Souhrn
Léčba chronické hepatitidy C je v současné době založena výlučně na použití léčiv ze skupiny přímo působících virostatik. Jedná se o látky inhibující jeden ze 3 nejdůležitějších enzymů replikačního cyklu viru. Virostatika jsou dělena podle cílové struktury na 3 základní třídy, další dělení je dáno především chemickou strukturou jednotlivých virostatik. Společným znakem všech režimů je vysoká účinnost a bezpečnost. Jako režimy s pangenotypovou účinností se označují režimy, které využívají kombinací 2 či 3 virostatik různých tříd a které jsou účinné u všech genotypů HCV. V současnosti jsou dostupné 3 takové režimy. Pangenotypové režimy představují pravděpodobně poslední vývojové stadium léčby chronické hepatitidy C. V přehledovém článku je podrobně rozebrána účinnost jednotlivých pangenotypových režimů v jednotlivých podskupinách pacientů s HCV infekcí. Pozornost je věnována především datovým podkladům pro jejich použití.
Klíčová slova:
chronická hepatitida C – virostatikum
Úvod
Chronická infekce virem hepatitidy C (HCV) představuje i ve 21. století závažný zdravotní problém s velkými sociálními a společenskými dopady. Infekce postihuje kolem 80–100 milionů osob na celém světě a je považována za hlavní příčinu rozvoje jaterní cirhózy a hepatocelulárního karcinomu v ekonomicky vyspělých zemích [1,2]. Situaci dobře ilustruje skutečnost, že v letech 2007–2010 ve Spojených státech překračovala úmrtnost na komplikace infekce HCV úmrtnost související s infekcí HIV [3,4].
Od roku 2000 až do roku 2012 byla standardní terapie chronické infekce HCV založena na podání kombinace pegylovaného interferonu α (PEG-IFN) s ribavirinem (RBV) [5]. Délka léčby byla 48 týdnů v případech chronické HCV infekce vyvolané genotypem 1 a 24 týdnů v případech infekce vyvolané genotypy 2 a 3. Účinnost (tedy setrvalá virologická odpověď – SVR, viz níže) této kombinační terapie u genotypu 1 byla 40–60%, u genotypu 2 a 3 přibližně 80% [6,7] (Poznámka autora: SVR je měřítkem účinnosti léčebného režimu. Je definována jako negativní sérová HCV RNA ve 12. týdnu po skončení protivirové léčby metodou polymerázové řetězové reakce (RT-PCR) s dolním detekčním limitem 15 IU/ml).
První generace virostatik – přímo působící virostatika
V roce 2011 vstoupila léčba virové hepatitidy C do zcela nové éry, éry, která je charakterizována rychlým průnikem tzv. přímo působících virostatik (DAA – Directly Acting Antivirals) do terapeutických kombinací této závažné infekce. Počátkem éry bylo schválení prvních 2 zástupců této heterogenní skupiny léčiv, bocepreviru a telapreviru (a později simepreviru), k užití u chronické HCV infekce. Přímo působící virostatika mají svůj název odvozen od mechanizmu účinku. Látky této skupiny přímo inhibují některý z enzymů uplatňujících se v průběhu replikačního cyklu HCV. V rámci replikace HCV dochází k syntéze jediného prekurzorového proteinu, který je translačním produktem celého virového genomu. Jeho následné štěpení zahajuje virová proteáza, která postupně uvolňuje jednotlivé strukturální i nestrukturální proteiny. Posledním krokem procesu je uvolnění RNA polymerázy, která je klíčovým enzymem celé replikace. DAA jsou látky inhibující buď právě proteázu (produkt NS3/4 oblasti virového genomu), nebo RNA polymerázu (produkt NS5B) nebo komplex proteinů, jehož klíčovou součástí je NS5A protein, který je považován za kofaktor RNA polymerázy a který se účastní regulace řady posttranslačních dějů (NS5A).
Druhá generace virostatik
Boceprevir, telaprevir a simeprevir byly zástupci první generace virostatik, která se používala pouze velmi krátkou dobu, a to pouze a zásadně v kombinaci s pegylovaným interferonem a ribavirinem. Kolem roku 2015 nastala 2. fáze revolučních změn, která je charakterizována nástupem čistě bezinterferonových režimů, při nichž se vzájemně kombinuje několik perorálních virostatik. Tyto moderní kombinace již nevyžadují současné podání PEG-IFN, a dokonce ani RBV. První vlna těchto kombinací byla tzv. genotypově specifická. Tento popisný pojem vyjadřuje skutečnost, že tyto režimy nebyly použitelné u všech známých genotypů HCV. Příčinou bylo především riziko existence nebo rozvoje substitucí asociovaných s rezistencí (RAS) u určitých genotypů. Důsledkem RAS je ztráta citlivosti virové populace na použitou virostatickou kombinaci. Pro tuto populaci (kvazidruh HCV) nesoucí si substituci podmiňující rezistenci na určité virostatikum se vžilo označení „varianta (viru HCV) asociovaná s rezistencí“ (RAV). Do skupiny virostatik s genotypově specifickou účinností patří např. ombitasvir, dasabuvir a paritaprevir potencovaný ritonavirem nebo kombinace grazoprevir/elbasvir.
Pangenotypové režimy
Jedním z teoretických cílů, které byly vytyčeny v minulosti při vývoji jednotlivých přímo působících virostatik blokujících replikaci viru hepatitidy C, byla snaha nalézt virostatikum, či spíše kombinaci dvou či více virostatik, která by měla tzv. pangenotypovou účinnost, tj. virostatikum nebo jejich kombinace by efektivně inhibovala replikaci všech základních genotypů HCV (HCV GT 1–7). Pangenotypové režimy kombinují 2 nebo 3 perorální virostatika tzv. 2. generace:
- inhibitory NS3/4A proteázy (koncovka generického názvu je -previr)
- inhibitory NS5B polymerázy – nukleos(t)idové i nonnukleos(t)idové povahy (koncovka generického názvu je -buvir)
- inhibitory NS5A komplexu (koncovka generického názvu je -asvir)
Součástí pangenotypových režimů v naprosté většině indikací není ani ribavirin (RBV), délka léčby je 8–16 týdnů. Délka léčby je definována především stupněm jaterní fibrózy, genotypem/subtypem HCV, výchozí viremií a případnou léčbou v minulosti. V tomto bodě odlišujeme dosud neléčené pacienty a pacienty v minulosti léčené. U osob v minulosti léčených je třeba ještě někdy rozlišit, zda byla použita léčba obsahující některé virostatikum, či nikoliv. Všechny pangenotypové režimy mají účinnost přesahující 95 %.
V roce 2018 se pangenotypové režimy staly základem doporučených postupů pro diagnostiku a léčbu HCV infekce vydaných Evropskou asociací pro studium jater (European Association for the Study of the Liver – EASL) [8]. Za pangenotypové režimy jsou považovány v současnosti 3 režimy:
- sofosbuvir/velpatasvir (SOF/VEL)
- glekaprevir/pibrentasvir (GLE/PIB)
- sofosbuvir/velpatasvir/voxilaprevir (SOF/VEL/VOX)
Právě těmto pangenotypovým režimům a jejich užití u většiny pacientů s HCV infekcí se budeme věnovat v následujícím přehledovém článku. Cíleně vynecháme problematiku protivirové léčby pacientů s dekompenzovanou cirhózou, protože jde o problematiku vysoce speciální, která by měla být řešena výlučně v transplantačních centrech.
Kombinace sofosbuviru s velpatasvirem
Kombinace sofosbuviru a velpatasviru (SOF/VEL) byla prvním pangenotypovým režimem, který vstoupil na evropský trh. Fixní kombinace SOF/VEL je dostupná jako lék Epclusa® (výrobce Gilead Sciences, USA), 1 tbl obsahuje SOF 400 mg (inhibitor RNA polymerázy, tj. produktu NS5B oblasti virového genomu) a VEL 100 mg (inhibitor kofaktoru polymerázy – komplexu NS5A) [9]. Standardní dávkování ve všech dále diskutovaných režimech a indikacích je 1 tbl à 24 hod.
Farmakologická charakteristika
Sofosbuvir (obr. 1) je proléčivo, které prodělává intracelulární trifosforylaci, jejíž produkt je pomocí RNA polymerázy inkorporován do HCV RNA. Mechanizmem účinku je tzv. ukončení řetězce – po navázání aktivní látky (v našem případě SOF) nemůže pokračovat další řetězení dceřiné virové RNA. SOF je účinný u všech hlavních nejrozšířenějších genotypů HCV (1–6), neinterferuje se syntézou lidské DNA či RNA, neinhibuje ani mitochondriální RNA polymerázy. SOF není metabolizován systémem cytochromu P450, potenciál lékových interakcí je tedy mnohem omezenější nežli u virostatik nižších generací. SOF je substrátem lékového transportéru P-gp a proteinu rezistence karcinomu prsu (BCRP), jeho aktivní metabolit však nikoliv. Potentní induktory P-gp ve střevě (rifampicin, karbamazepin a fenytoin) snižují plazmatickou koncentraci SOF, snižuje se tedy rovněž intracelulární přítomnost aktivního metabolitu a dochází ke snížení protivirové účinnosti SOF. Naopak inhibitory P-gp/BCRP zvyšují plazmatickou hladinu SOF, avšak nikoliv aktivního metabolitu, takže SOF může být s inhibitory podáván současně [9].
Obr. 1. Strukturální vzorec sofosbuviru 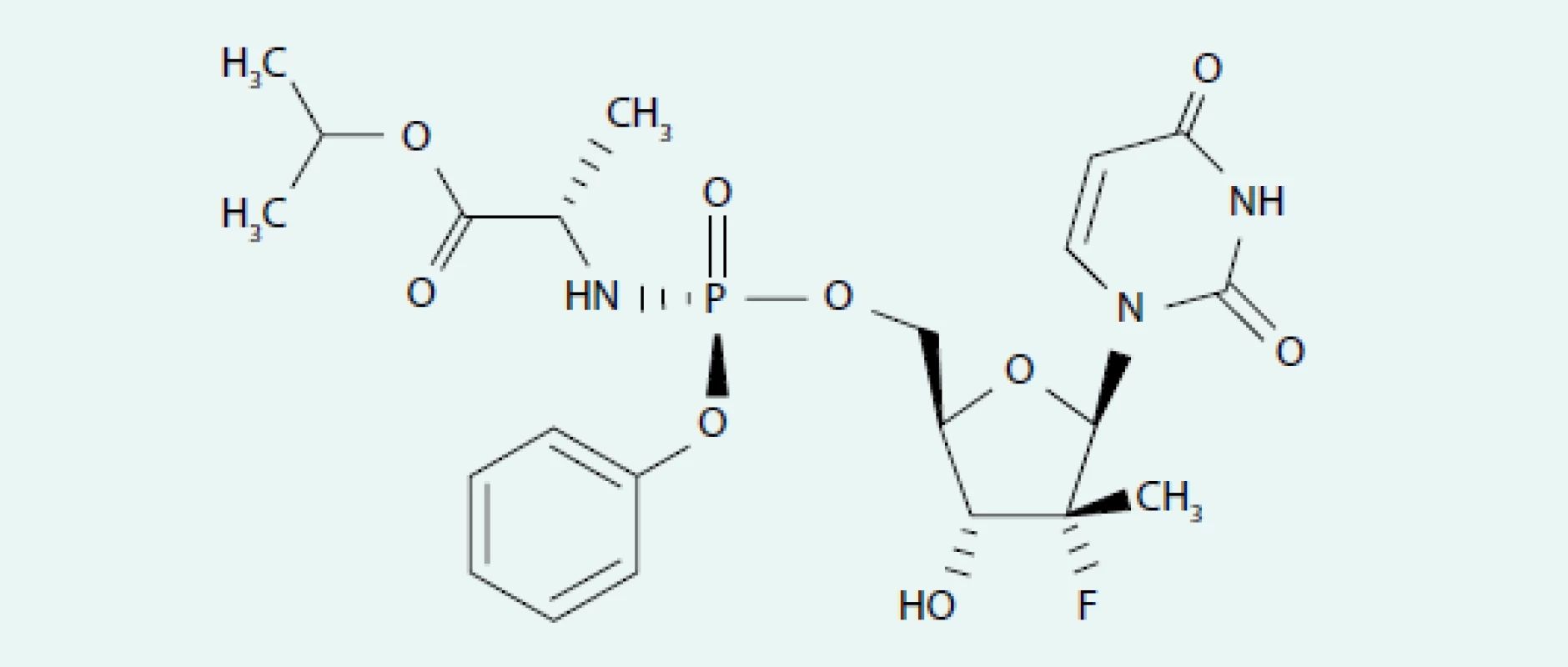
Velpatasvir (obr. 2) je inhibitorem několika lékových transportérů a dalších transportních molekul v bazolaterální membráně hepatocytu. Velpatasvir je substrátem CYP2B6, CYP2C8 a CYP3A4 s pomalým metabolizmem. Současné podávání VEL a léčiv, u kterých může být zvýšení jejich plazmatické hladiny spojeno se závažnou vedlejší reakcí, je proto kontraindikováno. Jmenovat je třeba dabigatran a rosuvastatin. Induktory P-gp nebo silné induktory CYP2B6, CYP2C8 nebo CYP3A4 (např. rifampicin, rifabutin, třezalka tečkovaná, karbamazepin, fenobarbital a fenytoin), mohou snižovat plazmatické koncentrace sofosbuviru, velpatasviru, což vede ke snížení terapeutického účinku kombinace SOF/VEL [9].
Obr. 2. Strukturální vzorec velpatasviru 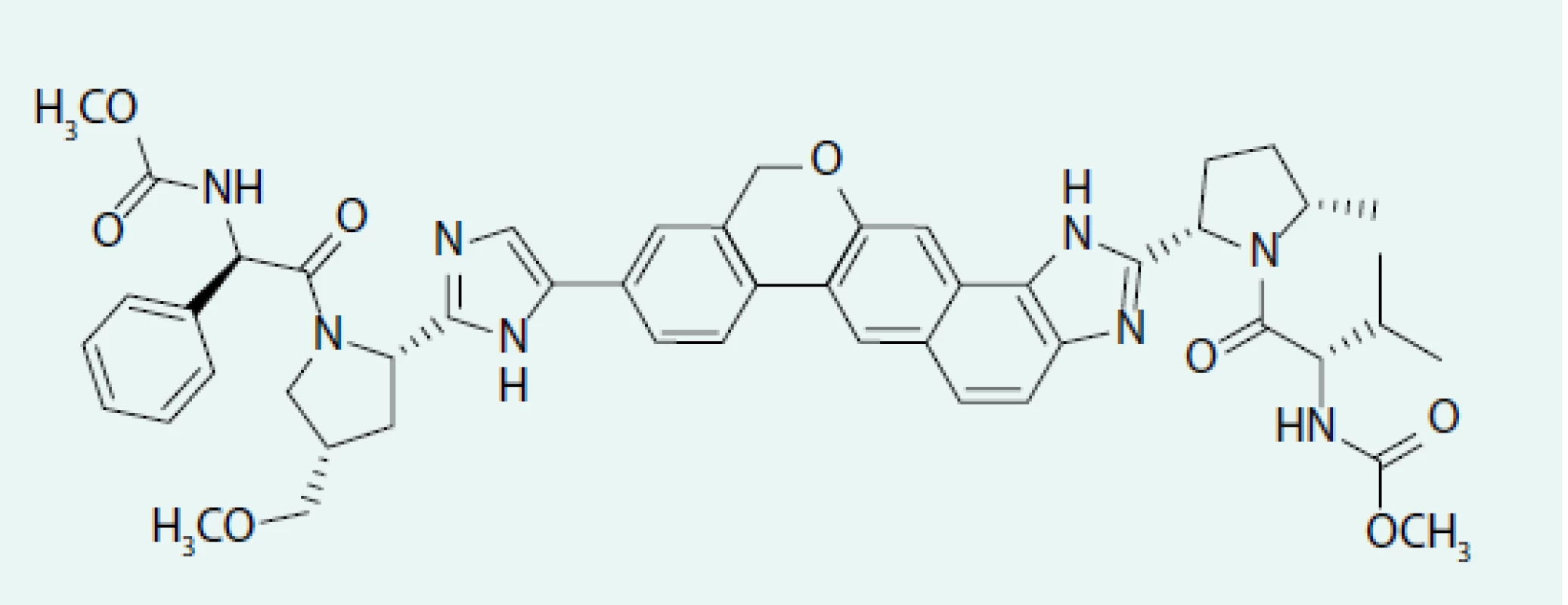
Klinické použití
Rozsáhlá data o účinnosti a bezpečnosti podání kombinace SOF/VEL poskytly studie fáze 3 s názvy ASTRAL-1 až 4 [10–13]. Primárním cílem všech celého rozsáhlého programu ASTRAL byla účinnost léčby měřená jako SVR12. Jednotlivé studie se lišily léčenou populací a genotypovým složením léčeného souboru pacientů. Studie ASTRAL-2 cílila na pacienty s HCV GT2, studie ASTRAL-4 zkoumala účinnost režimu SOF/VEL + RBV u pacientů s dekompenzovanou cirhózou.
Studie ASTRAL-1 byla multicentrická randomizovaná placebem kontrolovaná studie zkoumající účinnost a bezpečnost podání SOF/VEL po dobu 12 týdnů u širokého spektra pacientů s chronickou HCV infekcí vyvolanou všemi 6 základními genotypy (osoby s genotypem 5 nebyli randomizováni, všichni byli zařazeni do léčebné větve) [10]. Celkovou účinnost a účinnost léčby podle genotypu HCV a srovnání účinnosti u cirhotiků a osob bez jaterní cirhózy ukazují graf 1 a graf 2. Selhání léčby u pacientů s genotypem 1a bylo pouze 1krát v důsledku relapsu, v ostatních případech nešlo o „virologické selhání“. Jediné selhání léčby u genotypu 1b bylo dáno relapsem infekce po skončení léčby. Účinnost léčby a příčiny jejího selhání u cirhotiků a pacientů bez jaterní cirhózy ukazuje graf 2. Stejný obrázek ukazuje i účinnost a příčiny selhání u pacientů dosud neléčených pacientů a u osob, které již v minulosti léčeny byly. Jako vedlejší reakce s výskytem přesahujícím 10 % byly hlášeny bolesti hlavy, únava, nazofaryngitida a nauzea.
Graf 1. Výsledky studie ASTRAL-1: celková SVR a SVR podle genotypu HCV 
Graf 2. Výsledky studie ASTRAL-1: celková SVR a SVR cirhotiků a necirhotiků spolu s důvody selhání léčby 
Studie ASTRAL-1 se stala hlavním zdrojem dat pro doporučení, že pacienti bez jaterní cirhózy, infikovaní HCV GT1–6, dosud neléčení i opakovaně léčení mají být léčeni kombinací SOF/VEL po dobu 12 týdnů. Stejné doporučení se týká i pacientů s kompenzovanou jaterní cirhózou, ale s jedinou výjimkou. Tou výjimkou jsou pacienti infikovaní HCV GT3 ve stadiu jaterní cirhózy. Tato skupina pacientů by podle doporučení EASL neměla být léčena kombinací SOF/VEL, protože ve studii ASTRAL-3 byla ve skupině pacientů s jaterní cirhózou infikovaných HCV GT3 dosud neléčených i opakovaně léčených dosažena relativně nízká SVR 93%, resp. 89% (graf 3) [11,12]. Režim je proto v této skupině osob považován za suboptimální. V této skupině EASL doporučení jako postup volby uvádějí použití kombinace sofosbuvir/velpatasvir/voxilaprevir (viz dále). Nicméně v ČR tento režim v dané indikaci nemá stanovenu úhradu, nelze jej proto použít. Jedinou alternativou použitelnou v ČR pro tyto pacienty (tj. osoby s kompenzovanou cirhózou infikované HCV GT3, dosud neléčené i opakovaně léčené) je proto použití kombinace SOF/VEL + RBV. Tento režim připouštějí za předpokladu nedostupnosti SOF/VEL/VOX i standardy EASL.
Graf 3. Výsledky studie ASTRAL-3: SVR12 podle přítomnosti cirhózy a historie léčby 
Chybové úsečky ukazují 95% interval spolehlivosti.
RBV – ribavirin SOF – sofosbuvir VEL – velpatasvirKombinace glekapreviru s pibrentasvirem
Farmakologická charakteristika
Glekaprevir (GLE) je inhibitorem NS3/4A, pibrentasvir (PIB) je inhibitorem NS5A (obr. 3). Obě látky jsou dostupné ve formě fixní kombinace (lék Maviret®, výrobce Abbvie, USA) – 1 tbl obsahuje 100 mg GLE a 40 mg PIB, přičemž denní dávka odpovídá 3 tbl, které se užívají v jedné dávce [14].
Obr. 3. Strukturální vzorce glekapreviru (3.1) a pibrentasviru (3.2) 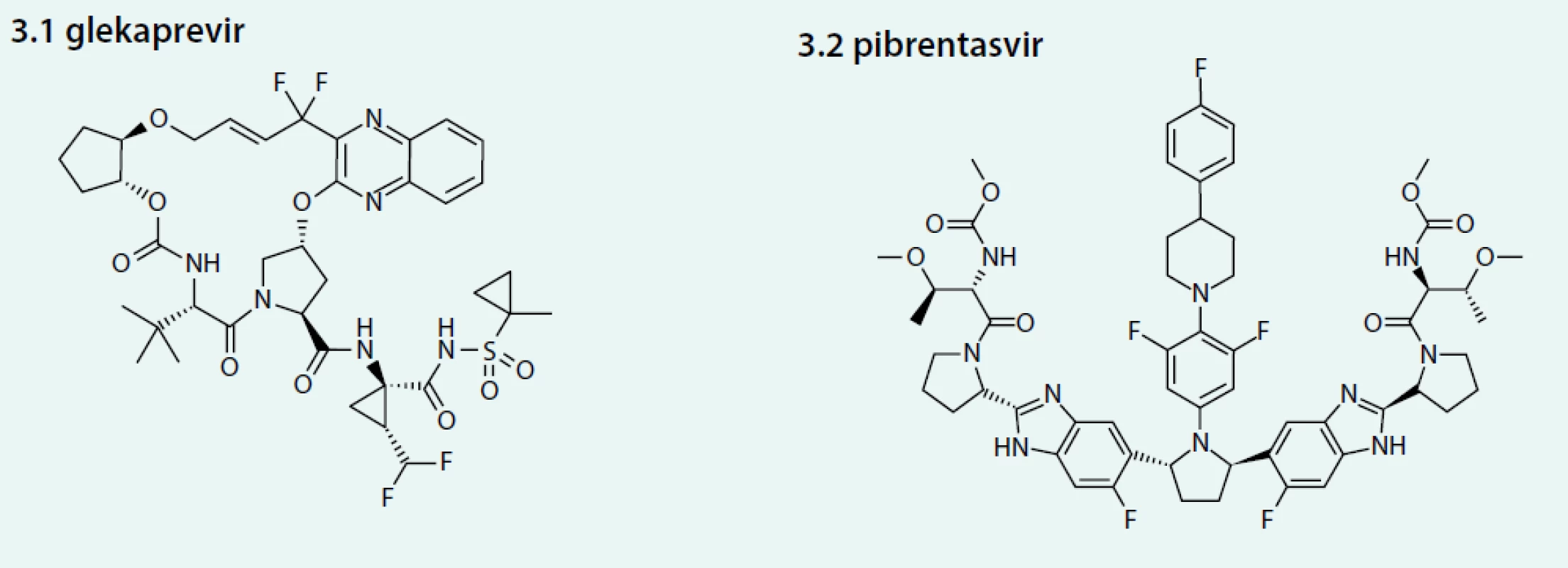
GLE i PIB jsou inhibitory P-glykoproteinu (P-gp), proteinu rezistence karcinomu prsu (BCRP) a polypeptidu transportujícího organické anionty (OATP) 1B1/3. Z této charakteristiky vyplývá i určité riziko lékových interakcí. Plazmatická koncentrace přípravků, které jsou substráty těchto enzymů, se může navýšit, a tím se zvýší jejich toxicita. Jedná se např. o dabigatran (substrát P-gp), rosuvastatin (substrát BCRP), některé další statiny, které jsou substráty OATP 1B1/3 (např. atorvastatin, lovastatin, pravastatin, simvastatin, rosuvastatin). GLE a PIB jsou in vivo slabé inhibitory cytochromu P450 (CYP) 3A, CYP1A2 a uridin glukuronosyltransferázy (UGT) 1A1. U citlivých substrátů CYP3A (midazolam, felodipin) nebo UGT1A1 (raltegravir) nebyla pozorována klinicky významná zvýšení expozice při podávání s přípravkem Maviret® [14]. Z praktického hlediska je třeba zmínit snížení účinnosti GLE/PIB v důsledku jeho sníženého vstřebávání při vzestupu žaludečního pH při současném podávání inhibitorů protonové pumpy. Při podávání omeprazolu 40 mg denně se maximální plazmatické koncentrace protivirových léčiv snížily na asi 60 %. SPC léku Maviret® nedoporučuje měnit dávkování tohoto léku při současném podávání inhibitorů protonové pumpy do denní dávky odpovídající 40 mg omeprazolu. Nicméně farmakokinetika kombinace GLE/PIB při vyšším dávkování protonových inhibitorů nebyla zkoumána.
Klinické použití
Program klinických studií zkoumajících účinnost kombinace GLE/PIB u pacientů s chronickou HCV infekcí byl prováděn odděleně pro genotyp HCV 3 a ostatní genotypy HCV, dále samostatně pro pacienty s cirhózou a bez cirhózy. Důvodem byly předpoklady (opřené o znalosti z minulosti) o potenciálně horší účinnosti kombinace u pacientů infikovaných HCV GT3 a u pacientů s jaterní cirhózou.
Kombinace GLE/PIB u non-3 genotypů HCV
Klinická doporučení k použití kombinace GLE/PIB se opírají o studie 3. fáze s názvy ENDURANCE 1–5 [15,16]. Uspořádání studií ENDURANCE 1, 2 a 4 ukazuje schéma 1. Cílovou populací této série studií byli pacienti BEZ jaterní cirhózy, infikovaní genotypy HCV 1, 2, 4, 5, 6, dosud neléčení i opakovaně léčení. Z léčebných režimů použitých u opakovaně léčených pacientů byly povoleny režimy interferonové (konvenční interferon a pegylovaný interferon s ribavirinem nebo bez něj a z bezinterferonových režimů potom pouze kombinace sofosbuviru a ribavirinu). Studie byly postaveny tak, aby bylo možno porovnat účinnosti léčby trvající 8 a 12 týdnů. Výsledky projektu ukazuje graf 4. Z obrázku je patrna jednak vysoká účinnost – SVR ≥ 99%, a jednak skutečnost, že mezi léčbou trvající 8 a 12 týdnů není významný rozdíl v SVR. Ve studiích byla zároveň prokázána vysoká bezpečnost podané medikace. Nejčastějšími vedlejšími reakcemi byla únava a cefalea (což je situace známá i u ostatních kombinací). Elevace AST/ALT a bilirubinu hodnocená jako možná hepatotoxicita použité kombinace byla velmi vzácná, elevace stupně 3 se vyskytly u AST/ALT < 2 % případů, elevace bilirubinu 3. stupně pak nepřesáhly v žádné větvi 1 %. Výsledky studií ENDURANCE se odrazily v doporučení léčit pacienty bez jaterní cirhózy infikované HCV GT 1, 2, 4, 5 a 6, dosud neléčené i opakovaně léčené kombinací GLE/PIB po dobu 8 týdnů.
Schéma 1. Uspořádání studií ENDURANCE-1, -2, -4: kombinace GLE/PIB u HCV GT1, 2, 4, 5, 6 
GLE – glekaprevir IFN – interferon PEG-IFN – pegylovaný interferon PIB – pibrentasvir RBV – ribavirin
*Dávkování: GLE/PIB 3 tbl v jedné dávce obsahující 100/40 mg, celková denní dávka 300/120 mg.
†Povolené režimy: IFN/PEG-IFN ± RBV nebo SOF + RBV ± PEG-IFNGraf 4. Výsledky studií ENDURANCE-1, -2, -4 
GT – genotyp HCV – virová hepatitida typu C SVR – setrvalá virologická odpověď/sustained virologic response
*Intention-to-treat (ITT)-PS analýza: zahrnuti byli všichni pacienti, kteří užili ≥ 1 dávku studijní medikace; vyloučeni byli pacienti s HCV/HIV koinfekcí a s léčbou sofosbuvirem v anamnéze.
†ITT analýza: vyloučeni pacienti s léčbou sofosbuvirem v anamnéze.
‡ITT analýzaLéčebný režim GLE/PIB u pacientů s jaterní cirhózou byl zkoumán v rámci programu studií EXPEDITION. I tento program oddělil HCV GT 3 od ostatních HCV genotypů. Výsledky studie EXPEDITION-1 u pacientů s kompenzovanou cirhózou při infekci HCV GT 1, 2, 4, 5 a 6 a s délkou léčby 12 týdnů ukazuje graf 5 [17]. Studie kromě vysoké účinnosti prokázala opět i vysokou bezpečnost podání kombinace GLE/PIB, v rámci studie nebyla léčba přerušena ani jednou z důvodu vedlejší reakce spojené s podáváním medikace, nejčastějšími vedlejšími reakcemi byla opět únava, cefalea a bolest hlavy (výskyt ≥ 10 %).
Graf 5. Výsledky studie ENDURANCE-3: dosud neléčení a opakovaně léčení pacienti s jaterní cirhózou, HCV GT1,2,4,5,6, doba léčby 12 týdnů [1,2] ![Výsledky studie ENDURANCE-3: dosud neléčení a opakovaně léčení pacienti s jaterní cirhózou, HCV
GT1,2,4,5,6, doba léčby 12 týdnů [1,2]](https://pl-master.mdcdn.cz/media/image_pdf/b906e721e104d7a38cf4f52f264e8f5c.png?version=1571426451)
*2 další selhání: v 1 případě odvolání informovaného souhlasu a v 1 případě nespolupráce pacienta
DCV – daklatasvir GLE – glekaprevir GT – genotyp HCV – virová hepatitida typu C ITT – intent-to-treat PIB – pibrentasvir SOF – sofosbuvir
SVR – setrvalá virologická odpověď/sustained virologic responseDoporučení vyplývající z této studie obsažené v EASL standardech je: dosud neléčení a opakovaně léčení pacienti s kompenzovanou cirhózou infikovaní jiným genotypem HCV než GT3 by měli být léčeni fixní kombinací GLE/PIB po dobu 12 týdnů.
Jak rychle se situace na poli léčby chronické HCV infekce vyvíjí, ilustrují výsledky studie EXPEDITION-8, které byly zveřejněny v prosinci roku 2018. Cílovou populací studie byli pacienti s kompenzovanou jaterní cirhózou infikovaní genotypy HCV 1–6, 17 % mělo trombocytopenii < 100 × 109/l, 90 % osob bylo funkční klasifikace Child-Pugh A 5 bodů. Při ITT analýze (Poznámka autora: Jako selhaní léčby byli hodnocení tito pacienti: 5 pacientů, u kterých nebyla dostupná HCV RNA ve 12. týdnu po skončení léčby – na konci studie; všichni však měli HCV RNA negativní při poslední absolvované návštěvě; 1 pacient s předčasným ukončením léčby) byla SVR 98% (274/280), při PP analýze (Poznámka autora: vyloučeni byli všichni nonrespondeři při ITT analýze:, n = 6, a 1 pacient, který dosáhl SVR12, ale při léčbě trvající < 8 týdnů) byla SVR dokonce 100% (273/273). Tato data prokazují vysokou, a s ostatními podskupinami pacientů srovnatelnou, SVR i u pacientů s jaterní cirhózou léčených kombinací GLE/PIB po dobu 8 týdnů [18].
Kombinace GLE/PIB u HCV GT3
Studie ENDURANCE 3 s osobami bez jaterní cirhózy a infikovanými HCV GT3 byla uspořádána poněkud odlišně než ostatní výše zmíněné studie [15]. Studie byla uspořádána tak, aby umožnila srovnání účinnosti léčby trvající 8 a 12 týdnů, ale obsahovala i kontrolní větev, v rámci které byli pacienti léčení kombinací daklatasvir (DCV) + sofosbuvir (SOF). Primárním cílem byla snaha o prokázání noninferiority zkoumaného režimu GLE/PIB 8 a 12 týdnů proti kombinaci DCV + SOF. Výsledky ukazuje graf 5. Podle výsledků znázorněných na grafu 6 byl primární cíl jednoznačně naplněn. Jediné omezení aplikace výsledků do běžné praxe spočívá v tom, že do studie bylo zahrnuto pouze 17 % osob se stadiem jaterní fibrózy F ≥ 3, 83 % pacientů mělo jaterní fibrózu F ≤ 2.
Graf 6. Výsledky studie EXPEDITION-1: pacienti infikovaní HCV GT3 bez jaterní cirhózy 
GT – genotyp HCV – virová hepatitida typu C SVR – setrvalá virologická odpověď/sustained virologic response Standardy EASL proto obsahují toto doporučení [8]: dosud neléčení pacienti s HCV GT 3 bez jaterní fibrózy nebo se středně pokročilou fibrózou (METAVIR F0-F2) by měli být léčeni touto kombinací po dobu 8 týdnů. Léčebně naivní pacienti s HCV GT3 s pokročilou fibrózou, ale bez cirhózy (METAVIR F3) mohou být léčeni touto kombinací po dobu 8 týdnů.
Opakovaně léčení pacienti s HCV GT3 bez jaterní cirhózy byli jednou z cílových populací studie SURVEYOR-2, část 3 (schéma 2) [19]. O výsledky této studie se opírá doporučení, aby osoby opakovaně léčené bez jaterní cirhózy infikované HCV GT3 byly léčeny kombinací GLE/PIB po dobu 16 týdnů (graf 7) [8]. Studie SURVEYOR-2, část 3 navázala na původní studii SURVEYOR-2, což byla studie fáze 2 [20].
Schéma 2. Uspořádání a léčená populace studie SURVEYOR-2, část 3 
Graf 7. Výsledky studie SURVEYOR-2, část 3 
Pacienti s jaterní cirhózou infikovaní HCV GT3, dosud neléčení i opakovaně léčení byli další cílovou populací již zmiňované studie SURVEYOR-2, část 3 [19]. Délka léčby byla 12 nebo 16 týdnů. Výsledky léčby ukazuje opět obr. 11. V rámci studie byla kromě bezpečnosti prokázána i vysoká SVR bez ohledu na existenci či neexistenci RAS při zahájení léčby (SVR nebyla statisticky významně rozdílná u osob s průkazem RAS a bez průkazu RAS). Na druhou stranu bylo prokázáno, že 4 z 5 relapsů HCV po skončení terapie byly spojeny s rozvojem RAS během protivirové léčby. Tato studie tedy poskytla podklad pro doporučení, aby pacienti s jaterní cirhózou při infekci HCV GT 3, kteří v minulosti nikdy nebyli protivirově léčeni, byli kombinací GLE/PIB léčeni po dobu 12 týdnů. Pacienti s jaterní cirhózou při HCV GT3, kteří již v minulosti byli léčeni protivirovou léčbou, by měli být léčeni kombinací GLE/PIB po dobu 16 týdnů.
Kombinace sofosbuviru s velpatasvirem a voxilaprevirem
Kombinace sofosbuviru, velpatasviru a voxilapreviru (SOF/VEL/VOX) je dostupná jako lék Vosevi® (výrobce Gilead Sciences, USA), 1 tbl obsahuje 400 mg SOF, 100 mg VEL a 100 mg VOX [21]. Standardní dávkování ve všech dále diskutovaných režimech a indikacích je 1 tbl à 24 hod. VOX je inhibitor NS3/4A proteázy vyvinutý firmou Gilead (obr. 4).
Obr. 4. Strukturální vzorec voxilapreviru 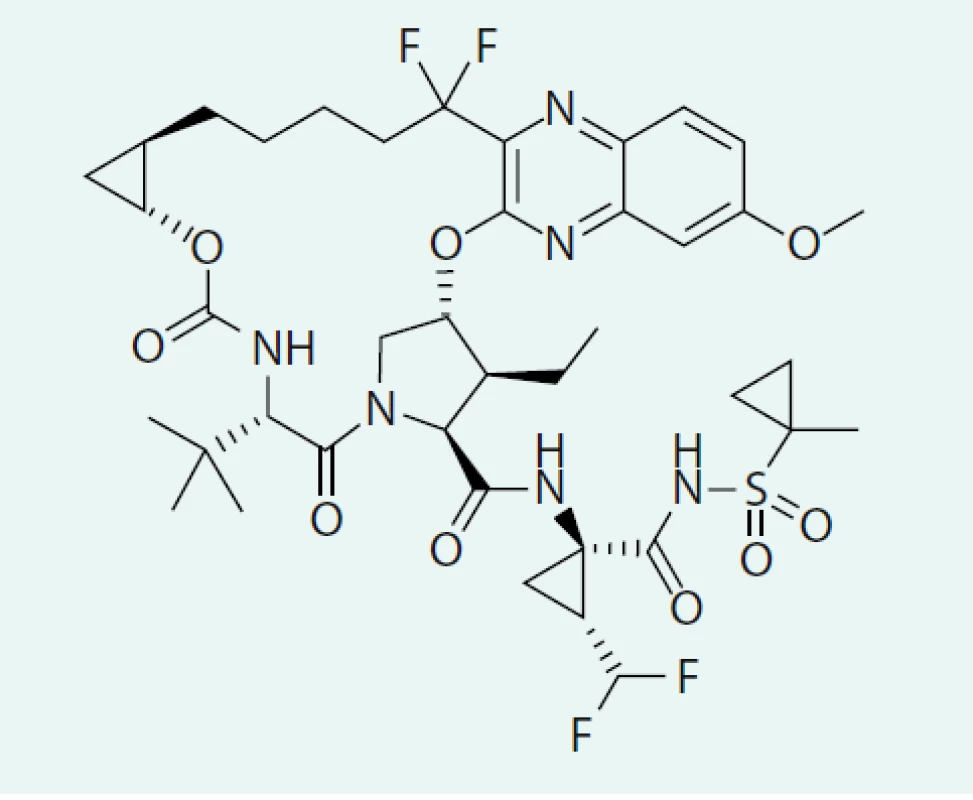
Specifikum kombinace spočívá v tom, že vzhledem k její vysoké účinnosti in vitro ve srovnání s většinou významných RAV, byl celý program studií fáze 3 cílen především na osoby se selháním předchozí protivirové léčby obsahujícím inhibitor NS3/4 nebo další virostatika.
Farmakologická charakteristika
VOX (podobně jako VEL) je inhibitorem P-gp, proteinu rezistence karcinomu prsu (BCRP) a dále polypeptidových transportérů organických aniontů OATP1B1 a OATP1B3. VOX má proto prakticky totožný potenciál lékových interakcí jako výše zmíněný VEL [21].
Klinické použití
Kombinace SOF/VEL/VOX prokázala vysokou účinnost i bezpečnost prakticky u všech podskupin pacientů s chronickou HCV infekcí. Výjimkou byli pacienti s dekompenzovanou cirhózou, u kterých je použití inhibitoru NS3/4 považováno za kontraindikované. Již jsem se zmínil, že celý program studií fáze 3 s trojkombinací SOF/VEL/VOX byl cílen na osoby, u nichž došlo k selhání léčby obsahující nejrůznější virostatika. Velmi důležitou součástí analýz celého programu tedy byla analýza vlivu existence RAS před zahájením léčby trojkombinací na její výsledek – procento SVR. Souhrnně lze konstatovat, že trojkombinace má excelentní a vysokou účinnost prakticky bez ohledu na existenci RAS, a proto je podání SOF/VEL/VOX chápáno jako jakási záchranná terapie a je doporučována pouze, a právě pro tyto osoby, u nichž podle anamnézy selhala léčba virostatiky. Výjimku dle současných standardů EASL představují pacienti s HCV GT3, jak byla tato problematika zmíněna v předchozí části. Oporu těchto doporučení je třeba hledat v publikovaných výsledcích studií 3. fáze studie POLARIS.
Studie POLARIS-1 měla jako cílovou skupinu osob pacienty infikované genotypy HCV 1–6, kteří byli již v minulosti neúspěšně léčeni režimem obsahujícím NS5A inhibitor [22]. Uspořádána byla jako dvojitě zaslepená placebem kontrolovaná studie. Kombinace SOF/VEL/VOX byla podávána po dobu 12 týdnů. Do studie byli zařazeni pacienti jak s jaterní cirhózou (46 % v léčené větvi), tak pacienti bez jaterní cirhózy. Pacienti infikovaní subtypem 1a tvořili 38 %, 1b 17 %, HCV GT2 2 %, GT3 30 %, GT4 8 % a GT5/6 pak jednotky případů. Účinnost léčby a příčiny selhání režimu u 10 pacientů ukazuje graf 8. Během léčby nedošlo k rozvoji breakthrough/průlomového fenoménu, virologické selhání – relaps infekce – byl pozorován pouze v 6 případech. V ostatních případech nešlo o virologické selhání léčebného režimu. Ve skupině cirhotiků byla SVR12 99 %, mezi pacienty bez cirhózy pak 93 %.
Graf 8. Výsledky studie POLARIS-1 a příčiny selhání léčby 
*Jako příčina byla prokázána non-adherence. Důležitá byla analýza SVR12 podle přítomnosti RAV v jednotlivých oblastech virového genomu (graf 9). 83 % osob ve studii mělo výchozí RAV, 79 % mělo výchozí RAV NS5A. Z obrázku je vidět, že mezi osobami s RAV a bez RAV nebyl významný rozdíl v dosažené SVR. Závěr ze studie plynoucí je velmi jednoduchý: kombinace SOF/VEL/VOX představuje dosud nejúčinnější a daty nejlépe podpořený režim opakované léčby u pacientů se selháním režimů DAA obsahujících inhibitory NS5A.
Graf 9. SVR12 ve studii POLARIS-1 podle výchozích RAV 
12 pacientů bylo vyloučeno z analýzy, protože nebyly dostupné požadované kompletní údaje. K analýze RAV bylo užito sekvenování s 15% cut off. Chybové úsečky ukazují 95% interval spolehlivosti. Primárním cílem studie POLARIS-2 bylo srovnání účinnosti režimu SOF/VEL/VOX trvajícím 8 týdnů s režimem SOF/VEL podávaným 12 týdnů u dosud neléčených pacientů infikovaných HCV GT1–6 [23]. Studie byla uspořádána jako otevřená, randomizovaná srovnávací studie. Nejdůležitější výsledky ukazuje graf 10. Celková SVR 8týdenního režimu SOF/VEL/VOX byla 95 %, což bylo ve srovnání s SVR12 u 12týdenního režimu SOF/VEL méně, než bylo očekáváno. Ani v této studii nebyl prokázán vliv RAV na výsledek protivirové léčby.
Graf 10. Celková SVR ve studii POLARIS-2: přímé srovnání režimů SOF/VEL/VOX 8 týdnů a SOF/VEL 12 týdnů 
Chybové úsečky ukazují 95% interval spolehlivosti. Další studie s názvem POLARIS-3 měla stejné uspořádání jako POLARIS-2, ale zahrnovala pacienty výlučně infikované HCV GT3 s jaterní cirhózou [23,24]. Větev léčená 8týdenním režimem kombinace SOF/VEL/VOX měla 29 % pacientů s počtem trombocytů < 100 000/μl, ve větvi SOF/VEL to bylo 19 %. Do studie byli zařazeni i nemocní v minulosti neúspěšně léčení IFN. SVR12 byla v obou větvích stejná, tedy 96%. V obou větvích nebyla SVR dosažena u 4 nemocných. U skupiny osob nikdy neléčených byla trojkombinace účinná v 96%, dvojkombinace v 99%. SVR u opakovaně léčených při použití režimu SOF/VEL/VOX byla 97%, u SOF/VEL 91%. Analýza SVR u pacientů s výchozími RAV ukázala, že SVR12 obou režimů u pacientů bez RAV byla 95%. Všichni pacienti s jakoukoliv dokumentovanou variantou kombinací RAV dosáhli v obou větvích vždy SVR12 ve 100 % případů.
Poslední studie ze studií fáze 3, POLARIS-4, byla uspořádána jako přímá komparativní studie režimů SOF/VEL/VOX a SOF/VEL podávaných 12 týdnů u pacientů infikovaných HCV GT1–6 s anamnézou expozice některému DAA s výjimkou inhibitorů NS5A [23,25]. SVR12 v případě kombinace SOF/VEL/VOX byla 97% vs 90% u SOF/VEL. Z virologických selhání byl v prvním pořadí pozorován jediný relaps, ostatní selhání byla z nevirologických důvodů. Mezi pacienty bez cirhózy byl SOF/VEL/VOX účinný v 98 % případů, SOF/VEL v 94 % případů. RAV přítomné před zahájením léčby neměly opět negativní vliv na dosažení SVR.
S ohledem na výše probrané výsledky léčby kombinací SOF/VEL/VOX především u pacientů se selháním předchozí léčby s použitím DAA je dle doporučení EASL tato kombinace pro pacienty s tímto typem onemocnění chápána jako „záchranná“. V jiných indikacích však doporučována není. Jedinou výjimku tvoří pacienti infikovaní HCV GT3 s jaterní cirhózou, u nichž je kombinace SOF/VEL/VOX režimem preferovaným před režimem SOF/VEL + RBV, a to právě pro možnost vynechat z léčby RBV, který je nositelem většiny nežádoucích účinků celé kombinace. Jak již bylo zmíněno, SOF/VEL/VOX nemá v indikaci odpovídající doporučením EASL v ČR stanovenu úhradu, nelze jej proto rutinně použít.
Závěr a shrnutí
Pangenotypové léčebné režimy, tj. režimy s virologickou účinností proti všem genotypům HCV představují pravděpodobně poslední vývojovou fázi hledání účinné léčby infekce HCV. Jejich vysoká účinnost, vysoká bezpečnost, a především jednoduchost jejich použití otevírají zcela nové možnosti a úvahy týkající se infekce HCV. Vrcholem těchto úvah jsou snahy o dosažení eliminace HCV, tak jak ji před 2 lety definovala WHO (tab).
Tab. 1. Cíle WHO týkající se eliminace HCV 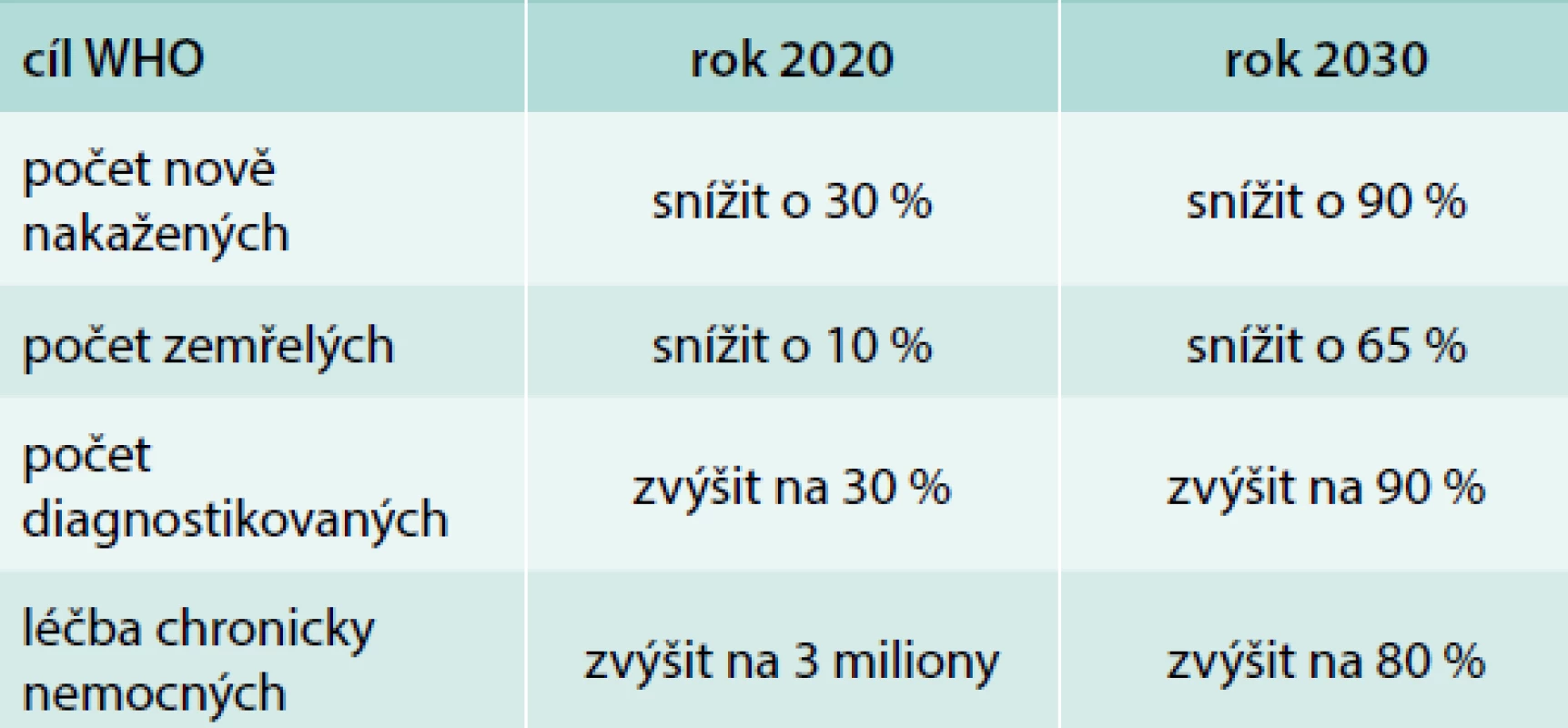
prof. MUDr. Petr Urbánek, CSc.
Interní klinika 1. LF UK a ÚVN-Vojenská fakultní nemocnice Praha
Doručeno do redakce 8. 1. 2018
Přijato po recenzi 17. 4. 2019
Zdroje
- [World Health organization]. Global alert and response (GAR). Hepatitis C. 2012. Dostupné z WWW: <http://www.who.int/csr/disease/hepatitis/whocdscsrlyo2003/en/index4html>.
- Perz JF, Armstrong GL, Farrington LA et al. The contributions of hepatitis B virus and hepatitis C virus infections to cirrhosis and primary liver cancer worldwide. J Hepatol 2006; 45(4): 529–538. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jhep.2006.05.013>.
- Kanwal F, Hoang T, Kramer JR et al. Increasing prevalence of HCC and cirrhosis in patients with chronic hepatitis C virus infection. Gastroenterology 2011; 140(4): 1182–1188.e1. Dostupné z DOI: <http://dx.doi.org/10.1053/j.gastro.2010.12.032>.
- Deuffic-Burban S, Poynard T, Sulkowski MS et al. Estimating the future health burden of chronic hepatitis C and human immunodeficiency virus infections in the United States. J Viral Hepat 2007; 14(2): 107–115. Dostupné z DOI: <http://dx.doi.org/10.1111/j.1365–2893.2006.00785.x>.
- Urbánek P, Husa P, Galský J et al. Standardní diagnostický a terapeutický postup chronické infekce virem hepatitidy C (HCV). Čas Lék. Česk 2008; 147(5): 1–12.
- Fried MW, Shiffman ML, Reddy KR et al. Peginterferon alfa-2a plus ribavirin for chronic hepatitis C virus infection. N Engl J Med 2002; 347(13): 975–982. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMoa020047>.
- Hadziyannis SJ, Sette H, Morgan TR et al. Peginterferon-alfa2a and ribavirin combination therapy in chronic hepatitis C. Ann Intern Med 2004; 140(5): 346–355. Dostupné z DOI: <http://dx.doi.org/10.7326/0003–4819–140–5-200403020–00010>.
- European Association for the Study of the Liver. EASL Recommendations on Treatment of Hepatitis C 2018. J Hepatol 2018; 69(2): 461–511. Dostupné z DOI: <https://doi.org/10.1016/j.jhep.2018.03.026>.
- Epclusa. SPC. Datum první registrace: 6. července 2016, datum poslední revize textu: červenec 2016. Dostupné z WWW: <www.sukl.cz>.
- Younossi ZM, Stepanova M, Feld J et al. Sofosbuvir/velpatasvir improves patient-reported outcomes in HCV patients: Results from ASTRAL-1 placebo-controlled trial. J Hepatol 2016; 65(1): 33–39. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jhep.2016.02.042>.
- Younossi ZM, Stepanova M, Sulkowski M et al. Ribavirin-Free Regimen With Sofosbuvir and Velpatasvir Is Associated With High Efficacy and Improvement of Patient-Reported Outcomes in Patients With Genotypes 2 and 3 Chronic Hepatitis C: Results from Astral-2 and -3 Clinical Trials. Clin Infect Dis 2016; 63(8): 1042–1048. Dostupné z DOI: <http://dx.doi.org/10.1093/cid/ciw496>.
- Foster GR, Afdhal N, Roberts SK et al. Sofosbuvir and Velpatasvir for HCV Genotype 2 and 3 Infection. N Engl J Med 2015; 373(27): 2608–2617. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMoa1512612>.
- Curry MP, O’Leary JG, Bzowej N et al. Sofosbuvir and Velpatasvir for HCV in Patients with Decompensated Cirrhosis. N Engl J Med 2015; 373(27): 2618–2628. <http://dx.doi.org/10.1056/NEJMoa1512614>.
- Maviret. SPC. Datum první registrace: 26. 7. 2017, datum poslední revize textu: listopad 2018. Dostupné z WWW: <http://www.sukl.cz/modules/medication/detail.php?code=0222376&tab=texts>.
- Zeuzem S, Foster GR, Wang S et al. Glecaprevir-Pibrentasvir for 8 or 12 Weeks in HCV Genotype 1 or 3 Infection. N Engl J Med 2018; 378(4): 354–369. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMoa1702417>.
- Asselah T, Kowdley KV, Zadeikis N et al. Efficacy of Glecaprevir/Pibrentasvir for 8 or 12 Weeks in Patients With Hepatitis C Virus Genotype 2, 4, 5, or 6 Infection Without Cirrhosis. Clin Gastroenterol Hepatol 2018; 16(3): 417–426. Dostupné z DOI: <http://dx.doi.org/10.1016/j.cgh.2017.09.027>.
- Forns X, Lee SS, Valdes J et al. Glecaprevir plus pibrentasvir for chronic hepatitis C virus genotype 1, 2, 4, 5, or 6 infection in adults with compensated cirrhosis (EXPEDITION-1): a single-arm, open-label, multicentre phase 3 trial. Lancet Infect Dis 201; 17(10): 1062–1068. Dostupné z DOI: <http://dx.doi.org/10.1016/S1473–3099(17)30496–6>.
- Brown RS Jr, Hezode C, Wang S et al. Preliminary efficacy and safety of 8-week glecaprevir/pibrentasvir in patients with HCV genotype 1–6 infection and compensated cirrhosis: the EXPEDITION-8 study [AASLD abstract LB-7]. Hepatology 2018; 68(Suppl 1). Dostupné z WWW: <https://www.sciencedirect.com/journal/journal-of-hepatology/vol/68/suppl/S1>.
- Wyles D, Poordad F, Wang S et al. Glecaprevir/pibrentasvir for hepatitis C virus genotype 3 patients with cirrhosis and/or prior treatment experience: A partially randomized phase 3 clinical trial. Hepatology 2017; 67(2):514–523. Dostupné z DOI: <http://dx.doi.org/10.1002/hep.29541>.
- Kwo PY, Poordad F, Asatryan A et al. Glecaprevir and pibrentasvir yield high response rates in patients with HCV genotype 1–6 without cirrhosis. J Hepatol 2017; 67(2): 263–271. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jhep.2017.03.039>.
- Vosevi. SPC. Datum první registrace: 26. července 2017, datum poslední revize textu: listopad 2018. Dostupné z WWW: <http://www.sukl.cz/modules/medication/detail.php?code=0222375&tab=texts>.
- Bourlière M, Gordon SC, Flamm SL et al. Sofosbuvir, Velpatasvir, and Voxilaprevir for Previously Treated HCV Infection. N Engl J Med 2017; 376(22): 2134–2146. Dostupné z DOI: <http://10.1056/NEJMoa1613512>.
- Jacobson IM, Lawitz E, Gane EJ et al. Efficacy of 8 Weeks of Sofosbuvir, Velpatasvir, and Voxilaprevir in Patients With Chronic HCV Infection: 2 Phase 3 Randomized Trials. Gastroenterology 2017; 153(1): 113–122. Dostupné z DOI: <http://dx.doi.org/10.1053/j.gastro.2017.03.047>.
- Foster GR, Thompson A, Ruane PJ et al. A Randomized, Phase 3 Trial of Sofosbuvir/Velpatasvir/Voxilaprevir for 8 Weeks and Sofosbuvir/Velpatasvir for 12 Weeks for Patients with Genotype 3 HCV Infection and Cirrhosis: The POLARIS-3 Study. Hepatology 2016; 64(1 Suppl): A258. Dostupné z DOI: <https://doi.org/10.1002/hep.28796>.
- Zeuzem S, Flamm S, Tong M et al. A Randomized, Controlled, Phase 3 Trial of Sofosbuvir/Velpatasvir/Voxilaprevir or Sofosbuvir/Velpatasvir for 12 Weeks in Direct-Acting Antiviral-Experienced Patients With Genotype 1–6 HCV Infection: The POLARIS-4 Study. Hepatology 2016; 64(1 Suppl): A109. Dostupné z DOI: <https://doi.org/10.1002/hep.28796>.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek Z odborné literaturyČlánek errata et corrigenda
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2019 Číslo 9- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- S prof. Vladimírem Paličkou o racionální suplementaci kalcia a vitaminu D v každodenní praxi
-
Všechny články tohoto čísla
- Hepatologie – úvod do problematiky
- Neinvazivní diagnostika jaterních chorob – zobrazovací metody
- Současný pohled na diagnostiku a léčbu hepatitidy B
- Pangenotypové režimy léčby chronické hepatitidy C
- Vývoj poznatků o nemoci způsobené virem hepatitidy E
- Nealkoholové postižení jater při steatóze
- Sérové markery v diagnostice nealkoholické steatohepatitidy
- Rizikové faktory a surveillance hepatocelulárního karcinomu
- Transplantace jater – vývoj indikací v poslední dekádě
- Z odborné literatury
- errata et corrigenda
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Neinvazivní diagnostika jaterních chorob – zobrazovací metody
- Vývoj poznatků o nemoci způsobené virem hepatitidy E
- Nealkoholové postižení jater při steatóze
- Současný pohled na diagnostiku a léčbu hepatitidy B
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



