-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Současné trendy v imunosupresivní léčbě
Current trends in immunosuppressive treatment
Immunosuppressive agents represent a class of drugs that inhibits activity of the immune system. They are mostly used in autoimmune diseases and other inflammatory conditions treatment and in prevention of recipient´s immune response to donors antigens in transplantations. There is a broad spectrum of different immunosuppressive drugs with various mechanisms of action. This article provides an overview of drugs currently registered as immunosuppressive agents in the Czech Republic and provides some insights what we might expect regarding this group of drugs in the future.
Keywords:
biologic treatment – fusion proteins – Kinase inhibitors – Monoclonal antibodies – tolerance
Autoři: Marta Sobotková; Jiřina Bartůňková
Působiště autorů: Ústav imunologie 2. LF UK a FN Motol, Praha
Vyšlo v časopise: Vnitř Lék 2019; 65(2): 136-142
Kategorie: Přehledné referáty
Souhrn
Imunosupresiva představují skupinu látek používaných k potlačení funkce imunitního systému. Uplatňují se zejména v léčbě autoimunitních a jiných chronických zánětlivých onemocnění a k potlačení imunitní reakce příjemce proti dárcovským antigenům po transplantacích. V současnosti máme k dispozici široké spektrum imunosupresiv s různými mechanizmy účinku. Tento článek přináší přehled léků aktuálně registrovaných v České republice jako imunosupresiva a zamýšlí se rovněž nad možnými dalšími směry vývoje v rámci této farmakoterapeutické skupiny.
Klíčová slova:
biologická léčba – fúzní proteiny – kinázové inhibitory – monoklonální protilátky – tolerance
Úvod
Jako imunosupresiva označujeme léky, které potlačují funkce imunitního systému. Používáme je v případech, v nichž příliš intenzivní imunitní reakce organizmus poškozují, jako je tomu u autoimunitních a dalších chronických zánětlivých chorob, nebo potřebujeme utlumit normálně fungující imunitní systém, jak se děje u pacientů po transplantacích [1].
Současná imunosupresiva většinou působí nespecificky. To znamená, že kromě autoreaktivních či aloreaktivních lymfocytů potlačují funkce dalších složek imunity včetně lymfocytů normálních. To vede k utlumení fyziologických imunitních reakcí, které nás chrání před patogeny ze zevního prostředí a zajišťují odstraňování starých a poškozených buněk. Proto je nejčastější obecnou komplikací imunosupresivní léčby zvýšené riziko onemocnění infekčních a nádorových [2].
Z tohoto hlediska je velkým pokrokem tzv. biologická léčba. Ačkoli se stále jedná o imunosupresivní terapii nespecifickou, je díky cílenému působení zpravidla spojena s menšími riziky vedlejších účinků. Pravděpodobně nejpřesnější definice vymezuje biologická léčiva jako farmaka, při jejichž výrobě jsou používány živé organizmy nebo jejich produkty a jejichž mechanizmus účinku spočívá v cíleném ovlivnění molekul nebo dějů zúčastněných v určitých biologických procesech. Podle této definice mezi biologická léčiva používaná v imunosupresivní indikaci zpravidla zahrnujeme monoklonální protilátky, fúzní proteiny a analoga cytokinů. Někteří autoři mezi ně počítají i kinázové inhibitory, což jsou ovšem léky s malou molekulou vyráběné synteticky. Jelikož mají biologická léčiva zpravidla poměrně složitou strukturu, mohou být citlivá na modifikace ve výrobním procesu. Z tohoto důvodu pro analogické léky, zaváděné na trh po vypršení původního patentu další farmaceutickou společností, nepoužíváme označení generika, ale biosimilární léčiva. V anglické literatuře se pak setkáme s pojmy jako biosimilars, follow on biologics nebo subsequent entry biologics [3].
V současnosti máme k dispozici široké spektrum imunosupresiv s různou chemickou strukturou i mechanizmem účinku (tab. 1). Podle ATC (anatomicko-terapeuticko-chemické) klasifikace jsou řazena do skupiny L04 [4].
Tab. 1. Rozdělení imunosupresiv podle mechanizmu účinku. Upraveno podle [4], údaje platné k 19. 6. 2018 ![Rozdělení imunosupresiv podle mechanizmu účinku. Upraveno podle [4], údaje platné k 19. 6. 2018](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/18e512f4140ce37b62a2e36448b8bf83.jpeg)
ATG – antitymocytární globulin IVIG – polyklonální polyspecifické intravenózní imunoglobuliny/IntraVenous ImmunoGlobulin mTOR – mammalian Target Of Rapamycine Současná imunosupresiva v historických souvislostech
Historie imunosupresivní léčby se začala psát v roce 1948, v němž americký lékař Philip Showalter Hench poprvé aplikoval kortizon pacientce postižené revmatoidní artritidou. Po několika dnech terapie byla původně imobilní pacientka schopna chůze. Účinnost následně ověřil ještě na 15 dalších pacientech a s velkým ohlasem zveřejnil. Za svůj přelomový objev byl společně se svými kolegy již roku 1950 odměněn Nobelovou cenou [5]. Glukokortikoidy dodnes představují základní lék používaný v terapii širokého spektra autoimunitních a jiných chronických zánětlivých onemocnění. Kromě perorálního a parenterálního způsobu podání jsou aplikovány i lokálně na kůži a sliznice nebo intraartikulárně. Mechanizmus jejich imunosupresivního účinku spočívá v inhibici transkripčních faktorů NF-κB a AP1, čímž tlumí tvorbu celé řady prozánětlivých cytokinů, expresi fosfolipázy A i aktivitu NO-syntetázy, expresi adhezivních molekul a hlavního histokompatibilního komplexu glykoproteinů II. třídy (Major Histocompatibility Complex – MHC), uvolňování histaminu z bazofilů a ve vyšších koncentracích také indukují apoptózu lymfocytů. Jejich působení tedy ovlivňuje jak mechanizmy specifické, tak nespecifické imunity [1].
Imunosupresiva zasahující do metabolizmu DNA se objevila na konci 50. a začátkem 60. let 20. století. Tyto látky byly původně zpravidla vyvíjeny k léčbě nádorových onemocnění, ale řada z nich našla své místo v léčbě chorob autoimunitních a v transplantologii. Jedním z nich byl v 50. letech minulého století cyklofosfamid, který byl vynalezen jako méně toxický derivát dusíkatého yperitu. V organizmu se metabolizuje na aktivní metabolity, které mají schopnost alkylovat DNA. Jedná se o poměrně toxické imunosupresivum, a proto je jeho použití v současnosti rezervováno pro závažnější a rychle progredující formy autoimunitních onemocnění, jako jsou např. ANCA asociované vaskulitidy a závažnější formy lupusové nefritidy [1,4,6]. Na přelomu 40. a 50. let minulého století byla také objevena antifolika – antimetabolity kyseliny listové, které interferují se syntézou purinů, kyseliny tymidylové a tymidinu [1]. Hlavním představitelem imunosupresiv z této skupiny je v současnosti metotrexát. Ačkoli první studie zaměřené na použití antifolik v léčbě revmatoidní a psoriatické artritidy proběhly již roku 1951, pro léčbu psoriatické artritidy byl metotrexát registrován americkou FDA (Food and Drug Administration) až v roce 1972 a pro léčbu revmatoidní artritidy dokonce až roku 1988. Tato skutečnost je poměrně překvapivá vzhledem k tomu, že metotrexát je v současnosti v léčbě revmatoidní artritidy lékem první linie [6,7]. Na přelomu 50. a 60. let 20. století byl vyvinut antimetabolit purinových nukleových bází azatioprin. Právě díky němu se roku 1962 podařila první úspěšná transplantace kadaverózní ledviny od nepříbuzného dárce [8]. V současnosti se azatioprin kromě transplantologie uplatňuje v léčbě širokého spektra autoimunitních onemocnění, např. revmatoidní a psoriatické artritidy, systémového lupus erythematodes (SLE), autoimunitní hepatitidy a celé řady dalších [4,6]. Dalším analogem purinových bází registrovaným jako imunosupresivum je kladribin, který byl dosud používán zejména v onkologii, ale nově je schválen i pro léčbu vysoce aktivních forem relabující roztroušené sklerózy [4]. Se syntézou purinových bází interferuje i mykofenolát mofetil, který je v organizmu metabolizován na kyselinu mykofenolovou. Jedná se o ireverzibilní inhibitor inozinmonofosfátdehydrogenázy, který po svém uvedení na trh roku 1994 prakticky nahradil azatioprin v transplantačních imunosupresivních režimech. Kromě transplantologie je zkoušen i u některých autoimunitních onemocnění. Zejména se osvědčil v léčbě lupusové nefritidy [4,9,10]. Nejnovějšími farmaky, která zasahují do metabolizmu DNA, jsou leflunomid a jeho aktivní metabolit teriflunomid. Leflunomid byl FDA registrován roku 1998 k léčbě psoriatické a revmatoidní artritidy a teriflunomid roku 2012 pro léčbu roztroušené sklerózy. Fungují jako inhibitory enzymu dihydroorotátdehydrogenázy, který je nutný pro syntézu pirimidinů de novo [4,11].
Antilymfocytární a antitymocytární globuliny
V 60. letech 20. století vstoupily na trh i antilymfocytární a antitymocytární globuliny. Antilymfocytární globuliny byly původně získávány se séra koní imunizovaných extraktem z lymfatických tkání, ale později byla k jejich výrobě používána i jiná zvířata. V současnosti je v ČR registrován pouze globulin antitymocytární, získávaný imunizací králíků extraktem z lidského tymu. Jedná se tedy o heterologní imunoglobuliny namířené proti lidským T-lymfocytům. Ačkoli zprvu byly tyto látky používány jako adjuvantní imunosupresiva v běžných transplantačních režimech, od roku 1984 se uplatňují zejména v léčbě a prevenci akutní rejekce [1,12].
Kalcineurinové inhibitory
Velký zlom pro transplantologii nastal v 70. letech 20. století s příchodem cyklosporinu. Cyklosporin byl objeven jako produkt půdní houby Tolypocladium inflatum při výzkumu látek použitelných jako antibiotika. Záhy však u něj byl popsán imunosupresivní potenciál, který byl v době svého objevu díky přednostnímu ovlivnění T-lymfocytů zcela unikátní. Cyklosporin se tak velmi rychle stal klíčovým lékem používaným v imunosupresivních potransplantačních režimech. Není bez zajímavosti, že tehdejší Československo bylo 2. státem na světě, který začal cyklosporin produkovat. Cyklosporin je v transplantologii široce používán dodnes a kromě toho našel využití v léčbě autoimunitních onemocnění, jako jsou např. revmatoidní artritida, SLE (zejména při renálním postižení), psoriáza a těžké formy atopické dermatitidy [3,13]. Objev cyklosporinu dal současně vzniknout i nové skupině imunosupresiv – tzv. kalcineurinovým inhibitorům (nebo obecněji léčivům vážícím se na imunofiliny, označovaným také jako antibiotická imunosupresiva). Imunofiliny představují širokou rodinu ubikviterně se vyskytujících proteinů schopných vázat různé látky včetně imunosupresiv. Podílejí se na celé řadě buněčných procesů, zejména aktivačních a signálních drahách buňky. Z hlediska aktuálně používaných farmak jsou důležitými představiteli imunofilinů zejména cyklofiliny, vážící cyklosporin, a FK506 vážící proteiny (FKBP), které váží sirolimus a takrolimus a jejich analoga. Imunofilin s navázaným léčivem následně inhibuje buď kalcineurin (kalcineurinové inhibitory) nebo enzym mammalian Target Of Rapamycine (mTOR, inhibitory mTOR). Kalcineurin hraje zásadní roli ve zprostředkování buněčné signalizace z receptoru T-lymfocytů pro antigen (TCR). Jeho aktivace je důležitá hlavně pro transkripci genů pro cytokiny, ale reguluje i transport proteinů a iontů, moduluje enzymatickou aktivitu a hraje úlohu i v apoptóze. Kromě cyklosporinu řadíme mezi kalcineurinové inhibitory i takrolimus (FK506), objevený v roce 1987, a pimekrolimus, uvedený na trh roku 2001. Zatímco systémově podávaný takrolimus našel uplatnění v transplantologii a je zkoušen v léčbě některých autoimunitních chorob, jeho lokální forma je určena k terapii atopické dermatitidy. Ve stejné indikaci je ve formě krému používán i pimekrolimus. Enzym mTOR se podílí na regulaci funkce celé řady proteinů a důsledkem jeho inhibice je zablokování přechodu buňky z G1 do S fáze. Inhibitory mTOR ovlivňují především pozdější stadia aktivace T-lymfocytů a inhibují proliferaci buněk indukovanou cytokiny. Prvním představitelem léků z této skupiny byl sirolimus (rapamycin), který byl poprvé izolován a popsán v roce 1975 jako produkt půdní houby Streptomyces hygroscopicus původem z Velikonočních ostrovů. Právě z jejich domorodého označení Rapa Nui, byl odvozen název rapamycin. V současnosti sirolimus využíváme především v transplantologii, ale stenty napuštěné touto látkou lze použít i k prevenci restenóz po balónkových angioplastikách. Novější látkou z této skupiny je everolimus, používaný především k profylaxi orgánové rejekce po transplantacích solidních orgánů. Kalcineurinové inhibitory a inhibitory mTOR působí synergicky a tohoto efektu se s úspěchem klinicky využívá [3,13]. Inhibitory mTOR jsou díky svému antiproliferativnímu účinku používány i v onkologii. Další zajímavou látkou s imunosupresivním potenciálem, která byla objevena při zkoumání produktů půdních hub, je gusperimus. Jeho mechanizmus účinku se však od výše uvedených látek liší a nebyl dosud přesně objasněn. Předpokládá se, že by po vazbě na některé heat shock proteiny mohl inhibovat transkripční faktor NF-κB, a díky tomu tlumit funkce T-lymfocytů i B-lymfocytů, dendritických buněk i monocytů. V České republice byl gusperimus přechodně registrován k terapii rejekce po transplantacích ledvin a později dovážen ve specifickém léčebném programu k terapii rezistentních forem granulomatózy s polyangiitidou (GPA, dříve Wegenerova granulomatóza) [3,13,14].
Polyklonální intravenózní imunoglobuliny
V 80. letech 20. století byl objeven imunosupresivní potenciál polyklonálních imunoglobulinů a na trh vstoupily první monoklonální protilátky. Polyklonální intravenózní imunoglobuliny poprvé v imunosupresivní indikaci s úspěchem použil švýcarský lékař Paul Imbach v roce 1980 u 12letého chlapce s refrakterní idiopatickou trombocytopenickou purpurou, lymfopenií, sekundární hypogamaglobulinemií a opakovanými infekty. Ani po více než 30 letech však není přesně znám mechanizmus jejich imunosupresivního působení. Zvažována je např. blokáda Fc receptoru fagocytů, obnovení idiotypové a antiidiotypové sítě, suprese nebo neutralizace cytokinů, blokáda adhezivních molekul, inhibice vazby komplementu na cílové tkáně a indukce apoptózy. V současnosti jsou určeny k léčbě diagnóz jako idiopatická trombocytopenická purpura, syndrom Guillaina-Barrého, Kawasakiho choroba a multifokální motorická neuropatie. Kromě toho se s úspěchem používají např. k léčbě roztroušené sklerózy, chronické zánětlivé demyelinizační polyneuropatie nebo rejekce po transplantacích [3,15].
Monoklonální protilátky
V 80. letech se objevily také první terapeutické monoklonální protilátky. Označujeme tak imunoglobuliny produkované jedním klonem B-lymfocytů. Tento jednotný původ určuje i jejich shodné vlastnosti a antigenní specifitu. První monoklonální protilátky připravili hybridomovou technologií Cézar Millstein a Georges J. F. Köhler v roce 1974 a roku 1984 byli za tento objev odměněni Nobelovou cenou. Hybridomy jsou hybridní buňky vzniklé fúzí buněk získaných ze sleziny senzibilizovaných myší s nesmrtelnými buňkami myelomovými. Protilátky, které produkují, jsou cizorodé myší proteiny. Po jejich podání pacientům docházelo k tvorbě protilátek označovaných jako HAMA (Human Anti-Mouse Antibodies). Tyto protilátky nejen blokují funkci monoklonální protilátky a urychlují její eliminaci z organizmu, ale mohou vést i k závažné alergické reakci. Proto byly snahy o jejich maximální „humanizaci“. Problém řeší metody genového inženýrství, které kombinují myší a lidskou DNA tak, že ponechávají myší DNA kódující úseky zajišťující antigenní specificitu a kombinují ji s genem pro lidský imunoglobulin. Vzniklý gen je vložen do vhodné savčí buňky, která pak produkuje příslušnou protilátku. Tak byly získány protilátky chimérické, které jsou humánní z 65 % a myšího původu u nich jsou jen Fab fragmenty, a humanizované, které obsahují lidského proteinu více než 90 % a myšího původu jsou u nich jen oblasti reagující s antigenními epitopy. V současnosti však máme k dispozici i řadu protilátek plně humánních. Původ protilátky lze určit i podle generické přípony jejího názvu. Koncovka -omab odpovídá monoklonálním protilátkám myšího původu, příponu -ximab mají protilátky chimérické, -zumab humanizované a -umab plně humánní (schéma) [3,16]. Mechanizmus účinku monoklonálních protilátek spočívá ve vazbě na konkrétní cílovou strukturu, což může mít různé důsledky. Nejčastěji vazba na buněčný povrch vede k likvidaci cílové buňky. Za efektorový mechanizmus zodpovídá Fc fragment monoklonální protilátky a děje se tak prostřednictvím fagocytózy, na protilátkách závislé cytotoxické reakci (ADCC) nebo aktivací komplementu. Pokud je cílovým antigenem solubilní molekula, dochází k její neutralizaci. Při vazbě na receptor na buněčném povrchu dochází k zablokování signální cesty, která je s touto molekulou spojena. Zvažována je i možnost tvorby antiidiotypových protilátek nebo indukce apoptózy po navázání protilátky na buněčný povrch [3,16]. První terapeuticky používanou monoklonální protilátkou byl muromonab (OKT3), schválený k užití v humánní medicíně FDA roku 1985. Byl cílený proti CD3 znaku T-lymfocytů a určený k léčbě akutní rejekce po transplantacích [17]. První zmínky o testování monoklonálních protilátek v léčbě autoimunitních chorob pochází z roku 1992. Jednalo se o protilátku namířenou proti znaku CD52 s názvem Campath a testovanou na pacientech s revmatoidní artritidou [3]. Dnes je již k dispozici celá řada dalších monoklonálních protilátek s různou antigenní specifitou. Jejich zavedení do praxe znamenalo zásadní převrat nejen v transplantologii a léčbě autoimunitních onemocnění, ale také v onkologii, a jejich použití se rozšiřuje i na léčbu chorob infekčních. V současnosti se také jedná o nejrychleji se rozrůstající skupinu imunosupresiv. Z hlediska imunosupresivního působení monoklonálních protilátek je nezbytné správně zvolit cílovou strukturu, proti které má být namířena. Vzhledem k tomu, že u autoimunitních chorob i v transplantologii potřebujeme aktivitu imunitního systému utlumit, cíleny jsou především buňky a další struktury zapojené do mechanizmu zánětu. Přehled terapeutických monoklonálních protilátek aktuálně (k 19. 6. 2018) registrovaných v ČR jako imunosupresiva nabízí tab. 2.
Schéma. Typy terapeutických monoklonálních protilátek. Upraveno podle [3] ![Schéma. Typy terapeutických monoklonálních protilátek. Upraveno podle [3]](https://pl-master.mdcdn.cz/media/image_pdf/59bc4be5ae0a8dfbd9e56d0f35159068.jpeg?version=1553518218)
Tab. 2. Přehled monoklonálních protilátek registrovaných v ČR jako imunosupresiva. Upraveno podle [4], údaje platné k 19. 6. 2018 ![Přehled monoklonálních protilátek registrovaných v ČR jako imunosupresiva. Upraveno podle [4], údaje
platné k 19. 6. 2018](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/f9472aec1b2df1fbaf54049824f52591.jpeg)
CD – Cluster of Differenciation IgG – imunoglobulin G IL – interleukin TNF – tumor nekrotizující faktor/Tumor Necrosis Factor Biologická léčiva
Monoklonální protilátky společně s fúzními proteiny a analogy cytokinů (antagonisty receptorů) zpravidla řadíme mezi tzv. biologická léčiva (definice viz Úvod). Fúzní proteiny jsou bílkoviny vzniklé spojením 2 a více genů. V praxi bývá výsledná struktura tvořená Fc fragmentem imunoglobulinu a další komponentou, která cíleně ovlivňuje konkrétní děje v organizmu. Prvním fúzním proteinem registrovaným jako imunosupresivum byl etanercept, který FDA schválila k léčbě revmatoidní artritidy roku 1998. Ačkoli spektrum fúzních proteinů registrovaných jako imunosupresiva zatím zdaleka není tak široké, jako je tomu u monoklonálních protilátek, nepochybně můžeme očekávat, že se jejich počet bude rozšiřovat (tab. 1) [3,13,18]. Analoga cytokinů fungují jako antagonisté příslušných receptorů a dosud jediným registrovaným imunosupresivem fungujícím na tomto principu je anakinra. Jedná se rekombinantní neglykosylovanou formu IL1, která funguje jako antagonista receptoru pro IL1. Ačkoli je oficiálně registrován i pro léčbu revmatoidní a juvenilní idiopatické artritidy, v praxi je používán zejména v terapii některých vzácných autoinflamatorních onemocnění [3,4,13]. Přehled biologických léků podle mechanizmu účinku je uveden v tab. 3.
Tab. 3. Přehled biologických léčiv podle mechanizmu účinku. Údaje platné k 19. 6. 2018 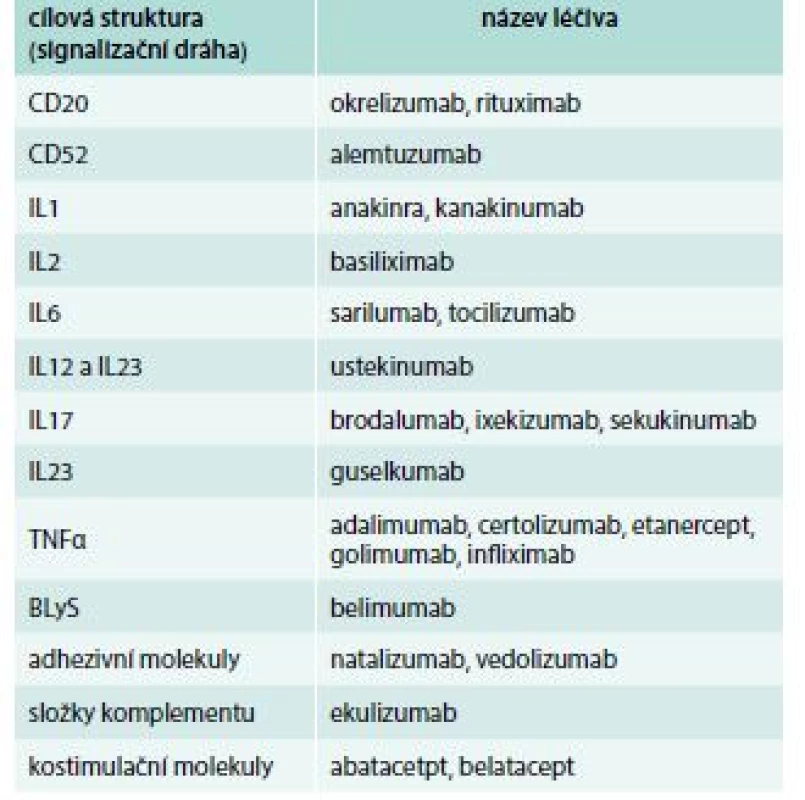
BLyS – B-Lymphocyte Stimulator CD – Cluster of Differenciation CTLA – Cytotoxic T-Lymphocyte-Associated protein IL – interleukin TNF – tumor nekrotizující faktor/Tumor Necrosis Factor Nová imunosupresiva
Po roce 2010 se objevila nová imunosupresiva s novými mechanizmy účinku. Pro léčbu roztroušené sklerózy byl významný právě rok 2010, kdy FDA schválila preparát fingolimod jako první perorálně podávaný preparát určený k léčbě této diagnózy. Jedná se o látku, která se po své metabolizaci v organizmu váže na receptor pro sfingosin-1-fosfát (S1P) lokalizovaný na lymfocytech, brání jejich migraci z lymfatických uzlin, a tím snižuje infiltraci CNS patogenními lymfocyty. Předpokládá se také působení prostřednictvím interakce s S1P na nervových buňkách [4,19]. Roku 2011 EMA (European Medicines Agency) registrovala pro léčbu idiopatické plicní fibrózy pirfenidon, látku, která tlumí fibrogenezi. Pirfenidon totiž ne zcela přesně objasněným mechanizmem snižuje proliferaci fibroblastů a produkci prozánětlivých cytokinů a proteinů [4,20]. Portfolio léků určených k léčbě idiopatické plicní fibrózy později rozšířil i nintedanib schválený FDA roku 2014. Mechanizmus účinku spočívá v inhibici tyrozinkináz, zapojených zejména do signalizačních drah asociovaných s receptory pro vaskulární endoeliální růstový faktor (Vascular Endothelial Growth Factor – VEGF), fibroblastový růstový faktor (Fibroblast Growth Factor – FGF) a destičkový růstový faktor (Platelet Derived Growth Factor – PDGF) [4,21]. Pro Evropské státy se jednalo o vůbec první kinázový inhibitor registrovaný jako imunosupresivum (schválení EMA roku 2015). Obecný mechanizmus účinku kinázových inhibitorů spočívá v inhibici proteinkináz, enzymů, zapojených do buněčné signalizace. Donedávna byla hlavní oblastí jejich použití zejména onkologie, která využívá více či méně specifických inhibitorů mutovaných kináz, které se uplatňují jako onkogeny. Nyní se jejich použití rozšiřuje i na onemocnění autoimunitní. Celosvětově prvním kinázovým inhibitorem registrovaným jako imunosupresivum byl tofacitinib, který FDA schválila pro léčbu revmatoidní artritidy roku 2012. Jedná se o inhibitor janusových kináz (JAK), zejména pak JAK1 a JAK3. Později byl pro léčbu stejné diagnózy registrován i další inhibitor JAK baricitinib, který tlumí aktivitu zejména JAK1 a JAK2. Oba výše zmiňované preparáty jsou určeny pro léčbu pacientů se středně těžkou až těžkou revmatoidní artritidou, kteří nedostatečně reagují na konvenční léčbu [4]. V léčbě psoriatické artritidy a psoriázy je novinkou apremilast (schválení FDA i EMA roku 2014), který funguje jako inhibitor fosfodiesterázy 4. Moduluje zejména tvorbu TNFα, IL23, IL17 a dalších prozánětlivých cytokinů, a tlumí tak zánětlivou odpověď [4].
Budoucnost imunosupresivní léčby
Jakým směrem se bude v budoucnu ubírat imunosupresivní terapie, nelze zcela přesně odhadnout. Současný vývoj směřuje od neselektivních léčiv se širokým spektrem nežádoucích účinků, jako jsou glukokortikoidy nebo cyklofosfamid, k léčivům ovlivňujícím cíleně konkrétní struktury, jako jsou monoklonální protilátky nebo kinázové inhibitory. Kromě toho jsou vyvíjeny deriváty již existujících léčiv. Příkladem může být volkosporin, jenž představuje novou generaci kalcineurinových inhibitorů a zdá se být nadějným lékem pro transplantologii a léčbu některých autoimunitních onemocnění, jako je např. SLE či neinfekční uveitidy [22]. Dále můžeme zmínit ozanimod, který je po fingolimodu dalším antagonistou S1P receptorů a jeví se být slibným léčivem nejen pro terapii roztroušené sklerózy, ale i nespecifických střevních zánětů [23]. Objevují se i látky využívající zcela nové mechanizmy účinku. Příkladem může být laquinimod, jehož imunomodulační působení pravděpodobně spočívá zejména v ovlivnění mechanizmů nespecifické imunity, jako jsou např. toll-like receptory. Tato látka prokázala svou účinnost v léčbě roztroušené sklerózy a nadějnou se jeví i pro léčbu Crohnovy choroby [23,24]. Předpokládá se také rozšíření indikací léků již registrovaných. Např. pro ekulizumab, který byl původně registrován jen pro léčbu paroxyzmální noční hemoglobinurie a atypického hemolyticko-uremického syndromu, byla nově rozšířena indikace i pro léčbu myasthenia gravis, a mohl by být nadějnou látkou např. i pro léčbu akutní rejekce zprostředkované protilátkami a neuromyelitis optica [22,25]. Naopak řada původně nadějných látek je z trhu stažena. Příkladem je daklizumab, monoklonální protilátka proti receptoru pro IL2. Ten byl původně určen k profylaxi rejekce po transplantacích ledviny, ale po krátkodobém stažení z trhu byl později pod jiným názvem registrován k léčbě roztroušené sklerózy. V současnosti však byl opět stažen z trhu z důvodu rizika závažných nežádoucích účinků [24].
Všechna dosud zmiňovaná imunosupresiva působí nespecificky prostřednictvím celkové inhibice zánětu a netlumí pouze patogenní lymfocyty namířené proti autoantigenu či dárcovským antigenům (v případě transplantací). Díky tomu je jejich použití spojené s celou řadou nežádoucích účinků. Antigen specifická imunosuprese by z tohoto pohledu byla velmi lákavým způsobem léčby, protože nenavozuje snížení obranyschopnosti, ale pouze navozuje toleranci. Původně nadějné výsledky na zvířecích modelech se ovšem zatím příliš nedaří převést do klinické praxe [25]. Jediným registrovaným léčivem, které funguje na tomto principu, je glatiramer acetát, určený k léčbě roztroušené sklerózy. Jedná se o polymer složený ze 4 aminokyselin, který je analogem bazického myelinového proteinu. Přesný mechanizmus jeho účinku není zcela objasněn, ale předpokládá se odklon od Th1 a Th17 odpovědi směrem k Th2 a indukce antigen specifických supresorových buněk [26].
Závěr
Imunosupresiva představují skupinu látek, které slouží k potlačení funkce imunitního systému. Jejich první použití spadá do období krátce po II. světové válce, kdy byly u pacientky s revmatoidní artritidou poprvé úspěšně použity kortikosteroidy. Později přišla další imunosupresiva a jejich zavedení do praxe bylo přínosem nejen pro léčbu autoimunitních onemocnění, ale umožnilo také rozvoj transplantologie. V současné době se již jedná o velkou skupinu léčiv s různou chemickou strukturou a širokým spektrem mechanizmů účinku, která se stále rozrůstá. Nově vyvíjená léčiva mají oproti starším látkám zpravidla cílenější způsob působení a výhodnější farmakokinetické vlastnosti. V současnosti velký úspěch i rozvoj zaznamenává především použití monoklonálních protilátek a dalších biologických léčiv, která cíleně ovlivňují konkrétní molekuly zapojené do mechanizmů zánětu. Zatím však stále nemáme v klinické praxi žádný lék, který by bez jakýchkoliv nežádoucích účinků vyléčil autoimunitní chorobu nebo navodil doživotní toleranci příjemců vůči dárcovským antigenům. Řešením by mohla být antigen specifická imunosupresivní léčba využívající různé mechanizmy navození tolerance. Bohužel, zatím se jedná o metodu čistě experimentální a na její širší zavedení do praxe si pravděpodobně budeme muset ještě nějakou dobu počkat.
MUDr. Marta Sobotková
Ústav imunologie 2. LF UK a FN Motol, Praha
Doručeno do redakce 26. 6. 2018
Přijato po recenzi 26. 11. 2018
Zdroje
-
Hynie S. Speciální farmakologie. Díl VII/A. Protinádorová chemoterapeutika a imunomodulační látky. 2 vyd. Karolinum: Praha 2003 : 104–130. ISBN 80–246–0656–9.
-
Bartůňková J, Šedivá A, Janda A. Imunodeficience. 2. vyd. Grada: Praha 2007 : 192–197.ISBN 978–80–247–1980–1.
-
Pavelka K, Arenberger P, Lukáš M et al. Biologická léčba zánětlivých autoimunitních onemocnění v revmatologii, gastroenterologii a dermatologii. Grada: Praha 2014 : 3–7. ISBN 978–80–247–5048–4.
-
Databáze léků. Státní ústav pro kontrolu léčiv. Dostupné z WWW: <www.sukl.cz>
-
Lloyd M. Philip Showalter Hench, 1896–1965. Rheumatology (Oxford) 2002; 41(5): 582–584.
-
Pavelka K, Rovenský J. Klinická revmatologie. Galén: Praha 2003 : 773–828. ISBN 80–7262–174–2.
-
Pavelka K. Nová doporučení pro léčbu revmatoidní artritidy. Postgraduální medicína 2017; 19(1): 6–12.
-
Murray JE. Nobel Prize Lecture: The first succesful transplant in man. Dostupné z WWW: <https://web.stanford.edu/dept/HPS/transplant/html/murray.html>. [cit. 14. 6. 2018]
-
Pellegrino B. Immunosuppression. Dostupné z WWW: <https://emedicine.medscape.com/article/432316-overviewServer>.
-
Matl I. Léčba lupusové nefritidy. Interní Med Praxi 2012; 14(5): 206–208.
-
Thon V. Teriflunomid v léčbě relabující-remitující formy roztroušené sklerózy – imunomodulační mechanismy. Neurol praxi 2016; 17(1): 52–54.
-
Thiyagarajan UM, Ponnuswamy A, Bagul A. Thymoglobulin and its use in renal transplantation: a review. Am J Nephrol 2013; 37(6): 586–601. Dostupné z DOI: <http://dx.doi.org/10.1159/000351643>.
-
Sobotková M, Bartůňková J. Antibiotická imunosupresiva. Remedia 2008; 18(3): 233–241.
-
Perenyei M, Jayne DR, Floßmann O. Gusperimus: immunological mechanism and clinical applications. Rheumatology (Oxford) 2014; 53(10): 1732–1741. Dostupné z DOI: <http://dx.doi.org/10.1093/rheumatology/ket451>.
-
Imbach P. Treatment of immune thrombocytopenia with intravenous immunoglobulin and insights for other diseases. A historical review. Swiss Med Wkly 2012; 142:w13593. Dostupné z DOI: <http://dx.doi.org/10.4414/smw.2012.13593>.
-
Sobotková M, Bartůňková J. Monoklonální protilátky a další biologická léčiva užívaná v imunosupresivní léčbě. Remedia 2008; 18(5): 356–364.
-
Smith SL. Ten years of Orthoclone OKT3 (muromonab-CD3): a review. J Transpl Coord 1996; 6(3): 109–119.
-
Czajkowsky DM, Hu J, Shao Z et al. Fc-fusion proteins: new developments and future perspectives. EMBO Mol Med 2012; 4(10): 1015–1028. Dostupné z DOI: <http://dx.doi.org/10.1002/emmm.201201379>.
-
Havrdová E. Fingolimod. Remedia 2011; 21(4): 297–303.
-
Vašáková M. Pirfenidon v léčbě idiopatické plicní fibrózy. Remedia 2015; 25(1): 61–66.
-
Šterclová M, Vašáková M. Nintedanib. Remedia 2016; 26(1): 39–42.
-
Hardinger KL, Brennan DC. Novel immunosuppressive agents in kidney transplantation. World J Transplant 2013; 3(4): 68–77. Dostupné z DOI: <http://dx.doi.org/10.5500/wjt.v3.i4.68>.
-
White JR, Phillips F, Monaghan T et al. Review article: novel oral-targeted therapies in inflammatory bowel disease. Aliment Pharmacol Ther 2018; 47(12): 1610–1622. Dostupné z DOI: <http://dx.doi.org/10.1111/apt.14669>.
-
Faissner S, Gold R. Efficacy and Safety of the Newer Multiple Sclerosis Drugs Approved Since 2010. CNS Drugs 2018; 32(3): 269–287. Dostupné z DOI: <http://dx.doi.org/10.1007/s40263–018–0488–6>.
-
Paul F, Murphy O, Pardo S et al. Investigational drugs in development to prevent neuromyelitis optica relapses. Expert Opin Investig Drugs 2018; 27(3): 265–271. Dostupné z DOI: <http://dx.doi.org/10.1080/13543784.2018.1443077>.
-
Miller SD, Turley DM, Podojil JR. Antigen-specific tolerance strategies for the prevention and treatment of autoimmune disease. Nat Rev Immunol 2007; 7(9): 665–677. Dostupné z DOI: <http://dx.doi.org/10.1038/nri2153>.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2019 Číslo 2- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- S prof. Vladimírem Paličkou o racionální suplementaci kalcia a vitaminu D v každodenní praxi
-
Všechny články tohoto čísla
- Primární imunodeficience u dospělých
- Sekundární imunodeficience jako následek chronických onemocnění
- Léčba humorálních imunodeficiencí
- Nežádoucí účinky imunoglobulinové léčby
- Současné trendy v imunosupresivní léčbě
- Co dnes znamená alergologie pro internu a naopak
- Anafylaktické příznaky a anafylaktický šok
- Helen Chapel et al. Základy klinické imunologie
- Imunitní systém ve fyziologickém řádu organizmu
- Zánět obranný a poškozující: základní charakteristiky
- Cytokiny rodiny IL1 u chronických zánětlivých procesů
- Heterogenita lymfocytov ako ústredných operačných jednotiek imunitného systému
- Mikrobiota, imunita a imunologicky mediované choroby
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Anafylaktické příznaky a anafylaktický šok
- Nežádoucí účinky imunoglobulinové léčby
- Současné trendy v imunosupresivní léčbě
- Primární imunodeficience u dospělých
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



