-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Kardiovaskulární riziko u pacientů s revmatickými chorobami a jeho management
Cardiovascular risk in patients with rheumatic disease and its management
Cardiovascular disease (CVD) risk in patients with rheumatic diseases is increased by 50 % compared to the general population. This is a result of the increased inflammatory activity as well as modification of traditional CVD risk factors by the primary disease. So called lipid paradox, paradoxical decrease of concentrations of atherogenic plasma lipids due to increased inflammatory activity and their rise with successful anti-inflammatory treatment, is of particular importance. CVD risk in rheumatic diseases is further modified by drugs used for their treatment: while some treatment modalities increase the risk (e.g. glucocorticoids), others may act in an opposite direction (methotrexate, biological therapies). CVD risk stratification in patients with rheumatic diseases is uneasy; so far none of the specific scoring systems has been shown superior to traditional ones designed for the general population. Principles of cardiovascular risk intervention remain the same as for the general population: the management starts with lifestyle measures (healthy diet, increase in physical activity and smoking cessation) complemented with pharmacotherapy when indicated. Blood pressure as well as lipid lowering therapies should be led according to the same principles as in the general population and, also, to the same treatment goals. To improve CVD prevention outcomes in patients with rheumatic diseases it seems feasible to work in interdisciplinary teams led by a rheumatologist cooperating with a specialist in CVD prevention strategies (general practitioner, cardiologist, internist, diabetes specialist). A nutritional therapist and a physiotherapist are important members of the team, too. Interdisciplinary and complex CVD prevention in patients with rheumatic diseases decreases CVD morbidity.
Key words:
cardiovascular risk – intervention – lipid paradox – rheumatic diseases – risk factors – risk stratification
Autoři: Jiří Laštůvka 1; Sabína Oreská 2; Michal Tomčík 2; Michal Vrablík 3
Působiště autorů: Interní oddělení Masarykovy nemocnice v Ústí nad Labem, o. z., Krajská zdravotní a. s. 1; Revmatologický ústav a Revmatologická klinika 1. LF UK a VFN v Praze 2; III. interní klinika – klinika endokrinologie a metabolizmu 1. LF UK a VFN v Praze 3
Vyšlo v časopise: Vnitř Lék 2018; 64(1): 51-59
Kategorie: Přehledné referáty
Souhrn
Ve srovnání s běžnou populací je kardiovaskulární (KV) riziko nemocných s revmatickými onemocněními zvýšeno asi o 50 %. Příčinou je sama zvýšená zánětlivá aktivita i modifikace tradičních rizikových faktorů základním onemocněním. V tomto kontextu je zvláště zajímavý tzv. lipidový paradox, tzn. snížení koncentrací aterogenních sérových lipidů přímo úměrné aktivitě zánětlivého procesu a jejich vzestup při léčbou navozeném poklesu aktivity zánětu. KV riziko v kontextu revmatických onemocnění modifikují i léčiva užívaná k jejich terapii: některá cévní riziko ovlivňují negativně (glukokortikoidy), jiná neutrálně nebo mírně pozitivně (metotrexát, biologická terapie). Stratifikace KV rizika u populace revmatiků není snadná, specifické skórovací systémy zatím nezlepšily odhad rizika ve srovnání se systémy používanými pro běžnou populaci. Intervence kardiovaskulárního rizika zachovává principy pro běžnou populaci: základní úroveň představují režimová opatření (dieta, zvýšení pohybové aktivity, zanechání kouření) doplněná vhodnou farmakoterapií. Antihypertenzní i hypolipidemická farmakoterapie má být vedena podle stejných pravidel a k cílům shodným s doporučeními pro běžnou populaci. Ke zlepšení výsledků prevence KV příhod u pacientů s revmatickými chorobami je vhodné budovat interdisciplinární týmy, v nichž se na péči bude podílet kromě revmatologa lékař zaměřený na KV prevenci (praktický lékař, internista, kardiolog, diabetolog) s dalšími členy týmu (nutriční a rehabilitační specialisté, fyzioterapeuti). Interdisciplinární péče snižuje kardiovaskulární morbiditu pacientů s revmatickým onemocněním.
Klíčová slova:
intervence – kardiovaskulární riziko – lipidový paradox – revmatická onemocnění – rizikové faktory – stratifikace rizikaÚvod
Díky léčebným možnostem ovlivňujícím zánětlivé a autoimunitní procesy a novým strategiím léčby se v posledních desetiletích podařilo zmírnit průběh revmatických onemocnění. Tím vystupuje do popředí význam komorbidit a současně vliv antirevmatické léčby na ně. Pacienti s revmatickými onemocněními mají zvýšené riziko předčasného úmrtí [1]. Většina studií uvádí, že doba dožití je oproti běžné populaci zkrácena asi o 10 let, dle kanadské studie [2] dokonce o 17 let. Přibližně 50 % předčasných úmrtí je způsobeno kardiovaskulárními (KV) chorobami [3]. Klinický obraz ischemické srdeční choroby (ICHS) bývá u revmatických pacientů mnohdy odlišný, častěji se jedná o němou ICHS s náhlou smrtí [4]. Zvýšení kardiovaskulárního rizika u revmatoidní artritidy (RA) oproti běžné populaci bývá srovnáváno s rizikem u diabetes mellitus (DM) 2. typu [5,6]. Přibývá důkazů, že totéž platí i u dalších zánětlivých kloubních onemocnění, jako je ankylozující spondylitida (AS) [7] a psoriatická artritida (PsA). To před lékaře pečující o revmatické pacienty staví nové otázky a výzvy – výběr vhodné léčby s ohledem na KV riziko, identifikace pacientů se zvýšeným KV rizikem a zvážení možné intervence k jeho snížení.
Tyto poznatky odráží doporučení Evropské ligy proti revmatizmu (European League Against Rheumatism – EULAR), která byla recentně aktualizována [8], i další doporučení odborných společností: 2016 ESC/EAS Guidelines for the Management od Dyslipidemias, 2016 ESC Guidelines on cardiovascular disase prevention in clinical practice. Současné doporučené postupy EULAR zahrnují 3 ústřední principy a 10 doporučení (tab. 1).
Tab. 1. Doporučené postupy EULAR z roku 2015/2016 pro management kardiovaskulárního rizika při zánětlivých kloubních onemocněních 
AS – ankylozující spondylitida EULAR – Evropská liga proti revmatizmu HDL – high-density lipoprotein KV – kardiovaskulární NSA – nesteroidní antirevmatika PsA – psoriatická artritida RA – revmatoidní artritida Ústřední principy:
- lékaři by si měli být vědomi, že KV riziko pacientů s RA a pravděpodobně též s AS a PsA je oproti běžné populaci zvýšené
- za management KV rizika revmatických pacientů je zodpovědný revmatolog
- užívání nesteroidních antirevmatik (NSA) a glukokortikoidů by mělo být v souladu s doporučenými postupy EULAR a ASAS (Assessments in Ankylosing Spondylitis International Society)
Intenzita zkoumání této problematiky se v posledním období zvyšuje, nicméně pohled na tabulku a sílu důkazů dokumentuje míru nejistoty, nedostatečného prozkoumání a nedostatku evidence v oblasti KV rizika u revmatických pacientů. Srovnání s kardiovaskulárními doporučeními pro běžnou populaci citovanými výše ukazuje přinejmenším o stupeň nižší třídu i sílu doporučení.
Kardiovaskulární riziko revmatických pacientů a příčiny jeho zvýšení
Příčiny zvýšení KV rizika a KV morbidity u revmatických pacientů jsou komplexní. Revmatické choroby mohou přímo postihovat kardiovaskulární aparát – ovšem nakolik se tyto specifické kardiovaskulární projevy revmatických chorob podílejí na celkové KV morbiditě a mortalitě, není přesněji prokázáno. Oproti běžné populaci, u níž hrají hlavní úlohu v aterogenezi tzv. tradiční rizikové faktory, dochází u pacientů s revmatickými chorobami k akceleraci aterosklerotického procesu v důsledku přítomnosti i dalších, netradičních rizikových faktorů, které jsou pro tyto choroby specifické a souvisí také s charakterem revmatického onemocnění. Průběh aterosklerózy a jednotlivé KV rizikové faktory může ovlivňovat různými způsoby také protizánětlivá či imunosupresivní terapie.
Rizikové faktory akcelerace aterosklerózy u revmatických pacientů
Tradiční rizikové faktory
Dle studie INTERHEART [9] jsou nejvýznamnějšími a zároveň ovlivnitelnými rizikovými faktory KV onemocnění a progrese aterosklerózy: kouření, arteriální hypertenze, dyslipidemie, diabetes mellitus, abdominální obezita, životní styl a psychosociální faktory. U pacientů s RA může být výskyt těchto faktorů oproti běžné populaci odlišný, jakkoli se data z různých prací liší.
Procento kuřáků je dle některých údajů mezi revmatickými pacienty vyšší než v běžné populaci [10]. Kouření je spojeno s pozitivitou sérologických markerů revmatických onemocnění (revmatoidní faktor, RF, protilátky proti cyklickému citrulinovému proteinu, anti-CCP), rozvojem revmatického onemocnění, závažnějšími klinickými projevy a horší odpovědí na imunosupresivní terapii [11].
Je možné, že i další tradiční rizikové faktory (arteriální hypertenze, dyslipidemie) se u RA pacientů vyskytují častěji než v běžné populaci, ale jasné důkazy chybějí [8]. Dle údajů z Norska má hypertenze u RA pacientů minimálně stejně vysokou prevalenci jako v běžné populaci a je špatně kontrolovaná – poddiagnostikovaná a nedostatečně léčená, což potvrzuje většina studií. Na druhou stranu metaanalýza z roku 2011 vyšší výskyt hypertenze u revmatických pacientů neprokázala [12]. TK mohou zvyšovat i některé protizánětlivé léky – glukokortikoidy, NSA, cyklosporin, leflunomid [13].
Dyslipidemie u revmatických pacientů jsou komplexní a specifický problém, budou pojednány v samostatném odstavci.
Vztah revmatických onemocnění a diabetes mellitus je pravděpodobně obousměrný. Je popisován záchyt nediagnostikovaného diabetu u pacientů s RA přibližně 1,5krát vyšší než v běžné populaci. Vyšší výskyt DM je přičítán vyššímu výskytu obezity a nevhodnému životnímu stylu u pacientů s RA zejména kvůli zhoršené mobilitě či kortikoterapii [14,15]. Další studie naopak upozorňují na možný vyšší výskyt RA u pacientů s DM [16].
Charakter obezity u pacientů s RA je odlišný od běžné populace. Běžná definice obezity podle BMI nemusí odrážet tyto specifické změny. U pacientů s RA se jedná o tzv. sarkopenickou obezitu, při níž dochází ke snížení svalové hmoty a relativnímu zvýšení podílu tělesného tuku oproti zdravým jedincům stejného věku, avšak bez výrazného dopadu na hodnotu BMI [17]. Tyto změny tělesného složení jsou příčinou paradoxu, při kterém i nízké BMI je u RA pacientů spojeno s vyšším KV rizikem.
Fyzická aktivita je u pacientů s RA nižší než u zdravých kontrol zejména pro omezenou mobilitu při postižení pohybového aparátu. Důsledkem je snížená svalová síla, úbytek svalové hmoty a zvýšení KV rizika. Z obou výše diskutovaných důvodů vyplývá nutnost a přínos pravidelného cvičení u pacientů s RA nejen z hlediska zlepšení/udržení pohyblivosti, ale i z hlediska snížení rizika KV komplikací [18].
Jako významný rizikový faktor bývá zmiňován i stres a deprese, jejichž míra je u pacientů s RA zvýšená. Stres ovlivňuje imunitní systém a může spouštět autoimunitní zánětlivé procesy. Solomon et al popsali u pacientů s RA asociaci mezi stresem a výskytem karotických plátů [19]. Vztah mezi stresem, depresí a systémovým onemocněním se také jeví jako obousměrný. Dle studie INTERHEART patří psychosociální stres mezi nejvýznamnější faktory ovlivňující kardiovaskulární riziko [9].
Poruchy metabolizmu lipoproteinů u revmatických pacientů
Dyslipidemie u pacientů s RA ilustruje komplexnost vztahů mezi rizikovými faktory a KV onemocněními. U revmatických onemocnění je popisován tzv. lipidový paradox, tedy opačný vztah mezi hladinou lipidů a KV rizikem, než bývá v běžné populaci. Zvýšená zánětlivá aktivita vede u revmatických chorob stejně jako u jiných zánětlivých stavů (sepse, pooperační stav, akutní infarkt myokardu, nádorové onemocnění a jeho dlouhodobá terapie) ke snížení hladin lipidů. Aktivitu RA provází nižší hladina celkového cholesterolu a LDL-cholesterolu (low density lipoprotein) oproti běžné populaci, ačkoli je KV riziko zvýšené. Potlačení aktivity zánětu u RA je spojené se vzestupem hladin lipidů a zároveň se snížením incidence kardiovaskulárních příhod. Zánětlivá aktivita je spojena kromě kvantitativních i s kvalitativními změnami lipoproteinů. Částice HDL (high density lipoproteins) mají za normálního stavu protizánětlivé a ateroprotektivní vlastnosti. Inhibují oxidaci LDL částic, podporují reverzní transport cholesterolu, snižují endoteliální aktivaci a mají antitrombotické vlastnosti. Kardioprotektivní efekt HDL-cholesterolu je přisuzován zejména reverznímu transportu cholesterolu. Protizánětlivé účinky HDL-cholesterolu bývají přičítány inhibici exprese adhezivních molekul na endotelu, které jinak umožňují vazbu mononukleárů na cévní stěnu. HDL partikule mají navíc antioxidativní účinky a stimulují produkci oxidu dusnatého [20]. Systémový zánět vede ke změnám složení i funkce HDL částic. Mění se zastoupení apoproteinů i množství jednotlivých lipidových složek a zvyšuje se podíl prozánětlivých proteinů. V důsledku těchto změn se HDL stávají dysfunkčními, ztrácejí své pozitivní vlastnosti, mají vlastnosti prozánětlivé (tab. 2).
Tab. 2. Změny složení HDL-cholesterolu při vystupňované zánětlivé odpovědi 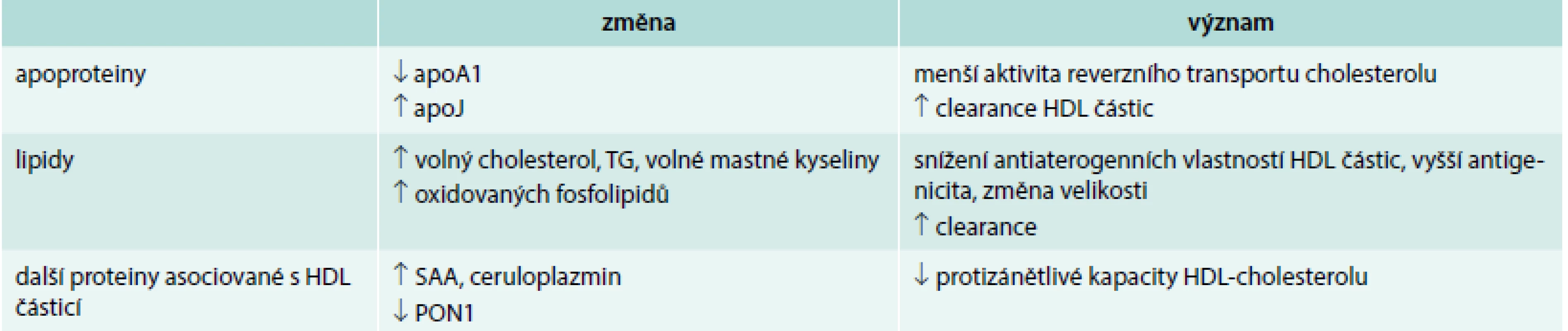
apo – apolipoprotein PON1 – paraoxonáza SAA – sérový amyloid A Změněné prozánětlivé HDL byly popsány i u dalších chronických chorob, jako je diabetes mellitus 2. typu [21]. Takové HDL částice neplní své antiaterogenní funkce.
Celkově můžeme shrnout, že běžná interpretace lipidového profilu při stanovení KV rizika u pacientů s RA může být tedy nesprávná a vést k podcenění rizika.
KV rizikové faktory specifické pro zánětlivá onemocnění (tzv. netradiční rizikové faktory)
Zvýšení KV rizika u pacientů s RA je způsobeno hlavně zánětlivou aktivitou, jejím přímým vlivem na rozvoj a progresi aterosklerózy a na další rizikové faktory, jako jsou změny lipidového spektra, inzulinová rezistence a oxidační stres [22].
Zvýšená zánětlivá aktivita je nezávislým rizikovým faktorem KV onemocnění i v běžné populaci. Ateroskleróza i RA sdílejí podobné zánětlivé mechanizmy. U obou procesů najdeme vysoké hladiny zánětlivých mediátorů, jako jsou faktor nádorové nekrózy (TNF), interleukiny 1 a 6 (IL1, IL6), C-reaktivní protein (CRP). Tyto (i další) zánětlivé biomarkery jsou nezávislými prediktory vaskulárního rizika [23]. Zánětlivé mechanizmy vedou k endoteliální dysfunkci a hrají významnou roli ve všech stadiích aterogeneze a následné trombózy. Možnost ovlivnění rozvoje aterosklerózy a kardiovaskulárních příhod snížením zánětlivé aktivity zkoumala a potvrdila studie CANTOS s kanakinumabem, inhibitorem IL1β, který selektivně redukuje aktivitu subklinického zánětu bez vlivu na další rizikové faktory aterosklerózy. Studie skončila jednoznačně pozitivním výsledkem zejména u podskupiny pacientů s vystupňovanou zánětlivou reakcí a dobrou odpovědí na podání aktivní léčby a představuje tak první důkaz o vlivu „čistě“ protizánětlivé léčby na riziko aterotrombotických cévních příhod [24]. U pacientů s RA závisí zvýšení cévního rizika na více faktorech, jakými jsou aktivita choroby, počet exacerbací a délka jejich trvání a na řadě dalších. Samotná délka trvání onemocnění neměla v některých pracích jednoznačnou korelaci s rizikem KV komplikací, existují důkazy o vyšším KV riziku i u pacientů v časných stadiích onemocnění s nedávno diagnostikovanou RA [25]. V nové verzi doporučených postupů EULAR se proto doporučuje screening KV rizika u všech pacientů bez ohledu na délku trvání klinicky manifestní RA [8].
Vliv farmakoterapie revmatických onemocnění na KV riziko
KV morbiditu a jednotlivé rizikové faktory ovlivňují i léky užívané v léčbě zánětlivých revmatických onemocnění. Tento vliv může být pozitivní i negativní. Možný negativní vliv na KV morbiditu v běžné populaci byl prokázán u některých COX2 inhibitorů a následně studován i u neselektivních nesteroidních protizánětlivých léčiv (NSA), jak shrnuje recentní přehled amerických autorů [26]. Glukokortikoidy mají negativní vliv na řadu tradičních kardiovaskulárních rizikových faktorů a mohou být spojeny se zvýšeným rizikem infarktu myokardu a dalších aterotrombotických cévních příhod [27]. Naproti tomu chorobu modifikující léčiva (disease-modifying antirheumatic drugs – DMARDs), zejména metotrexát, KV riziko spíše snižují. Mechanizmus tohoto účinku není zcela zřejmý, ale pravděpodobně je zprostředkován především snížením zánětlivé aktivity [28]. Vliv biologické léčby na kardiovaskulární riziko je intenzivně studován. Jednotlivé preparáty mohou mít negativní vliv na některé tradiční kardiovaskulární rizikové faktory, uvádí se i přímé nežádoucí kardiovaskulární účinky. Literární údaje nejsou jednotné, celkově však převažuje názor, že biologická léčba ovlivňuje kardiovaskulární morbiditu a mortalitu pozitivně. Nejvíce údajů v tomto směru mají anti-TNF preparáty, vzhledem k jejich relativně nejširšímu použití [29]. Dle aktuálních doporučených postupů EULAR je důležitější dosáhnout snížení zánětlivé aktivity než způsob či typ medikace, kterým tohoto cíle dosáhneme.
Vliv farmakoterapie revmatických onemocnění na kardiovaskulární riziko
Přehled vlivu jednotlivých léčebných možností na KV riziko uvádí tab. 3. Recentně byla na toto téma publikována stěžejní metaanalýza dostupných studií hodnotících vliv vybrané farmakoterapie užívané v revmatologii na výskyt velkých cévních příhod [30].
Tab. 3. Vliv vybraných protizánětlivých a imunosupresivních preparátů na parametry KV rizika 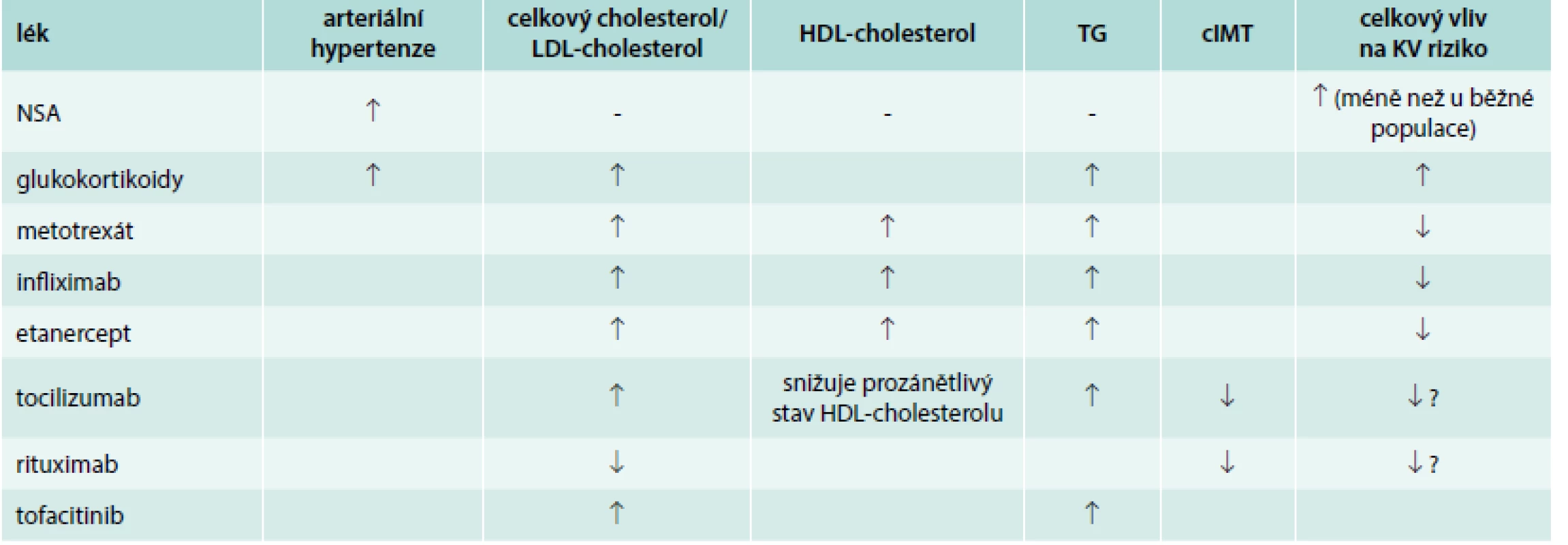
TG– triglyceridy cIMT – tloušťka intimy-medie karotických arterií KV – kardiovaskulární NSA – nesteroidní antirevmatika Nesteroidní antirevmatika (NSA)
Užívání NSA v běžné populaci provází vyšší výskyt arteriální hypertenze, srdečního selhání a celkově vyšší KV riziko. Jejich vliv na KV riziko u pacientů s RA je do jisté míry předmětem kontroverze. Některé studie vztah mezi užíváním NSA a zvýšením KV rizika u pacientů se zánětlivým kloubním onemocněním neprokázaly [31]. Podle dánské studie se KV riziko u pacientů s RA léčených NSA zvyšuje jen mírně a významně méně než v případě užívání těchto léčiv u osob bez chronického zánětlivého onemocnění (tzn. u běžné populace) [32]. Rozsáhlá metaanalýza studií hodnotících otázku KV bezpečnosti nesteroidních antirevmatik uzavřela, že s vyšší dávkou většiny NSA narůstá výskyt závažných kardiovaskulárních příhod. Výjimku představuje naproxen zřejmě díky výraznějším antiagregačním účinkům [33]. Na druhou stranou protizánětlivý efekt NSA u RA a umožnění větší fyzické aktivity mohou částečně negativní KV působení těchto léčiv u pacientů s RA vyvažovat. Zvýšení KV rizika při užívání NSA u revmatických pacientů tedy celkově může být menší než při pohledu na asociaci léčby NSA a kardiovaskulárních příhod v běžné populaci [8].
Glukokortikoidy
Glukokortikoidy mají negativní vliv na rozvoj a kompenzaci arteriální hypertenze, lipidový a glukózový metabolizmus [34]. Při jejich užívání dochází k rozvoji centrální obezity a inzulinové rezistence. Vedou ke zvýšení hladin celkového cholesterolu, triglyceridů, ke zmenšení velikosti a zvýšení denzity LDL částic. Glukokortikoidy jsou spojeny se zvýšeným rizikem infarktu myokardu [35]. Zvýšení KV rizika je závislé na dávce a délce užívání. Podle některých údajů ovšem protizánětlivý efekt kortikoidů vyvažuje zvýšené kardiovaskulární riziko [36].
Metotrexát
Metotrexát (MTX) zvyšuje koncentrace celkového, LDL-cholesterolu a HDL-cholesterolu i triglyceridů, což může být důsledek snížení zánětlivé aktivity. V jedné studii MTX u pacientů s ICHS zvýšil riziko náhlé smrti a KV morbiditu [37]. Následné studie a většina v současnosti dostupných dat ukazují, že protizánětlivý efekt MTX KV morbiditu i mortalitu spíše snižuje [38,39]. MTX může zvyšovat homocysteinemii (deplecí kyseliny listové). Ovšem význam terapií navozených změn homocysteinemie pro výslednou modulaci KV rizika není jasný, jak dokumentuje např. zkušenost s fibráty (které homocysteinemii zvyšují) nebo neúspěch strategií snižujících homocysteinemii ve snaze o snížení KV rizika [40]. Probíhá studie CIRT (Cardiovascular Inflammation Reduction Trial), která hodnotí vliv nízké dávky MTX na snížení rizika velkých cévních příhod u pacientů po infarktu myokardu s diabetes mellitus 2. typu nebo metabolickým syndromem [41].
Další konvenční syntetické chorobu modifikující léky (csDMARDs)
Soli zlata a antimalarika nemají prokázaný pozitivní vliv na KV riziko, přestože antimalarika snižují krevní tlak, dokumentováno bylo i snížení rizika vzniku diabetu při léčbě hydroxychlorochinem [42]. Leflunomid naopak zvyšuje krevní tlak. Jak antimalarika a leflunomid ovlivňují KV riziko, není prokázáno, údaje jsou nejednotné [43].
Biologická léčba
Anti-TNF preparáty – infliximab, etanercept a pravděpodobně také novější golimumab či certolizumab snižují zánětlivou aktivitu, modifikují lipoproteinové spektrum a snižují KV riziko u pacientů s RA. Dle metaanalýz zvyšují HDL-cholesterol, celkový cholesterol a triglyceridy, mohou zvýšit i LDL-cholesterol [44,45]. Menší studie dokumentují další možné mechanizmy příznivého působení anti-TNF léčiv na cévní funkce: zlepšení endoteliální dysfunkce, antioxidační schopnosti HDL částic či inzulinové senzitivity [46,47].
Tocilizumab (blokátor IL6 receptoru) výrazně snižuje systémovou zánětlivou aktivitu. S léčbou tímto preparátem je však spojen vzestup LDL-cholesterolu. Na druhou stranu změnou složení HDL-cholesterolu snižuje jejich prozánětlivý potenciál. Navíc stoupá množství malých a středních HDL částic, které jsou považovány za antiaterogenní [48]. Hodnocení KV rizika při léčbě tocilizumabem probíhá a zatím se jeho kardiovaskulární bezpečnostní profil jeví příznivě [49].
Rituximab (anti-CD 20) indukuje apoptózu B-lymfocytů. Experimentální práce dokumentují zlepšení inzulinové senzitivity při depleci B-lymfocytů, což provází zlepšení lipoproteinového metabolizmu [50]. Menší studie (55 zařazených žen, 24 týdnů sledování) prokázala kromě příznivého vlivu rituximabu na lipidový metabolizmus i zlepšení intimomediální tloušťky karotických arterií (cIMT) u pacientů [51].
Tofacitinib – inhibitor Janus kináz 1 a 3 – zvyšuje LDL-cholesterol a triglyceridy. Je otázkou, zda vzestup LDL-cholesterolu při léčbě není vlastně posun k „zdravému“ lipidovému metabolizmu při omezení vystupňované zánětlivé aktivity. V každém případě lze negativní vliv tofacitinibu na lipoproteinový metabolizmus významně omezit léčbou statinem [52].
Identifikace revmatických pacientů se zvýšeným KV rizikem
V běžné praxi je identifikace revmatických pacientů se zvýšeným KV rizikem nedostatečná. Screening poruch metabolizmu plazmatických lipidů není prováděn důsledně, použití antihypertenziv a hypolipidemik je suboptimální [53,54]. Terapeutické cíle definované v doporučených postupech dosahuje přibližně 40 % pacientů s RA a hypertenzí, 57 % s elevací LDL-cholesterolu a stejné procento pacientů s DM 2. typu [55]. Je však pravdou, že při srovnání těchto údajů s mírou kontroly rizikových faktorů v běžné populaci situace u pacientů sledovaných revmatology vyznívá spíše lépe.
Pro stanovení KV rizika se používají predikční modely, které stanoví individuální KV riziko a také hranici pro doporučení farmakologické intervence. Predikční modely KV rizika používané pro běžnou populaci však podhodnocují riziko pacientů s revmatickými onemocněními [56,57]. Neberou v úvahu specifické rizikové faktory při zánětlivém onemocnění, kvalitativní i kvantitativní změny lipidového spektra, odlišné tělesné složení (sarkopenie) atd. V současnosti jsou využívány a zkoumány 3 základní směry, jak tyto situace řešit:
- systémy pro obecnou populaci, upravené koeficientem pro RA – m-SCORE
- systémy již zahrnující RA – QRISK2
- systémy specifické pro RA – ERS-RA (Extended Risk Score – Rheumatoid Arthritis)
Jsou diskutovány i další přístupy, nizozemští autoři např. navrhovali zvýšit věk RA pacientů o 15 let a používat skórovací systém pro běžnou populaci [58].
V evropské populaci je nejužívanějším predikčním modelem KV rizika systém SCORE užívaný i v ČR. EULAR doporučuje výsledné riziko násobit koeficientem 1,5 – tzv. m-SCORE. V původních doporučeních se měl používat koeficient 1,5 jen při určitých kritériích (délka choroby, extraartikulární projevy atd). V nových doporučených postupech EULAR je tento koeficient doporučeno použít u všech pacientů s RA.
Britský model QRISK2 RA přímo zahrnuje – riziko se násobí koeficientem 1,4.
Arts porovnával 4 predikční modely – Framinghamské skóre (FHS), Reynoldsovo skóre (RRS), evropské SCORE a QRISK-2 a prokázal, že žádný nedokáže pacienty do rizikových skupin klasifikovat správně. Zatímco QRISK-2 riziko u pacientů s RA nadhodnocuje, ostatní podhodnocují. M-SCORE podhodnocuje riziko u pacientů s nízkým a středním rizikem, nadhodnocuje u vysoce rizikových pacientů [59].
Model specifický pro pacienty s RA je ERS-RA (Extended Risk Score – Rheumatoid Arthritis), založený na údajích z registru CORRONA, který zahrnoval 23 605 pacientů s RA. Zohledňuje 2 skupiny rizikových faktorů – „tradiční“ a faktory specifické pro revmatické onemocnění [60].
ATACC-RA je nově vyvíjený kalkulátor rizika pro pacienty s RA zahrnující věk, pohlaví, kouření, hypertenzi, poměr celkového cholesterolu a HDL-cholesterolu, séropozitivitu (revmatoidní faktor a anticitrulinové protilátky), zhodnocení aktivity onemocnění a další parametry [61]. Přes svou komplexnost (a tedy relativně obtížnou použitelnost v klinické praxi) se ani nová skóre nezdají být vhodnými nástroji k rozpoznání nejrizikovějších pacientů s revmatickými onemocněními. Jak shrnují autoři nedávné rozsáhlé mezinárodní analýzy, ani nejnovější a nejkomplexnější skórovací systémy pro pacienty s RA nepřinášejí zpřesnění rizika ve srovnání s klasifikačními systémy (podstatně jednoduššími) pro běžnou populaci [62].
Možnosti ovlivnění KV rizika u pacientů s revmatickými onemocněními
Možnosti intervence se u revmatických onemocnění neliší od běžné populace. I v tomto případě základní úroveň představují režimová opatření. Fyzická aktivita snižuje zánětlivou aktivitu. V epidemiologických studiích u běžné populace koncentrace CRP klesá při vyšší fyzické aktivitě [63]. Také ve studiích u pacientů s RA cvičení snížilo CRP, vedlo ke zvýšení svalové hmoty, poklesu adipozity a celkovému funkčnímu zlepšení. Fyzické cvičení také nebylo spojeno s žádným nepříznivým vlivem na aktivitu choroby a právem stojí na prvním místě intervence základního onemocnění i zvýšeného KV rizika revmatických pacientů [64].
Dieta a management dalších rizik (arteriální hypertenze) se řídí stejnými principy jako u osob bez RA. Specificky se budeme věnovat problematice hypolipidemické léčby, protože změny lipidového spektra u revmatiků jsou zatíženy lipidovým paradoxem a navíc u pacientů s RA panují stále obavy z možného většího výskytu negativního ovlivnění svalové tkáně ve srovnání s běžnou populací.
Hypolipidemika u revmatických onemocnění
Statiny jsou léky, které prokazatelně pozitivně ovlivňují kardiovaskulární morbiditu a mortalitu v běžné populaci [65]. Dle současné úrovně znalostí a důkazů jde o léky bezpečné, s nízkým výskytem nežádoucích účinků. Nejčastěji se objevují různé formy svalového postižení – od bolesti svalů a únavy až po závažnou, ale raritní rabdomyolýzu [66]. Obava z dalšího zhoršení mobility při postižení svalové tkáně navozené statinem je u pacientů s RA (a jejich ošetřujících lékařů) pochopitelná. Navíc s ohledem na zvýšení KV rizika u revmatických pacientů může být indikace farmakoterapie dyslipidemie posunuta do mladších věkových kategorií, s čímž souvisí opakovaně nastolovaná otázka bezpečnosti dlouhodobé terapie hypolipidemiky.
Jaké máme důkazy o bezpečnosti a účinnosti hypolipidemik u pacientů s RA?
Účinnost a bezpečnost hypolipidemik při zánětlivých onemocněních zkoumala např. studie TRACE RA (Trial of atorvastatin for the primary prevention of cardiovascular events in patients with RA). Studie s 2 986 pacienty s RA prokázala, že atorvastatin v dávce 40 mg denně nejen snižuje významně koncentrace LDL-cholesterolu, ale také o 34 % redukuje riziko velkých kardiovaskulárních příhod (byť tento výsledek nedosáhl statistické významnosti s ohledem na krátkou dobu trvání studie, která byla průměrně 2,5 roku). Velmi důležitý závěr studie byla bezpečnost léčby atorvastatinem srovnatelná s placebem [67].
Studie TARA (Trial of atorvastatin in rheumatoid arthritis) prokázala, že statiny mají mírný ale klinicky zřejmý protizánětlivý efekt a modifikují rizikové faktory u stavů s vysokým stupněm autoimunitního zánětu [68].
Post hoc analýza studií se statiny naznačuje, že relativní redukce výskytu kardiovaskulárních onemocnění u chronických zánětlivých kloubních onemocnění je srovnatelná jako u jiných stavů při srovnatelně dobrém bezpečnostním profilu [69].
Kardiovaskulární prevence – mezioborová spolupráce
V běžné populaci je v našich podmínkách primární KV prevence v rukou praktického lékaře. Za management KV rizika revmatických pacientů je dle doporučených postupů EULAR zodpovědný revmatolog [8]. S ohledem na komplexnost revmatologické problematiky i specifika kardiovaskulárního rizika u pacientů s chronickými zánětlivými onemocněními pojiva se tento požadavek jeví jako racionální. Na druhé straně časová náročnost intervence kardiovaskulárního rizika včetně nutnosti (opakované) edukace o režimových opatřeních může být bariérou správně prováděné intervence KV rizika v rutinní klinické praxi revmatologa. I proto poslední verze doporučení EULAR shrnující principy kardiovaskulární prevence u nemocných se zánětlivými kloubními onemocněními podtrhuje význam mezioborové spolupráce [8]. Centrální úlohu nadále hraje revmatolog, který spolupracuje s dalšími odborníky – internistou zaměřeným na KV prevenci, kardiologem, diabetologem. Nezbytnou součást týmu tvoří edukátoři z řad nutričních terapeutů, fyzioterapeutů a rehabilitačních specialistů. Správně vedená preventivní péče může snížit KV riziko pacientů s revmatickými onemocněními na úroveň běžné populace [70].
Závěry pro praxi
- riziko kardiovaskulárních chorob u revmatických pacientů je zvýšené a vede ke zkrácení doby jejich dožití oproti běžné populaci
- adekvátní léčba revmatických onemocnění a snížení zánětlivé aktivity vede ke snížení KV rizika
- i u revmatických pacientů je třeba věnovat pozornost tradičním rizikovým faktorům a jejich kontrole, identifikace rizikových pacientů je v praxi nedostatečná
- zánětlivá aktivita u revmatických pacientů je spojena s paradoxní inverzí vztahu hladiny lipidů a kardiovaskulárního rizika, snížení zánětlivé aktivity vede k zvýšení hladiny aterogenních sérových lipoproteinů
- procento revmatických pacientů užívajících adekvátní antihypertenzní a hypolipidemickou medikaci je nedostatečné
- statiny jsou u revmatických pacientů bezpečné, navíc mohou mít přínos pro snížení zánětlivé aktivity
- dle doporučení EULAR má být kardiovaskulární riziko zhodnoceno každých 5 let nebo při významné změně aktivity nemoci či terapie
- intervence ke snížení KV rizika u pacientů s revmatickými onemocněními musí být komplexní, založená na režimových opatřeních doplněných adekvátní farmakoterapií
- mezioborová spolupráce (revmatolog, internista se zaměřením na KV prevenci, kardiolog, diabetolog, nutriční terapeut a fyzioterapeut) se jeví jako prostředek ke zlepšení výsledků preventivních strategií v této oblasti
Autorský kolektiv je podpořen následujícími granty: AZV ČR: 15–28277A, AZV 16–33574A, AZV 16–33542A, SVV 260373, UNCE 204022 a za podpory MZ ČR – Institucionální podpora, Koncepční rozvoj výzkumné organizace č. MZO 023728.
prim. MUDr. Jiří Laštůvka
Interní oddělení Masarykovy nemocnice v Ústí nad Labem, o. z., Krajská zdravotní a.s.
Doručeno do redakce 30. 12. 2017
Přijato po recenzi 5. 1. 2018
Zdroje
1. Dadoun S, Zeboulon-Ktorza N, Combescure C et al. Mortality in rheumatoid arthritis over the last fifty years: systematic review and meta-analysis. Joint Bone Spine 2013; 80(1): 29–33. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jbspin.2012.02.005>.
2. Wolfe F, Mitchell DM, Sibley JT et al. The mortality of rheumatoid arthritis. Arthritis Rheum 1994; 37(4): 481–494.
3. Aviña-Zubieta J, Choi H, Sadatsafavi M et al. Risk of cardiovascular mortality in patients with rheumatoid arthritis: a meta-analysis of observational studies. Arthritis Rheum 2008; 59(12): 1690–1697. Dostupné z DOI: <http://dx.doi.org/10.1002/art.24092>.
4. Gabriel SE. Cardiovascular morbidity and mortality in rheumatoid arthritis. Am J Med 2008; 121(10 Suppl 1): S9-S14. Dostupné z DOI: <http://dx.doi.org/10.1016/j.amjmed.2008.06.011>.
5. van Halm VP, Peters MJL, Voskuyl AE et al. Rheumatoid arthritis versus diabetes as a risk factor for cardiovascular disease: a cross-sectional study, the CARRE Investigation. Ann Rheum Dis 2009; 68(9): 1395–1400. Dostupné z DOI: <http://dx.doi.org/10.1136/ard.2008.094151>.
6. Lindhardsen J, Ahlerhof O, GislasonGH et al. The risk of myocardial infarction in rheumatoid arthritis and diabetes mellitus: a Danish nationwide cohort study. Ann Rheum Dis 2011; 70(6): 929–934. Dostupné z DOI: <http://dx.doi.org/10.1136/ard.2010.143396>.
7. Bakland G, Gran JT, Nossent JC. Increased mortality in ankylosing spondylitis is related to disease activity. Ann Rheum Dis 2011; 70(11): 1921–1925. Dostupné z DOI: <http://dx.doi.org/10.1136/ard.2011.151191>.
8. Agca R, Heslinga SC, Rollefstad S et al. EULAR recommendations for cardiovascular disease risk management in patients with rheumatoid arthritis and other forms of inflammatory joint disorders: 2015/2016 update. Ann Rheum Dis 2017; 76(1): 17–28. Dostupné z DOI: <http://dx.doi.org/10.1136/annrheumdis-2016–209775>.
9. Yusuf S, Hawken S, Ôunpuu S et al. Effect of potentially modifiable risk factors associated with myocardial infarction in 52 countries (the INTERHEART study): case-control study. Lancet 2004; 364(9438): 937–952. Dostupné z DOI: <http://dx.doi.org/10.1016/S0140–6736(04)17018–9>.
10. Gonzalez A, Maradit Kremers H, Crowson CS et al. Do cardiovascular risk factors confer the same risk for cardiovascular outcomes in rheumatoid arthritis patients as in non-rheumatoid arthritis patients? Ann Rheum Dis 2008; 67(1): 64–69. Dostupné z DOI: <http://dx.doi.org/10.1136/ard.2006.059980>.
11. Rojas-Serrano J, Perez L, Garcia C et al. Current smoking status is associated to a non-ACR 50 response in early rheumatoid arthritis. A cohort study. Clin Rheumatol 2011; 30(12): 1589–1593. Dostupné z DOI: <http://dx.doi.org/10.1007/s10067–011–1775–5>.
12. Boyer JF, Gourraud PA, Cantagrel A et al. Traditional cardiovascular risk factors in rheumatoid arthritis: a meta-analysis. Joint Bone Spine 2011; 78(2): 179–183. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jbspin.2010.07.016>.
13. Rho YH, Oeser A, Chung CP et al. Drugs Used in the Treatment of Rheumatoid Arthritis: Relationship between Current Use and Cardiovascular Risk Factors. Arch Drug Inf 2009; 2(2): 34–40. Dostupné z DOI: <http://dx.doi.org/10.1111/j.1753–5174.2009.00019.x>.
14. Abou Assi H, Connelly MA, Bateman LA et al. Does a lack of physical activity explain the rheumatoid arthritis lipid profile? Lipids Health Dis 2017; 16(1): 39. Dostupné z DOI: <http://dx.doi.org/10.1186/s12944–017–0427–4>.
15. Ursini F, Russo E, D’Angelo S et al. Prevalence of Undiagnosed Diabetes in Rheumatoid Arthritis: an OGTT Study. Medicine (Baltimore) 2016; 95(7): e2552. Dostupné z DOI: <http://dx.doi.org/10.1097/MD.0000000000002552>.
16. Lu MC, Yan ST, Yin WY et al. Risk of Rheumatoid Arthritis in Patients with Type 2 Diabetes: A Nationwide Population-Based Case-Control Study. PLOS ONE 2014; 9(7): e101528. Dostupné z DOI: <http://dx.doi.org/10.1371/journal.pone.0101528>.
17. Stavropoulos-Kalinoglou A, Metsios G, Koutedakis Y et al. Obesity in rheumatoid arthritis. Rheumatology (Oxford) 2011; 50(3): 450–462. Dostupné z DOI: <http://dx.doi.org/10.1093/rheumatology/keq266>.
18. Cooney, JK Law RJ, Matshke V et al. Benefits of Exercise in Rheumatoid Arthritis. J Aging Res 2011; 2011 : 681640. Dostupné z DOI: <http://dx.doi.org/10.4061/2011/681640>.
19. Solomon A, Woodiwiss A., Abdool-Carrim A et al. The carotid artery atherosclerosis burden and its relation to cardiovascular risk factors in black and white Africans with established rheumatoid arthritis: a cross-sectional study. J Rheumatol 2012; 39(9): 1798–1806. Dostupné z DOI: <http://doi: 10.3899/jrheum.120073>.
20. O‘Neill F, Riwanto M, Charakida M et al. Structural and functional changes in HDL with low grade and chronic inflammation. Int J Cardiol 2015; 188 : 111–116. Dostupné z DOI: <http://dx.doi.org/10.1016/j.ijcard.2015.03.058>.
21. von Eckardstein A, Widmann C. High-density lipoprotein, beta cells, and diabetes. Cardiovasc Res 2014; 103(3): 384–394. Dostupné z DOI: <http://dx.doi.org/10.1093/cvr/cvu143>.
22. Choy E, Ganeshalingam K, Semb AG et al. Cardiovascular risk in rheumatoid arthritis: recent advances in the understanding of the pivotal role of inflammation, risk predictors and the impact of treatment. Rheumatology 2014; 53(12), 2143–2154. Dostupné z DOI: <http://dx.doi.org/10.1093/rheumatology/keu224>.
23. Rho YH, Chung CP, Oeser A et al. Inflammatory Mediators and Premature Coronary Atherosclerosis in Rheumatoid Arthritis. Arthritis Rheum 2009; 61(11): 1580–1585. Dostupné z DOI: <http://dx.doi.org/10.1002/art.25009>.
24. Ridker PM, MacFadyen JG, Everett BM et al. [CANTOS Trial Group]. Relationship of C-reactive protein reduction to cardiovascular event reduction following treatment with canakinumab: a secondary analysis from the CANTOS randomised controlled trial. Lancet. 2017. pii: S0140–6736(17)32814–3. Dostupné z DOI: <http://dx.doi.org/10.1016/S0140–6736(17)32814–3>.
25. Godson NJ, Wiles NJ, Lunt M et al. Mortality in early inflammatory polyarthritis: cardiovascular mortality is increased in seropositive patients. Arthritis Rheum 2002; 46(8): 2010–2019. Dostupné z DOI: <http://dx.doi.org/10.1002/art.10419>.
26. Pepine CJ, Gurbel PA. Cardiovascular safety of NSAIDs: Additional insights after PRECISION and point of view. Clin Cardiol 2017. Dostupné z DOI: <http://dx.doi.org/10.1002/clc.22814>.
27. W J, Bijlsma J, Buttgereit F. Adverse events of glucocorticoids during treatment of rheumatoid arthritis: lessons from cohort and registry studies. Rheumatology (Oxford) 2016; 55(Suppl 2): ii3-ii5. Dostupné z DOI: <http://dx.doi.org/10.1093/rheumatology/kew344>.
28. Micha R, Imamura F, Wyler von Ballmoos M et al. Systematic review and meta-analysis of methotrexate use and risk of cardiovascular disease. Am J Cardiol 2011; 108(9): 1362–1370. Dostupné z DOI: <http://dx.doi.org/10.1016/j.amjcard.2011.06.054>.
29. Ramiro S, Sepriano A, Chatzidionysiou K et al. Safety of synthetic and biological DMARDs: a systematic literature review informing the 2016 update of the EULAR recommendations for management of rheumatoid arthritis. Ann Rheum Dis 2017; 76(6): 1101–1136. Dostupné z DOI: <http://dx.doi.org/10.1136/annrheumdis-2016–210708>.
30. Roubille C, Richer V, Starnino T et al. The effects of tumour necrosis factor inhibitors, methotrexate, non-steroidal anti-inflammatory drugs and corticosteroids on cardiovascular events in rheumatoid arthritis, psoriasis and psoriatic arthritis: a systematic review and meta-analysis. Ann Rheum Dis 2015; 74(3): 480–489. Dostupné z DOI: <http://dx.doi.org/10.1136/annrheumdis-2014–206624>.
31. Goodson N, Brookhart A, Symmons D et al. Non-steroidal anti-inflammatory drug use does not appear to be associated with increased cardiovascular mortality in patients with inflammatory polyarthritis: results from a primary care based inception cohort of patients. Ann Rheum Dis 2009; 68(3): 367–372. Dostupné z DOI: <http://dx.doi.org/10.1136/ard.2007.076760>.
32. Lindhardsen J, Gislason G, Jacobsen S et al. Non-steroidal anti-inflammatory drugs and risk of cardiovascular disease in patients with rheumatoid arthritis: a nationwide cohort study. Ann Rheum Dis 2013; 73(8): 1515–1521. Dostupné z DOI: <http://dx.doi.org/10.1136/annrheumdis-2012–203137>.
33. Kearney PM, Baigent C, Goodwin J et al. Do selective cyclo-oxygenase-2 inhibitors and traditional non-steroidal anti-inflammatory drugs increase the risk of atherothrombosis? Meta-analysis of randomised trials. BMJ 2006; 332(7553): 1302–1308. Dostupné z DOI: <http://dx.doi.org/10.1136/bmj.332.7553.1302>.
34. Fardet L, Fève B. Systemic glucocorticoid therapy: a review of its metabolic and cardiovascular adverse events. Drugs 2014; 74(15): 1731–1745. Dostupné z DOI: <http://dx.doi.org/10.1007/s40265–014–0282–9>.
35. Avina-Zubieta J, Abrahamowicz M, De Vera M et al. Immediate and past cumulative effects of oral glucocorticoids on the risk of acute myocardial infarction in rheumatoid arthritis: a population-based study. Rheumatology (Oxford) 2013; 52(1): 68–75. Dostupné z DOI: <http://dx.doi.org/10.1093/rheumatology/kes353>.
36. Naranjo A, Sokka T, Descalzo M et al. Cardiovascular disease in patients with rheumatoid arthritis: results from the Quest-RA study. Arthritis Res Ther 2008; 10(2): R30. Dostupné z DOI: <http://dx.doi.org/10.1186/ar2383>.
37. Landewe RB, van den Borne BE, Breedveld FC et al. Methotrexate effects in patients with rheumatoid arthritis with cardiovascular comorbidity. Lancet 2000; 355(9215): 1616–1617. Dostupné z DOI: <http://dx.doi.org/10.1016/S0140–6736(00)02222–4>.
38. Choi HK, Hernan MA, Seeger JD et al. Methotrexate and mortality in patients with rheumatoid arthritis: a prospective study. Lancet 2002; 359(9313): 1173–1177. Dostupné z DOI: <http://dx.doi.org/10.1016/S0140–6736(02)08213–2>.
39. Micha R, Imamura F, von Ballmoos MW et al. Systematic review and meta-analysis of methotrexate use and risk of cardiovascular disease. Am J Cardiol 2011; 108(9): 1362–1370. Dostupné z DOI: <http://dx.doi.org/10.1016/j.amjcard.2011.06.054>.
40. Clarke R, Halsey J, Lewington S et al. [B-Vitamin Treatment Trialists‘ Collaboration]. Effects of lowering homocysteine levels with B vitamins on cardiovascular disease, cancer, and cause-specific mortality: Meta-analysis of 8 randomized trials involving 37 485 individuals. Arch Intern Med 2010; 170(18): 1622–1631. Dostupné z DOI: <http://dx.doi.org/10.1001/archinternmed.2010.348>.
41. Ridker PM. Testing the inflammatory hypothesis of atherothrombosis: scientific rationale for the cardiovascular inflammation reduction trial (CIRT). J Thromb Haemost 2009; 7(Suppl 1): 332–339. Dostupné z DOI: <http://dx.doi.org/10.1111/j.1538–7836.2009.03404.x>.
42. Wasko MC, Hubert HB, Lingala VB et al. Hydroxychloroquine and risk of diabetes in patients with rheumatoid arthritis. JAMA 2007; 298(2): 187–193. Dostupné z DOI: <http://dx.doi.org/10.1001/jama.298.2.187>.
43. Atzeni F, Turiel M, Caporali R et al. The effect of pharmacological therapy on the cardiovascular system of patients with systemic rheumatic diseases. Autoimmun Rev 2010; 9(12): 835–839. Dostupné z DOI: <http://dx.doi.org/10.1016/j.autrev.2010.07.018>.
44. Dixon WG, Watson KD, Lunt M et al. Reduction in the incidence of myocardial infarction in patients with rheumatoid arthritis who respond to anti-tumor necrosis factor alpha therapy: Biologics Register. Arthritis Rheum 2007; 56(9): 2905–2912. Dostupné z DOI: <http://dx.doi.org/10.1002/art.22809>.
45. Jacobsson LT, Turesson C, Gulfe A et al. Treatment with tumor necrosis factor blockers is associated with a lower incidence of first cardiovascular events in patients with rheumatoid arthritis. J Rheumatol 2005; 32(7): 1213–1218.
46. Angel K, Provan SA, Fagerhol MK et al. Effect of 1-year anti-TNF-alpha therapy on aortic stiffness, carotid atherosclerosis, and calprotectin in inflammatory arthropathies: a controlled study. Am J Hypertens 2012; 25(6): 644–650. Dostupné z DOI: <http://dx.doi.org/10.1038/ajh.2012.12>.
47. Ljung L, Simard JF, Jacobsson L et al. Treatment with tumor necrosis factor inhibitors and the risk of acute coronary syndromes in early rheumatoid arthritis. Arthritis Rheum 2012; 64(1): 42–52. Dostupné z DOI: <http://dx.doi.org/10.1002/art.30654>.
48. Naerr GW, Rein P, Saely CH et al. Effects of synthetic and biological disease modifying antirheumatic drugs on lipid and lipoprotein parameters in patients with rheumatoid arthritis. Vascul Pharmacol 2016; 81 : 22–30. Dostupné z DOI: <http://dx.doi.org/10.1016/j.vph.2016.01.006>.
49. Olejárová M. Nežádoucí účinky biologické léčby v revmatologii. Vnitř Lék 2016; 62(7–8): 605–612.
50. Winer DA, Winer S, Shen L et al. B Lymphocytes Promote Insulin Resistance through Modulation of T Lymphocytes and Production of Pathogenic IgG Antibody. Nat Med 2011; 17(5): 610–617. Dostupné z DOI: <http://dx.doi.org/10.1038/nm.2353>.
51. Novikova DS, Popkova TV, Lukina GV et al. The Effects of Rituximab on Lipids, Arterial Stiffness and Carotid Intima-Media Thickness in Rheumatoid Arthritis. J Korean Med Sci 2016; 31(2): 202–207. Dostupné z DOI: <http://dx.doi.org/10.3346/jkms.2016.31.2.202>.
52. McInnes IB, Kim HY, Lee SH et al. Open-label tofacitinib and double-blind atorvastatin in rheumatoid arthritis patients: a randomised study. Ann Rheum Dis 2014; 73(1): 124–131. Dostupné z DOI: <http://dx.doi.org/10.1136/annrheumdis-2012–202442>.
53. Bartels C, Kind A, Everett C et al. Low frequency of primary lipid screening among medicare patients with rheumatoid arthritis. Arthritis Rheum 2011; 63(5): 1221–1230. Dostupné z DOI: <http://dx.doi.org/10.1002/art.30239>.
54. Ikdahl E, Rollefstad S, Wibetoe G et al. Exploring The Inadequate Cardiovascular Disease Prevention in Inflammatory Joint Diseases: Results from The NOCAR Project. Ann Rheum Dis 2016; 75(Suppl 2): 473.
55. Chung CP, Giles JT, Petri M et al. Prevalence of traditional cardiovascular risk factors in patients with rheumatoid arthritis: comparison with control subjects from multi-ethnic study of atherosclerosis. Semin Arthritis Rheum 2012; 41(4): 535–544. Dostupné z DOI: <http://dx.doi.org/10.1016/j.semarthrit.2011.07.004>.
56. Crowson CS, Matteson EL, Roger VL et al Usefulness of risk scores to estimate the risk of cardiovascular disease in patients with rheumatoid arthritis. Am J Cardiol 2012; 110(3): 420–424. Dostupné z DOI: <http://dx.doi.org/10.1016/j.amjcard.2012.03.044>.
57. Arts EE, Popa CD, den Broeder AA et al. Prediction of cardiovascular risk in rheumatoid arthritis: performance of original and adapted SCORE algorithms. Ann Rheum Dis 2016; 75(4): 674–680. Dostupné z DOI: <http://dx.doi.org/10.1136/annrheumdis-2014–206879>.
58. Wiersma T, Smulders YM, Stehouwer CD et al. Summary of the multidisciplinary guideline on cardiovascular risk management (revision 2011). Ned Tijdschr Geneeskd 2012; 156(36): A5104.
59. Arts EEA, Popa C, Broeder AA et al. Performance of four current risk algorithms in predicting cardiovascular events in patients with early rheumatoid arthritis. Ann Rheum Dis 2015; 74(4): 668–674. Dostupné z DOI: <http://dx.doi.org/10.1136/annrheumdis-2013–204024>.
60. Solomon DH, Greenberg J, Curtis JR et al. Derivation and internal validation of an expanded cardiovascular risk prediction score for rheumatoid arthritis: a Consortium of Rheumatology Researchers of North America Registry Study. Arthritis Rheumatol 2015; 67(8): 1995–2003. Dostupné z DOI: <http://dx.doi.org/10.1002/art.39195>. Erratum in Errata. [Arthritis Rheumatol. 2016].
61. Arts E. OP0164 A Transatlantic Cardiovascular Risk Calculator for Rheumatoid Arthritis (ATACC-RA). EULAR 2014: Scientific Abstracts Oral Presentations. Abstract session: Comorbidity and disease impact in RA. Ann Rheum 2014; 73(suppl 2): S123-S124. Dostupné z DOI: <http://dx.doi.org/10.1136/annrheumdis-2014-eular.1712>.
62. Crowson CS, Rollefstad S, Kitas GD et al. [A Trans-Atlantic Cardiovascular Risk Consortium for Rheumatoid Arthritis (ATACC-RA)]. Challenges of developing a cardiovascular risk calculator for patients with rheumatoid arthritis. PLoS One 2017; 12(3): e0174656. Dostupné z DOI: <http://dx.doi.org/10.1371/journal.pone.0174656>. Erratum in Correction: Challenges of developing a cardiovascular risk calculator for patients with rheumatoid arthritis. [PLoS One 2017].
63. Ford ES. Does exercise reduce inflammation? Physical activity and C-reactive protein among U.S. adults. Epidemiology 2002; 13(5): 561–568. Dostupné z DOI: <http://dx.doi.org/10.1097/01.EDE.0000023965.92535.C0>.
64. Cooney JK, Law RJ, Matshke V. Benefits of Exercise in Rheumatoid Arthritis. J Aging Res 2011; 2011 : 681640. Dostupné z DOI: <http://dx.doi.org/10.4061/2011/681640>.
65. Vrablík M. Farmakoterapie dyslipidemie: průvodce ošetřujícího lékaře. 2. vyd. Maxdorf Jessenius: Praha 2016. ISBN 978–80–7345–503–3.
66. Pella D, Gvozdjáková A, Lietava J et al. Myopatie asociovaná se statiny: klinické doporučení Slovenskej asociácie aterosklerózy a České společnosti pro aterosklerózu. AtheroRev 2016, 1(1): 7–13.
67. Kitas G, Nightingale P, Armitage J et al. SAT0105 Trial of Atorvastatin for the Primary Prevention of Cardiovascular Events in Patients with Rheumatoid Arthritis (TRACE RA). 2015 ACR/ARHP Annual Meeting. Arthritis Rheumatol. 2015; 67(Suppl 10). Dostupné z WWW: <http://acrabstracts.org/abstract/trial-of-atorvastatin-for-the-primary-prevention-of-cardiovascular-events-in-patients-with-rheumatoid-arthritis/>.
68. McCarey DW, McInnes IB, Madhok R et al. Trial of Atorvastatin in Rheumatoid Arthritis (TARA): double-blind, randomised placebo-controlled trial. Lancet 2004; 363(9426): 2015–2021. Dostupné z DOI: <http://dx.doi.org/10.1016/S0140–6736(04)16449–0>.
69. Semb AG, Kvien TK, DeMicco DA et al. Effect of intensive lipid-lowering therapy on cardiovascular outcome in patients with and those without inflammatory joint disease. Arthritis Rheum 2012; 64(9): 2836–2846. Dostupné z DOI: <http://dx.doi.org/10.1002/art.34524>.
70. Hollan I, Dessein PH, Ronda N et al. Prevention of cardiovascular disease in rheumatoid arthritis. Autoimmun Rev 2015; 14(10): 952–969. Dostupné z DOI: <http://dx.doi.org/10.1016/j.autrev.2015.06.004>.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2018 Číslo 1- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Diabetická dyslipidemie a mikrovaskulární komplikace diabetu
- Familiární kombinovaná hyperlipidemie – nejčastější familiární dyslipidemie v běžné populaci i u pacientů s časným výskytem aterotrombotických kardiovaskulárních příhod
- Epidemiologie hypercholesterolemie
- MedPed – realita péče o familiární hypercholesterolemie v největším centru
- Postavení inhibitorů PCSK9 a lipoproteinové aferézy v léčbě homozygotní a závažné heterozygotní familiární hypercholesterolemie: Kdo z koho, nebo je to jinak?
- Kardiovaskulární riziko u pacientů s revmatickými chorobami a jeho management
- Ateroskleróza aneb Výběr z „interního kmene“
- Regrese koronární aterosklerózy a možnosti jejího zobrazení se zaměřením na výsledky studie GLAGOV
- Vliv pulzatility na markery poškození vaskulatury u pacientů s implantovanou mechanickou srdeční podporou s kontinuálním průtokem
- Poznámky k analytice biomarkerů kardiovaskulárního rizika
- Dlouhé nekódující RNA v patofyziologii aterosklerózy
- Postavení hydrochlorothiazidu mezi thiazidovými a thiazidům podobnými diuretiky
- Česko-slovenská lipidová akademie
- Josef Marek, Václav Hána a kolektiv. Endokrinologie.
- Stanovisko výboru České společnosti pro aterosklerózu k doporučením ESC/EAS pro diagnostiku a léčbu dyslipidemií z roku 2016
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Familiární kombinovaná hyperlipidemie – nejčastější familiární dyslipidemie v běžné populaci i u pacientů s časným výskytem aterotrombotických kardiovaskulárních příhod
- Epidemiologie hypercholesterolemie
- Diabetická dyslipidemie a mikrovaskulární komplikace diabetu
- Postavení hydrochlorothiazidu mezi thiazidovými a thiazidům podobnými diuretiky
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



