-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Význam merania obehových časov a elasticity pečene v porovnaní s MELD pri odhade jednoročného rizika nepriaznivého priebehu klinicky diagnostikovanej cirhózy
Hepatic transit times and liver elasticity compared with meld in predicting a 1 year adverse clinical outcome of a clinically diagnosed cirrhosis
Introduction and objectives:
Hepatic transit times measured by the contrast enhanced ultrasonography and liver elasticity were found to predict a clinically significant portal hypertension. However, these modalities we not yet sufficiently evaluated in predicting adverse clinical outcome in patients with clinically diagnosed cirrhosis (D´Amico stages > 1), having a clinically significant portal hypertension. The aim of our study was to assess the predictive power of the liver transit times and the liver elasticity on an adverse clinical outcome of clinically diagnosed cirrhosis compared with the MELD score.Methods:
The study group included 48 consecutive outpatients with cirrhosis in the 2., 3. and 4. D’Amico stages. Patients with stage 4 could have jaundice, patients with other complications of portal hypertension were excluded. Transit times were measured from the time of intravenous administration of contrast agent (Sonovue) to a signal appearance in a hepatic vein (hepatic vein arrival time, HVAT) or time difference between the contrast signal in the hepatic artery and hepatic vein (hepatic transit time, HTT) in seconds. Elasticity was measured using the transient elastography (Fibroscan). The transit times and elasticity were measured at baseline and patients were followed for up for 1 year. Adverse outcome of cirrhosis was defined as the appearance of clinically apparent ascites and/or hospitalization for liver disease and/or death within 1 year.Results:
The mean age was 61 years, with female/male ratio 23/25. At baseline, the median Child-Pugh score was 5 (IQR 5.0–6.0), MELD 9.5 (IQR 7.6 to 12.1), median HVAT was 22 s (IQR 19–25) and HTT 6 (IQR 5–9). HTT and HVAT negatively correlated with Child-Pugh (-0.351 and -0.441, p = 0.002) and MELD (-0.479 and -0.388, p = 0.006) scores. The adverse outcome at 1-year was observed in 11 cases (22.9 %), including 6 deaths and 5 hospitalizations. Median HVAT in those with/without the adverse outcome was 20 seconds (IQR 19.3–23.5) compared with 22 s (IQR 19–26, p = 0.32). Cases with adverse outcome had significantly higher MELD (12.9 vs 8.5), Child-Pugh score (7.0 vs 5.0) and the liver elasticity (52.5 vs 21.5 kPa) (p < 0.05). The AUROC of the HVAT, liver elasticity and MELD for the prediction of the adverse outcome was 0.60 (95% CI 0.414 to 0.785), 0.767 (0.56 to 0.98) and 0.813 (0.66 to 0.97). Unlike HVAT, the liver elasticity > 35.3 kPa increased the risk of the adverse outcome 10.3-times and MELD score > 11 points 8.5-times.Conclusion:
In patients with clinically diagnosed cirrhosis having a clinically significant portal hypertension hepatic transit times do not predict the 1-year adverse clinical outcome. However, the liver elasticity > 35.3 kPa appears clinically useful with a prognostic value comparable with MELD.Key words:
clinically diagnosed cirrhosis – hepatic transit times – liver elasticity – MELD – portal hypertension
Autoři: Tomáš Koller 1; Zuzana Piešťanská 1; Tibor Hlavatý 1; Jozef Holomáň 2; Jozef Glasa 2; Juraj Payer 1
Působiště autorů: V. interná klinika LF UK a UN Bratislava – Nemocnica Ružinov, Slovenská republika 1; Ústav farmakológie, klinickej a experimentálnej farmakológie SZU Bratislava, Slovenská republika 2
Vyšlo v časopise: Vnitř Lék 2016; 62(5): 351-359
Kategorie: Původní práce
Souhrn
Úvod a ciele:
Zistilo sa, že obehové časy pečene merané pomocou kontrastnej ultrasonografie a elasticita pečene dokázali predpovedať klinicky signifikantnú portálnu hypertenziu. Nie je však zatiaľ dostatočne preskúmané, či by obehové časy pečene dokázali predpovedať nepriaznivý priebeh aj u pacientov s klinicky diagnostikovanou cirhózou, ktorí vo väčšine prípadov majú klinicky signifikantnú portálnu hypertenziu. Cieľom našej štúdie bolo zhodnotiť význam obehových časov a elasticity pečene v predikcii nepriaznivého priebehu cirhózy a porovnať ich s MELD (model for end-stage liver disease).Metódy:
Sledovaná skupina zahŕňala 48 po sebe idúcich ambulantných pacientov s cirhózou v 2.–4. štádiu podľa D´Amica. Pacienti v štádiu 4. mohli mať len ikterus, pacienti s ostatnými komplikáciami portálnej hypertenzie neboli zahrnutí. Meranie obehových časov bolo vykonané počas kontrolného ultrasonografie. Obehové časy boli merané od intravenóznej aplikácie kontrastnej látky (SonoVue) a jej príchodu do hepatálnej žily (venózny čas/hepatic vein arrival time – HVAT) alebo časového rozdielu medzi kontrastným signálom vo vetve a. hepatica a hepatálnej žily (obeh pečene/hepatic transit time – HTT) v sekundách. Elasticita pečene bola meraná pomocou tranzientnej elastografie (Fibroscan). Obehové časy a elasticita boli merané pri vstupe do sledovania. Pacienti boli následne sledovaní počas 1 roka. Nepriaznivý priebeh cirhózy bol definovaný ako objavenie sa klinicky zjavného ascitu alebo hospitalizácie pre chorobu pečene alebo úmrtia.Výsledky:
Priemerný vek bol 61 rokov, pomer ženy/muži bol 23/25. Pri vstupe do štúdie bol medián Childova-Pughova skóre 5 (IQR 5,0–6,0), MELD 9,5 (IQR 7,6–12,1), medián HVAT bol 22 s (IQR 19–25) a HTT 6 (IQR 5–9). HTT aj HVAT negatívne korelovali s Childovom-Pughovom skóre (-0,351, resp. -0,441; p = 0,002) a MELD (-0,479, resp. -0,388; p = 0,006) skóre. Po dobu jedného roka bol nepriaznivý priebeh zaznamenaný v 11 prípadoch (22,9 %), vrátane 6 úmrtí a 5 hospitalizácií. Medián HVAT bol v prípadoch s nepriaznivým priebehom 20 s (IQR 19,3–23,5) porovnaní s 22 s (IQR 19 do 26, p = 0,32). Prípady s nepriaznivým priebehom mali signifikantne vyššie MELD (12,9 vs 8,5), Childovo-Pughovo skóre (7,0 vs 5,0) a elasticitu pečene (52,5 vs 21,05 kPa) (p < 0,05). AUROC pre HVAT, elasticitu pečene a MELD v predikcii nepriaznivého priebehu bol 0,60 (95% CI 0,414–0,785), 0,767 (0,56–0,98) a 0,813 (0,66–0,97). Čas HVAT nebol schopný predpovedať nepriaznivý klinický výsledok, ale elasticita pečene > 35,3 kPa zvýšila toto riziko 10,3-násobne a MELD > 11 bodov 8,5-násobne.Záver:
U pacientov s klinicky diagnostikovanou cirhózou s prítomnou klinicky signifikantnou portálnou hypertenziou obehové časy pečene nepreukázali schopnosť predpovedať nepriaznivý priebeh do jedného roka. Naopak, meranie elasticity pečene sa ukázalo ako klinicky prospešné s prognostickou hodnotou porovnateľnou s MELD.Kľúčové slová:
elasticita pečene – klinicky diagnostikovaná cirhóza – MELD – obehové časy pečene – portálna hypertenziaÚvod
Cirhóza je celosvetovo závažným zdravotníckym problémom [1]. V krajinách východnej Európy je úmrtnosť na cirhózu jedna z najvyšších na svete [2]. V ostatných krajinách je cirhóza častou príčinou predčasnej úmrtnosti jedincov do 65. roku života [3,4]. Prirodzený priebeh cirhózy závisí najmä od štádia portálnej hypertenzie a je charakterizovaný štádiami podľa D´Amica [5]. So zvyšujúcim sa štádiom sa zvyšuje aj miera komplikácií a úmrtnosti. Kompenzovaná cirhóza je charakterizovaná 1. štádiom s absenciou pažerákových varixov a 2. štádiom s prítomnosťou varixov pažeráka. Dekompenzovaná cirhóza je charakterizovaná 3. štádiom s prítomnosťou varikózneho krvácania, 4. štádiom s prítomnosťou ascitu, ikteru alebo encefalopatie a 5. štádiom s prítomnosťou viacerých komplikácií. Skorá diagnóza cirhózy ešte v 1. štádiu je v súčasnosti stále veľkou výzvou, pretože je možná len pomocou biopsie pečene, elastografie, pomocou merania hepatálneho venózneho gradientu (hepatic venous pressure gradient – HVPG) alebo pri náhodnom operačnom náleze. Drvivú väčšinu pacientov s diagnostikovanou cirhózou však v súčasnosti tvoria jedinci v 2. alebo vyššom štádiu. Z definície týchto štádií vyplýva, že títo pacienti už majú klinicky signifikantnú portálnu hypertenziu s HVPG > 10 mm Hg [5]. Prognóza cirhózy je však aj v týchto štádiách portálnej hypertenzie variabilná, progresia hepatálneho zlyhávania a komplikácie cirhózy sa objavujú nepredvídateľne [6]. Odhalenie pacientov s nepriaznivým priebehom by však bolo medicínsky žiadúce a mohlo by viesť ku skorému nasadeniu preventívnych opatrení, kauzálnej liečby a ku skorej identifikácii vhodných kandidátov na transplantáciu pečene.
V súčasnosti preto existuje snaha o identifikáciu markerov, ktoré by pomohli nájsť skupinu pacientov s nepriaznivým priebehom cirhózy. Meranie HVPG je zvyčajne dostupné len v niekoľkých centrách v krajine. Jedným z novších markerov je elasticita pečene meraná pomocou tranzientnej elastografie. Meranie elasticity pečene je validovanou neinvazívnou metódou odhalenia fibrózy a cirhózy pečene. Nedávno sa tiež zistilo, že elasticita pečene u pacientov s cirhózou koreluje s HVPG a mohla by slúžiť aj ako prediktor komplikácií portálnej hypertenzie a úmrtia [7]. Ďalšou možnosťou sú obehové časy pečene, ktoré je možné merať použitím kontrastnej ultrasonografie (USG). Meranie obehu pečene sa zdá teoreticky atraktívne, pretože by mohlo vystihovať patogenézu hepatálnej dysfunkcie s tvorbou intrahepatálnych skratov. Čím je poškodenie pečene významnejšie, tým je obeh kontrastnej látky medzi vetvou a. hepatica a hepatálnou žilou kratší. Viaceré práce ukázali, že obehové časy pečene významne korelovali s HVPG a dokázali predpovedať klinicky významnú portálnu hypertenziu [8]. V súčasnosti však nie je jasné, či by obehové časy dokázali predpovedať priebeh cirhózy už v štádiách klinicky signifikantnej portálnej hypertenzie (D´Amico štádium > 1). Ak by sa to dokázalo, merania by umožnili lepší odhad rizika pacienta pri jedinom USG vyšetrení.
Ciele práce
- v skupine sledovaných pacientov s klinicky diagnostikovanou cirhózou použitím kontrastnej USG zmerať obehové časy pečene a pomocou tranzientnej elastografie zmerať elasticitu pečene, následne tieto merania porovnať s existujúcimi prognostickými modelmi cirhózy
- sledovaním nášho súboru počas 1 roka vyhodnotiť, ako obehové časy pečene a elasticita pečene dokážu predpovedať nepriaznivý priebeh cirhózy v porovnaní s MELD
Pacienti a metódy
Súbor pacientov sme zostavili z po sebe nasledujúcich pacientov s cirhózou, ktorí sú sledovaní na hepatologickom pracovisku našej kliniky. Cirhóza bola diagnostikovaná pomocou klinického vyšetrenia, laboratórnych hodnôt, USG-obrazu alebo prítomnosti pažerákových varixov pri endoskopii. Inklúznym kritériom do štúdie boli pacienti s cirhózou v 1.–4. štádiu podľa D´Amica. Pacienti v 1. štádiu sú však raritní (1 prípad v našom súbore), pacienti v 4. štádiu mohli mať len ikterus (bilirubín > 34 μmol/l). V prípadoch klinicky evidentného ascitu, encefalopatie, renálneho zlyhávania alebo hepatocelulárneho karcinómu pacienti neboli zaradení. Takto diagnostikovanú skupinu pacientov s cirhózou sme nazvali ako klinicky diagnostikovaná cirhóza. Každý pacient pri vstupe absolvoval klinické vyšetrenie, laboratórne testy na štandardné prognostické parametre ako Childovo-Pughovo skóre a MELD-skóre, nátrium, krvný obraz a USG vyšetrenie pečene.
USG vyšetrenie pečene bolo vykonané u každého pacienta v rámci skríningu hepatocelulárneho karcinómu. Bolo vykonané na prístroji Aloka Prosound α5 (Tokyo, Japonsko) s použitím štandardnej konvexnej sondy 3,5–5 MHz pri štandardnom zobrazení a duplexnom zobrazení v. portae a hepatálnych žíl. Zaznamenaná bola priechodnosť v. portae, rýchlosť toku a prietok vo v. portae [9]. Následne bola pacientom intravenóznym bolusom aplikovaná kontrastná látka SonoVue (Bracco, Taliansko) v objeme 2,5 ml nasledovaná rýchlym preplachom fyziologickým roztokom. Zaznamenávali sme obehové časy pečene nasledovne:
- arteriálny čas (hepatic arterial time – HAT) bol definovaný ako časový interval v sekundách od začiatku intravenóznej (i.v.) aplikácie kontrastnej látky po objavenie sa kontrastného signálu vo vetvách a. hepatica v parenchýme pečene
- venózny čas (hepatic vein arrival time – HVAT) bol definovaný ako časový interval od začiatku i.v. aplikácie po objavenie sa prvých znakov kontrastného signálu vo v. hepatica asi 5 cm od ich sútoku s v. cava inferior,
- obehový čas pečene (hepatic transit time – HTT) bol definovaný ako rozdiel medzi arteriálnym a venóznym časom (HTT = HVAT – HAT). Všetky vyšetrenia boli vykonané jedným vyšetrujúcim a následne digitálne zaznamenávané (obr. 1). Časové intervaly v sekundách boli následne odčítané zo záznamov 2 nezávislými hodnotiteľmi.
Obr. 1. Kontrastné vyšetrenie pečene 
1 – signál v hepatálnej žile 2 – signál v riečisku a. hepatica 3 – signál vo vetvení v. portae U všetkých pacientov bol záujem vykonať aj elastografické vyšetrenie pečene do niekoľkých týždňov od USG vyšetrenia, avšak z viacerých dôvodov toto vyšetrenie absolvovala len podskupina pacientov. Vyšetrenie bolo vykonané na prístroji Fibroscan (Echosense, Paríž, Francúzsko) ráno nalačno, dodržaním protokolu predpísaného výrobcom. Elasticita pečene bola zaznamenaná v kPa s interkvartilovým rozptylom.
Súbor vyšetrených pacientov sme následne sledovali každé 3 mesiace počas 1 roka. Zaznamenali sme výskyt komplikácií cirhózy ako objavenie sa klinicky významného ascitu, encefalopatie, krvácania z varixov alebo úmrtia. Definovali sme tzv. nepriaznivý priebeh cirhózy do 1 roka. Jeho definícia bola naplnená vtedy, ak sa počas 1 roka objavil aspoň 1 z nasledujúcich cieľových javov: nové objavenie sa klinicky zjavného ascitu, nutnosť hospitalizácie z hepatálnych príčin alebo úmrtie z akejkoľvek príčiny. Vypočítali sme počet dní od USG vyšetrenia do dátumu objavenia sa nepriaznivého priebehu. Ak nepriaznivý priebeh nenastal, počet dní bol cenzurovaný na 400 dní.
Štatistická analýza bola vykonaná použitím softvéru MedCalc v.15 (Medcalc, Ostende, Belgicko). Dáta boli analyzované na normálny rozptyl. Väčšina kľúčových parametrov nemala normálnu distribúciu, preto v tabuľkách uvádzame pre každý parameter medián a interkvartilový rozptyl. Na zistenie korelácií medzi premennými sme použili neparametrický Spearmanov test, na porovnávanie dát sme použili neparametrický Mannov-Whitneyho test. Pre MELD, obehové časy a elasticitu sme pomocou ROC (receiver operating characteristic curve) analýzy identifikovali vhodné prahy, ktoré by dokázali predpovedať nepriaznivý priebeh cirhózy do 1 roka. Pre každý prah sme následne zostrojili Kaplanovu-Meierovu krivku pravdepodobnosti prežitia s/bez nepriaznivého priebehu.
Štúdia bola vykonaná v súlade s Helsinskou deklaráciou. Štúdia bola vykonaná s podporou grantu Ministerstva školstva SR a Slovenskej akadémie vied VEGA V-13–004–00. Protokol štúdie schválila lokálna etická komisia a pacienti podpísali informovaný súhlas v súlade s platnými právnymi predpismi.
Výsledky
Zo 48 pacientov s klinicky diagnostikovanou cirhózou bolo 25 žien a 23 mužov s priemerným vekom 61 rokov. Alkoholová etiológia cirhózy bola u 77,1 % pacientov, ostatní pacienti mali infekciu HBV, HCV alebo cirhózu pri tukovej chorobe pečene. Diagnóza cirhózy bola známa priemerne 4 roky. Všetci pacienti boli pri vstupe do štúdie kauzálne liečení na chorobu pečene. U 3 z nich však došlo počas sledovania ku recidíve pitia alkoholu.
Štádia cirhózy podľa D´Amica boli zastúpené nasledovne: 1.–4. štádium malo 1, 29, 10 a 8 pacientov, 37,5 % pacientov malo štádium 3. a 4. znamenajúce dekompenzovanú cirhózu. 36 pacientov absolvovalo elastografické vyšetrenie pečene. Sumárna štatistika súboru je uvedená v tab. 1.
Tab. 1. Sumárna štatistika súboru vyšetrených pacientov s klinicky diagnostikovanou cirhózou 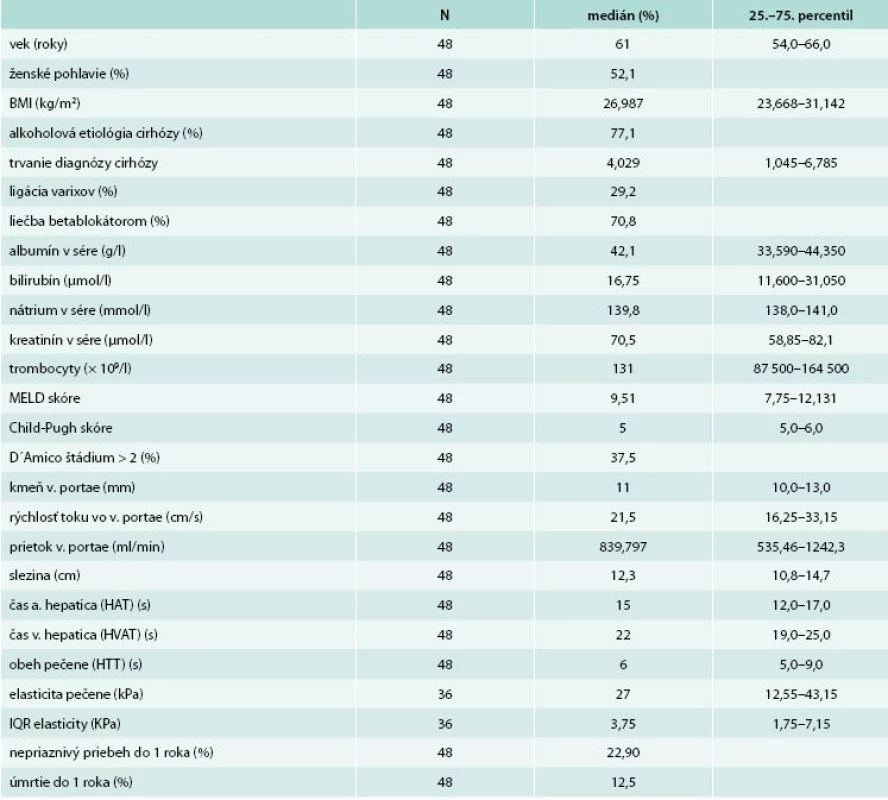
Porovnaním obehových časov pečene medzi oboma hodnotiteľmi sme zistili, že Spearmanov korelačný koeficient bol pre hodnoty HVAT 0,903 a pre hodnoty HTT 0,907.
Porovnanie obehových časov pečene a elasticity pečene s prognostickými modelmi cirhózy korelačnou analýzou uvádzame v tab. 2. Zistili sme, že venózny čas (HVAT) a čas obehu pečene (HTT) signifikantne korelovali s modelmi MELD a Child-Pugh. Elasticita pečene taktiež signifikantne korelovala s modelom MELD.
Tab. 2. Spearmannov korelačný koeficient medzi sledovanými prognostickými parametrami cirhózy pečene 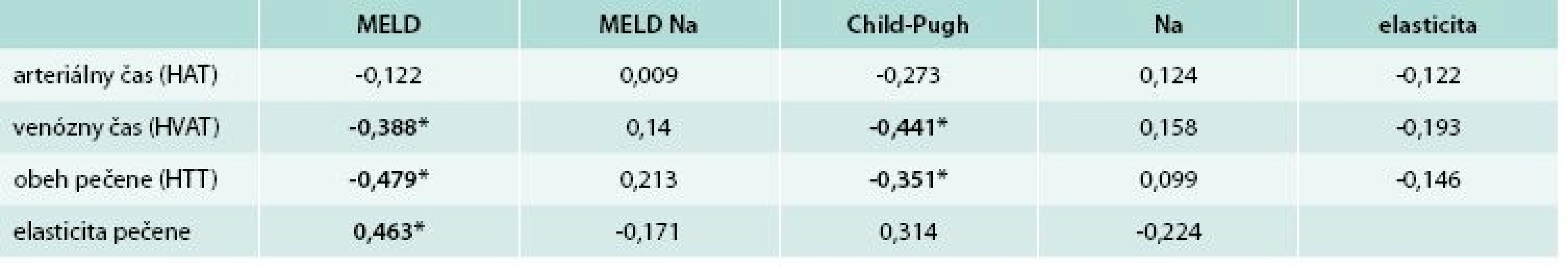
*p < 0,05 Porovnaním obehových časov v skupine pacientov s kompenzovanou cirhózou (D´Amico štádium 1. a 2., n = 30) so skupinou s dekompenzovanou cirhózou (štádium 3. a 4., n = 18) sme zistili, že obehové časy neboli štatisticky významne odlišné (HVAT 22 vs 21,5; p = 0,8562 a HTT 12 vs 12; p = 0,8264).
Porovnaním obehových časov u pacientov, ktorí užívali/neužívali liečbu betablokátorom, sme zistili signifikantne predĺžený HVAT (22,5 vs 19,5 s; p = 0,0156) a nesignifikantne predĺžený HTT (12 vs 10 s; p = 0,084) v skupine užívajúcej betablokátor.
Sledovaním súboru pacientov počas 1 roka sme zistili, že nepriaznivý priebeh cirhózy nastal u 11 pacientov (22,9 %). U 6 pacientov došlo k úmrtiu z hepatálnych príčin, u 5 pacientov došlo ku objaveniu sa ascitu alebo hospitalizácie z hepatálnych príčin. Ani 1 pacient nepodstúpil transplantáciu pečene vzhľadom na prítomnosť kontraindikácií (vek u 2, po jednom pľúcna hypertenzia, renálne zlyhanie, morbídna obezita a recidíva abúzu etanolu). Porovnanie základných klinických, biochemických a prognostických parametrov, ako aj obehových časov a elasticity pečene medzi pacientmi s priaznivým a nepriaznivým priebehom je uvedené v tab. 3. Zistili sme, že pacienti s nepriaznivým priebehom cirhózy do 1. roka mali signifikantne vyšší vek (66 vs 59 rokov; 0,032), MELD skóre (12,9 vs 8,47; p = 0,002), Childovo-Pughovo skóre (7 vs 5; p = 0,0001) a jednotlivé parametre použité v týchto modeloch (bilirubín, albumín), ďalej mali nižšiu koncentráciu nátria v sére (136,3 vs 140 mmol/l; p = 0,0004) a trombocytov (106 vs 138 × 109/l; p = 0,04).
Tab. 3. Porovnanie pacientov podľa objavenia sa nepriaznivého priebehu cirhózy do 1 roka (dekompenzácie, hospitalizácie alebo úmrtia) 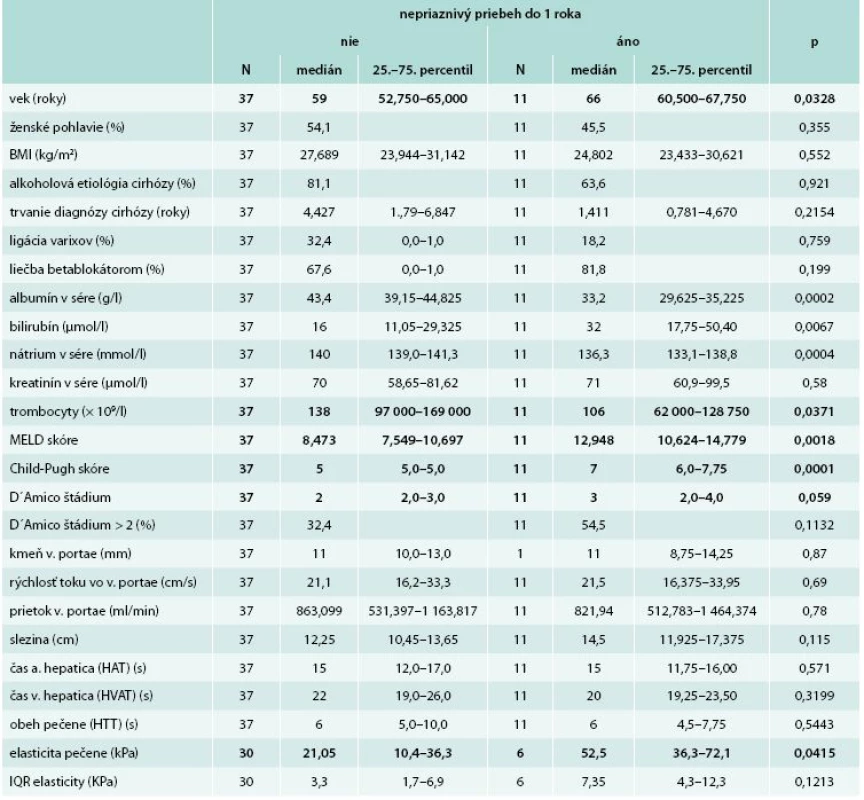
Obehové časy pečene neboli medzi oboma skupinami odlišné (HVAT 20 vs 22 s; p = 0,32/HTT 6 vs 6 s; p = 0,54). V podskupine 36 pacientov, ktorí absolvovali elastografické vyšetrenie pečene, bola elasticita pečene signifikantne vyššia v skupine pacientov s nepriaznivým priebehom (52,5 vs 21,05 kPa; p = 0,04).
Štádium cirhózy podľa D´Amica taktiež súviselo s nepriaznivým priebehom cirhózy do 1 roka, ku ktorému došlo u 0,0, 17,2, 10,0 a 66,7 % pacientov v štádiu 1, 2, 3 a 4 (p = 0,012 pre trend).
Pre venózny čas (HVAT), elasticitu pečene a MELD sme identifikovali prahy, ktoré by dokázali predpovedať nepriaznivý priebeh cirhózy. Pre venózny čas (HVAT) sme analýzou ROC krivky zistili AUROC = 0,60 s prahom obehu pečene ≤ 21 s, ktorý by dokázal predpovedať nepriaznivý priebeh cirhózy so 63,6% senzitivitou a 56,8% špecificitou. Pre elasticitu pečene sme analýzou ROC krivky zistili AUROC = 0,767 s prahom elasticity > 35,3 kPa, ktorá by dokázala predpovedať nepriaznivý priebeh cirhózy s 83,3% senzitivitou a 73,33% špecificitou. Pre MELD skóre sme analýzou ROC krivky zistili AUROC = 0,813 s prahom MELD > 11, ktorý by dokázal predpovedať nepriaznivý priebeh cirhózy s 72,7% senzitivitou a 83,8% špecificitou. Pre identifikované prahy sme pre každý z týchto parametrov zostrojili Kaplanovu-Meierovu krivku, ktorú uvádza graf 1, 2 a 3. Pre venózny čas neboli rozdiely medzi skupinami štatisticky významné (p = 0,187). Skupina s elasticitou pečene > 35,3 kPa mala 10,27-násobné riziko (HR 1,86–56,55; p = 0,0082) a skupina s MELD skóre > 11 mala 8,49-násobné riziko (HR 2,12–33,95; p = 0,0001) nepriaznivého priebehu cirhózy do jedného roka.
Graf 1. Pravdepodobnosť nepriaznivého priebehu cirhózy do 1 roka 
Graf 2. Pravdepodobnosť nepriaznivého priebehu cirhózy do 1 roka 
Graf 3. Pravdepodobnosť nepriaznivého priebehu cirhózy do 1 roka 
Diskusia
V našej práci sme zistili, že u 48 pacientov s klinicky diagnostikovanou cirhózou obehové časy pečene a elasticita negatívne korelovali s MELD. Pacienti na liečbe neselektívnym betablokátorom mali obehové časy pečene dlhšie v porovnaní s neliečenými. Sledovaním súboru počas 1 roka sme zistili, že obehové časy nedokázali dostatočne presne predpovedať nepriaznivý priebeh cirhózy. Naopak, elasticita pečene sa javila ako klinicky použiteľný prediktor nepriaznivého priebehu, ktorý bol porovnateľný s MELD skóre.
V našej práci je použitý termín klinicky diagnostikovaná cirhóza, ktorý vychádza zo súčasnej klinickej praxe. Viac ako 90 % pacientov s cirhózou je diagnostikovaných na základe prítomnosti varixov pažeráka alebo komplikácií portálnej hypertenzie [10]. Tieto komplikácie sú však často úspešne liečené a pacienti sú dlhodobo sledovaní bez objavenia sa ďalších komplikácií. Následný prirodzený priebeh je však dosť variabilný a ťažko predvídateľný. Ovplyvňuje ho nielen stav samotnej pečene, ale aj pokračujúci vplyv etiologickej príčiny poškodenia pečene (alkohol, steatohepatitída) a mnoho ďalších faktorov ako napr. stav výživy, alebo genetické faktory. Javí sa teda praktické zamerať sa práve na túto skupinu pacientov, a identifikovať spomedzi nej tých, ktorí majú nepriaznivý priebeh do 1 roka. Naviac, pri odstránení etiologického agens cirhózy je v súčasnosti možné očakávať regresiu cirhózy smerom k nižším štádiám fibrózy [11]. Možný efekt regresie fibrózy pečene však nie je dostatočne preskúmaný a možno ho očakávať najskôr v horizonte viacerých rokov.
Kontrastná USG bola prvýkrát zavedená do praxe s cieľom posúdenia benígnych a malígnych fokálnych lézií pečene [12]. Meranie obehových časov pečene bolo prvýkrát popísané približne pred 10 rokmi [13]. Táto metóda by mohla mať potenciál kvantifikovať poruchu prekrvenia pečene u pacientov s pokročilými chorobami pečene [14]. Fenomén by mohol byť výrazný najmä u pacientov s cirhózou, u ktorých sa predpokladá, že skratovanie krvi vchádzajúcej do pečene by mohlo byť jedným z mechanizmov progresie dysfunkcie pečene. Predchádzajúce práce ukázali, že obeh pečene je skrátený u pacientov so signifikantnou fibrózou v porovnaní so zdravými kontrolami [15]. Naviac, ak bola u pacientov s HBV a HCV etiológiou už prítomná cirhóza, obehové časy pečene sa ešte viac skrátili [13,16]. Venózny čas pečene tiež dosiahol uspokojivú presnosť v neinvazívnej identifikácii pacientov s cirhózou [17]. Pilotná štúdia zistila tesnú negatívnu koreláciu medzi voľným tlakom vo v. portae a venóznym časom pečene u pacientov s chronickou HBV infekciou a ukázala, že venózny čas pečene by bol dobrým markerom portálneho tlaku [18]. Doposiaľ najväčšia štúdia porovnávala venózny čas pečene s hepatálnym venózno-portálnym gradientom (HVPG) u 116 pacientov s kompenzovanou cirhózou [8]. Štúdia zistila medzi nimi tesnú negatívnu koreláciu r2 = 0,545. Naviac, venózny čas dokázal predpovedať klinicky signifikantnú portálnu hypertenziu (HVPG ≥ 10 mm Hg) s plochou pod krivkou AUROC = 0,95. Autori tejto štúdie identifikovali prah venózneho času s veľmi dobrou presnosťou v predpovedaní klinicky signifikantnej portálnej hypertenzie. Cieľom našej práce bolo preto overiť hypotézu, či obehové časy pečene dokážu predpovedať nepriaznivý priebeh cirhózy aj u pacientov, u ktorých je už prítomná klinicky signifikantná portálna hypertenzia. Naša hypotéza bola patogeneticky atraktívna, pretože za progresiou cirhózy a portálnej hypertenzie by mohli stáť aj progresívne zmeny v perfúzii pečene s intrahepatálnymi skratmi prietoku. Našu hypotézu sme však nepotvrdili. Zistili sme, že oba obehové časy nie sú tými parametrami, ktoré by dokázali predpovedať objavenie sa ascitu, hospitalizácie alebo úmrtia. Nezaznamenali sme rozdiely v obehových časoch ani medzi skupinami s kompenzovanou a dekompenzovanou cirhózou (D´Amico štádium 1 a 2 vs 3 a 4), čo vysvetľujeme prítomnosťou klinicky signifikantnej portálnej hypertenzie u takmer všetkých pacientov. Iné práce sledujúce prognostický význam merania obehových časov pečene u pacientov s už prítomnou klinicky signifikantnou portálnou hypertenziou však doposiaľ publikované neboli. Naša práca je v tomto ohľade prvá. V súčasnosti sa teda dá konštatovať, že zmeny obehových časov pečene sú skorými markermi cirhózy a portálnej hypertenzie, ktoré je možné využiť zatiaľ len pri neinvazívnej diagnostike klinicky signifikantnej portálnej hypertenzie. Napriek tomu je jasné, že kontrastné sonografické vyšetrenie pečene umožňuje asi najpresnejšie zobraziť detaily cievneho zásobenia pečene. Výzvou však naďalej zostáva identifikovať vhodný parameter, ktorý by dostatočne presne vystihoval poruchu prekrvenia pečene. Nedávna práca renomovaných autorov ukazuje možný smer vývoja hodnotenia prekrvenia pečene pomocou kontrastnej USG. Autori pomocou počítačového modelu analyzovali obraz pečene na bohatosť cievnej siete a jej spojení [19]. Zistili, že miera vaskulárnych prepojení úzko koreluje so stupňom portálnej hypertenzie.
Elastografia ako metóda merania tuhosti pečene je zaužívanou metódou na diagnostiku fibrózy aj cirhózy pečene. Spočiatku sa predpokladalo, že už vzniknutá cirhóza je konečným štádiom fibrózy pečene a jej ďalšia prognóza už nezávisí od stupňa tuhosti pečene. Zistilo sa však, že aj elasticita pečene koreluje s HVPG [20] a môže predpovedať komplikácie cirhózy, jej dekompenzáciu, vznik hepatocelulárneho karcinómu [21] alebo úmrtia z hepatálnych príčin [22]. V rakúskej štúdii dokázala elasticita vyššia ako 18 kPa predpovedať klinicky významnú portálnu hypertenziu (HVPG > 10 mm Hg) s asi 85% presnosťou [23]. Austrálska štúdia pacientov s cirhózou pri HCV infekcii a alkoholovej etiológii ukázala, že elasticita nad 35 kPa je asociovaná s objavením sa komplikácií portálnej hypertenzie [7]. Podobný prah bol identifikovaný aj v našej práci. Rizikovú elasticitu nad 35,3 kPa sme namerali u 13 pacientov (36 %), naopak nízko rizikovú elasticitu sme zaznamenali u 23 pacientov (64 %). Ázijské štúdie, v ktorých dominuje cirhóza pri HBV infekcii, identifikovali výrazne nižšie rizikové prahy v úrovni asi 17–20 kPa [24]. Nedávna metaanalýza viacerých štúdií u pacientov s cirhózou prevažne vírusovej etiológie potvrdila úlohu elastografie v predikcii dekompenzácie cirhózy a jej prognózy [25]. Rizikové prahy elasticity sú však závislé od etiológie a zloženia populácie. Rozdielny prah pre každú etiológiu nie je doposiaľ spoľahlivo vysvetlený. Jedným možným vysvetlením by bolo, že množstvo fibrózneho tkaniva je v pečeni rozdielne pri cirhózach rôznej etiológie. Ukázalo sa, že práve cirhóza alkoholovej etiológie má odlišnú patofyziológiu a nakoniec vedie ku asi dvojnásobnej ploche fibrózy v explantovanej pečeni v porovnaní s cirhózou vírusovej etiológie. Množstvo fibrózneho tkaniva pečene tak zvyšuje elasticitu pečene pri alkoholovej cirhóze [26]. Meranie elasticity pečene u pacientov s cirhózou sa podľa výsledkov našej práce javí ako sľubná prognostická metóda. Naviac, je relatívne ľahko vykonateľná a jej dostupnosť sa postupne zvyšuje. V našej práci dokázala identifikovať asi 1/3 pacientov s 10,2-násobne zvýšeným rizikom nepriaznivého priebehu do 1 roka. Až štúdie na vyššom počte pacientov však ukážu, či je prediktívna hodnota elasticity nezávislá od zaužívaných prognostických modelov, ako je napr. MELD.
V našej štúdii MELD skóre s prahovou hodnotou > 11 dokázalo predpovedať nepriaznivý priebeh cirhózy do 1 roka. MELD bol pôvodne navrhnutý tak, aby predvídal 3-mesačnú mortalitu u pacientov podstupujúcich transjugulárny porto-systémový skrat (TIPSS) [27,28]. Neskôr, po modifikácii UNOS v USA (united network for organ sharing) sa začal používať ako model na prideľovanie orgánov na transplantáciu pečene. Jeho účelom je presadzovať pacientov s najťažším postihnutím pečene smerom ku najvyššej priorite a v súčasnosti sa využíva aj v mnohých krajinách Európy. Počas posledného desaťročia bolo tiež preukázané, že MELD skóre dokáže odhadnúť prognózu pri akútnom krvácaní z varixov [27], pri akútnej alkoholovej hepatitíde [29], pri objaveniu sa závažných komplikácií cirhózy, najmä spontánnej bakteriálnej peritonitídy a hepatorenálneho syndrómu [30,31]. Len málo štúdií hodnotilo schopnosť MELD v odhade priebehu kompenzovanej cirhózy. Prvá takáto významná štúdia hodnotila 213 prípadov s kompenzovanou cirhózou a zistila, že MELD bol významným prediktorom dekompenzácie cirhózy s 15% zvýšením rizika s každým bodom v MELD [32]. Ďalšia nedávna štúdia zistila, že sérové koncentrácie sodíka a MELD-Na skóre boli významnými prediktormi úmrtnosti u pacientov s kompenzovanou cirhózou [33]. Naša štúdia teda len potvrdila, že MELD skóre môžeme považovať za overený model v odhade rizika aj u pacientov s klinicky diagnostikovanou cirhózou. Dokázal identifikovať približne 1/3 pacientov s 8,5-násobným rizikom nepriaznivého priebehu klinicky stabilizovanej cirhózy. Childovo-Pughovo skóre je tiež validným prognostickým modelom cirhózy [34]. Skóre najlepšie vystihuje prognózu dekompenzovanej cirhózy, avšak v našej štúdii z definície súboru vyplývalo, že väčšina pacientov mala Childovo-Pughovo skóre 5.
Vzhľadom na riziko štatistickej chyby II, teda nezistenia rozdielu, aj keď je prítomný, sme vykonali analýzu štatistickej sily. Zistili sme, že na identifikáciu prognostického markera porovnateľného s MELD bolo potrebné zaradiť najmenej 46 pacientov. V súbore sme boli schopní potvrdiť prediktívnu hodnotu MELD aj elasticity pečene aj pri tomto počte pacientov.
Záver
Záverom je možné konštatovať, že u pacientov s klinicky diagnostikovanou cirhózou sme nezistili klinický význam merania obehových časov pečene. Naopak, ukázali sme, že meranie elasticity pečene môže mať klinický význam v odhade prirodzeného priebehu cirhózy a jej prognostická hodnota je porovnateľná s MELD.
S podporou grantu VEGA V-13–004–00.
MUDr. Tomáš Koller, PhD.
koller.tomas@gmail.com
V. interná klinika LF UK a UN Bratislava – Nemocnica Ružinov,
Slovenská republika
www.fmed.uniba.sk
Doručeno do redakce 1. 12. 2015
Přijato po recenzi 1. 2. 2016
Zdroje
1. Mokdad A, Lopez AD, Shahraz S et al. Liver cirrhosis mortality in 187 countries between 1980 and 2010: a systematic analysis. BMC Med 2014; 12 : 145. Dostupné z DOI: <http://dx.doi.org/10.1186/s12916–014–0145-y>.
2. Blachier M, Leleu H, Peck-Radosavljevic M et al. The burden of liver disease in Europe: a review of available epidemiological data. J Hepatol 2013; 58(3): 593–608.
3. Zpráva o zdraví obyvatel České republiky (2014). Ministerstvo zdravotnictví České republiky. Dostupné z WWW: <http://www.mzcr.cz/verejne/dokumenty/zprava-o-zdravi-obyvatel-ceske-republiky2014-_9420_3016_5.html>.
4. Maniecka-Bryła I, Bryła M, Bryła P et al. The burden of premature mortality in Poland analysed with the use of standard expected years of life lost. BMC Public Health 2015; 15 : 101. Dostupné z DOI: <http://dx.doi.org/10.1186/s12889–015–1487-x>.
5. D´Amico G. Natural History and Stages of Cirrhosis. In: De Franchis R, Dell´Era A (eds.) Variceal Hemorrhage. Springer Science + Bussiness Media: New York 2014 : 203–210. ISBN 978–1493900015.
6. Jepsen P, Ott P, Andersen PK et al. Clinical course of alcoholic liver cirrhosis: a Danish population-based cohort study. Hepatology 2010; 51(5): 1675–1682.
7. Kitson MT, Roberts SK, Colman JC et al. Liver stiffness and the prediction of clinically significant portal hypertension and portal hypertensive complications. Scand J Gastroenterol 2015; 50(4): 462–469.
8. Kim MY, Suk KT, Baik SK et al. Hepatic Vein Arrival Time as Assessed by Contrast-Enhanced Ultrasonography Is Useful for the Assessment of Portal Hypertension in Compensated Cirrhosis. Hepatology 2012; 56(3): 1053–1062.
9. Berzigotti A, Reverter E, Garcia-Criado A et al. Reliability of the estimation of total hepatic blood flow by Doppler ultrasound in patients with cirrhotic portal hypertension. J Hepatol 2013; 59(4): 717–722.
10. Koller T, Kindlová J, Šturdík I et al. Prognostické indexy cirhózy a ich vzťah k prirodzenému priebehu a k príčinám úmrtia pacientov s cirhózou v slovenskej populácii pred érou transplantácie pečene. Trendy v hepatológii 2013; 5(1): 26.
11. Marcellin P, Gane E, Buti M et al. Regression of cirrhosis during treatment with tenofovir disoproxil fumarate for chronic hepatitis B: a 5-year open-label follow-up study. Lancet 2013; 381(9865): 468–475.
12. von Herbay A, Vogt C, Willers R et al. Real-time imaging with the sonographic contrast agent SonoVue: differentiation between benign and malignant hepatic lesions. J Ultrasound Med 2004; 23(12): 1557–1568.
13. Lim KP, Taylor-Robinson SD, Patel N et al. Hepatic vein transit times using a microbubble agent can predict disease severity non-invasively in patients with hepatitis C. Gut 2005; 54(1): 128–133.
14. Sugimoto H, Kaneko T, Hirota M et al. Earlier hepatic vein transit-time measured by contrast ultrasonography reflects intrahepatic hemodynamic changes accompanying cirrhosis. J Hepatol 2002; 37(5): 578–583.
15. Pedersen JF, Larsen V, Bytzer P et al. Hepatic transit time of ultrasound contrast in biopsy characterized liver disease. Acta Radiol 2005; 46(6): 557–560.
16. Li N, Ding H, Fan P et al. Intrahepatic transit time predicts liver fibrosis in patients with chronic hepatitis B: quantitative assessment with contrast-enhanced ultrasonography. Ultrasound Med Biol 2010; 36(7): 1066–1075.
17. Liu GJ, Lu MD. Diagnosis of liver cirrhosis with contrast-enhanced ultrasound. World J Radiol 2010; 2(1): 32–36.
18. Zhang CX, Hu J, Hu KW et al. Noninvasive analysis of portal pressure by contrast-enhanced sonography in patients with cirrhosis. J Ultrasound Med 2011; 30(2): 205–211.
19. Amat-Roldan I, Berzigotti A, Gilabert R et al. Assessment of Hepatic Vascular Network Connectivity with Automated Graph Analysis of Dynamic Contrast-enhanced US to Evaluate Portal Hypertension in Patients with Cirrhosis: A Pilot Study. Radiology 2015, 277(1): 268–276.Dostupné z DOI: <http://dx.doi.org/10.1148/radiol.2015141941>.
20. Hong WK, Kim MY, Baik SK et al. The usefulness of non-invasive liver stiffness measurements in predicting clinically significant portal hypertension in cirrhotic patients: Korean data. Clin Mol Hepatol 2013; 19(4): 370–375.
21. Kuo YH, Lu SN, Hung CH et al. Liver stiffness measurement in the risk assessment of hepatocellular carcinoma for patients with chronic hepatitis. Hepatol Int 2010; 4(4): 700–706.
22. Robic MA, Procopet B, Metivier S et al. Liver stiffness accurately predicts portal hypertension related complications in patients with chronic liver disease: a prospective study. J Hepatol 2011; 55(5): 1017–1024.
23. Reiberger T, Ferlitsch A, Payer BA et al. Noninvasive screening for liver fibrosis and portal hypertension by transient elastography – a large single center experience. Wien Klin Wochenschr 2012; 124(11–12): 395–402.
24. Kim SU, Lee JH, Kim DY et al. Prediction of liver-related events using fibroscan in chronic hepatitis B patients showing advanced liver fibrosis. PLoS One 2012; 7(5): e36676. Dostupné z DOI: <http://dx.doi.org/10.1371/journal.pone.0036676>.
25. Singh S, Fujii LL, Murad MH et al. Liver stiffness is associated with risk of decompensation, liver cancer, and death in patients with chronic liver diseases: a systematic review and meta-analysis. Clin Gastroenterol Hepatol 2013; 11(12): 1573 -1584.e1–2; quiz e88–9. Dostupné z DOI: <http://dx.doi.org/10.1016/j.cgh.2013.07.034>.
26. Hall A, Germani G, Isgro G et al. Fibrosis distribution in explanted cirrhotic livers. Histopathology 2012; 60(2): 270–277.
27. Singal AK, Kamath PS. Model for End-stage Liver Disease. J Clin Exp Hepatol 2013; 3(1): 50–60.
28. Fejfar T, Safka V, Hulek P et al. MELD score in prediction of early mortality in patients suffering refractory ascites treated by TIPS. Vnitř Lék 2006; 52(9): 771–776.
29. Louvet A, Labreuche J, Artru F et al. Combining Data From Liver Disease Scoring Systems Better Predicts Outcomes of Patients With Alcoholic Hepatitis. Gastroenterology 2015; 149(2): 398–406.e8; quiz e16–7. Dostupné z DOI: <http://dx.doi.org/10.1053/j.gastro.2015.04.044>.
30. Kraja B, Sina M, Mone I et al. Predictive Value of the Model of End-Stage Liver Disease in Cirrhotic Patients with and without Spontaneous Bacterial Peritonitis. Gastroenterol Res Pract 2012; 2012 : 539059. Dostupné z DOI: <http://dx.doi.org/10.1155/2012/539059>.
31. Alessandria C, Ozdogan O, Guevara M et al. MELD score and clinical type predict prognosis in hepatorenal syndrome: relevance to liver transplantation. Hepatology 2005; 41(6): 1282–1289.
32. Ripoll C, Groszmann R, Garcia-Tsao G et al. Hepatic Venous Pressure Gradient Predicts Clinical Decompensation in Patients With Compensated Cirrhosis. Gastroenterology 2007; 133(2): 481–488.
33. Umemura T, Shibata S, Sekiguchi T et al. Serum sodium concentration is associated with increased risk of mortality in patients with compensated liver cirrhosis. Hepatol Res 2015; 45(7): 739–744.
34. Sembera S, Jirkovsky V, Fejfar T et al. Survival of patients after TIPS in the University Hospital Hradec Kralove. Vnitř Lék 2011; 57(12): 1038–1044.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2016 Číslo 5- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
-
Všechny články tohoto čísla
- Cystická fibróza – editorial
- Imunitní systém a zpracování informací – editorial
- Význam merania obehových časov a elasticity pečene v porovnaní s MELD pri odhade jednoročného rizika nepriaznivého priebehu klinicky diagnostikovanej cirhózy
- Diagnostika cystické fibrózy u dospělých
- Účinnost léčby lokální reziduální neoplazie za standardizovaných podmínek
- Hyperkalcemie, příznaky, diferenciální diagnostika a léčba aneb důležitost vyšetřování kalcia
- Idiopatické střevní záněty jako protrombotický stav
- Klinické dôsledky syndrómu polycystických ovárií
- Léčba rituximabem jako výzva k prevenci infekčních komplikací
- Dokáže rybí olej zlepšit hojení ran v chirurgii?
- Využití nových léků v primoterapii mnohočetného myelomu
-
Richard Rokyta, Cyril Höschl (eds).
Bolest a regenerace v medicíně -
Milan Halenka, Zdeněk Fryšák.
Atlas ultrasonografie štítné žlázy -
Petra Svozílková et al.
Uveitidy v kazuistikách
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Hyperkalcemie, příznaky, diferenciální diagnostika a léčba aneb důležitost vyšetřování kalcia
- Diagnostika cystické fibrózy u dospělých
- Dokáže rybí olej zlepšit hojení ran v chirurgii?
- Význam merania obehových časov a elasticity pečene v porovnaní s MELD pri odhade jednoročného rizika nepriaznivého priebehu klinicky diagnostikovanej cirhózy
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



