-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Kazuistika získané hemofilie A
Case history acquired haemophilia A
Acquired haemophilia A is a rare form of acquired coagulopathy caused by autoantibodies against coagulation factor VIII. It is characterized by major bleeding complications often life – threatening. An estimated incidence is about 1 – 2 cases per million inhabitants per year. The authors report case history of acquired haemophilia in 85 year old woman. Bleeding complications were well controled by bypassing agents. Inhibitor eradication was successful after the use of second line agent rituximab.
Key words:
acquired haemophilia A – factor VIII inhibitor – rituximab
Autoři: Z. Čermáková 1; R. Hrdličková 2; Š. Blahutová 2; A. Ligová 3
Působiště autorů: Lékařská fakulta OU Ostrava, děkan doc. MU Dr. Jaroslav Horáček, CSc. 1; Krevní centrum FN Ostrava, přednostka prim. MU Dr. Zuzana Čermáková, Ph. D. 2; Ústav klinické hematologie Lékařské fakulty OU a FN Ostrava, přednosta prim. MU Dr. Jaromír Gumulec 3
Vyšlo v časopise: Vnitř Lék 2013; 59(4): 313-316
Kategorie: Kazuistiky
Souhrn
Získaná hemofilie A je vzácná forma získané koagulopatie, vyvolaná protilátkami inhibujícími aktivitu koagulačního faktoru VIII. Je charakterizována závažným, mnohdy život ohrožujícím krvácením. Četnost onemocnění je asi 1 – 2 případy na 1 milion obyvatel ročně. Autoři představují kazuistiku získané hemofilie A u ženy ve věku 85 let. Krvácivé epizody byly efektivně zvládnuty preparáty s bypassovou aktivitou. Eradikace inhibitoru faktoru VIII byla úspěšná při použití 2. linie léčby rituximabem.
Klíčová slova:
získaná hemofilie A – inhibitor faktoru VIII – rituximabÚvod
Získaná hemofilie A je vzácné život ohrožující onemocnění způsobené autoprotilátkami inhibujícími aktivitu koagulačního faktoru VIII (F VIII). Četnost výskytu činí 1 – 2 případy na 1 milion obyvatel ročně; nejvíce případů onemocnění je popisováno u žen ve fertilním věku v souvislosti s graviditami a porody a u osob starších 68 let [1]. Ačkoliv je získaná hemofilie často asociována se základní diagnózou, nejčastěji autoimunitní chorobou, malignitou (solidní tumory, lymfoproliferace), graviditou, event. indukcí léky, téměř u 50 % nemocných se nepodaří příčinu odhalit [2]. Na rozdíl od vrozené hemofilie pacienti mnohem méně krvácejí do kloubů, v klinických projevech dominují rozsáhlé podkožní hematomy, krvácení do měkkých tkání, svalů a sliznic, hematurie, závažné krvácení do gastrointestinálního traktu a centrálního nervového systému. Výskyt těžkého a život ohrožujícího krvácení je častý (90 %), mortalita 3 – 33 %, resp. 8 – 22 % má v posledních letech se zlepšením diagnostiky a dostupnosti léčby klesající tendenci [3,4]. Přesto existuje skupina pacientů, podle různých údajů 6 – 33 %, kteří nekrvácejí, případně mají jen minimální příznaky, léčbu nevyžadují a jediným projevem tohoto onemocnění jsou patologické hodnoty výsledků laboratorních vyšetření [3,5].
V laboratorních výsledcích základních koagulačních testů je detekováno izolované prodloužení hodnoty aktivovaného parciálního tromboplastinového testu (aPTT), resp. jeho poměru aPTT - R na 2 – 3násobek při normálních hodnotách protrombinového času i trombinového času. Korekčním testem je možno odlišit deficit koagulačních faktorů tzv. vnitřní cesty od přítomnosti inhibitoru specifického i nespecifického (lupus antikoagulans). Principem testu je korekce koagulační odchylky přidáním normální „zdravé“ směsné plazmy v případě deficitu koagulačních faktorů a přetrvávání patologického výsledku v případě inhibitoru. Vyšetření je provedeno ihned a po 2hodinové inkubaci při 37 °C, jelikož specifický inhibitor F VIII je časově závislý. Dalším krokem je vyšetření aktivity F VIII. Při dostupnosti tohoto testu v místní laboratoři je vhodné (z důvodu časové úspory) u podezření na diagnózu získané hemofilie provést tento test souběžně s testem korekčním. Aktivita F VIII je v přítomnosti specifického inhibitoru nízká, většinou pod 1 %, nicméně ani méně významné snížení F VIII diagnózu nevylučuje. Nakonec je nutná kvantifikace inhibitoru F VIII. Titr se uvádí v Bethesda jednotkách (B.U.); 1 B.U. je množství inhibitoru, které během inkubace inaktivuje 50 % nabídnutého faktoru. Toto vyšetření bývá dostupné obvykle jen ve specializovaných koagulačních laboratořích. Aktivita F VIII a výše titru specifického inhibitoru často nekorelují se závažností a intenzitou klinických projevů [5,6].
V léčbě získané hemofilie je nutný komplexní přístup – zástava krvácení, eradikace inhibitoru a léčba případného vyvolávajícího onemocnění. K zvládnutí krvácivých komplikací jsou k dispozici 2 preparáty s bypassovou aktivitou – rekombinantní faktor VIIa (rF VIIa, NovoSeven®) v doporučené dávce 90 µg/ kg hmotnosti pacienta à 2 – 3 hod, nebo koncentrát aktivovaného protrombinového komplexu (aPCC, Feiba NF®) v dávce 50 – 100 IU/ kg hmotnosti pacienta à 6 – 12 hod s maximální dávkou 200 IU/ kg/ den [2,5]. Oba léky se podávají opakovaně do zástavy krvácení. Odpověď na hemostatickou terapii je sledována zejména klinicky, neexistuje specifický laboratorní test monitorující účinnost bypassové léčby. Výsledky obou preparátů jsou srovnatelné, a pokud se nedaří zvládnout krvácení jedním z nich, je možná jejich vzájemná výměna, případně i kombinace [3,5].
Zahájení eradikace inhibitoru je doporučeno ihned po stanovení diagnózy. V první linii se používají kortikoidy – prednison v dávce 1 mg/ kg hmotnosti pacienta na den samostatně nebo lépe v kombinaci s cyklofosfamidem 1 – 2 mg/ kg hmotnosti pacienta na den maximálně po dobu 3 týdnů [2,3,5]. Úspěšnost je udávána 60 – 70 % pro monoterapii kortikoidy a 70 – 80 % pro kombinovanou léčbu [6]. Medián doby dosažení remise představuje při použití tohoto způsobu léčby přibližně 5 týdnů [5]. Pokud po 4 – 6 týdnech imunosuprese nedochází k odpovědi, je doporučeno zvážit druhou linii léčby – rituximab (v dávce 375 mg/ m2 tělesného povrchu pacienta, 4 dávky v týdenních intervalech) samostatně nebo v kombinaci s kortikoidy [2,5]. Jinou alternativou jsou další cytotoxické léky – azathioprin, vinkristin, cyklosporin, mykofenolát.
Kazuistika
Prezentujeme kazuistiku 85leté polymorbidní pacientky hospitalizované na interním oddělení pro celkové zhoršení zdravotního stavu. Pro závažné krvácení do jazyka a spodiny dutiny ústní bylo vyžádáno hematologické konzilium (obr. 1). V osobní anamnéze je uvedena apendektomie v mládí, jeden porod, hysterektomie a parciální ovarektomie pro myom ve 44 letech a cholecystektomie v 50 letech, operace katarakty oboustranně, hypertenze III. stupně, ischemická choroba srdeční, stav po ischemické cévní mozkové příhodě bez neurologického deficitu, spondylartróza a spondylolistéza, kořenový iritační syndrom, hiátová hernie s ezofagitidou a glaukom. Pacientka v minulosti neudávala žádné krvácivé komplikace, rovněž rodinná anamnéza je negativní ve vztahu k vrozeným krvácivým chorobám. Při klinickém vyšetření byly dále nalezeny i poměrně rozsáhlé podkožní hematomy a trvale prosakující krev z drobné kožní exkoriace na krku. Z léků ovlivňujících hemostázu pacientka užívala pouze ticlopidin. Ostatní medikace: Fentanyl náplast, Lozap H, Concor COR, Betahistin Ratiofarm, Tanakan, Helicid, Vigantol gtt, Aricept, Betatopic gtt. Úvodní laboratorní výsledky (tab. 1) prokázaly mírnou normocytární normochromní anémii (Hgb 115 g/ l, Hct 0,35) a počet leukocytů a trombocytů bez nálezu patologických hodnot. V koagulačních testech bylo prodloužené aPTT - R na 4,1, protrombinový test, fibrinogen a antitrombin byly v normě. Při vyšetření korekčního testu nedošlo k úpravě hodnot aPTT po přidání normální plazmy. Trombinovým testem a vyšetřením anti‑Xa byla vyloučena event. přítomnost heparinu. Došetření koagulačních faktorů, ovlivňujících aPTT jednofázovou metodou pomocí aPTT reagencie středně citlivé na lupus antikoagulans (APTT - XL, Pacific hemostasis) a faktor deficitních plazem (DG - VIII, DG - IX, DG - XI a DG - XII, Grifols), odhalilo výrazně sníženou aktivitu F VIII (F VIII:C) – 0,9 %. Nižší byly i aktivity dalších faktorů: F IX:C 47,7 %, F XI:C 52,7 % a F XII:C 38,7 %. K vyloučení vlivu lupus antikoagulans byla stanovena F VIII:C i aPTT reagencií necitlivou k LA (Actin FS, Siemens) – 1,9 %. Nicméně paralelně byla potvrzena i přítomnost lupus antikoagulans konfirmačním testem (destičkový neutralizační test – PNP). Specifický inhibitor F VIII byl definován aktivitou 13,6 B.U. Na základě klinických projevů a výsledků provedených laboratorních vyšetření byla u pacientky stanovena diagnóza získané hemofilie A za současné přítomnosti lupus antikoagulans. Léčba pacientky byla zahájena podáním 3 dávek rFVIIa (NovoSeven®) v dávce 90 µg/ kg hmotnosti pacientky à 3 hod 1. den (celkem 3 dávky), 2. den bylo pokračováno dvěma aplikacemi koncentrátů faktorů aPCC (Feiba NF®) v dávce 85 IU/ kg hmotnosti v intervalu à 12 hod, což vedlo k zástavě krvácení a výrazné regresi otoku jazyka a sliznic dutiny ústní. Nové krvácivé projevy v 6., 11. a 17. dnu od stanovení diagnózy (2krát rozsáhlé podkožní hematomy na horních končetinách, 1krát na zádech a dolní končetině) byly řešeny podáním koncentrátů faktorů aPCC (Feiba NF®) v dávce 85 IU/ kg hmotnosti pacientky jednorázově, ve 2 případech s opakováním po 12 hod. Od 1. dne diagnózy byla zavedena kombinovaná imunosupresivní terapie s cílem eradikovat inhibitor F VIII: Solu - Medrol (metylprednisolon) 500 mg i.v. první 3 dny, dále pokračováno Prednisonem (prednison) 1 mg/ kg hmotnosti pacientky denně (50 mg/ den) p.o. a Cyclophosphamidem (cyklofosfamid) 1 mg/ kg hmotnosti pacientky denně (50 mg/ den) p.o. I když nedocházelo k poklesu titru inhibitoru, byla po úvodních 14 dnech zahájena pomalá redukce dávky Prednisonu o 5 – 10 mg za týden až na hodnotu 20 mg/ den s ohledem na věk pacientky a přidružené diagnózy (hypertenze, glaukom, osteoporóza, výrazná kožní atrofie). Pět týdnů od zahájení léčby se hodnoty inhibitoru faktoru VIII pohybovaly v hodnotách 10,4 – 13 B.U., pouze jednou zachycena hodnota titru 7,6 B.U. (graf 1). Vzhledem k neuspokojivým výsledkům první linie léčby bylo 35. den od jejího zahájení rozhodnuto zastavit podávání cyklofosfamidu a začít s aplikací 4 cyklů MabThery (rituximabu) 375 mg/ m2 tělesného povrchu pacientky v týdenních intervalech s pokračováním podávání Prednisonu 20 mg/ den. I během tohoto období ještě byly opakovaně podávány koncentráty faktorů aPCC pro 3 dny trvající hematurii (4 dávky faktorů aPCC v dávce 85 IU/ kg hmotnosti pacientky à 12 hod první 2 dny a následně v dávce 50 IU/ kg hmotnosti pacientky à 6 hod jeden den), dále pro nestavitelné krvácení z drobné ranky na prstu ruky (jednorázově 85 IU/ kg hmotnosti pacientky) a pro nové hematomy na dolních i horních končetinách (jednorázově 85 IU/ kg hmotnosti pacientky). Poslední krvácení se u pacientky objevilo následující den po aplikaci 4. dávky rituximabu. Během hospitalizace byla pacientka přeléčena pro infekci močových cest s febriliemi a bronchopneumonii s odpovídajícím nálezem na RTG plic kombinací širokospektrých antibiotik a antimykotik. Malignita nebyla prokázána. Z autoimunitních chorob byla nalezena pouze laboratorní přítomnost lupus antikoagulans bez orgánového postižení. Celkové remise s normalizací aktivity faktoru VIII (54,7 %), normalizací aPTT, poklesem inhibitoru F VIII na 0,1 B.U. i vymizením lupus antikoagulans bylo u naší pacientky dosaženo po 128 dnech od stanovení diagnózy (graf 1). Vzhledem k hodnotám aPTT jsme u pacientky již dále nekontrolovali v úvodu zřejmě jen in vitro snížené F IX:C, F XI:C, F XII:C.
Obr. 1. Krvácení do jazyka a spodiny dutiny ústní. 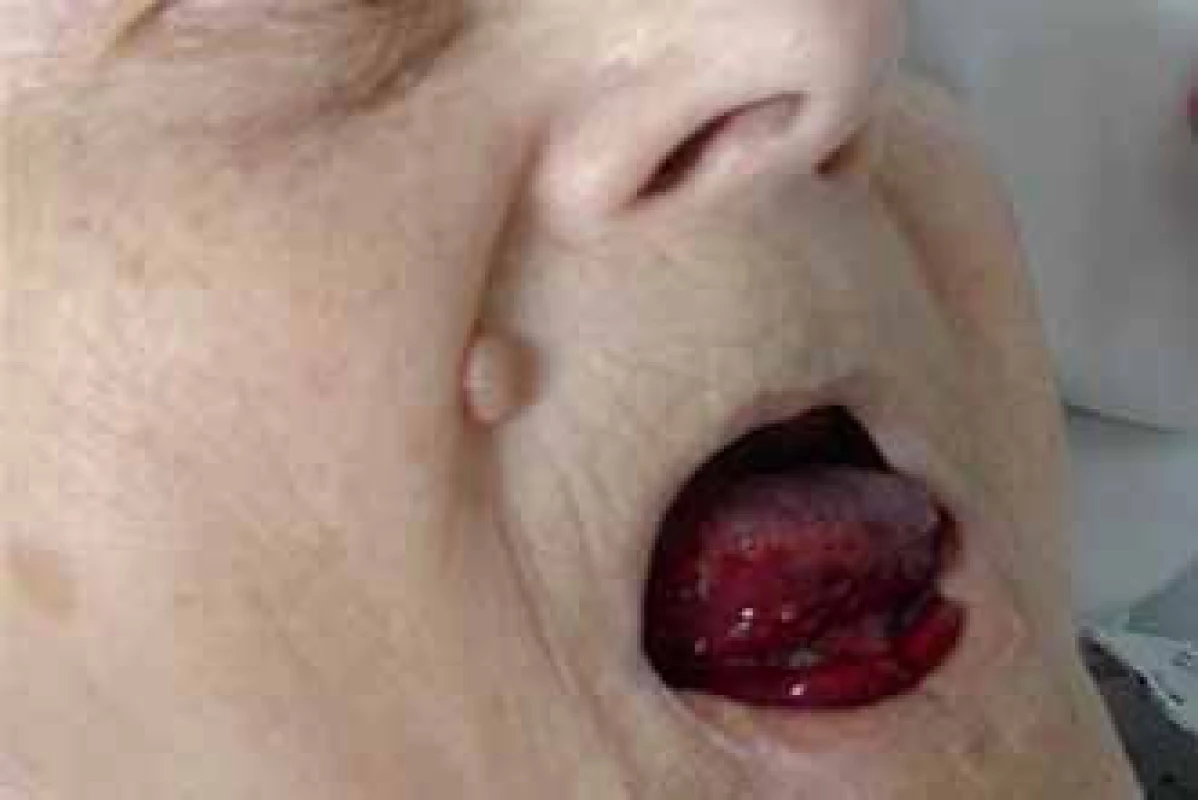
Tab. 1. Laboratorní výsledky při stanovení diagnózy získané hemofilie A, během léčby a po léčbě. 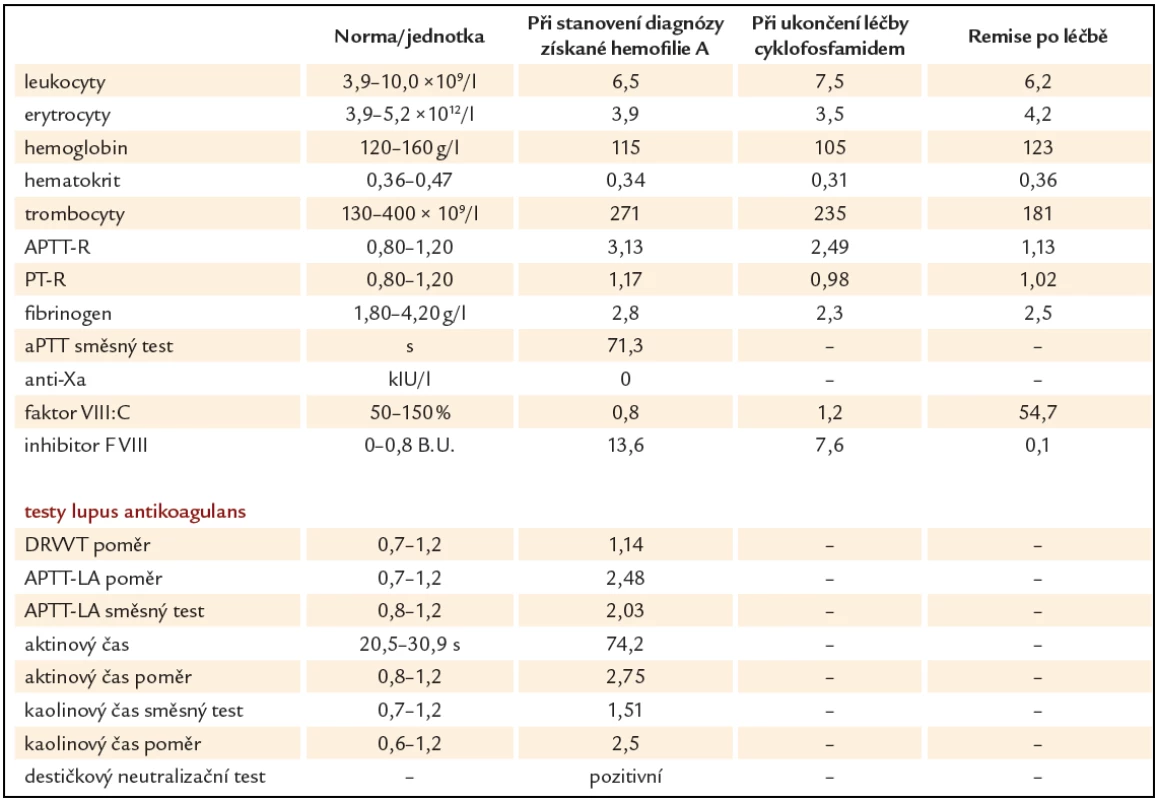
Graf 1. Časový průběh inhibitoru F VIII a F VIII. 
Diskuze
Získaná hemofilie A je relativně vzácné onemocnění vzniklé na autoimunitním podkladě. V patogenezi se uplatňuje vazba protilátky na některé z funkčních míst F VIII, následně znemožnění vazby F VIII na F IX a F X, interferenci s vazbou F VIII na von Willebrandovův faktor, případně interferenci s vazbou F VIII na fosfolipidy. Nejčastěji se jedná o imunoglobuliny třídy IgG, vzácně IgM nebo IgA [8]. Mechanizmus vzniku inhibitoru není plně objasněn. V klinickém obraze pacientů dominují závažné, často i život ohrožující krvácivé komplikace, které nemusejí korelovat s aktivitou faktoru VIII a titrem inhibitoru. Riziko zakrvácení trvá po celou dobu přítomnosti inhibitoru. U některých pacientů může být i klinicky asymptomatický průběh, případně mají jen minimální příznaky nevyžadující terapii. V laboratorních nálezech je přítomno prodloužené aPTT bez úpravy v korekčním testu po 2hodinové inkubaci s normální plazmou, diagnóza je určena stanovením F VIII:C a inhibitoru F VIII Bethesda metodou, v případě nízkého titru je přesnější jeho stanovení Nijmegen modifikací. V diferenciální diagnóze je nutno odlišit nespecifický inhibitor lupus antikoagulans, léčbu a případné předávkování heparinem, event. i jinými antikoagulačními léky. V terapii závažných krvácivých komplikací je doporučeno použití preparátů s bypassovou aktivitou rFVIIa nebo koncentrát aPCC, při nezvladatelných krváceních je možná i jejich kombinace. Součástí léčby je eradikace inhibitoru lépe kombinovanou imunosupresí kortikoidy s cyklofosfamidem v 1. linii léčby, v případě selhání po 5 – 6 týdnech je volena 2. line léčby – kortikoidy v kombinaci s jiným imunosupresivem (nejčastěji cyklosporinem A) nebo rituximabem (monoklonální protilátka anti‑CD20).
V uvedené kazuistice byl u pacientky kromě specifického inhibitoru F III prokázán i lupus antikoagulans, který se pravděpodobně spolu s reakcí inhibitoru F VIII s F VIII přítomným v použité faktor deficitní plazmě podílel na in vitro snížení F IX:C, F XI:C a F XII:C. Krvácivé komplikace byly dobře zvládnuty preparáty s bypassovou aktivitou rFVIIa použitým v úvodu léčby v dávce 90 µg/ kg hmotnosti pacientky à 3 hod 1. den i koncentrátem aPCC v dalším průběhu v dávce 85 IU/ kg hmotnosti 2krát denně, což je v souladu s mezinárodními doporučeními [3,5]. Na méně závažné krvácivé projevy byla použita také jednorázová aplikace. Pouze při hematurii jsme byli nuceni aplikovat koncentráty aPCC 3 dny za sebou a jako účinnější se nám jevil režim 50 IU/ kg hmotnosti pacientky à 6 hod než 85 IU/ kg hmotnosti 2krát denně. S eradikací inhibitoru faktoru VIII jsme byli úspěšní až v druhé linii léčby při použití rituximabu.
Závěr
V rámci diferenciální diagnostiky prodlouženého aPTT testu zejména u staršího pacienta s nově vzniklým krvácením je nutno uvažovat i o diagnóze získané hemofilie. Neodhalení problému může vést k fatálním krvácivým komplikacím. Naše pacientka dobře reagovala na přípravky s bypassovou aktivitou (rVIIa a faktory aPCC), s eradikací inhibitoru faktoru VIII jsme byli úspěšní až v 2. linii léčby. Použití rituximabu i v tak vysokém věku se kromě dobře zvládnutých febrilních infektů obešlo bez dalších komplikací.
prim. MU Dr. Zuzana Čermáková, Ph.D.
www.fno.cz
e‑mail: zuzana.cermakova@fno.cz
Doručeno do redakce: 16. 10. 2012
Přijato po recenzi: 12. 2. 2013
Zdroje
1. Hay CR, Brown S, Collins PW et al. The diagnosis and management of factor VIII and IX inhibitors: a guidline from the United Kingdom Haemophilia Centre Doctors’ Organization. Br J Haematol 2006; 133 : 591 – 605.
2. Huth-Kuhne A, Baudo F, Collins P et al. International recommendations on the diagnosis and treatment of patients with acquired hemophilia A. Haematologica 2009; 94 : 566 – 575.
3. Sborov DW, Rodgers GM. Acquired hemophilia A: a curent review of autoantibody disease. Clin Adv Hematol Oncol 2012; 10 : 19 – 27.
4. Holme PA, Brosstad F, Tjønnfjord GE. Acquired haemophilia: management of bleeds and immune therapy to eradicate autoantibodies. Haemophilia 2005; 11 : 510 – 515.
5. Collins P, Baudo F, Huth - Kuhne A et al. Consensus recommendations for the diagnosis and treatment of acquired hemophilia A. BMC Research Notes 2010; 3 : 161.
6. Smejkal P, Buliková A, Chlupová G et al. Získaná hemofilie A. Vnitř Lék 2012; 58 : 571 – 578.
7. Collins PW, Hirsch S, Baglin TP et al. Acquired hemophilia A in the United Kingdom: 2‑year national surveillance study by the United Kingdom Haemophilia Centre Doctors’ Organization. Blood 2007; 109 : 1870 – 1877.
8. Buliková A, Smejkal P, Zavřelová J et al. Získané inhibitory krevního srážení. Interní Med 2008; 10 : 336 – 339.
Štítky
Diabetologie Endokrinologie Interní lékařství Chirurgie všeobecná Intenzivní medicína Kardiologie Onkologie Urgentní medicína Laboratoř
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2013 Číslo 4- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Magnosolv a jeho využití v neurologii
-
Všechny články tohoto čísla
- Krátká baterie pro testování fyzické zdatnosti seniorů – editorial
- Dálková monitorace implantabilních přístrojů v kardiologii – editorial
- Aortální stenóza – editorial
- Aortální stenóza – editorial
- Změny hmotnosti a kompenzace diabetu (HbA1c) u nemocných s diabetes mellitus 2. typu po přidání exenatidu (Byetta) ke stávající léčbě ve 28 diabetologických ambulancích v ČR – studie BIBY‑II (sledování 24 měsíců)
- „Krátká baterie pro testování fyzické zdatnosti seniorů“ – pilotní studie a validizace testu u starších osob v České republice
- Kteří příbuzní prvního stupně nemocných s kolorektálními neoplaziemi jsou nejvíce ohroženi
- Přínos systému vzdáleného sledování v dlouhodobé péči o pacienty s implantabilními kardiovertery‑ defibrilátory
- Aortální stenóza
- Tuberkulóza v České republice. Současný stav. Diagnóza, léčba, prevence
- Perindopril v léčbě hypertenze a kardiovaskulárních chorob: evoluce pokračuje orodisperzní formou
- Oxidační stres u pacientů po transplantaci ledviny
- PET-CT dokumentovaný rychlý nástup léčebné odpovědi cyklofosfamidu, thalidomidu a dexametazonu u multicentrické formy Castlemanovy nemoci. Popis případu a přehled informací o léčbě
- Kazuistika získané hemofilie A
- Metastázy do plic jako první projevy okultního medulárního mikrokarcinomu
- Využití vildagliptinu z pohledu interního lékaře
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Aortální stenóza
- Metastázy do plic jako první projevy okultního medulárního mikrokarcinomu
- „Krátká baterie pro testování fyzické zdatnosti seniorů“ – pilotní studie a validizace testu u starších osob v České republice
- Perindopril v léčbě hypertenze a kardiovaskulárních chorob: evoluce pokračuje orodisperzní formou
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



