-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Využití „label-free“ proteinových čipů pro proteomiku onkohematologických onemocnění
Use of label-free protein chips for proteomics of oncohematological diseases
Despite great advances in our understanding of the molecular basis of many diseases, there are still substantial gaps in our understanding of oncohematological diseases as well as in the development of effective strategies for early diagnosis and for treatment. The current interest in proteomics is growing partly due to the prospects that proteomic methods offer and hopefully overcome limitations of other approaches. At the Institute of Hematology and Blood Transfusion the proteomics of oncohematological diseases, especially myelodysplastic syndrome and chronic myeloid leukaemia, has been studied. This work gives an overview of development and importance of proteomics for studying the oncohematological diseases. Furthermore, it introduces several new methods applied in proteomics, deals with problems attached to working with complex biological samples, and at the end describes our latest development of a protein chip with on-line detection using an optical method – the surface plasmon resonance – for characterizing MDS pathogenesis.
Key words:
proteomics – myelodysplastic syndromes – oncohematological diseases – surface plasmon resonance
Autoři: K. Pimková 1,2; J. Suttnar 1; M. Bockova 2; J. Homola 2; J. E. Dyr 1
Působiště autorů: Oddělení biochemie Ústavu hematologie a krevní transfuze Praha, vedoucí oddělení biochemie prof. Ing. Jan E. Dyr, DrSc. 1; Oddělení optických senzorů Ústavu fotoniky a elektroniky Praha, vedoucí oddělení optických senzorů doc. Ing. Jiří Homola, DrSc. 2
Vyšlo v časopise: Vnitř Lék 2012; 58(Suppl 2): 84-89
Kategorie: 60 let Ústavu hematologie a krevní transfuze Praha
Souhrn
Přestože děláme velké pokroky v objasňování molekulární podstaty mnohých onemocnění, stále je zde mnoho nezodpovězených otázek týkajících se patogeneze nádorových onemocnění, případně vývoje efektivních metod pro včasnou diagnostiku a léčbu. Současný zájem o proteomiku vzrůstá částečně i proto, že proteomika nabízí metody, které dokážou překonat nedostatky jiných metod, a zároveň nabízí možnost sledovat procesy, které vedou k patologickým změnám v organizmu v průběhu onemocnění. Tato práce přináší přehled o vývoji a významu proteomiky pro studium onkohematologických onemocnění. Dále pak uvádí přehled nejnovějších metod používaných v proteomice, zabývá se problémy souvisejícími s používáním komplexního biologického materiálu, popisuje využití proteomiky na Ústavu hematologie a krevní transfuze v charakterizaci myelodysplastického syndromu (MDS) a chronické myeloidní leukemie. Na závěr uvádíme naše zkušenosti s vývojem proteinového čipu s on-line detekcí optickou metodou rezonance povrchového plazmonu pro studium patogeneze MDS onemocnění.
Klíčová slova:
proteomika – myelodysplastický syndrom – onkohematologická onemocnění – rezonance povrchového plazmonuÚvod
Proteomika je jednou z disciplín, které se snaží komplexně popsat biologické systémy v rámci takzvaných „omics“ technologií (genomika, transkriptomika, proteomika, metabolomika, fluxonomika a další). Inspirací pro termíny je genomika, která byla takto pojmenována v roce 1986 T. H. Roderickem odvozením z pojmu genom, vytvořeného již ve 20. letech minulého století ze slov gen a chromozom [1]. Pojem proteom byl poprvé použit v roce 1996 k označení souboru bílkovin kódovaných genomem [2]. Zkoumání proteomu – proteomika – zahrnuje nalezení nejen všech bílkovin v organizmu kódovaných DNA, ale i jejich izoforem, (posttranslačních) modifikací, vzájemných interakcí, vytváření komplexů apod., což je vše zahrnováno do tzv. „postgenomické“ éry.
Pro komplexní proteomické experimenty je studium celkového proteomu organizmu zpravidla rozděleno na zkoumání subproteomů definovaných na základě různých kritérií. Může jít o proteom určitého typu buněk, v rámci tohoto subproteomu o proteom glykoproteinů, membránových bílkovin, proteom určitých buněčných organel a podobně [3–5]. Již z tohoto krátkého výčtu je zřejmé, že důležitou součástí proteomického experimentu je příprava vzorku, resp. izolace určitého subproteomu.
Proteomika získává stále větší význam jako disciplína, která zcela jedinečně přispívá k detekci, prevenci a léčbě mnohých onemocnění, např. kardiovaskulárních [6,7] či rakoviny včetně onkohematologických onemocnění [8,9]. I přes řadu nových poznatků, kterými přispěly genomické studie k objasnění patogeneze onkohematologických onemocnění, tyto metody nekorelují s hladinou proteinů a není možné u nich využít biologické tekutiny pro přímou detekci biomarkerů [10–13]. Proteomika překonává tato omezení, bezprostředně podává informace o expresi bílkovin, o jejich izoformách, posttranslačních modifikacích a protein-proteinových komplexech. Zjednodušeně lze říci, že genomika vypovídá o tom, co se může stát, transkriptomika o tom, co vypadá, že se stane, a proteomika vypovídá o tom, co způsobí, že se to stane. Snad největší nevýhodou proteomiky vůči genomice je, že neexistuje amplifikační procedura podobná PCR, která by umožnila pracovat s omezeným množstvím dostupného biologického materiálu. Zvládnutí proteomických postupů také proto vyžaduje věnovat velkou pozornost získávání a zpracování vzorků a vypracování vhodných purifikačních a obohacovacích technik, které je uskutečnitelné pouze na dostatečně vybaveném pracovišti s kvalifikovaným personálem.
Pro rozvoj proteomiky měl zásadní význam nástup několika technologií. Chronologicky to byla nejdříve, v 80. letech minulého století, dvojrozměrná SDS elektroforéza s využitím immobilinů pro izoelektrickou fokusaci v prvním rozměru separace bílkovin, kde ke standardizaci metody zásadně přispěli Görg et al [14]. Další prudký rozvoj proteomiky umožnil na přelomu 80. a 90. let minulého století nástup metod využívajících hmotnostní spektrometrii [15,16], které vycházely z prací nositelů Nobelovy ceny J. B. Fena a K. Tanaky. A konečně, významnou proteomickou technikou se staly proteinové mikroaraye, poprvé použité v roce 2000 pro studium protein-proteinových interakcí, vazby ligandů a obecně biochemických experimentů [17].
Pokud se má proteomika stát metodou významně přispívající k individualizaci péče o pacienta (personalizovaná medicína), musí disponovat prostředky, které poskytují výsledky rychle a z velkého množství vzorků (high throughput systems). Právě proteinové mikroaraye nebo proteinové mikročipy mají z uvedených proteomických metod reálnou šanci stát se takovým diagnostickým systémem, který je navíc kompatibilní s technikami hmotnostní spektrometrie. Proteomické mikročipy využívají v zásadě 2 způsoby detekce: se značenými, nebo neznačenými bílkovinami. V 1. případě jsou zkoumané bílkoviny modifikovány fluorescenčními, radioizotopovými nebo jinými značkami, které lze snadno detekovat široce dostupnými analytickými technikami. Označení bílkovin však často způsobuje změny jejich přirozených funkčních a afinitních vlastností a samotné značení je pracné, časově náročné a mnohdy omezené povahou zkoumaných bílkovin. Ve 2. případě jsou používány systémy nevyžadující značení zkoumaných souborů bílkovin – tzv. „label-free“ metody [18]. Bílkoviny jsou zkoumány se zachováním svých přirozených vlastností a v reálném čase lze určit reakční kinetiky biomolekulárních interakcí. Mezi zástupce label-free metod patří optická metoda rezonance povrchového plazmonu (SPR), SPR zobrazování (SPR imaging), elipsometrie, interferenční techniky atd. V porovnání s metodami využívajícími značení bývají zatím o něco méně citlivé, nicméně obě skupiny technik se rychle vyvíjejí a poskytují vzájemně se doplňující výsledky.
Významným materiálem používaným v proteomických experimentech pro identifikaci a kvantifikaci bílkovin vypovídajících o stavu pacienta je krevní plazma nebo sérum. Do jejího proteomického profilu přispívají všechny orgány, se kterými se v krevním oběhu dostane do kontaktu, a tak vlastně reprezentuje vzorek proteomu podstatné části organizmu. Bílkoviny se v plazmě nacházejí ve velice širokém rozmezí koncentrací (10 a více řádů) a diagnosticky zajímavá bývá zpravidla množina bílkovin o velmi nízké koncentraci. Je zřejmé, že ani dvojrozměrné elektroforetické techniky ani vícerozměrné chromatografické techniky nejsou schopny monitorovat změny málo zastoupených bílkovin na pozadí těch hojně zastoupených, jako jsou albumin, fibrinogen, imunoglobuliny apod. V proteomických experimentech využívajících plazmu jako výchozí materiál je proto možné se zabývat např. subproteomem bílkovin s určitou vlastností, které byly z plazmy izolovány vhodnou imunoafinitní technikou (např. získání glykoproteinů pomocí immobilizovaných lektinů). Hojně zastoupené bílkoviny také bývají pomocí různých metod, nejčastěji opět imunoafinitních, z plazmy odstraněny (depletovány). Takto upravená plazma je vhodným materiálem pro další proteomické experimenty, ve kterých jsou zachovány poměry přítomných bílkovin. Konečně posledním způsobem, jak výchozí plazmatický materiál upravit, je vyrovnání koncentrací všech přítomných bílkovin, pro které se používají peptidové knihovny. V tomto případě ale dochází ke ztrátě informace o vzájemném kvantitativním zastoupení původně přítomných bílkovin.
Proteinové čipy, které pro detekci využívají jak značené, tak neznačené zkoumané soubory bílkovin (proteomů), jsou prostředkem pro stanovení známých proteinových biomarkerů onemocnění včetně onkohematologických a ve spojení s hmotnostní spektrometrií lze i zachycené neznámé bílkoviny (po uvolnění nebo in situ) identifikovat jako nové markery choroby. Pro správnou funkci proteinového čipu je nezbytná kontrola interakcí mezi materiálem jeho povrchu a analyzovanými biomolekulami. Dobře navržený povrch biosenzoru musí zaručit citlivost a selektivitu detekce, pro kterou je nezbytná eliminace nespecifické interakce materiálu vzorku s povrchem senzoru [19–21].
Ačkoli jsou vyvíjeny stále dokonalejší metody snižující nespecifické interakce analytů s povrchem, jedním z prostředků, který může přispět ke snížení nespecifit, je redukce komplexnosti vzorku, v případě krevní plazmy její deplece. Albumin, jako hlavní komponent krevní plazmy, lze odstranit adsorpcí na imunoafinitní kolony nebo na sorbenty s navázanými barvivy, jako je Cibacron Blue [22]. Chromatografie na immobilizovaném heparinu v kombinaci s chromatografií na immobilizovaném proteinu G je rovněž účinnou a ekonomickou strategií pro úpravu plazmy k proteomické analýze [23]. Zřejmě nejrozšířenější metodou deplece krevní plazmy je současné imunoafinitní odstranění nejvíce zastoupených bílkovin plazmy [24], které využívá mnoho komerčních souprav, jako např. Multiple Affinity Removal System Column (MARS, Agilent) [25]. Již zmíněné vyrovnání koncentrací bílkovin pomocí peptidových knihoven bývá realizováno např. komerčním kitem ProteoMiner firmy Biorad, který je založen na hexapeptidové knihovně, jejíž peptidy interagují rovnoměrně s jednotlivými bílkovinami vzorku. Všechny bílkoviny vzorku jsou zachyceny částečkami sorbentu, a protože pro hojně zastoupené bílkoviny je k disposici omezený počet vazebných míst, dochází k jejich rychlému vysycení a nezachycené bílkoviny jsou vymyty [26]. Takto získaný vzorek, který obsahuje zhruba stejné množství všech původně přítomných bílkovin, je použitelný pro různé proteomické experimenty s výjimkou zjišťování kvantitativních informací z původního vzorku.
Uvedené předpoklady o vlivu deplece krevní plazmy na snížení nespecifických interakcí biosenzoru se zkoumaným materiálem jsme testovali na modelové detekci VEGFR-1, markeru myelodysplastického syndromu, pomocí jeho fyziologického protějšku VEGF-A imobilizovaného na povrch SPR senzoru.
Metody
Materiál
Krev byla odebrána do polypropylenových zkumavek s citrátem. Plazma byla získána centrifugací při 14 000× g po dobu 5 min při 15 °C. Všechny vzorky byly získány v souladu s etickou komisí na Ústavu hematologie a krevní transfuze.
Lidský rekombinantní protein VEGF-A a VEGF Recptor-1/Fc chimera byly dodány firmou Sigma-Aldrich (St. Louis, MO). 11-mercapto-tetra(ethyleneglycol)undekanol [HSC11(EG)4OH] a 16-mercapto-hexa(ethyleneglycol)hexadecanová kyselina [HSC11(EG)6OCH2COOH] byly dodány firmou Prochimia (Gdańsk, Poland). Hovězí sérový albumin (BSA) byl získán od firmy Sigma-Aldrich (St. Louis, MO). Ethanolamin hydrochlorid (EA), 3-(ethyliminomethylideneamino)--N,N-dimethylpropan-1-amin (EDC) a 1-hydroxypyrrolidine-2,5-dione (NHS) byly součástí Amine Coupling kitu od firmy Biacore (Uppsala, Sweden). MARS Human 14 (Hu-14) kolona a pufry A a B k ní dodávané byly získány od firmy Agilent (HPST Praha, Czech Republic). Ve všech experimentech byla používána 2krát destilovaná a deionizovaná voda (Milli-Q50, Millipore, Prague, Czech Republic). Všechny ostatní chemikálie byly analytické čistoty.
Pufry: PBS (0,01 M fosfát; 0,138 M chlorid sodný; 0,0027 M chlorid draselný; pH 7,4), SA (0,01 M octan sodný; pH 5,0), PBNa (0,01 M fosfát; 0,75 M chlorid sodný; 0,009 M chlorid draselný; pH 7,4), 10% BSA/PBS (w/w), 0,2% BSA/PBNa (w/w), ACD (0,08 M citrát trojsodný dihydrát; 0,06 M kyselý citrát sodný monohydrát; 0,1 M glukóza).
Deplece plazmy
Byla použita kolona Mars Hu-14 4,6 × 100 mm odstraňující 14 nejhojněji zastoupených bílkovin v lidské krevní plazmě o kapacitě 40 μl krevní plazmy pro analýzu. Byl použit protokol od firmy Agilent, který byl přizpůsoben systému PF2D (Beckman Coulter Praha, Czech Republic). Byly získány 2 frakce: frakce 1 vytékala v pufru A o pH 7,4 a obsahovala málo zastoupené bílkoviny krevní plazmy, zatímco frakce 2 obsahovala vysoce zastoupené bílkoviny uvolněné z kolony kyselým pufrem B (pH 2,5). Obě frakce byly převedeny do PBS pufru, zahuštěny na Amicon filtrech s MWCO o 3 kDa (Millipore, Prague, Czech Republic) a skladovány při –80 °C do doby použití.
Biosenzor s povrchovými plazmony
Pro detekci depletovaných vzorků byl používán 4kanálový SPR senzor s modulací vlnové délky (SPR biosenzor) optimalizovaný v Oddělení optických senzorů Ústavu fotoniky a elektroniky Akademie věd. Princip SPR metody je založen na měření malých změn indexu lomu média v těsné blízkosti kovového povrchu senzoru. Tyto změny mohou být způsobeny navázáním analytu na jeho biospecifického partnera ukotveného na zlatém povrchu senzoru. U použitého SPR biosenzoru dopadá polychromatické záření z halogenové lampy, které bylo zkolimované a polarizované, na vlastní senzorovou část skládající se z optického hranolu a skleněného čipu pokrytého tenkým titanovým filmem (~2 nm) a vrstvou zlata (~55 nm). Po dopadu světlo excituje povrchový plazmon ve 4 různých místech na zlatém čipu (4 oddělené kanály). Odražené světlo je odvedeno 4 optickými vlákny do 4kanálového spektrografu. Spektra jsou analyzována v reálném čase s pomocí speciálního softwaru s vyhodnocováním rezonanční vlnové délky nezávisle pro každý kanál. Pro přivedení vzorků k povrchu senzoru je použita peristaltická pumpa (Ismatech, Švýcarsko). V této práci byl použit nedávno vyvinutý fluidický systém přivádění vzorků k povrchu, který má 2 oddělené vstupy do jednotlivých kanálů na povrchu čipu. Umožňuje přepínat mezi analyzovaným komplexním vzorkem (plazma) a protékajícím pufrem, a účinně tak průběžně snižuje nespecifickou odezvu senzoru a umožňuje detekci vzorku o nižších koncentracích [27]. Všechny experimenty byly prováděny při teplotě 25 °C a průtoku 30 μl/min (pokud není uvedeno jinak).
SPR detekce plné a depletované plazmy
Plná plazma byla naředěna 10krát PBS s 2% BSA, což odpovídá 10% koncentraci (w/w) proteinů vzhledem k plazmě plné. Plazma depletovaná byla po zahuštění doplněna na takový objem, aby koncentrace málo zastoupených proteinů ve frakci 1 i hojně zastoupených proteinů ve frakci 2 odpovídala 10% koncentraci u každé skupiny proteinů vzhledem k jejich původní koncentraci v plné plazmě. BSA je do plazmy i protékajícího pufru přidáván z důvodu kontinuálního vyblokovávání volných míst na povrchu senzoru, čímž snižuje nespecifickou interakci proteinů plazmy s povrchem. Plazma byla přiváděna k povrchu v 10–30vteřinových cyklech prokládaných 30vteřinovými cykly s protékajícím pufrem (2% BSA/PBNa) pro odstranění nespecificky navázaných proteinů. Celkový čas kontaktu plazmy s povrchem byl tedy 5 min.
Ukotvení VEGF-A a detekce VEGFR-1
Postup imobilizace VEGF-A a detekce VEGFR-1 již byly popsány dříve [28]. Krátce očištěný zlatý SPR čip byl pokrytý vrstvou alkylthiolů zakončených karboxylovou skupinou. VEGF-A (o koncentraci 2 μg/ml v PBS) byl ukotven na povrchu senzoru pomocí kovalentní amidové vazby s aktivovanými karboxylovými skupinami alkanethiolů (aktivované 1 : 1 směsí NHS a EDC). Místa neobsazená proteinem VEGF-A byla dovysycena BSA (0,5 mg/ml) v SA pufru. PBNa pufr o vysoké iontové síle byl použit na odmytí nekovalentně vázaného VEGF-A a BSA. Zbylé karboxylové skupiny byly deaktivovány 1M EA (obr. 1).
Obr. 1. Odezva SPR senzoru na imobilizaci vaskulárního endoteliálního růstového faktoru A (VEGF-A) a BSA na aktivovaný povrch SPR čipu. 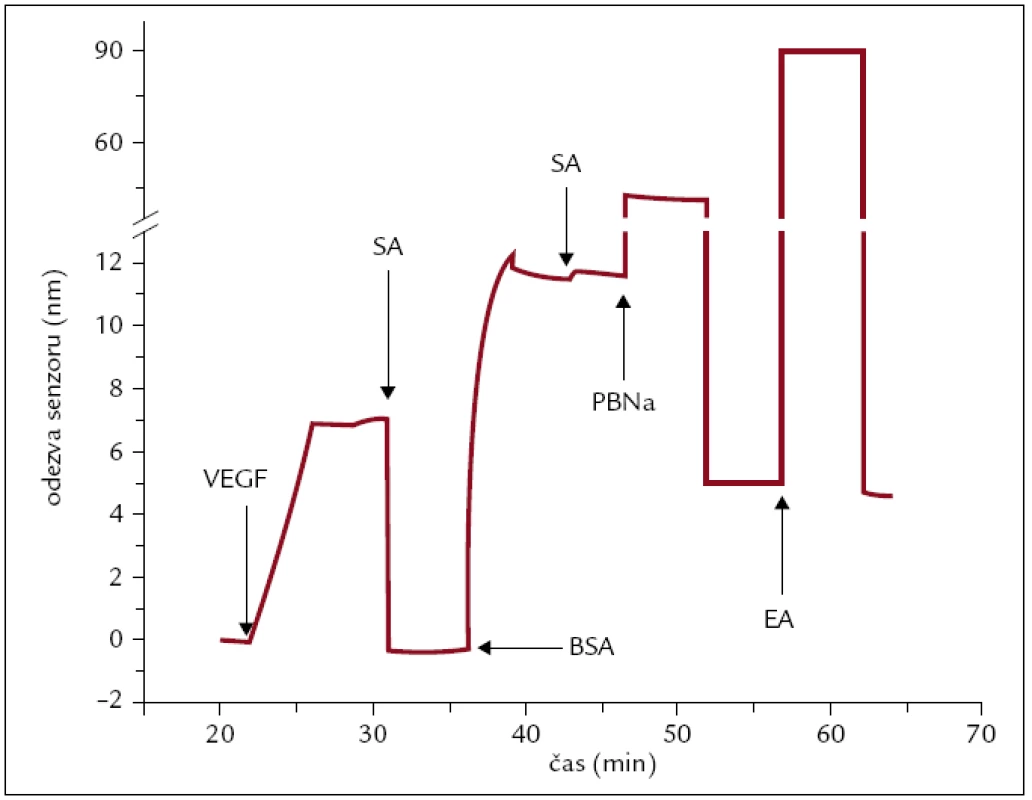
Do 10krát naředěné plazmy v PBS s 2% BSA byl přidán VEGFR-1 o finální koncentraci (25–100 ng/ml). Vzorek byl přiváděn k povrchu v 10–30vteřinových cyklech prokládaných 30vteřinovými cykly s protékajícím pufrem (2% BSA/PBNa). BSA/PBNa pufr s vyšší iontovou silou zajišťuje odstranění nespecificky navázaných proteinů, ale zároveň nedochází k narušení vazby VEGFR-1 k imobilizovanému VEGF-A. Celkový čas kontaktu plazmy s povrchem byl 5 min.
Výsledky a diskuze
Odpověď senzoru na ředěnou plnou plazmu a plazmu depletovanou byla měřena ve všech 4 kanálech a nespecifická odezva byla vypočítána z rozdílu mezi odezvou senzoru před aplikací plazmy a 5 min po návratu do protékajícího pufru. Odezva odpovídá nespecifické adsorpci proteinů plné nebo depletované plazmy na povrch čipu. Průměrná odezva senzoru na plnou plazmu (10krát ředěnou PBS/BSA) byla 0,24 nm, což odpovídá koncentraci bílkoviny 4,08 ng/cm2 na povrchu. Průměrná odezva na plazmu depletovanou byla 0,01 nm, odpovídající koncentraci 0,17 ng/cm2. Nespecifická odezva byla stanovena ve 3 různých experimentech za stejných podmínek. Průměrnou nespecifitu plné a depletované plazmy zobrazuje obr. 2. Nespecifita depletované plazmy byla 24krát nižší vzhledem k plazmě nedepletované.
Obr. 2. Průměrná odezva senzoru na povrch s imobilizovaným VEGF-A na 10% plazmu plnou a depletovanou. 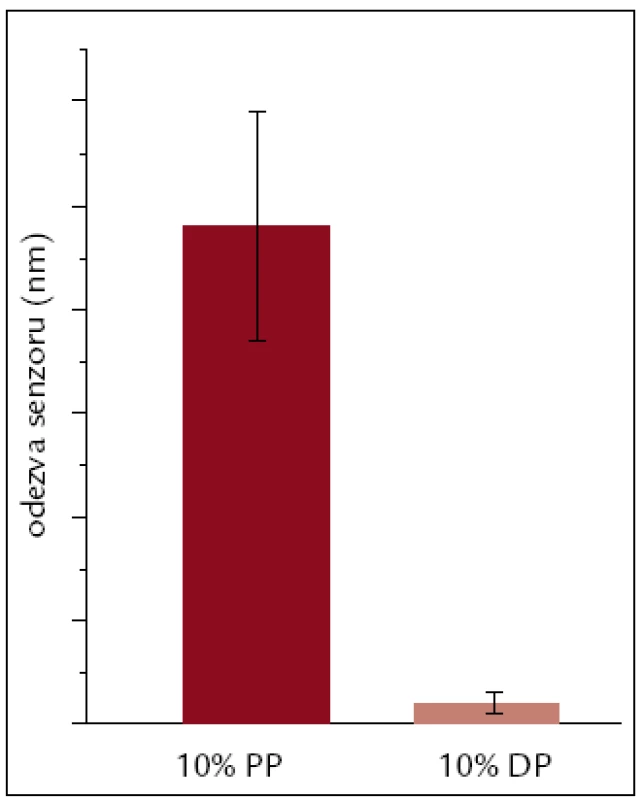
Testovaný čip byl pokrytý tzv. samouspořádající se vrstvou alkylthiolů, jedním s nejhojněji používaných funkčních povrchů na biosenzorech. Ačkoli byl v posední době zaznamenán velký pokrok ve vývoji těchto materiálů a mohou se chlubit minimální nespecifitou, vyžaduje analýza komplexních biologických vzorků jejich úpravu před analýzou. Kombinace vhodného povrchu a efektivního ošetření vzorku, kdy se odstraní nejhojněji zastoupené bílkoviny, by pak mohla umožnit detekci látek o velmi nízké koncentraci, jako jsou např. markery některých onemocnění.
Ověřovali jsme vliv deplece krevní plazmy na detekci VEGFR-1, markeru myelodysplastického syndromu, pomocí jeho fyziologického protějšku VEGF-A imobilizovaného na povrch senzoru přes karboxylové skupiny alkanethiolů. Depletovaná a nedepletovaná 10% krevní plazma s dodaným VEGFR-1 o různých koncentracích (10–200 ng/ml) byla přivedena k povrchu senzoru. Odezva senzoru na depletovanou krevní plazmu s dodaným VEGFR-1 narůstala s aplikovanou koncentrací téměř lineárně. Obr. 3 ukazuje kalibrační křivku s limitem detekce 25 ng/ml, který byl určen jako koncentrace odpovídající 3násobku standardní odchylky odezvy senzoru. Odpověď senzoru na VEGFR-1 v 10% nedepletované krevní plazmě nebylo možné citlivě zaznamenat.
Obr. 3. Kalibrační křivka pro detekci VEGFR-1 v 10% depletované plazmě. Horizontální linkou je znázorněn limit detekce, který odpovídá koncentraci 25 ng/ml. 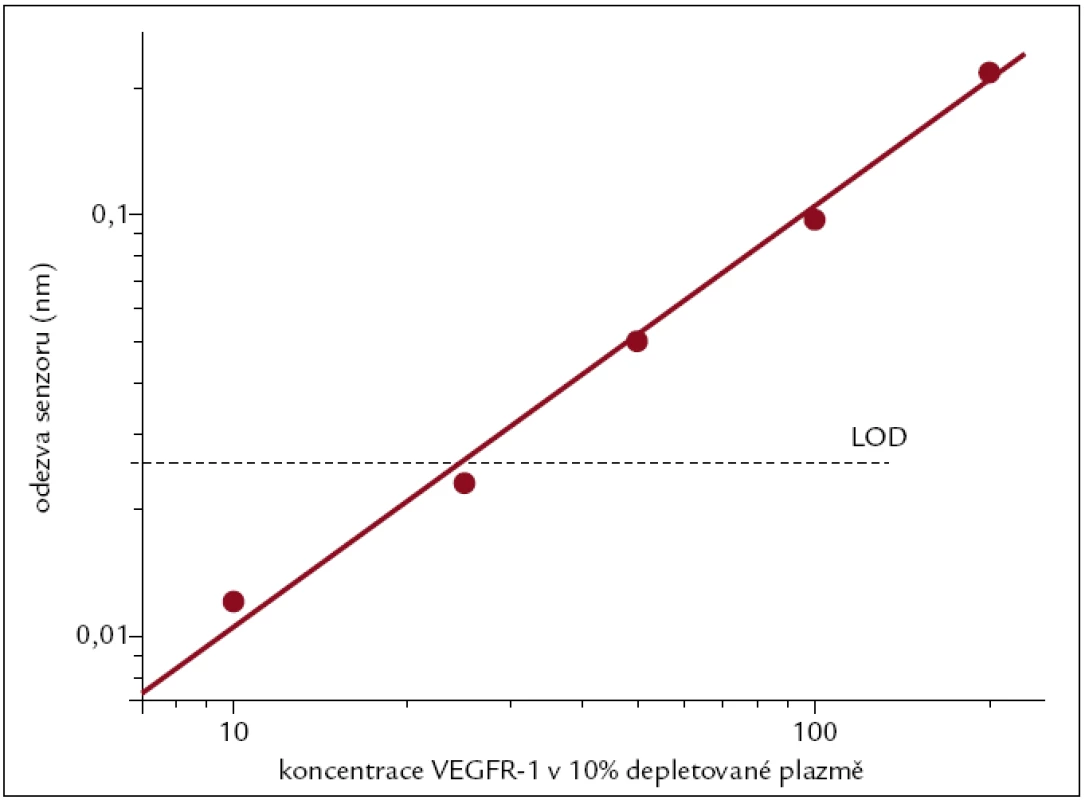
Interakce plazmatických proteinů s povrchem byla mnohem nižší u plazmy depletované ve srovnání s plazmou plnou. Skutečnost, že koncentrace málo zastoupených proteinů byla v obou plazmách stejná, vypovídá o tom, že hlavní podíl na nespecifické odpovědi senzoru na plazmu mají vysoce zastoupené proteiny, které jsou deplecí odstraněny. Ukázali jsme, že deplecí snížená nespecifická odpověď senzoru umožnila detekci cílového proteinu o mnohem nižší koncentraci než v případě plné plazmy. Imunodeplece vzorku pomocí kolony MARS Hu-14, která odstraní přibližně 94 % celkové bílkovinné hmoty z lidské plazmy, je tedy účinnou metodou pro přípravu vzorku pro optickou metodu SPR.
Poděkování
Práce vznikla za přispění grantu GAČR P205/12/G118 a grantu Evropské Unie ERDF OPPK 24001.
prof. Ing. Jan E. Dyr, DrSc.
www.uhkt.cz
e-mail. jan.dyr@uhkt.cz
Doručeno do redakce: 12. 5. 2012
Zdroje
1. McKusick VA. Genomics: structural and functional studies of genomes. Genomics 1997; 45 : 244–249.
2. Wilkins MR, Pasquali C, Appel RD et al. From proteins to proteomes: large scale protein identification by two-dimensional electrophoresis and amino acid analysis. Biotechnology (NY) 1996; 14 : 61–65.
3. Riedel T, Suttnar J, Brynda E et al. Fibrinopeptides A and B release in the process of surface fibrin formation. Blood 2011; 117 : 1700–1706.
4. Majek P, Reicheltova Z, Stikarova J et al. Proteome changes in platelets activated by arachidonic acid, collagen, and thrombin. Proteome Sci 2010; 8 : 56.
5. Sobotkova A, Masova-Chrastinova L, Suttnar J et al. Antioxidants change platelet responses to various stimulating events. Free Radic Biol Med 2009; 47 : 1707–1714.
6. Maly MA, Majek P, Reicheltova Z et al. Proteomic analysis of plasma samples from acute coronary syndrome patients – The pilot study. Int J Cardiol 2012; 157 : 126–128.
7. Majek P, Reicheltova Z, Suttnar J et al. Plasma proteome changes in cardiovascular disease patients: novel isoforms of apolipoprotein A1. J Transl Med 2011; 9 : 84.
8. Micallef J, Dharsee M, Chen J et al. Applying mass spectrometry based proteomic technology to advance the understanding of multiple myeloma. J Hematol Oncol 2012; 3 : 13.
9. Majek P, Reicheltova Z, Suttnar J et al. Plasma proteome changes associated with refractory cytopenia with multilineage dysplasia. Proteome Sci 2011; 9 : 64.
10. Merkerova MD, Bystricka D, Belickova M et al. From cryptic chromosomal lesions to pathologically relevant genes: integration of SNP-array with gene expression profiling in myelodysplastic syndrome with normal karyotype. Genes Chromosomes Cancer 2012; 51 : 419–428.
11. Votavova H, Grmanova M, Dostalova Merkerova M et al. Differential expression of microRNAs in CD34+ cells of 5q - syndrome. J Hematol Oncol 2011; 4 : 1.
12. Lopotova T, Nadvornikova S, Zackova M et al. N-terminally truncated WT1 variant (sWT1) is expressed at very low levels in acute myeloid leukemia and advanced phases of chronic myeloid leukemia. Leuk Res 2012; 36: e81–e83.
13. Machova Polakova K, Lopotova T, Klamova H et al. Expression patterns of microRNAs associated with CML phases and their disease related targets. Mol Cancer 2011; 10 : 41.
14. Gorg A, Postel W, Gunther S. The current state of two-dimensional electrophoresis with immobilized pH gradients. Electrophoresis 1988; 9 : 531–546.
15. Fenn JB, Mann M, Meng CK et al. Electrospray ionization for mass spectrometry of large biomolecules. Science 1989; 246 : 64–71.
16. Karas M, Hillenkamp F. Laser desorption ionization of proteins with molecular masses exceeding 10,000 daltons. Anal Chem 1988; 60 : 2299–2301.
17. MacBeath G, Schreiber SL. Printing proteins as microarrays for high-throughput function determination. Science 2000; 289 : 1760–1763.
18. Ray S, Mehta G, Srivastava S. Label-free detection techniques for protein microarrays: prospects, merits and challenges. Proteomics 2010; 10 : 731–748.
19. Jiang SY, Cao ZQ. Ultralow-Fouling, Functionalizable, and Hydrolyzable Zwitterionic Materials and Their Derivatives for Biological Applications. Adv Mater 2010; 22 : 920–932.
20. Krishnan S, Weinman CJ, Ober CK. Advances in polymers for anti-biofouling surfaces. J Mater Chem 2008; 18 : 3405–3413.
21. Hucknall A, Rangarajan S, Chilkoti A. In Pursuit of Zero: Polymer Brushes that Resist the Adsorption of Proteins. Adv Mater 2009; 21 : 2441–2446.
22. Ahmed N, Barker G, Oliva K et al. An approach to remove albumin for the proteomic analysis of low abundance biomarkers in human serum. Proteomics 2003; 3 : 1980–1987.
23. Lei T, He QY, Wang YL et al. Heparin chromatography to deplete high-abundance proteins for serum proteomics. Clin Chim Acta 2008; 388 : 173–178.
24. Pieper R, Su Q, Gatlin CL et al. Multi-component immunoaffinity subtraction chromatography: An innovative step towards a comprehensive survey of the human plasma proteome. Proteomics 2003; 3 : 422–432.
25. Martosella J, Zolotarjova N, Liu HB et al. Reversed-phase high-performance liquid chromatographic prefractionation of immunodepleted human serum proteins to enhance mass spectrometry identification of lower-abundant proteins. J Proteome Res 2005; 4 : 1522–1537.
26. Righetti PG, Boschetti E. The Proteominer and the Fortyniners: Searching for Gold Nuggets in the Proteomic Arena. Mass Spectrom Rev 2008; 27 : 596–608.
27. Piliarik M, Bockova M, Homola J. Surface plasmon resonance biosensor for parallelized detection of protein biomarkers in diluted blood plasma. Biosens Bioelectron 2010; 26 : 1656–1661.
28. Pimkova K, Bockova M, Hegnerova K et al. Surface plasmon resonance biosensor for the detection of VEGFR-1 – a protein marker of myelodysplastic syndromes. Anal Bioanal Chem 2012; 402 : 381–387.
Štítky
Diabetologie Endokrinologie Interní lékařství
Článek vyšel v časopiseVnitřní lékařství
Nejčtenější tento týden
2012 Číslo Suppl 2- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Imunohematologie – historie, současný stav poznání a role ÚHKT
- Metabolizmus železa a jeho regulace
- Akutní myeloidní leukemie – historický vývoj a současnost léčby ve světě a v ÚHKT
- Akutní lymfoblastová leukemie: historie a současnost
- Chronická myeloidní leukemie – zásadní změna prognózy nemocných po zavedení léčby inhibitory tyrozinových kináz
- Molekulární genetika v diagnostice a léčbě chronické myeloidní leukemie
- Transplantace krvetvorných buněk a její role v léčbě chorob krvetvorby během posledních 25 let
- Prevence a léčba infekčních komplikací v hematoonkologii
- Naléhavé stavy v hematologii
- Péče o pacienty s hemofilií a jejich rodiny v ÚHKT
- 60 let Ústavu hematologie a krevní transfuze Praha
- Sledování vrozených a získaných, strukturních a funkčních změn fibrinogenu
- Myelodysplastický syndrom. Pokroky v diagnostice a léčbě během 30 let trvání registru nemocných s myelodysplastickým syndromem v ÚHKT
- Využití „label-free“ proteinových čipů pro proteomiku onkohematologických onemocnění
- Hemaferéza – vysoce účinná technika v terapii nemocných
- Vnitřní lékařství
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Imunohematologie – historie, současný stav poznání a role ÚHKT
- Naléhavé stavy v hematologii
- Metabolizmus železa a jeho regulace
- Hemaferéza – vysoce účinná technika v terapii nemocných
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



