-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Laboratorní diagnostika imunitně podmíněných trombocytopenií
Laboratory diagnostics in immune-mediated thrombocytopenias
Immune-mediated thrombocytopenias are caused by alloantibodies or autoantibodies directed against platelet surface antigens. This group of immune disorders is divided into five types of thrombocytopenias in which platelet antibody testing is possible: immune thrombocytopenia, drug-induced immune thrombocytopenia, foetal and neonatal alloimmune thrombocytopenia, post-transfusion purpura, multi-platelet transfusion refractoriness. Laboratory testing involves detection and identification of patient serum antibodies using indirect tests or antibodies attached to patient platelets using direct tests. The analysis of blood samples for platelet antibody detection is complicated due to insufficient sensitivity of some laboratory tests. Identification of platelet-specific HPA antibodies provides important information, which facilitates the clinical diagnosis of immune-mediated disorder.
Keywords:
immune-mediated thrombocytopenia – HPA – HLA
Autoři: L. Janků 1,2; H. Lejdarová 1,2
Působiště autorů: Transfuzní a tkáňové oddělení, FN Brno 1; Katedra laboratorních metod, LF MU Brno 2
Vyšlo v časopise: Transfuze Hematol. dnes,27, 2021, No. 3, p. 232-239.
Kategorie: Souhrnné/edukační práce
doi: https://doi.org/10.48095/cctahd2021232Souhrn
Imunitně zprostředkované trombocytopenie vznikají v důsledku aloprotilátek nebo autoprotilátek namířených proti povrchovým antigenům trombocytů. Rozlišujeme pět hlavních typů trombocytopenií, u kterých se testují protilátky proti trombocytům: imunitní trombocytopenie, polékové imunitní trombocytopenie, fetální a neonatální aloimunitní trombocytopenie, potransfuzní purpura a refrakternost k trombocytovým transfuzním přípravkům. Laboratorní diagnostika zahrnuje detekci a identifikaci volných protilátek přítomných v séru nebo plazmě pacienta pomocí nepřímých testů nebo protilátek navázaných na antigeny pacientových trombocytů prostřednictvím přímých testů. Analýza krevních vzorků ke stanovení protilátek proti trombocytům bývá v praxi komplikovaná nedostatečnou citlivostí některých laboratorních testů. Identifikace specifických protilátek proti HPA antigenům poskytuje důležité informace, které mohou pomoci ve stanovení klinické diagnózy imunitně zprostředkovaného onemocnění.
Klíčová slova:
imunitní trombocytopenie – HPA – HLA
ÚVOD
Trombocyty vznikají odštěpováním cytoplazmy zralých megakaryocytů v kostní dřeni. Jeden megakaryocyt je schopen vyprodukovat přibližně 1 000–5 000 trombocytů. Jejich počet v periferní krvi je regulován trombopoetinem. Jedná se o klíčový cytokinový hormon, který reguluje produkci megakaryocytů a trombocytů. Primárně je syntetizovaný v játrech a podporuje megakaryocyty k produkci trombocytů v kostní dřeni vazbou na c-Mpl receptor. Fyziologická hodnota trombocytů v krvi zdravého jedince se pohybuje v rozmezí 150–450×109/l. Trombocyty cirkulují v krvi přibližně 7–10 dní, stárnutí trombocytů se projevuje postupnými změnami v morfologii, aktivaci a v hustotě povrchových receptorů. Zánik starých a poškozených trombocytů nebo trombocytů s navázanými protilátkami probíhá převážně ve slezině a v játrech a v menší míře v kostní dřeni [1,2].
Patologický stav, kdy dochází ke snížení počtu trombocytů pod hodnotu 150×109/l, se označuje jako trombocytopenie. Příčiny vzniku trombocytopenie mohou být vrozené nebo získané a podle závažnosti se dělí na trombocytopenii lehkou (trombocyty > 70×109/l), středně těžkou (trombocyty 20–70×109/l) a těžkou (trombocyty < 20×109/l). Pacienti s počtem trombocytů přesahujícím 50×109/l jsou často asymptomatičtí. Ke spontánnímu krvácení dochází většinou až při poklesu počtu trombocytů pod hodnotu 20×109/l. Příčinou trombocytopenie může být snížená produkce trombocytů v kostní dřeni, kdy je ovlivněna produkce megakaryocytů (např. dřeňový útlum, infiltrace kostní dřeně maligními buňkami, myelodysplastický syndrom, infekce) nebo zvýšený zánik trombocytů v periferii (např. trombotické mikroangiopatie – hemolyticko-uremický syndrom, trombotická trombocytopenická purpura (TTP), dále infekce, diseminovaná intravaskulární koagulace (DIC), mechanické poškozování trombocytů u pacientů s umělou srdeční chlopní či konzumpce trombocytů při mimotělní membránové oxygenaci) [3]. Zvýšený zánik trombocytů může být také způsoben přímým toxickým účinkem různých léků a dalších substancí nebo, jak je tomu v případě imunitních trombocytopenií, destrukcí trombocytů zprostředkovanou protilátkami. Autoprotilátky jsou namířené proti vlastním trombocytovým glykoproteinům (GP) z důvodu ztráty tolerance vlastních antigenů, aloprotilátky vznikají imunizací jedince vůči antigenům, které v jeho fenotypu chybí a je jim vystaven při transfuzi, během těhotenství nebo po transplantaci. Protilátky jsou schopny se vázat na membránu trombocytů, iniciovat patogenezi, která končí dysfunkcí a destrukcí trombocytů s typickými klinickými příznaky, jako jsou petechie, ekchymózy až krvácení, nejčastěji z nosu a dásní, do zažívacího či urogenitálního traktu, výjimečně do mozku [4,5].
Specifické antigeny trombocytů se nazývají HPA (human platelet antigens). Kromě těchto HPA antigenů trombocyty také exprimují antigeny, které se nacházejí i na jiných typech buněk, tzv. non-HPA antigeny: GPIV [CD36], CD109, antigeny červených krvinek Ii, Lewis a P, lidské leukocytární antigeny I. třídy (human leukocyte antigens – HLA) a antigeny krevně skupinového systému AB0 [6]. V současné době je známo 41 HPA, které jsou exprimovány na 6 různých trombocytových glykoproteinech, GPIIb, GPIIIa, GPIba, GPIbb, GPIa a CD109. Databáze HPA antigenů je dostupná na http: //www.versiti.org/HPA. Dvanáct HPA antigenů je uspořádáno do šesti bialelických systémů: HPA-1, HPA-2, HPA-3, HPA-4, HPA-5 a HPA-15 [7]. Alela označená „a“ se vyskytuje ve vyšší frekvenci v populaci než alela označená „b“. HPA antigeny, u kterých byly detekovány protilátky pouze proti jednomu ze dvou antigenů, jsou označeny indexem „w“ (např. HPA-10bw). Převážná většina HPA antigenů je lokalizována na GPIIb/IIIa [8,9]. V případě autoimunitních trombocytopenií se autoprotilátky tvoří nejčastěji proti glykoproteinovým komplexům GPIIb/IIIa a GPIb/IX, méně často proti GPIa/IIa [4].
Trombocytopenie, u kterých je požadováno testování protilátek proti trombocytům, můžeme rozdělit do pěti kategorií. Je to imunitní trombocytopenie (immune thrombocytopenia – ITP), která je charakterizována tvorbou autoprotilátek proti vlastním trombocytům vedoucích k jejich předčasné destrukci. Polékové trombocytopenie (drug-induced immune thrombocytopenia – DITP) způsobují protilátky asociované s léky, patogeneze DITP je složitá a existuje několik různých mechanizmů, kterými tyto protilátky podporují destrukci trombocytů. V případě fetální a neonatální aloimunitní trombocytopenie (fetal and neonatal alloimmune thrombocytopenia – FNAIT) prochází mateřské IgG protilátky produkované proti paternálním antigenům na trombocytech plodu přes placentu a způsobují trombocytopenii plodu. Potransfuzní purpura (post-transfusion purpura – PTP) je vzácnou komplikací krevní transfuze. Je způsobena HPA auto - nebo aloprotilátkami, vyskytuje se obvykle mezi 5. a 10. dnem po transfuzi, nejčastěji po transfuzi trombocytů. Refrakternost k trombocytovým transfuzním přípravkům (multi-platelet transfusion refractoriness – MPTR) představuje komplikaci v souvislosti s opakovanými transfuzemi trombocytů, kdy vytvořené protilátky proti HLA antigenům u příjemce ničí transfundované trombocyty. Vzácněji může být refrakternost způsobena protilátkami proti specifickým HPA antigenům [4,10].
Po zjištění trombocytopenie je diferenciální diagnostika zaměřena na zjišťování příčin jejího vzniku. Produkce trombocytů v kostní dřeni může být snížená v důsledku dřeňového útlumu (idiopatický, polékový) nebo infiltrace kostní dřeně maligními buňkami. Na periferii dochází k úbytku trombocytů při hypersplenismu, v důsledku působení (auto) protilátek, při zvýšené spotřebě trombocytů u DIC, heparinem indukované trombocytopenie (HIT) nebo v důsledku zvýšené ztráty při krvácení a diluce při převodu náhradních roztoků [3]. Součástí diagnostiky trombocytopenie je mimo jiné i problematika vyšetřování protilátek proti trombocytům, kterou se zabývají specializovaná pracoviště, jako jsou HLA laboratoře a imunohematologické laboratoře. Výsledky přítomnosti či absence protilátek proti trombocytům v séru pacienta nebo autoprotilátek vázaných na trombocyty přispívají ke stanovení klinické diagnózy. K nepřímým testům k detekci volných protilátek proti trombocytům patří destičkový imunofluorescenční test (DIFT), enzyme-linked immunosorbent assay (ELISA), průtoková cytometrie (FC) a monoclonal antibody-specific immobilization of platelet antigen (MAIPA). Testy se provádí ze vzorku srážlivé krve. Diagnostické trombocyty se zpravidla získávají izolací z buffy coat podle typu testu od 2–3 dárců krve krevní skupiny 0. Tyto nepřímé testy se provádí v případě diagnóz FNAIT, PTP a při MPTR [10]. Přímé testy detekují autoprotilátky vázané na pacientovy trombocyty. Jsou senzitivnější a specifičtější pro detekci autoprotilátek než testy nepřímé. Autoprotilátky jsou nejlépe detekovatelné ve vázané formě na trombocytech pacienta metodou FC nebo MAIPA ze vzorku nesrážlivé krve. Každý z uvedených testů má určité limitace, a proto je vhodná kombinace jednotlivých testů. Identifikaci aloprotilátky je možné provést testem MAIPA, který je časově náročný a je k němu nutné mít panel HPA otypovaných trombocytů. Modernější způsob testování protilátek proti trombocytům využívá fluorescenčně značené mikročástice (beads) s navázanými GP, které se inkubují se sérem pacienta. Měření a hodnocení přítomnosti protilátek se provádí na analyzátoru Luminex/LABScan [11]. Test PakLx (Immucor GTI Diagnostic, USA) umožňuje detekci a specifikaci protilátek proti HPA antigenům lokalizovaných na GPIIb/IIIa – HPA-1a, -1b, -3a, -3b, -4a, -4b; na GPIb/IX – -2a, -2b; na GPIa/IIa – -5a, -5b; GPIV a anti-HLA protilátek I. třídy. PakLx test neumožňuje detekci protilátek proti antigenu HPA-15. Výhodou použití tohoto testu je rychlé provedení z malého množství vzorku bez otypovaného panelu trombocytů [12]. Antigenní systém HPA-15, který je lokalizován na glykoproteinu CD109, je charakterizován nízkou expresí na trombocytech, exprese je variabilní mezi jedinci a CD109 molekula je nestabilní při zpracování trombocytů, což také přispívá k problematické detekci anti-HPA-15 protilátek [13]. Přehled dostupných vyšetření u jednotlivých typů trombocytopenií je uveden v tab. 1.
Tab. 1. Laboratorní vyšetření pro jednotlivé diagnózy. 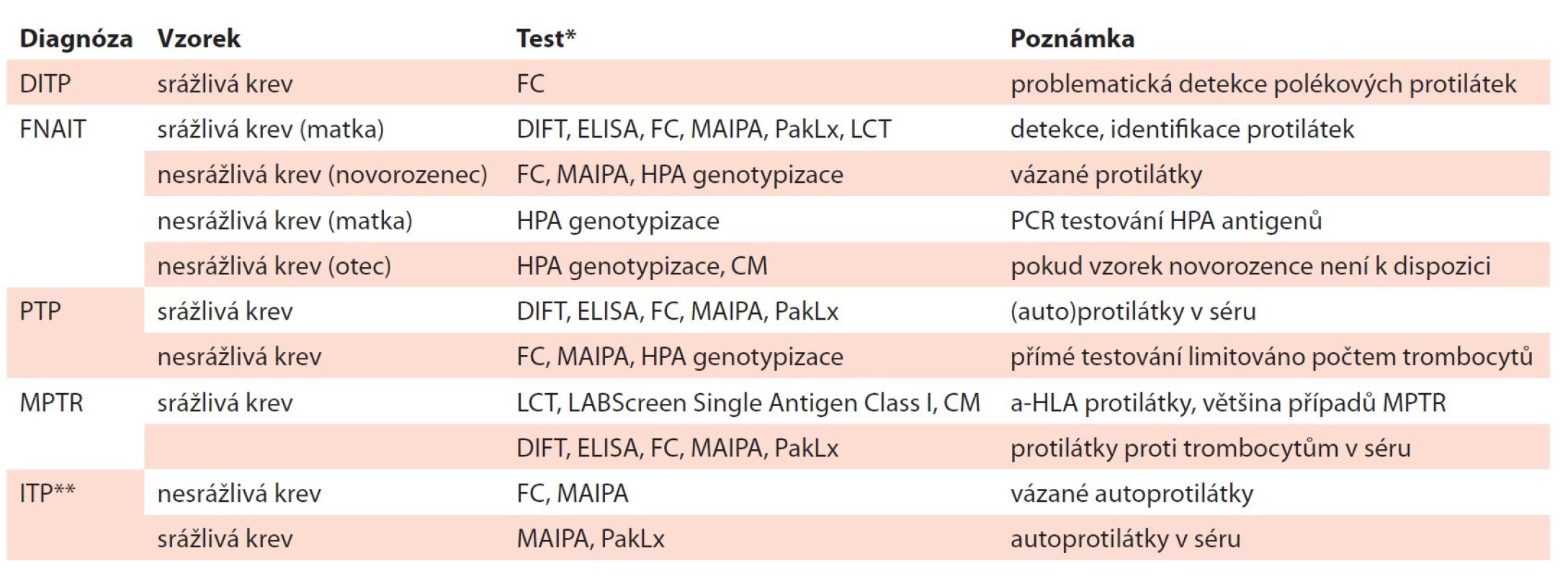
* spektrum prováděných testů se může v jednotlivých laboratořích lišit
** pomocné pouze v určitých případech
CM – křížová zkouška, DIFT – destičkový imunofl uorescenční test, DITP – poléková trombocytopenie, ELISA – enzyme-linked immuno-sorbent assay, FC – průtoková cytometrie, FNAIT – fetální a neonatální aloimunitní trombocytopenie, HLA – lidské leukocytární antigeny, HPA – specifi cké antigeny trombocytů, ITP – autoimunitní trombocytopenie, LABScreen Single Antigen Class I – test k identifi kaci HLA antigenů I. třídy technologií xMAP Luminex, LCT – lymfocytotoxický test k detekci a-HLA protilátek, MAIPA – monoclonal antibody-specifi c immobilization of platelet antigen, MPTR – refrakternost k trombocytovým transfuzním přípravkům, PakLx – test k detekci a identifi - kaci protilátek technologií xMAP Luminex, PCR – polymerázová řetězová reakce, PTP – potransfuzní purpuraIMUNITNÍ TROMBOCYTOPENIE
Jedná se o heterogenní autoimunitní onemocnění charakterizované produkcí autoprotilátek namířených proti antigenům trombocytů. Onemocnění je definováno dočasným nebo trvalým snížením počtu trombocytů (většinou pod 100×109/l) v důsledku zrychlené destrukce a/nebo zhoršené produkce trombocytů s následným zvýšeným rizikem krvácení [14]. Autoimunitní proces je podmíněn vzájemnou interakcí mezi trombocyty, antigen-prezentujícími buňkami, B - a T-lymfocyty a nakonec vede k tvorbě protilátek proti povrchovým GP trombocytů. I když počáteční impulzy, které vedou k autoimunitě, nejsou ještě úplně jasné, autoprotilátky a autoreaktivní CD8+ cytotoxické T-lymfocyty spouští destrukci trombocytů a zhoršují produkci trombocytů megakaryocyty v kostní dřeni. Se závažností trombocytopenie narůstá riziko krvácivých projevů, které jsou typické na kůži a sliznicích. U dětí představuje ITP nejčastější získané krvácivé onemocnění, manifestaci akutní formy většinou předchází infekce. U dospělých, na rozdíl od dětí, je tendence přechodu onemocnění do chronické formy. Až dvě třetiny pacientů s chronickou formou ITP dosáhnou parciální nebo kompletní remise po několika letech [15].
Nejčastější infekční agens v souvislosti s ITP jsou Helicobacter pylori, virus hepatitidy C a virus lidské imunodeficience, méně často cytomegalovirus, Epstein-Barrové virus a další [16]. Jedním z předpokládaných mechanizmů, kterým infekce vedou k autoimunitě, jsou tzv. molekulární mimikry, kdy virové proteiny napodobují trombocytové receptory, aby unikly imunitnímu systému. V případě imunitní odpovědi proti těmto virovým proteinům může dojít ke zkřížené reaktivitě proti trombocytovým receptorům, která následně vede k tvorbě autoprotilátek namířených jak proti virovým proteinům, tak i proti trombocytovým receptorům [19].
V současné době neexistuje žádný laboratorní test nebo klinický parametr, který by jednoznačně potvrdil diagnózu ITP. Diagnóza je stanovena po vyloučení jiných příčin trombocytopenie, tedy per exclusionem. Přibližně u 60 % pacientů s ITP jsou detekovatelné autoprotilátky, které jsou nejčastěji namířeny proti GPIIb/IIIa (cca 70 %) a/nebo proti komplexu GPIb/IX/V (cca 25 %). Ve sporadických případech byly detekovány i protilátky proti GPIa/IIa nebo GPVI (cca 5 %) [16]. Autoprotilátky urychlují odstraňování trombocytů prostřednictvím makrofágů a dendritických buněk ve slezině, komplementových depozit, apoptózou trombocytů nebo inhibicí megakaryocytové produkce trombocytů. Většina autoprotilátek nalezených u pacientů s chronickou ITP jsou protilátky třídy IgG, IgM a sporadicky IgA [17]. Z genetických rizikových faktorů se dále uvádí asociace mezi ITP a jednonukleotidovým polymorfismem v genech kódujících některé cytokiny nebo chemokiny [16]. Nové biomarkery, jako jsou mikroRNA, které regulují hladinu cytokinů a dalších imunitních komponent, jsou také považovány za potencionální rizikový faktor ITP [18].
Testování autoprotilátek proti trombocytům není součástí standardního diagnostického programu pro nově diagnostikované ITP, avšak detekce protilátek může někdy pomoci potvrdit diagnózu ITP, případně vyloučit jiné diagnózy. Testování protilátek by mohlo být přínosné u pacientů s perzistentní nebo chronickou formou ITP a u atypických průběhů onemocnění [15]. Až u 40 % pacientů nejsou detekovány protilátky. Detekce protilátek je ovlivněna řadou faktorů, jako jsou např. citlivost daného testu, typ použitých monoklonálních protilátek, způsob zpracování vzorků v laboratoři a také zkušenost laboratoře se vzorky s nedostatečným počtem trombocytů. Průkaz protilátek diagnózu ITP podporuje, negativita ji ovšem nevylučuje. V některých případech nebývá přítomna pozitivní korelace mezi přítomností protilátek v séru, počtem trombocytů a klinickými příznaky pacienta. Pravděpodobně je to v důsledku toho, že v akutní fázi onemocnění trombocyty absorbují protilátky ze séra a ty jsou následně eliminovány z cirkulace [21].
Autoprotilátky je možné testovat ve vázané formě na trombocytech metodou FC nebo MAIPA. Toto vyšetření se provádí ze vzorku nesrážlivé krve, ze kterého jsou izolovány trombocyty k přímému průkazu navázaných protilátek. Vyšetření protilátek lze provést i ze séra, které je nejdříve inkubováno s dárcovskými trombocyty krevní skupiny 0. Pozitivní výsledek znamená přítomnost autoprotilátek vázaných na trombocytech nebo volných, přítomných v séru. Vzorek nesrážlivé krve k detekci vázaných autoprotilátek je nutno zpracovat co nejdříve po odběru, testovaná séra pacientů lze zamrazit pro pozdější analýzu [10,22]. V patogenezi ITP se uplatňují pouze autoprotilátky proti specifickým GP trombocytů. Anti-HLA protilátky, se kterými se v praxi setkáváme podstatně častěji, příčinnou souvislost s ITP nemívají [15].
POLÉKOVÉ IMUNITNÍ TROMBOCYTOPENIE
V souvislosti s užíváním některých léků se u pacienta může vyskytnout DITP, která často nemusí být ihned rozpoznána. Jedná se o závažný klinický problém, který se projevuje výraznou trombocytopenií často doprovázenou krvácivými projevy, které mohou vést až k úmrtí pacienta. DITP je vyvolána protilátkami, které jsou specifické pro daný lék. Tyto protilátky se vážou Fab oblastí na membránové GP trombocytů pouze v přítomnosti daného léčiva a vedou k jejich destrukci [23]. DITP se typicky vyvíjí za 1–2 týdny po nasazení nové medikace nebo v průběhu několika hodin po opětovné expozici danému léku. Počet trombocytů je obvykle menší než 20×109/l, nástup trombocytopenie je rychlý a bývá provázen krvácivými projevy. DITP obvykle začíná ustupovat během 1–2 dní po vysazení léku, který DITP vyvolal, a odeznění všech klinických projevů lze očekávat přibližně do týdne. Protilátky však mohou přetrvávat řadu let, proto je důležité daný lék vyloučit z medikace. DITP se vyskytuje obvykle u hospitalizovaných pacientů s bohatou farmakologickou anamnézou a komorbiditami, klinický obraz je často nerozpoznatelný od ITP a může vést k neadekvátní odpovědi na léčbu [24].
Řada léčiv může způsobit trombocytopenii imunitním nebo neimunitním mechanizmem. Neimunitní trombocytopenie je vyvolána potlačením produkce trombocytů (např. chemoterapie) nebo interferencí se specifickou funkcí megakaryocytů (např. bortezomid). Imunitně indukovaná trombocytopenie končí zrychlenou destrukcí trombocytů z důvodu tvorby polékových protilátek (např. valproát, soli zlata, chinin, chinidin, penicilin, ibuprofen, tirofiban, eptifibatid, abciximab a další) nebo imunokomplexovým mechanizmem aktivace trombocytů (např. heparin). Polékové protilátky proti megakaryocytům mohou také způsobit imunitně zprostředkovanou supresi produkce trombocytů [25]. Kromě léků mohou vyvolat DITP také některé nápoje obsahující chinin [26].
Dostupnost a spolehlivost laboratorního testování protilátek, které se vážou na trombocyty pouze v přítomnosti léku, může potvrdit diagnózu DITP. Bohužel není dostupná žádná univerzální metoda pro testování polékových protilátek, i když nejčastěji uváděnou metodou je FC z důvodu senzitivity testu a možnosti poskytnout kvantitativní výsledek [25,27]. Testování polékových protilátek má však určitá omezení, která vedou k nízké senzitivitě použitých testů. Některé léky nejsou rozpustné při neutrálním pH, DITP se může rozvinout v důsledku metabolitu daného léku, který není dostupný pro testování a přítomnost jiných protilátek proti trombocytům může zkreslovat testování. Dále je obtížné optimalizovat koncentraci léčiva pro testování in vitro. Jako další příčina nízké senzitivity testů se uvádí slabá vazba léku na trombocyty, která vede k rychlému snížení počtu molekul léku na povrchu trombocytů, a proto je důležité udržovat určitou kritickou koncentraci léku ve všech promývacích pufrech až do konce testu [25,28].
FETÁLNÍ A NEONATÁLNÍ ALOIMUNITNÍ TROMBOCYTOPENIE
FNAIT je imunitně podmíněné onemocnění způsobené tvorbou aloprotilátek proti HPA antigenům plodu a může vést ke vzniku závažné trombocytopenie až krvácení u jinak zdravých novorozenců. Vyskytuje se ve frekvenci přibližně jeden případ na 1 000 porodů a je vyvolaná imunizací matky vůči HPA antigenům plodu zděděných od otce [29]. Nejčastěji identifikovanou protilátkou u klinicky závažných trombocytopenií je anti-HPA-1a. HPA-1a antigen exprimuje v kavkazské populaci přibližně 98 % žen (genotyp HPA-1a/a nebo HPA-1a/b). Přibližně 2 % žen jsou HPA-1a negativní (genotyp HPA-1b/b). Tyto HPA-1a negativní ženy jsou imunizovány inkompatibilním fetálním antigenem HPA-1a. Mateřské IgG přechází přes placentu a vstupují do fetální cirkulace vazbou na neonatální Fc receptor, vážou se na fetální trombocyty a způsobují jejich destrukci. V závislosti na stupni závažnosti trombocytopenie mohou být někteří novorozenci asymptomatičtí, těžší formy fetální trombocytopenie vyvolávají intrauterinní nebo postnatální krvácivé komplikace. Většina případů FNAIT je diagnostikována až po porodu, 40–60 % novorozenců s FNAIT pochází z prvního těhotenství. U mírných a středně těžkých forem se trombocytopenie novorozence upraví během několika dnů bez dalších následků, avšak závažné formy FNAIT provázené intrakraniálním krvácením mohou vést k úmrtí nebo k závažným neurologickým postižením [30]. Protilátka proti HPA-1a antigenu je zodpovědná za přibližně 80–85 % případů FNAIT, druhou nejčastější je protilátka proti HPA-5b antigenu (10–15 % případů). Protilátka proti HPA-1b antigenu způsobuje přibližně 6 % případů FNAIT [31].
Přibližně asi 10 % HPA-1a negativních žen s HPA-1a pozitivním plodem má detekovatelné anti-HPA-1a protilátky. Tato nízká frekvence imunizace je částečně vysvětlena prezentováním HPA-1a antigenu imunitním systémem matky, který je závislý na expresi HLA molekul II. třídy. Asi 90 % těhotných žen, které vytváří anti-HPA-1a protilátky, jsou HLA-DRB3*01 : 01 pozitivní. Tato HLA-DRB3*01 : 01 alela spolu s HLA-DRA alelou kódují molekulu HLA-DR52, která váže peptidy s leucinem v pozici 33 (HPA-1a), nikoli peptidy s prolinem ve stejné pozici (HPA-1b). Při absenci této HLA alely u matky je aloimunizace vzácná [32]. Loewenthal et al. [33] uvádí, že také přítomnost alely HLA-DRB4*01 : 01 může přispívat k rozvoji FNAIT, zvláště v kombinaci s alelou DRB3*01 : 01. Jiné studie však příspěvek DRB4*01 : 01 k rozvoji FNAIT nepotvrdily [32,34].
Na trombocytech jsou kromě HPA antigenů exprimovány také HLA antigeny I. třídy. Protilátky proti HLA antigenům I. třídy jsou běžně detekovatelné v průběhu těhotenství (cca 30 % těhotných žen) v závislosti na citlivosti dané detekční metody. Vyskytují se významně častěji u žen s vícečetným těhotenstvím v anamnéze [35]. Je obtížné zahrnovat anti-HLA protilátky do patogeneze FNAIT, protože až 30 % těhotných žen je imunizováno proti HLA antigenům I. třídy a jejich narozené děti nemají trombocytopenii. V některých případech jsou však anti-HLA protilátky jediným zjištěním a možným vysvětlením FNAIT [36,37]. Případy, kdy FNAIT je pravděpodobně způsobena aloprotilátkami proti HLA antigenům I. třídy, jsou poměrně vzácné a zdá se, že vysoký titr anti-HLA protilátek u matky by mohl být důležitým rizikovým faktorem neonatální trombocytopenie [38].
Laboratorní diagnostika spočívá v průkazu protilátek proti trombocytům v séru matky, případně u novorozence, v HPA genotypizaci matky, novorozence nebo otce v závislosti na dostupnosti jednotlivých vzorků. Pokud není možno odebrat vzorek novorozenci, bývá součástí diagnostiky provedení křížové zkoušky (cross-match – CM) mezi sérem matky a trombocyty otce, pokud je vzorek od otce k dispozici. Vzorky od matky a novorozence by měly být odebrány co nejdříve po porodu [39]. K detekci trombocytových protilátek v séru matky se používají nepřímé laboratorní testy DIFT, ELISA a FC. Součástí diagnostiky je i vyšetření anti-HLA protilátek. Kromě srážlivé krve je nutné odebrat matce i vzorek nesrážlivé krve do EDTA k HPA genotypizaci. U novorozence, pokud je vzorek k dispozici, je preferována nesrážlivá krev odebraná do EDTA k HPA genotypizaci. Tento vzorek je možné využít také k rychlému průkazu vázaných protilátek na trombocytech metodou přímé FC, pokud laboratoř toto vyšetření provádí. V případě, že vzorek od novorozence není dodán, pak by měl být došetřen otec. Odebírá se nesrážlivá krev do EDTA k izolaci trombocytů pro vyšetření CM a k HPA genotypizaci otce [4,10]. K identifikaci trombocytové protilátky se používá test MAIPA nebo semikvantitativní test PakLx s využitím technologie xMAP Luminex [40,41]. HPA genotypizaci matky a dítěte je vhodné provést i v případě, že protilátky proti trombocytům nebyly u matky detekovány. Tato skutečnost může nastat v případě protilátek s nízkou afinitou nebo v případě tzv. opožděných protilátek, které mohou být detekovatelné několik týdnů po porodu [39]. Laboratorní potvrzení diagnózy FNAIT (přítomnost anti-HPA protilátek namířených proti neshodným HPA antigenům, inkompatibilita v HPA antigenech) je důležitým prognostickým faktorem v péči o těhotnou ženu v případě dalšího těhotenství [29].
POTRANSFUZNÍ PURPURA
PTP je vzácná komplikace krevní transfuze se závažnou, imunitně zprostředkovanou trombocytopenií, která se vyskytuje opožděně, nejčastěji 5–10 dní po aplikaci. PTP je provázena krvácivými projevy v důsledku závažné trombocytopenie, která je příčinou 10–20% mortality u pacientů s krvácením do CNS. Incidence PTP se odhaduje asi na 1 : 50 000–100 000 transfuzí, avšak skutečný výskyt není snadné určit, protože PTP je poměrně obtížné diferencovat od ostatních trombocytopenií, a tak pravděpodobně zůstává nerozpoznána a podhodnocena [43]. Podobně jako u FNAIT, 85 % případů PTP je obvykle vyvoláno anti-HPA-1a protilátkou u jedinců s HPA-1b/1b genotypem, dříve imunizovaných těhotenstvími nebo transfuzemi. Kromě působení anti-HPA aloprotilátek jsou pacientovy vlastní HPA-1a negativní trombocyty také destruovány, a to IgG či IgM panreaktivními autoprotilátkami [44]. Příčina destrukce vlastních HPA-1a negativních trombocytů autoprotilátkami není zcela objasněna. Hawkins et al. [45] předkládá tři nejpravděpodobnější teorie. Dvě z nich jsou založeny na předpokladu, že solubilní HPA-1a antigen je transfundován pacientovi. První vychází z tvorby imunokomplexů (anti-HPA-1a/HPA-1a), které se vážou nespecificky na pacientovy HPA-1a negativní trombocyty a vedou k jejich destrukci prostřednictvím makrofágů v retikuloendotelovém systému. Druhá teorie předpokládá vazbu transfundovaných HPA-1a solubilních antigenů na trombocyty pacienta, přičemž jsou tyto trombocyty následně ničeny přítomnými anti-HPA-1a protilátkami. Třetí teorie vychází z hypotézy, že specifické autoprotilátky proti trombocytům se tvoří současně s aloprotilátkami a jsou příčinou autologní destrukce trombocytů.
U neléčených pacientů se trombocytopenie upraví přibližně za 20 dní, avšak krvácivé projevy u PTP jsou časté, proto rychlá diagnostika a včasná terapie snižuje mortalitu tohoto onemocnění. Terapie spočívá v podávání intravenózních imunoglobulinů či kortikosteroidů nebo v odstranění protilátek z krevního oběhu pacienta plazmaferézou. Je-li nutná transfuze, HPA-1a negativní pacienti by měli být transfundováni HPA-1a negativními transfuzními přípravky, přestože transfuze trombocytů negativních pro daný antigen bývá v akutní fázi často neefektivní. Pacienta je nutno informovat o riziku další transfuze. Pokud je podání transfuze nevyhnutelně nutné, k prevenci rekurence PTP je nutno podávat antigen-negativní transfuze nebo autologní krev. V případě transfuze erytrocytů je možno indikovat promyté erytrocyty, které nejsou kontaminovány trombocyty [43,45–47].
Diagnózu PTP není snadné stanovit, protože pacienti jsou často v kritickém stavu nebo po operacích a existuje u nich alternativní vysvětlení pro trombocytopenii, např. infekce, medikace, apod. Diferenciální diagnostika zahrnuje ITP, DITP, TTP, HIT, DIC, sepsi a pseudotrombocytopenii. Od PTP je také nutné odlišit pasivní aloimunitní trombocytopenii, kdy anti-HPA protilátky jsou do oběhu příjemce transfuze pasivně přeneseny od imunizovaného dárce [45]. Diagnostika PTP je založena na sérologických nálezech, jako jsou přítomnost cirkulujících aloprotilátek k běžným trombocytovým antigenům a současně absence odpovídajících antigenů na trombocytech pacienta. Ačkoliv testování protilátek a antigenů nebývá bezprostředně dostupné, aplikace krevní transfuze 7–10 dní před rozvojem trombocytopenie by měla vést k suspektní diagnóze PTP [48]. Laboratorní diagnostika by měla zahrnovat průkaz protilátek proti trombocytům v séru pacienta a průkaz autoprotilátek vázaných na jeho trombocyty, identifikaci HPA protilátek a HPA genotypizaci k potvrzení absence daného antigenu na trombocytech pacienta. Do laboratoře je nutné k vyšetření suspektní PTP zaslat zkumavku srážlivé krve pacienta ke stanovení přítomnosti protilátek proti trombocytům v séru a zkumavku nesrážlivé krve EDTA pro přímou detekci vázaných autoprotilátek a k HPA genotypizaci. Průkaz protilátek proti trombocytům v séru se provádí v souladu se zavedenými laboratorními postupy nepřímými testy DIFT, ELISA, FC. Vázané autoprotilátky se mohou detekovat pomocí FC ze vzorku nesrážlivé krve, pokud je ve vzorku dostatečné množství trombocytů. Identifikace trombocytových protilátek se provádí testem MAIPA nebo pomocí technologie xMAP Luminex, případně jinými alternativami [45].
REFRAKTERNOST K TROMBOCYTOVÝM TRANSFUZNÍM PŘÍPRAVKŮM
Trombocyty se v běžné klinické praxi podávají AB0/RhD kompatibilní, HLA nebo HPA kompatibilita se nezohledňuje. Účinnost transfuze trombocytů je definována tzv. CCI indexem (corrected count increment). Lze jej vypočítat podle vzorce:
CCI = {PLT po (109/l) – PLT před (109/l) } × povrch těla (m2) /PLT v přípravku (1011). Za jednu hodinu po transfuzi by jeho stanovení mělo dosahovat hodnoty minimálně 10. Za refrakternost k trombocytovým transfuzním přípravkům se považuje neadekvátní vzestup počtu trombocytů, kdy CCI za jednu hodinu po transfuzi dosahuje hodnot nižších než 7,5×109/l. Kromě CCI je k hodnocení refrakternosti možné použít index PI (the post-transfusion increment) nebo PPR (the percentage platelet recovery) [49,50].
Příčiny refrakternosti se dělí do dvou skupin, na imunitně a neimunitně podmíněné. Mezi nejčastější neimunitní příčiny refrakternosti patří infekce, horečka, medikace pacienta (např. Vancomycin, Amphotericin B), krvácení, DIC, reakce štěpu proti hostiteli, venookluzivní nemoc a splenomegalie. Transfundované trombocyty vedou k dostatečnému CCI 1 hodinu po transfuzi, avšak nepřežívají do druhého dne [49,50]. Neimunitní faktory jsou zodpovědné za většinu (80–90 %) případů refrakterností. Naproti tomu mezi imunitní příčiny refrakternosti patří AB0 inkompatibilita, protilátky proti HLA antigenům I. třídy a anti-HPA protilátky. Imunitní faktory jsou příčinou jen asi 20–25 % případů refrakterností [50,51]. V důsledku dřívější imunizace pacienta transfuzemi, těhotenstvím nebo transplantací jsou aloprotilátky nejčastěji namířeny proti HLA antigenům I. třídy nebo se anti-HLA protilátky mohou vyskytovat současně s anti-HPA protilátkami. Refrakternost způsobená pouze specifickými anti-HPA protilátkami se vyskytuje poměrně vzácně. Z anti-HLA protilátek, které jsou klinicky závažné a mohou způsobit refrakternost, to jsou protilátky proti HLA-A a -B antigenům. HLA-Cw antigeny jsou také exprimovány na trombocytech, ale vzhledem k jejich nižší expresi a omezeným datům týkající se vlivu anti-HLA-Cw protilátek na účinnost transfuze trombocytů u imunizovaných pacientů se při výběru HLA shodného dárce trombocytů k HLA-Cw antigenům nepřihlíží [50].
Při podezření na refrakternost je nutné provést vyšetření anti-HLA protilátek a protilátek proti trombocytům ze séra pacienta k vyloučení imunitní příčiny. Vyšetřovací metody zahrnují LCT test k detekci anti-HLA protilátek, ELISA, DIFT, FC nebo MAIPA k detekci anti-trombocytových protilátek nebo lze anti-HLA a anti-HPA protilátky detekovat senzitivnějšími metodami s využitím technologie xMAP Luminex [49].
V případě imunitního typu refrakternosti, který je způsobený anti-HLA protilátkami, je nutné zajistit HLA shodné či kompatibilní transfuze trombocytů. HLA-A, -B shodného dárce trombocytů lze vyhledat v některém registru HLA otypovaných dárců krve. Pokud je transfuze účinná a dojde k adekvátnímu nárůstu trombocytů, mělo by se pokračovat v podávání trombocytů od HLA shodných dárců. Pokud nejsou k dispozici HLA shodní dárci, lze vybrat dárce s neshodným HLA antigenem v širší antigenní specifitě. Pokud nejsou HLA otypovaní dárci k dispozici, lze jako alternativu podat kompatibilní trombocyty od HLA neshodného dárce dané krevní skupiny na základě negativního výsledku CM. Podávání trombocytů na základě negativního výsledku CM mezi dárcem a příjemcem umožňuje zajistit vhodného dárce trombocytů bez potřeby dostupného panelu HLA typovaných dárců krve, bez známé HLA typizace příjemce a je finančně méně nákladné při krátkodobé léčbě refrakterních pacientů (bez nutnosti HLA typizace nebo identifikace protilátek). Hlavní nevýhodou podávání kompatibilních trombocytů na základě negativního CM je potřeba opakovaně provádět vyšetření CM pokaždé, když je vyžadována transfuze trombocytů a také riziko další imunizace pacienta, která může negativně ovlivnit výběr dárců pro budoucí transfuze trombocytů [50].
Podávání deleukotizovaných transfuzních přípravků snižuje riziko aloimunizace, přičemž jejich spotřeba v České republice kontinuálně narůstá. Přesto se refrakternost k podání trombocytů objevuje stále častěji, a to zejména v důsledku neimunitních faktorů. Jedním z možných vysvětlení je nárůst nových léčebných technologií a postupů, které ve svém důsledku zvyšují počet vedlejších vlivů na efekt a odpověď organizmu na podání transfuze trombocytů [52].
ZÁVĚR
Testování protilátek a antigenů poskytuje důležité informace, které napomáhají lékařům ve stanovení diagnózy a v optimalizaci léčby. I když u ITP nemá testování autoprotilátek vzhledem k nízkému záchytu patřičnou výpovědní hodnotu, v některých případech může být nápomocné. Detekce polékových protilátek vede k vyloučení preskripce daného léku z medikace pacienta. U PTP a MPTR je pro budoucí hemoterapii žádoucí výběr vhodných HPA či HLA otypovaných dárců krve. Laboratorní potvrzení FNAIT může včasnou léčbou zabránit manifestaci onemocnění v případě budoucího těhotenství. Diagnostický proces někdy ztěžuje fakt, že do laboratoře není často dodán odpovídající biologický materiál. V případě FNAIT se mnohdy nemyslí na odběr vzorku od matky a v případě, kdy není možné odebrat vzorek novorozenci k typizaci HPA, nebývá využita možnost odběru vzorku od otce. Jindy je dodán nevhodný vzorek, případně jeho nedostatečné množství. Tyto nedostatky mnohdy znemožňují laboratorní průkaz přítomných protilátek. Smyslem předkládané souhrnné práce je poskytnout přehledné a ucelené informace o problematice imunitních trombocytopenií a usnadnit orientaci lékařů v nabízených vyšetřeních a požadavcích na biologický materiál k vyšetření.
Seznam zkratek
CCI – corrected count increments
CD – cluster of differentiation
CM – cross-match, křížová zkouška
DIC – diseminovaná intravaskulární koagulace
DIFT – destičkový imunofluorescenční test
DITP – poléková imunitní trombocytopenie
EDTA – ethylendiamintetraoctová kyselina, protisrážlivý roztok
ELISA – enzyme-linked immunosorbent assay
FC – průtoková cytometrie
FNAIT – fetální a neonatální aloimunitní trombocytopenie
GP – glykoprotein
HIT – heparinem indukovaná trombocytopenie
HLA – human leukocyte antigens
HPA – human platelet antigens
ITP – imunitní trombocytopenie
MAIPA – monoclonal antibody-specific immobilization of platelet antigen
MPTR – refrakternost k trombocytovým transfuzním přípravkům
PI – the post-transfusion increment
PPR – the percentage platelet recovery
PTP – potransfuzní purpura
TTP – trombotická trombocytopenická purpura
Podíl autorů na přípravě rukopisu
LJ – příprava první a konečné verze rukopisu
HL – revize, korekce rukopisu
Čestné prohlášení
Autoři prohlašují, že v souvislosti s tématem, vznikem a publikací článku nejsou ve střetu zájmů a vznik a publikace článku nebyly podpořeny žádnou farmaceutickou firmou.
Do redakce doručeno dne 2. 7. 2020.
Přijato po recenzi dne 5. 3. 2021.
RNDr. Libuše Janků
Transfuzní a tkáňové oddělení
FN Brno
Jihlavská 20
625 00 Brno
e-mail: janku.libuse@fnbrno.cz
Zdroje
- Rinder HM, Tomer A. Platelet production, kinetics, and hemostasis. In: Simon TL, Snyder EL, Solheim BG et al. Rossi’s principles of transfusion medicine. 4th ed., Blackwell Publishing 2009; 149–167.
- Varghese LN, Defour JP, Pecquet Ch, Constantinescu SN. The thrombopoietin receptor: structural basis of traffic and activation by ligand, mutations, agonists, and mutated calreticulin. Front Endocrinol. 2017; 8 : 59. publikováno elektronicky 31. března 2017. DOI: 10.3389/fendo.2017.00059.
- Gauer RL, Braun MM. Thrombocytopenia. Am Fam Physician. 2012; 85 (6): 612–622.
- Lochowitz AJ, Curtis BR. Clinical applications of platelet antibody and antigen testing. Lab Med. 2011; 42 (11): 687–692.
- Provan D, Stasi R, Newland AC, et al. International consensus report on the investigation and management of primary immune thrombocytopenia. Blood. 2010; 115 (2): 168–186.
- Curtis BR, McFarland JG. Platelet immunology and alloimmunization. In: Simon TL, Snyder EL, Solheim BG et al. Rossi’s principles of transfusion medicine. 4th ed., Blackwell Publishing 2009; 168–186.
- Ouabdelmoumene Z, El Housse H, Zarati F, et al. Frequencies of human platelet antigens (HPA-1, -2, -3, -4, and -5) among the Moroccan blood donors. Int J Blood Transfus Immunohematol. 2018; 8 : 100038Z02ZO2018.
- Curtis BR, McFarland JG. Human platelet antigens – 2013. Vox Sang. 2014; 106 : 93–102.
- Metcalfe P. Platelet antigens and antibody detection. Vox Sang 2004; 87 (Suppl.1): 82–86.
- Heikal NM, Smock KJ. Laboratory testing for platelet antibodies. Am J Hematol. 2013; 88 : 818–821.
- Porcelijn L, Huiskes E, de Haas M. Progress and development of platelet antibody detection. Transfus Apher Sci. 2020; 59 (1): 102 705.
- Porcelijn L, Huiskes E, Comijs-van Osselen I, et al. A new bead-based human platelet antigen antibodies detection assay versus the monoclonal antibody immobilization of platelet antigens assay. Transfusion. 2014; 54 : 14861–1492.
- Maślanka K, Michur H, Guz K, et al. The relevance of HPA-15 antigen expression for anti-HPA-15 antibody detection. Int Jnl Lab Hem. 2012; 34 : 65–69.
- Cines DB, Bussel JB, Liebman HA, Luning Prak ET. The ITP syndrome: pathogenic and clinical diversity. Blood 2009; 113 : 6511–6521.
- Matzdorff A, Meyer O, Ostermann H, et al. Immune thrombocytopenia – current diagnostics and therapy: recommendations of a joint working group of DGHO, ÖGHO, SGH, GPOH, and DGTI. Oncol Res Treat. 2018; 41 (suppl 5): 1–30.
- Swinkels M, Rijkers M, Voorberg J, Vidarsson G, Leebeek FWG, Jansen AJG. Emerging concepts in immune thrombocytopenia. Front Immunol; publikováno elektronicky 30. dubna 2018. DOI: 10.3389/fimmu.2018.00880.
- Nishioka T, Yamane T, Takubo T, Ohta K, Park K, Hino M. Detection of various platelet-associated immunoglobulins by flow cytometry in idiopathic thrombocytopenic purpura. Cytometry B Clin Cytom. 2005; 68 (1): 37–42.
- Jernas M, Hou Y, Stromberg Celid F, et al. Differences in gene expresion and cytokine levels between newly diagnosed and chronic pediatric ITP. Blood. 2013; 122 (10): 1789–1792.
- Rose NR. Negative selection, epitope mimicry and autoimmunity. Curr Opin Immunol. 2017; 49 : 51–55.
- Cooper N. State of the art – how I manage immune thrombocytopenia. Br J Haematol. 2017; 177 : 39–54.
- Hamidpour M, Khalili G, Tajic N, Shamsian BS, Hamidpour R. Comparative of three methods (ELIZA, MAIPA and flow cytometry) to determine anti-platelet antibody in children with ITP. Am J Blood Res. 2014; 4 (2): 86–92.
- Teraz-Orosz A, Cooper N, Crawley JTB, Salles-Crawley II. Detection of anti-platelet antibodies in immune thrombocytopenia by flow cytometry. Br J Haematol. 2019; 184 (5): 844–847.
- Aster RH, Curtis BR, McFarland JG, Bougie DW. Drug-induced immune thrombocytopenia: pathogenesis, diagnosis and management. J Thromb Haemost. 2009; 7 (6): 911–918.
- George JN, Aster RH. Drug-induced thrombocytopenia: pathogenesis, evalution, and management. Hematology Am Soc Hematol Educ Program. 2009; 153–158.
- Arnold DM, Nazi I, Warkentin TE, et al. Approach to the diagnosis and management of drug-induced immune thrombocytopenia. Transfus Med Rev. 2013; 27 (3): 137–145.
- Royer DJ, George JN, Terrell DR. Thrombocytopenia as an adverse effect of complementary and alternative medicines, herbal remedies, nutritional supplements, foods, and beverages. Eu J Haematol. 2010; 84 : 421–429.
- Arnold DM, Kukaswadia S, Nazi I, et al. A systematic evaluation of laboratory testing for drug-induced immune thrombocytopenia. J Thromb Haemost. 2013; 11 (1): 169–176.
- McFarland JG. Detection and identification of platelet antibodies in clinical disorders. Transfus Apher Sci. 2003; 28 : 297–305.
- Regan F, Lees CC, Jones B, Nicolaides KH, Wimalasundera RC, Mijovic A, on behalf of the royal college of obstetricians and gynaecologists. Prenatal management of pregnancies at risk of fetal neonatal alloimmune thrombocytopenia (FNAIT). Scientific impact paper No. 61. BJOG. 2019; 126: e173–e185.
- Mella MT, Eddleman K. Neonatal alloimmune thrombocytopenia. Int J Clin Transf Med. 2015 3 : 29–40.
- Curtis BR. Recent progress in understanding the pathogenesis of fetal and neonatal alloimmune thrombocytopenia. Br J Haematol. 2015; 171 : 671–682.
- Wienzek-Lischka S, König IR, Papenkort EM, et al. HLA-DRB3*01 : 01 is a predictor of immunization against human platelet antigen-1a but not of the severity of fetal and neonatal alloimmune thrombocytopenia. Transfusion. 2017; 57 : 533–540.
- Loewenthal R, Rosenberg N, Kalt R, et al. Compound heterozygosity of HLA-DRB3*01 : 01 and HLA-DRB4*01 : 01 as a potential predictor of fetal neonatal alloimmune thrombocytopenia. Transfusion. 2013; 53 : 344–352.
- Delbos F, Bertrand G, Croisille L, Ansart-Pirenne H, Bierling P, Kaplan C. Fetal and neonatal alloimmune thrombocytopenia: predictive factors of intracranial hemorrhage. Transfusion. 2016; 56 : 59–66.
- Masson E, Vidal C, Deschamps M, et al. Incidence and risk factors of anti-HLA immunization after pregnancy. Hum Immunol. 2013; 74 (8): 946–951.
- Saito S, Ota M, Komatsu Y, et al. Serologic analysis of three cases of neonatal alloimmune thrombocytopenia associated with HLA antibodies. Transfusion. 2003; 43 (7): 908–917.
- Starcevic M, Tomicic M, Malenica M, Zah-Matakovic V. Neonatal alloimmune thrombocytopenia caused by anti-HLA-A24 alloantibodies. Acta Paediatr. 2010; 99 : 630–632.
- Dahl J, Refsum E, Ahlen MT, et al. Unraveling the role of maternal anti-HLA class I antibodies in fetal and neonatal thrombocytopenia – antibody specificity analysis using epitope data. J Reprod Immunol. 2017; 122 : 1–9.
- Schallmoser K, Kutschera J, Macher S, et al. Delayed detectability of anti-HPA-3a by the MAIPA assay in a severe neonatal alloimmune thrombocytopenia, but successful transfusion of incompatible donor platelets: a case report. Vox Sang. 2006; 91 : 181–183.
- Cooper N, Bein G, Heidinger K, Santoso S, Sachs UJ. A bead-based assay in the work-up of suspected platelet alloimmunization. Transfusion. 2016; 56 : 115–118.
- Bonstein L, Haddad N. Taking a wider view on fetal/neonatal alloimmune thrombocytopenia. Thromb Res. 2017; 151 (Suppl 1): 100–102.
- Petermann R, Bakchoul T, Curtis BR, Mullier F, Miyata S, Arnold DM, for the Subcommittee on Platelet Immunology. Investigations for fetal and neonatal alloimmune thrombocytopenia: communication from the SSC of the ISTH. J Thromb Haemost. 2018; 16 : 2526–2529.
- Albalawi M, Zolaly M, Alkhayat N, Al Sharif O, Elyamany G. Current understanding of post transfusion purpura: a systematic review. J Am Sci. 2015; 11 (10): 146–151.
- Taaning E, Tonnesen F. Pan-reactive platelet antibodies in post-transfusion purpura. Vox Sang. 1999; 76 : 120–123.
- Hawkins J, Aster RH, Curtis BR. Post-transfusion purpura: current perspectives. J Blood Med. 2019; 10 : 405–415.
- Rafei H, Yunus R, Nassereddine S. Post - transfusion purpura: a case report of an underdiagnosed phenomenon. Cureus. 2017; 9 (5): e1207. Publikováno elektronicky 1. května 2017. DOI: 10.7759/cureus.1207.
- Farhadfar N, Desai A, Sivapiragasam A, Harris J, Desai A, Hindenburg A. Diagnosis and management of post transfusion purpura: a case report. J Clin Case Rep. 2015; 5 : 6. Publikováno elektronicky 9. června 2015. DOI: 10.4172/2165-7920.1000550.
- Shtalrid M, Shvidel L, Vorst E, Weinmann EE, Berrebi A, Sigler E. Post-transfusion purpura: a challenging diagnosis. Isr Med Assoc J. 2006; 8 : 672–674.
- Hod E, Schwartz J. Platelet transfusion refractoriness. Br J Haematol. 2008; 142 : 348–360.
- Stanworth SJ, Navarrete C, Estcourt L, Marsh J. Platelet refractoriness – practical approaches and ongoing dilemmas in patient management. Br J Haematol. 2015; 171 : 297–305.
- Juskewitch JE, Norgan AP, De Goey SR, et al. How do I manage the platelet transfusion-refractory patient? Transfusion. 2017; 57 : 2828–2835.
- Rioux-Massé B, Cohn C, Lindgren B, Pulkrabek S, McCullough J. Utilization of cross-matched or HLA-matched platelets for patients refractory to platelet transfusion. Transfusion. 2014; 54 : 3080–3087.
Štítky
Hematologie a transfuzní lékařství Interní lékařství Onkologie
Článek vyšel v časopiseTransfuze a hematologie dnes
Nejčtenější tento týden
2021 Číslo 3- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
- Antikoagulační léčba u pacientů před operačními výkony
-
Všechny články tohoto čísla
- Nové poznatky v patofyziológii Ph-negatívnych myeloproliferatívnych neoplázií
- Změny v imunitním systému u neléčených nemocných s chronickou lymfocytární leukémií – část 2: nespecifická imunita
- POEMS syndrom – vzácné onemocnění asociované s monoklonální gamapatií a polyneuropatií: diagnostika a terapie
- Laboratorní diagnostika imunitně podmíněných trombocytopenií
- Ph negativní myeloproliferativní neoplázie na českých hematologických centrech – analýza dat MIND
- Kryokonzervované směsné trombocyty v náhradním roztoku
- Mnohočetná plazmocytóza lymfatických uzlin s přítomností monoklonální gamapatie – plazmocelulární neoplázie či indolentní B-lymfom?
- Primář MUDr. Jiří Horák, 11. 6. 1936 – 21. 6. 2021
- Transfuze a hematologie dnes
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Laboratorní diagnostika imunitně podmíněných trombocytopenií
- Nové poznatky v patofyziológii Ph-negatívnych myeloproliferatívnych neoplázií
- POEMS syndrom – vzácné onemocnění asociované s monoklonální gamapatií a polyneuropatií: diagnostika a terapie
- Kryokonzervované směsné trombocyty v náhradním roztoku
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



