-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
PREZIDENTSKÉ SYMPOZIUM
Vyšlo v časopise: Transfuze Hematol. dnes,22, 2016, No. Supplementum1, p. 7-13.
Kategorie: 30. Olomoucké hematologické dny
2927. GRANULOCYTOPENIE – PATOFYZIOLOGIE, DIAGNOSTIKA, LÉČBA
Čermák J.
(Ústav hematologie a krevní transfuze, Praha)
Abstrakt sdělení není k dispozici.
2966. DIFERENCIÁLNÍ DIAGNOSTIKA EOZINOFILIE
Doubek M., Brychtová Y., Adam Z.
(Interní hematologická a onkologická klinika, LF MU a FN, Brno)
ÚVOD
Eozinofilie je častým nálezem u řady onemocnění, včetně onemocnění onkologických či interních. Na druhou stranu klonální hypereozinofilie sama o sobě může mít zhoubný průběh.
INCIDENCE
Údaje o incidenci eozinofilie v české či slovenské populaci neznáme. Podle zahraničních dat je eozinofilie přítomna u < 0,2 % pacientů s normálními parametry krevního obrazu. Incidence život ohrožujícího idiopatického hypereozinofilního syndromu je pak asi 0,5 případů na 100 000 obyvatel a rok.
Základní dělení eozinofilií
Eozinofilie se dělí na:
- Sekundární eozinofilie – cytokiny indukovaný reaktivní fenomén
- Primární (klonální) eozinofilie – přítomny histologické, cytogenetické nebo molekulární známky klonality
- Idiopatická eozinofilie – není prokázána neklonální či klonální příčina. Hypereozinofilní syndrom je pak podmnožinou idiopatické eozinofilie, kdy je přítomno více než 1,5.109/l eozinofilů a je prokázáno poškozování orgánů a tkání eozinofily.
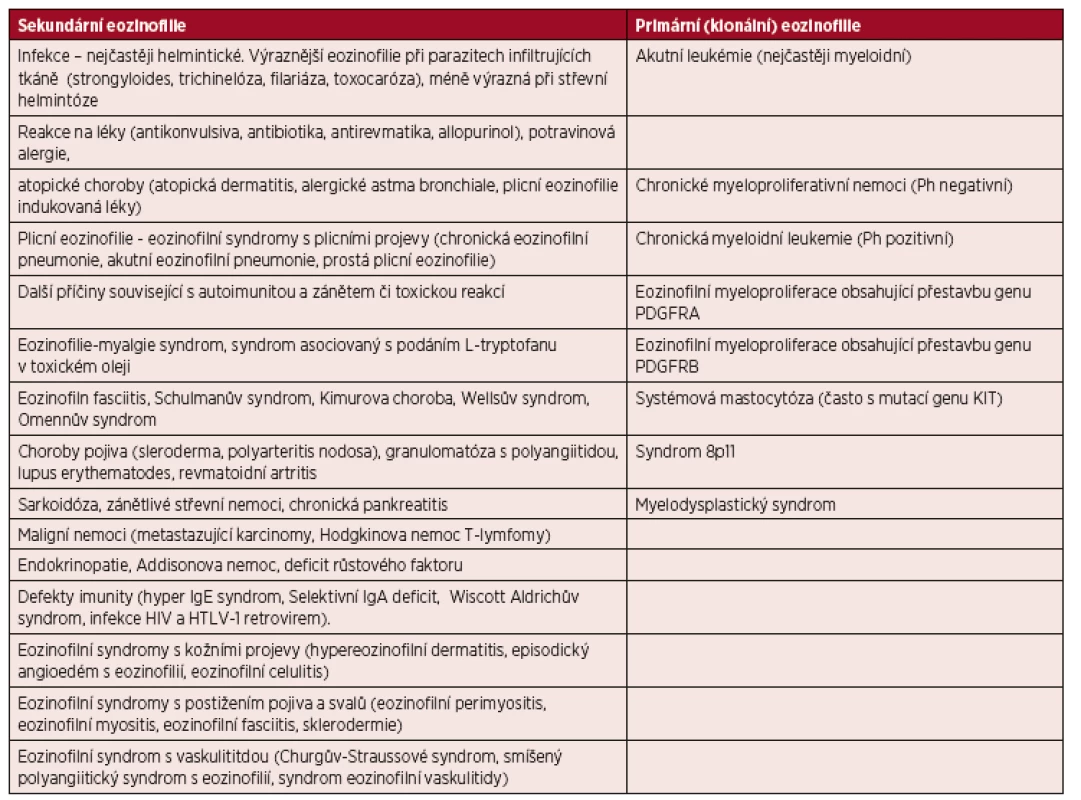
Přehled příčin eozinofilie uvádí tabulka 1.
Při diferenciální diagnostice eozinofilie je vhodné přihlédnout i k absolutnímu počtu ezinofilů v periferní krvi, i když pravděpodobnost ireverzibilního orgánového postižení při eozinofilii nezávisí na absolutním počtu všech eozinofilů.
VYBRANÉ PŘÍČINY EOZINOFILIE
1) Infekce
Eozinofilie nejčastěji provází parazitární choroby. Tyto lze nomenklaturně rozdělit na parazitující prvoky (protozoa) a na parazitující červy (vermes), pro které se v lékařství používá termínu helminti.
2) Alergické choroby
V průmyslových zemích jsou alergie nejčastější příčinou eozinofilie (senná rýma, alergická rýma, astma, reakce na léky či jiné látky, alergická cystitida). Tyto alergie však způsobují nejčastěji jen mírný (0,5 – 0,7.109/l), výjimečně střední vzestup počtu eozinofilů.
K alergickým eozinofiliím patří rovněž tzv. DRESS syndrom (drug rash with eosinophilia and systemic symptomes), který je formou alergické reakce na léky. Z léků mohou vyvolat eozinofilii antibiotika, antituberkulotika, antimykotika, antiflogistika, antipsychotické léky, fenothiaziny, chlorpromazin, antiepileptika, hydantoináty, barbituráty, antidiabetika, antikoagulancia a protinádorové léky. Nejčastějšími reakcemi, doprovázejícími lékovou alergickou reakci, je kožní raš, makulopapulózní exantém, výjimečně jiná forma postižení kůže až exfoliativní dermatitis, často i teplota s bolestmi kloubů a svalů. Méně častá je hmatná lymfadenopatie. Interval mezi zahájením užívání léku a vznikem polékové alergické reakce je nejčastěji 2 – 6 týdnů.
3) Eozinofilní syndromy s plicní manifestací a další plicní nemoci
Eozinofilie provází často řadu plicních onemocnění – plicní karcinomy, sarkoidózu či astma (viz alergické choroby). Může jít jak o důsledek plicního postižení, tak i o příčinu.
4) Maligní choroby
Mnoho maligních chorob je provázeno vzestupem počtu eozinofilů. Nejčastěji jde o pokročilé malignity s metastázami. Často je eozinofilie nalézána u pacientů s plicními tumory nebo hematologickými chorobami (neklonální eozinofilie u Hodgkinůva lymfomu, nehodgkinských lymfomů obzvláště T typu, akutní lymfoblastické leukemie). V případech maligních lymfoproliferativních onemocnění může eozinofilie předcházet roky jejich další manifestaci. Po úspěšné léčbě maligního lymfoproliferativního onemocnění může eozinofilie vymizet a relabovat může opět až měsíce před zřetelným relapsem maligní choroby.
5) Imunologické příčiny eozinofilie
Imunologické příčiny eozinofilie zahrnují hyper - IgE syndrom, izolovaný deficit IgA nebo Wiskottův-Aldrichův syndrom.
Hypereozinofilní syndrom vyvolaný T lymfocyty
T-lymfocyty stojí v pozadí všech reaktivních eozinofilií. V některých případech známe příčinu, a pak je eozinofilie klasifikována dle této příčiny (léky, paraziti apod.), nebo příčinu neznáme a pak jednotka spadá to kategorie idiopatického hypereozinofilního syndromu, pokud splňuje jeho kritéria uvedená výše. Na hypereozinofilní syndrom mediovaný T-lymfocyty lze usuzovat v případech neprokázané klonální eozinofilie, nebo při prokázané klonální populaci T-lymfocytů, produkujících vysoké koncentrace výše uvedených interleukinů, signalizujících Th2 profil těchto buněk. Pacienti s hypereozinofilií způsobenou T-lymfocyty mají častěji vysokou koncentraci imunoglobulinu IgE a polyklonální hypergamaglobulinemií. Za fyziologických okolností dochází k T-lymfocyty mediované eozinofilii při parazitárních infekcích. Za patologických okolností dochází k této reakci u alergických stavů, autoimunitních onemocnění a nakonec i u maligních lymfomů, obzvláště T-typu.
Další stavy spojené s eozinofilií
Mezi eozinofilní syndromy ne zcela jasné etiologie, ale pravděpodobně rovněž související s T-buněčnou imunitní odpovědí patří následující choroby: idiopatický epizodický angioedém s eozinofilií, hypereozinofilní dermatitis, eozinofilní celulitida (Wellsův syndrom), eozinofilní myositidy, eozinofilní fascitida, eozinofilní gastroenteritidy či Crohnova nemoc nebo ulcerozní kolitida spojené s eozinofilií. Tyto relativně benigní nemoci s eozinofilií obvykle poškozují jen jeden orgán a počet eozinofilů v krvi může a nemusí být zvýšený.
Eozinofilie může provázet i revmatoidní artritidu a další kolagenózy. Odborná literatura popisuje takzvanou eozinofilní myopatii.
Syndrom eozinofilní fascitidy (Schulmanův syndrom) je příbuzný sklerodermii, které se značně podobá makroskopickým postižením kůže a podkoží a odlišuje se eozinofilií, infiltrací podkoží eozinofily a přítomností hypergamaglobulinemie.
Kimurova choroba je podobné onemocnění mladých mužů. Projevuje podkožními infiltráty v oblasti hlavy a krku a je spojena s regionální lymfadenopatií. Histolocký obraz zahrnje folikulární hyperplazii a eozinofilní infiltráty.
6) Klonální eozinofilie
Klonální eozinofilie jsou způsobena primární poruchou v kostní dřeni. Klonalitu lze pak prokázat cytogeneticky nebo molekulárně genetickými metodami. Klonální eozinofilie spadá do skupiny myeloproliferativních nemocí. Ke klonálním eozinofiliím patří podle klasifikace Světové zdravotnické organizace chronická eozinofilní leukemie (CEL) a myeloidní a lymfoidní neoplázie spojené s eozinofilií a abnormalitami genů PDGFRA, PDGFRB nebo FGFR1.
Chronická eozinofilní leukemie
Ke kritériím CEL patří: 1) zvýšený počet nezralých eozinofilů v krvi (nad 1,5 x 109/l) a v kostní dření, která navíc může obsahovat až do 20 % blastů, 2) infiltrace tkání nezralými eozinofily, 3) jsou přítomny hematologické abnormality: degranulace, vakuolizace, hyposegmentace, hypersegmentace eozinofilů, hepatomegalie, splenomegalie, zvýšená koncentrace vitaminu B12, abnormálním skóre leukocytární alkalické fosfatázy, které bývá spíše zvýšené než snížené, myelofibróza, myeloidní dysplazie a bazofilie a 4) je vyloučena abnormalita genů PDGFRA, PDGFRB, FGFR1 či BCR-ABL1 (bývá u chronické myeloidní leukemie). V literatuře jsou popsány i morfologické odchylky patologických eozinofilů od jejich fyziologických protějšků při vyšetření elektronovou mikroskopií. Odlišení CEL od idiopatického hypereozinofilního syndromu může být ale někdy komplikované. K odlišení může pomoc průkaz chromozomálních abnormalit v buňkách eozinofilní řady u CEL, které u HES přítomny nebývají, nebo zmožení blastů v kostní dřeni enbo periferní krvi.
Kardiální, neurologické a další komplikace (viz níže) se mohou vyvinout v případě CEL stejně jako u idiopatického HES s polyklonálními eozinofily, nebo při parazitární chorobě, a proto nepředstavují rozlišovací ukazatel.
Diagnostické kritéria CEL jsou přesně uvedena v tabulce 2.
Tab. 2. Kritéria chronické eozinofilní leukemie a hypereozinofilního syndromu podle Světové zdravotnické organizace. 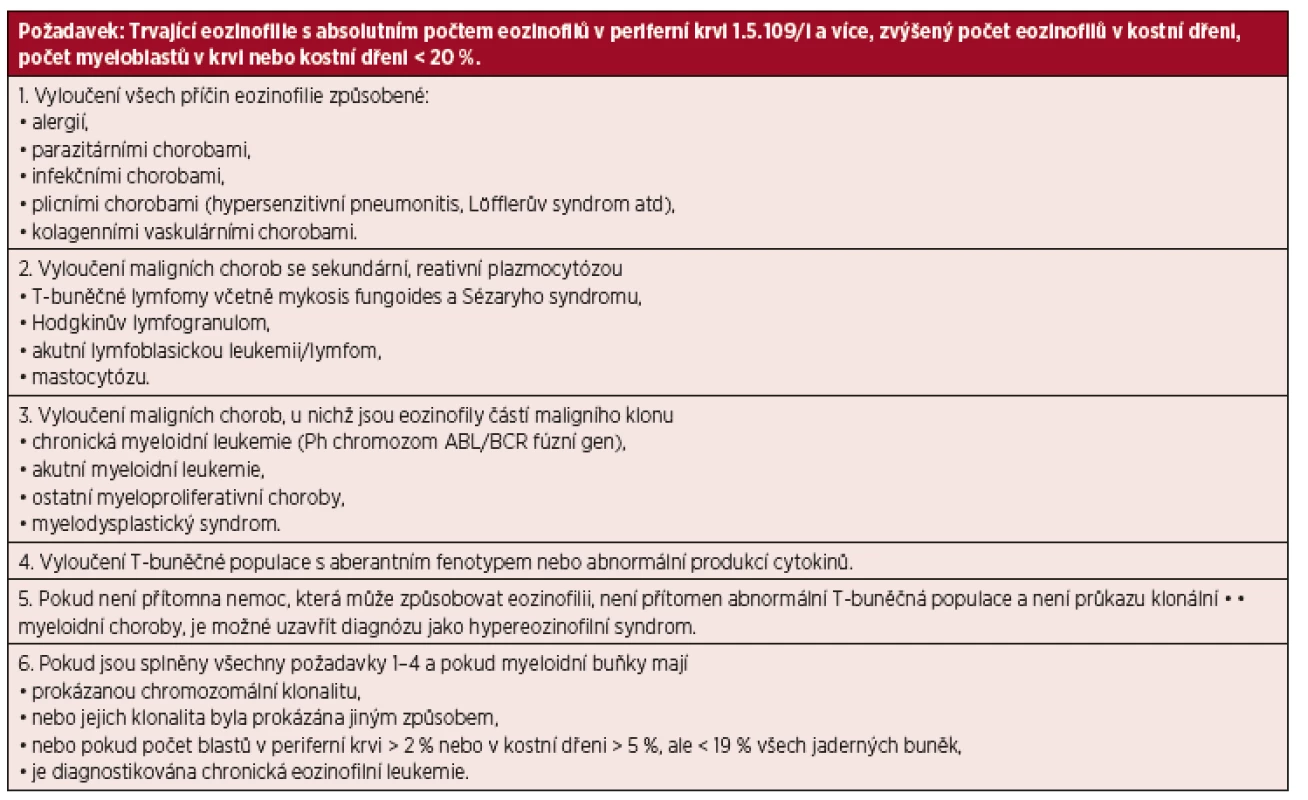
Myeloidní a lymfoidní neoplázie spojené s eozinofilií a abnormalitami genů PDGFRA, PDGFRB nebo FGFR1
- a) Eozinofilní myeloproliferace spojené s přestavbou genů PDGFRA nebo PDGFRB
V některých přípdech lze prokázat souvislost klonální eozinofilie s mutacemi či přestavbami genů pro takzvaný platelet derived growth factor receptor alfa (PDGFRA) a beta (PDGFRB). Klinickými projevy se tyto případy eozinofilie podobají HES (viz níže), systémové mastocytóze nebo CEL. Z klinického průběhu nelze tedy na přítomnost mutace PDGFRA usuzovat.
Gen PDGFRA kóduje tyrozinkinázový receptor PDGFRA a je lokalizován na chromosomu 4 (4q12). Jako první byla popsána translokace t(1;4)(q44;q12), která má za následek fúzi genu PDGFRA s genem FIP1L1 za vzniku fúzního genu FIP1L1-PDGFRA. K aktivaci PDGFRA může dojít také v důsledku dalších chromosomálních translokací. Například t(4;22)(q12;q11), která má za následek vznik fúzního genu BCR-PDGFRA. Postupně byly rozeznávány další geny, které po fúzi s genem PDGFRA: KIF5B, CDK5RAP2, STRN nebo ETV. Každá z výše uvedených cest vede ke konstitutivní aktivaci genu PDGFRA.
Fúzní gen FIP1L1 byl nalezen asi u 12-14 % všech pacientů s eozinofilií, většinou u mužů.
Gen PDGFRB je lokalizován na chromosomu 5, v oblasti 5q33. K jeho aktivaci dochází různými chromosomálními translokacemi, například t(5;12)(q33;p13), která vede ke vzniku fúzního genu ETV6-PDGFRB. Popsáno bylo dalších několik genů, které mohou být fúzními partnery genu PDGFR.
Velmi významným faktem, který se týká tohoto podtypu eozinofilie je fakt, že zde existuje velmi účinná terapeutická možnost tyzozinkinázovými inhibortory, například imatinibem (1, 2, 3, 11, 12, 13).
- b) Eozinofilní myeloproliferativní syndrom 8p11 (FGFR1 eozinofilní myeloproliferativní syndrom)
Myeloproliferativní syndrom 8p11 je známý pod označením human stem cell leukemie/lymphoma syndrome. Je asociován s mutací či translokací receptoru 1 fibroblastového růstového faktoru (fibroblast growth factor receptor-1 FGFR-1).
Klinicky se tato myeloproliferace projevuje eozinofilií, myeloproliferativními a myelodysplastickými znaky, lymfadenopatií, zvýšeným výskytem současného maligního T-lymfomu. Nemoc má agresivní průběh.
7) Idiopatický hypereozinofilní syndrom (HES)
Termín idiopatický HES je vyhrazen pro případy zvýšeného počtu eozinofilů, u nichž nebyl prokázán klonální ani reaktivní původ. Definice HES je následující:
Počet eozinofilů v periferní krvi je ≥ 1,5 x 109/l po dobu 6 měsíců, nebo do smrti způsobené důsledky eozinofilie.
Není přítomna jiná rozpoznatelná příčina hypereozinofilie.
Jsou příznaky orgánového poškození, například kardiomyopatie, hepatosplenomegalie, plicní poruchy, horečky, anémie, ale i neurologické poruchy.
Incidence hypereozinofilního syndromu je poměrně malá. Chorobou průměrně ročně onemocní jeden člověk z 200 000 obyvatel. Muži jsou postiženi 9x častěji než ženy. Nejvíce se manifestuje u lidí ve věku 20 – 50 let.
Častým nálezem u HES je postižení řady tkání a orgánů. Nejčastější je postižení srdce (58 %), případně mozku a periferních nervů (54 %). K příznakům HES tedy patří: eozinofilní endomyokardiální choroba (k poškození srdečního svalu dochází ve třech stádiích: 1) akutní nekrotické, 2) pozdější trombotické, 3) pozdní fibrotické stádium; první zánětlivé stadium je charakterizováno eozinofilní infiltrací endomyokradu; vznik poškození srdce není závislý na počtu eozinofilů) (13, 14), postižení centrálního nervového systému, trombembolická nemoc, plicní projevy (plicní infiltráty, které jsou prchavé, trvají od několika hodin do několika dní), postižení zažívacího traktu, postižení pohybového aparátu (bolesti svalů a kloubů), kožní postižení (např. kopřivkovitý výsev), postižení ledvin, postižení zraku (suché konjuktivitidy, episkleritidy a abnormality cév sítnice), imunologické poruchy (někdy extrémně zvýšené hladiny imunoglobulinu E).
8) Eozinofilie provázející další myeloproliferativní choroby
Euzinofilie může provázet chronickou myeloidní leukémii (CML), pravou polycytémii (PV), esenciální trombocytémii (ET) i primární myelofibrózu (PMF). Dále se může vyskytovat u chronické neutrofilní leukemie (CNL), neklasifikovatelných myeloproliferací, chronické myelomonocytární leukemie (CMML) i systémové mastocytozy (častá mutace genu KIT).
ZÁVĚR
Zvýšený počet eozinofilů může provázet velký počet chorob, z nichž nechteré jsou dobře, jiné hůře léčebně ovlivnitelné. V některých případech je eozinofilie zcela asymptomatická a je otázkou, zda se příznaky nemoci neobjeví až po několika letech trvání eozinofilie.
Každopádně každý nález zvýšeného počtu eozinofilů vyžaduje pečlivého vyšetření a pokud je rozpoznán patologický podklad tohoto zvýšení, tak i odpovídající léčbu.
2861. NOVÉ POHLEDY NA PREVENCI A LÉČBU ŽILNÍCH TROMBOEMBOLICKÝCH KOMPLIKACÍ U ONKOLOGICKÝCH PACIENTŮ
Hluší A., Krčová V.
(HOK, FN, Olomouc)
Žilní tromboembolické komplikace (HŽT - hluboká žilní trombóza, PE - plicní embolie) patří k hlavním komplikacím maligních onemocnění a jsou druhou nejčastější příčinou smrti u této skupiny pacientů. Z celkového počtu pacientů postižených tromboembolickou nemocí (TEN) tvoří nemocní s nádorovým onemocněním asi 20-30 %. Nález TEN při autopsii byl zjištěn u více než 50 % zemřelých pro zhoubné nádorové onemocnění, za života byla přitom diagnóza HŽT či EP potvrzena u 15 % pacientů. Uvedené komplikace vedou nejen ke zkrácení přežívání, ale i k významnému zhoršení kvality života a mají významný vliv na další prognózu nemocných. Riziko TEN komplikací u onkologických pacientů je 7 násobně zvýšeno oproti nemocným bez nádoru, převyšuje tak riziko spojené s nejčastějšími vrozenými trombofilními stavy.
Patofyziologie vzniku TEN komplikací u pacientů s nádory je komplexní. Hyperkoagulační stav je spojen s aktivací endotelu zánětlivými cytokiny (např. TNF-alfa, IL-1, IL-6) uvolňovaných makrofágy po kontaktu s maligními buňkami. Endotel může být poškozován i přímo maligními buňkami. Prokoagulačně působí nadprodukce tkáňového faktoru, zvýšené hladiny FVIII, fibrinogenu, PAI-1. Trombogenně působí některé „cancer procoagulans“ uvolňované samotnými nádorovými elementy (např. tkáňový faktor či mucin u adenokarcinomů). Dále přispívá zvýšená adhezivita a agregabilita trombocytů, může se podílet i sekundární trombocytémie při malignitě. Významně se může podílet spontánní nebo chemo - či radioterapií indukovaný rozpad nádoru. Nezřídka se podílí i mechanický cévní útlak samotným nádorem. Riziko TEN dále navyšuje potřeba operačních zákroků. Trombofilní riziko narůstá při imobilizaci, cytostatické terapii, ozařování, hormonální nebo antiangiogenní léčbě, zavedení centrálního žilního přístupu či septických komplikacích. K vyjmenovaným faktorům se dále mohou přidružovat klasické vrozené i získané trombofilní stavy a působení dalších rizik vyplývajících z případné další komorbidity.
Individuální rizikový profil pacienta s nádorovým onemocněním se odvíjí od typu nádorového onemocnění, jeho pokročilosti (stádium), lokalizace nádoru vzhledem k možnému cévnímu útlaku, charakteru protinádorové léčby a dalších faktorech nesouvisejících s vlastním nádorem (věk, anamnéza prodělané TEN příhody, vrozená trombofilie, komorbidita, obezita, kardiální insuficience). K nejrizikovějším nemocným patří pacienti s karcinomy pankreatu, plic, žaludku, střeva, tumory mozku, zvláště metastazující, dále lymfomy a myelomy. Postoperační riziko je nejvyšší u rozsáhlých resekčních výkonů, zejména v oblasti břicha a pánve. Vysoké riziko spojené s protinádorovou léčbou představují např. tamoxifen, cisplatina, L-asparagináza, thalidomid, antiangiogenní léky jako bevacizumab, sorafenib aj.
Indikace a kontraindikace antikoagulační terapie u pacientů s nádorovým onemocněním a žilními TEN komplikacemi se shodují s postupy u pacientů bez nádoru. Cílem antikoagulační léčby je zabránit progresi trombózy či embolie, předcházet jejich recidivám při minimalizaci rizika krvácivých komplikací. Oproti běžné populaci je antikoagulační terapie TEN u pacientů s nádory spojena jak se zvýšeným rizikem krvácení, tak s vyšším rizikem recidivy trombóz. Antikoagulační terapie je doporučena u všech pacientů s nádorovým onemocněním s novou i rekurentní HŽT a EP. Neléčená PE má 30% mortalitu, většinou z recidivy embolizace. U neléčené symptomatické HŽT je riziko plicní embolie 50%
Pro iniciální léčbu první epizody TEN u nádorových onemocnění jsou využívány nízkomolekulární hepariny (LMWH), fondaparinux, případě nefrakcionovaný heparin (UFH). Srovnávací studie u uvedených modalit nejsou. Extrapolací dat z klinických studií u neselektovaných pacientů vychází nejlepší poměr účinnosti a bezpečnosti pro LMWH, které jsou tak při iniciální léčbě jednoznačně doporučovány. Další výhody nízkomolekulárních heparinů jsou v příznivějších ekonomických parametrech, jednoduchém dávkování i možnosti ambulantní terapie. Lepší parametry přežívání u pacientů léčených LMWH vyvolaly vědecký zájem o možné přímé antineoplastické vlastnosti LMWH. Data srovnávající jednotlivé druhy LMWH dostupná nejsou, nejrozsáhlejší zkušenosti jsou s enoxaparinem, deltaparinem, tinzaparinem a nadroparinem. UFH bývá v uvedené indikaci využíván pouze okrajově. Použití fondaparinuxu může být výhodné u pacientů s anamnézou heparinem indukované trombocytopenie. Léčba pomocí nových antikoagulancií (NOAC) dabigatranem, rivaroxabanem, apixabanem, není t.č. pro nedostatek klinických dat u TEN a nádorových onemocnění v současnosti doporučována. I přes výrazně menší výskyt lékových interakcí ve srovnání s VKAs může jejich plasmatickou hladinu ve smyslu zvýšení i snížení ovlivňovat řada cytostatik a imunosupresiv.
Pro iniciální použití trombolýzy u pacientů s nádorovým onemocněním a extenzivní EP či HŽT není evidence dostatečná. Neexistují nicméně data, která by její použití vylučovala. Indikace trombolýzy by měla být pečlivě individuálně zvážena s posouzením benefitu, bezpečnosti a rizik. Není doporučena pro pacienty s CNS postižením a přítomností dalších rizikových faktorů pro krvácení.
V dlouhodobé antikoagulační terapii TEN komplikací asociovaných s nádory a sekundární profylaxi jsou dle konsenzuálních doporučení (ACCP 2012, NCCN 2011, ASCO 2013) rovněž prefeferovány LMWH před antikoagulační terapií antagonisty vitaminu K (VKAs). Výsledky studií srovnávající uvedené modality po 3-6 měsících léčby prokázaly lepší účinnost LMWH v rekurenci HŽT. Meta-analýza 7 studií tyto závěry potvrdila s redukcí relativního rizika o 53 %. Výhody LMWH jsou známy: odpadá nutnost rutinní monitorace, nejsou lékové a potravinové interakce, kratší poločas je rovněž bezpečnostní výhodou. Mezi negativa LMWH patří vyšší ekonomická náročnost a injekční aplikace v porovnání s VKAs. Použití VKAs uvedená doporučení ponechávají pro případy, kde LMWH není dostupný. Doporučená cílová hladina INR je 2-3.
Délka antikoagulační léčby při první epizodě HŽT je minimálně 3-6 měsíců. Přínos dalšího pokračování nad toto období je třeba individuálně zvážit s pečlivým posouzením rizika rekurence TEN a rizika významných krvácivých komplikací. Posuzujeme, zda jde o trombózu provokovanou, výsledky biomarkerů, zobrazovacích metod, toleranci dosavadní léčby i preference pacienta. Pokračování v antikoagulační terapii je přínosné u pacientů s progresivní či metastazující malignitou nebo u pacientů v chemoterapii, u kterých není přítomno vysoké riziko krvácení. Volba antikoagulancia vychází ze zkušeností s dosavadní terapií. V případě prolongované terapie LMWH je třeba brát v úvahu i riziko osteoporózy.
Závažným klinickým problémem je rekurence TEN komplikací během antikoagulační léčby. V případě rekurence trombózy při subterapeutické hladině INR během terapie VKAs je možná přemosťující léčba plnou dávkou LMWH s návratem k účinné perorální antikoagulaci nebo pokračování v plné léčbě LMWH. Pokud dojde k recidivě trombózy při léčbě LMWH, eskaluje se dávka nízkomolekulárního heparinu o 20 až 25 %, účinnější může být dávkování LMWH 2 x denně. V případech rekurentních TEN komplikací je častěji využívána monitorace léčby pomocí anti-Xa.
Mezi specifické problémy pacientů s nádorovými chorobami a výskytem trombotických komplikací patří antikoagulační léčba u pacientů s renálním selháním, kteří vyžadují důslednou laboratorní monitoraci biochemických a koagulačních parametrů vč. anti-Xa při léčbě LMWH. Pro část pacientů může být vhodná i terapie UFH. Pro dlouhodobou léčbu je u této skupiny pacientů za bezpečnou považována perorální léčba VKAs. Další specifickou skupinu pacientů představují nemocní s implantovanými kavafiltry. Jednoznačně doporučeny jsou u pacientů s akutní TEN komplikací a kontraindikací antikoagulančí léčby. Nelze opomenout ani výskyt katetrových trombóz a žilních trombóz ve splanchnickém řečišti, které jsou u pacientů s nádory též častější.
V klinické praxi se poměrně často setkáváme s případy incidentální HŽT, tzn. klinicky asymptomatické trombózy zjištěné při zobrazovacím vyšetření provedeném z jiného důvodu (nejčastěji v rámci stážování nádorové choroby). Výskyt těchto případů je dle některých studií více než 50%. Nález incidentální TEN příhody zhoršuje prognózu i kvalitu života pacientů. Pokud není kontraindikace, měla být i v těchto případech zahájena plná antikoagulační léčba.
Management antikoagulační léčby TEN u nádorových onemocnění u pacientů s vysokým rizikem krvácení patří mezi nejsložitější klinické situace. U těchto nemocných je třeba individuálně zhodnotit míru rizika krvácení se zohledněním stadia a typu malignity, potřebné délky antikoagulační léčby, potřeby invazivních zákroků, přítomnosti či pravděpodobnosti rozvoje trombocytopenie, výchozích koagulačních parametrů, jaterní insuficience, rizika sepse a DIC. Zhodnotit je třeba přítomné i potenciální zdroje krvácení a dle možností je sanovat. V přítomnosti menších krvácivých komplikací lze vést plnou antikoagulační léčbu za její důsledné monitorace. V případě absolutní kontraindikace antikoagulační terapie je doporučeno zvážit implantaci kaválního filtru. V případě trombocytopenie je za bezpečnou hranici považován počet Tr nad 50x109/l. U hodnot nižších nebo při významném riziku krvácení z jiných příčin lze léčit sníženou dávkou LMWH. VKAs jsou u vysoce rizikových pacientů nevhodné.
Stejně jako správně vedená antikoagulační léčba u pacientů s nádory a TEN komplikacemi snižuje morbiditu a mortalitu, tak indikované podání antikoagulační profylaktické léčby je pro pacienty obrovským přínosem a jejich kvalitu života i přežívání ovlivňuje ještě výrazněji. K primární profylaxi jsou používány většinou LMWH, své místo má rozhodně i fyzikální prevence. Ke stanovení rizika TEN a indikaci profylaxe jsou k dispozici prediktivní modely; např. Khoranův bodový systém jako rizikové faktory hodnotí tumory pankreatu, žaludku, lymfomy, karcinom plic, gynekologické tumory, počet Tr nad 350x109/l, hemoglobin od 100 g/l, použití léků stimulujících erytropoesou, leukocytozu nad 11x109/l, BMI nad 35. Samozřejmostí je perioperační profylaxe chirurgických zákroků. Běžná doba profylaxe je kolem dvou týdnů nebo do plné mobilizace a do dimise. U rozsáhlých výkonů v oblasti pánve a břicha se prodlužuje až na 4 týdny i po propuštění pacienta. Rovněž pacienti s malignitou hospitalizovaní z nechirurgického důvodu by profylakticky být zajištěni měli. Paušální profylaxe u ambulantních pacientů v chemoterapii doporučena není. Těžit z ambulantní profylaxe mohou pacienti s metastatickým nebo lokálně pokročilým tumorem v chemoterapii s nízkým rizikem krvácení. Profylaxe je rutinně doporučena pro pacienty s mnohočetným myelomem léčených IMiDs (thalidomid, lenalidomid). Přínos primární ambulantní profylaxe by měl být individuálně hodnocen opakovaně v průběhu léčby malignity se zohledňováním vývoje samotného nádorového onemocnění, komplikací, komorbidit, výskytu přídatných trombofilních stavů či rizikových faktorů a aktuálního rizika krvácení.
Podpořeno grantem IGA - LF 2016-001.
Štítky
Hematologie a transfuzní lékařství Interní lékařství Onkologie
Článek Mnohočetný myelomČlánek TransplantaceČlánek POSTGRADUÁLNÍ SEKCE 1Článek Laboratorní diagnostikaČlánek PODPŮRNÁ PÉČEČlánek TRANSFUZNÍ PROBLEMATIKAČlánek RejstříkČlánek Wiedermannova přednáškaČlánek Postgraduální sekce 2Článek Konference Ošetřovatelství 1Článek Konference Ošetřovatelství 2Článek Mnohočetný myelomČlánek PsychologieČlánek TransplantaceČlánek MorfologieČlánek Dárcovské a léčebné aferézyČlánek Laboratorní diagnostikaČlánek Anémie/CytopenieČlánek OŠETŘOVATELSTVÍ
Článek vyšel v časopiseTransfuze a hematologie dnes
Nejčtenější tento týden
2016 Číslo Supplementum1- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Mnohočetný myelom
- Akutní leukemie/Chronická myeloidní leukemie
- Transplantace
- MALIGNÍ LYMFOMY/CHRONICKÁ LYMFOCYTÁRNÍ LEUKEMIE
- POSTGRADUÁLNÍ SEKCE 1
- Laboratorní diagnostika
- PODPŮRNÁ PÉČE
- TRANSFUZNÍ PROBLEMATIKA
- Rejstřík
- Wiedermannova přednáška
- Postgraduální sekce 2
- Symposium on Advances in Molecular Hematology 1: Lymphoma Pathogenesis
- Konference Ošetřovatelství 1
- Symposium on Advances in Molecular Hematology 2: Stressed Hematopoiesis
- Symposium on Advances in Molecular Hematology 3: State of the Art Invited Lecture
- Konference Ošetřovatelství 2
- Mnohočetný myelom
- Akutní leukemie/Chronická myeloidní leukemie
- Psychologie
- Konference zdravotních laborantů 1
- Myelodysplastický syndrom/ Myeloproliferativní onemocnění
- Transplantace
- Maligní lymfomy/Chronická lymfocytární leukemie
- Konference zdravotních laborantů 2
- PREZIDENTSKÉ SYMPOZIUM
- Morfologie
- Dárcovské a léčebné aferézy
- Laboratorní diagnostika
- Anémie/Cytopenie
- OŠETŘOVATELSTVÍ
- Transfuze a hematologie dnes
- Archiv čísel
- Aktuální číslo
- Pouze online
- Informace o časopisu
Nejčtenější v tomto čísle- Myelodysplastický syndrom/ Myeloproliferativní onemocnění
- Morfologie
- Anémie/Cytopenie
- MALIGNÍ LYMFOMY/CHRONICKÁ LYMFOCYTÁRNÍ LEUKEMIE
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání