-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Počátky a směřování hypolipidemické léčby v 21. století
Autoři: prof. MUDr. Rosolová Hana, DrSc.
Působiště autorů: 2. interní klinika Fakultní nemocnice Plzeň ; Univerzita Karlova ; Lékařská fakulta v Plzni ; Centrum preventivní kardiologie
Vyšlo v časopise: Svět praktické medicíny, 1, 2020, č. 2, s. 37-46
Kategorie: Medicína v ČR: přehledový článek
Souhrn
Od objevu cholesterolu uběhla téměř dvě století – během nich byla prokázána souvislost mezi koncentrací cholesterolu v krvi a vznikem aterosklerotického plátu, došlo k porozumění metabolismu cholesterolu a ostatních lipidů, k objevení hypolipidemik a ke zjištění, že snížení cholesterolu v krvi vede k redukci komplikací aterosklerózy až dokonce k regresi ateromových plátů. Farmakologická léčba hypolipidemiky byla zahájena v polovině 20. století. Nové poznatky Goldsteina a Browna o cholesterolu na molekulárněgenetické úrovni a zavedení statinů do léčby hypercholesterolemie přinesly přelom v léčbě a prevenci aterosklerózy a nejčastějších kardiovaskulárních onemocnění. Postupně byly definovány a snižovány cílové hodnoty cholesterolu, resp. LDL-cholesterolu podle celkového kardiovaskulárního rizika pacientů. Vývoj hypolipidemické terapie směřuje k fixním kombinacím hypolipidemik a k biologické léčbě inhibitory enzymu PCSK9.
Hyperlipoproteinemie, resp. dyslipidemie (což je lepší výraz pro poruchu lipidového metabolismu, neboť vyjadřuje nejen zvýšení, ale i nežádoucí snížení některých lipoproteinových částic) má mnoho společného s arteriální hypertenzí. Obě skupiny chorob jsou zároveň nejvýznamnějšími rizikovými faktory pro kardiovaskulární onemocnění (KVO) na podkladě aterosklerózy, obě skupiny chorob jsou většinou asymptomatické, ale přitom vyžadují celoživotní léčbu. Základem léčby dyslipidemií i arteriální hypertenze je modifikace životních návyků, především zanechání kouření, racionální strava s omezením nasycených mastných tuků ve prospěch nenasycených, omezení solení a pravidelný pohyb. Farmakologická léčba dyslipidemie nemá tak dlouhou tradici jako farmakologická léčba arteriální hypertenze, přesto prochází hypolipidemická léčba obrovským rozvojem a od monoterapie přechází ke kombinační terapii, jako tomu bylo v léčbě hypertenze. Kombinační terapie dyslipidemie je stejně jako kombinační léčba hypertenze účinnější a přináší podobné výhody: použití nižších dávek jednotlivých léků, což je v asociaci s nižším rizikem nežádoucích účinků, postihuje více metabolických poruch než monoterapie, tak jako u hypertenze postihuje více mechanismů regulujících krevní tlak. Kombinace hypolipidemik (např. statin + ezetimib) působí synergicky podobně jako kombinace některých antihypertenziv (např. inhibitoru ACE s blokátorem kalciových kanálů) u hypertenze. Pokud se použijí oba léky ve fixní kombinaci, zlepší to adherenci i perzistenci pacientů k celoživotní léčbě. Nelze opominout známý fakt, že pokud zahájíme léčbu dyslipidemie a arteriální hypertenze současně, docílíme většího snížení celkového kardiovaskulárního (KV) rizika a zlepšení adherence k léčbě relativně o 30 %.
Historie objevu cholesterolu a jeho vztahu k ateroskleróze
První krystaly cholesterolu izoloval ve žlučových kamenech francouzský lékař a chemik Francois Poulletier de la Salle v roce 1758 (pouze z ústního podání, bez publikace). V roce 1815 francouzský chemik Michel Eugene Chevreul nazval tuto látku cholesterin. Existence cholesterolu (Ch) jako molekuly byla odhalena až německým chemikem Adolfem Windausem v roce 1903, avšak strukturu molekuly Ch upřesnil jeho dlouholetý kolega Heinrich Otto Wieland v roce 1930 (oba obdrželi Nobelovu cenu za chemii). Biosyntézu cholesterolu (a mastných kyselin) studovali biochemici Konrad Emil Bloch (Američan německého původu) a Feodor Felix Konrad Lynen (Němec), kteří obdrželi Nobelovu cenu za fyziologii a lékařství v roce 1964. Syntézu Ch provedl poprvé americký chemik Robert Burns Woodward v roce 1951, nositel Nobelovy ceny za chemii v roce 1965 (čerpáno z encyklopedie Wikipedia).
I když akumulace lipidů ve stěnách arterií byly popsány již v roce 1856 německým patologem R. Virchowem, první důkazy o souvislosti mezi Ch a patologickými nálezy v aortě přinesly pokusy ze začátku 20. století prováděné ruským patologem Nikolajem Nikolajevičem Aničkovem na králících krmených čistým Ch, vaječnými žloutky a slunečnicovým olejem. Bohužel se tato souvislost neprokázala na jiných zvířecích modelech (např. na psech), jejichž cévy nejsou tak citlivé k Ch a tvorbě aterosklerózy jako u králíků, a proto byl objev zapomenut. Americký vědec John William Gofman bral výsledky Aničkovových pokusů vážně a zkoumal transport lipidů v krevním řečišti. Gofman byl první, kdo koncem 40. let 20. století objevil tři hlavní skupiny lipoproteinů pomocí ultracentrifugace. Objevil a pojmenoval LDL-Ch jako „špatný“ a HDL -Ch jako „dobrý“ v souvislosti s aterosklerózou a rizikem koronární nemoci. Byl právem nazýván otcem klinické lipidologie. V jeho objevech pokračoval vědecký tým Donalda S. Fredricksona, který dále prohloubil znalosti o lipoproteinovém metabolismu a jeho vztahu k ateroskleróze.1 Známá je především Fredricksonova klasifikace lipoproteinů do pěti skupin podle elektroforézy z roku 1967 (tab. 1).
Tab. 1. Fredricksonova/WHO klasifikace hyperlipoproteinemií 
Ve 20. letech 20. století popsal norský patolog Francis Harbitz souvislost mezi šlachovými tumory (xantomy) a náhlou srdeční smrtí. Na konci 30. let norský lékař Carl Müller popsal řadu pacientů s xantomy a anginou pectoris; sledoval celé rodiny a jako první předpokládal, že se jedná o dědičné onemocnění (obr. 1). V první polovině 20. století byla popsána familiární hypercholesterolemie (FH) jako Harbitzova -Müllerova nemoc.2 V polovině 60. let libanonský lékař Avedis K. Khachadurian významně přispěl k potvrzení genetického původu FH. Sledoval rodiny s FH a popsal její dvě základní formy: homozygotní a heterozygotní FH, kterou rozdělil na dominantní a recesivní typ. Zjistil, že děti s homozygotní formou se rodí s velmi vysokými hladinami Ch (kolem 800 mg/dl, tj. 20 mmol/l) a umírají kolem pěti let svého věku na srdeční příhody, zatímco u dětí s heterozygotní formou jsou hladiny Ch o něco nižší (kolem 300–400 mg/dl, tj. 8–10 mmol/l) a srdeční příhody se objevují ve věku 35–60 let.3
Obr. 1. Xantomy na Achillových šlachách. 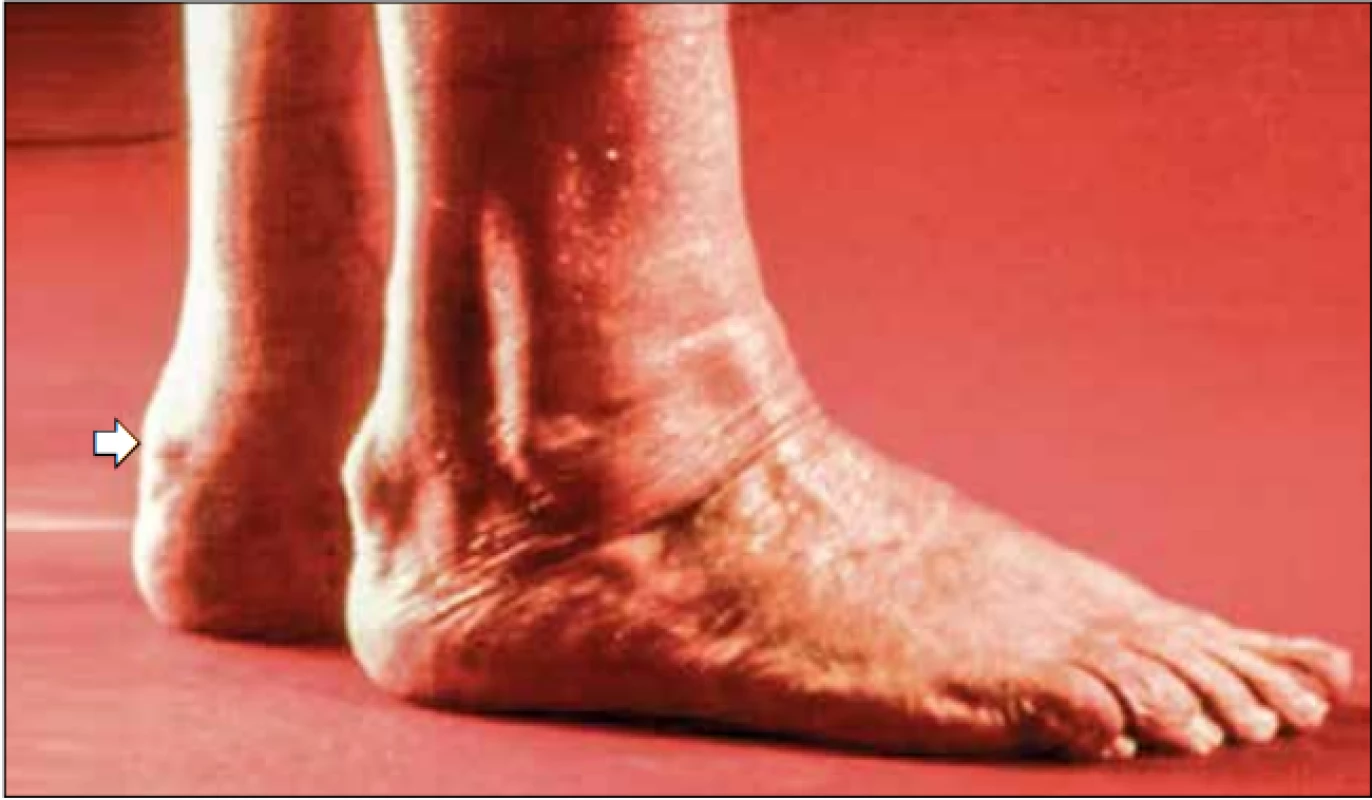
První epidemiologická studie, která vědecky prokázala kauzální souvislost mezi koncentrací Ch v krvi a výskytem srdečního infarktu na podkladě aterosklerózy (AS), byla Framinghamská studie.4 Tato studie byla zahájena po druhé světové válce v USA, neboť američtí muži ve středním věku (40 – 50 let) často umírali na srdeční infarkt a lékařská společnost chtěla vědět, co k tomu vede. Přesto ještě dlouhá léta nebyl vysoký Ch léčen farmakologicky. V průběhu dalších let probíhala řada epidemiologických a preventivních studií, existovaly informace o KV morbiditě a mortalitě v různých zemích. První studií, která prokázala, že různé hladiny Ch jsou ovlivněny různými dietními návyky a dalšími vlivy životního stylu, byla Seven Countries Study.5 Především vysoká konzumace nasycených tuků, např. ve Finsku, vedla k vyšším koncentracím Ch a k 8× vyšší koronární mortalitě ve srovnání s Japonskem a 3× vyšší koronární mortalitě ve srovnání s Itálií. Přesto tato „lipidová hypotéza“ nebyla ještě dlouho přijata širokou odbornou společností.
O velký pokrok ve znalostech metabolismu Ch se zasloužili američtí vědci Joseph Goldstein a Michael Brown (obr. 2); zahájili moderní výzkum cholesterolu na buněčné, molekulární a genetické úrovni. Geneticky klasifikovali typy lipoproteinů, objevili receptory pro LDL-Ch a jejich genetickou regulaci i genetické pozadí kruciálního enzymu v syntéze Ch.6, 7 Goldstein a Brown jsou nositeli Nobelovy ceny ve fyziologii a medicíně z roku 1985. Svými objevy přesvědčili odbornou i laickou veřejnost, že „lipidová hypotéza“ je potvrzena, a přispěli k vývoji statinů, po jejich objevu (viz níže). Spolupracovali s objevitelem statinu A. Endo a zjistili, jak statiny působí; redukcí syntézy Ch dojde k up-regulaci LDL receptorů, což vede ke snížení LDL-Ch, nikoli HDL-Ch. Tím významně podpořili vývoj statinů k léčbě FH i k prevenci a léčbě KVO na podkladě aterosklerózy.
Obr. 2. Joseph L. Goldstein a Michael S. Brown. 
Intervenční studie, tj. farmakologická léčba Ch, s konečnou platností doložila, že Ch je skutečně kauzálním a nezávislým rizikovým faktorem pro KVO, neboť jeho snížením dojde i ke snížení výskytu i úmrtnosti na srdeční infarkty. První taková studie testovala cholestyramin (tj. pryskyřici – viz dále) v primárně preventivní intervenční studii v polovině 80. let 20. století (LRC -CPPT – Lipid Research Clinics Coronary Primary Preventive Trial); cholestyramin významně snížil výskyt fatální i nefatální ischemické choroby srdeční.8
Vývoj farmakologické léčby dyslipidemií
Kyselina nikotinová
K nejstarším hypolipidemikům patří kyselina nikotinová. Na začátku 20. století byla objevena kyselina nikotinová v miligramových dávkách jako vitamin zvaný niacin, vitamin B3 , PP faktor = pellagra preventing factor. Kanadský patolog Rudolf Altschul zjistil v 50. letech 20. století, že niacin ve vysokých (gramových) dávkách snižuje cholesterol i lipidová depozita u králíků s experimentálně vyvolanou aterosklerózou.9 Tento účinek prokázal se spolupracovníky i u lidí.10
Kyselina nikotinová byla indikována především pacientům po infarktu myokardu. Dobrý účinek niacinu na lipidový profil (redukce LDL-Ch o 20 %, zvýšení HDL-Ch o 20 %, snížení triglyceridů [TG] o 20 %) byl opakovaně prokázán včetně redukce lipoproteinu (a) – Lp(a). Ve studii Coronary Drug Project snížil niacin ve srovnání s placebem recidivu infarktu myokardu téměř o 30 % za 6 let, po 15 letech došlo také k nevýznamnému snížení mortality.11 I když byl niacin testován v dalších studiích v kombinacích se statiny i fibráty (klofibrát, gemfibrozil), pro relativně časté nežádoucí účinky nebyl příliš oblíben (vazodilatace v kůži – flush a nepříjemné píchání).
Studie AIM-HIGH (Atherothrombosis Intervention in Metabolic Syndrome with low HDL/high Triglycerides: Impact on Global Health Outcomes) neprokázala lepší kardioprotektivitu ve větvi léčené statinem a niacinem ER ve srovnání s větví léčenou pouze statinem.12 Kombinace niacinu s laropiprantem (tj. látkou, která snižuje flush vyvolaný niacinem) se přidala k zavedené hypolipidemické léčbě (statin ± ezetimib) u pacientů s velmi vysokým KV rizikem ve studii HPS-2 THRIVE (the Heart Protection Study 2-Treatment of HDL to Reduce the Incidence of Vascular Events). Ani v této studii se neprokázalo větší snížení KV příhod ve větvi pacientů léčených niacinem s laropiprantem.13 Niacin tedy selhal ve srovnání se statinem v redukci reziduálního KV rizika, a proto se v Evropě již nepoužívá. Kombinace niacinu s laropiprantem dokonce zvýšila výskyt nefatálních nežádoucích účinků (zvýšení iktů, hladiny glykemie, svalových a gastrointestinálních obtíží), a proto byla stažena z trhu.
Fibráty
Historie první syntézy fibrátů spadá do 50. let 20. století, kdy se fibráty studovaly v rámci výzkumu rostlinných hormonů. Jejich hypolipidemický efekt byl testován u lidí o 10 let později. Ze všech dostupných derivátů byl vybrán klofibrát, který byl nejvíce účinný a nejméně toxický. Na začátku své existence se však fibráty nezapsaly příliš pozitivně do historie léků snižujících KV a celkovou mortalitu. Výsledky první velké mortalitní fibrátové studie ukázaly, že klofibrát sice snižoval výskyt KV příhod, ale zvyšoval celkovou mortalitu (především se zvýšil výskyt karcinomu žlučových cest).14 Druhou negativní událostí bylo zjištění, že kombinace gemfibrozilu s cerivastatinem zvýšila výskyt myopatií, a proto se tato kombinace již nedoporučuje.
Přesný mechanismus hypolipidemických účinků fibrátů byl dlouho neznámý. Později bylo objeveno, že fibráty aktivují PPAR-alfa receptory v jádrech buněk, a tak významně redukují hladinu TG, zvyšují HDL-Ch a snižují počet malých denzních LDL částic ve prospěch větších a méně aterogenních LDL. V monoterapii jsou fibráty dosud nenahraditelné v léčbě těžké hypertriglyceridemie (TG ≥ 7 mmol/l), která ohrožuje svého nositele akutní pankreatitidou.
V kombinaci se statiny jsou vhodné především k léčbě aterogenní dyslipidemie (zvýšené TG a event. snížený HDL-Ch). U nás je v podstatě používán pouze fenofibrát, což je zároveň nejdéle používané hypolipidemikum u nás.15
Kombinace statinu a fenofibrátu, která byla testována u diabetiků 2. typu ve studii ACCORD, se v současné době doporučuje u pacientů s diabetem, u nichž byla dosažena cílová hodnota LDL-Ch podle celkového KV rizika, ale přetrvává vyšší koncentrace TG, případně i nižší HDL-Ch (reziduální KV riziko). U těchto pacientů vede kombinace statinu s fenofibrátem k redukci nefatálních KV příhod, avšak nesnižuje KV mortalitu.16 Kombinace statinu s fenofibrátem byla opakovaně testována a zhodnocena jako dobře tolerovaná a bezpečná kombinační hypolipidemická léčba, která upravuje lipidový profil tak, že snižuje aterogenitu plazmy, jak uvádějí experti v konsenzu věnovaném roli kombinační terapie fenofibrátem se statinem. 17 Fibráty příznivě ovlivňují také mikrovaskulární diabetické komplikace, především zabraňují rozvoji diabetické retinopatie, a to nezávisle na přítomnosti aterogenní dyslipidemie.18
Pryskyřice
Pryskyřice byly vyvinuty jako hypolipidemika v 70. letech 20. století k redukci LDL-Ch. Pryskyřice na sebe vážou žlučové kyseliny, tím omezují jejich enterohepatální cyklus, zvyšují jejich syntézu v játrech a zároveň dochází ke zvýšení počtu LDL receptorů na povrchu jaterních buněk a většímu vychytávání Ch z krve. Redukují glykemii, ale zvyšují hladinu TG, mají malý efekt na HDL-Ch. Většina dat, jež jsou k dispozici, se týká cholestyraminu a colestipolu, které jsou velmi špatně snášeny především pro břišní diskomfort. Novější colesevelam má stejný účinek, ale méně nežádoucích projevů. Indikují se velmi omezeně, spíše u těhotných žen nebo u dětí.
Statiny
Objev statinů znamenal přelom v léčbě cholesterolu, aterosklerózy a prevenci KVO. Mevastatin byl objeven náhodně při studiu hub pro potravinářské účely v roce 1976 Japoncem Akira Endo. Synteticky připravené statiny byly účinnější a lépe tolerované. Jejich hlavní účinek (inhibice enzymu HMG-CoA reduktázy) snižuje syntézu Ch především v jaterních buňkách. První intervenční studie proběhly v 90. letech, průlomovou studií byla studie 4S (Scandinavian Simvastatin Survival Study), která u pacientů po infarktu myokardu prokázala významný účinek simvastatinu, jenž vedl oproti placebu k významnému snížení výskytu koronárních příhod, KV i celkové úmrtnosti.19 Statiny mají nejlepší důkazy z velkých prospektivních studií; snížení LDL-Ch o 1 mmol/l vede k významnému snížení celkové mortality o 10 %, koronární mortality o 20 %, rizika pro velké koronární příhody o 23 % a rizika pro CMP o 17 %.20
Jsou to léky první volby v léčbě dyslipidemií. Jejich kontraindikací je úplná intolerance léčby statiny. V klinické praxi se tento problém zřejmě nadhodnocuje, na čemž se podílejí dva faktory: jednak nocebo efekt (pacient je poučen o možném nežádoucím účinku – bolesti svalů, a tak se bolesti objeví anebo své bolesti jiného původu přisuzuje léčbě statiny) a druhým faktorem jsou negativní nepravdivé informace o statinech, které se šíří na sociálních sítích a v různých médiích. Statinová intolerance samozřejmě existuje a vyskytuje se asi u 5–10 % pacientů léčených statiny. Je však velmi často částečná, tj. pacient snese menší dávku statinu nebo jeho intermitentní podávání. V kombinaci s nefarmakologickými opatřeními a dalšími hypolipidemiky se dá dosáhnout cílových hodnot LDL-Ch podle celkového KV rizika i u pacientů s částečnou intolerancí statinů. Správně rozpoznat a řešit intoleranci statinů je časově náročné, a proto je v přiloženém schématu (obr. 3) uveden algoritmus.21
Obr. 3. Algoritmus managementu statinem asociovaných myopatií (SAM). 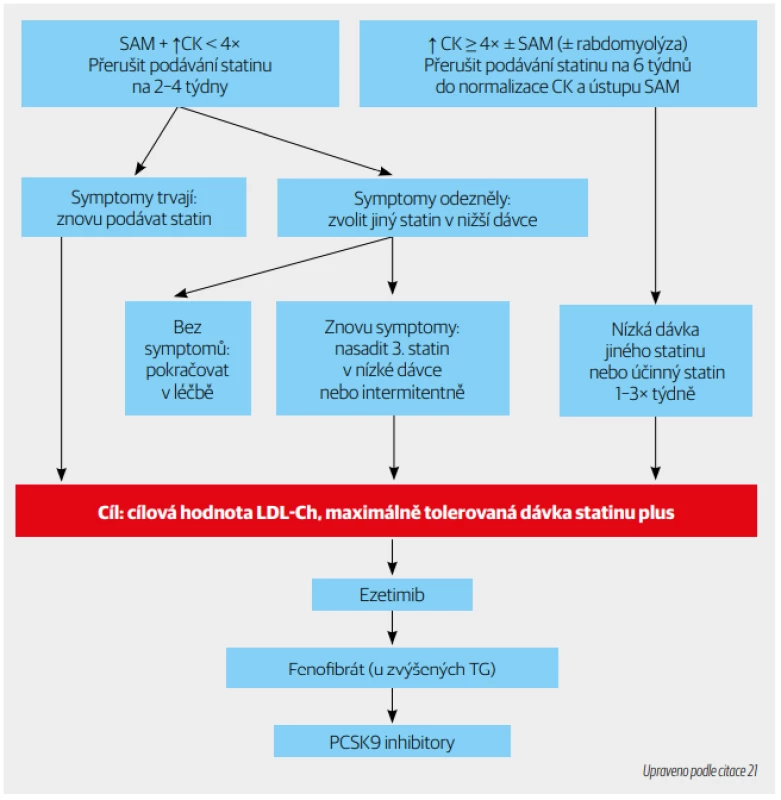
CK – kreatininkináza; TG – triglyceridy Ezetimib
Ezetimib se objevil na farmakologickém trhu poprvé v roce 2002. Jedná se o proléčivo, které se v organismu mění na aktivní glukuronid, jenž působí v řasinkovém lemu tenkého střeva. Glukuronid se váže na NPC1L1 (Niemannův-Pickův C1 like 1) protein, a tím brání reabsorpci cholesterolu ze střeva zpět do krve. Glukuronid opakovaně recirkuluje a to zajišťuje dlouhodobou účinnost ezetimibu při jeho podání 1× denně. Poločas vylučování (především stolicí) je zhruba 22 hodin. Biologická dostupnost ezetimibu není ovlivněna jídlem a jeho farmakokinetika není ovlivněna ani věkem, ani pohlavím.
Kombinace ezetimibu se statinem. Snížená reabsorpce cholesterolu ze střeva však může vyvolat nejen zvýšení počtu receptorů pro cholesterol na povrchu jaterních buněk a jeho větší vychytávání z krve, ale i stimulaci jeho produkce jaterními buňkami. Stejně tak monoterapie statinem může vést k větší reabsorpci cholesterolu ze střeva. Proto kombinace ezetimibu se statinem (nazývaná duální inhibice cholesterolu) je velmi prospěšná a také účinnější než monoterapie jednotlivými léky (obr. 4). 22 V současné době máme k dispozici i fixní kombinace statinu s ezetimibem, které umožňují uzpůsobit léčbu potřebám jednotlivých pacientů. Jedná se konkrétně o fixní kombinace atorvastatinu s ezetimibem (Zoletorv, Zetovar) a fixní kombinace rosuvastatinu s ezetimibem (např. Rosumop Combi, Twicor, Delipid Plus, Zenon). Kdysi populární kombinace simvastatinu s ezetimibem (Inegy) je v současnosti na ústupu z trhu před novějšími kombinacemi.
Obr. 4. Duální inhibice cholesterolu ezetimibem a statinem ukázaná na příkladu rosuvastatinu. 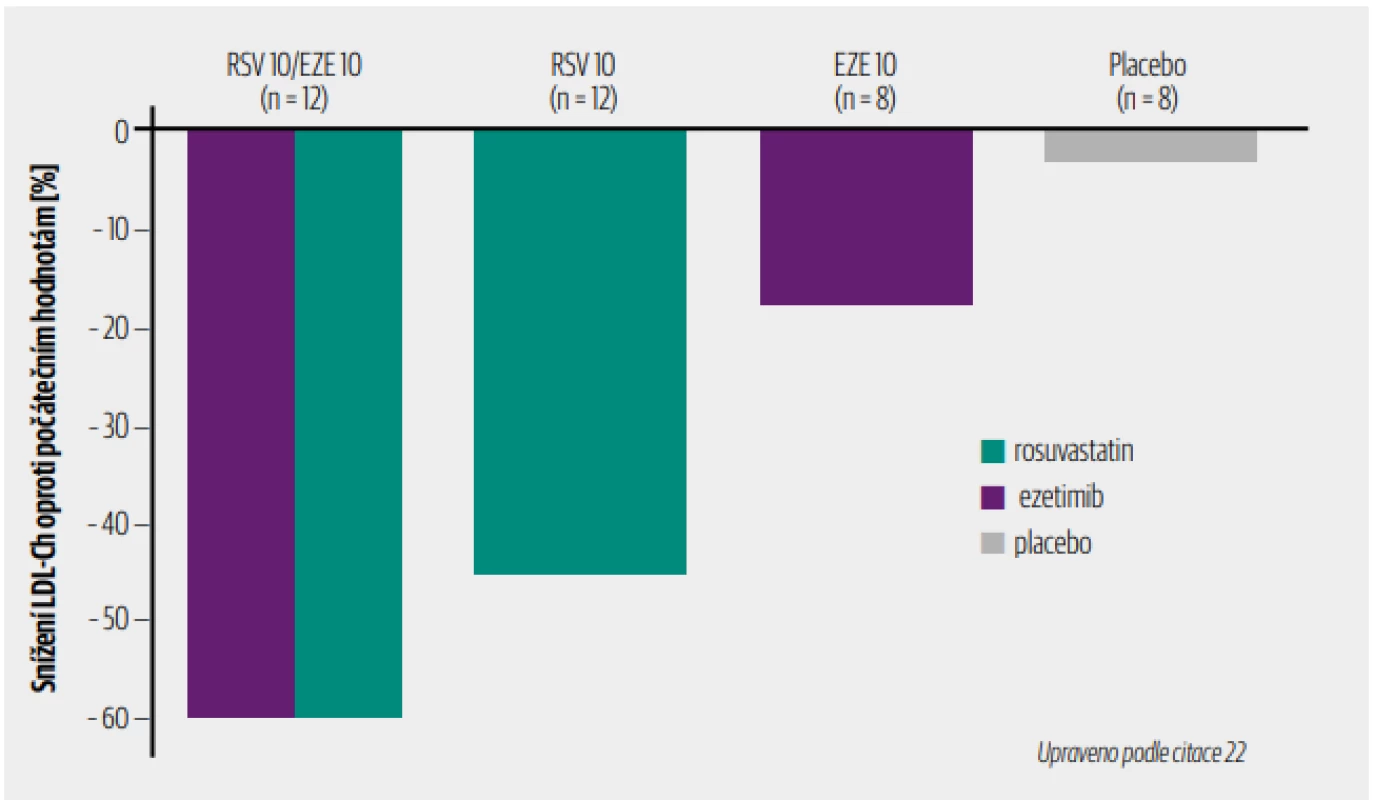
EZE – ezetimib; LDL-Ch – low density lipoprotein cholesterol;
RSV – rosuvastatin
Ezetimib vmonoterapii snižuje LDL-Ch o18 %, rosuvastatin vmonoterapii o43 %, oba léky podané současně o60 %.Byla provedena řada studií s kombinací statinu a ezetimibu, které prokázaly větší účinnost ve srovnání s monoterapií statinem, dobrou snášenlivost a bezpečnost této kombinační léčby. Tato kombinace byla potvrzena jako velmi účinná v prevenci KVO poprvé u nemocných s chronickým renálním onemocněním ve studii SHARP.23
Přelom v indikaci kombinační hypolipidemické terapie statin a ezetimib přinesla bezesporu studie IMPROVE-IT (the IMProved Reduction of Outcomes: Vytorin Efficacy International Trial), která potvrdila, že další snížení LDL-Ch při kombinaci simvastatinu s ezetimibem dále významně snižuje KV riziko. V roce 2017 byla publikována nová analýza ze studie IMPROVE-IT, ve které bylo použito tzv. TIMI skóre pro nemocné po infarktu myokardu. TIMI skóre obsahovalo následujících devět charakteristik: vyšší věk, diabetes mellitus, hypertenze, kouření, ischemická choroba dolních končetin, cévní mozková příhoda, aortokoronární bypass, srdeční selhání a renální dysfunkce. Nízké riziko zahrnuje pacienty s nanejvýš jednou charakteristikou, střední riziko se dvěma a vysoké riziko tři a více z těchto devíti charakteristik. Pacienti ze studie IMPROVE-IT kategorizovaní do vysokého rizika měli největší prospěch z kombinační terapie statinu s ezetimibem.24
Ve studii PRECISE-IVUS byl sledován účinek kombinační terapie atorvastatinem s ezetimibem oproti monoterapii atorvastatinem na primární cíl studie – procentuální objem ateromů v koronárních tepnách pacientů po perkutánní koronární intervenci (PCI). Intravaskulární ultrazvuk (IVUS) na začátku a po 9–12 měsících léčby prokázal, že kombinační hypolipidemická léčba vedla k větší regresi objemu ateromů než monoterapie atorvastatinem.25 Subanalýza studie prokázala, že významnými prediktory pro regresi ateromů byly LDL-Ch a věk. Čím nižší byla koncentrace LDL-Ch a čím starší byl pacient, tím větší byla regrese aterosklerotických plátů.
V japonské studii (Masuda J. a kol., 2015)26 bylo prokázáno, že kombinovaná hypolipidemická léčba ezetimibem s rosuvastatinem vedla k větší regresi objemu ateromů než u monoterapie rosuvastatinem (obr. 5).
Obr. 5. Regrese aterosklerotických plátů při kombinované hypolipidemické terapii 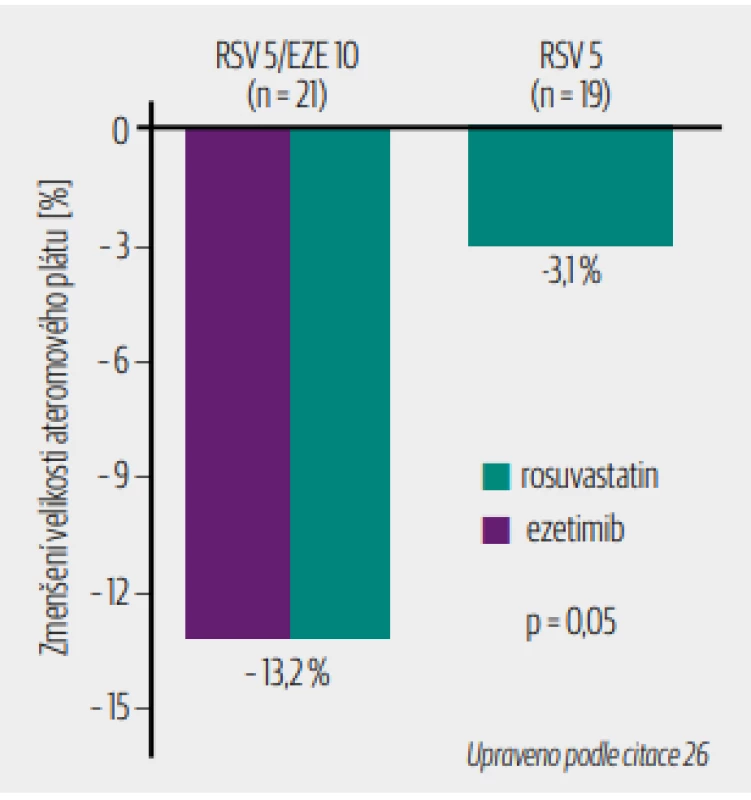
EZE – ezetimib; RSV – rosuvastatin
Regrese ateromů je větší za použití kombinace rosuvastatinu sezetimibem ve srovnání smonoterapií rosuvastatinemS kombinací rosuvastatinu s ezetimibem byly provedeny ještě další studie. Studie ACTE (the efficACy and safeTy of Ezetimibe added on to rosuvastatin versus up titration of rosuvastatin in hypercholesterolemic patiens at risk for coronary heart disease) byla 6týdenní multicentrická mezinárodní studie, která zahrnovala 440 pacientů. Ezetimib 10 mg přidaný k 5 nebo 10 mg rosuvastatinu snížil LDL-cholesterol o 21 % ve srovnání s monoterapií rosuvastatinem, při níž zvýšení dávky rosuvastatinu z 10 na 20 mg snížilo LDL-cholesterol o necelých 6 %. Kombinace rosuvastatinu 5 mg a ezetimibu 10 mg byla účinnější než rosuvastatin 10 mg (rozdíl 12,3 %; p < 0,001) a kombinace rosuvastatin 10 mg + ezetimib 10 mg byla účinnější než rosuvastatin 20 mg (rozdíl 17,5 %; p < 0,001). Významně více pacientů dosahovalo cílových hodnot LDL-cholesterolu při kombinované terapii než při monoterapii rosuvastatinem.27
Všechny tyto studie prokázaly, že kombinace statinu s ezetimibem je velmi dobře tolerovaná, bezpečná a účinná nejen na snížení LDL-Ch, ale i na dosažení cílových hodnot LDL -Ch, případně dosažení sekundárního cíle, tj. non-HDL-Ch nebo koncentrace apolipoproteinu B. Účinná léčba hypercholesterolemie je jednou z nejdůležitějších cest ke snížení celkového KV rizika v sekundární i primární prevenci KVO. Kombinaci statin a ezetimib bychom měli volit tehdy, pokud pacient nedosáhne cílových hodnot LDL-Ch monoterapií statinem v nejvyšší tolerované dávce.
Ezetimib lze použít také v monoterapii, i když jeho účinek není tak intenzivní jako v kombinační léčbě se statinem. Monoterapii lze využít u pacientů s absolutní intolerancí statinů. Experimentální a některé malé klinické studie ukázaly, že ezetimib redukuje nejen celkový a LDL-cholesterol v průměru o 20 %, ale u nemocných s inzulinovou rezistencí (u pacientů s DM 2. typu nebo s metabolickým syndromem) také snižuje koncentraci TG asi o 15 % a zvyšuje koncentraci HDL-cholesterolu zhruba o 2 %, tj. zlepšuje aterogenní dyslipidemii. U jedinců léčených ezetimibem docházelo k významné redukci non-HDL -Ch (o 20 %) i koncentrace apolipoproteinu B, tj. cílových ukazatelů pro léčbu aterogenní dyslipidemie. Pacienti s diabetem 2. typu léčení ezetimibem v monoterapii anebo v kombinaci se statinem měli významně méně malých denzních LDL částic, které se typicky vyskytují u aterogenní dyslipidemie, ve srovnání s diabetiky léčenými pouze statinem.28
Cetrapiby
Epidemiologické studie KVO sice ukázaly, že vyšší HDL-Ch je v asociaci s nižším KV rizikem, ale studie s inhibitory CETP (cholesteryl ester transfer protein) neprokázaly, že by farmakologické zvýšení HDL -Ch vedlo ke snížení KV rizika. Přestože cetrapiby významně zvyšují HDL-Ch (o více než 100 %), nesnižují výskyt KV příhod, a proto nebyly uvedeny na trh jako hypolipidemika. Studie ILLUMINATE s torcetrapibem byla prvním takovým velkým zklamáním; bylo zjištěno, že torcetrapib zvyšuje krevní tlak, což by mohlo vysvětlit jeho nedostatečný kardioprotektivní vliv.29 Pozdější analýzy prokázaly, že nejen torcetrapib, ale i evacetrapib (studie ACCELERATE trial) zvyšují aterogenní apoproteiny. Úspěch anacetrapibu (přidaného k intenzivní statinové léčbě) při snížení KV rizika lze vysvětlit spíše snížením LDL-Ch než zvýšením HDL-Ch (studie REVEAL). Dalcetrapib ve studii dal-OUTCOMES nezvyšoval HDL-Ch tolik jako ostatní cetrapiby, ale genetické studie z nedávné doby naznačují, že by mohl být prospěšný u některých pacientů s určitým genotypem. Ve studiích se pokračuje, ale cesta zvyšování hodnot HDL-Ch v prevenci KVO byla velice zpochybněna.
Biologická léčba dyslipidemií – kombinace inhibitorů PCSK9 se statinem, event. s ezetimibem
Enzym PCSK9 (proproteinová konvertáza subtilisinu/kexinu typu 9) byl objeven teprve v roce 2003 a o dva roky později byla objasněna jeho funkce. Bylo zjištěno, že nemocní se zvýšenou aktivitou genu pro PCSK9 mají vysoké hladiny Ch a velmi vysoké KV riziko (jedna z forem familiární hypercholesterolemie). Naopak u nemocných s velmi nízkými hladinami Ch v plazmě a s velmi nízkým výskytem aterosklerotických vaskulárních onemocnění bylo zjištěno, že mají genetický defekt pro enzym PCSK9 a tím jeho nedostatek. Enzym PCSK9 kromě jiného reguluje počet LDL receptorů na povrchu jaterních buněk. Navázání tohoto enzymu na LDL receptor spolu s LDL částicí vede v jaterní buňce k rozkladu nejen LDL-Ch, ale i LDL receptoru, který se tak nemůže vrátit na povrch buňky a nemůže opětovně sloužit k vychytávání LDL částic. Tak vznikl nápad, že pokud zablokujeme tento enzym protilátkou, můžeme zvýšit počet LDL receptorů, které budou vychytávat LDL částice z krve, a tím snížit hladinu LDL-Ch v plazmě. Je to tedy jednoduchý a velmi přirozený způsob, jak zvýšit recyklaci LDL receptorů, a proto se tato léčba monoklonálními lidskými protilátkami řadí mezi tzv. biologickou léčbu.
Po přidání inhibitoru PCSK9 pacientovi léčenému statinem se koncentrace LDL-Ch sníží o dalších 60–70 %. Kromě toho dochází k poklesu koncentrace VLDL (very low density lipoproteins), především TG (v průměru o 13 %), ke zvýšení koncentrace HDL-Ch (o 7 %) a k významnému poklesu Lp(a) (o 26 %).30 Kombinace PCSK9 inhibitorů se statiny ± ezetimibem je novou a dosud nejúčinnější kombinací v léčbě hypercholesterolemie i smíšené dyslipidemie. V současné době jsou v Evropě registrovány dva léky – evolokumab (Repatha 140 mg) a alirokumab (Praluent 75 mg, 150 mg). Oba se aplikují podkožně 1–2× měsíčně. S oběma preparáty se uskutečnila řada studií, jejichž výsledky jsou velmi podobné a homogenní. Většina studií probíhala s kombinační hypolipidemickou terapií, kdy ke standardní léčbě statinem ± ezetimibem byla přidána léčba inhibitorem PCSK9. Některých studií se však účastnili i pacienti s absolutní intolerancí statinů, kdy léčba inhibitorem PCSK9 proběhla v kombinaci s ezetimibem nebo i samostatně.
Kromě velkého ovlivnění lipidového spektra bylo prokázáno v mortalitní studii FOURIER (Further Cardiovascular Outcomes Research with PCSK9 Inhibition in Subjects with Elevated Risk), že evolokumab významně snížil složený primární cíl o 15 % (úmrtí z KV příčin, infarkt myokardu, cévní mozková příhoda, hospitalizace pro nestabilní anginu pectoris nebo koronární revaskularizaci), a proto byla studie předčasně ukončena za 2,2 roku jejího průměrného trvání.31 Podobně ve studii ODYSSEY Outcome došlo k významnému 15% snížení výskytu primárních cílů (KV úmrtí, nefatální infarkt myokardu, ischemická cévní mozková příhoda, hospitalizace pro nestabilní anginu pectoris). Kardiovaskulární mortalita nebyla ovlivněna ani v jedné ze jmenovaných studií; důvodem je nejspíše jejich velmi krátké trvání. Studie ODYSSEY Outcome trvala v průměru 2,8 roku, přičemž 44 % pacientů bylo ve studii 3 a více roku. To může být důvodem toho, že v této studii došlo k významnému snížení celkové mortality ve skupině léčené alirokumabem o 15 % (Schwartz GG, ústní prezentace výsledků na kongresu Am Coll Cardiol, 2018).
Doporučení odborných společností v Evropě pro prevenci nejčastější komplikace aterosklerózy a vývoj cílových hodnot LDL-Ch
V roce 1974 byla vydána v USA Doporučení pro prevenci a léčbu KVO32 a v roce 1976 Světová zdravotnická organizace (WHO), resp. její regionální kancelář pro Evropu vydala v Berlíně Zprávu pracovní skupiny k prevenci KVO.33 V těchto dokumentech se ještě léčba hypercholesterolemie příliš nezmiňovala. Zatímco velký entuziasmus byl vkládán do léčby akutních koronárních příhod, velmi malý zájem byl o prevenci KVO, především o primární prevenci KVO.
Teprve v roce 1994 vznikla první evropská doporučení pro prevenci ischemické choroby srdeční, která byla vytvořena třemi odbornými společnostmi (ESC, EAS a ESH) a v nichž bylo použito Framinghamské skóre k určení celkového KV rizika podle pěti základních rizikových faktorů (pohlaví, věk, kouření, hladina celkového Ch, systolický krevní tlak). Farmakologická léčba hypercholesterolemie se však doporučovala až při hladinách celkového Ch 8 mmol/l a více a u pacientů s vysokým Framinghamským skóre 20 % a více a s C-Ch 7 mmol/l a vyšším. Za fyziologickou hladinu cholesterolu se tehdy považovaly hladiny celkového Ch 5–6 mmol/l.34 O čtyři roky později, tj. v roce 1998, ve druhých evropských společných doporučeních byla cílová hodnota celkového Ch pod 5 mmol/l a LDL-Ch pod 3 mmol/l.35 Farmakologická léčba Ch byla doporučována, jen když selhala nefarmakologická opatření a celkové KV riziko bylo 20 % a vyšší a C-Ch 5 mmol/l a vyšší nebo LDL -Ch 3 mmol/l a vyšší. Teprve v roce 2003 ve třetích evropských doporučeních byla cílová hodnota Ch snížena u vysokého KV rizika pod 4,5 u celkového Ch a pod 2,5 u LDL-Ch.36 V těchto doporučeních byl představen nový evropský skórovací systém (SCORE Risk Charts) vzniklý na podkladě evropských mortalitních studií; jednalo se nejen o riziko pro ischemickou chorobu srdeční, ale i pro další KVO na podkladě aterosklerózy. Pacientům s absolutním KV rizikem 5 % a vyšším a C-Ch nad 5 mmol/l nebo LDL-Ch nad 3 mmol/l byla doporučena kromě nefarmakologických přístupů i farmakologická léčba.
V roce 2007 ve čtvrtých společných evropských doporučeních, na kterých pracovalo již 9 odborných evropských společností a pozvaní experti, byly uvedeny cílové hodnoty pro C-Ch a LDL -Ch pro populaci, pro vysoké KV riziko bez manifestní KVO a pro pacienty s KVO (tab. 2). U pacientů v sekundární prevenci bylo doporučeno snížit celkový Ch pod 4 mmol/l a LDL -Ch pod 2 mmol/l. 37 V českých doporučeních ČSAT z roku 2007 u pacientů s KVO jsme uváděli, že je možné snížit LDL-Ch pod 1,8 až k 1,5 mmol/l, což bylo velmi progresivní ve srovnání s evropskými doporučeními.38 Řada studií prokázala, že pokud se podaří snížit LDL-Ch v krvi pod 2 mmol/l, dochází dokonce k regresi aterosklerotických plátů zjištěné pomocí intravaskulárního ultrazvuku (IVUS). V pátých společných doporučeních evropských odborných společností z roku 2012 se stratifikuje celkové KV riziko na nízké, střední, vysoké a velmi vysoké; cílové hodnoty LDL-Ch se u pacientů s velmi vysokým rizikem mají snížit pod 1,8 mmol/l nebo alespoň o 50 %, pokud se cíle nedaří dosáhnout.39 V roce 2016 v šestých společných doporučeních se má snížit LDL-Ch u vysokého rizika pod 2,5 mmol/l a zároveň alespoň o 50 % a u velmi vysokého rizika pod 1,8 mmol/l a alespoň o 50 %.40 Bylo totiž prokázáno, že čím níže klesne hladina LDL-Ch a čím déle je pacient léčen, tím je nižší výskyt aterosklerotických příhod.
Tab. 2. Vývoj cílových hodnot cholesterolu v prevenci kardiovaskulárních onemocnění v Evropě 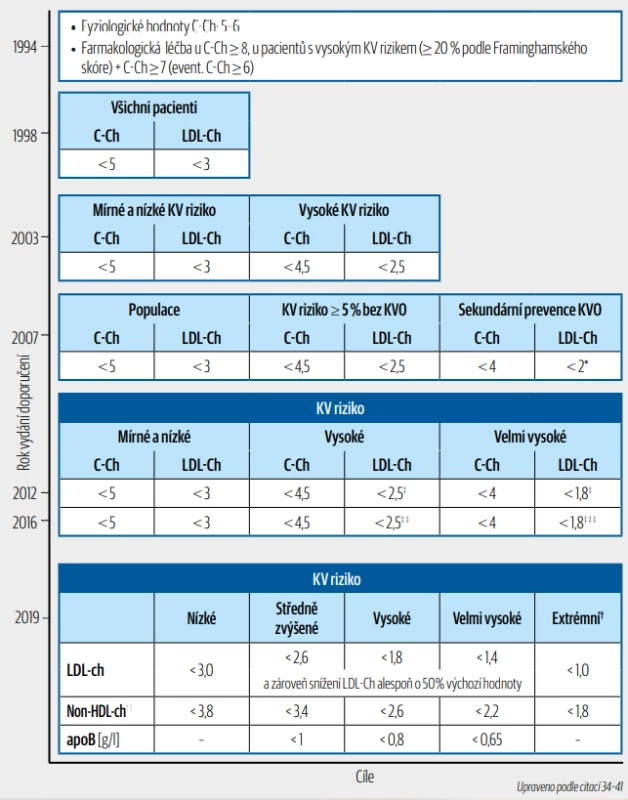
Všechny číselné hodnoty (svýjimkou apoB) jsou uvedeny vmmol/l
Ch – cholesterol; C-Ch – celkový cholesterol; LDL-Ch – low density lipoprotein cholesterol
KV – kardiovaskulární
KVO – kardiovaskulární onemocnění
* Česká guidelines ČSAT již v roce 2007 doporučovala LDL-Ch < 1,8 až k 1,5
‡ Pokud se nedaří hodnot dosáhnout, potom snížit LDL-Ch alespoň o 50 %
‡ ‡ U vysokého KV rizika: pokud jsou výchozí hodnoty LDL-Ch 2,6–5,2, potom snížit LDL-Ch alespoň o 50 %
‡ ‡ ‡ U velmi vysokého KV rizika: pokud jsou výchozí hodnoty LDL-Ch 1,8–3,5, potom snížit LDL-Ch alespoň o 50 %
† Extrémní riziko je definováno jako výskyt opakované KV příhody do dvou let od první takové události u pacienta již léčeného statinem
† † Cílové hodnoty non-HDL-Ch jsou vždy o 0,8 mmol/l vyšší než příslušná cílová hodnota LDL-chPrimárním cílem léčby dyslipidemií je stále LDL-Ch a jeho cílová hodnota. V nových evropských doporučených postupech pro léčbu dyslipidemií z roku 2019 jsou uvedeny nové definice pro stratifikaci celkového kardiovaskulárního rizika (tab. 3) i nové cílové hodnoty pro LDL-Ch.41 U pacientů s velmi vysokým KV rizikem by měl dosahovat LDL-cholesterol hodnot pod 1,4 mmol/l a u pacientů s vysokým rizikem pod 1,8 mmol/l a zároveň bychom měli dosáhnout snížení LDL-Ch alespoň o 50 % výchozí hodnoty (tab. 2). 41
Tab. 3. Tabulka SCORE ke zjištění absolutního rizika jedince pro fatální kardiovaskulární příhody (vysoké riziko ≥ 5 %) [Upraveno podle 2019 ESC/EAS Guidelines– citace 41]
Evropské regiony s vysokým rizikem KV chorob* – 10leté riziko fatální kardiovaskulární příhody![Tabulka SCORE ke zjištění absolutního rizika jedince pro fatální kardiovaskulární příhody
(vysoké riziko ≥ 5 %) [Upraveno podle 2019 ESC/EAS Guidelines– citace 41]<br>
Evropské regiony s vysokým rizikem KV chorob* – 10leté riziko fatální kardiovaskulární příhody](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/e7dc989a2a1d1fdd29fa196b1c693938.png)
Tabulka systematického odhadu koronárního rizika pro evropské populace s vysokým rizikem kardiovaskulárních onemocnění.
10leté riziko fatálního kardiovaskulárního onemocnění v populacích s vysokým rizikem kardiovaskulárních onemocnění na základě
následujících rizikových faktorů: věk, pohlaví, kouření, systolický krevní tlak a celkový cholesterol. Chceme-li převést riziko fatálního
kardiovaskulárního onemocnění na riziko celkového (fatálního i nefatálního) kardiovaskulárního onemocnění, vynásobíme u mužů
číslem 3, u žen číslem 4 a o něco méně u starších lidí.
Poznámka: Tabulka pro odhad systematického koronárního rizika je určena pro lidi bez zjevného kardiovaskulárního onemocnění,
diabetu (1. a 2. typu), chronického onemocnění ledvin, familiární hypercholesterolemie nebo velmi vysokých úrovní jednotlivých
rizikových faktorů – tito lidé již jsou na vysoké úrovni kardiovaskulárního rizika a potřebují intenzivní ovlivňování rizikových faktorů.
Tyto nové tabulky SCORE se mírně liší od těch, které jsou uvedeny v pokynech Evropské kardiologické společnosti/Evropské
společnosti pro aterosklerózu z roku 2016 pro správu dyslipidemií, a evropských pokynů pro prevenci kardiovaskulárních chorob
v klinické praxi z roku 2016, a to tím, že:
1. byl zvýšen věk z 65 na 70 let,
2. byla započtena interakce mezi věkem a každým z dalších rizikových faktorů, čímž se snížilo nadhodnocování rizika u starších osob oproti původním tabulkám SCORE,
3. byl odstraněn cholesterolový pás 8 mmol/l, protože osoby s touto hladinou cholesterolu mají v každém případě nárok na další vyhodnocení.
SCORE = Systematický odhad koronárních rizik (Systematic Coronary Risk Estimation).
* Evropské regiony s vysokým rizikem KV onemocnění – Albánie, Alžírsko, Arménie, Bosna a Hercegovina, Chorvatsko, Česká republika, Estonsko, Maďarsko, Lotyšsko, Libanon, Libye, Litva, Černá Hora, Maroko, Polsko, Rumunsko, Srbsko, Slovensko, Tunisko a Turecko.Závěr
První objev cholesterolu ve žlučových kamenech (zdokumentováno začátkem 19. století), zjištění jeho role v aterogenezi (Goldstein, Brown 70.–80. léta 20. století) a v léčbě a prevenci KVO až po schopnost vyvolat regresi ateromových plátů velkým snížením cholesterolu v krvi (začátek 21. století), to vše trvalo lidstvu téměř 200 let. Dnes je již „lipidová hypotéza“ aterosklerózy a aterosklerotických KVO jasně prokázána. Bylo shromážděno velké množství důkazů o prospěšnosti snižování Ch, resp. LDL-Ch v krvi v léčbě a prevenci aterosklerotických vaskulárních chorob.
Velmi mnoho důkazů bylo získáno o protektivním vlivu stravy s nižším obsahem nasycených tuků ve prospěch nenasycených tuků, stravy bohaté na minerály, vitaminy, antioxidanty přijímané v ovoci a zelenině jak na krevní tlak, tak i na koncentrace lipidů a glukózy v krvi, a tím i na strukturu a funkci tepen důležitých orgánů. Existuje dostatek důkazů z velkých studií o škodlivosti kouření tabáku i sedavého způsobu života. Přesto chybí lidstvu motivace k plošnému zavedení zdravých životních návyků, případně i k pravidelnému celoživotnímu užívání medikamentů, které byly prokázány jako prospěšné u pacientů s vysokým a velmi vysokým KV rizikem (pacienti s prodělanou KV příhodou nebo s diabetes mellitus, s nedostatečnou funkcí ledvin nebo s chronickými zánětlivými chorobami průdušek aj.).
Jak zlepšit motivaci* těchto pacientů a jak zastavit popírání vědeckých nálezů a šíření nepravdivých, resp. vědecky neprokázaných tvrzení o racionální farmakoterapii? To je velký úkol nejen pro preventivní kardiologii, ale i pro celou medicínu.
Pozn.: Uvedený článek Počátky a směřování hypolipidemické léčby v 21. století je rozšířením a aktualizací článku Rosolová H. Kdy začala a kam směřuje hypolipidemická léčba v 21. století? Aktuální medicína 2018;2 : 15–26, který vyšel při příležitosti XXV. kongresu České internistické společnosti ČLS JEP. S ohledem na jeho zajímavost a přínosnost i pro lékaře dalších specializací jej přinášíme též našim čtenářům.
* Jednou z možností pro alespoň částečné zlepšení motivace některých pacientů jsou i léky, které pomocí jedné tablety léčí více onemocnění současně – např. dyslipidemii spolu s hypertenzí pomocí fixní kombinace kvalitních léků podávaných maximálně jednou denně. To je však již téma na samostatný článek.
prof. MUDr. Hana Rosolová, DrSc.
Centrum preventivní kardiologie,
Univerzita Karlova,
Lékařská fakulta v Plzni
2. interní klinika Fakultní nemocnice Plzeň
Zdroje
1. Fredrickson DS, Levy RI, Lees RS. Fat transport in lipoproteins – an integrated approach to mechanisms and disorders. NEJM 1967;276(1):34–42. doi:10.1056/NEJM196701052760107. PMID 5333081.
2. Müller C. Angina pectoris in hereditary xanthomatosis. Arch Intern Med 1939; 64 : 675–700.
3. Avedis K. Khachadurian. The inheritance of essential familial hypercholesterolemia. Am J Med 1964;37 : 402–407. doi.org/10.1016/0002-9343 (64)90196-2
4. Kannel WB, Dawber TR, Friedman GD, et al. Risk factors in coronary heart disease. An evaluation of several serum lipids as predictors of coronary heart disease; the Framingham study. Ann Intern Med 1964;61 : 888–99.
5. Keys A, Blackburn H, Taylor H. Coronary heart disease in seven countries. Circulation 1970;41(Suppl. 4):120–161.
6. Brown, MS, Goldstein, JL. A receptor-mediated pathway for cholesterol homeostasis. Science 1986;232 : 34–47.
7. Goldstein JL, Brown MS. Regulation of the mevalonate pathway. Nature 1990;343 : 425–430.
8. Lipid Research Clinics Coronary Primary Preventive Trial results II: The relationship of reduction in incidence of coronary heart disease to cholesterol lowering. JAMA 1984;251(3):365–74.
9. Altschul R. Die Beeinflussung des Blutcholesterinspiegels und der experimentellen Atherosklerose durch Nikotinsaure. Ztschr Kreislaufforsch 1956;45 : 453–60.
10. Altschul R, Hoffer A, Stephen JD. Influence of nicotinic acid on serum cholesterol in man. Arch Biochem 1955;54 : 558–9.
11. Canner PL, Berge KG, Wenger NK, et al. Fifteen-year mortality in Coronary Drug Project patients: long-term benefit with niacin. JACC 1986;8 : 1245–1255.
12. AIM HIGH Investigators. Boden WE, Probstfield JL, Anderson T, et al. Niacin in patients with low HDL cholesterol levels receiving intensive statin therapy. N Engl J Med 2011;365 : 2255–67.
13. HPS2-THRIVE Collaborative Group. HPS2-THRIVE randomized placebo-controlled trial in 25 673 high-risk patients of ER niacin/laropiprant: trial design, pre-specified muscle and liver outcomes, and reasons for stopping study treatment. Eur Heart J 2013; online ahead of print 27 February 2013. HPS2-THRIVE Trial website: http://www.thrivestudy.org/HPS 2-THRIVE.
14. Committee of Principal Investigators. WHO cooperative trial on primary prevention of ischemic heart disease with clofibrate to lower serum cholesterol: final mortality follow-up. Lancet 1984;2(8403):600–604.
15. Rosolová H, Dobiášová M, Soška V, et al. Combined therapy of mixed dyslipidemia in patients with high cardiovascular risk and changes in the lipid target values and atherogenic index of plasma. Cor et Vasa 2014;56:e133–e139. www.sciencedirect.com/science/article/pii/ S0010865014000125.
16. Ginsberg HN, Elam MB, Lovato LC, et al.; ACCORD Study Group. Effects of combination lipid therapy in type 2 diabetes mellitus. N Engl J Med 2010;362 : 1563–1574.
17. Aguiar C, Alegria E, Bonadonna RC, et al. A review of the evidence on reducing macrovascular risk in patients with atherogenic dyslipidemia: A report from an expert consensus meeting on the role of fenofibrate-statin combination therapy. Atherosclerosis Suppl 2015;19 : 1–12.
18. Wright AD, Dodson PM. Medical management of diabetic retinopathy: fenofibrate and ACCORD Eye studies. Eye (Lond) 2011;25 : 843–849.
19. Scandinavian Simvastatin Survival Study Group: Randomised trial of cholesterol lowering in 4444 patients with coronary heart disease: the Scandinavian Simvastatin Survival Study (4S). Lancet 1994;344 : 1383–1389.
20. Cholesterol TreatmentTrialists’ (CTT) Collaboration, Baigent C, Blackwell L, Emberson J, Holland LE, Reith C, Bhala N, Peto R, Barnes EH, Keech A, Simes J, Collins R. Efficacy and safety of more intensive lowering of LDL cholesterol: a meta-analysis of data from 170,000 participants in 26 randomised trials. Lancet 2010;376 : 1670–1681.
21. Pella D, Vrablik M, et al. Myopatie asociovaná se statiny: klinické doporučení Slovenskej asociácie aterosklerózy a České společnosti pro aterosklerózu. Ather Rev 2016; 1(1):7–13.
22. Kosoglou T, Statkevich P, Yang B, et al. Pharmacodynamic interaction between ezetimibe and rosuvastatin. Curr Med Res Opin 2004;20 : 1185–1195.
23. Baigent C, Landray MJ, Reith C, et al. The effects of lowering LDL cholesterol with simvastatin plus ezetimibe in patients with chronic kidney disease (Study of Heart and Renal Protection): a randomized placebo-controlled trial. Lancet 2011; DOI 10.1016/ S0140-6736(11)60739-3.
24. Bohula EA, Morrow DA, Giugliano RP, et al. Atherothrombotic risk stratification and ezetimibe for secondary prevention. J Am Coll Cardiol 2017;69(8):911–921. doi:10.1016/j. jacc.2016.11.070.
25. Tsujta K, Sugiyama S, Sumida H, et al. Impact of dual lipid-lowering strategy with ezetimibe and atorvastatin on coronary plaque regression in patients with percutaneous coronary intervention. The multicenter randomized controlled PRECISE-IVUS Trial. JACC 2015;66 (5):495–507.
26. Masuda J, Tanigawa T, Yamada T et al. Effect of combination therapy of ezetimibe and rosuvastatin on regression of coronary at.herosclerosis in patients with coronary artery disease. Int Heart J 2015;56(3): 278–285. doi: 10.1536/ihj.14–311.
27. Bays HE, Davidson MH, Massaad R et al. Safety and efficacy of ezetimibe added to rosuvastatin 5 or 10 mg versus up-titration of rosuvastatin in patients with hypercholesterolemia (the ACTE study). Am J Cardiol 2011; 108(4): 523–530. doi: 10.1016/jamjcard.2011.03.079.
28. Takase H, Dohi Y, Okado T, et al. Effects of ezetimibe on visceral fat in the metabolic syndrome: a randomised controlled study. Eur J Clin Invest 2012;42(12):1287–1294. DOI: 10.1111/ eci.12000.
29. Barter PJ, Caulfield M, Eriksson M, et al. ILLUMINATE Investigators. Effects of torcetrapib in patients at high risk for coronary events. NEJM 2007;357(21):2109–22.
30. Sabatine MS, Giugliano RP, Wiviott SD, et al., for the Open-Label Study of Long-Term Evaluation against LDL-Cholesterol (OSLER) Investigations. Efficacy and safety of evolocumab in reducing lipids and cardiovascular events. NEJM 2015;372 : 1500–1509
31. Sabatine MS, Giugliano RP, Keech AC, et al. Evolocumab and clinical outcomes in patients with cardiovascular disease. NEJM 2017;DOI:10.1056/NEJMoa1615664.
32. Wright IS, Fredrickson DT, et al. Cardiovascular diseases – Guidelines for prevention and care. Washington, DC: U. S. Government Printing Office, 1974.
33. The WHO Regional Office for Europe. The prevention of coronary heart disease. Report of a Working Group, Berlin, GD2. 1976 Copenhagen: WHO/EURO/CP/CVD 002(10), 1974.
34. Pyörälä K, De Backer G, Graham I, et al. Prevention of coronary heart disease in clinical practice. Recommendations of the Task Force of the European Society of Cardiology, The European Atherosclerosis Society and the European Hypertension Society. Eur Heart J 1994;15(10):1300–31.
35. Wood D, De Backer G, Faergeman O, et al. Prevention of coronary heart disease in clinical practice. Recommendations of the Second Joint Task Force of European and other Societies on Coronary Prevention. Eur Heart J 1998;19 : 1334–1503.
36. De Backer G, Ambrosioni E, Borch-Johnsen K, et al. European guidelines on cardiovascular disease prevention in clinical practice. The third Joint Task Force of European and other Societies on Cardiovascular Disease Prevention in Clinical Practice. Eur J Cardiovasc Prev Rehabil 2003;10(4):S1–S10.
37. Graham I, Atar D, Borch-Johnsen K, et al. European guidelines on cardiovascular disease prevention in clinical practice: full text. Fourth Joint Task Force of the European Society of Cardiology and Other Societies on Cardiovascular Disease Prevention in Clinical Practice (constituted by representatives of nine societies and by invited experts). Eur Heart J 2007;28(19):2375–414.
38. Vaverková H, Soška V, Rosolová H, et al. Doporučení pro diagnostiku a léčbu dyslipidémií v dospělosti, vypracované výborem České společnosti pro aterosklerózu. Vnitř Lék 2007;53(2):181–7.
39. Perk J, De Backer G, Gohlke H, et al. European Guidelines on cardiovascular disease prevention in clinical practice (version 2012): the Fifth Joint Task Force of the European Society of Cardiology and Other Societies on Cardiovascular Disease Prevention in Clinical Practice (constituted by representatives of nine societies and by invited experts). Eur J Prev Cardiol 2012;19(4):585–667. doi: 10.1177/2047487312450228.
40. Piepoli MF, Hoes AW, Agewall S, et al. 2016 European Guidelines on cardiovascular disease prevention in clinical practice: The Sixth Joint Task Force of the European Society of Cardiology and Other Societies on Cardiovascular Disease Prevention in Clinical Practice (constituted by representatives of 10 societies and by invited experts). Developed with the special contribution of the European Association for Cardiovascular Prevention & Rehabilitation (EACPR). Eur J Prev Cardiol 2016;23(11):NP1–NP96. doi: 10.1177/2047487316653709.
41. Mach E, Baigent C, Catapano AL, et al Task Force Members: 2019 ESC/EAS Guidelines for the management of dyslipidaemias: lipid modification to reduce cardiovascular risk. The Task Force for the management of dyslipidaemias of the European Society of Cardiology (ESC) and European Atherosclerosis Society (EAS). Eur Heart J 2019 : 1–78. doi:10.1093/eurheartj/ehz455.
Štítky
Praktické lékařství pro děti a dorost Praktické lékařství pro dospělé
Článek Úvodní slovoČlánek Chronická žilní insuficience
Článek vyšel v časopiseSvět praktické medicíny
Nejčtenější tento týden
2020 Číslo 2- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Magnosolv a jeho využití v neurologii
-
Všechny články tohoto čísla
- Úvodní slovo
- Komentář kčlánku Top 20 výzkumných studií roku 2019 pro lékaře primární péče
- Komentář kčlánku Top 20 výzkumných studií roku 2019 pro lékaře primární péče
- Komentář k článku Top 20 výzkumných studií roku 2019 pro lékaře primární péče
- Jak postupovat při hematurii? Krok za krokem
- Komentář k článku: Jak postupovat při hematurii? Krok za krokem
- Očkování VAKCINACE v době covidové
- Bude léčba vzácných onemocnění dostupnější? Do sněmovny míří novela zákona č. 48/1997 Sb., o veřejném zdravotním pojištění
- Primář Jan Vachek: Je lepší přijít dvakrát zbytečně než jednou pozdě
- Hraniční stavy v tyreoidologii
- Počátky a směřování hypolipidemické léčby v 21. století
- Terapie alirokumabem – současné možnosti akazuistika z praxe
- Překvapivé zlepšení hypercholesterolemie
- Kombinovaná léčba hypertenze umladšího pacienta stachykardií
- Chronická žilní insuficience
- Ultrazvuk v praktickém lékařství – pokud ano, jak ho používat?
- Novinky v registracích Evropské lékové agentury
- Klinické vyšetření pohybového ústrojí pro lékaře primární péče
- Top 20 výzkumných studií roku 2019 pro lékaře primární péče
- Svět praktické medicíny
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Jak postupovat při hematurii? Krok za krokem
- Chronická žilní insuficience
- Hraniční stavy v tyreoidologii
- Ultrazvuk v praktickém lékařství – pokud ano, jak ho používat?
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



