-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Léčba insuficience hrudní anastomózy po Ivor Lewis ezofagektomii
Treatment of anastomotic leak after Ivor Lewis esophagectomy
Introduction: Anastomotic leak (AL) is one of the most serious surgical complications after esophagectomy. Endoscopic, radiological and surgical methods are used in the treatment of AL. The aim of this study was to retrospectively evaluate our therapeutic procedures and results of AL treatment after Ivor Lewis esophagectomy (ILE).
Methods: Retrospective audit of all ILEs performed in the years 2005−2019. Evaluation of AL treatment results according to Esophagectomy Complication Consensus Group (ECCG) classification and according to the primary therapeutic procedure with a focus on the treatment with esophageal stent.
Results: Out of 817 patients with ILE, AL was detected in 80 patients (9.8%): ECCG type I 33 (41%), type II 23 (29%) and type III 24 (30%) patients. Some 33 patients (41%) were treated conservatively. Esophageal stents were used in 39 patients (49%), of which 18 (23%) had concomitant percutaneous drainage and 17 (21%) were reoperated. Reoperation without a stent insertion was performed in 7 patients (9%). Esophageal diversion with cervical esophagostomy was performed in a total of 16 patients (20%). Esophageal stent treatment was successful in 24/39 patients (62%). Airway fistula occurred in 4 patients treated with stent (10%). Endoscopic vacuum therapy was successfully used in three patients after stent failure. Eight patients (10%) died as a result of AL. Mortality of AL type I, II and III was 0%, 4% and 29%.
Conclusion: Successful treatment of AL requires an individual and multidisciplinary approach. The primary effort should aim to preserve anastomosis using endoscopic and radiological methods. In case of insufficient clinical effect, we recommend not to hesitate with reoperation. If primary therapy fails, the life-saving procedure is a cervical esophagostomy.
Keywords:
Ivor Lewis esophagectomy − anastomotic leak treatment − esophageal stent
Autoři: T. Haruštiak 1; J. Tvrdoň 1; A. Pazdro 1; M. Šnajdauf 1; H. Faltová 1; T. Teršíp 1; J. Wolesky 1; V. Černý 2; J. Schützner 1; A. Stolz 1; P. Pafko 1; R. Lischke 1
Působiště autorů: III. chirurgická klinika, 1. lékařská fakulta Univerzity Karlovy, Fakultní nemocnice v Motole, Praha 1; 2. lékařská fakulta Univerzity Karlovy, Praha 2
Vyšlo v časopise: Rozhl. Chir., 2020, roč. 99, č. 10, s. 438-446.
Kategorie: Původní práce
Souhrn
Úvod: Insuficience anastomózy (anastomotický leak, AL) patří mezi nejzávažnější chirurgické komplikace po resekci jícnu. V léčbě se uplatňují metody endoskopické, radiologické a chirurgické. Předmětem sdělení je retrospektivní zhodnocení terapeutických postupů a výsledků léčby AL po transtorakální resekci jícnu s hrudní anastomózou (Ivor Lewis ezofagektomie, ILE).
Metody: Retrospektivní audit všech ILE provedených v letech 2005−2019. Zhodnocení výsledků léčby AL podle Esophagectomy Complication Consensus Group (ECCG) klasifikace a podle primárního terapeutického postupu se zaměřením na léčbu jícnovým stentem.
Výsledky: Z celkového počtu 817 pacientů s ILE byl AL zjištěn u 80 nemocných (9,8 %). Podle ECCG klasifikace mělo typ I 33 (41 %), typ II 23 (29 %) a typ III 24 (30 %) pacientů. Konzervativně bylo léčeno 33 pacientů (41 %). Jícnový stent byl zaveden u 39 pacientů (49 %), z toho 18 (23 %) mělo perkutánní drenáž a 17 (21 %) bylo reoperováno. Reoperace bez stentu byla provedena u 7 pacientů (9 %). Diverze jícnu s krční ezofagostomií byla provedena celkem u 16 nemocných (20 %). Léčba jícnovým stentem byla úspěšná u 24/39 pacientů (62 %). Píštěl do dýchacích cest se objevila u 4 pacientů léčených stentem (10 %). Endoskopická podtlaková terapie byla úspěšně použita u tří nemocných po selhání stentu. V důsledku AL zemřelo 8 pacientů (10 %). Mortalita AL typu I, II a III byla 0 %, 4 % a 29 %.
Závěr: Úspěšná léčba AL vyžaduje individuální a multidisciplinární přístup. Na místě je primární snaha o anastomózu záchovný výkon s využitím endoskopických a radiologických metod. Při nedostatečném klinickém efektu doporučujeme neváhat s reoperací. Při selhání primární terapie je život zachraňujícím výkonem krční ezofagostomie.
Klíčová slova:
Ivor Lewis ezofagektomie − léčba insuficience anastomózy − jícnový stent
ÚVOD
Ezofagektomie představuje základní léčebný výkon u resekabilního karcinomu jícnu, ačkoli operace může být indikována i v případě koncových stadií některých benigních onemocnění jícnu a v určitých případech traumatického postižení jícnu. Podle operačního přístupu se rozlišuje transtorakální a transhiatální ezofagektomie a minimálně invazivní varianty obou výkonů. Jako náhrada jícnu se preferenčně užívá tubulizovaný žaludek s anastomózou lokalizovanou v hrudníku nebo na krku. Nejčastěji prováděným výkonem v případě karcinomu dolního jícnu a ezofagogastrické junkce je transtorakální resekce jícnu s hrudní ezofago-gastrickou anastomózou (Ivor Lewis ezofagektomie, dále ILE). Bez ohledu na chirurgický přístup je ezofagektomie spojena s vysokou celkovou morbiditou a významnou pooperační mortalitou. Insuficience ezofagogastrické anastomózy (anastomotický leak, dále jen AL) je jednou z nejčastějších a nejobávanějších komplikací. V literatuře je uváděná četnost AL po ezofagektomii v rozmezí 0−35 % [1–3]. Anastomotický leak po ezofagektomii významně zvyšuje pooperační morbiditu, zásadně přispívá k pooperační mortalitě, vede k prodloužení doby hospitalizace, zvyšuje náklady na zdravotní péči a často vede k dlouhodobému snížení kvality života pacienta [4]. Příčiny vzniku AL jsou multifaktoriální. Mezi rizikové faktory patří krční umístění anastomózy, intenzivní předoperační radioterapie, obezita a komorbidní stavy jako diabetes, renální insuficience, srdeční selhání či chronické plicní onemocnění [4–8]. Léčba AL v současnosti není standardizována a často je multidisciplinární. Zahrnuje metody endoskopické, intervenčně radiologické a samozřejmě chirurgické. Cílem této studie je retrospektivně zhodnotit terapeutické postupy a výsledky léčby anastomotického leaku u pacientů po Ivor Lewis ezofagektomii léčených ve specializovaném velkoobjemovém centru.
METODY
Z prospektivně vedené databáze všech pacientů, kteří podstoupili ezofagektomii na III. chirurgické klinice 1. LFUK a FN v Motole v letech 2005 až 2019, byl identifikován soubor pacientů, u kterých byla provedena ILE. Z tohoto souboru byli vybráni pacienti, u kterých byl v časném pooperačním období (do 30 dní po operaci) diagnostikován anastomotický leak, a tito představují studovanou skupinu nemocných. Anastomotický leak byl definován jako jakékoliv narušení celistvosti anastomózy zjištěné radiologicky jako extraluminace iodové kontrastní látky na ezofagografii (RTG pasáž) nebo na počítačové tomografii s perorálním podáním kontrastní látky (CT), klinicky jako patologický odpad do hrudního drénu, endoskopicky nebo intraoperačně [4,9]. Všichni pacienti po resekci jícnu měli rutinně provedené RTG vyšetření jícnu jodovou kontrastní látkou 7. pooperační den k vyloučení asymptomatického leaku a zhodnocení evakuační schopnosti žaludečního konduitu. V případě klinického podezření na leak byla RTG pasáž nebo CT provedeno dřív nebo opakováno později. Podle doporučení Esophagectomy Complication Consensus Group (ECCG) byl AL na základě klinické prezentace a léčby klasifikován na typ I-III [9]. U studované skupiny nemocných byla retrospektivně zjištěna doba od operace po diagnostiku leaku, zhodnocena ohraničenost leaku na RTG pasáži nebo CT, vyhodnocen klinický stav (asymptomatický stav nebo mírné známky zánětu nebo sepse) a zrekapitulována terapie. Podle primárního způsobu ošetření AL byli pacienti rozděleni do tří skupin: 1) skupina primárně léčená konzervativně, 2) skupina primárně léčena jícnovým stentem a 3) skupina primárně indikována k operační revizi bez použití jícnového stentu. Byly zhodnoceny sekundární terapeutické postupy, tj. léčebné kroky vynucené selháním primárního způsobu ošetření AL. Byla vyhodnocena pooperační mortalita v důsledku AL, úspěšnost primárního terapeutického postupu, celková úspěšnost zahojení AL bez nutnosti chirurgicky zrušit anastomózu a zhodnoceny komplikace léčby jícnovým stentem. Pooperační mortalita byla definována jako úmrtí pacienta v souvislosti s AL v průběhu hospitalizace nebo časné re-hospitalizace (do 30 dnů po propuštění). Zahojení anastomózy bylo posouzeno endoskopicky a radiologicky. Všichni pacienti, pokud to jejich stav dovoloval, podepsali informovaný souhlas s provedenými terapeutickými intervencemi.
Terapeutický postup u jednotlivých typů AL dle klasifikace ECCG
Typ I představuje ohraničený AL léčený konzervativně, úpravou dietního režimu, případně antibiotickou terapií [9]. V našem souboru pacientů byl u nemocných s leakem typu I pozastaven perorální příjem, výživa byla zajištěna enterální cestou (nasojejunální sonda nebo jejunostomie od operace) nebo parenterálně a selektivně byla podávána antibiotická terapie v případě klinických a laboratorních známek zánětu. Délka konzervativní léčby byla většinou 7 dní, během nichž se opakovala RTG pasáž jícnem. Podle přítomnosti a velikosti reziduálního leaku a klinického stavu pacienta bylo buďto pokračováno v konzervativní terapii, nebo byla zahájena šetrná realimentace pacienta.
Typ II představuje AL vyžadující endoskopickou nebo radiologickou intervenci nebo drenáž, avšak bez chirurgické reoperace [9]. V našem souboru se jednalo o pacienty, kteří byli léčeni pomocí endoskopicky zavedeného jícnového stentu, endoskopickou podtlakovou terapií (endoscopic vacuum therapy, dále jen EVT) nebo pomocí perkutánně zavedené drenáže hrudníku či mediastina s nebo bez CT navigace. Všechny jícnové stenty byly u našich pacientů zavedeny jedním ze tří endoskopujících chirurgů. Byly použity výhradně stenty firmy ELLA-CS, s. r. o., a to plně potažené samoexpandibilní metalické stenty Boubella-E (průměr 20 mm), Flexella-Plus (průměr 20 mm) nebo Danis-Seal (průměr 25 mm) (Obr. 1). Správná poloha a utěsnění leaku byly kontrolovány následnou RTG pasáží nebo CT vyšetřením. V případě dislokace stentu nebo přetrvávání extraluminace na RTG vyšetření či klinicky byla poloha stentu endoskopicky upravena nebo byl stent vyměněn za jiný typ. Zpočátku byly použity stenty bez zajištění proti dislokaci. Od roku 2010 jsme začali jícnové stenty stabilizovat v požadované poloze zavěšením za vlákno, které bylo vyvedeno nosní dírkou a opatřeno kotvou zabraňující aborálnímu posunu (Obr. 2). EVT byla prováděna v celkové anestezii endoskopujícími chirurgy pomocí soupravy Eso-SPONGE (B. Braun).
Obr. 1. Typy používaných stentů ELLA-CS: A − Boubella-E, B − Flexella-Plus, C − Danis-Seal
Fig. 1: ELLA-CS stent types: A − Boubella-E; B − Flexella-Plus; C − Danis-Seal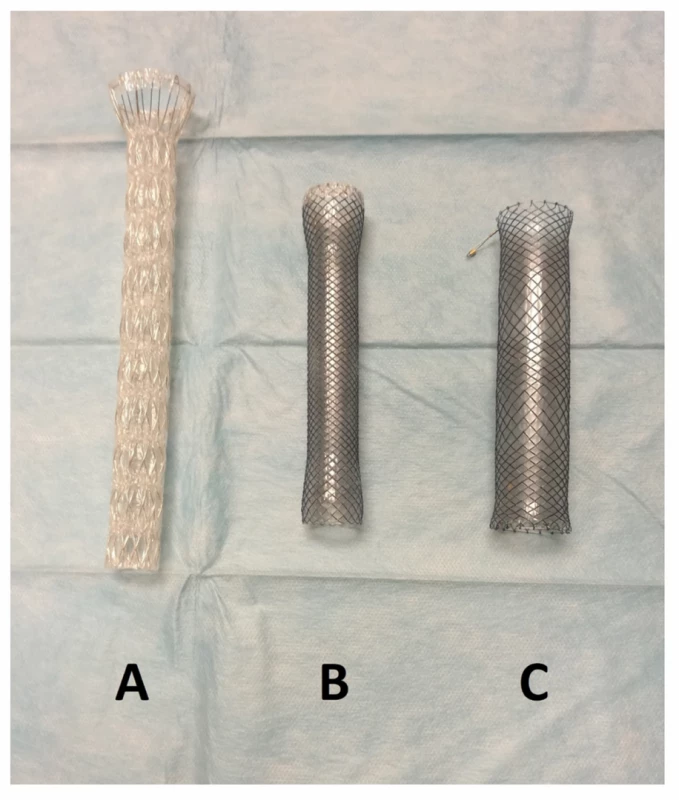
Obr. 2. Prevence migrace stentu − ukotvení stentu před nosní dírkou
Fig. 2: Prevention of stent migration − anchoring of the stent in front of the nostril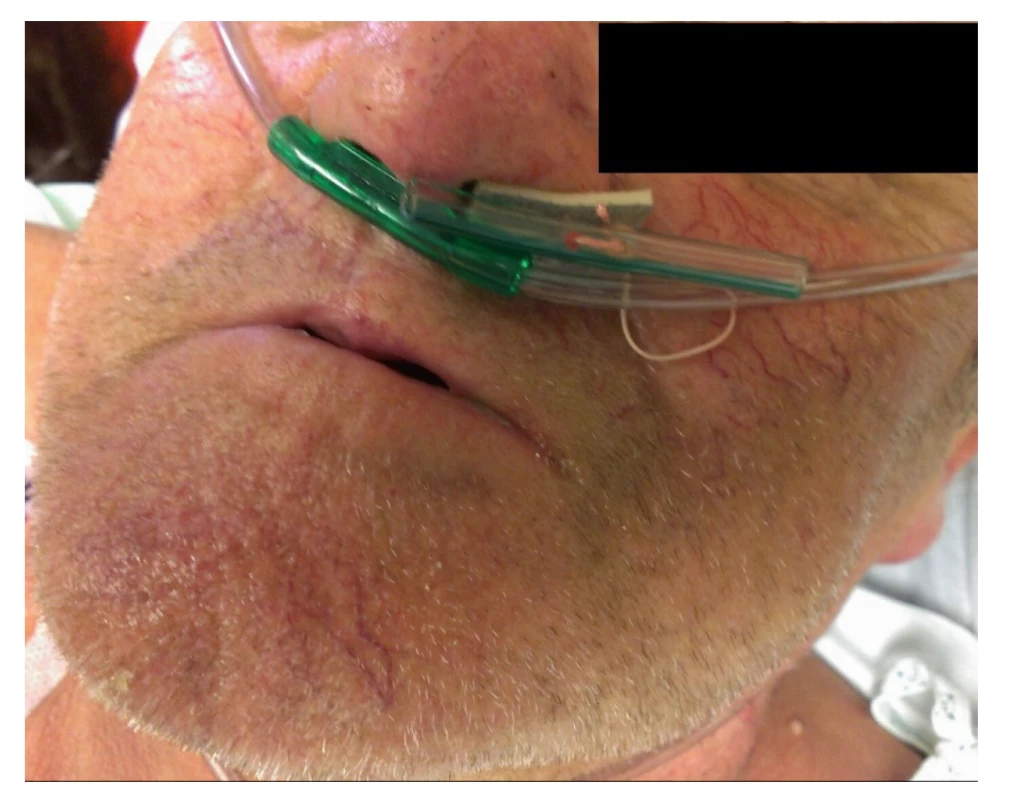
Typ III představuje leak anastomózy vyžadující reoperaci v celkové anestezii [9]. V našem souboru se jednalo o pacienty s nekrózou žaludečního konduitu nebo anastomotickým leakem primárně indikované k reoperaci s nebo bez zavedení jícnového stentu nebo pacienty vyžadující operační revizi jako sekundární léčebný krok při nedostatečném klinickém efektu primární terapie. Indikací reoperace byla nedostatečná nebo neproveditelná perkutánní drenáž, empyém hrudníku vyžadující chirurgický debridement a dekortikaci, nekróza žaludečního tubulu vyžadující resekci žaludku nebo klinicky či RTG manifestní perzistující leak nedostatečně ošetřený jícnovým stentem a provázený progredující či neustupující sepsí. Reoperace sestávala z retorakotomie, debridementu pleurální dutiny s nebo bez dekortikace plíce a vícečetné drenáže pleurálního a mediastinálního prostoru. U některých pacientů s AL bylo provedeno zrušení anastomózy, pahýl jícnu byl vyveden jako krční ezofagostomie a žaludeční tubulus byl slepě uzavřen, vrácen do břišní dutiny a byl derivován chirurgickou gastrostomií. K tomu byla selektivně provedena nutriční jejunostomie. U pacientů s nekrotickým žaludečním konduitem byla k tomu navíc provedena parciální či totální resekce žaludečního tubulu.
VÝSLEDKY
Z celkového počtu 1021 pacientů s resekcí jícnu bylo identifikováno 817 pacientů, u kterých byla provedena ILE. Anastomóza byla konstruována ručně koncem ke konci u 134 pacientů (16 %), polomechanicky stranou ke straně pomocí lineárního endostapleru s ručně šitým předním obvodem u 672 pacientů (82 %) a pomocí cirkulárního stapleru koncem ke straně u 11 pacientů (1,3 %).
Anastomotický leak byl zjištěn u 80 pacientů (9,8 %), v mediánu 7 dní po operaci (rozsah 1 až 30 dní). Ohraničený leak kontrastní látky na RTG zobrazovacím vyšetření byl nalezen u 44 pacientů (55 %), neohraničený leak u 34 pacientů (43 %) a bez detekovatelné extraluminace kontrastní látky byli 2 pacienti (3 %). Významná nekróza žaludečního tubulu byla zjištěna u 3 pacientů (4 %). Podle ECCG klasifikace mělo AL typ I 33 pacientů (41 %), typ II 23 pacientů (29 %) a typ III 24 pacientů (30 %). Klinicko-patologické charakteristiky pacientů, léčebné postupy a výsledky léčby podle jednotlivých typů leaku jsou znázorněny v Tab. 1. Medián doby hospitalizace pacientů s AL byl 33 dní (rozsah 14 až 153 dní). Celková hospitalizační mortalita pacientů po ILE byla 2,7 %. V souvislosti s AL zemřelo 8 pacientů. Celková hospitalizační mortalita pacientů po ILE asociovaná s AL činila tedy 1 %. Mortalita pacientů s AL byla 10 %. Dále jsou probrány výsledky jednotlivých terapeutických postupů podle primárního způsobu ošetření anastomotického leaku.
Tab. 1. Klinicko-patologické charakteristiky, léčba a výsledky pacientů s anastomotickým leakem typ I-III podle ECCG klasifikace
Tab. 1: Clinical-pathological characteristics, treatment procedures and outcomes of patients with anastomotic leak type I-III according to ECCG classification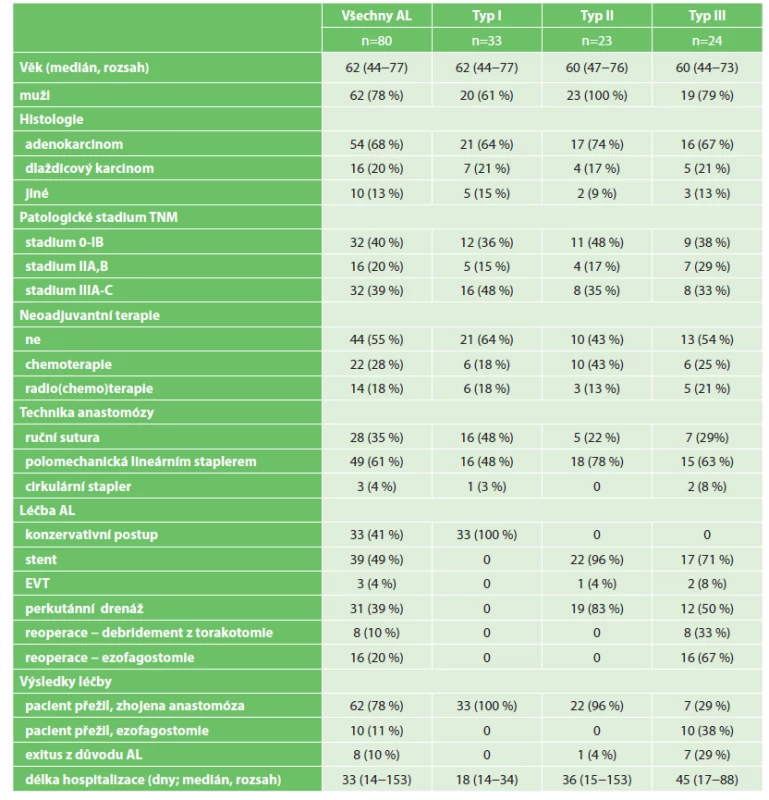
Konzervativní postup
U 35 pacientů bylo postupováno konzervativně. Všichni pacienti měli ohraničený leak kontrastní látky na RTG pasáži jícnem nebo na CT, zjištěný u většiny pacientů při rutinním RTG vyšetření 7. den po operaci. Asymptomatických pacientů bylo 26, mírné známky zánětu (subfebrilie, zvýšené zánětlivé parametry) vykazovalo 9 pacientů. Celkem 33 pacientů se na konzervativní terapii zahojilo bez nutnosti jiné intervence. Jednomu pacientovi byla provedena perkutánní CT-navigovaná drenáž reaktivního pleurálního výpotku. Medián pooperační hospitalizace u konzervativně řešených pacientů byl 18 dní (rozsah 14 až 34 dní). Jednomu pacientovi se původně 33 mm dlouhá ohraničená píštěl na konzervativní terapii zvětšila na 45 mm s depem kontrastní látky, a proto mu byl 57. pooperační den zaveden jícnový stent. Stent byl odstraněn za 37 dní s nálezem zhojené píštěle anastomózy. Šest týdnů poté byl pacient rehospitalizován pro RTG prokázanou gastro-pulmonální píštěl a mnohočetný metastatický proces plic. Tato píštěl byla paliativně ošetřena opětovným zavedením jícnového stentu s RTG nálezem utěsnění píštěle. Pacient zemřel za další dva měsíce v rámci symptomatické terapie při nádorové generalizaci. Úspěšnost primárně konzervativní terapie byla 97 % a pooperační mortalita 0 %.
Endoskopické zavedení jícnového stentu
Primární ošetření AL pomocí endoskopicky zavedeného jícnového stentu bylo provedeno u 38 pacientů a u jednoho pacienta byl jícnový stent zaveden sekundárně při selhání konzervativní terapie (viz výše). Diagnóza byla stanovena v mediánu 8 dní (rozsah 3 až 23 dní) po operaci. Ohraničený leak (délky 20 až 70 mm) mělo 10 pacientů, neohraničené zatékání kontrastní látky do pleurální dutiny bylo zjištěno u 28 pacientů, jeden pacient neměl prokázaný leak kontrastní látky, ale měl endoskopický nález nekrózy anastomózy způsobující dysfagie. Klinické známky sepse byly přítomné u 30 pacientů (79 %), ostatní nebyli klinicky septičtí. Velikost dehiscence dle endoskopického hodnocení se pohybovala od neviditelné až po 70 % obvodu (Obr. 3), 7 pacientů mělo dehiscenci ≥25 % obvodu. Stenty bez stabilizace byly použity celkem u 15 pacientů, zavěšené stenty u 24 pacientů (Obr. 4). Endoskopické manipulace se stentem (repozice stentu nebo extrakce a zavedení nového stentu) byly nutné u 17 pacientů (44 %), přičemž u nezavěšených stentů to bylo u 9 pacientů (60 %), kdežto u zavěšených stentů jenom u 8 pacientů (33 %). Celkem bylo použito 58 stentů u 39 pacientů, nejvíce 5 stentů u jednoho pacienta. U šesti pacientů bylo použito 3 a více stentů. Utěsnění leaku na kontrolním RTG zobrazení bylo dosaženo u 28 pacientů (72 %) (Obr. 5), u zbylých nemocných přetrvávala extraluminace kontrastní látky i po opakovaných manipulacích se stentem. Pět pacientů mělo zavedený stent bez současné drenáže mediastina či pleurální dutiny. CT navigovaná drenáž pleurální dutiny či mediastinální kolekce byla provedena u 18 pacientů (Obr. 6), 13 pacientů mělo buďto stávající hrudní drén od operace, nebo měli zaveden hrudní drén bez navigace a tři pacienti byli současně se zavedením stentu indikováni k reoperaci z torakotomie. Celkově reoperaci podstoupilo 17 pacientů se zavedeným stentem (44 %), z toho tři pacienti primárně spolu se zavedením stentu. Debridement pleurální dutiny a drenáž byla provedena u 8 pacientů (21 %) včetně tří pacientů indikovaných primárně. Zrušení anastomózy s vyvedením krční ezofagostomie byla provedena u 9 stentovaných pacientů (23 %). Stent byl extrahován za medián 25 dní (rozsah 1 až 91 dní) po zavedení. Závažné komplikace stentáže se vyskytly u 4 pacientů (10 %). U jednoho pacienta došlo k vzniku pozdní gastropulmonální píštěle, viz výše. U dalších tří nemocných byla zjištěna ezofago - či gastro-bronchiální fistula. Všem byla provedena krční ezofagostomie, u dvou pacientů byla provedena i pravostranná pneumonektomie, u jednoho nemocného plastika bronchu svalovým lalokem. Všichni tři nemocní komplikaci podlehli (17., 45. a 81. pooperační den). Celkem v důsledku AL zemřelo 7 pacientů primárně léčených jícnovým stentem (18 %). Zhojení píštěle po odstranění stentu bylo dosaženo u 24 pacientů (62 %). U čtyř nemocných (10 %) přetrvávala ohraničená mediastinální píštěl i po odstranění stentu, přičemž jeden pacient byl ponechán ke konzervativnímu zhojení píštěle při zavedené perkutánní drenáži a u tří pacientů byla ke zhojení reziduální píštěle použita EVT. U jednoho pacienta léčeného pomocí EVT byla následně zjištěna subklinická ezofago-pulmonální fistula úspěšně zhojena konzervativně. Čtyři nemocní přežili s ezofagostomií (10 %). Úspěšnost terapie AL jícnovým stentem v kombinaci se sekundárními léčebnými postupy (operační debridement, EVT), ve smyslu zachování původní anastomózy, byla 72 %. Ze sedmi pacientů, kteří měli rozsáhlou dehiscencí (≥25 % obvodu), se anastomózu podařilo zahojit všem čtyřem pacientům s dehiscencí ≤1/3 obvodu anastomózy. Naopak, z tří pacientů, kteří měli dehiscenci ≥40 % obvodu, dva zemřeli (40 % a 60 % obvodu) a jedna pacientka přežila s krční ezofagostomií (70 % obvodu) (Obr. 3).
Obr. 3. Endoskopický obraz dehiscence 70 % obvodu anastomózy s okrskovou nekrózou, léčba stentem selhala
Fig. 3: Endoscopic image of dehiscence of 70% of the circumference of the anastomosis with focal necrosis; stent treatment failed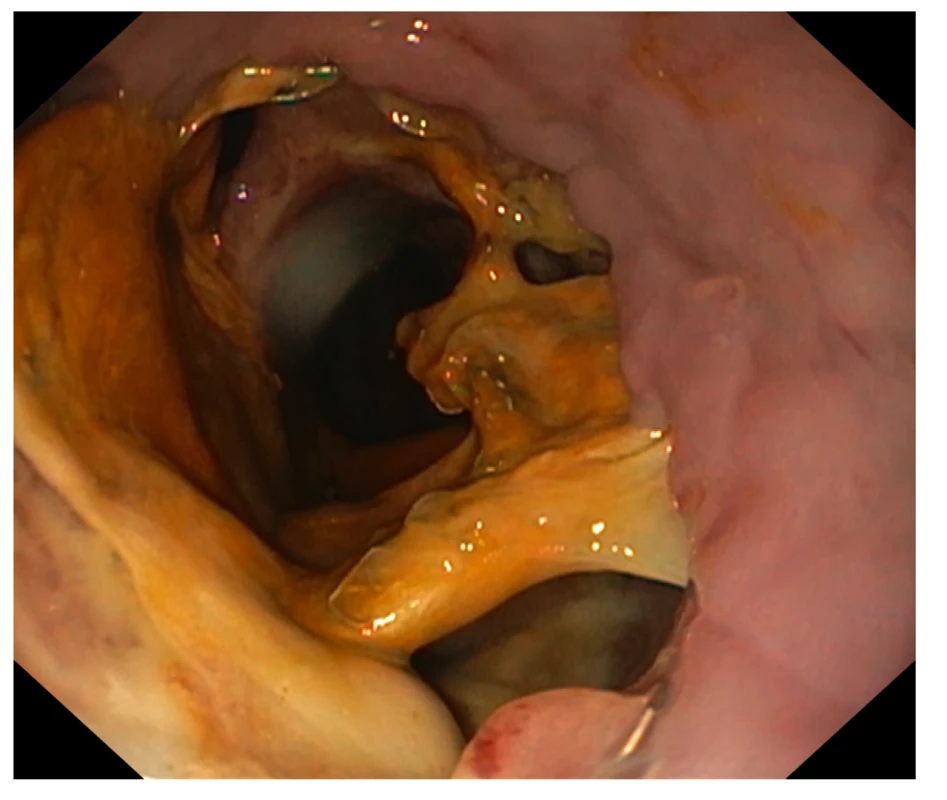
Obr. 4. Endoskopický obraz zavedeného zavěšeného jícnového stentu
Fig. 4: Endoscopic image of an inserted suspended esophageal stent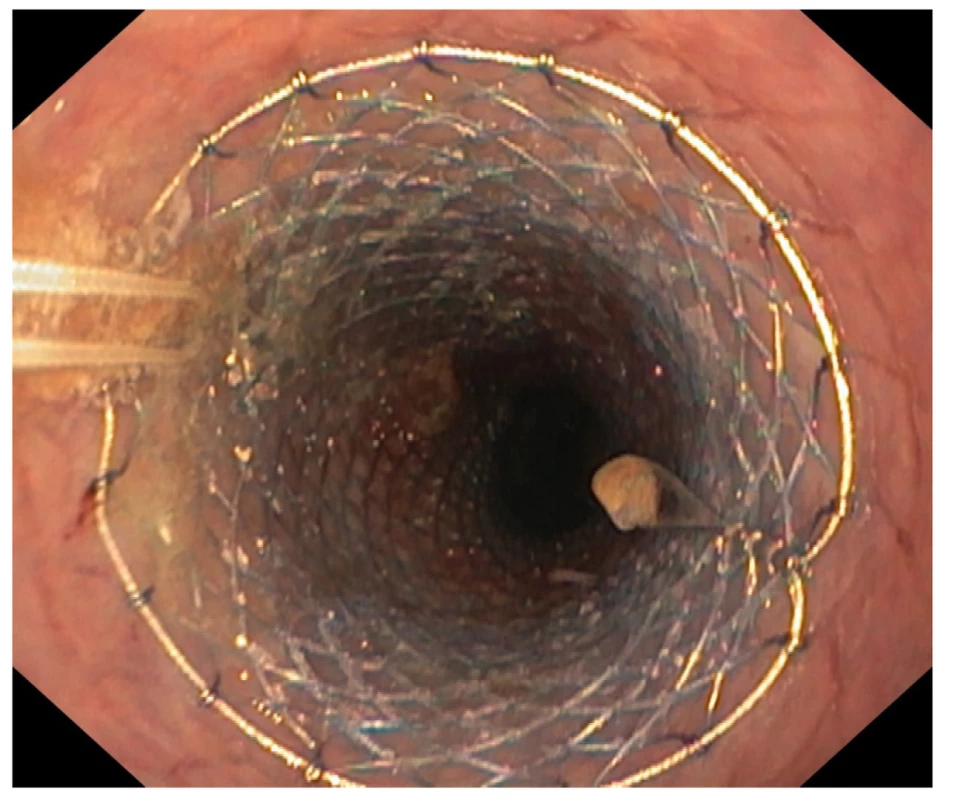
Obr. 5. A − ohraničený AL na ezofagografii, B − ezofagografický obraz utěsněného AL po zavedení stentu
Fig. 5: A − contained AL on esophagography; B − esophagographic image of a sealed AL after stent insertion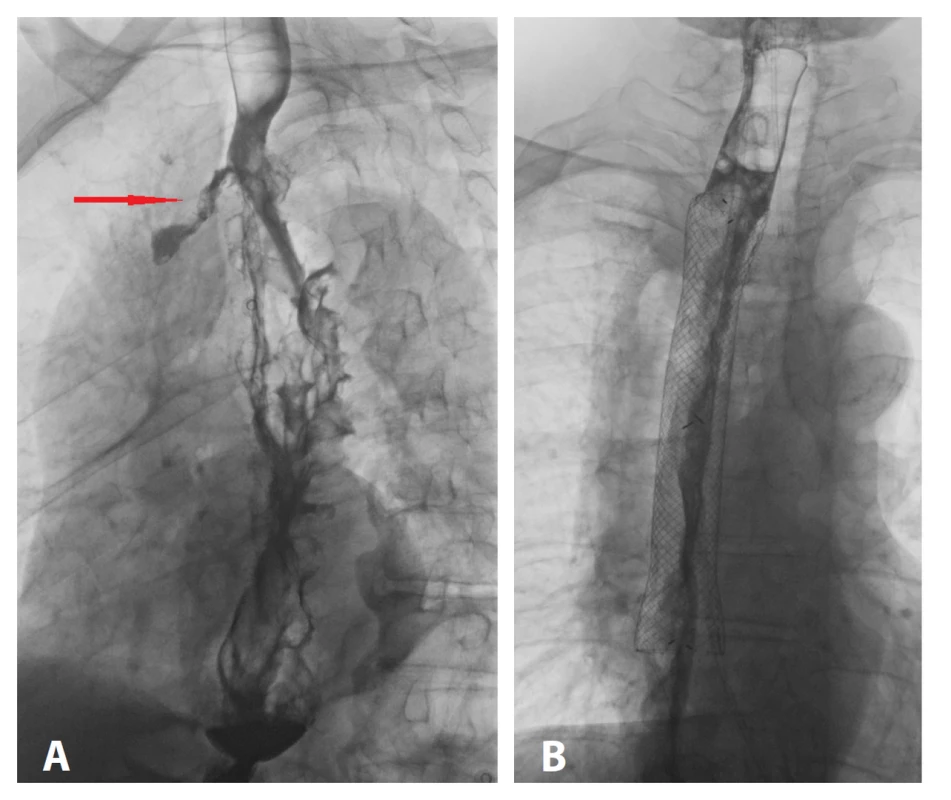
Obr. 6. CT navigovaná drenáž mediastinálního abscesu, v jícnu stent
Fig. 6: CT guided drainage of mediastinal abscess, stent in the esophagus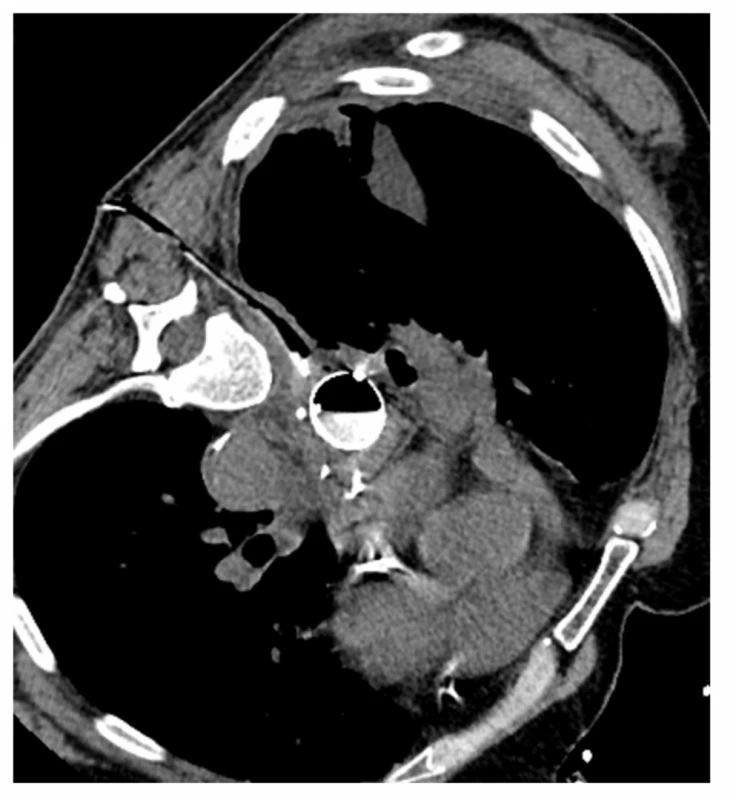
Primární reoperace bez použití stentu
Primární reoperace bez použití jícnového stentu byla provedena u 7 pacientů v mediánu 6 dní po primární operaci (rozsah 1 až 13 dní). U všech bylo provedeno zrušení anastomózy a konstruována krční ezofagostomie a gastrostomie nebo jejunostomie. Čtyři pacienti byli indikováni k reoperaci pro současnou nekrózu žaludečního tubulu. U dvou pacientů s AL bez nekrózy byla provedena krční ES, protože v té době jsme ještě jícnový stent standardně k léčbě leaku nepoužívali. Jeden pacient měl dehiscenci víc než 2/3 obvodu anastomózy. Pooperačně zemřel jeden pacient. Úspěšnost primární reoperace bez použití stentu z hlediska zahojení anastomózy tedy byla 0 %.
DISKUZE
Anastomotický leak je závažná a poměrně častá chirurgická komplikace ohrožující pacienta na životě. Zejména v případě hrudní lokalizace anastomózy může únik obsahu jícnu a žaludku do okolí vést k bakteriální kontaminaci a rozvoji mediastinitídy, empyému hrudníku a z toho plynoucí sepse se selháváním životních orgánů. Úmrtnost pacientů s AL po ezofagektomii je několikanásobně vyšší než pacientů bez této komplikace [10]. V našem souboru měli pacienti s AL přibližně 5× vyšší mortalitu než pacienti, u kterých se AL neobjevil.
Předpokladem úspěšné léčby AL je včasná diagnostika této komplikace ještě předtím, než se rozvine těžká, život ohrožující sepse. Pečlivé monitorování klinického stavu a laboratorních parametrů na jednotce intenzivní péče v pooperačním období je samozřejmostí. První příznaky můžou být nepříznačné, jako například alterace mentálního stavu nebo nově vzniklá fibrilace síní. V případě podezření na možné komplikace je potřeba vyloučit AL pomocí ezofagografie nebo CT s perorální kontrastní látkou. Výhodou CT vyšetření proti RTG pasáži je vyšší senzitivita diagnostiky AL (kromě extraluminace k. l. například nepřímé známky jako bublinky plynu v okolí anastomózy), navíc podává informaci o rozsahu kontaminace pleurální dutiny a mediastina, případně i o jiných možných příčinách septického stavu (např. pneumonie) a umožní posoudit možnost CT navigované perkutánní drenáže [11]. Nevýhodou je vyšší radiační zátěž pacienta. Endoskopické vyšetření jako první diagnostickou metodu při podezření na AL neprovádíme, protože i v případě RTG prokázaného AL jsme v některých případech dehiscenci anastomózy endoskopicky nespatřili, ale jenom fibrinový povlak anastomózy či okrskovou nekrózu. Vždy ji však provádíme při pozitivním radiologickém nálezu a klinické symptomatologii. Endoskopie má nezastupitelné místo v primární diagnostice nekrózy transponátu, která nemusí být spojená s RTG detekovatelným AL.
Význam rutinního radiologického vyšetřování na přítomnost AL u pacientů po resekci jícnu je diskutabilní. Na našem pracovišti provádíme všem pacientům po resekci jícnu RTG pasáž jodovou kontrastní látkou 7. den po operaci k vyloučení klinicky okultního AL. Časový odstup pro toto vyšetření se u různých pracovišť liší a někteří autoři zpochybňují význam rutinního vyšetřování, poukazujíce na riziko aspirace kontrastní látky a indikují radiologické zobrazení jen v případě klinického podezření [12]. Klinický vývoj u neléčeného asymptomatického pacienta s okultním AL je nejasný, nelze však vyloučit, že rychlá realimentace může vést k progresi píštěle a klinické manifestaci. Na druhé straně ani negativní rutinní vyšetření nezaručuje, že pacient nebude mít AL. Jedna třetina našich pacientů měla AL diagnostikovaný později než 7. pooperační den, kdy měli negativní rutinní ezofagografii.
V případě prokázání AL musí být léčba pokud možno bezodkladná a adekvátní. Na místě je multidisciplinární přístup s účastí chirurga, endoskopisty, intervenčního radiologa, intenzivisty a fyzioterapeuta. Při rozhodování o optimální léčebné strategii je potřeba vzít v úvahu více faktorů: lokalizaci anastomózy, dobu od primární operace, RTG nález – ohraničenost leaku či volné zatékání do pleurální dutiny, CT známky empyému, možnost CT navigované drenáže, endoskopický nález – rozsah dehiscence anastomózy, přítomnost a rozsah nekrózy žaludku, oddálení okrajů defektu, aktuální klinický stav pacienta – klinické známky sepse, selhávání orgánových funkcí, dále věk pacienta, jeho komorbidity a funkční rezervy, předchozí terapeutické pokusy a v neposlední míře dostupné terapeutické možnosti. Primárně je snaha o zachování anastomózy, nicméně AL je život ohrožující komplikace a zabránit úmrtí pacienta i za cenu zrušení anastomózy má prioritu.
Obecné zásady léčby AL zahrnují zabránění leaku endoskopickými, radiologickými nebo chirurgickými metodami, léčbu přidružené mediastinitídy a pleurálního empyému chirurgicky nebo pomocí perkutánní drenáže a adekvátní širokospektrální antibiotickou a antimykotickou terapií, symptomatickou a podpůrnou léčbu orgánového selhávání a přidružených komplikací, adekvátní výživu s preferencí enterální nutrice cestou jejunostomie či nasojejunální sondy a fyzioterapii [8].
Ne každý pacient s AL musí být však léčen agresivně. V našem souboru bylo u 41 % pacientů postupováno konzervativně, bez intervence k zabránění leaku či drenáže. Podmínkou konzervativního postupu je malý ohraničený leak na RTG zobrazení, dobrý klinický stav pacienta (asymptomatický pacient nebo jen mírné známky zánětu – subfebrilie, leukocytóza) bez klinicky vyjádřených příznaků sepse a dobrá evakuace žaludečního konduitu [13]. Konzervativní terapie spočívá v oddálení realimentace, pokračování enterální či parenterální výživy, případně antibiotické terapii a pečlivé monitoraci klinického stavu s kontrolním radiologickým zobrazením v odstupu několika dní až týdne. Většina dobře selektovaných pacientů se na konzervativní terapii zahojí.
V případě klinicky manifestního AL je potřeba zabránit pokračování extraluminace a kontaminace pokusem o uzavření dehiscence anastomózy. To je možné dosáhnout endoskopickými, radiologickými nebo chirurgickými metodami. Na našem pracovišti se nám osvědčilo endoskopické zavedení plně potaženého metalického stentu. Popisované jsou i endoskopické metody uzavření píštěle pomocí klipů, endoskopické sutury či aplikace fibrinového lepidla [14]. S těmito metodami v případě AL nemáme zkušenosti, nicméně bychom je vyhradili jenom pro velmi malé defekty s přiléhajícími vitálními okraji nebo k uzavření reziduální píštěle po nekompletním zhojení pomocí jiné metody. Chirurgické způsoby uzávěru dehiscence zahrnují prostou suturu okrajů dehiscence po nezbytné nekrektomii, suturu dehiscence potencovanou přídatnou tkání, jako je svalový lalok, perikard či omentum, nebo resekci anastomózy s bezprostřední konstrukcí nové anastomózy nebo derivační krční ezofagostomie [13,15]. Jednoduchou suturu defektu anastomózy nelze doporučit. Tkáně v okolí dehiscence jsou často nekrotické nebo v důsledku akutního zánětu nekvalitní a sutura je ohrožena vysokým rizikem opětovného leaku [16]. Dobré výsledky jsou publikovány s primární suturou zajištěnou svalovým lalokem m. serratus anterior nebo latissimus dorsi [17,18]. Na našem pracovišti jsme ve studovaném období svalovou lalokovou plastiku anastomózy v případě AL neprováděli. Resekce dehiscentní anastomózy s reanastomózou připadá v úvahu, když se objeví AL včasně po primární operaci, většinou vinou technické chyby či selhání stapleru při konstrukci anastomózy, a tkáně ještě nejsou významně změněné infekcí. Podmínkou je žaludeční tubulus v dostatečném nadbytku a dobře mobilizovatelný.
Léčba AL pomocí jícnového stentu je zavedená metoda nechirurgického ošetření této komplikace a je v současnosti preferovaným způsobem ošetření AL na našem pracovišti. Výhodou je minimální invazivita výkonu, který je možné provést bez celkové anestezie endoskopicky či pomocí intervenční radiologie. Nevýhodou je sklon k dislokaci stentu aborálním směrem, v některých případech nedostatečné utěsnění leaku a možnost vzniku jiných závažných komplikací. Není shoda v tom, jaký rozsah dehiscence lze ošetřit stentem, aby měla reálnou šanci na zhojení. Doporučení se pohybují od méně než 30 % až do 70 % obvodu anastomózy [19–21]. Z naší zkušenosti můžeme potvrdit, že dehiscence do 30 % obvodu lze na stentu zahojit s vysokou pravděpodobností, avšak žádnou anastomózu dehiscentní na víc než 40 % cirkumference se nám nepodařilo pomocí stentu zachránit. Zavádět stent u AL s dehiscencí víc než poloviny obvodu obecně nedoporučujeme, jen ve specifických, přísně selektovaných případech po individuálním zvážení rizika. K zabránění leaku lze použít plně potažený nebo parciálně potažený metalický nebo plastikový stent. Metaanalýza nenalezla rozdíl v úspěšnosti vyléčení AL či komplikacích mezi metalickými a plastikovými stenty [22]. U parciálně potažených stentů je popisována nižší tendence k migraci stentu [22]. Aborální dislokace stentu je častý problém, který souvisí s tím, že stent není v místě anastomózy dostatečně zastabilizován opřením o stěnu jícnu. Na našem pracovišti jsme problém s dislokací stentu vyřešili tím, že ho zavěšujeme na vlákno, které je vyvedené nosní dírkou a ukotvené o segment ustřiženého drénu. Pomocí této metody jsme dosáhli snížení nutných endoskopických reintervencí na polovinu, vesměs jenom pro radiologické neutěsnění leaku. V literatuře jsou udávány i možnosti fixace stentu pomocí klipu či endoskopické sutury. Dalším problémem bývá nedostatečné utěsnění leaku pomocí stentu. Většina pracovišť, naše nevyjímaje, provádí kontrolní ezofagografii po zavedení stentu. V případě přetrvávajícího leaku na RTG zobrazení je vhodné upravit polohu stentu (posunutím orálně) nebo stent vyměnit za širší. I přesto, že jsme téměř u poloviny pacientů endoskopicky reintervenovali a použili v průměru 1,5 stentu na pacienta, se v našem souboru přibližně u ¼ pacientů nepodařilo leak utěsnit ani opakovanými endoskopickými manévry. V posledních letech jsme začali víc používat Danis-Seal stenty, které jsou širší a lépe utěsní leak. Nevýhodou je však větší potenciální riziko komplikací plynoucí z většího expanzního tlaku na okolí. Nedostatečné utěsnění leaku pomocí stentu neznamená vždy nutnost měnit léčebnou strategii a reoperovat. Pokud je AL dobře drenován a pacient je v dobrém klinickém stavu, lze postupovat konzervativně. Takto se nám podařilo zahojit dva pacienty. Při progresi sepse však neváháme s reoperací. Shoda v literatuře není ani co se týče časové délky stentování, kdy se doporučení pohybují od 2 do 8 týdnů. Většina autorů včetně našeho pracoviště ponechává stent 3–5 týdnů, v závislosti na rozsahu dehiscence, charakteru stentu, RTG nálezu a klinickém průběhu. Po 4 týdnech je vhodné stent odstranit a ověřit zahojení anastomózy. Pokud nadále trvá AL, je možné zavést nový stent nebo pokračovat s jinou nechirurgickou metodou (např. EVT). Úspěšnost léčby AL pomocí stentu se udává v rozmezí 60–85 % [19,22–26]. V našem souboru se na stentu zahojily 2/3 pacientů, což odpovídá publikovaným údajům z jiných velkoobjemových pracovišť [23]. Zavedení stentu do anastomózy však nese i potenciální riziko komplikací. Mezi nejzávažnější patří disrupce anastomózy příliš širokým stentem, krvácení při proležení stentu do velké cévy nebo vznik píštěle s dýchacími cestami. Popisovány jsou i lehčí komplikace jako fixace stentu v jícnu granulacemi s obtížnou extrakcí či pozdní vznik stenózy jícnu, nejčastěji v místě horního okraje stentu. V našem souboru pacientů jsme zaznamenali tři případy komunikace jícnu či žaludku s bronchem. Souvislost se zavedením stentu se dala v těchto případech předpokládat. Všechny případy měly fatální průběh i přes maximální chirurgickou terapii.
Neméně důležitou součástí ošetření AL je adekvátní drenáž perianastomotického abscesu či mediastinálních kolekcí a pleurálních výpotků. To je možné docílit prostou drenáži hrudníku, nicméně velmi často se jedná o ohraničené výpotky vyžadující cílenou CT navigovanou perkutánní drenáž. V našem souboru jen 5 nemocných mělo zavedený stent bez nutnosti současné nebo následné drenáže. V případě, že adekvátní drenáž nelze provést perkutánně nebo je na CT patrný multilokulární empyém hrudníku s debris a kolapsem plíce, indikujeme reoperaci s dekortikací plíce a chirurgickou drenáží pleury a mediastina. V našem souboru podstoupil chirurgický debridment pleurální dutiny každý pátý stentovaný pacient. Některé nemocné jsme vzhledem ke klinickému stavu a CT nálezu indikovali k operační revizi primárně spolu se zavedením jícnového stentu jako hybridní výkon. Abscesy horního mediastina jsou přístupné i chirurgické drenáži z krční incize s využitím srkavé drenáže [16].
Novou metodu ošetření AL představuje endoskopická podtlaková terapie (EVT), která vychází z principu podtlakové terapie chirurgických ran. Jedná se o drenážní výkon, kdy houba, napojená přes nasogastrickou sondu na podtlakovou nádobu, je endoskopicky zavedená přes defekt anastomózy přímo do perianastomotického abscesu nebo jenom do lumen jícnu v úrovni anastomózy. Léčba vyžaduje několik endoskopických výměn houby. Dobré zkušenosti s touto léčbou jsou publikovány zejména německými autory, kteří EVT používají jako primární metodu léčby AL s úspěšností dosahující až 85–94 % [24,27,28]. Randomizovaná studie srovnávající použití jícnového stentu proti EVT v léčbě AL neexistuje, nicméně retrospektivní studie většinou favorizují EVT jak v míře zahojení anastomózy, tak ve výskytu nežádoucích komplikací [14]. Recentní velká retrospektivní studie však rozdíl v úspěšnosti obou metod nepotvrdila [24]. Naše zkušenost s EVT zahrnuje tři pacienty, u kterých jsme tuto metodu indikovali z důvodu perzistujícího ohraničeného leaku po odstranění stentu. Všem se podařilo AL pomocí EVT zahojit. U jednoho pacienta se objevila subklinická ezofago-pulmonální píštěl, která se zahojila konzervativně. EVT považujeme za vhodnou metodu ošetření ohraničeného mediastinálního leaku, zejména v případě, kdy není proveditelná nebo dostatečně účinná CT navigovaná perkutánní drenáž perianastomotického abscesu.
Ultimátním operačním výkonem u AL je zrušení anastomózy s diverzí jícnu v podobě krční ezofagostomie. Jedná se o značně mutilující, ale život zachraňující výkon. Primárně jej indikujeme v případě endoskopicky potvrzené nekrózy žaludečního tubulu nebo rozsáhlé dehiscence anastomózy s nekrotickými okraji, kdy šance na zahojení anastomózy jsou nepatrné. Jako sekundární řešení je krční ezofagostomie indikována při selhání jiných terapeutických postupů, kdy se klinický stav pacienta z důvodu AL progresivně zhoršuje nebo když je pacient v chronické neustupující sepsi z důvodu perzistujícího leaku i přes všechny méně agresivní terapeutické postupy. Rekonstrukce zažívacího traktu se u těchto pacientů většinou provádí pomocí tlustého střeva s odstupem několika měsíců. V našem souboru jsme krční ezofagostomii provedli celkem u 16 pacientů, z toho u 7 nemocných primárně a u 9 nemocných jako záchranný výkon při progredující či neustupující sepsi. Mortalita výkonu byla 38 %, což reflektuje závažný klinický stav indikovaných pacientů.
ZÁVĚR
Anastomotický leak představuje závažnou komplikaci ezofagektomie s významnou morbiditou a mortalitou. Úspěšná léčba vyžaduje včasnou diagnostiku, individuální přístup a multidisciplinární účast specialistů. Klíčové místo v diagnostice má endoskopické a radiologické vyšetření jícnu. Konzervativní léčba je možná u selektované skupiny nemocných v dobrém klinickém stavu s ohraničeným únikem kontrastní látky na zobrazovacím vyšetření. Většina symptomatických pacientů profituje z neinvazivních metod ošetření AL, jako jsou implantace jícnového stentu nebo endoskopická podtlaková terapie. Důležitými součástmi léčby jsou adekvátní drenáž, výživa a intenzivní symptomatická terapie. Pozornost je potřeba věnovat vývoji klinického stavu a v indikovaných případech neváhat s chirurgickou revizí, debridementem a drenáží pleurální dutiny a mediastina. Záchranný výkon při selhání terapie představuje krční diverze jícnu.
Konflikt zájmů
Autoři článku prohlašují, že nejsou v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise, s výjimkou kongresových abstrakt a doporučených postupů.
MUDr. Tomáš Haruštiak, Ph.D.
Klausova 2551/13
150 00 Praha
e-mail: tomas.harustiak@fnmotol.cz
Zdroje
- Blencowe NS, Strong S, McNair AGK, et al. Reporting of short-term clinical outcomes after esophagectomy: A systematic review. Ann Surg. 2012;255 : 658–666. doi:10.1097/SLA.0b013e3182480a6a.
- Prochazka V, Marek F, Kunovsky L, et al. Comparison of cervical anastomotic leak and stenosis after oesophagectomy for carcinoma according to the interval of the stomach ischaemic conditioning. Ann R Coll Surg Engl. 2018;100 : 509–514. doi:10.1308/rcsann.2018.0066.
- Vrba R, Aujeský R, Stašek M, et al. Karcinom jícnu - výsledky chirurgické terapie na I. chirurgické klinice FN Olomouc. Rozhl Chir. 2018;97 : 342–348.
- Harustiak T, Pazdro A, Snajdauf M, et al. Anastomotic leak and stricture after hand-sewn versus linear-stapled intrathoracic oesophagogastric anastomosis: single-centre analysis of 415 oesophagectomies. Eur J Cardiothorac Surg. 2016;49 : 1650−1659. doi:10.1093/ejcts/ezv395.
- Kassis ES, Kosinski AS, Ross P, et al. Predictors of anastomotic leak after esophagectomy: An analysis of the society of thoracic surgeons general thoracic database. Ann Thorac Surg. 2013;96 : 1919–1926. doi:10.1016/j.athoracsur.2013.07.119.
- Klevebro F, Elliott JA, Slaman A, et al. Cardiorespiratory comorbidity and postoperative complications following esophagectomy: a European multicenter cohort study. Ann Surg Oncol. 2019;26 : 2864–2873. doi:10.1245/s10434-019-07478-6.
- Klevebro F, Friesland S, Hedman M, et al. Neoadjuvant chemoradiotherapy may increase the risk of severe anastomotic complications after esophagectomy with cervical anastomosis. Langenbeck’s Arch Surg. 2016;401 : 323–331. doi:10.1007/s00423-016-1409-0.
- Messager M, Warlaumont M, Renaud F, et al. Recent improvements in the management of esophageal anastomotic leak after surgery for cancer. Eur J Surg Oncol. 2017;43 : 258–269. doi:10.1016/j.ejso.2016.06.394.
- Low DE, Alderson D, Cecconello I, et al. International consensus on standardization of data collection for complications associated with esophagectomy: Esophagectomy Complications Consensus Group (ECCG). Ann Surg. 2015;262 : 286–294. doi:10.1097/SLA.0000000000001098.
- Rutegård M, Lagergren P, Rouvelas I, et al. Intrathoracic anastomotic leakage and mortality after esophageal cancer resection: A population-based study. Ann Surg Oncol. 2012;19 : 99–103. doi:10.1245/s10434-011-1926-6.
- Strauss C, Mal F, Perniceni T, et al. Computed tomography versus water-soluble contrast swallow in the detection of intrathoracic anastomotic leak complicating esophagogastrectomy (Ivor Lewis): A prospective study in 97 patients. Ann Surg. 2010;251 : 647−651. doi:10.1097/SLA.0b013e3181c1aeb8.
- Cools-Lartigue J, Andalib A, Abo-Alsaud A, et al. Routine contrast esophagram has minimal impact on the postoperative management of patients undergoing esophagectomy for esophageal cancer. Ann Surg Oncol. 2014;21 : 2573–2579. doi:10.1245/s10434-014-3654-1.
- Low DE. Diagnosis and management of anastomotic leaks after esophagectomy. J Gastrointest Surg. 2011;15 : 1319–1322. doi:10.1007/s11605-011-1511-0.
- Famiglietti A, Lazar JF, Henderson H, et al. Management of anastomotic leaks after esophagectomy and gastric pull-up. J Thorac Dis. 2020;12 : 1022–1030. doi:10.21037/jtd.2020.01.15.
- Dent B, Griffin SM, Jones R, et al. Management and outcomes of anastomotic leaks after oesophagectomy. Br J Surg. 2016;103 : 1033–1038. doi:10.1002/bjs.10175.
- Šiška D, Janík M, Tarabová K, et al. Management of oesophageal anastomosis dehiscence after oesophagectomy for oesophageal cancer. Rozhl Chir. 2020;99 : 200–206. [in Czech] doi:10.33699/PIS.2020.99.5.200-206.
- Crestanello JA, Deschamps C, Cassivi SD, et al. Selective management of intrathoracic anastomotic leak after esophagectomy. J Thorac Cardiovasc Surg. 2005;129 : 254–260. doi:10.1016/j.jtcvs.2004.10.024.
- Martin LW, Swisher SG, Hofstetter W, et al. Intrathoracic leaks following esophagectomy are no longer associated with increased mortality. Ann Surg. 2005;242 : 392–402. doi:10.1097/01.sla.0000179645.17384.12.
- Plum PS, Herbold T, Berlth F, et al. Outcome of self-expanding metal stents in the treatment of anastomotic leaks after Ivor Lewis esophagectomy. World J Surg. 2019;43 : 862–869. doi:10.1007/s00268-018-4832-2.
- Schubert D, Scheidbach H, Kuhn R, et al. Endoscopic treatment of thoracic esophageal anastomotic leaks by using silicone-covered, self-expanding polyester stents. Gastrointest Endosc. 2005;61 : 891–896. doi:10.1016/s0016-5107(05)00325-1.
- Schaheen L, Blackmon SH, Nason KS. Optimal approach to the management of intrathoracic esophageal leak following esophagectomy: A systematic review. Am J Surg. 2014;208 : 536–43. doi:10.1016/j.amjsurg.2014.05.011.
- Van Boeckel PGA, Sijbring A, Vleggaar FP, et al. Systematic review: Temporary stent placement for benign rupture or anastomotic leak of the oesophagus. Aliment Pharmacol Ther. 2011;33 : 1292–301. doi:10.1111/j.1365-2036.2011.04663.x.
- Anderloni A, Genco C, Massidda M, et al. Self-expanding metal stents for the treatment of post-surgical esophageal leaks: A tertiary referral center experience. Dig Surg. 2019;36 : 309–316. doi:10.1159/000489817.
- Berlth F, Bludau M, Plum PS, et al. Self-expanding metal stents versus endoscopic vacuum therapy in anastomotic leak treatment after oncologic gastroesophageal surgery. J Gastrointest Surg. 2019;23 : 67–75. doi:10.1007/s11605-018-4000-x.
- Feith M, Gillen S, Schuster T, et al. Healing occurs in most patients that receive endoscopic stents for anastomotic leakage; dislocation remains a problem. Clin Gastroenterol Hepatol. 2011;9 : 202–210. doi:10.1016/j.cgh.2010.12.010.
- van Boeckel PGA, Dua KS, Weusten BLAM, et al. Fully covered self-expandable metal stents (SEMS), partially covered SEMS and self-expandable plastic stents for the treatment of benign esophageal ruptures and anastomotic leaks. BMC Gastroenterol. 2012;12 : 19. doi:10.1186/1471-230X-12-19.
- Laukoetter MG, Mennigen R, Neumann PA, et al. Successful closure of defects in the upper gastrointestinal tract by endoscopic vacuum therapy (EVT): a prospective cohort study. Surg Endosc. 2017;31 : 2687−2696. doi:10.1007/s00464-016-5265-3.
- Wedemeyer J, Brangewitz M, Kubicka S, et al. Management of major postsurgical gastroesophageal intrathoracic leaks with an endoscopic vacuum-assisted closure system. Gastrointest Endosc. 2010;71 : 382–386. doi:10.1016/j.gie.2009.07.011.
Štítky
Chirurgie všeobecná Ortopedie Urgentní medicína
Článek vyšel v časopiseRozhledy v chirurgii
Nejčtenější tento týden
2020 Číslo 10- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Stillova choroba: vzácné a závažné systémové onemocnění
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
-
Všechny články tohoto čísla
- Minimalizace a maximalizace v hrudní chirurgii
- Využití mimotělních podpor v hrudní chirurgii
- Pooperační chylothorax − souhrnné sdělení
- Léčba insuficience hrudní anastomózy po Ivor Lewis ezofagektomii
- Maligní onemocnění po transplantaci plic
- Hypertermická peroperační intrapleurální chemoterapie a chirurgická cytoredukce jako součást multimodální léčby maligního mezoteliomu pleury – kazuistika
- Problematika plicních metastáz při pseudomyxomu peritonea – kazuistika a přehled literatury
- Plicní arteriovenózní malformace řešená videoasistovanou torakoskopickou lobektomií
- Rozhledy v chirurgii
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Pooperační chylothorax − souhrnné sdělení
- Hypertermická peroperační intrapleurální chemoterapie a chirurgická cytoredukce jako součást multimodální léčby maligního mezoteliomu pleury – kazuistika
- Maligní onemocnění po transplantaci plic
- Využití mimotělních podpor v hrudní chirurgii
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



