-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Imunohistochemická exprese onkoproteinu EGFR a její prognostický význam u karcinomů slinných žláz
Immunohistochemical Expression of EGFR Oncoprotein and Its Prognostic Significance in Salivary Gland Carcinomas
Background:
To investigate the expression of EGFR oncoprotein in salivary gland carcinomas and to correlate it with the prognosis, T stage of the primary and its cervical metastases.Methods:
Immunohistochemistry for EGFR protein was performed in 76 carcinomas, using formalin-fixed paraffin-embedded sections. For the evaluation of reactivity of tumor cells, a histoscore combining membranous staining intensity (scala no reaction, weak, moderate, strong) with the percentage of positive cells, namely 0 (no reaction or reaction in <10 % cells), 1+, 2+, 3+ (weak, moderate, strong in ≥ 10 % of cells) was applied. Prognostic correlation was performed in a subset of 55 patients in three different modes: I. 0 negative vs. 1+, 2+, and 3+ positive. II. 0, 1+ negative vs. 2+ and 3+ positive. III. 0, 1+, 2+ negative vs. 3+ positive. Univariate disease-specific survival curves were calculated by Kaplan-Meier method, the distributions were compared with the log-rank test. For the same modes, correlation between EGFR expression and the T stage of the primary and its cervical metastases was evaluated using Fisher’s exact test.Results:
39.5 % (30/76) carcinomas were EGFR negative, 60,5 % (46/76) were positive, with the histoscore of the latter making 1+, 2+ and 3+ in 15 (32.6 %) (1+), 12 (26.1 %) and 19 (41.3 %) cases, respectively. In adenoid cystic, salivary duct and mucoepidermoid carcinoma and carcinoma ex pleomorphic adenoma the EGFR immunoreaction tested positive in 65.5 % (19/29), 47.8 % (11/23), 83.3 % (5/6) and 100 % (4/4) of cases, respectively. 80 % (4/5) of acinic cell carcinomas were scored with 0. Of other histopathologic entities, positive EGFR immunoreaction was recorded in undifferentiated carcinoma (2/2), malignant mixed tumour (1/2), adenocarcinoma NOS (1/1), papillary-cystic adenocarcinoma (1/1) and mammary analogue secretory carcinoma of salivary glands (1/1). One each small cell carcinoma and cribriform cystadenocarcinoma was EGFR negative. The disease-specific survival in EGFR positive carcinomas differed from that in EGFR negative ones, especially in modus II, but no statistic significance was recorded (p=0.073).Conclusions:
Of all histopathological entities tested, carcinoma ex pleomorphic adenoma, undifferentiated carcinoma and adenocarcinoma NOS showed 100% immunoreactivity, the reaction of other histotypes was less frequent with a variable histoscore. We failed to demonstrate any statistical significance of EGFR expression for the prognosis, T stage and cervical metastases of salivary gland carcinomas.Key words:
EGFR oncoprotein, salivary gland carcinoma, prognosis.
Autoři: I. Stárek 1; L. Kučerová 2; A. Skálová 3; M. Brož 1; T. Bakaj 1; A. Zapletalová 4; L. Hostička 5
Působiště autorů: Klinika otorinolaryngologie a chirurgie hlavy a krku LF UP a FN, Olomouc ; přednosta prof. MUDr. I. Stárek, CSc. Ústav patologie, FN Olomouc 1; přednosta doc. MUDr. M. Tichý, CSc. Ústav patologie, FN Plzeň 2; přednosta prof. MUDr. M. Michal Ústav lékařské biofyziky LF UP, Olomouc 3; přednostka doc. RNDr. H. Kolářová, CSc. Stomatologická klinika FN Plzeň 4; přednosta doc. MUDr. A. Zicha, CSc. 5
Vyšlo v časopise: Otorinolaryngol Foniatr, 60, 2011, No. 2, pp. 78-84.
Kategorie: Původní práce
Souhrn
Cíle:
Zhodnocení exprese onkoproteinu EGFR u karcinomů slinných žláz a její korelace s prognózou, T stadiem primárního tumoru a výskytem regionálních metastáz.Metody:
Retrospektivní imunohistochemická analýza exprese EGFR onkoproteinu byla provedena u 76 karcinomů za užití formalinem fixované, v parafinu zalité tkáně. Exprese byla hodnocena pomocí histoskore, kombinujícího intenzitu (škála žádná, slabá, střední, silná) membranózní reakce a procento pozitivních buněk jako 0 (zcela bez nebo reakce u <10 % buněk), 1+, 2+ a 3+ (slabá, střední, silná reakce u ≥ 10 % buněk). Prognostické korelace byly provedeny u 55 pacientů univariátní analýzou křivek nádorově specifického přežití dle Kaplan-Meiera a porovnáním pomocí log-rank testu, a to ve 3 modech: I. 0 negativní vs. 1+, 2+, 3 + pozitivní. II. 0, 1+ negativní vs. 2+ a 3 + pozitivní. III. 0, 1+, 2+ negativní vs. 3 + pozitivní. Ve stejných modech byl Fisherovým přesným testem zkoumán vliv exprese EGFR na rozsah primárního tumoru a regionální uzlinové metastázy.Výsledky.
30 (tj. 39,5 %) karcinomů bylo EGFR negativních, 46 (60,5 %) pozitivních, přičemž u 15 (32,6 %) z posledně uvedených jsme zaznamenali histoskore 1+, u 12 (26,1 %) 2+ a u 19 (41,3 %) 3+. U adenoidně cystického, salivárního duktálního, mukoepidermoidního karcinomu a karcinomu z pleomorfního adenomu byla imunoreakce pozitivní v 65,5 % (19/29), 47,8 % (11/23), 83,3 % (5/6) a 100 % (4/4) případů. 80 % (4/5) acinocelulárních karcinomů jevilo EGFR negativitu. Z ostatních histopatologických jednotek byly pozitivní nediferencovaný karcinom (2/2), maligní smíšený tumor (1/2), adenokarcinom NOS (1/1), papilárně-cystický adenokarcinom (1/1) a sekreční karcinom parotis mamárního typu (1/1), negativní pak karcinom malobuněčný (0/1) a kribriformní cystadenokarcinom (0/1). Rozdíly v nádorově specifickém přežívání mezi EGFR pozitivními a negativními karcinomy byly největší pro modus II, nedosahovaly však statistické signifikance (p = 0,073).Závěr:
Ze všech testovaných jednotek vykazoval 100% pozitivitu EGFR karcinom z pleomorfního adenomu, nediferencovaný karcinom a adenokarcinom NOS. Ostatní histopatologické typy jevily imunoreaktivitu v menší míře při většinou variabilním histoskore. Neprokázali jsme signifikantní význam imunohistochemické exprese EGFR onkoproteinu pro prognózu, T stadium ani výskyt krčních metastáz.Klíčová slova:
EGFR onkoprotein, karcinomy slinných žláz, prognóza.ÚVOD
Jedním ze současných úkolů onkopatologů je identifikace genových a molekulárních abnormalit, odpovědných za iniciaci, proliferaci a metastázování tumorů, otevírající možnosti biologické terapie především pokročilých, prognosticky závažných stadií. Uvedený trend se samozřejmě nevyhýbá ani nádorům slinných žláz s dosud neuspokojivými výsledky léčby jejich vysoce maligních typů. Tato onkologická skupina, představující méně než 6 % všech tumorů hlavy a krku, je charakteristická velkým množstvím histopatologických jednotek odlišného biologického chování. Teoreticky tak lze v jejich onkogeneze předpokládat roli celé řady dnes známých i dosud neidentifikovaných supresorických genů a protoonkogenů, jejichž profil, specifický pro daný histopatologický typ nádoru, je i determinantem jejich prognózy. Zatím však byly s různým výsledkem testovány jen některé z nich, především pak ty, jejichž cílená blokáda se projevila jako účinná v terapii jiných, převážně solidních malignit (22). Sem patří především gen pro receptor epidermálního růstového faktoru (EGFR). Léčba monoklonální protilátkou Cetuximab (Erbitux), která je dnes standardem v léčbě metastatického kolorektálního karcinomu, pronikla i do terapeutických schémat lokálně pokročilých a generalizovaných dlaždicobuněčných karcinomů hlavy a krku.
Dosud publikované zprávy o expresi onkoproteinu EGFR u salivárních karcinomů se týkají jen nevelkého počtu případů a jejich výsledky jsou mnohdy protichůdné. Ve studii jsme proto na poměrně širokém histopatologickém spektru sledovali imunohistochemickou expresi EGFR, její prognostický význam a vztah k rozsahu primárního tumoru a jeho regionálním metastázám. Domníváme se, že naše práce by mohla být přínosem v odpovědi na otázku, zda se identifikace tohoto biologického markeru může stát podkladem pro selekci nádorů, reagujících na léčbu monoklonální protilátkou či tyrozin-kinázovými inhibitory. Ve hře je i možný přínos exprese tohoto onkoproteinu pro obtížnou histopatologickou diferenciální diagnózu některých salivárních karcinomů.
SOUBOR PACIENTŮ A METODY
V registru karcinomů slinných žláz, vedených v ústavech patologie v Olomouci a v Plzni, byly vyhledány archivované materiály karcinomů slinných žláz u 76 nemocných. Poměr obou pohlaví v souboru byl prakticky vyrovnán (39 mužů, 37 žen). 52 karcinomů vyrůstalo z příušní žlázy, v gl. submandibularis bylo lokalizováno 18, v malých slinných žlázách 6 karcinomů, v žádném případě se nevyskytl tumor ve žláze podjazykové.
Imunohistochemická exprese EGFR byla stanovena v celém souboru 76 nádorů. Z jednotlivých histopatologických forem (tab. 1) byl nejčastějším karcinom adenoidně cystický (29x), následovaný karcinomem duktálním (23x), mukoepidermoidním (6x), acinocelulárním (5x) a karcinomem z pleomorfního adenomu (4x), dále nediferencovaným karcinomem a maligním smíšeným tumorem (vždy 2x), po jednom případě pak malobuněčným karcinomem neuroendokrinním, adenokarcinomem jinak nespecifikovaným, adenokarcinomem papilárně-cystickým a sekrečním karcinomem slinných žláz, jež je novou, ve WHO klasifikaci dosud neuvedenou jednotkou (27).
Tab. 1. Histopatologický profil a histoskore karcinomů slinných žláz. 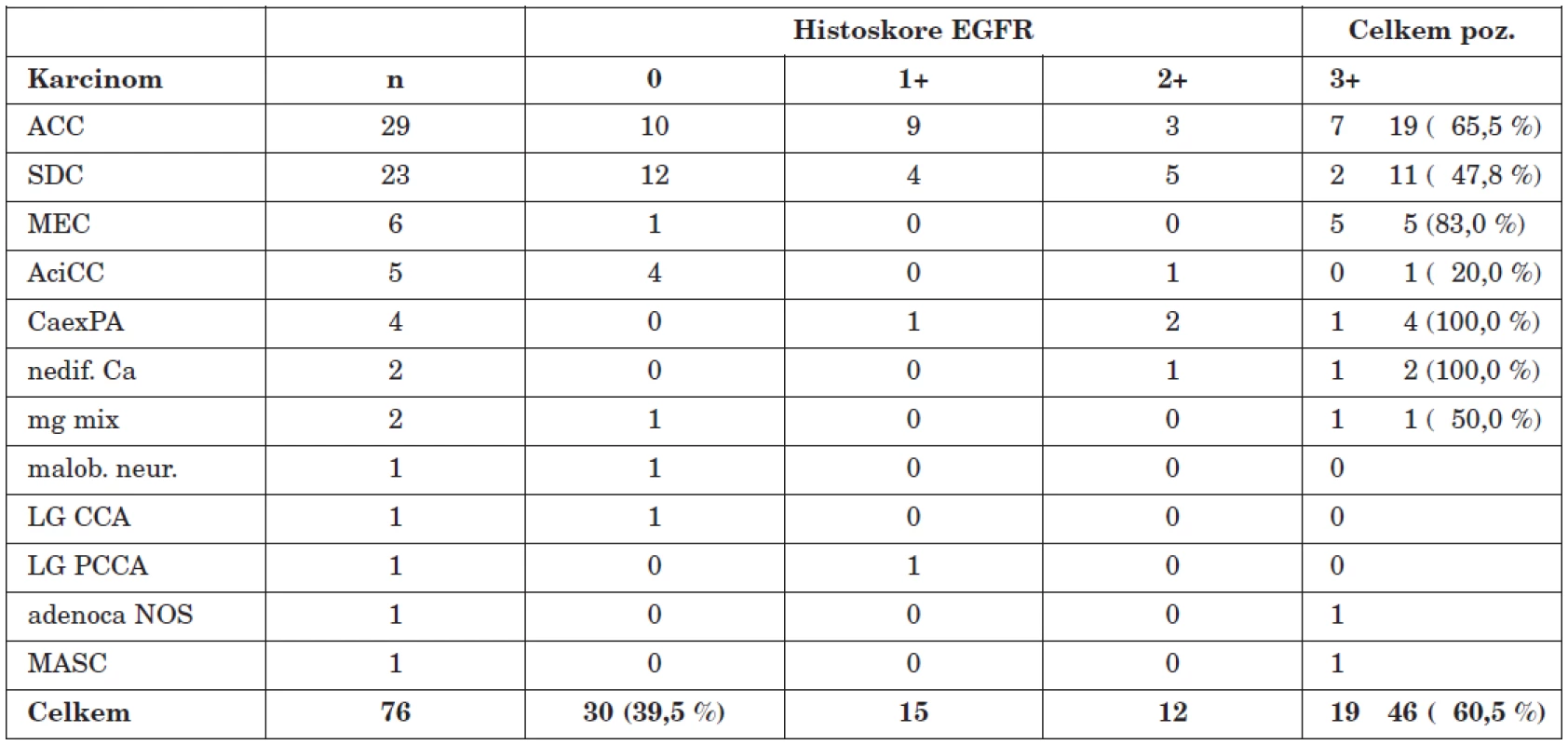
ACC – karcinom adenoidně cystický, LG CCA – LG kribriformní cystadenokarcinom, SDC – karcinom salivární duktální, LG PCCA – adenoca papilárně cystický, MEC – karcinom mukoepidermoidní, MASC – mamární analogní sekretorický karcinom, AciCC – karcinom acinocelulární Klinické údaje pro follow-up a histopatologický stav (pN) uzlin byly dostupné jen u 55 případů. V této podskupině byl zkoumán vliv exprese EGFR na nádorově specifické přežití, klinické stadium primárního tumoru a regionální lymfatické metastázy. Věk nemocných se pohyboval v rozmezí 8 až 86 (průměr 56,6, medián 59) let. 14 tumorů jsme diagnostikovali ve stadiu T1, 14 ve stadiu T2, 19 ve stadiu T3, 8 ve stadiu T4. U 42 parotických tumorů byla 10x provedena konzervativní superficiální, 8x konzervativní totální, 24 totální radikální či semiradikální parotidektomie. Zbývajících 10 submandibulárních karcinomů bylo odstraněno v bloku se žlázou, 3 tumory malých slinných žláz byly exstirpovány in toto. Součástí chirurgického výkonu byla vždy terapeutická nebo elektivní bloková disekce. 15 (27,3 %) z těchto 55 pacientů bylo následně klasifikováno jako pN+. 37 nemocných žije, z toho 8 se známkami onemocnění, 18 na nádor zemřelo. Rozsah sledovacího intervalu byl 8-270, průměr 62,4 (medián 33) měsíců.
IMUNOHISTOCHEMICKÉ VYŠETŘENÍ
K detekci exprese EGFR byla použita imunohistochemická reakce s primární protilátkou proti EGFR firmy Dakopatts, v ředění 1 : 100. K odkrytí (demaskování) epitopů EGFR jsme použili natrávení tkáně proteázou. Celý proces probíhal automaticky v imunostaineru Bench Mark ULTRA IHC/ISH firmy VENTANA (Roche).
K hodnocení exprese jsme použili interpretační manuál dodaný firmou DAKO, s atestem FDA (Food and Drug Administration).
Exprese byla hodnocena pomocí histoskore, kombinujícího intenzitu (škála žádná, slabá, střední, silná) membranózní reakce a procento pozitivních buněk jako 0 (zcela bez nebo reakce u <10 % buněk), 1+, 2+ a 3+ (slabá, střední, silná reakce u ≥ 10 % buněk). Jako pozitivní kontrola byly použity choriové klky.
STATISTICKÉ METODY
Pravděpodobnost kumulativního nádorově specifického přežití (Kaplan-Meier) u pacientů s EGFR pozitivními a negativními karcinomy jsme porovnali log-rank testem. Vztah mezi expresí EGFR a rozsahem primárního tumoru a uzlinovými metastázami byl zkoumán přesným Fisherovým testem. Vzhledem k chybění standardu a rozdílné metodice, jež byla použita v dosud publikovaných pracích, jsme význam exprese EGFR pro všechny tři výše uvedené veličiny analyzovali ve 3 následujících modech: I. 0 negativní vs. 1+, 2+, 3 + pozitivní. II. 0, 1+ negativní vs. 2+ a 3 + pozitivní. III. 0, 1+, 2+ negativní vs. 3 + pozitivní.
VÝSLEDKY
Celkové výsledky imunoexprese EGFR jsou přehledně uvedeny v tabulce 1. Ze všech 76 testovaných karcinomů bylo 30 (tj. 39,5 %) negativních. Imunopozitivitu jevilo celkem 46 (60,5 %) nádorů, přičemž histoskore činilo u 15 z nich (32,6 %) 1+, u 12 (26,1 %) 2+ a u 19 (41,3 %) 3+. Při hodnocení jednotlivých histopatologických jednotek je zřejmé, že u nejčastěji zastoupeného adenoidně cystického a salivárního duktálního karcinomu byla imunoreakce při variabilním histoskore pozitivní v 19 (tj. 65,5 %) a 11 (47,8 %) z celkem 29, resp. 23 případů. U 6 mukoepidermoidních karcinomů jsme zjistili v 5 případech (tj. 83,3 %) histoskore 3+. Pozitivní 1+ až 3+ reakci vykazovaly všechny 4 karcinomy z pleomorfního adenomu. Naproti tomu většina acinocelulárních karcinomů (4/5, tj. 80 %) jevila EGFR negativitu.
Při statistické analýze významu exprese EGFR pro kumulativní přežívání, stratifikované dle jednotlivých modů, jsme zjistili, že největší, avšak nesignifikantní rozdíl (p = 0,073) mezi oběma porovnávanými skupinami byl v modu II (tj. 0, 1+ negativní vs. 2+, 3+ pozitivní). Pro modus I a III byly rozdíly v přežívání menší. Ani pro jeden z modů nebyla prokázána signifikantní korelace mezi rozsahem primárního tumoru (p = 0,901, 0,812 a 1,000 pro modus I, II, resp. III), pozitivitou uzlin (p = 0,749, 0,239 a 0,208 pro modus I, II, resp. III) a expresí EGFR.
DISKUSE
EGFR (receptor epidermálního růstového faktoru, syn. erbB-1, HER1) patří spolu s erbB2, erbB3 a erbB4 do rodiny receptorů epidermálních růstových faktorů s tyrozin-kinázovou aktivitou, jenž hrají důležitou roli v růstu fetálních epiteliálních tkání a postnatálně i v jejich homeostáze. Tento glykoprotein s extra - i intracelulární doménou chrání buňky před apoptózou, stimuluje jejich proliferaci, diferenciaci a migraci, a je rovněž činitelem angiogenetickým. Aktivace EGFR, k níž dochází alteracemi jeho genu lokalizovaného na krátkém raménku chromozomu 7, anebo i jinými mechanismy (zvýšená tvorba růstových a dalších na EGFR se vážících faktorů), tak hraje významnou roli při vzniku a progresi epiteliálních malignit různých lokalit (13, 23). Jak bylo prokázáno, druhý z této rodiny, erbB-2 (syn. HER-2-Neu), je spojen se vznikem salivárního duktálního karcinomu (23), u pleomorfního adenomu se velmi pravděpodobně účastní na jeho maligní konverzi v karcinom (6).
Exprese EGFR je nepříznivou prognostickou známkou u celé řady solidních tumorů. U dlaždicobuněčných karcinomů hlavy a krku je její význam sporný. Zatímco Normanno (21) a Grandis (11) ji spojují se signifikantně nižším disease-free intervalem, podle Maiorana (18) mají EGFR pozitivní karcinomy ústní dutiny lepší prognózu.
Výsledky publikovaných studií, zabývajících se imunohistochemickou expresí EGFR a jejím prognostickým významem u salivárních karcinomů, jsou značně nejednotné.
Udávaná celková exprese EGFR, jež v našem souboru dosáhla 60,5 %, a její pozitivita u jednotlivých histopatologických jednotek salivárních karcinomů kolísá ve velkém rozmezí.
V souboru Sorensenové (28), čítajícím 73 pacientů, bylo 58 (tj. 79 %) EGFR pozitivních. Přitom ani jedna z 10 zde zastoupených histopatologických jednotek nebyla zcela negativní, pozitivita nejčastěji se vyskytujících karcinomů přesahovala 70 %. Exprese EGFR nekorelovala signifikantně s histopatologickým gradingem, klinickým stadiem, výskytem uzlinových metastáz, nebyl prokázán ani její prognostický význam.
Ettl (7) zjistil expresi EGFR u 35 ze 62 (tj. 56,5 %) testovaných salivárních karcinomů. Nejvyšší imunoreakci přitom vykazoval karcinom dlaždicobuněčný, následovaný karcinomem mukoepidermoidním, karcinomem z pleomorfního adenomu a adenoidně cystickým (80 %, 53 %, 46 % a 36 % případů), naproti tomu 91 % karcinomů acinocelulárních a duktálních bylo negativních. U ostatních, početně velmi málo zastoupených jednotek, kolísala imunoreakce od 0 do 66 %. Pro celou testovanou skupinu se exprese jevila jako nezávislý negativní prognostický činitel, nebyl však prokázán žádný vztah k určitému histologickému typu či klinickým parametrům tumorů. Při analýze jednotlivých histopatologických jednotek bylo zjištěno, že exprese EGFR je statisticky nesignifikantním prognostickým faktorem u mukoepidermoidního, ne však u adenoidně cystického a salivárního duktálního karcinomu. K podobnému závěru dospěla Hoyek-Gebeily (12), v jejímž souboru 16 mukoepidermoidních karcinomů byla exprese EGFR, reflektující jejich histopatologický grading, spojená se špatnou prognózou.
V Monteirově sestavě 88 karcinomů slinných žláz, pozůstávající z 13 histopatologických jednotek, vykazovalo imunoreakci 36,4 % případů. Největší, asi 60-70% pozitivita, byla zjištěna u adenokarcinomu jinak nespecifikovaného (NOS), salivárního duktálního (obr. 1), mukoepidermoidního a dlaždicobuněčného karcinomu, naproti tomu u karcinomu acinocelulárního a adenoidně cystického byla reakce jen 10%, ostatní vzácnější jednotky byly negativní. Exprese EGFR signifikantně korelovala s histologickým gradingem, neměla však vliv na prognózu (20). Výraznou imunoreakci u mukoepidermoidního karcinomu vedle dalších prací (1, 14, 24, 28, 29) potvrdila i naše studie, kdy 5 ze 6 testovaných nádorů mělo histoskore 3+. Gibbons (9) zjistil signifikantně významné rozdíly v EGFR expresi mezi tímto typem nádoru a karcinomem adenoidně cystickým, jevícím v jeho souboru minimální pozitivitu. Jeho zkušenosti jsou tak v protikladu se závěrem naší i dalších publikovaných prací, udávajících u adenoidně cystického karcinomu imunoreakci v 65,5 až 85 % případů (1, 28).
Obr. 1. Salivární duktální karcinom. Patrná silná membránová pozitivita imunoreakce EGFR. 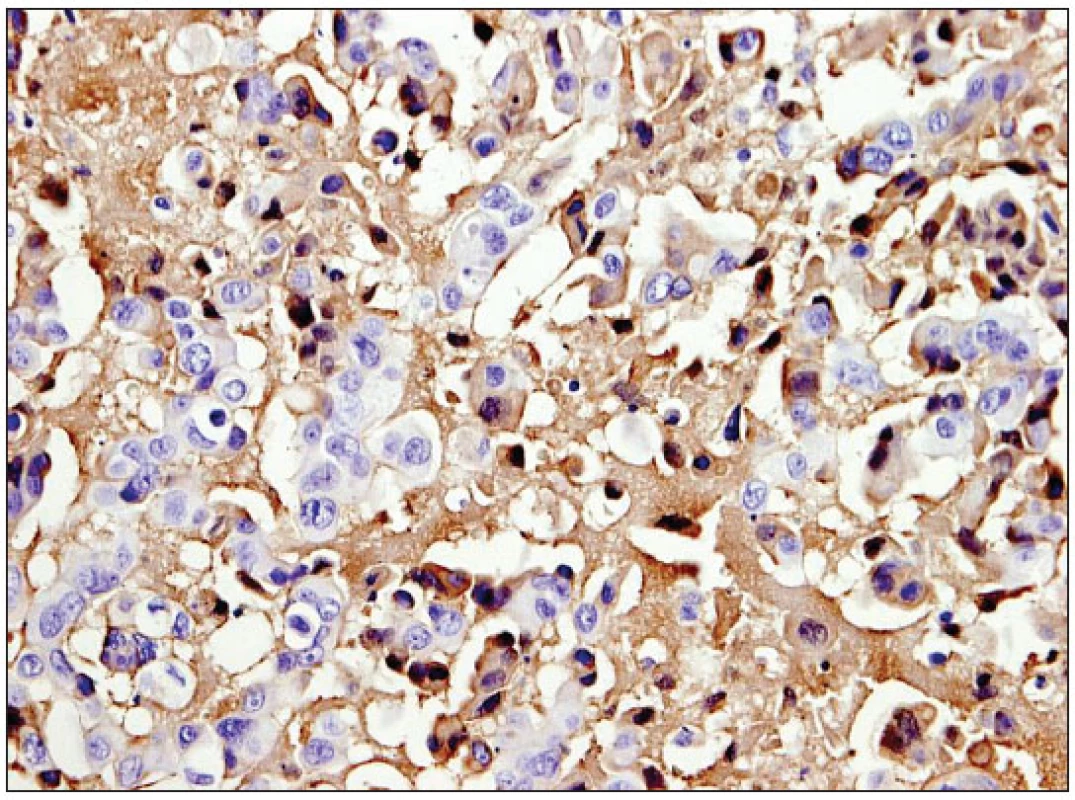
V našem souboru reagovalo pozitivně 47,8 % salivárních duktálních karcinomů (obr. 1), což je v souhlase s údaji Katopodiho (14) a Monteiry (20). Naproti tomu Ettl (7) udává jen asi 10% pozitivitu. V sestavě Williamsové bylo 48 % EGFR reaktivních duktálních karcinomů spojeno s nižším všeobecným přežitím (32). Fan (8) studoval koexpresi EGFR s androgenními receptory a TGFα, kde 11 ze 12 (92 %) karcinomů bylo EGFR pozitivních. Uzavírá, že podobně jako u karcinomu prostaty jsou EGFR a TGFα, jejichž autokrinní aktivace je zprostředkována androgenními receptory, důležité pro vznik této histopatologické jednotky.
V našem souboru všechny 4 případy karcinomu z pleomorfního adenomu, klasifikované jako high-grade, jevily EGFR pozitivitu. Analogické výsledky udávají Matsubayashi (19) a Katori (15), kteří zjistili signifikantní rozdíl v EGFR imunoreakci mezi low - a high grade kancerizovanou složkou tohoto nádoru. Vysoká exprese měla negativní vliv na přežití. Výsledky uvedených prací tak naznačují, že EGFR se (podobně jako c‑erbB-2) účastní maligního zvratu pleomorfního adenomu.
Z našich a z dosud publikovaných zkušeností (7, 20, 28) je zřejmé, že naprostá většina acinocelulárních karcinomů je EGFR negativních. Naproti tomu jsme zjistili 3+ reakci u sekrečního karcinomu (MASC), který však byl zastoupen jen jedním případem. Pokud by další studie potvrdily pravidelnou EGFR pozitivitu u posledně uvedeného histotypu, pak by se exprese tohoto proteinu mohla stát významným markerem v obtížné histopatologické diferenciální diagnóze obou uvedených jednotek.
EGFR exprimují i některé benigní sialomy, imunoreakce zde však v závislosti na jejich histopatologickém typu kolísá mezi 5 – 44 % (33). Ve Wangově (31) sestavě jevilo EGFR pozitivitu všech hodnocených 5 benigních a 13 maligních myoepiteliomů, přičemž mezi oběma skupinami nebylo rozdílu v intenzitě reakce.
Vedle imunohistochemické exprese byly zkoumány i alterace genu pro EGFR. Sequieros-Santiago (25) testoval pomocí PCR jeho amplifikaci v souboru 24 adenoidně cystických karcinomů, z nichž avšak ani jeden tento onkoprotein neexprimoval. Pozitivní nález byl zjištěn v 67 % případů, přičemž amplifikace korelovala s výskytem vzdálených metastáz. Vidal (30) v rámci multicentrické studie, hodnotící klinický efekt léčby Lapatinibem, hodnotila EGFR amplifikaci fluorescenční in situ hybridizací u 20 pacientů s adenoidně cystickými a 20 jinými salivárními karcinomy, u nichž byla v 75, resp. 84 % případů prokázána střední či silná pozitivní imunohistochemická onkoproteinová exprese. Ani v jednom ze 36 nádorů, u nichž se hybridizace zdařila, však nebyla EGFR amplifikace prokázána.
Další studie se zaměřily na genetické změny, spojené s účinností cílené anti-EGFR léčby monoklonální protilátkou (Cetuximab) či tyrozin-kinázovými inhibitory. Dahse (3) sledovala pomocí alelově-specifické PCR na souboru 65 nejčastěji se vyskytujících typů salivárních karcinomů výskyt mutací genu BRAF, jenž je hlavním efektorem KRAS v ose RAS-RAF-MAPK signální dráhy EGFR. Onkogenní bodové mutace BRAF mohou obcházet EGFR signální kaskádu a způsobovat tak její nezávislou aktivaci, navozující neúčinnost cílené blokády EGFR. Ani v jednom z analyzovaných tumorů nebyly přítomny žádné získané mutace, byla naopak prokázána přítomnost divokého typu BRAF a KRAS ve 100, resp. 98,5 % případů. Táž autorka pak v jiné studii (4) hodnotila výskyt EGFR aktivačních mutací v tyrozin-kinázové doméně u adenoidně cystického a mukoepidermoidního karcinomu. Tyto mutace, jež se v závislosti na geografické lokalizaci vyskytují u 10 – 30 % pacientů s nemalobuněčnými karcinomy plic, kde jsou indikátorem jejich citlivosti k tyrozin-kinázovým inhibitorům, však v testovaném souboru 65 karcinomů vykazoval jen jeden nádor z každého uvedeného histotypu. Podobné výsledky udává i Anzicková (2), která v PCR a DNA sekvenační analýze 23 mukoepidermoidních salivárních karcinomů přítomnost aktivačních genových mutací v exonu 19 a 21 ani v jednom případě nemohla potvrdit.
Cílená anti-EGFR terapie u karcinomů slinných žláz dosud nepřináší příliš optimismu. Budiž však řečeno, že byla zatím testována jen jako paliativum u jinak neřešitelných, recidivujících či generalizovaných nádorů. Cetuximab byl podáván 30 pacientům s pokročilými, EGFR výrazně exprimujícími karcinomy, z nichž téměř polovinu tvořily předtím chemoterapeutiky léčené adenoidně cystické karcinomy (17). Ze 22 hodnocených nemocných bylo u 11 dosaženo stabilizace nemoci, u 9 došlo k progresi, dva pacienti po jednom měsíci odmítli další pokračování léčby. De Dosso (5) uvádí objektivní odezvu u jednoho nemocného s adenoidně cystickým karcinomem jícnu, kde vedle cetuximabu byly podávány ještě deriváty platiny.
Rozpačité výsledky přináší zatím i léčba tyrozin-kinázovými inhibitory. Gefitinib byl testován především u adenoidně cystického karcinomu s vysokou EGFR imunopozitivitou. V 53 % případů bylo dosaženo stabilizace nemoci, která se v polovině případů udržela po dobu 16 a více týdnů (10). Podobné výsledky udává Laurie (16) i u dalších, nejčastěji se vyskytujících high-grade salivárních karcinomů. O něco lepších výsledků se dosahuje při jeho kombinaci s klasickými chemoterapeutiky. Agulnik (1) sledoval vliv Lapatinibu (duální, EGFR a erbB2 tyrozin kinázový inhibitor) na většinou EGFR pozitivní, progresivně rostoucí recidivující či metastatické adenoidně cystické a jiné salivární karcinomy. Ani v jedné skupině však nezaznamenal objektivní odpověď, asi u jedné třetiny nemocných s 3+ EGFR imunoreaktivními tumory však došlo k přechodné stabilizaci nádoru.
ZÁVĚR
V konfrontaci s výsledky jiných autorů je zřejmé, že EGFR exprimují nejvíce high-grade karcinom z pleomorfního adenomu, adenokarcinom jinak nespecifikovaný a mukoepidermoidní. U karcinomu acinocelulárního je reaktivita velmi nízká, což se jeví jako potenciální diferenciálně diagnostický znak pro jeho odlišení od podobného sekrečního karcinomu slinných žláz. U adenoidně cystického a salivárního duktálního karcinomu jsme zjistili EGFR pozitivitu asi v polovině případů, literární údaje jsou však značně rozporné. U vzácně se vyskytujících histopatologických jednotek nelze pro malé počty případů činit žádné spolehlivé závěry. Imunohistochemické stanovení exprese EGFR nemělo signifikantní význam pro prognózu, rozsah primárního tumoru ani jeho lymfogenní šíření.
Práce je podpořena grantem č. NS9725-4/2008 IGA MZ ČR.
Prof. MUDr. Ivo Stárek, CSc.
ORL klinika LF UP a FN
I. P. Pavlova 6
775 20 Olomouc
e-mail: stareki@fnol.cz
Zdroje
1. Agulnik, M., Cohen, E. W., Cohen, R. B. et al.: A phase II study of lapatinib in recurrent or metastatic EGFR and/or Erb2 expressing adenoid cystic and non-adenoid cystic malignant tumors of the salivary glands. J. Clin. Oncol., 25, 2007, s. 3987-3984.
2. Anzick, S. L., Chen, W. D., Park, Y. et al.: Unfavourable prognosis of CRTC1-MAML2 positive mucoepidermoid tumors with CDKN2A deletions. Gen. Chrom. Cancer, 49, 2010, s. 59-69.
3. Dahse, R., Driemel, O., Schwarz, S. et al: Epidermal growth factor receptor kinase domain mutations are rare in salivary gland carcinomas. Br. J. Cancer, 100, 2009, s. 623-625.
4. Dahse, R., Kromeyer-Hauschild, K., Berdnt, A. et al.: No indidence of BRAF mutations in salivary gland carcinomas – implications for anti-EGFR therapies. J. Biomed. Biotech. [online], 2009, 501736, [cit. 2011-01-19]. Dostupný z WWW: <10.1155/2009/501736>.
5. De Dosso, S., Mazzucchelli, L., Gheilmini, M. et al.: Response to oxaliplatin with cetuximab in minor salivary gland adenoid cystic carcinoma. Tumori, 95, 2009, s. 378-381.
6. Di Palma, S., Skálová, A., Vaněček, T. et al.: Non-invasive (intracapsular) carcinoma ex pleomorphic adenoma: recognition of focal carcinoma by HER-2/neu and MIB1 immunohistochemistry. Histopathol., 46, 2005, č. 2, s. 144-152.
7. Ettl, T., Schwarz, N., Hartmann, A. et al.: Overexpression of EGFR and absence of C-KIT expression correlate with poor prognosis in salivary gland carcinomas. Histopathol. 53, 2008, č. 5, s. 567-577.
8. Fan, Ch. Y., Melhem, M., Hosal, A. S. et al.: Expression of androgen receptor, epidermal growth factor, and transforming growth factor α in salivary duct carcinoma. Arch. Otolaryngol. Head Neck Surg., 127, 2001, s. 1075-1079.
9. Gibbons, M. D., Manne, U., Carroll, W. R. et al.: Molecular differences in mucoepidermoid carcinoma and adenoid cystic carcinoma of the major salivary glands. Laryngoscope, 111, 2001, s. 1373-1378.
10. Glisson, B. S., Blumenschein, F. M., Erasmus, J. et al.: Phase II trial of gefitinib in patients with incurable salivary gland cancer. Proc. Amer. Soc. Clin. Oncol., 23, 2005, s. 508, abs. 5532.
11. Grandis, J. R., Melhem, M. F., Gooding, W. E. et al.: Levels of TGFα and EGFR protein in head and neck squamous cell carcinoma and patient survival. J. Nat. Cancer Inst., 90, 1998, s. 824-832.
12. Hoyek-Gebeily, J., Nehmé, E., Aftimos, G. et al.: Mucoepidermoid carcinoma of salivary glands: the prognostic value of tumoral markers. Rev. Stomatol. Chir. Maxillofac., 108, 2007, č. 6, s. 482-488.
13. Kari, C., Chan, T. O., Rocha de Quadros, V. et al.: Targeting the epidermal growth factor receptor in cancer: apoptosis takes center stage. Cancer Res., 63, 2003, č. 1, s. 1-5.
14. Katopodi, E., Patsouris, E., Papanikolaou, V. et al.: Immunohistochemical detection of epidermal growth factor and its receptor in salivary gland carcinomas. Oral Surg. Oral Med. Oral Pathol. Oral Radiol. Endod., 95, 2003, s. 266-268.
15. Katori, H., Nozawa, A., Tsukuda, M.: Expression of epidermal growth factor receptor, transforming growth factor-α and Ki-67 in relationship to malignant transformation of pleomorphic adenoma. Acta Oto-Laryngol., 127, 2007, s.1207-1213.
16. Laurie, S. A., Licitra, L.: Systemic therapy in the palliative management of advanced salivary gland cancers. J. Clin. Oncol., 24, 2006, s. 2673-2678.
17. Licitra, L., Locati, L. D., Potepan, P. et al.: Cetuximab (C225) in recurrent and/or metastatic salivary gland carcinomas (RMSGCs): A monoinstitutional phase II study. J. Clin. Oncol., 24, 2006, č. 18S, part 1, s. 291, (abs. No. 5547).
18. Maiorano, E., Favia, G., Maisonnneuve, P. et al.: Prognostic implication of epidermal growth factor receptor immunoreactivity in squamous cell carcinoma of the oral mucosa. J. Pathol., 185, 1998, s. 167-174.
19. Matsubayashi, S., Yoshihara, T.: Carcinoma ex pleomorphic adenoma of the salivary gland: an immunohistochemical study. Eur. Arch. Otorhinolaryngol., 264, 2007, s. 789-785.
20. Monteiro, L. S., Bento, M., Palmeira, C. et al.: Epidermal growth factor receptor immunoexpression evaluation in malignant salivary gland tumours. J. Oral. Pathol. Med., 38, 2009, s. 508-513.
21. Normanno, N., De Luca, A., Bianco, C. et al.: Epidermal growth factor receptor (EGFR) signaling in cancer. Gene, 366, 2006, s. 2-16.
22. Prenen, H., Kimpe, M., Nuyts, S.: Salivary gland carcinomas: molecular abnormalities as potential therapeutic targets. Curr. Opin. Oncol., 20, 2008, s. 270-274.
23. Salomon, D. S., Brandt, R., Ciardiello, F. et al.: Epidermal growth factor-related peptides and their receptors in human malignancies. Crit. Rev. Oncol. Hematol., 19, 1995, s. 183-232.
24. Shang, J., Shui, Y., Sheng, L. et al: Epidermal growth factor receptor and human epidermal growth receptor 2 expression in parotid mucoepidermoid carcinoma: possible implications for target therapy. Oncol. Rep., 19, 2008, s. 435-440.
25. Sequieros-Santiago, G., Garcia-Carracedo, D., Fresno, M. F. et al.: Oncogene amplification pattern in adenoid cystic carcinoma of the salivary glands. Oncol. Reports, 21, 2009, č. 5, s. 1215-1222.
26. Skálová, A., Stárek, I., Vaněček, T. et al.: Expression of HER2/neu gene and protein in salivary duct carcinomas of parotid gland as revealed by fluoresence in situ hybridisation immunohistochemistry. Histopathol., 42, 2003, č. 4, s. 348-356.
27. Skálová, A., Vaněček, T., Šíma, R. et al.: Mammary analogue secretory carcinoma of salivary glands, containing the ETV6-NTRK3 fusion gene: a hitherto undescribed salivary gland tumor entity. Amer. J. Surg. Pathol., 34, 2010, s. 599-608.
28. Sorensen, K. B., Godballe, C., de Stricker, K. et al.: Parotid carcinoma: expression of kit protein and epidermal growth factor receptor. J. Oral Pathol. Med., 35, 2006, s. 286-291.
29. Vered, M., Braunstein, E., Buchner, A.: Immunohistochemical study of epidermal growth factor receptor in adenoid cystic carcinoma of salivary gland origin. Head Neck, 24, 2002, s. 632-636.
30. Vidal, L., Tsao, M. S., Pond, G. R. et al.: Fluorescence in situ hybridization gene amplification analysis of EGFR and HER2 in patients with malignant salivary gland tumors treated with lapatinib. Head Neck, 31, 2009, s. 1006-1012.
31. Wang, L., Gao, Y., Yang, L.: Significance of expression of epidermal growth factor receptor, transforming growth factor beta, c-erbB-2 oncogene in myoepithelioma of salivary gland. Chung-Hua Kou Chiang Hsueh Tsa Chih Chinese J. Stomatol., 34, 1999, č. 2, s. 100-102.
32. Williams, M. D., Robert, D., Blumenschein, G. R. et al.: Differential expression of hormonal and growth factor receptors in salivary duct carcinomas. Amer. J. Surg. Pathol., 31, 2007, s. 1645-1652.
33. Yamada, K., Iwai, K., Okada, Y. et al.: Immunohistochemical expression of epidermal growth factor receptor in salivary gland tumours. Virchows Arch. A Pathol. Anat. Histopathol., 415, 1989, s. 523-531.
Štítky
Audiologie a foniatrie Dětská otorinolaryngologie Otorinolaryngologie
Článek Branchio–oto–renální syndrom
Článek vyšel v časopiseOtorinolaryngologie a foniatrie
Nejčtenější tento týden
2011 Číslo 2- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Fexofenadin – nesedativní a imunomodulační antihistaminikum v léčbě alergických projevů
- Isoprinosine nově bez indikačních a preskripčních omezení
- Lokální antiseptická terapie faryngitidy – účinnost oktenidinu a zachování integrity střevní mikrobioty
- Benzydamin v léčbě zánětů v dutině ústní
-
Všechny články tohoto čísla
- Pendredův syndrom v České republice
- Mezioborové sympozium „Komplexní vyšetření horních a dolních dýchacích cest v ambulantní i klinické praxi“
- Workshop – Mikrochirurgie hrtanu
- Extraezofageální refluxní choroba - mezioborový konsenzus
- Extraezofageální reflux: porovnání základních diagnostických metod (Reflux symptom index, Reflux finding score, diagnosticko - terapeutický test, pH-metrie)
- Imunohistochemická exprese onkoproteinu EGFR a její prognostický význam u karcinomů slinných žláz
- Změna komunikace je u pacientů s trvalou tracheostomií největším hendikepem
-
Nádorová trombóza v. jugularis interna
Kazuistika a přehled jejích epidemiologických, patogenetických a klinických aspektů - Mnohočetný neurofibrom hrtanu
- Branchio–oto–renální syndrom
- Otorinolaryngologie a foniatrie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Změna komunikace je u pacientů s trvalou tracheostomií největším hendikepem
- Extraezofageální refluxní choroba - mezioborový konsenzus
- Pendredův syndrom v České republice
-
Nádorová trombóza v. jugularis interna
Kazuistika a přehled jejích epidemiologických, patogenetických a klinických aspektů
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



