-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Somatostatinová receptorová scintigrafie 99mTc-EDDA/HYNIC-TOC první klinické zkušenosti v České republice
Somatostatin receptor scintigraphy - 99mTc-EDDA/HYNIC-TOC first clinical experience in the Czech Republic
Introduction:
The aim of this article is to introduce the somatostatin analog EDDA/HYNIC-TOC labeled with 99mTechnetium available in Czech Republic since 2011. This radiopharmaceutical has been used for scintigraphic localisation of tumors bearing somatostatin receptors.Material and methods:
We evaluated 18 patients in our department from September 2011. There were 3 pts with medullary thyroid cancer, 12 pts with neuroendocrine tumor (NET) or carcinoid, 2 pts with suspected carcinoid and 1 pt due to endocrine orbitopathy. Imaging consists of whole-body scan and SPECT/CT performed 4 hours post injection of 700 MBq of Tektrotyd. We add an abdominal SPECT 1 to 2 hours post injection.Results:
Positive findings were detected in 6 pts. It was in agreement to other diagnostic methods. We detected accumulation in the suprarenal glands in 10 pts. This was not interpreted as a pathology, we believe this detection is thanks to a better resolution and an improved image quality. 12 pts were negative.Conclusion:
99mTc EDDA/HYNIC-TOC (Tektrotyd) could be a good alternative to 111In-DTPA-D-Phe1-octreotide (Octreoscan) in evaluating patients with tumors bearing somatostatin receptors. Better availability, lower radiation and improved image quality are the advantage. Early tomographic imaging of abdomen should be done to avoid false positive findings due to nonspecific tracer accumulation.Key Words:
neuroendocrine tumors, receptor scintigraphy, somatostatin
Autoři: Kateřina Táborská
Působiště autorů: Klinika nukleární medicíny a endokrinologie 2. LF UK a FN Motol
Vyšlo v časopise: NuklMed 2012;1:7-12
Kategorie: Původní práce
Souhrn
Úvod:
Cílem článku je představení analogu somatostatinu EDDA/HYNIC-TOC značeného 99mTechneciem (Tektrotyd), který je v České republice dostupný od roku 2011. Radiofarmakum se používá k scintigrafické lokalizaci nádorů se somatostatinovými receptory.Materiál a metoda:
Na Klinice nukleární medicíny a endokrinologie v Motole jsme od září 2011 dosud vyšetřili 18 pacientů. Jednalo se o 3 pacienty s medulárním karcinomem štítné žlázy (MTC), 12 pacientů s neuroendokrinním tumorem (NET) nebo karcinoidem, 2 pacienty s podezřením na přítomnost karcinoidu a 1 pacient byl indikován pro endokrinní orbitopatii. Protokol vyšetření zahrnuje celotělové snímání a tomografickou akvizici za 4 hodiny po aplikaci 700 MBq Tektrotydu. Za 1-2 hodiny po aplikaci doplňujeme SPECT břicha.Výsledky:
Patologický nález jsme pozorovali u 6 pacientů. U všech pacientů byl nález ve shodě s jinými vyšetřovacími metodami. Zobrazení nadledvin jsme pozorovali u 10 vyšetřených. Nález nebyl interpretován jako patologie, vysvětlujeme si ho dosahovaným vyšším rozlišením a zlepšenou kvalitou obrazů. U 12 pacientů bylo vyšetření negativní.Závěr:
99mTc EDDA/HYNIC-TOC (Tektrotyd) může být alternativou k užití 111In-DTPA-D-Phe1-octreotidu (Octreoscan) při vyšetřování nemocných s tumory exprimujícími somatostatinové receptory. Výhodou je větší dostupnost radiofarmaka, nižší radiační zátěž a vyšší kvalita zobrazení. K vyloučení falešně pozitivních nálezů v dutině břišní vzhledem k hepatobiliární exkreci je užitečné provádět dvě tomografická vyšetření břicha, přičemž první by mělo být provedeno mezi 1. a 2. hodinou po aplikaci.Klíčová slova:
neuroendokrinní tumory, receptorová scintigrafie, somatostatinÚvod
Neuroendokrinní tumory (NET) vznikají ze zvláštní populace buněk, které jsou disperzně rozloženy v celé řadě orgánů a tkání. Zlatým standardem funkčního zobrazení neuroendokrinních tumorů byla od roku 1989 scintigrafie pomocí 111In-DTPA-D-Phe1-octreotidu (Octreoscan, 111In-OCT) s predominantní vazebnou afinitou k receptorům subtypu 2, méně 5 a 3 1,2. Od roku 2011 je v České republice dostupný také 99mTc-EDDA/HYNIC-TOC (Tektrotyd, 99mTc-TOC), zatím jako neregistrovaný léčivý přípravek. Cílem našeho sdělení je informovat o prvních zkušenostech našeho pracoviště s tímto novým radiofarmakem.
Materiál a metoda
Na Klinice nukleární medicíny a endokrinologie v Motole jsme od září 2011 dosud vyšetřili 18 pacientů. Jednalo se o 3 pacienty s medulárním karcinomem štítné žlázy (MTC) po totální tyreoidektomii se zvýšenou hladinou kalcitoninu, 12 pacientů s histologicky nebo laboratorně prokázaným NET nebo karcinoidem, kteří byli indikováni k vyšetření v rámci předoperačního stagingu nebo v rámci sledování po operaci, dále 2 pacienti s podezřením na přítomnost karcinoidu pro elevaci kyseliny hydroxyindoloctové (HIAA). 1 pacient byl indikován pro endokrinní orbitopatii před zvažovanou léčbou analogy somatostatinu.
Při přípravě pacienta na vyšetření jsme doporučili den před vyšetřením příjem lehké stravy. V den vyšetření byli pacienti nalačno až do skončení první akvizice. Pokud pacient užíval analogy somatostatinu, vysadili jsme je 3 dny u krátkodobě působících (sandostatin) a 4-6 týdnů u dlouhodobě působících (somatulin). K snížení radiační zátěže jsme doporučili zvýšenou hydrataci v den aplikace radiofarmaka. Radiofarmakum jsme aplikovali o aktivitě 700 MBq. Vedlejší účinky po aplikaci se u našich pacientů nevyskytly. Vyšetření byla prováděna na gamakameře Symbia S a hybridní SPECT/CT kameře Symbia T firmy Siemens. Mezi 1. a 2. hodinou jsme zaznamenali statický planární snímek a tomografii břicha, celotělové vyšetření jsme snímali za 4 hodiny po aplikaci a doplnili jsme další tomografie (SPECT/CT) v rozsahu od baze lební po inquiny. Pro planární pětiminutové statické obrazy jsme použili matici 128x128, pro celotělové snímání matici 256x1024. Při tomografii jsme použili matici 128x128 s nastavením akvizičních parametrů na 128 projekcí, s trváním jedné projekce 15 sekund, detektory se pohybovaly po necirkulární orbitě. Data jsme rekonstruovali iterativně s korekcí na absorpci záření.
Výsledky
Fokální akumulaci radiofarmaka mimo oblasti s fyziologickým uptakem jsme považovali za abnormální a pozorovali jsme ji u 5 pacientů z 18 vyšetřených. U všech pacientů byl nález ve shodě s jinými vyšetřovacími metodami – 1 x karcinoid žaludku s verifikací biopsií, 1 x malobuněčný plicní tumor s verifikací biopsií, 3 nemocní s metastázami karcinoidu, s předchozím pozitivním průkazem ložisek pomocí 111In-OCT, u jednoho z nich byla nalezena další ložiska v plicích pomocí 99mTc-TOC, odstup mezi oběma vyšetřeními ale činil 6 měsíců (Obr.1, Obr. 2). Fokální záchyt radiofarmaka ve tkáni s fyziologickým uptakem (štítná žláza) jsme zjistili u 1 pacientky, i tento nález byl považován za pozitivní. Cytologicky byl nález suspektní z přítomnosti papilárního karcinomu a pacientka byla indikována k provedení totální tyreoidektomie. Zobrazení nadledvin jsme v našem souboru pozorovali u 10 vyšetřených. U 12 pacientů bylo vyšetření negativní, u 4 z nich bylo vyšetření indikováno pro elevaci biochemických hodnot (3 x kalcitonin u pacientů s MTC, 1 x HIAA u pacientky vyšetřované pro křečovité bolesti břicha), ostatní byli vyšetřováni v rámci stagingu bez podezření na recidivu a 1 pacient z neonkologické indikace. Všichni pacienti jsou nadále klinicky sledováni.
Obr. 1. Pacient s karcinoidem tenkého střeva, primární tumor označen šipkou. Pro srovnání zobrazeno celotělové vyšetření <sup>99m</sup>Tc-Tektrotyd (vlevo) a <sup>111</sup>In-Octreoscan (vpravo). Anatomická lokalizace ložisek zobrazena na obrázku 2. 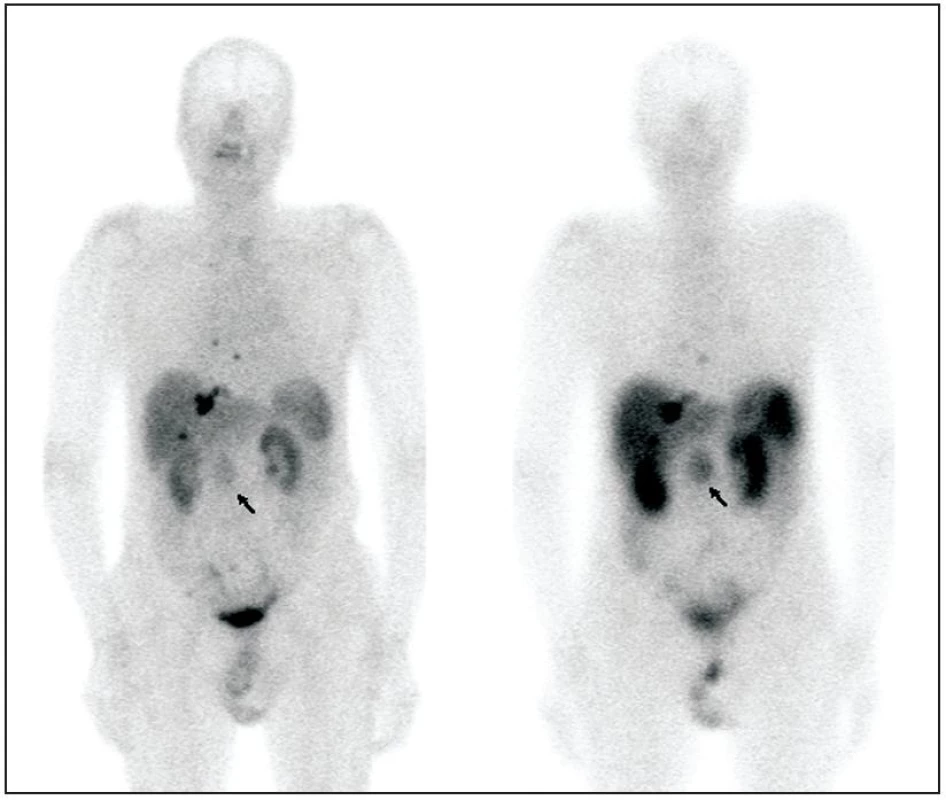
Obr. 2. Na tomografických řezech viditelný primární tumor v kličce tenkého střeva (vlevo nahoře), ložisko v levé plíci (vpravo nahoře), ve sternu (vlevo dole) a v uzlině před játry (vpravo dole). 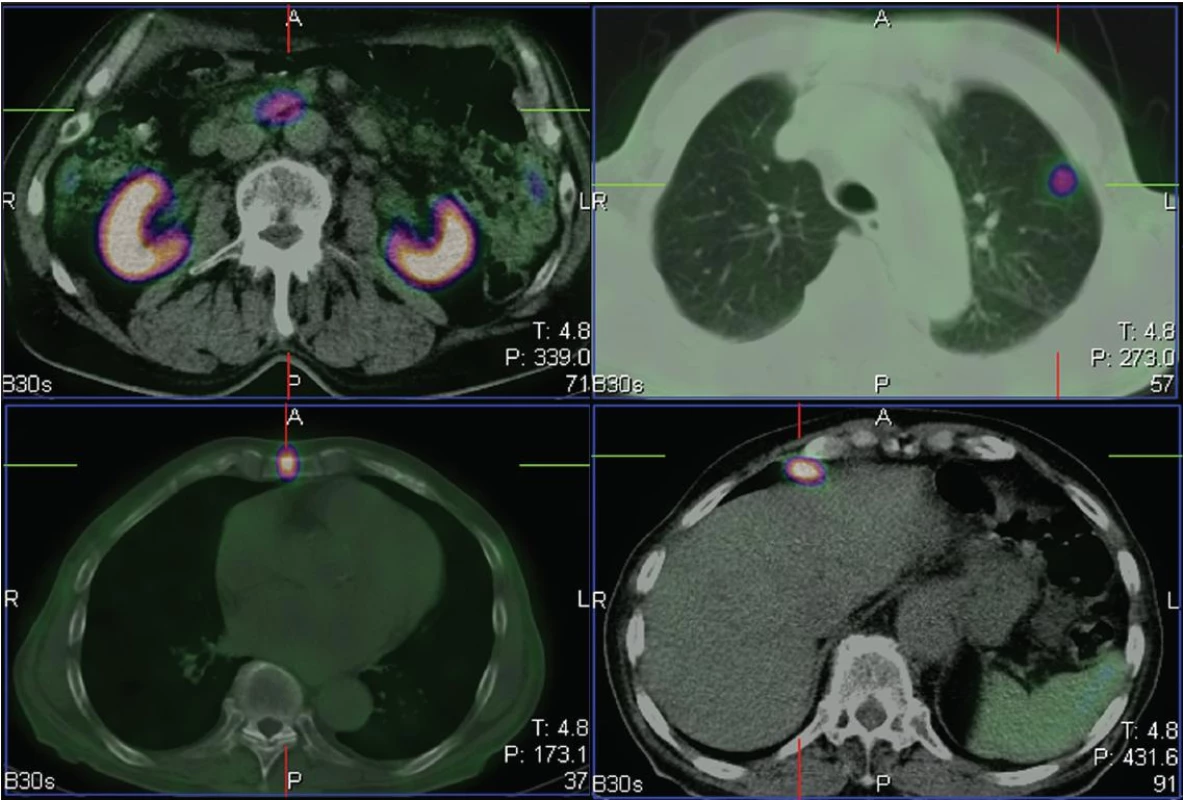
Diskuse
Nádorové buňky NET si zachovávají specifické funkční vlastnosti neuroendokrinních buněk, díky nimž je lze identifikovat. Kromě schopnosti secernovat různé látky a hormony k nim patří zvýšená exprese somatostatinových receptorů v buněčné membráně. Tyto receptory mohou být efektivně zobrazeny, pokud se na ně naváže vhodné radiofarmakum. Komplex receptor – radiofarmakum je internalisován buňkou a je akumulován ve vyšší koncentraci v nádorové buňce v porovnání s okolními tkáněmi. Vysílané gama záření je detekováno scintilačním krystalem ve skenerech typu SPECT-PET/CT, a proto se toto vyšetření nazývá somatostatinová receptorová scintigrafie (Obr. 3). Je známo pět subtypů somatostatinových receptorů (sstr 1 - sstr 5, sstr 2A, 2B), jejich incidence v NET je odlišná (Tab. 1). Somatostatin se váže na všechny subtypy, pro krátký biologický poločas (1-2 minuty) nemůže být při scintigrafii využit. Proto byly připraveny syntetické analogy somatostatinu, které dosahují vyšší stability, liší se ale vazebnou afinitou k jednotlivým subtypům receptorů. Senzitivita vyšetření pomocí 111In-OCT je dle literárních údajů vysoká (85-95 %) pro detekci karcinoidu a gastroenteropankreatických neuroendokrinních tumorů (GEP-NET), dříve uváděných jako glukagonom, vipom, gastrinom, nižší pro insulinom (25-60 %) kvůli nízké incidenci somatostatinových receptorů subtypu 2. Senzitivita vyšetření klesá s nižší velikostí ložisek, u tumorů menších než 2 cm činila senzitiva 35 % 3. Známou nevýhodou vyšetření je vysoká energie záření gama, kterou izotop 111In emituje při radioaktivní přeměně, z které se odvíjí suboptimální kvalita zobrazení a vyšší radiační zátěž pro pacienta i jeho okolí (při aplikaci 110 MBq je to 13 mSv, při aplikaci 220 MBq, která je nutná pro SPECT zobrazení, je to 26 mSv). Proto byla snaha připravit analogy somatostatinu, které by mohly být značeny jinými izotopy, pro gamakamery optimálně techneciem (99mTc). V roce 2000 představil Decristoforo nové radiofarmakum EDDA/HYNIC-TOC značené 99mTc, s vazebnou afinitou k somatostatinovým receptorům subtypu 2, méně 5 a 3. Prokázal, že biodstribuce a kinetika byla obdobná jako u 111In-OCT, radiofarmakum vykazovalo uptake v tumoru již za 15 minut po podání, za 4 hodiny bylo dosaženo nejvyššího poměru mezi ložiskem a tělním pozadím a uptake v tumoru přetrvával ještě za 20 hodin 4.
Obr. 3. Schematicky zobrazen princip somatostatinové receptorové scintigrafie. Analog somatostatinu (AS) označený radionuklidem je vázán na membránový receptor, internalizován a vnášen do buňky. Upraveno podle E. Van Cutsema <sup>9</sup>. 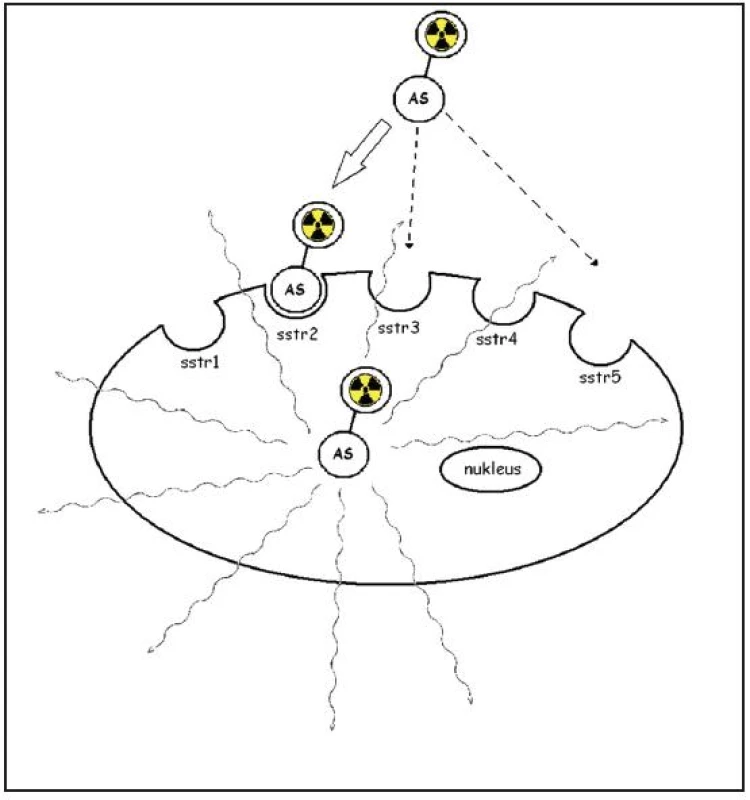
Tab. 1. Exprese somatostatinových receptorů u neuroendokrinních tumorů <sup>7</sup>. 
Další možností značení analogů somatostatinu je použití 68gallia (Ga) a jeho detekce pomocí pozitronové emisní tomografie. 68Ga je dceřiný prvek získaný z generátoru 68Ge/68Ga. 68Germanium (Ge) má dlouhý poločas přeměny 270 dnů, 68Ga 68 minut. Aplikace těchto vyšetření je limitována na PET centra a v České republice jsou zatím nedostupná.
Somatostatinová receptorová scintigrafie s 99mTc-TOC je stejně jako 111In-OCT metodou první volby pro funkční zobrazení karcinoidu a gastroenteropankreatických neuroendokrinních nádorů jak v rámci pátrání po primárním tumoru, tak poskytuje informaci o přítomnosti metastáz. Průkaz vazby na receptory zároveň slouží k ověření účinnosti léčby analogy somatostatinu. Gabriel a kol. stanovil senzitivitu 99mTc-TOC a 111In-OCT ve skupině 41 nemocných s histologicky prokázaným nebo biologicky a klinicky suspektním NET na 75 % pro 99mTc-TOC a 58 % pro 111In-OCT. U 32 pacientů byl nález shodný (78 %), u 9 odlišný (22 %). 6 falešně negativních výsledků (14,6 %) bylo registrováno při vyšetření pomocí 111In-OCT. Dva falešně pozitivní výsledky byly zaznamenány při vyšetření pomocí 99mTc-TOC a byly způsobeny nespecifickým uptakem ve střevech. K vyloučení falešně pozitivních nálezů v dutině břišní proto autoři navrhli rozšířit protokol vyšetření o snímání břicha již mezi 1. a 2. hodinou po aplikaci, neboť uptake radiofarmaka v tumoru je rychlý a umožňuje jeho časné zobrazení 5. Tento postup se osvědčil i na našem pracovišti. Mezi 1. a 2. hodinou provádíme statický snímek a tomografii břicha, další tomografické vyšetření je opakováno po 4-6 hodinách. Jen ložiska zobrazená v časné fázi beze změny lokalizace v čase jsme považovali za pozitivní (Obr. 4). Navíc u všech 18 pacientů byla po 4 hodinách od aplikace dutina břišní hůře přehledná pro přítomné vyloučené radiofarmakum v gastrointestinální oblasti.
Obr. 4. Snímky MIP (maximum intensity projection) u pacienta s karcinoidem tenkého střeva z obrázku 1. Pruhovitý nespecifický uptake radiofarmaka (NU) je zobrazen na snímku (a) získaném za 1 hodinu po aplikaci, na snímku za 4 hodiny (b) již není přítomný. Ložiska 1, 2, 3 nemění v čase svou lokalizaci, je patrný vzestup intenzity a lepší kontrast k tělnímu pozadí na snímku (b). 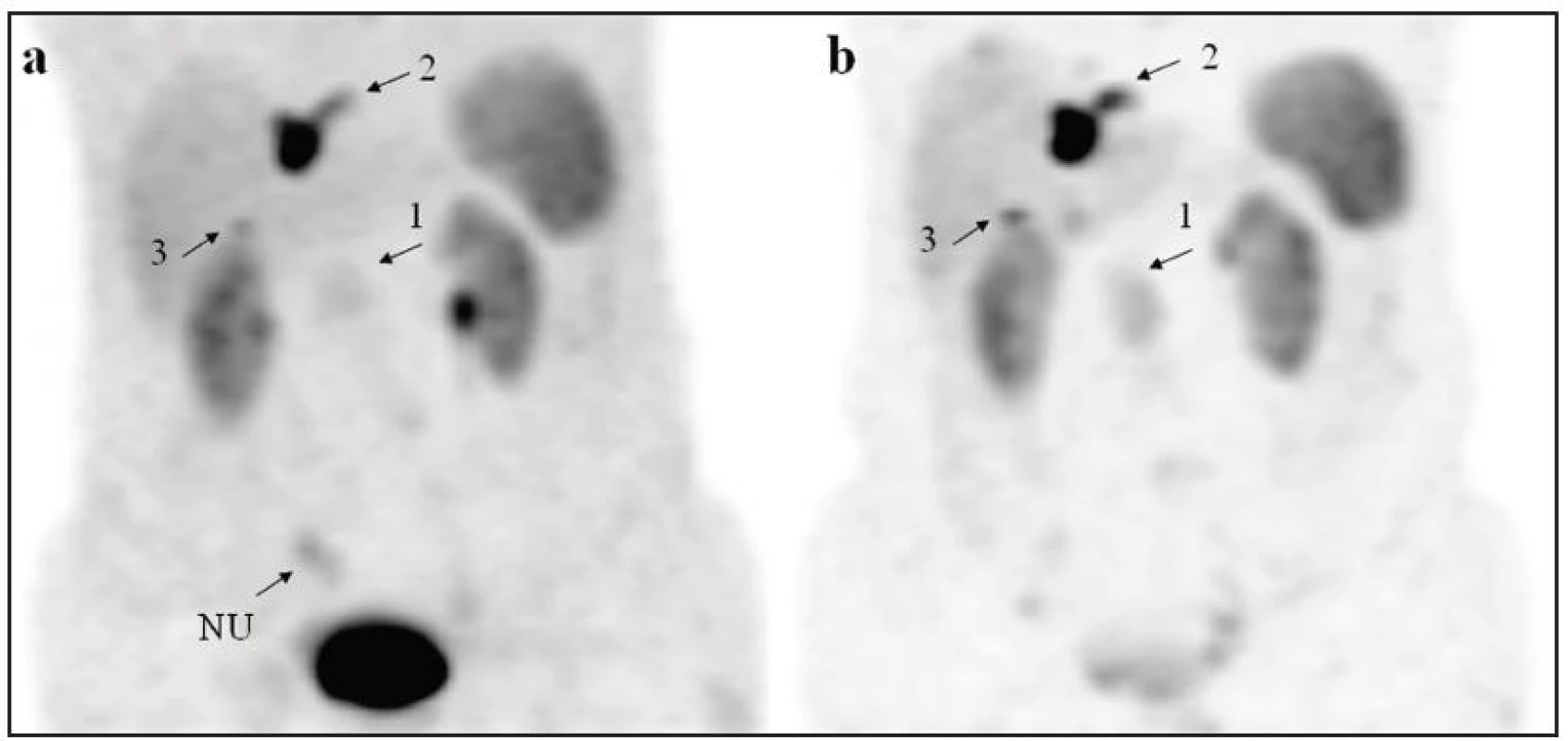
Vyšetření může být dále indikováno u pacientů s podezřením na přítomnost adenomů hypofýzy, především hormonálně aktivních, k průkazu metastáz medulárního karcinomu štítné žlázy, feochromocytomu, paragangliomu, neuroblastomu. Další nádory, které exprimují somatostatinové receptory, jsou karcinomy prsu, prostaty, plic, maligní melanomy, lymfomy, sarkomy, světlobuněčné karcinomy ledvin, diferencované karcinomy štítné žlázy, astrocytomy, meningeomy (Tab. 2). Kontraindikací vyšetření je gravidita, relativní kontraindikací laktace. Aplikovaná aktivita se pohybuje v rozmezí 370-925 MBq, obvykle je podáno 700 MBq, což jsme použili i v naší studii. Efektivní dávka po podání 700 MBq činí přibližně 4 mSv. Po aplikaci si může vzácně pacient stěžovat na bolesti hlavy nebo břicha. Tyto vedlejší účinky jsme u našich pacientů nepozorovali.
Tab. 2. Přehled onemocnění, která mohou být zobrazena pomocí somatostatinové receptorové scintigrafie <sup>8</sup>. 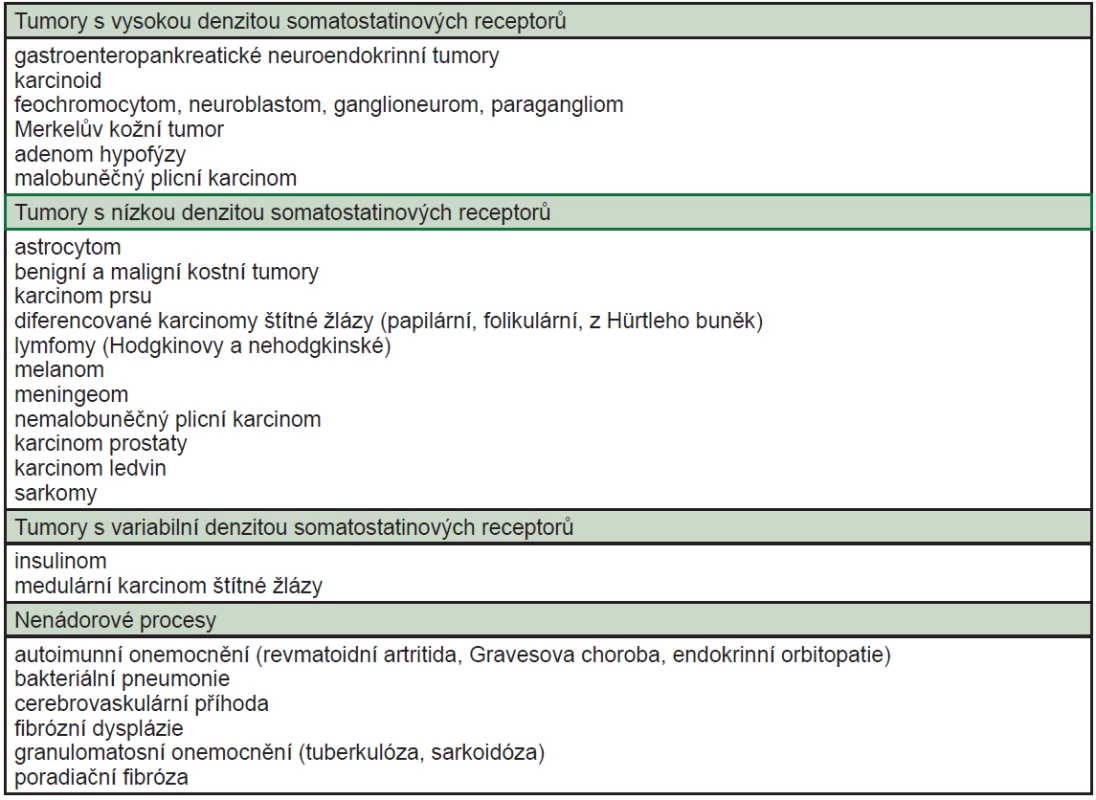
K fyziologickému nálezu patří zobrazení jater, sleziny a ledvin a vyloučené radiofarmakum ve žlučníku, v kličkách střevních a v močovém měchýři. Na tomografických řezech může být patrná mírná akumulace radiofarmaka v hypofýze a nadledvinách. V literatuře se zobrazení nadledvin dosud neuvádělo, ačkoliv patří k orgánům exprimujícím somatostatinové receptory 6. S vizualizací predilekčně levé nadledviny jsme se v našem souboru setkali u 10 vyšetřených, u žádného z nich vyšetření nebylo indikováno pro podezření na feochromocytom a nebyl přítomen abnormální morfologický nález v této oblasti (Obr. 5). Tento jev si vysvětlujeme dosahovaným vyšším rozlišením a zlepšenou kvalitou obrazů. Zobrazení štítné žlázy je preferenčně způsobeno specifickou vazbou na somatostatinové receptory spíše než přítomností volného 99mTc. V takovém případu jsme pak pozorovali mírnou difuzní akumulaci ještě navíc v žaludku, ve slinných a slzných žlázách. Fokální záchyt radiofarmaka ve štítné žláze u jedné pacientky byl verifikován histologicky po provedení totální tyreoidektomie, kdy bylo prokázáno ložisko 5 mm odpovídající mikrokarcinomu štítné žlázy.
Obr. 5. Šipkami označeny nadledviny na transverzálním a koronárním tomografickém řezu. 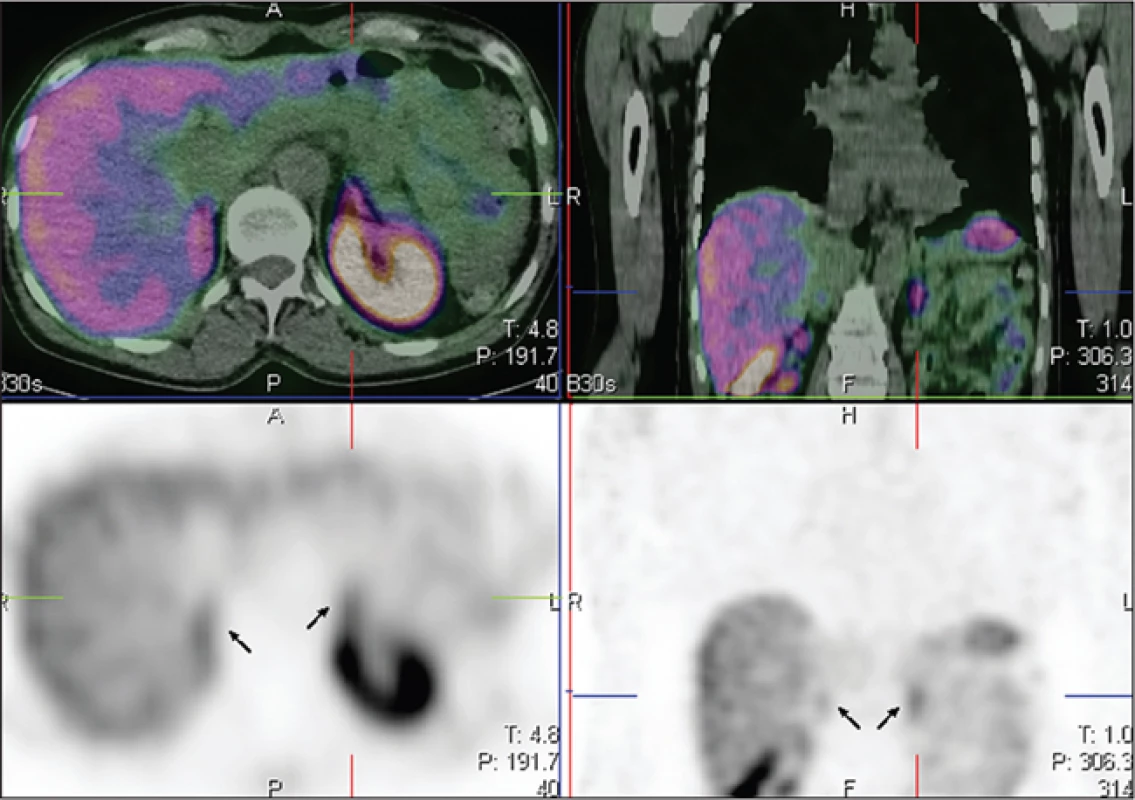
Závěr
99mTc-TOC může být alternativou k užití 111In-OCT při vyšetřování nemocných s tumory exprimujícími somatostatinové receptory. Výhodou je větší dostupnost radiofarmaka, nižší radiační zátěž a vyšší kvalita zobrazení. Větší komfort pro vyšetřované přináší zkrácení akvizičního protokolu na jeden den. K vyloučení falešně pozitivních nálezů v dutině břišní vzhledem k hepatobiliární exkreci je užitečné provádět dvě tomografická vyšetření břicha, přičemž první by mělo být provedeno mezi 1. a 2. hodinou po aplikaci. K posouzení prospěšnosti 99mTc-TOC vyšetření je třeba provést více vyšetření u odlišných tumorů s vysokou denzitou somatostatinových receptorů a získat více klinických dat.
Kateřina Táborská
Klinika nukleární medicíny a
endokrinologie 2. LF UK a FN Motol
katerina.taborska@fnmotol.cz
Zdroje
1. Krenning EP, Bakker WH, Kooij PPM et al. Somatostatin receptor scintigraphy with 111In-DTPA-D-PHE-1 - octreotide in man: metabolism, dosimetry and comparison with [123I-Tyr-3-]-octreotide. J Nucl Med 1992;33 : 652-658
2. Krenning EP, Kwekkeboom DJ, Akker WH et al. Somatostatin receptor scintigraphy with [111In-DTPA-D-Phe1] - and [1231-Tyr3]-octreotide: the Rotterdam experience with more than 1000 patients. Eur J Nucl Med 1993;20 : 716-731
3. Zimmer T, Ziegler K, Bader M et al. Localization of neuroendocrine tumours of the upper gastrointestinal tract. Gut 1994;35 : 471–475
4. Decristoforo C, Mather SJ, Cholewinski W et al. 99mTc-EDDA/HYNIC-TOC: a new 99mTc-labelled radiopharmaceutical for imaging somatostatin receptor-positive tumours: first clinical results and intra-patient comparison with 111In-labelled octreotide derivatives. Eur J Nucl Med. 2000;27 : 1318–1325
5. Gabriel M, Decristoforo C, Donnemiller E et al. An intrapatient comparison of 99mTc-EDTTA/HYNIC-TOC with 111In-DTPA-octreotide for diagnosis of somatostatin receptor-expressing tumors. J Nucl Med 2003;44 : 708-716
6. Reubi JC, Kvols L, Krenning EP et al. Distribution of somatostatin receptor in normal and tumour tissue. Metabolism 1990;30 (suppl 2):78–81
7. De Herder W, Hofland LJ, van der Lely AJ, Lamberts SWJ. Somatostatin receptors in gastroenteropancreatic neuroendocrine tumours. Endocrine-Related Cancer 2003;10 : 451–458
8. The SNM practice guideline Somatostatin Receptor Scintigraphy Version 2.0 [online]. 2011. [cit. 2012-01-16]. Dostupné na: http://interactive.snm.org/index.cfm?PageID=772
9. Van Cutsem E, Verslype CH. Emerging therapies for neuro - endocrine tumors. Annals of Oncology 2008;19:(Suplement 8)
Štítky
Nukleární medicína Radiodiagnostika Radioterapie
Článek vyšel v časopiseNukleární medicína
Nejčtenější tento týden
2012 Číslo 1- Biochemoterapie agresivního karcinomu rekta – kazuistika z českého prostředí
- MDT Board: unikátní projekt pro lékaře pečující o pacienty s onemocněním plic a dalšími patologiemi v oblasti hrudníku
- Idiopatická plicní fibróza a refluxní choroba: silný vztah plný nejasností
- Konverzní léčba hraničně resekabilních jaterních metastáz kombinací mFOLFOX6 + panitumumab – kazuistika
- Časná regrese nádoru jako marker celkového přežití v 1. linii léčby mCRC
Nejčtenější v tomto čísle- Somatostatinová receptorová scintigrafie 99mTc-EDDA/HYNIC-TOC první klinické zkušenosti v České republice
- Neuroendokrinní tumory
- Zátěžové testy v nukleární kardiologii
- Kvalita prováděných zátěžových testů u perfuzní scintigrafie myokardu
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



