-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Fixní kombinace antidiabetik
Fixed-dose combinations of antidiabetic drugs
Current guidelines from ADA (American Diabetes Association) and EASD (European Association for the Study of Diabetes) for the treatment of type 2 diabetes, underline individualisation of treatment, early start of combination therapy to hit more pathophysiological pathways, and consistent treatment of comorbidities. The fixed combinations of antidiabetic drugs provide good means to achieving these goals without increasing the number of tablets. This article presents an overview of the currently available fixed combinations of antidiabetic drugs, their importance in the treatment of type 2 diabetes, and considers the importance and the possibilities of influencing patients' adherence to treatment.
Keywords:
type 2 diabetes mellitus – combination therapy – fixed-dose combination – adherence to the treatment
Autoři: M. Paclíková; A. Šmahelová
Působiště autorů: Diabetologické centrum, III. interní geronto-metabolická klinika LF UK a FN Hradec Králové
Vyšlo v časopise: Kardiol Rev Int Med 2016, 18(2): 104-108
Souhrn
Dle současných doporučení ADA (American Diabetes Association) a ( EASD ( European Association for the Study of Diabetes) je v léčbě diabetes mellitus 2. typu zdůrazněna individualizace léčby, včasné zahájení kombinační terapie k zasažení více patofyziologických cest a důsledná léčba komorbidit. Fixní kombinace antidiabetik jsou vhodným prostředkem k dosažení těchto cílů bez navýšení počtu užívaných tablet. Článek prezentuje přehled dostupných fixních kombinací antidiabetik, jejich význam v léčbě diabetes mellitus 2. typu a zamýšlí se nad významem a možnostmi ovlivnění adherence pacienta k léčbě.
Klíčová slova:
diabetes mellitus 2. typu – kombinační léčba – fixní kombinace – adherence k léčběÚvod
Diabetes mellitus 2. typu (DM2) je nejčastější metabolické onemocnění s celosvětově narůstající incidencí, která bez nadsázky opravňuje hovořit o pandemii diabetu. Tento trend potvrzují i epidemiologická data International Diabetes Federation (IDF) z roku 2015, která odhadují celosvětový nárůst počtu diabetiků až na 415 milionů dospělých osob [1]. Podle údajů Ústavu zdravotnických informací a statistiky ČR (ÚZIS) je v ČR k roku 2013 hlášeno 861 650 diabetiků z toho 788 350 (91,5 %) jako diabetici 2. typu [2]. S vývojem nových antidiabetik zaznamenala léčba DM2 v posledních letech významných změn. Současná aktuální doporučení ADA a EASD (American Diabetic Association a European Association for the Study of Diabetes) zdůrazňují individualizaci léčby a léčebných cílů se zaměřením na snížení nežádoucích rizik, zejména hypoglykemie.
DM2 je progresivní onemocnění a léčba zaměřená pouze na jeden patofyziologický cíl nemusí vést k adekvátní kontrole glykemie. V důsledku toho je často nezbytná kombinační léčba. Porozumění patofyziologickým mechanizmům hyperglykemie a farmakologickému účinku široké škály antidiabetik umožňuje správně a efektivně vedenou léčbu DM2. Kombinační léčba může být užívána v podobě jednotlivých účinných agens nebo ve formě fixních kombinací.
Aktuální doporučení pro léčbu DM2
Dle současných doporučení je zdůrazňována léčba DM2 individualizovaná na pacienta. Její součástí je nejen ovlivnění patofyziologických cest hyperglykemie, ale rovněž léčba ostatních komorbidit, zejména hypertenze, dyslipidemie a obezity. U osob s krátkou dobou trvání diabetu a bez závažných komorbidit jsme v léčbě důslední, s cílem glykovaného hemoglobinu (HbA1c) pod 45 mmol/ mol. Naopak u osob polymorbidních, s dlouhou dobou trvání diabetu, u nichž hypoglykemie prohlubuje riziko komplikací, postačuje cílová hodnota HbA1c do 60 mmol/ mol. Po stanovení diagnózy DM2 je zahájena monoterapie metforminem zároveň s režimovými opatřeními. Pokud monoterapie nevede do šesti měsíců od zahájení léčby k dosažení cílové kompenzace, je třeba zahájit kombinační léčbu některým z dalších lékových skupin (deriváty sulfonylurey, thiazolidindiony, gliptiny, glukagon-like peptid – GLP1 analoga, glifloziny). Společným znakem diabetu je hyperglykemie a každá z těchto lékových skupin ovlivňuje jinou patofyziologickou cestu pověstného DeFronzova oktetu hyperglykemie (obr. 1) [3]. V jakém pořadí mají být léky druhé a další kombinace přidávány, není dnes explicitně stanoveno. Zdůrazněna je již zmíněná individualizace přístupu.
Obr. 1. Patofyziologie hyperglykemie (DeFronzův oktet). 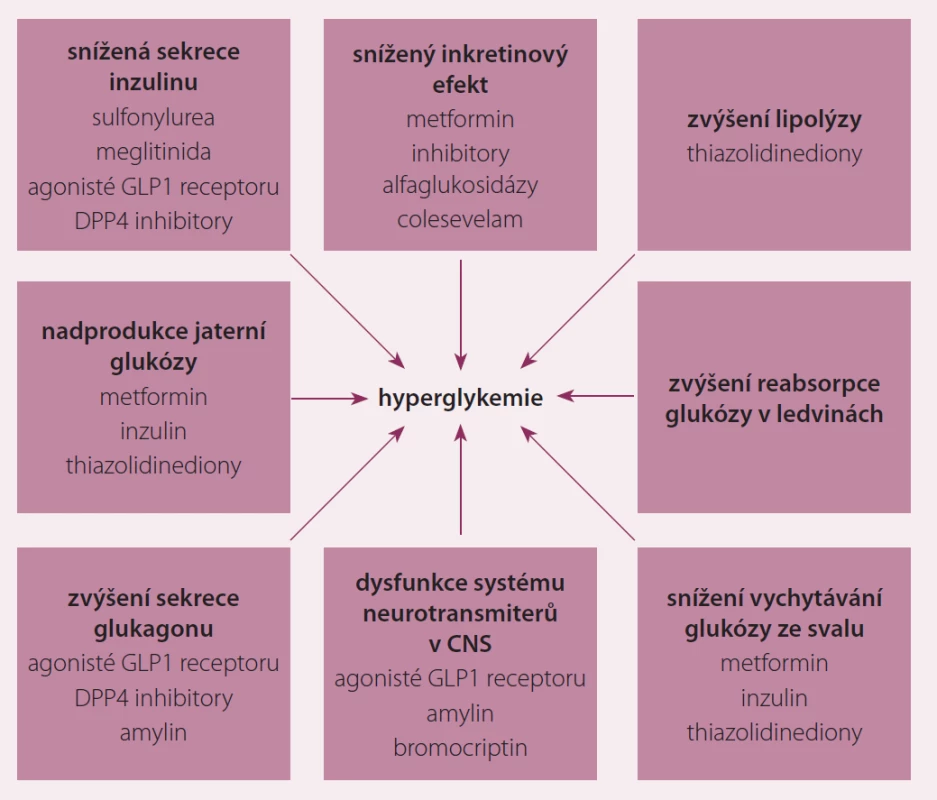
U pacientů s iniciální hodnotou HbA1c ≥ 75 mmol/ mol je možné zahájit dvojkombinační či trojkombinační terapii ihned po stanovení diagnózy DM2. V případě hyperglykemie s klinickými symptomy lze zahájit léčbu přímo inzulinem. Pokud kombinační léčba nevede do šesti měsíců ke zlepšení kompenzace, je třeba změnit dávkování nebo skupinu antidiabetika. V posledním kroku je možná nejen prostá intenzifikovaná inzulinoterapie, ale také dvě dávky premixovaného inzulinu nebo kombinace inzulinu a GLP1 analoga. Algoritmus léčby je schematicky znázorněn na obr. 2 [4,5].
Obr. 2. Doporučení pro léčbu diabetes mellitus 2. typu dle ADA (American Diabetic Association). 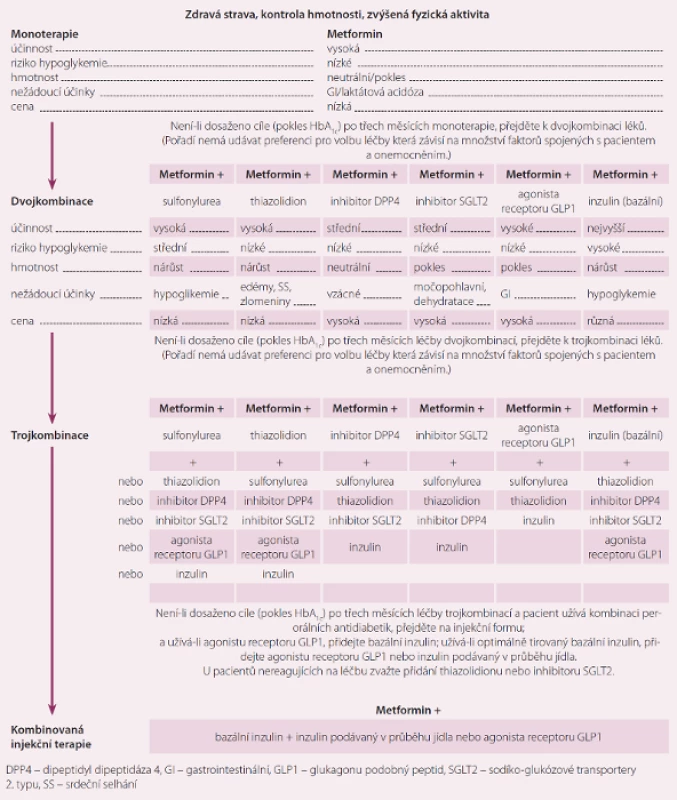
Význam fixních kombinací v léčbě DM2
DM2 je progresivní onemocnění, které je velmi často součástí metabolického syndromu a dalších chorob. Důsledkem špatně léčené hyperglykemie, hypertenze a dyslipidemie je vysoké riziko vzniku cévních komplikací, a proto je kromě režimových opatření nutná intenzivní farmakoterapie. Adherence pacientů k léčebným doporučením kolísá. Počet skutečně užitých dávek léků oproti doporučení ovlivňuje zejména počet předepsaných tablet, frekvence užívání, věk, délka léčby a nežádoucí účinky. Nonadherence k léčbě zvyšuje počet hospitalizací, mortalitu a ekonomické náklady na léčbu. DM2 je onemocnění s vysokým rizikem nonadherence, a to z několika příčin. Nemocní s DM2 jsou obvykle starší osoby, diabetes je onemocnění chronické, asymptomatické, často spojené s komorbiditami. Pacienti dlouhodobě užívají velký počet tablet v několika denních dávkách a nezanedbatelné jsou také nežádoucí účinky farmak (hypoglykemie, dyspepsie, otoky). Fixní kombinace antidiabetik tedy mohou zvýšit adherenci k terapii a zlepšit kompenzaci diabetu.
Existují dva hlavní důvody pro využití fixních kombinací antidiabetik. Prvním je zlepšení adherence k léčbě, která se jinak snižuje s počtem užívaných tablet. Druhým důvodem je současná intervence více patofyziologických mechanizmů diabetu. Díky recentním doporučením léčby DM2 je možné za určitých definovaných podmínek (HbA1c ≥ 75 mmol/ mol) fixní kombinaci nasadit ihned při stanovení diagnózy diabetu [6,7].
Perorální formy fixních kombinací antidiabetik
Komerční portfolio fixních kombinací antidiabetik se s příchodem nových lékových skupin (zejména gliptinů a gliflozinů) významně rozšířilo. Základem většiny preparátů je metformin jako antidiabetikum první volby v terapii DM2 a prediabetu (zvýšená glykemie nalačno a porucha glukózové tolerance). Patří do skupiny biguanidů a mechanizmus jeho účinku není přesně znám. Ví se, že inhibuje jaterní glukoneogenezi, zlepšuje vychytávání glukózy svalovou a tukovou tkání a snižuje vstřebávání glukózy ve střevě. Při respektování kontraindikací (glomerulární filtraci ≤ 60ml/ min, srdeční selhání NYHA III – IV, akutní stavy) je metformin jednoznačně nejefektivnějším inzulinosenzitizérem. Přehled perorálních fixních kombinací ukazuje tab. 1.
Tab. 1. Perorální formy fixních kombinací antidiabetik. 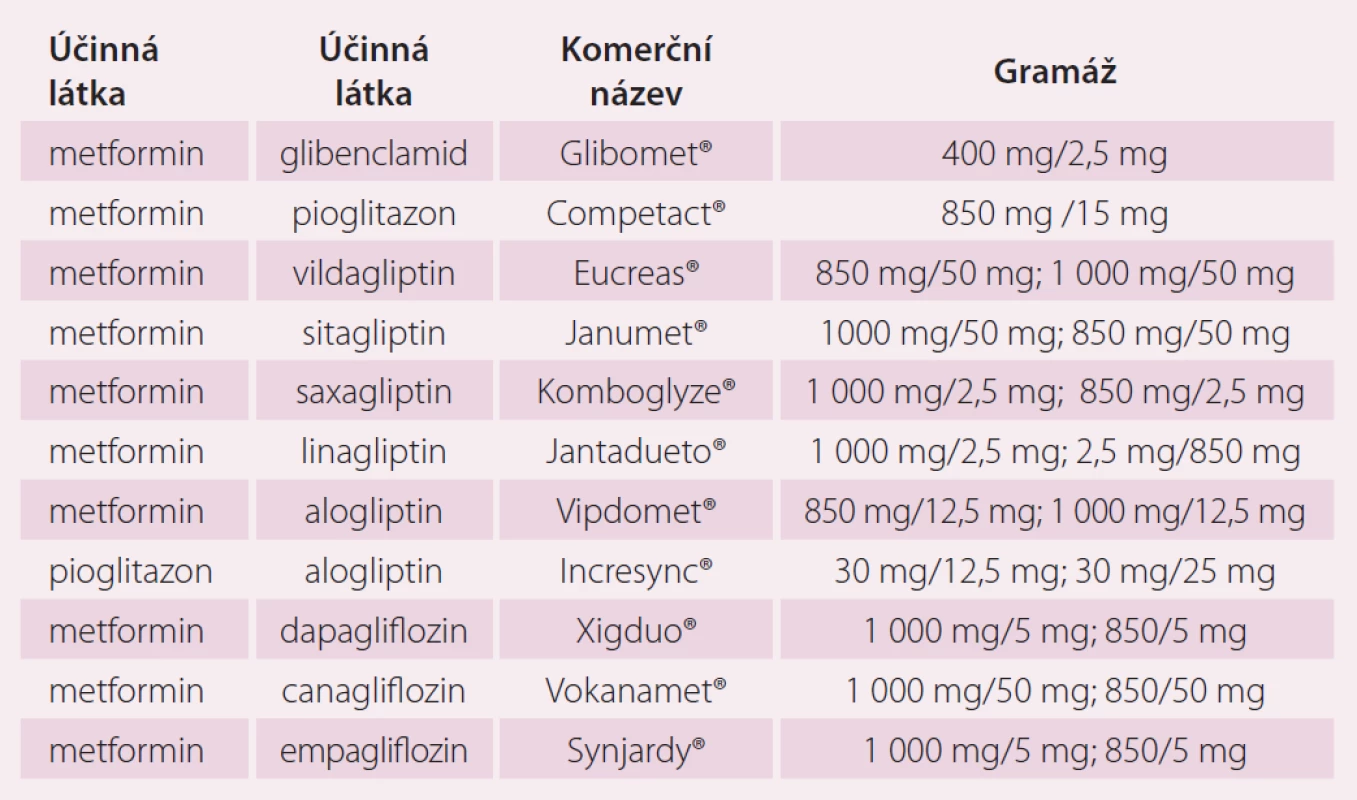
Metformin a derivát sulfonylurey
K nejdéle zavedeným fixním kombinacím patří kombinace metforminu s glibenclamidem (Glibomet®). Glibomet obsahuje metforminhydrochloridum 400 mg a glibenclamid 2,5 mg v jedné potahované tabletě. Glibenclamid patří mezi zástupce derivátů sulfonyulrey, které řadíme mezi inzulinová sekretagoga. Zvyšují citlivost beta buněk vůči glukóze, a stimulují tak sekreci inzulinu. Metformin i glibenclamid mají aditivní účinek na snížení glykemie, metformin zlepšuje hlavně glykemie lačné a glibenclamid glykemie postprandiální. Podmínkou efektivního působení glibenclamidu je zachovalá inzulinová sekrece. Deriváty sulfonylurey mají vyšší riziko hypoglykemie a přírůstku hmotnosti [8].
Metformin a thiazolidindiony
Jediným dosud užívaným zástupcem thiazolidindionů je pioglitazon. Pioglitazon je inzulinosenzitizér, aktivátor receptoru PPARγ. Tím je ovlivněna transkribce genů zapojených do metabolizmu lipidů a sacharidů. Tyto děje vedou k diferenciaci adipocytů a přesunu ektopicky uložených lipidů z jater a svalů do tukové tkáně podkoží. Výsledkem je snížení inzulinové rezistence, zvýšení inzulinové senzitivity a pokles hladiny volných mastných kyselin. Samotný pioglitazon je obsažen v preparátu s komerčním názvem Actos®. Obvyklá dávka je 15 – 30 mg 1× denně. Hlavním nežádoucím účinkem této skupiny je vzestup hmotnosti a otoky. Z praktického pohledu je velmi vhodným u pacientů s výraznou inzulinorezistencí, tam kde je metformin kontraindikován, v kombinaci s deriváty sulfonylurey nebo DDP4 inhibitory (inhibitory dipeptidylpeptidázy-4) nebo bazálním inzulinem.
Fixní kombinaci metforminu a pioglitazonu představuje Competact®. Obě účinné látky zlepšují inzulinovou senzitivitu, ale odlišným mechanizmem. Metformin je v této kombinaci inzulin šetřící lék, pioglitazon je více inzulinový senzitizér. Metformin snižuje glykemii především snížením jaterní glukoneogeneze, zatímco pioglitazon stimuluje receptory PPR α a γ zlepšuje periferní vychytávání a utilizaci glukózy. Metformin ani pioglitazon nestimulují sekreci inzulinu, jsou to antihyperglykemické léky. Do roku 2010 byla dostupná kombinace metforminu a rosiglitazonu (Avandamet). Rosiglitazon byl však z trhu stažen pro potenciálně nepříznivý vliv na kardiovaskulární systém [9].
Metformin a gliptiny (inhibitory DPP4)
Gliptiny řadíme do skupiny inkretinových terapeutik (spolu s GLP1). Pro tuto skupinu je charakteristický tzv. inkretinový efekt, tedy vyšší stimulace sekrece inzulinu při podání glukózy per os v porovnání s intravenozní aplikací. Inkretiny jsou tedy inzulin uvolňující látky produkované v gastrointestinálním traktu jako odpověď na stimulaci dietou. Nejvýznamnějšími nativními inkretiny jsou GLP1 a GIP (glukozodependentní-inzulinotropní peptid). Inkretiny jsou fyziologicky v řádu minut degradovány DPP4. Gliptiny jako inhibitory DPP4 prodlužují efekt elevovaných hladin inkeritinů. V klinické praxi se u pacientů se zachovalou sekrecí inzulinu užívají v kombinaci s metforminem, deriváty sulfonylurey či glitazony. V současnosti je v ČR dostupný sitagliptin, vildagliptin, saxagliptin, linagliptin a alogliptin. Rozdíly v antidiabetické účinnosti jednotlivých gliptinů se ukazují jako velmi malé. Většina gliptinů je eliminována ledvinami, proto je u chronické renální insuficience od stupně CKD 3 nutná redukce dávky většiny gliptinů. Výjimkou je linagliptin, který je převážně vylučován v nezměněné formě žlučí, a tedy nevyžaduje redukci dávkování ani v pokročilých stadiích renálního selhání [10]. Ve fixní kombinaci jsou gliptiny na trhu s metforminem (sitagliptin + metformin – Janumet®, vildagliptin + metformin – Eucreas®, saxagliptin + metformin – Komboglyze®, alogliptn + metformin – Vipdomet®, linagliptin + metformin – Jantadueto®). Kromě Eucreasu®, který se při normálních ledvinných funkcích užívá ve dvou denních dávkách, jsou ostatní fixní kombinace podávány v jedné denní ranní dávce. Preparáty jsou v několika gramážích účinných látek, tak aby mohly být přizpůsobeny individuálnímu terapeutickému cíli, snášenlivosti léku, stavu renálních a hepatálních funkcí.
Alogliptin je jako jediný z představitelů gliptinů dostupný ve fixní kombinaci s pioglitazonem pod firemním názvem Incresync®. Tato fixní kombinace je registrována jako druhá nebo třetí linie léčby dospělých pacientů s DM2, kterým samotný pioglitazon neposkytuje dostatečnou kontrolu a pro které je metformin nevhodný, nebo v kombinaci s metforminem jako přídatná léčba u pacientů, kterým jejich maximální tolerovaná dávka metforminu a pioglitazonu neposkytuje dostatečnou kompenzaci diabetu. Podáván je jednou denně v dávce 25 mg alogliptinu a 30 mg pioglitazonu. Pro nemocné se středně závažnou renální insuficiencí (glomerulární filtrace 30 – 50 ml/ min) je forma preparátu s redukovanou dávkou alogliptinu (12,5 mg) [11,12].
Metformin a glifloziny
Glifloziny jsou nejnovější lékovou skupinou antidiabetik, které mají zcela odlišný, na inzulinu nezávislý mechanizmus působení. Glifloziny inhibují specifický glukózový přenašeč, tzv. sodium-glukose kotransporter (SGLT2) v proximálním tubulu nefronu, a tím zabraňují zpětné renální reabsorbci glukózy. Ztráty glukózy v moči mohou dosáhnout až 70 g za den. Vlivem glykosurie tak dochází nejen ke snížení glykemie, ale také krevního tlaku, hladiny triglyceridů a poklesu hmotnosti. Glifloziny jsou v současné době užívány v terapii pacientů s DM2, a to jako 2. – 3. volba k metforminu nebo inzulinoterapii. S úspěchem je užíváme u inzulinorezistentních pacientů s obezitou. V experimentu jsou slibná data užívání gliflozinů i u diabetu 1. typu. Pro jejich diuretický efekt jsou výhodné pro pacienty s retencí tekutin. Obezřetnost je třeba u geriatrických nemocných s nastavenou diuretickou terapií a sklonem k dehydrataci. Účinnost gliflozinů klesá spolu se snížením renálních funkcí, proto není doporučeno glifloziny nově nasazovat při glomerulární filtraci ≤ 60 ml/ min. Nežádoucím účinkem gliflozinů jsou nezávažné močové a genitální infekce [13,14].
V ČR máme registrovány tři zástupce gliflozinů – dapagliflozin (Forxiga®), empagliflozin (Jardiance®) a canagliflozin (Invocana®). Všechny uvedené jsou k dispozici také ve fixních kombinacích s metforminem. Dapagiflozin a metfromin pod komerčním názvem Xigduo®, přípravek s 5 mg dapagliflozinu v jedné tabletě, podává se ve dvou denních dávkách. Canagliflozin a metformin registrován jako Vocanamet® obsahuje 50 mg canagliflozinu v jedné tabletě, podává se 2× denně. Nejmladší na trhu je empagliflozin s metforminem pod komerčním názvem Synjardy®, obsahuje 5 mg empagliflozinu v jedné tabletě a užívá se 2× denně. Fixní kombinace gliflozinů s metforminem ovlivňují jak lačnou, tak postprandiální glykemii. Může být přínosem pro inzulinorezistentní obézní nemocné, kteří selhávají v dietě, a adherence k léčbě [15–17].
Fixní kombinace GLP1 analog a bazálního inzulinu
GLP1 analoga řadíme do skupiny inkretinů – látek, které působí na podkladě inkretinového efektu (viz výše). Mechanizmus působení spočívá ve vazbě GLP1 analoga na GLP1 receptor. Touto vazbou dochází ke zvýšení sekrece inzulinu a snížení sekrece glukagonu, aniž by bylo zvýšeno riziko hypoglykemie. Díky zpomalení vyprazdňování žaludku a centrálnímu anorektickému efektu dochází při jejich podávání k poklesu hmotnosti. GLP1 analoga mají příznivý efekt na pokles krevního tlaku, snížení koncentrace lipidů a dalších parametrů kardiovaskulárního rizika. Na trhu jsou k dispozici GLP1 analoga s kratším biologickým poločasem a převládajícím vlivem na snížení postprandiální glykemie (lixisenatid, exenatid 2× denně) a GLP1 analoga s delším biologickým poločasem a větším vlivem na snížení lačné glykemie (liraglutid, exenatid 1× týdně). V klinické praxi se do terapie přidávají jako preparáty druhé či třetí volby s metforminem, případně jiným perorálním antidiabetikem nebo bazálním inzulinem. Aplikace GLP1 analog je v podobě subkutánní injekce. Z praktického pohledu je třeba zmínit, že s ohledem k ceně patří tato sofistikovaná terapie k přípravkům s preskribčním omezením [18]. Léčba bazálním inzulinem může být podle mezinárodních i českých doporučení nasazeno do terapie již v relativně časné fázi diabetu, pokud stávající léčba nevede k uspokojivé kompenzaci. Arbitrálně stanovenou hranicí intenzifikace léčby je hodnota glykovaného hemoglobinu ≥ 53 mmol/ mol. Kombinace bazálního inzulinu s GLP1 analogem je terapeuticky efektivní a oblíbená. Relativně brzké užití inkretinové terapie je racionální s ohledem na mechanizmus účinku. Především protektivní vliv na beta buňku by se mohl podílet na zpomalení progrese onemocnění. Tuto skutečnost reflektují nejnovější doporučení ADA a EASD a jako rovnocennou alternativu klasické inzulinové intenzifikaci uvádějí kombinaci bazálního inzulinu s GLP1 analogem. Logickým vyústěním je vývoj fixní kombinace GLP1 analoga s bazálním inzulinem. V lednu roku 2015 byla na švýcarský trh uvedena první fixní kombinace bazálního inzulinu degludec a GLP1 analoga liraglutid pod obchodním názvem Xultophy®. Preparát je k dispozici v předplněných perech a aplikuje se podkožně 1× denně, bez závislosti na jídle. V ČR se uvedení na trh chystá v brzké době. Efektivita fixní kombinace degludecu a liraglutidu byla hodnocena v rámci studií Dual. Ve studii Dual I byla terapie fixní kombinací porovnávána s terapií degludecem a liraglutidem u pacientů dosud léčených metforminem/ pioglitazonem. Po 26 týdnech léčby došlo u pacientů léčených fixní kombinací k poklesu glykovaného hemoglobinu o 1,9 %, ve skupině s degludecem o 1,4 % a ve skupině s liraglutidem o 1,3 %. Ve studii Dual II byla fixní kombinace porovnávána s degludecem u pacientů dosud léčených bazálním inzulinem, metforminem, případně i deriváty sulfonylurey. V průběhu studie poklesl glykovaný hemoglobin u pacientů aplikujících fixní kombinaci o 1,9 %, u pacientů aplikujících samotný bazální inzulin o 0,9 %. Ve skupině s fixní kombinací klesla hmotnost o 2,7 kg, ve skupině s degludecem rozdíl v hmotnosti nebyl. Studie Dual III hodnotila efekt fixní kombinace vs. ponechání stávající terapie. Ve skupině s fixní kombinací došlo k poklesu glykovaného hemoglobinu o 1,3 % (vs. 0,4 %). Studie Dual IV porovnávala efekt fixní kombinace vůči placebu u pacientů v kombinační terapii s metforminem a/ nebo sulfonylureou. Studie Dual Vporovnávala efekt fixní kombinace vs. bazální inzulin glargin. Ve skupině s fixní kombinací degludec a liraglutid došlo k signifikantnějšímu poklesu glykovaného hemoglobinu (1,8 vs. 1,1 %). Klinické studie Dual pokračují nadále. Fixní kombinace Xultophy® (IDegLira) obsahuje inzulin degludec v koncentraci 100 j/ ml a liraglutid v koncentraci 3,6 mg/ ml. Jedna podaná dávkovací jednotka obsahuje 1 j inzulinu degludec a 0,036 ml liraglutidu. Maximální možná dávka je 50 jednotek degludecu a 1,8 ml liraglutidu. Xultophy® bude k dispozici v předplněném peru s objemem 3 ml (300 jednotek degludecu a 10,8 mg liraglutidu).
Dalším fixním preparátem je LixiLan [19,20]. Jedná se o kombinaci bazálního inzulinu glargin a GLP1 analoga lixisenatidu. LixiLan byl dosud hodnocen v klinických studiích LixiLan-O a Lixilan-L. Studie Lixilan-O přinesla srovnání fixní kombinace a terapie glarginem u pacientů léčených dosud metforminem. Studie LixiLan-L srovnávala pacienty s kombinací bazálního inzulinu + metforminu nebo jiných perorálních antidiabetik a pacienty léčené fixní kombinací LixiLan. Výsledky obou studií prezentované na podzim 2015 potvrdily superioritu LixiLanu v poklesu glykovaného hemoglobinu. Na trhu tento preparát zatím k dispozici není [21].
Závěr
DM2 je progresivní onemocnění, které v důsledku postupného poklesu sekrece inzulinu vyžaduje intenzifikaci léčby. Současná doporučení léčby DM2 apelují na časné zahájení kombinační terapie s ohledem k individuálním cílům léčby diabetu a ostatních komorbidit. Tato léčebná strategie často vede k nárůstu počtu denních dávek léků, včetně injekční aplikace, a vyššímu výskytu nežádoucích účinků farmak. Tím může být zásadně narušena adherence pacienta k léčbě. Právě fixní kombinace mohou být řešením, jak adherenci pacienta zlepšit a současně postihnout více patofyziologických mechanizmů onemocnění. Při volbě vhodného pacienta, s obvyklým zvážením kontraindikací obou zastoupených složek, jsou fixní preparáty vhodnou volbou v současných i perspektivních širokých možnostech léčby DM2.
Doručeno do redakce: 19. 4. 2016
Přijato po recenzi: 27. 4. 2016
MU Dr. Markéta Paclíková
www.fnhk.cz
marketa.paclikova@centrum.cz
Zdroje
1. IDF diabetes atlas. 7th ed. Available from: http://www.diabetesatlas.org.
2. Novinky ÚZIS ČR. Činnost odboru diabetologie, péče o diabetiky v roce 2013. Dostupné z: http://www.uzis.cz/rychle-informace/cinnost-oboru-diabetologie-pece-diabetiky-roce-2013.
3. DeFronzo RA, Banting Lecture. From the Triumvirate to the omnious octet: new paradigm for the treatment of type 2 diabetes mellitus. Diabetes 2009; 58 : 773–795. doi: 10.2337/db09-9028.
4. Inzucchi SE, Bergenstal RM, Buse JB et al. Management of hyperglycemia in type 2 diabetes, 2015: a patient-centered approach: update to a position statement of the American Diabetes Association and the European Association for the Study of Diabetes. Diabetologia 2015; 58 : 429–442. doi: 10.1007/s00125-014-3460-0.
5. Škrha J, Pelikánová T, Kvapil M. Doporučený postup péče o diabetes mellitus 2. typu, Česká diabetologická společnost, 2016. Dostupné z: http://www. diab.cz.
6. Cramer JA. A systematic review of adherence with medications for diabetes. Diabetes Care 2004; 27 : 1218–1224.
7. Lavarnia F, Adkins S, Shubrook JH. Use of oral combination therapy for type 2 diabetes in primary care: meeting individualized patient goal. Postgrad Med 2015; 127 : 808–817. doi: 10.1080/00325481.2015.1085293.
8. Šmahelová A. Význam kombinovaných perorálních antidiabetik v léčbě diabetu 2. typu. Interní Med 2009; 11 : 155–158.
9. Šmahelová A. Pioglitazon – využití v léčbě diabetika 2. typu. Kapitoly z kardiologie 2013; 4 : 122–125.
10. Kim W, Egan JM. The role of incretins in glucose homeostasis and diabetes treatment. Pharmacol Rev 2008; 60 : 470–512. doi: 10.1124/pr.108.000604.
11. Haluzík M, Svačina Š. Inkretinová léčba diabetu. Praha: Mladá fronta 2011.
12. Šmahelová A. Gliptiny v léčbě diabetu 2. typu – současnost a budoucnost. Farmakoterapie 2011; 7 : 462–467.
13. Kvapil M. Inhibitory SGLT2: nová cesta k léčbě diabetu. In: Kvapil M (ed). Diabetologie 2010. Praha: Triton 2010.
14. Asano T, Anai M, Sakoda H et al. SGLT as a therapeutic target. Drugs Fut 2004; 29 : 461–466.
15. Kvapil M. Dapagliflozin. Farmakoterapie 2013; 9 : 356–360.
16. Škrha J. Empagliflozin a současné postavení inhibitorů SGLT2 v terapii diabetu 2. typu. Farmakoterapie 2015; 11 : 98–103.
17. Prázný M, Slíva J. Empagliflozin – nový inhibitor SGLT2 pro léčbu diabetu 2. typu. Farmakoterapie 2014; 10 : 50–53.
18. Campbell JE, Drucker DJ. Pharmacology, physiology and mechanism of incretin hormone action. Cell Metab 2013; 17 : 819–837. doi: 10.1016/j.cmet.2013.04.008.
19. Gough SC, Bode B, Woo V et al. Efficacy and safety of a fixed-ratio combination of insulin degludec and liraglutide (IDegLira) compared with its components given alone: results of a phase 3, open-label, randomised, 26-week, treat-to-target trial in insulin-naive patients with type 2 diabetes. Lancet Diabetes Endocrinol 2014; 2 : 885–893. doi: 10.1016/S2213-8587(14)70174-3.
20. Russel-Jones D. Combination of insulin Degludec/liraglutid (IDegLira): key results from DUAL programme. EASD 2015. Available from: http://www.easdvirtualmeeting.org/resources/results-of-the-dual-programme.
21. J. Rosenstock. Benefits of fixed -ratio formulation of once -daily insulin glargine/lixisenatide (LixiLan) vs glargine in type 2 diabetes inadequately controlled on metformin. Oral Presentation. EASD 2014, Vídeň.
Štítky
Dětská kardiologie Interní lékařství Kardiochirurgie Kardiologie
Článek vyšel v časopiseKardiologická revue – Interní medicína
Nejčtenější tento týden
2016 Číslo 2- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- S prof. Vladimírem Paličkou o racionální suplementaci kalcia a vitaminu D v každodenní praxi
-
Všechny články tohoto čísla
- Fixní kombinace antidiabetik
- Fixní kombinace v antiagregační léčbě
- Fixní kombinace v pneumologii
- Dapagliflozin a studie DECLARE – budoucnost léčby diabetes mellitus?
- Sacubitril-valsartan (LCZ696) v léčbě srdečního selhání
- Použití rivaroxabanu v prevenci cévní mozkové příhody u pacienta s chronickým srdečním selháním a nevalvulární fibrilací síní – kazuistika
- Hot lines z ACC 2016, Chicago
- Vedolizumab v léčbě idiopatických střevních zánětů
- Fixní kombinace v klinické praxi
- Fixní kombinační léčba hypertenze
- Léčba hypertenze z pohledu ambulantního lékaře
- Fixní kombinace s hypolipidemiky
- Kardiologická revue – Interní medicína
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Fixní kombinace s hypolipidemiky
- Sacubitril-valsartan (LCZ696) v léčbě srdečního selhání
- Fixní kombinační léčba hypertenze
- Fixní kombinace v pneumologii
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



