-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Kombinační léčba perorálními antidiabetiky
Oral antidiabetic drugs – fixed combination therapy
Type 2 diabetes mellitus is caused by the presence of disturbances in insulin secretion, insulin resistance and reduced action of the incretin axis. At present, any disorder can be influenced pharmacologically. Therefore, combination therapy is a rational basic principle for pharmacological intervention in type 2 diabetes. It facilitates an individual approach to therapy.
Keywords:
type 2 diabetes mellitus – oral antidiabetic drugs – fixed combination therapy
Autoři: M. Kvapil
Působiště autorů: Interní klinika 2. LF UK a FN v Motole, Praha
Vyšlo v časopise: Kardiol Rev Int Med 2014, 16(6): 454-457
Kategorie: Kardiologická revue
Souhrn
Diabetes mellitus 2. typu je důsledkem přítomnosti poruchy sekrece inzulinu, inzulinové rezistence a sníženého účinku inkretinové osy. V současnosti lze farmakologicky ovlivnit každou poruchu. Proto je kombinační terapie racionálním základním principem pro farmakologickou intervenci diabetu 2. typu. Umožňuje individuální přístup v terapii.
Klíčová slova:
diabetes mellitus 2. typu – perorální diabetika – léčba fixní kombinacíÚvod
Diabetes mellitus je syndrom definovaný přítomností hyperglykemie jako základního symptomu. Hyperglykemie, jejímž korelátem je zvýšená koncentrace glykovaného hemoglobinu, je pro organizmus toxická. Typickým důsledkem hyperglykemie jsou vaskulární komplikace. V obecné populaci tvoří hodnoty glykemie a glykovaného hemoglobinu spojitou množinu, diskriminační hodnoty pro stanovení horní hranice normy a hranice pro diabetes byly stanoveny arbitrárně odvozením od rizika zejména mikrovaskulárních komplikací. Glykovaný hemoglobin koreluje s kardiovaskulárním rizikem a mortalitou u pacientů bez diabetu [1], zvýšené riziko kardiovaskulárních komplikací je popsáno u osob s pouze mírně patologicky zvýšenou glykemií (tzv. prediabetes zahrnující hraniční glykemii nalačno a porušenou glukózovou toleranci) [2]. Významně zvýšené kardiovaskulární riziko (KVR) u pacientů s diabetem je známo dlouhou dobu, opakovaně potvrzováno i novými studiemi a je vyšší u žen ve srovnání s muži [3].
Cílem terapie diabetu je snížení mortality a prevence pozdních komplikací při minimalizaci nežádoucích účinků terapie. Základní podmínkou dosažení cíle je snížení hyperglykemie – základního příznaku diabetu – k hodnotám zdravých osob. Pacient s diabetem 1. typu nemá vlastní sekreci inzulinu, proto je plně závislý na terapii exogenním inzulinem. U nemocných s diabetem 2. typu je v první fázi vývoje nemoci inzulin jednou z možných alternativ léčby (obvykle v kombinaci s perorálními antidiabetiky). Po delším průběhu choroby je však nezbytnou součástí terapie, protože sekrece inzulinu postupně klesá, i když je vždy zachována v míře zabraňující vzniku ketoacidózy. Od začátku diagnózy je tak terapie postavena na edukaci, životosprávě (dieta a pohyb, redukce nadváhy, resp. obezity) v kombinaci s perorálními antidiabetiky.
Současná koncepce léčby diabetu vychází z patofyziologických poznatků, přičemž jsou v podstatě přípustné různé individuální variace terapie (nepřekračující kontraindikace), pokud je dosaženo cíle – bezpečného zlepšení kompenzace. Tímto prizmatem je třeba posuzovat využití jednotlivých režimů terapie. Z praktického hlediska jsou pro klinika důležité ty patofyziologické poruchy, které je možné ovlivnit farmakologickou terapií. Zjednodušeně, v současnosti je k dispozici farmakologická intervence, která zejm. zlepšuje sekreci inzulinu, zlepšuje rezistenci k inzulinu, restituuje defekt inkretinové osy. Nově byla vyvinuta terapie, která účinkuje nezávisle na inzulinu či jeho receptoru – glifloziny. Tuto vlastnost vykazovaly doposud pouze inhibitory alfa glukosidázy.
Patofyziologie diabetes mellitus 2. typu
Ve stavu nalačno je odbržděna jaterní glykogenolýza a glukoneogeneze, což je způsobeno nízkou inzulinemií. Postprandiálně játra ukládají glukózu do zásob (glykogensyntéza) a současně zastaví novotvorbu glukózy. Tento obrat v metabolizmu je způsoben prudkým zvýšením koncentrace inzulinu uvolněného v důsledku zvýšené sekrece indukované aktivací vegetativního nervového systému (cefalická fáze) a následně vstřebáváním glukózy a aminokyselin ze zažívacího traktu. Významným způsobem se na výsledné glykemii podílí také změna sekrece glukagonu. Fyziologická sekreční odpověď inzulinu na sekreční podnět je typicky dvoufázová, první, tzv. časná či první fáze inzulinu je krátkodobá (minuty) a je následována tzv. druhou (pozdní) fází inzulinové sekrece. Chybění první fáze sekrece inzulinové má významný klinický dopad, neboť první – časná fáze sekrece inzulinu umožňuje dosáhnout rychle po jídle rovnovážné koncentrace mezi plazmou a intersticiem (při zachovalé 1. fázi ekvilibrium do 10 min, bez 1. fáze ekvilibrium do 35 min), jinými slovy, umožňuje rychlý nástup účinku inzulinu na periferii. Časná fáze sekrece inzulinu má kritický význam pro udržení postprandiální glykemie v normálním rozmezí. V poslední době však bylo potvrzeno, že děje, které se podílejí na řízení glykemie, jsou mnohem komplexnější, než je výše uvedená základní koncepce [4].
Pro vznik diabetu 2. typu musí být přítomny dvě základní poruchy – inzulinová rezistence a porucha sekrece inzulinu. Na základě současných poznatků můžeme oprávněně předpokládat, že u naprosté většiny osob s diabetem 2. typu jsou přítomny obě poruchy, ale v různém poměru významnosti. Toto zjištění je velmi důležité pro racionální doporučení léčby, neboť můžeme izolovaně intervenovat poruchu sekrece inzulinu a inzulinovou rezistenci.
Inzulinová rezistence se rozvíjí na terénu dědičné predispozice poté, co dlouhodobě jedinec přijímá více energie, než vydává, což vede ke vzniku nadváhy či obezity. Tento proces je dlouhodobý, obvykle probíhá řadu let až desetiletí. Zprvu je inzulinorezistence kompenzována zvýšenou sekrecí inzulinu. Po dosažení maximální schopnosti sekrece inzulinu a spolu se ztrátou první časné fáze inzulinové sekrece dochází k pozvolnému přechodu z normální glukózové tolerance přes porušenou glukózovou toleranci (nebo hraniční glykemii nalačno) do stadia, kdy je hyperglykemie diagnostikou pro diabetes mellitus (7,0 mmol/ l). U pacienta s manifestním diabetem 2. typu má pak inzulinová rezistence obvykle komponentu geneticky podmíněnou (zejm. ta řadí diabetes 2. typu k manifestacím tzv. metabolického syndromu) a komponentu získanou, jejíž kvantita, zjednodušeně vyjádřeno, koreluje se stupněm obezity.
Porucha inzulinové sekrece má u pacientů s diabetem 2. typu složku kvantitativní a kvalitativní. V asymptomatickém úvodu stačí zvýšená sekrece inzulinu kompenzovat snižující se citlivost tkání, výsledkem je udržení glykemie v normálním rozmezí hodnot. V době přechodu od normální glukózové tolerance k diabetu se progresivně snižuje 1. fáze sekrece inzulinu a narůstá kvantita inzulinu uvolněného v 2. fázi. Mimo to se zvyšuje množství secernovaného proinzulinu. Další vývoj diabetu ve smyslu progrese nemoci definované postupným zhoršováním kompenzace (zvyšující se glykemií) je způsoben pozvolným absolutním úbytkem secernovaného inzulinu. Protože se inzulinorezistence nemění, není‑li intervenována, je pozvolné zvyšování glykemie jasným důsledkem relativního nedostatku inzulinu.
Jako postprandiální glykemii označujeme (na základě konsenzu) glykemii změřenou v době 60 – 120 min po jídle. U zdravého jedince dosahuje glykemie po jídle maximální hodnoty v době okolo jedné hodiny po jídle, u pacienta s diabetem 2. typu je to naopak v době blížící se 120. minutě po jídle. U pacientů s postupně se rozvíjející poruchou glukózové tolerance se glykemie po zátěži sacharidy (postprandiální glykemie) v průběhu času zvyšuje většinou absolutně více než glykemie nalačno. Důvodem je zejména inzulinorezistence jaterních buněk a ztráta první fáze sekrece inzulinu. Jsou‑li jaterní buňky inzulinorezistentní, pak postprandiálně nedochází ke snížení uvolňování glukózy (zejména chybí inhibice glukoneogeneze), postprandiální glykemie je proto významně vysoká. První – časná fáze sekrece inzulinu umožňuje dosáhnout po jídle rychle rovnovážné koncentrace mezi plazmou a intersticiem, tím umožňuje rychlý nástup účinku inzulinu na periferii. Toto vše vedle vlastního efektu v jaterních buňkách a tukové tkáni (v adipocytech inzulin zejm. tlumí lipolýzu, a snižuje tak uvolňování glycerolu a zejména volných mastných kyselin do periferní krve). Pro správný výběr terapie a správné vyhodnocení výsledků měření u jednoho každého pacienta je třeba chápat souvislost mezi glykemií nalačno a postprandiální glykemií. Z hlediska nutné intervence je stejně jako absolutní výše změřené postprandiální glykemie důležité absolutní (i relativní) navýšení glykemie postprandiální proti glykemii nalačno (preprandiální). Jinými slovy, pouze jedna absolutní hodnota glykemie nalačno neřekne nic k tomu, jaká intervence je vhodnější – zda cílená pouze na postprandiální glykemii či zda stačí snížit lačnou glykemii a touto cestou dosáhnout snížení celého glykemického profilu.
GLP 1 (glucagon like polypeptid 1) je hormon ze skupiny inkretinů. Je secernován postprandiálně z L buněk tenkého střeva, má krátký poločas (minuty), vykazuje celou řadu účinků, jejichž výsledkem je snížení glykemie [5]. Efekt inkretinové osy je u pacientů s diabetem 2. typu snížen [6], proto je velký potenciál terapeutického využití GLP 1 u diabetu 2. typu [7].
Proč kombinační terapie právě u diabetu?
Považujeme za prokázané, že terapie hyperglykemie je základní prevencí mikrovaskulárních, specifických komplikací diabetes mellitus [8]. Důkazy terapie diabetu pro prevenci makrovaskulárních, nespecifických komplikací diabetes mellitus (zejm. koronárních a cévních mozkových příhod) však nejsou jednoznačné [8 – 11]. Zřejmá je přitom pozitivní korelace mezi průměrnou glykemií a rizikem například ischemické choroby srdeční i u nediabetiků [1]. Jedním z možných vysvětlení, proč se nedaří přesvědčivě prokázat, že normoglykemie je prevencí vaskulárních katastrof, je limitace antidiabetické terapie, kterou do nedávné doby mohla medicína použít. Snaha o těsnou kompenzaci, o přiblížení se k hodnotám zdravého člověka, zvyšovala riziko hypoglykemických příhod [12].
Základní principy terapie diabetu v současnosti jsou tedy následující: časné stanovení diagnózy, intenzivní intervence od začátku s cílem dosažení těsné kompenzace, individuální přístup se zohledněním zejm. poměru základních poruch u daného pacienta, zohlednění významu postprandiální glykemie z hlediska výběru terapie a vlivu na kompenzaci diabetu, prevence pozdních komplikací cílenou intervencí dyslipidemie a hypertenze, minimalizace rizika hypoglykemie. Pro naplnění těchto principů se jeví kombinační terapie jako ideální přístup.
Výhody a nevýhody fixní kombinace
Klinické studie zahrnují v protokolu obvykle hodnocení compliance pacientů, pokud účastníci neužívají studijní medikaci, jsou vyřazeni z hodnocení. Publikované výsledky se tak blíží ideálnímu stavu, kdy množství užitého preparátu není nižší, než 85 – 90 % předepsaných dávek.
V reálných podmínkách běžné klinické praxe je však situace odlišná. Compliance pacientů s doporučenou léčbou kolísá. Počet skutečně užitých dávek léku proti doporučení ovlivňuje celá řada faktorů (tab. 1). Přesně provedená studie [13] doložila, že významným prvkem, který ovlivní počet skutečně užitých dávek předepsaného léku, je počet denních dávek. Při doporučení užívat lék jednou denně byla dávka užita v 79 % dnů sledovaného období, při doporučení užívat lék třikrát denně bylo užito pouze 38 % dávek. Podrobná analýza databáze pacientů léčených jedním či dvěma perorálními antidiabetiky prokázala vysoce významnou souvislost mezi počtem předepsaných tablet a snížením skutečně užitého počtu [14]. Podobně se snižovala adherence k terapii s počtem dalších předepsaných léků.
Tab. 1. Faktory, které snižují počet skutečně užitých dávek předepsaného léku. 
Fixní kombinace léků zvyšuje jednoznačně compliance u pacientů s chronickými chorobami, jak prokázala provedená metaanalýza [15].
Existují dva hlavní důvody pro využití fixních kombinací antidiabetik pro terapii diabetu 2. typu. Prvním je zlepšení adherence k doporučené terapii, která, jak je popsáno, se snižuje s počtem užívaných tablet. Druhým důvodem je vhodnost současné intervence dvou patofyziologických mechanizmů, které vedou ke vzniku onemocnění [16].
V současnosti jsou registrovány kombinace metforminu a sekretagog (sulfonylurea, glinidy), metforminu a inkretinové terapie (gliptiny, inhibitory dipeptidylpeptidázy 4), metforminu a látek ovlivňujících inzulinovou rezistenci (pioglitazon), pioglitazonu a sulfonylurey [16]. Objevují se i zprávy o kombinaci tří účinných látek v jedné tabletě (metformin, glimepirid a pioglitazon) [17].
V souladu s poznatkem, že účinek metforminu a sitaglitpinu se vzájemně doplňuje, čehož výsledkem je zlepšení kompenzace větší při kombinaci terapie v porovnání s pouhým součtem samostatných efektů [18], se nabízí vývoj fixní kombinace gliptinů a metforminu. Podstatnou výhodou této kombinace je skutečnost, že gliptiny mají minimální riziko nežádoucích účinků, zejména hypoglykemie [19]. Výsledkem je situace, kdy jsou registrovány fixní kombinace s metforminem pro sitagliptin, vildagliptin, saxagliptin, linagliptin i alogliptin [20]. Tato fixní kombinace je velmi dobře akceptována i pacienty [21]. Velmi slibnou se pak jeví fixní kombinace aligliptin/ pioglitazon [22]. Nejnověji bylo prokázáno, že artificiálně navozená glykosurie glifloziny iniciuje zvýšený výdej glukózy z jater („kompenzační mechanizmus“?). Z tohoto důvodu bude jistě velmi vhodná kombinace gliflozinu s gliptinem. Proto je i připravena k uvedení na trh fixní kombinace dapagliflozin/ saxagliptin.
Je s podivem, že přes zřejmé výhody je fixní kombinace perorálních antidiabetik v praxi stále málo rozšířená [23]. Tato skutečnost je obvykle zdůvodňována tím, že lze pouze obtížně titrovat dávku. S tímto argumentem lze pouze obtížně souhlasit, naprostá většina výrobců nabízí diferencované poměry fixních kombinací. Krom toho, nic nebrání postupnému titrování optimální dávky separátně a poté nahrazení fixní kombinací.
Racionální kombinace v terapii
Kombinovat jednotlivá antidiabetika je podle současné úrovně znalostí velmi racionální postup. Je však třeba respektovat individuální profil pacienta a současně mechanizmus účinku jednotlivých tříd antidiabetik, taktéž pak registrované indikace pro jednotlivé látky [24]. Vhodnost jednotlivých kombinací je orientačně popsána v tab. 2.
Tab. 2. Vhodné a nevhodné kombinace. 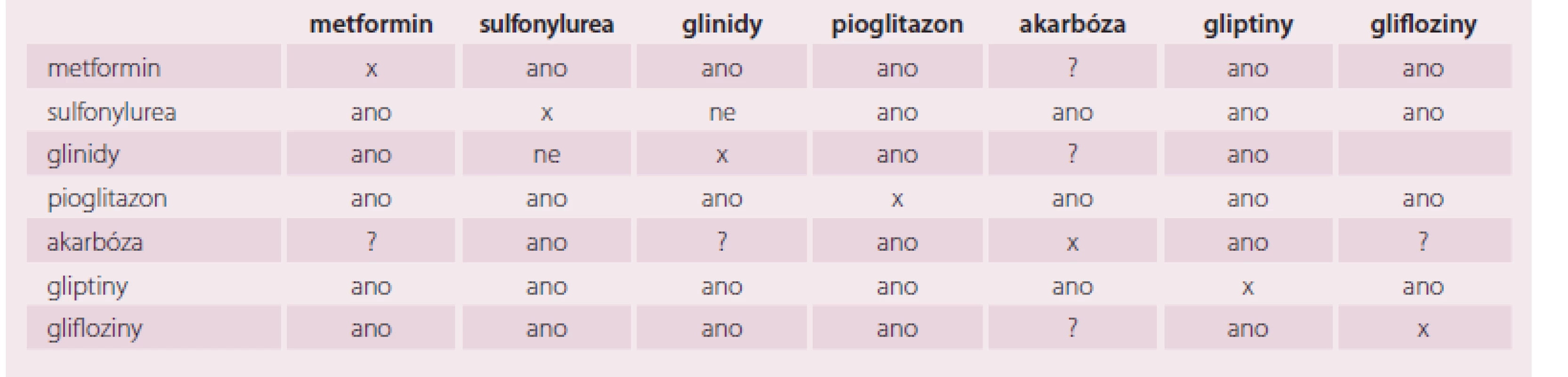
Závěr
Kombinační terapie vyžaduje nejen znalosti lékaře, ale také jeho velké zkušenosti. K dispozici nejsou klinické studie pro všechny možné kombinace. Rád bych zdůraznil, že podle mého nejhlubšího přesvědčení opakovaně potvrzovaného klinickou zkušeností je potenciál kombinační terapie vybrané individuálně podle profilu pacienta mnohem větší, než jsou průměrné efekty popisované v klinických studiích. Je to způsobeno tím, že do klinických studií jsou zařazováni pacienti pouze podle hlavní diagnózy – diabetes mellitus 2. typu. Pacienti se však liší v metabolickém profilu a významnosti jednotlivých poruch, které diabetes způsobují. Krom toho, diabetes 2. typu je progresivně se vyvíjející onemocnění, které vyžaduje úpravu terapie adekvátně aktuální situaci. Z těchto důvodů je zřejmé, že racionálně volená kombinační terapie diabetu je základem současné farmakologické intervence diabetu 2. typu.
Doručeno do redakce: 25. 11. 2014
Přijato po recenzi: 5. 12. 2014
prof. MUDr. Milan Kvapil, CSc., MBA
www.fnmotol.cz
milan.kvapil@fnmotol.cz
Zdroje
1. Santos ‑ Oliveira R, Purdy C, da Silva MP et al. Haemoglobin A1c levels and subsequent cardiovascular disease in persons without diabetes: a meta‑analysis of prospective cohorts. Diabetologia 2011; 54 : 1327 – 1334. doi: 10.1007/ s00125 ‑ 011 ‑ 2078 ‑ 8.
2. Ford ES, Zhao G, Li C. Pre‑diabetes and the risk for cardiovascular disease: a systematic review of the evidence. J Am Coll Cardiol 2010; 55 : 1310 – 1317. doi: 10.1016/ j.jacc.2009.10.060.
3. Huxley R, Barzi F, Woodward M. Excess risk of fatal coronary heart dinase associated with diabetes in men and women: meta‑analysis of 37 prospective kohort studies. BMJ 2006; 332 : 73 – 78.
4. Kvapil M, Perušičová J. Postprandiální glykémie. Praha: Triton 2006.
5. Ahrén B. Gut peptides and Type 2 diabetes mellitus treatment. Curr Diab Rep 2003; 3 : 365 – 372.
6. Nauck MA, Stockamenn F, Ebert R et al. Reduced incretin effect in Type 2 (non‑insulin‑dependent) diabetes. Diabetologia 1986; 29 : 46 – 52.
7. Anagnostis P, Athyros VG, Adamidou F et al. Glucagon‑like peptide ‑ 1‑based therapies and cardiovascular disease: looking beyond glycaemic control. Diabetes Obes Metab 2011; 13 : 302 – 312. doi: 10.1111/ j.1463 ‑ 1326.2010.01345.x.
8. Boussageon R, Bejan ‑ Angoulvant T, Saadatian ‑ Elahi M et al. Effect of intensive glucose lowering treatment on all cause mortality, cardiovascular death, and microvascular events in type 2 diabetes: meta‑analysis of randomised controlled trials. BMJ 2011; 343: d4169. doi: 10.1136/ bmj.d4169.
9. Mazzone T. Intensive glucose lowering and cardiovascular disease prevention in diabetes: reconciling the recent clinical trial data. Circulation 2010; 122 : 2201 – 2211. doi: 10.1161/ CIRCULATIONAHA.109.913350.
10. Zhang CY, Sun AJ, Zhang SN et al. Effects of intensive glucose control on incidence of cardiovascular events in patients with type 2 diabetes: a meta‑analysis. Ann Med 2010; 42 : 305 – 315. doi: 10.3109/ 07853891003796752.
11. Tkác I. Effect of intensive glycemic control on cardiovascular outcomes and all‑cause mortality in type 2diabetes: overview and metaanalysis of five trials. Diabetes Res Clin Pract 2009; 86 (Suppl 1): S57 – S62. doi: 10.1016/ S0168 ‑ 8227(09)70011 ‑ 7.
12. The effect of intensive treatment of diabetes on the development and progression of long‑term complications in insulin‑dependent diabetes mellitus. The Diabetes Control and Complications Trial Research Group. N Engl J Med 1993; 329 : 977 – 986.
13. Donnan PT, MacDonald TM, Morris AD. Adherence to prescribed oral hypoglycaemic medication in a population of patients with Type 2 diabetes: a retrospective cohort study. Diabet Med 2002; 19 : 279 – 284.
14. Cramer JA. A systematic review of adherence with medications for diabetes. Diabetes Care 2004; 27 : 1218 – 1224.
15. Bangalore S, Kamalakkannan G, Parkar S et al. Fixed‑dose combinations improve medication compliance: a meta‑analysis. Am J Med 2007; 120 : 713 – 719.
16. Blonde L, San Juan ZT. Fixed‑dose combinations for treatment of type 2 diabetes mellitus. Adv Ther 2012; 29 : 1 – 13. doi: 10.1007/ s12325 ‑ 011 ‑ 0094 ‑ 1.
17. Meshram DM, Langade DG, Kinagi SB et al. Evaluation of efficacy and safety of fixed dose combination of glimepiride 2 mg pluspioglitazone 15 mg plus metformin SR 500 mg in the management of patiens with type ‑ 2 diabetes mellitus. J Indian Med Assoc 2005; 103 : 447 – 450.
18. Goldstein BJ, Feinglos MN, Lunceford JK et al. Sitagliptin 036 Study Group. Effect of initial combination therapy with sitagliptin, a dipeptidyl peptidase ‑ 4 inhibitor, and metformin on glycemic control in patients with type 2 diabetes. Diabetes Care 2007; 30 : 1979 – 1987.
19. Karagiannis T, Paschos P, Paletas K et al. Dipeptidyl peptidase ‑ 4 inhibitors for treatment of type 2 diabetes mellitus in the clinical setting: systematic review and meta‑analysis. BMJ 2012; 344: e1369. doi: 10.1136/ bmj.e1369.
20. Státní ústav pro kontrolu léčiv. Přehledy a seznamy. [online] Dostupné z: http:/ / www.sukl.cz.
21. Benford M, Milligan G, Pike J et al. Fixed‑dose combination antidiabetic therapy: real ‑ world factors associated with prescribing choices and relationship with patient satisfaction and compliance. Adv Ther 2012; 29 : 26 – 40. doi: 10.1007/ s12325 ‑ 011 ‑ 0096 ‑ z.
22. DeFronzo RA, Burant CF, Fleck P et al. Efficacy and tolerability of the DPP ‑ 4 inhibitor alogliptin combined with pioglitazone, in metformin‑treated patients with type 2 diabetes. J Clin Endocrinol Metab 2012; 97 : 1615 – 1622. doi: 10.1210/ jc.2011 ‑ 2243.
23. Pan F, Chernew ME, Fendrick AM. Impact of fixed‑dose combination drugs on adherence to prescription medications. J Gen Intern Med 2008; 23 : 611 – 614. doi: 10.1007/ s11606 ‑ 008 ‑ 0544 ‑ x.
24. Kvapil M. Postavení fixní kombinace antidiabetik v terapii. Remedia 2013; 23 : 266 – 269.
Štítky
Dětská kardiologie Interní lékařství Kardiochirurgie Kardiologie
Článek Improve IT změní guidelines
Článek vyšel v časopiseKardiologická revue – Interní medicína
Nejčtenější tento týden
2014 Číslo 6- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Kombinační léčba hypertenze s přihlédnutím k fixním kombinacím
- AUTORSKÁ SOUTĚŽ ČASOPISU KARDIOLOGICKÁ REVUE – INTERNÍ MEDICÍNA
- Trojkombinace v léčbě hypertenze
- Kombinační léčba perorálními antidiabetiky
- Kombinační hypolipidemická léčba
- Kombinace antikoagulační a antiagregační léčby u nemocných po infarktu myokardu indikovaných k antikoagulační léčbě – tzv. triple terapie
- Kombinační imunosupresivní léčba
- Série komplikací po srdeční transplantaci – kazuistika
- Kombinace ACE inhibitorů a sartanů – kdy je doporučena?
- Monoklonální protilátky proti PCSK9 v léčbě dyslipidemií
- Improve IT změní guidelines
- Choroby aorty – diagnostika, klasifikácia a princípy manažmentu
- Genotypově‑fenotypové korelace a stratifikace rizika náhlé srdeční smrti u familiární hypertrofické kardiomyopatie – kazuistika
- Kardiovaskulární rehabilitace u pacientů po akutní koronární příhodě
- Penetrující poranění srdce – přehled
- Dapagliflozin cílí na adaptaci – je čas adaptovat i poučky o glykosurii
- Kardiologická revue – Interní medicína
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Choroby aorty – diagnostika, klasifikácia a princípy manažmentu
- Kombinace antikoagulační a antiagregační léčby u nemocných po infarktu myokardu indikovaných k antikoagulační léčbě – tzv. triple terapie
- Trojkombinace v léčbě hypertenze
- Kombinace ACE inhibitorů a sartanů – kdy je doporučena?
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



