-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Hluboká žilní trombóza a plicní embolie v geriatrické medicíně – dvě strany jedné mince
Deep venous thrombosis and pulmonary embolism in geriatric medicine – two sides of the same coin
The patients of advanced age whose number has been growing represent a highly heterogeneous group with very different health problems and miscellaneous clinical characteristics of many very often totally different diseases. Pulmonary embolism in the elderly represents immediate threat of life. Especially in old age clinical signs of pulmonary embolism are non-specific and could be both underdiagnosed and overdiagnosed. Optimal intensive treatment of the elderly should remove symptoms of the disease, achieve sufficient compensation of somatic status and prevent from complications. Their course of pulmonary embolism is more difficult and severe with higher mortality in comparison to younger people. In very old people with frailty and geriatric giants pulmonary embolism is relatively often occasional finding as cause for the death by obduction without any previous clinical symptoms. Thrombembolism is the most common cause of sudden death, and a major cause of morbidity, in later life. The incidence of venous thrombembolism increases exponentially with age. Since the inpatient mortality in general hospitals is about 10%, it is estimated that about 1% of patients admitted to the hospital die of pulmonary embolism. However, for every patient who dies of pulmonary embolism in a surgical ward, three die in nonsurgical wards. In the great majority of patients dying of pulmonary embolism, previous venous thrombembolism was not diagnosed or treated.
Keywords:
advanced age – multi-morbidity – pulmonary embolism – deep venous thrombosis – diagnostics – therapy
Autoři: P. Weber; D. Weberová; P. Ambrošová; H. Meluzínová; K. Bielaková; H. Matějovská Kubešová
Působiště autorů: Klinika interní, geriatrie a praktického lékařství LF MU a FN Brno-Bohunice
Vyšlo v časopise: Kardiol Rev Int Med 2012, 14(1): 17-21
Souhrn
Pacienti vyššího věku, jejichž počet neustále stoupá, tvoří značně heterogenní skupinu s velmi odlišnými zdravotními problémy a různorodou klinickou symptomatologií mnoha často zcela odlišných chorob. Plicní embolie ve stáří představuje bezprostřední ohrožení života. Zejména v pozdním stáří jsou klinické příznaky plicní embolie nespecifické a mohou být diagnostikovány jak nadměrně, tak i nedostatečně. Optimální intenzivní terapie plicní embolie u seniorů by měla vést k vymizení symptomů, dosažení přiměřené stabilizace somatického stavu a profylaxi komplikací. Průběh plicní embolie u multimorbidních seniorů je těžší, spojený s vyšší mortalitou ve srovnání s mladšími. V pozdním stáří u nemocných se syndromem stařecké křehkosti a rozvinutými geriatrickými syndromy bývá plicní embolie relativně častým náhodným nálezem při pitvě bez jakýchkoli předchozích klinických příznaků. Tromboembolická nemoc je běžnou příčinou vysoké morbidity a náhlé smrti v pozdním stáří a její výskyt roste exponenciálně s věkem. S ohledem na fakt, že asi 10 % hospitalizovaných nemocných ve všeobecných nemocnicích má plicní embolii, se odhaduje, že až 1 % přijatých pacientů na ni zemře. Na jednoho nemocného zemřelého na chirurgických oborech na plicní embolii připadá až trojnásobek na interních lůžkách. Ve většině případů úmrtí na plicní embolii přitom tromboembolická nemoc nebyla diagnostikována ani léčena.
Klíčová slova:
vysoké stáří – multimorbidita – plicní embolie – hluboká žilní trombóza – diagnostika – terapieÚvod
Nozologické jednotky, jakými jsou hluboká žilní trombóza (HŽT) a plicní embolie (PE), představují vzájemně nedělitelné kontinuum – žilní tromboembolickou nemoc (TEN), což má zásadní význam pro starší pacienty a představuje faktickou výzvu jak v diagnostice, tak i terapii pro lékaře pečující o nemocné jakéhokoli věku [1,2]. Z mnoha důvodů se výskyt jak HŽT, tak i PE zvyšuje s věkem [3]. Dochází k poklesu svaloviny dolních končetin postupně zhoršujícímu cirkulaci a vedoucí až ke stáze. Tím se okolo 60 let zvyšuje náchylnost k rozvoji trombózy [4], která může ve skupině nad 85 let postihovat až 20 % osob. Dochází k většímu postižení cévní stěny a hyperkoagulačním stavům.
Diagnostika žilního tromboembolizmu – tromboembolické nemoci (TEN) u seniorů je obtížná, ačkoli klinický obraz je obvykle velmi podobný mladším věkovým skupinám [5–7]. PE a HŽT přitom představují běžně se vyskytující problém u starších pacientů [8]. Oba stavy se zhoršují s věkem, vliv rasy a pohlaví je malý. Současná léčba se zdá být účinná jak v prevenci PE u HŽT, tak i v prevenci recidiv PE. Oba stavy jsou spojeny se značnou jednoletou mortalitou, což naznačuje, že je třeba správně vnímat rizikové faktory TEN a koincidující situace zvyšující jejich výskyt, stejně jako indikace správné profylaxe a metody léčby [5]. Gangireddy et al [9] popisují jako předoperační rizikové faktory spojené s TEN vyšší věk, mužské pohlaví, léčbu kortikosteroidy, chronickou obstrukční plicní nemoc (CHOPN), nedávný úbytek na váze, generalizaci malignit, nízký albumin a nízký hematokrit, ale nikoli diabetes mellitus. Pacienti s nízkou pravděpodobností PE mají obecně lepší prognózu ve srovnání s těmi, u nichž jsou přítomny uvedené rizikové faktory [10]. Izolovaně má přítomnost zmiňovaných rizik jen omezenou diagnostickou hodnotu.
Hlavní diagnostická strategie [11] vyžaduje od kliniků, aby u seniorů byli ve stálém podezření z obavy, že oligosymptomatičtí, případně asymptomatičtí senioři mohou mít i při banálních potížích PE i při normálních laboratorních nálezech a diagnóza je učiněna nejednou až post mortem. Zároveň představuje PE jedno z nejméně často správně diagnostikovaných kardiovaskulárních onemocnění [2]. Vždy přitom jde o medicínsky urgentní stav, protože velké embolie, někdy i mnoho menších opakovaných, mohou být fatální v krátké době.
Plicní embolie – ve vyšším věku
Vzhledem k tomu, že příznaky a projevy PE jsou nespecifické, může být PE jak nadměrně, tak i nedostatečně diagnostikována, a to zejména u starších lidí. Chybnou diagnostikou bývají ohroženi zejména senioři se současnými oběhovými a dechovými potížemi [12–14]. Standardní diagnostický a terapeutický přístup představují zásadní přínos v postupech u TEN seniorů [12].
Prvním předpokladem správné diagnostiky je pečlivé fyzikální vyšetření k posouzení možnosti jiných diagnóz, jako například srdeční selhání, ischemická choroba srdeční, tumory a infekce, které jsou časté u starších osob a mohou být občas zaměňovány s PE.
Za nejčastější a závažnou chybu lze považovat, když diagnóza PE není zvažována klinicky, a je náhodným nálezem při pitvě. Pleurální změny a možná i některé místní změny symetrie v prokrvení na RTG hrudníku lze odhalit, pokud je dobře prohlédnut. Běžně bývá normální skiagram hrudníku i u těžce nemocného pacienta.
Etiologie
Klid na lůžku a imobilizace představují největší riziko pro vznik HŽT. Určitá onemocnění, jež jsou běžná u starších (např. traumata cév dolních končetin, obezita [15], srdeční selhání, malignity, zlomeniny kyčle, myeloproliferativní onemocnění), zvyšují náchylnost k HŽT, stejně jako kouření, užívání estrogenů [16,17], terapie tamoxifenem, žilní katetr ve vena femoralis a chirurgické zákroky [15]. Rizikové faktory pro HŽT představují poranění cévní stěny, žilní stázy a všechny prokoagulační stavy, včetně vzácných nedostatků antitrombinu III, proteinu C a proteinu S, stejně jako diseminovaná intravaskulární koagulace, polycytemia vera nebo přítomnost antifosfolipidových protilátek. Stárnutí je spojeno se zvýšenou koagulací a produkty fibrinolýzy, což celkově vede k trombofilnímu stavu. Asi 90 % krevních sraženin, které způsobují PE, pochází z dolních končetin. Riziko, že trombus bude embolizovat a dostane se do plicního řečiště, je větší v případě, že se nalézá v podkolenní nebo iliofemorální žíle (cca 50 %), než v případě, že je pouze v bércových žilách (< 5 %). Méně obvyklá místa trombózy, která může vést k PE, jsou pravá síň, pravá komora a žíly pánevní, ledvin, jater, v. subclavia a krční žíly (asi 10 %) [1,2].
Symptomatologie
Klasická triáda: hemoptýza, pleurální bolest na hrudi a klinicky zjevná tromboflebitida jsou nalézány u seniorů spíše sporadicky, odhaduje se, že méně než v 10 % s TEN [6]. Polovina lidí, kteří mají PE, nemá žádné příznaky. S přibývajícím věkem roste množství jedinců s asymptomatickou PE. Přitom PE představuje po infarktu myokardu a cévní mozkové příhodě třetí nejčastější kardiovaskulární příčinu smrti [5].
U starších pacientů bývají nejčastějšími příznaky zrychlené dýchání (dechová frekvence > 16 dechů/min), dušnost, bolesti na hrudi (pleuritická), úzkost, bolesti nohou nebo otoky, hemoptýza a synkopa. Pacienti, kteří mají drobné tromboemboly, mohou být asymptomatičtí nebo mají zcela atypické příznaky. Nespecifické příznaky svědčící pro PE ve stáří jsou přetrvávající zvýšená teplota, alterace duševního stavu (delirium) nebo klinický obraz, který napodobuje infekci dýchacích cest. U pacientů s PE [18] se obvykle projevují jedním z následujících příznaků:
- diagnosticky matoucí syndromy (zmatenost, nevysvětlitelná horečka, dušnost, refrakterní srdeční selhání, nevysvětlitelné arytmie),
- přechodná dušnost a tachypnoe,
- plicní infarkt (pleuritická bolest, kašel, hemoptýza, pleurální výpotek, plicní infiltrát),
- pravostranné srdeční selhání spolu s dušností a tachypnoí druhotně při PE,
- oběhové selhání s hypotenzí a synkopou; méně než 20 % starších pacientů má klasickou triádu dušnosti, bolesti na hrudi a hemoptýzy; pokud chybí tachypnoe a související hypokapnie (nízký paCO2), PE je nepravděpodobná.
Nejčastější fyzikální nálezy u PE ve stáří bývají tachypnoe, tachykardie, horečka, otoky dolních končetin nebo citlivost, cyanóza a pleurální tření. I když většina starších pacientů s PE má HŽT jako první zdroj embolu, pouze u třetiny jsou přítomny klinické příznaky HŽT nohou.
Asi 1/3 starších pacientů s PE má pleurální výpotek, který je obvykle jednostranný. U 2/3 z nich bývají výpotky hemoragické. Tyto pleurální výpotky obecně mají plicní infiltrát na RTG hrudníku, který naznačuje konsolidaci plicního parenchymu. Infiltrace obvykle vymizí během několika dnů. Asi u 10 % pacientů s PE, zejména s těžkým srdečním selháním, se rozvine plicní infarkt.
Synkopa, systolický krevní tlak < 100 mmHg nebo výrazně snížený systolický krevní tlak u hypertoniků naznačují možnost masivní PE nebo u pacientů se sníženou kardiopulmonální rezervou poukazují na významný embolus. Normální tlak v pravé síni nebo komoře u pacientů s hypotenzí mluví proti PE jako příčině změny klinického stavu.
Diagnostika
Důležité pro volbu dalších diagnostických vyšetření je zohlednit pravděpodobnost PE v hodnotících škálách [10]. Klinická pravděpodobnost PE podle skórovacích systémů (Wellsovo a Ženevské skóre – tab. 1 a 2) dělí nemocné do skupin s nízkým, středním a vysokým rizikem PE [5]. Pravděpodobnost PE odvozená z těchto skórovacích systémů nám může naznačit potřebu dalších zobrazovacích a laboratorních vyšetření.
Tab. 1. Wellsovo klinické predikční skóre. 
Tab. 2. Revidované Ženevské skóre. 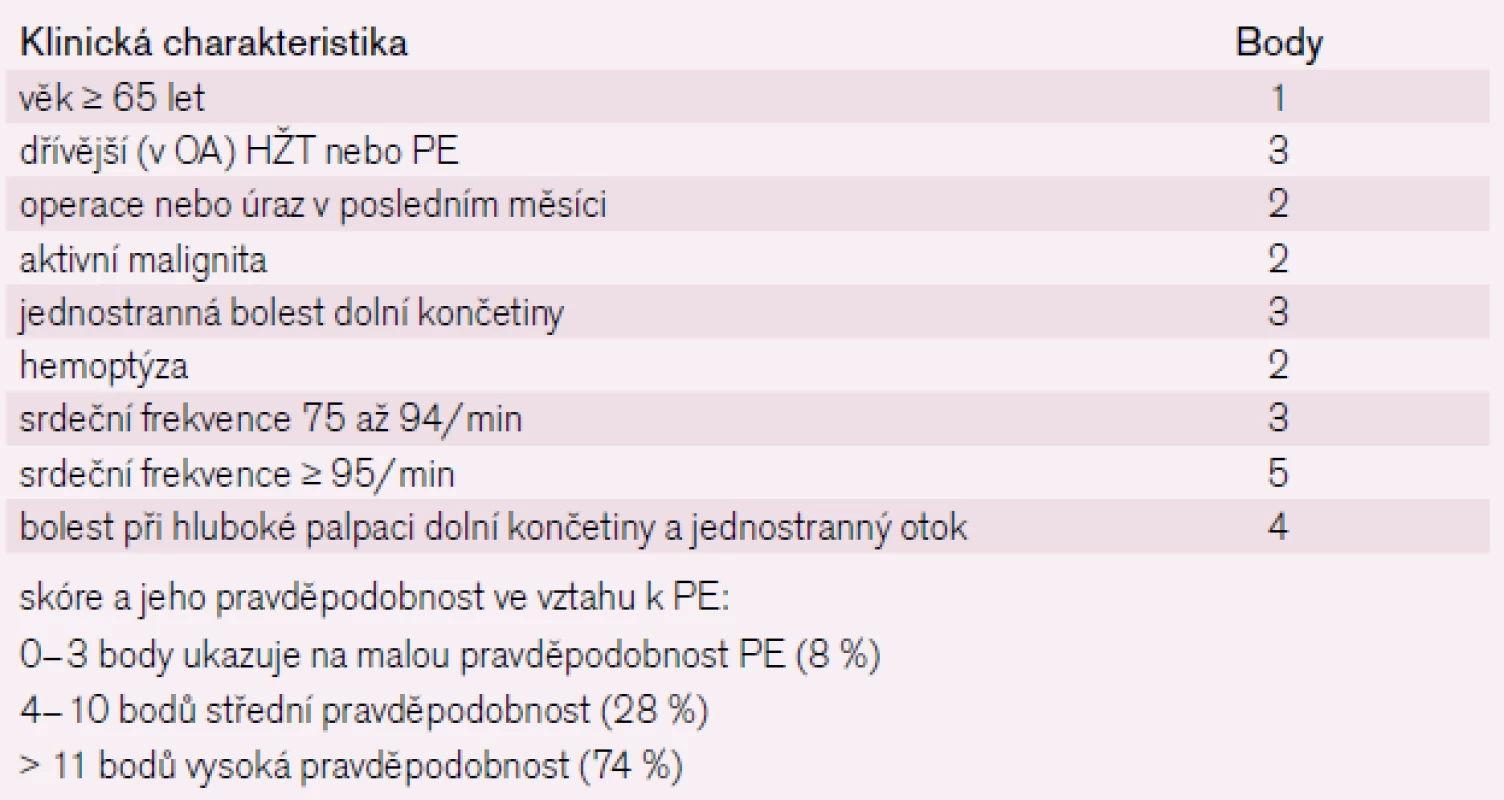
Toto hodnocení v kombinaci s výsledkem ventilačně-perfuzního scanu nebo spirálního CT hrudníku určí, zda je třeba dále vyšetřovat [19]. ECHO kardiografie nás upozorní na vzniklou dysfunkci pravé komory.
Velmi užitečná a jednoduchá pro diagnostiku PE v každodenní klinické praxi u starších pacientů je kombinace klinického předběžného skórovacího systému pravděpodobností a hladiny D-dimerů [20], případně doplnění vyšetření dalšími neinvazivními zobrazovacími metodami a stanovením biomarkerů. Ve VIDAS studii kombinace negativních D-dimerů a nezvýšené pravděpodobnostní předběžné testy účinně a bezpečně vylučuje PE u významné části ambulantních pacientů s podezřením na PE [21].
Pomocná a laboratorní vyšetření
Rentgen plic, EKG a tepenné hodnoty krevních plynů je třeba vždy vyšetřit. Pokud je PE považována za pravděpodobnou, je dalším krokem obvykle provedení ventilačně-perfuzního scanu. Pokud je nález plicního scanu nejednoznačný (např. pro základní plicní onemocnění), bude užitečné spirální CT vyšetření hrudníku. Vyšetření na HŽT žil dolních končetin ultrasonograficky poukazuje na potřebu antikoagulační terapie a obvykle eliminuje potřebu dalšího vyšetřování na PE. Zlatý standard v diagnostice PE představuje plicní angiografie.
RTG hrudníku: Může být normální nebo ukazovat jen nespecifické abnormality, např. atelektázu jednostrannou elevaci bránice, pleurální výpotek nebo plicní infiltrát. EKG: EKG nálezy jsou obvykle rovněž nespecifické, 33 % pacientů s PE má normální EKG křivku.
BNP (brain natriuretic peptid) a echokardiografie mohou být také užitečnými vyšetřeními v časném období u pacientů s PE [22]. Biomarkery mohou také zlepšit stratifikaci rizika nemocných s PE [23].
D-dimery: Hladiny D-dimerů (fibrin-specifický produkt) bývají zvýšené u pacientů s akutní trombózou [24,25]. Asi 60 % pacientů < 50 let, kteří mají podezření na PE, má i abnormální D-dimery. Oproti tomu 92 % pacientů > 70 roků má zvýšené hladiny D-dimerů – pravděpodobně díky komorbiditám [26]. Proto je-li výsledek D-dimerů negativní, je nepravděpodobné, že by se mohlo jednat o HŽT nebo PE. Jejich pozitivní výsledky u osob nad 70 let mají jen malou výpovědní hodnotu.
Použití D-dimerů jako sekundární metody k vyloučení HŽT je obecně doporučováno pro jeho vysokou senzitivitu při současně nízké specificitě. Falešně pozitivní hodnoty D-dimerů se mohou vyskytnout u pacientů s nedávným traumatem, chirurgickým zákrokem, malignitou, těhotenstvím, těžkou infekcí a onemocněním jater.
Prognóza
Mortalita hospitalizovaných pacientů > 65 s PE je 21 %. Pokud je PE hlavní (jedinou) diagnózou, činí úmrtnost 13 %. Pokud se jedná o sekundární diagnózu, dosahuje letalita až 31 %. Mnoho onemocnění a syndromů – včetně srdečního selhání, CHOPN, tumorů, infarktu myokardu, cévní mozkové příhody a zlomenin – výrazně zvyšuje riziko úmrtí u hospitalizovaných pacientů > 65 s PE. Nejhorší prognóza je u pacientů s těžkým srdečním nebo plicním onemocněním.
U pacientů > 65 let s PE je riziko recidivy v prvním roce 8 % a jednoletá mortalita činí 39 % (21% mortalita u hospitalizovaných a dalších 18 % připadá na úmrtnost během prvního roku po PE). U starších pacientů s HŽT, ale bez PE činí mortalita 21 % během prvního roku po PE.
Pitevní studie ve Velké Británii [27] a Švédsku [3,28] popisují vysoký výskyt PE jako hlavní příčiny úmrtí asi u 10 % pitvaných. Protože mortalita u hospitalizovaných nemocných v nemocnicích všeobecného zaměření činí okolo 10 %, odhaduje se, že asi 1 % pacientů přijatých do nemocnice zemře na PE. Na každého pacienta, který zemře na PE na chirurgických oborech, připadají tři úmrtí na PE na interních odděleních. Závažný je zejména fakt, že mortalita u pacientů nad 65 let s prokázanou PE byla 21 % ve studii Prospective Investigation of Pulmonary Embolism Diagnosis [29] a v jednoleté mortalitní studii činila až 39 % [30]. Někteří autoři [31] naznačují, že tato čísla mohou být ještě vyšší, než se předpokládá.
Léčba
Plicní embolektomie u starších pacientů bude výjimečným, ne příliš doporučovaným řešením, protože má velmi nízkou míru úspěšnosti a konzervativní medikamentózní terapie je obecně velmi efektivní. Tyto postupy by měly být pravidelnou součástí geriatrického armamentária.
Trombolytická terapie (fibrinolytika) by měla být vždy zvážena a individuálně posouzena u pacientů s HŽT v iliofemorální oblasti. Ta je také efektivní u pacientů s masivní PE, kteří mají významnou plicní hypertenzi, obstrukci více segmentů plicní cirkulace, dysfunkci pravé komory či systémovou hypotenzi [32].
Heparin brání tvorbě a růstu trombu. Protože riziko úmrtí na PE je nejvyšší v prvních několika hodinách tvorby trombu (8–12 hod), tedy v době, kdy často výsledky vyšetření nejsou k dispozici, měl by být heparin podáván pacientům se střední až vysokou klinickou pravděpodobností PE nebo HŽT, dokud všechna diagnostická vyšetření nejsou dokončena. Přednost je dávána nízkomolekulárnímu heparinu (low molecular weight heparin – LMWH) před nefrakcionovaným heparinem (UFH). LMWH může být podáván subkutánně jednou nebo dvakrát denně je vhodné kontrolovat antiXa a krevní obraz (trombocyty).
Léčba heparinem a warfarinem bude představovat zavedené a osvědčené metody. Dlouhodobá antikoagulace je zahajována obvykle v nemocnici heparinem a pokračuje po propuštění warfarinem. Stále však v této indikaci zůstává nezodpovězenou otázkou délka případné antikoagulační terapie.
Profylaxe
Profylaxe LMWH snižuje výskyt fatální PE o dvě třetiny u hospitalizovaných pacientů s rizikem vzniku HŽT [33,34]. Ta je u PE nesmírně důležitá, protože TEN je nejen obtížně detekovatelná, ale představuje i nadměrnou zátěž zdravotní a ekonomickou [35]. Nefarmakologická a medikamentózní opatření jsou často efektivní v její prevenci. Pacienti, kteří podstoupili totální náhrady kyčelního kloubu, kolenního kloubu nebo operaci karcinomu, budou profitovat z rozšířené farmakologické profylaxe po dobu čtyř až šesti týdnů, zejména s LMWH nebo UFH asi ve dvou ze tří případů TEN [33,36].
Výskyt tromboembolických komplikací je nejvyšší v perioperačním období. Odhaduje se, že u 20–30 % pacientů podstupujících všeobecně chirurgické zákroky se objevuje HŽT, z toho až 40 % u operací kyčlí a kolen, onkogynekologických operací, otevřené prostatektomie a hlavních neurochirurgických postupů. I když fatální PE se vyskytuje u 1–5 % všech operovaných pacientů, ve středním věku a u seniorů tvoří větší díl pooperačních úmrtí. Vzhledem k tomu, že HŽT i PE v séniu mohou být obtížně diagnostikovatelné i léčitelné, je značné úsilí zaměřeno na prevenci.
U pacientů s vysokým rizikem TEN jsou indikována nefarmakologická a medikamentózní opatření. Kvalitní kompresivní punčochy a zařízení pro pneumatickou kompresi doplňuje podávání minidávek nefrakcionovaného heparinu (5 000 jednotek subkutánně dvakrát nebo lépe třikrát denně), LMWH, warfarinu nebo přímého inhibitoru trombinu (např. dabigatran).
Závěr
Přístup ke starším pacientům by měl být důsledně individuální. Nové diagnostické metody a terapeutické algoritmy používané na akutních interních a geriatrických odděleních společně umožňují léčit úspěšně i multimorbidní hospitalizované pacienty, a to i v pokročilém věku. Moderní technické přístupy a terapeutické intervence umožňují i léčbu v pozdním stáří (včetně úzdravy) a ochranu soběstačnosti a zachování kvality života ve stáří u akutně nemocných seniorů.
Lékaři pečující o seniory se často potýkají s problematikou diagnostiky TEN v nejširším slova smyslu kvůli jejímu vyššímu výskytu v séniu, komorbiditám, mikro - nebo oligosymptomatologii a přetížení různými doporučeními [37].
Chtěli bychom zdůraznit neustálou potřebu myslet na možnost PE u starších osob s rizikovými faktory a s ohledem na ni používat předběžné diagnostické škály pravděpodobnosti rozsahu PE, jakými jsou Wellsovo nebo Ženevské skóre, co možná nejdříve [20,21].
Všeobecně se v literatuře uvádí, že spojení věku s rizikem krvácení po heparinu nebo warfarinu je mírné a kontrastuje se silným, konzistentním nálezem exponenciálního růstu rizika TEN s věkem [32,33]. V geriatrické medicíně je třeba brát v úvahu několik praktických důvodů pro předpis perorálních antikoagulancií [1,5,6]:
- Citlivost na antikoagulancia se zvyšuje s věkem (tj. je vhodné snížení denní dávky warfarinu).
- Polyfarmakoterapie (včetně sebeléčby) zvyšuje riziko lékových interakcí, které ovlivňují antikoagulační účinek nebo zvyšují riziko krvácení (tj. kyselina acetylsalicylová a NSAD).
- Zvýšený výskyt dalších současně se vyskytujících onemocnění rovněž zvyšuje riziko krvácení (např. těžká anémie, selhání ledvin, gastrointestinální krvácení, hemoragická cévní mozková příhoda, krvácivé stavy).
- Snížená compliance nebo zhoršený přístup k monitoringu – ať už prováděné praktickým lékařem nebo na nemocničních odděleních – také zvyšují riziko krvácení.
Doručeno do redakce 20. 12. 2011
Přijato po recenzi 3. 1. 2012
prof. MUDr. Pavel Weber, CSc.
MUDr. Dana Weberová
MUDr. Petronela Ambrošová
MUDr. Hana Meluzínová
MUDr. Katarína Bielaková
prof. MUDr. Hana Matějovská Kubešová, CSc.
Klinika interní, geriatrie a praktického lékařství LF MU a FN Brno-Bohunice
p.weber@fnbrno.cz
Zdroje
1. Beers MH, Thomas VJ, Jones TV (eds). The Merck Manual of Geriatrics. 7th ed. New York: Merck & Co 2006.
2. Braunwald E, Zipes DP, Libby P (eds). Heart Disease, a Textbook of Cardiovascular Medicine. 7th ed. Philadelphia: W. B. Saunders Comp. 2005.
3. Hansson PO, Welin L, Tibblin G et al. Deep vein thrombosis and pulmonary embolism in the general population. ‚The Study of Men Born in 1913‘. Arch Intern Med 1997; 157 : 1665–1670.
4. Price DT, Ridken PM. Factor V Leiden mutation and the risks for thromboembolic disease: a clinical perspective. Ann Intern Med 1997; 127 : 895–903.
5. Pathy MSJ, Sinclair AJ, Morley JE (eds). Principles and practice of geriatric medicine. 4th. ed. Chichester, UK: Wiley 2006.
6. Blackburn JA, Dulmus CN (eds). Handbook of gerontology: evidence-based approaches to theory, practice, and policy. New York: Hoboken, N. J. Wiley 2007.
7. Matějovská Kubešová H et al (eds). Akutní stavy v geriatrii, Praha: Galén 2009.
8. Kniffin WD Jr, Baron JA, Barrett J et al. The epidemiology of diagnosed pulmonary embolism and deep venous thrombosis in the elderly. Arch Intern Med 1994; 154 : 861–866.
9. Gangireddy C, Rectenwald JR, Upchurch GR et al. Risk factors and clinical impact of postoperative symptomatic venous thromboembolism. J Vasc Surg 2007; 45 : 335–341.
10. Bertoletti L, Le Gal G, Aujesky D et al. Prognostic value of the Geneva prediction rule in patients in whom pulmonary embolism is ruled out. J Intern Med 2011; 269 : 433–440.
11. Wells PS, Ginsberg JS, Andersen DR. Use of a clinical model for safe management of patients with pulmonary embolism. Ann Intern Med 1998; 129 : 997–1005.
12. Kalvach Z, Zadák Z, Jirák R et al (eds). Geriatrie a gerontologie. Praha: Grada Publishing a.s. 2004.
13. Topinková E. Geriatrie pro praxi. Praha: Galén 2005.
14. Gřiva M, Náplava R, Hlinomaz O. Chyby v diagnostice a léčbě akutních forem ischemické choroby srdeční. Kardiol Rev 2009; 11 : 48–53.
15. Barba R, Zapatero A, Losa JE et al. Riete Investigators. Body mass index and mortality in patients with acute venous thromboembolism: findings from the RIETE registry. J Thromb Haemost 2008; 6 : 595–600.
16. LaCroix AZ, Chlebowski RT, Manson JE et al. Health outcomes after stopping conjugated equine estrogens among postmenopausal women with prior hysterectomy: a randomized controlled trial. JAMA 2011; 305 : 1305–1314.
17. Sare GM, Gray LJ, Bath PM. Association between hormone replacement therapy and subsequent arterial and venous vascular events: a meta-analysis. Eur Heart J 2008; 29 : 2031–2041.
18. West J, Goodacre S, Sampson F. The value of clinical features in the diagnosis of acute pulmonary embolism: systematic review and meta-analysis. QJM 2007; 100 : 763–769.
19. Chlumský J, Charvát J. Plicní embolie. Prakt Lék 2007; 87 : 456–460.
20. Pasha SM, Klok FA, Snoep JD et al. Safety of excluding acute pulmonary embolism based on an unlikely clinical probability by the Wells rule and normal D-dimer concentration: a meta-analysis. Thromb Res 2010; 125 : 123–127.
21. Carrier M, Righini M, Djurabi RK et al. VIDAS D-dimer in combination with clinical pre-test probability to rule out pulmonary embolism. A systematic review of management outcome studies. Thromb Haemost 2009; 101 : 886–892.
22. Sanchez O, Trinquart L, Caille V et al. Prognostic factors for pulmonary embolism: the prep study, a prospective multicenter cohort study. Am J Respir Crit Care Med 2010; 181 : 168–173.
23. Widimský J. Biomarkery u akutní plicní embolie. Interv Akut Kardiol 2011; 10 : 102–108.
24. Douma RA, le Gal G, Söhne M et al. Potential of an age adjusted D-dimer cut-off value to improve the exclusion of pulmonary embolism in older patients: a retrospective analysis of three large cohorts. BMJ 2010; 340: c 1475.
25. Kabrhel C, Mark Courtney D, Camargo CA Jr et al. Factors associated with positive D-dimer results in patients evaluated for pulmonary embolism. Acad Emerg Med 2010; 17 : 589–597.
26. Douketis J, Tosetto A, Marcucci M et al. Patient--level meta-analysis: effect of measurement timing, threshold, and patient age on ability of D-dimer testing to assess recurrence risk after unprovoked venous thromboembolism. Ann Intern Med 2010; 153 : 523–531.
27. Alikhan R, Peters F, Wilmott R et al. Fatal pulmonary embolism in hospitalised patients: a necropsy review. J Clin Pathol 2006; 57 : 1254–1257.
28. Nordström M, Lindblad B. Autopsy-verified venous thromboembolism within a defined urban population – the city of Malmö, Sweden. APMIS 1998; 106 : 378–384.
29. Value of the ventilation/perfusion scan in acute pulmonary embolism: results of the prospective investigation of pulmonary embolism diagnosis (PIOPED). The PIOPED Investigators. JAMA 1990; 263 : 2753–2759.
30. Stein PD, Gottschalk A, Sostman HD et al. Methods of Prospective Investigation of Pulmonary Embolism Diagnosis III (PIOPED III). Semin Nucl Med 2008; 38 : 462–470.
31. Heit JA, Silverstein MD, Mohr DN et al. Predictors of survival after deep vein thrombosis and pulmonary embolism: a population-based cohort study. Arch Intern Med 1999; 159 : 445–456.
32. Janoušek S. Trombolytická léčba akutní plicní embolie. Interv Akut Kardiol 2008; 7 : 184–186.
33. Bottaro FJ, Elizondo MC, Doti C et al. Efficacy of extended thrombo-prophylaxis in major abdominal surgery: what does the evidence show? A meta-analysis. Thromb Haemost 2008; 99 : 1104–1111.
34. Kanaan AO, Silva MA, Donovan JL et al. Meta-analysis of venous thromboembolism prophylaxis in medically Ill patients. Clin Ther 2007; 29 : 2395–2405.
35. Kakkar VV, Balibrea JL, Martínez-González J et al. CANBESURE Study Group. Extended prophylaxis with bemiparin for the prevention of venous thromboembolism after abdominal or pelvic surgery for cancer: the CANBESURE randomized study. J Thromb Haemost 2010; 8 : 1223–1229.
36. Reynolds MW, Shibata A, Zhao S et al. Impact of clinical trial design and execution-related factors on incidence of thromboembolic events in cancer patients: a systematic review and meta-analysis. Curr Med Res Opin 2008; 24 : 497–505.
37. Siccama RN, Janssen KJ, Verheijden NA et al. Systematic review: diagnostic accuracy of clinical decision rules for venous thromboembolism in elderly. Ageing Res Rev 2011; 10 : 304–313.
Štítky
Dětská kardiologie Interní lékařství Kardiochirurgie Kardiologie
Článek Primum non nocereČlánek Několik slov úvodem…Článek Dyslipidemie v roce 2012Článek Galerie autorů
Článek vyšel v časopiseKardiologická revue – Interní medicína
Nejčtenější tento týden
2012 Číslo 1- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Primum non nocere
- Vitamin D a kardiovaskulární choroby
- Subklinické poškození mozku u starších pacientů s hypertenzí a demence
- Hluboká žilní trombóza a plicní embolie v geriatrické medicíně – dvě strany jedné mince
- Nové postupy v antikoagulační léčbě u seniorů s fibrilací síní
- Komplikace kardiostimulace u starších nemocných
- Komplikácie infrainguinálnych revaskularizačných výkonov u pacientov v geriatrickom veku
- Dyslipidemie v roce 2012
- Atherosclerosis of the intracranial arteries – current view, 2nd part
- Nezvyklá diagnostika perforace pravé komory defibrilační elektrodou
- Novinky z American Heart Association 2011
- Zemřel MUDr. Jaroslav Ulrich, CSc.
- Galerie autorů
- Několik slov úvodem…
- Kardiologická revue – Interní medicína
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Komplikace kardiostimulace u starších nemocných
- Vitamin D a kardiovaskulární choroby
- Hluboká žilní trombóza a plicní embolie v geriatrické medicíně – dvě strany jedné mince
- Nové postupy v antikoagulační léčbě u seniorů s fibrilací síní
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



