-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Katetrizační ablace síňových tachyarytmií: které pacienty indikovat a jak o ně následně pečovat
Catheter ablation for atrial tachyarrhythmias: which patients are indicated for the procedure and what is the follow-up care?
Atrial fi brillation is undoubtedly the most frequent heart rate disorder. The prevalence of this type of arrhythmia in general population is estimated to exceed 1 % and its incidence increases with age. The vast medical and socioeconomic implications of this problem are also accentuated by the fact that arrhythmia is related to a number of clinical consequences, e. g. thromboembolic cerebrovascular accidents, congestive heart failure, cognitive dysfunction and, last but not least, increased mortality. The paper deals with the pathophysiology of atrial fibrillation and its primary focus is on the new options for its non-pharmacological treatment, especially radiofrequency catheter ablation which has become a widely used procedure in spite of having been introduced in clinical practice just a few years ago. The effect of this treatment of atrial fibrillation highly exceeds the efficiency of standard anti-arrhythmia drugs. The greatest limitation for radiofrequency ablation today is the variability of the results in the different centres performing the procedure, a relatively higher incidence of complications, and last but not least the time consuming nature of the procedure and the resulting restrictions on the number of patients getting the treatment.
Key words
atrial fibrillation – pathophysiology – radiofrequency catheter ablation
Autoři: doc. MUDr. Mgr. Alan Bulava, Ph.D.
Působiště autorů: Kardiocentrum Nemocnice České Budějovice, a. s. alanbulava@seznam. cz
Vyšlo v časopise: Kardiol Rev Int Med 2008, 10(Mimořádné): 10-16
Souhrn
Fibrilace síní je bezpochyby nejčastější poruchou rytmu. Prevalence této arytmie se v obecné populaci odhaduje na více než 1 % a roste se zvyšujícím se věkem. Medicínskou i socioekonomickou rozsáhlost tohoto problému podtrhuje skutečnost, že s arytmií je spojena řada klinických následků: tromboembolické mozkové příhody, městnavé srdeční selhání, kognitivní dysfunkce a v neposlední řadě zvýšená mortalita. V textu se zabýváme v krátkosti patofyziologií fibrilace síní a především se zaměřujeme na nové možnosti nefarmakologické léčby, zejména na radiofrekvenční katétrové ablace, které přesto že byly zavedeny do klinické praxe teprve před několika lety, dočkaly se širokého použití. Účinnost této léčby fibrilace síní podstatně převyšuje účinnost všech běžně dostupných antiarytmik. Největší limitaci radiofrekvenčních ablací lze v současné době spatřovat ve variabilitě výsledků mezi jednotlivými centry, relativně vyšším počtu komplikací a v neposlední řadě v časové náročnosti výkonu a s tím souvisejícím omezeném počtu takto léčených pacientů.
Klíčová slova
fibrilace síní – patofyziologie – radiofrekvenční katétrová ablaceÚvod
Nejčastější síňovou arytmií je fibrilace síní (FiS), proto i většina následujícího textu bude věnována této arytmii. Rostoucí počet katetrizačních ablací i kardiochirurgických MAZE zákroků pro FiS přinesl do klinické praxe další problém – iatrogenní síňové tachykardie, které vznikají díky vytvoření arytmogenního substrátu v levé síni na podkladě netransmurálních lineárních či obkružujících lézí. Část této práce bude proto věnována i této problematice.
Epidemiologie fibrilace síní
Prevalence FiS roste se zvyšujícím se věkem. V obecné populaci se pohybuje kolem 1 % a zvyšuje se od 0,1 % v populaci mladší 50 let až k 10 % v populaci osmdesátníků [1]. Pro lepší představu o zátěži populace FiS uvádíme data z Framinghamské studie: ve věku 40 let je riziko vzniku FiS do konce života 26 % pro muže a 23 % pro ženy [2]. Data z evropských prospektivních observačních studií jsou podobná: riziko vzniku FiS během života u 55letých je 24 % u mužů a 22 % u žen. Vztaženo na početnost evropské populace se pak v Evropě problémům s touto arytmií nevyhne zhruba 7−7,5 mil. lidí. Nárůst absolutního počtu populace trpící FiS v USA je na rok 2050 odhadován na více než 10−12 mil. obyvatel [3]. Medicínskou i socioekonomickou rozsáhlost tohoto problému podtrhuje skutečnost, že s arytmií je spojena řada klinických následků: tromboembolické mozkové příhody, městnavé srdeční selhání, kognitivní dysfunkce a v neposlední řadě zvýšená mortalita.
Klasifikace fibrilace síní
Nedávno byl navržen klasifikační systém FiS založený na časovém období výskytu arytmie [4]. U vyšetřovaných pacientů může být diagnostikována FiS jako:
- první záchyt arytmie
- již opakující se arytmie
Pro potřeby invazivní nefarmakologické léčby FiS radiofrekvenční katétrovou ablací byla v roce 2007 navržena nová definice typů FiS [5]:
- paroxyzmální FiS: rekurentní epizody arytmie, které se spontánně ukončují do 7 dnů
- perzistující FiS: arytmie, která se udržuje po více než 7 dnů nebo trvá dobu kratší, ale vyžaduje elektrickou nebo farmakologickou kardioverzi
- dlouhodobá perzistující FiS: arytmie trvá déle než 1 rok,
- permanentní FiS: kardioverze arytmie se nezdařila nebo o ni nebyl učiněn pokus
Spouštěče a udržovače fibrilace síní
Ve své podstatě představuje FiS rychlou a asynchronní aktivaci síňového myokardu. Tato arytmie může být spuštěna salvou rychlé ektopické aktivity, tzv. spouštěči (z angl. triggers), ale ke svému udržení vyžaduje i určité změny v architektuře síní – nejčastěji dilataci, fibrózu, zóny lokálního bloku vedení či prodlouženého vedení apod. Tyto predispozice souhrnně nazýváme arytmogenní substrát [6]. Individuální rozdíly s ohledem na množství spouštěčů či přítomnost vulnerabilního substrátu jsou zřejmě podstatou širokého spektra symptomů, které můžeme u FiS pozorovat. Časná manifestace triggerů zahrnuje frekventní síňovou ektopii, většinou pocházející z jednoho místa, a může progredovat do repetitivních salv síňové tachykardie. Jak se substrát vyvíjí, paroxyzmy se stávají stále frekventnější, delší a finálně vedou k perzistující arytmii, která naopak vede k elektrické a strukturální remodelaci fixující arytmii (fibrilace plodí fibrilaci).
Ektopická aktivita je podněcována dysfunkcí sinusového uzlu, neurohumorální aktivací a intracelulárním přetížením kalciem. První práce potvrzující důležitost ektopické aktivity (fokálních triggerů) pocházejících z plicních žil, která je zodpovědná za spuštění FiS, byla práce Haissaguerreho et al z Bordeaux [7], jež byla později následována řadou dalších potvrzujících publikací [8–11]. FiS tedy může být spuštěna a minimálně v řadě případů i udržena fokální ektopickou aktivitou atriální tkáně lokalizované v rukávcích kolem plicních žil. Četné výboje elektrické aktivity z plicních žil mohou způsobit vznik déletrvajících, rychlých reentrantních okruhů, tzv. rotorů v plicních žilách nebo ve svalovině síní. Zatímco role ektopie z plicních žil v genezi FiS je dobře zdokumentována, faktory, které vedou k náchylnosti síní ke vzniku fibrilace při četné ektopii, jsou již méně jasné. Elektrická remodelace, zejména pak zkráceníefektivní refrakterní periody v levé síni, je pravděpodobně nejdůležitější.
Techniky radiofrekvenčních ablací pro fibrilaci síní
Fokální radiofrekvenční ablace
Rozvoj radiofrekvenčních katétrových ablací (RFA) přinesl do oblasti poznání patofyziologie FiS obrovský pokrok. V roce 1994 Haissaguerre et al referovali o úspěšném odstranění paroxyzmů FiS u 3 pacientů lokalizací a následnou ablací fokálního spouštěče v pravé síni [12]. Tatáž skupina autorů pak na malé sérii pacientů publikovala existenci takovýchto fokusů i v ústí plicních žil v levé síni [13]. Přelomovou publikací byla opět práce Haissaguerreho z roku 1998, v níž na souboru 45 pacientů s paroxyzmální FiS autoři ukázali, že 94 % fokusů lokálně spouštějících tuto arytmii je lokalizováno v plicních žilách [7].
Fokální RFA triggerů v plicních žilách byla brzy jako metoda opuštěna, a to především pro své limitace a relativně nízkou úspěšnost. V prvé řadě je kriticky závislá na přítomnosti ektopie během samého výkonu, protože jinak se nedá efektivně mapovat a cílit. Dále nelze vyloučit možnou přítomnost jiných fokálních zdrojů, v době ablační procedury klinicky němých, které mohou být zodpovědné za další paroxyzmy FiS v postablačním období. V neposlední řadě fokální ablace, které byly cíleny na ektopické ložisko v plicní žíle, byly zodpovědné za relativně vyšší procento žilních stenóz [14].
Segmentární ostiální izolace plicních žil
Poznání limitací fokálních RFA vedlo k rychlému rozšíření techniky empirické segmentární ostiální izolace plicních žil. Do plicní žíly je v místě venoatriální junkce nebo těsně za ní umístěn cirkulární mapovací katétr, který nahrává elektrickou aktivitu z plicní žíly a kolem ústí plicní žíly je ze síňové strany vytvořena řada ablačních lézí s cílem eliminace těchto potenciálů (obr. 1). Výhodou této procedury je jasný cíl: vytvoření bidirekčního bloku vedení, tj. elektrické izolace. Klinické studie ukazují, že úspěšnost tohoto přístupu u pacientů s paroxyzmální FiS je kolem 70 %, zatímco u perzistujících/permanentních forem arytmie je úspěšnost tohoto přístupu jen asi 35 %. Opakované RFA ukázaly, že za rekurencemi FiS stojí ve většině případů zotavení vedení v plicních žilách nebo objevení se dosud klinicky němých extrapulmonálních fokusů [15,16].
Obr. 1. A – nástřik levé horní plicní žíly kontrastní látkou jedním z transseptálních zavaděčů (TSS1) v levé šikmé projekci 45°, B – umístění cirkulárního katétru (CK) do levé horní plicní žíly, C – eliminace elektrických potenciálů pocházejících z levé horní plicní žíly (záznamové stopy PV 1,2 – PV 9,10). Při stimulaci z koronárního sinu jsou v signálech snímaných cirkulárním katétrem umístěným v plicní žíle patrny dva signály: potenciály z levé síně (modré šipky) a ostré potenciály z plicní žíly (červené šipky). První dva stimulované stahy prokazují vedení elektrické aktivity z levé síně do plicní žíly. Po zahájení aplikace radiofrekvenční energie (ABL katétr) dochází k eliminaci elektrického vedení. 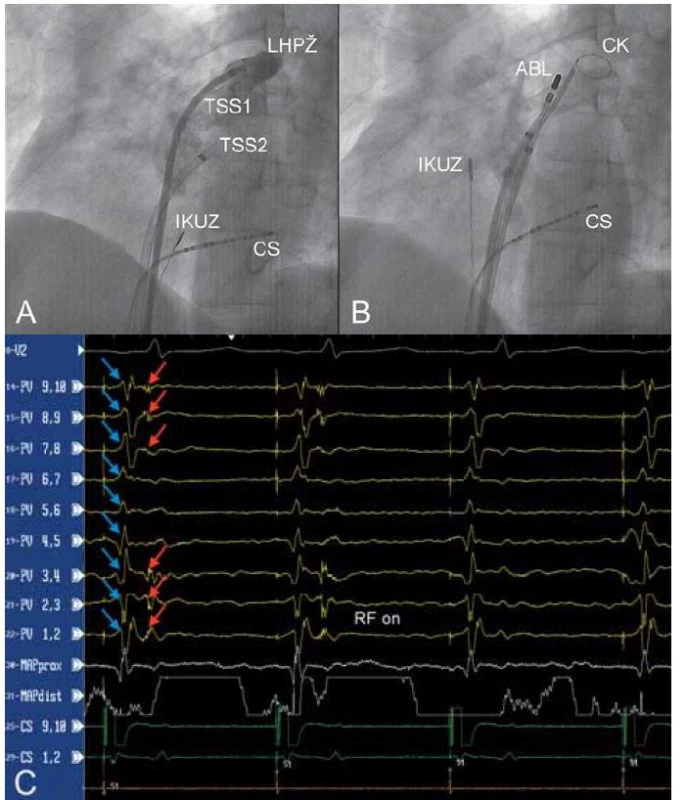
CS – katétr v koronárním sinu, IKUZ – intrakardiální ultrazvuková sonda. Cirkumferenční ablace kolem plicních žil
Nízká úspěšnost segmentárních izolací plicních žil a absence cílení možných fokusů vycházejících z oblastí mimo ústí plicní žíly vedly ke změnám ablačních technik. Ve shodě s chirurgickými technikami kompartmentalizace síní navrhl Pappone et al techniku cirkumferenční levosíňové ablace za podpory trojrozměrného (3D) elektroanatomického mapovacího systému [17]. Cílem této RFA bylo snížení voltáže lokálně snímaného bipolárního elektrokardiogramu o > 80 % původní hodnoty nebo na absolutní hodnoty < 0,1 mV vně ablačních linií. Cirkumferenční linie kolem plicních žil byly doplněny o další linie v levé síni: od levé dolní plicní žíly k mitrálnímu anulu (tzv. linka mitrálního istmu) a tzv. posteriorní linku, která spojovala na zadní stěně levé síně kontralaterální plicní žíly.
Nutnou podmínkou úspěšnosti tohoto výkonu je transmuralita a kontinuita vytvořených lézí. Podpora 3D mapovacích systémů, integrace s obrazem levé síně získaným z magnetické rezonance (MRI) či spirální výpočetní tomografie (CT) společně s použitím chlazených ablačních katétrů zlepšila výsledky mnoha center. Kromě recidiv FiS je hlavním rizikem nekompletnosti lézí vznik makroreentrantních síňových tachykardií (viz níže), které často vedou ještě k horším symptomům než sama fibrilace, a to díky vyšší komorové frekvenci, rezistenci na antiarytmika a nízké pravděpodobnosti spontánní terminace [18]. Úspěšnost těchto technik dosahuje u paroxyzmální FiS téměř 80 %. U perzistující a permanentní formy arytmie je však úspěšnost opět nízká a nepřekračuje 60 %.
Modifikací výše uvedeného postupu vznikla metoda cirkumferenční izolace plicních žil. V podstatě se jedná o hybridní přístup, při němž na rozdíl od metody cirkumferenční levosíňové ablace je opět cílem dosáhnout elektrické izolace plicních žil cirkumferenčními lézemi, které jsou aplikovány z antrální strany žilního ústí, někdy i široce v levé síní − wide atrial circumferential ablation − WACA (obr. 2), a efektivita je kontrolována cirkulárním mapovacím katétrem umístěným postupně ve všech plicních žilách. Výsledky obou sobě si podobných technik shrnuje tab. 1.
Obr. 2. Příklad cirkumferenční izolace plicních žil (pohled na levou síň zezadu). Ústí ipsilaterálních žil je obkrouženo jedinou obkružující lézí situovanou antrálně („wide atrial circumferential ablation“). Cílem je dosažení bidirekčního bloku vedení uvnitř ablační linie. Patrné jsou 3 samostatně ústící pravostranné plicní žíly (šedá, žlutá a cihlová barva) a 3 levostranné plicní žíly, z nichž 2 horní mají společné ústí. 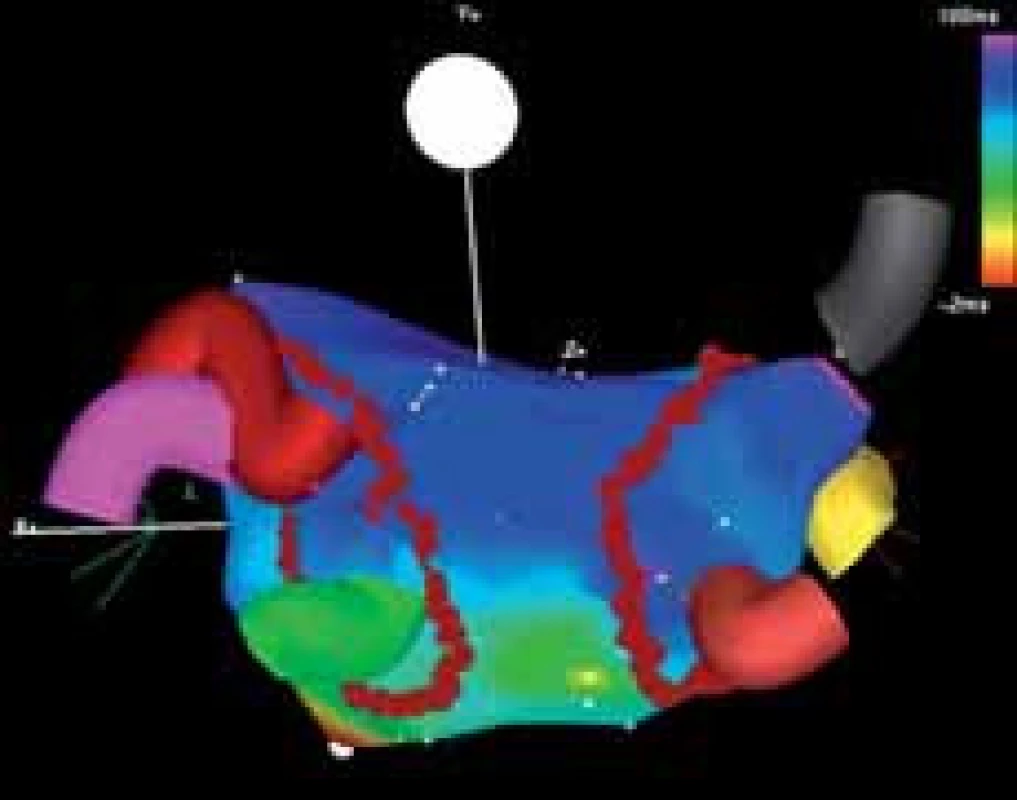
Tab. 1. Přehled klinických studií a úspěšnost levosíňových cirkumferenčních ablačních lézí kolem plicních žil. 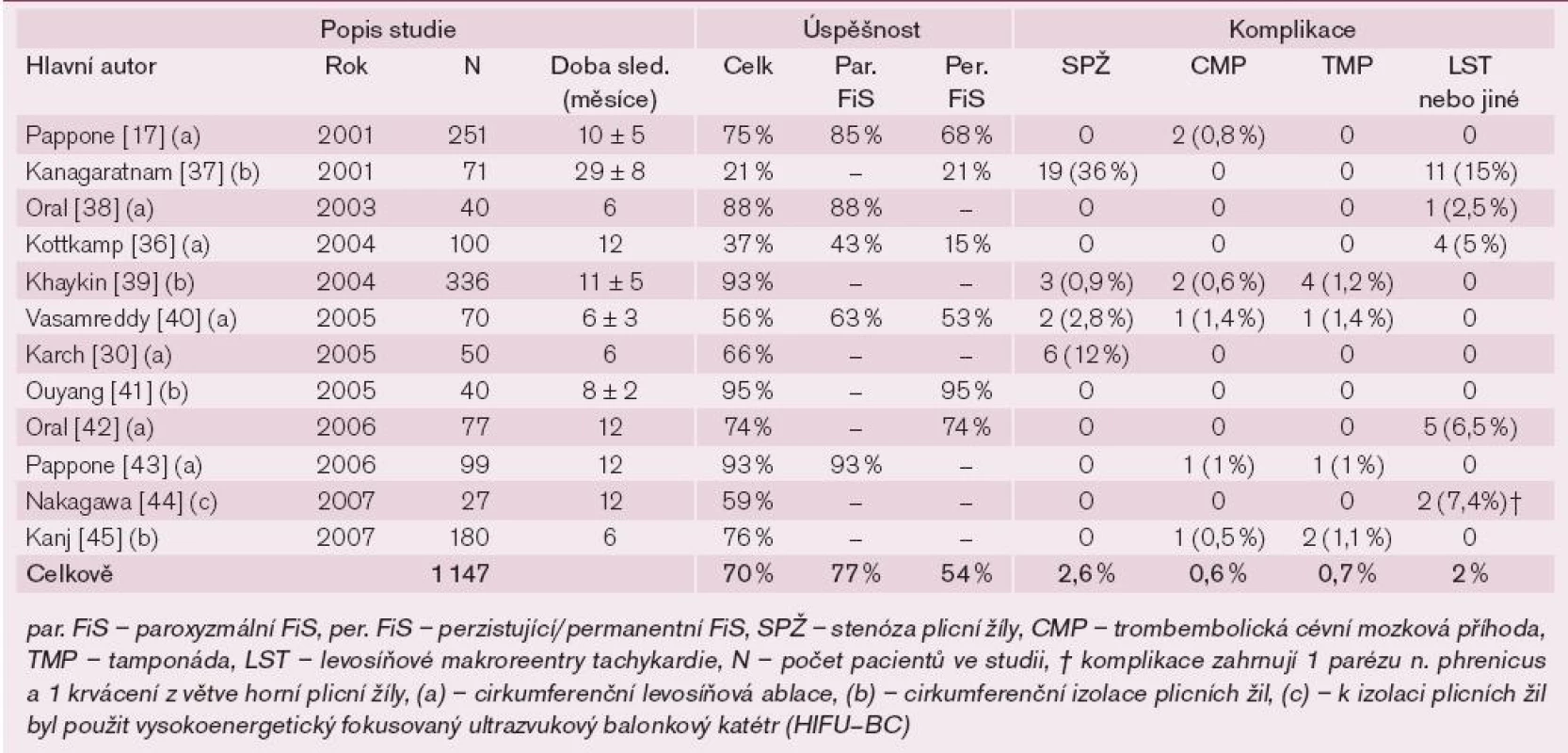
Alternativní ablační techniky
Zcela nový přístup k RFA pro FiS byl uplatněn americkými autory Nademaneem a et al [19]. Autoři za použití 3D elektroanatomického systému (CARTO) zmapovali v obou síních ložiska tzv. komplexních frakcionovaných síňových potenciálů (CFAE). Takovéto frakcionované potenciály jsou považovány za pivotální body, kolem nichž se otáčejí reentrantní fibrilační vlny a jejich přítomnost je kritická k udržení arytmie. Nademanee et al testovali hypotézu, že identifikace a následná ablace těchto kotevních bodů by mohla zabránit rekurenci arytmie. Studie zahrnovala 121 pacientů (57 s paroxyzmální a 64 s chronickou formou FiS). CFAE byly nalezeny především na interatriálním septu, v plicních žilách, horní stěně levé síně, kolem mitrálního anulu v levé posteroseptální oblasti a v koronárním sinu. Ablace těchto míst pak vedla k 91% úspěšnosti po 12 měsících sledování (70 % pacientů bez antiarytmik).
Poznání vlivu autonomního nervového systému na iniciaci FiS a anatomické studie potvrzující přítomnost gangliových plexů vedly k další modifikaci ablačních technik pro FiS. Vliv parasympatiku i sympatiku na buněčnou elektrofyziologii je již dlouho znám. Uvolnění acetylcholinu zkracuje absolutní refrakterní periodu síní i svaloviny plicních žil zatímco adrenergní stimulace zvyšuje obsah intracelulárního kalcia a podporuje vznik následných depolarizací, a tedy vznik ektopické elektrické aktivity. Oba jevy facilitují vznik mikroreentry a vedou ke snadné konverzi paroxyzmální ektopické síňové aktivity do setrvalé FiS [20].
Levosíňové gangliové plexy mohou být snadno lokalizovány periablačně za pomocí vysokofrekvenční stimulace (12 V při šířce pulzu 1−10 ms, délka cyklu 50 ms, tj. 20 Hz) do ablačního katétru. Vyvolání vagové odpovědi touto stimulací (významné zpomalení tepové frekvence nebo tranzientní kompletní AV blokáda) označuje lokalizaci plexů. V jedné z prvních studií zahrnující 60 pacientů s paroxyzmální FiS byla RFA gangliových plexůužita jako součást hybridní procedury zahrnující taktéž izolaci plicních žil [21]. Hybridní procedura vedla k udržení sinusového rytmu u 91 % pacientů, zatímco pouhá izolace plicních žil byla úspěšná jen v 71 %. Jiná retrospektivní studie ukázala, že kombinace cirkumferenční levosíňové ablace s RF ablací gangliových plexů měla ve srovnání s prostou cirkumferenční ablací vynikající výsledky: 99 % pacientů ve srovnání s 85 % nemělo po hybridním zákroku žádnou arytmii (12 měsíční sledování) [22]. Ačkoliv klinická evidence přínosu ablace gangliových plexů narůstá [20,22-26], je jasné, že bude zapotřebí dalších randomizovaných studií zaměřených na definitivní zhodnocení přínosu této techniky. Není navíc jisté, zda po určité době nedochází k reinervaci ablovaných okrsků, i když dosud nečetná data naznačují, že alespoň v době do 6 měsíců od výkonu tomu tak není [25].
V nedávné době byl publikován novější postup tzv. sekvenční ablační techniky pro léčbu pacientů s permanentní FiS [27]. U výkonu jsou postupně ablačně cíleny struktury, které jsou odpovědné za spuštění i udržení FiS, a efekt zákroku je hodnocen pomocí délky cyklu FiS pozorované většinou v oušku pravé či levé síně (tedy daleko od míst ablace) [28]. Postupně jsou cirkumferenčními lézemi izolovány všechny plicní žíly, event. jsou izolovány i další hrudní žíly (horní dutá žíla, koronární sinus aj.), provedena linie na horní stěně levé síně mezi žilami, linie mitrálního istmu a dále jsou cílena místa s kontinuální nebo komplexní frakcionovanou elektrickou aktivitou (schéma 1). Kumulativně s nárůstem ablačních lézí je u většiny pacientů možno pozorovat nárůst délky cyklu FiS až do organizace FiS do pravidelné levosíňové tachykardie nebo terminace arytmie přímo do sinusového rytmu bez nutnosti zevní elektrické kardioverze. Levosíňové tachykardie je pak možno dále mapovat, nalézt kritická místa a aplikací RF energie ukončit. Je nutné zdůraznit, že tento přístup vyžaduje excesivní ablační léze, rizikovost výkonu je vyšší a v indikaci je nutné individualizovat jednotlivá rizika vzhledem k přínosu.
Schéma 1. Sekvenční ablační strategie pro permanentní FiS (upraveno podle [28]). ![Schéma 1. Sekvenční ablační strategie pro permanentní FiS (upraveno podle [28]).](https://pl-master.mdcdn.cz/media/image/c034426fddde0ab55b55b3f297166c9d.jpg?version=1537796386)
AT – síňová tachykardie, CS – koronární sinus, FiS – fibrilace síní, OLS – ouško levé síně, OPS – ouško pravé síně, RFA – radiofrekvenční katétrová ablace, SR – sinusový rytmus. Současně s novými ablačními možnostmi dochází k rozvoji zobrazovacích technik. Především novější možnosti integrace obrazu levé síně a plicních žil získaného z MRI nebo spirální výpočetní tomografie s elektroanatomickou mapou z navigačních 3D-systémů (CARTO, NavX) umožňují lepší a rychlejší pochopení anatomických variant a preciznější a bezpečnější cílení ablačních lézí. Kromě toho je v klinickém testování systém, jenž by za použití intrakardiálního ultrazvuku dokázal trojrozměrně zobrazit anatomii levé síně v reálném čase. Nové robotické možnosti tzv. magnetické navigace (stereotaktický systém Niobe) ve spojení s těmito technologiemi pak může RF ablace pro FiS učinit méně závislými na zkušenosti operatéra či elektrofyziologického centra.
Dnešní pohled na indikace k RFA pro fibrilaci síní
Zatímco dříve byli pacienti indikováni k RFA teprve po selhání alespoň 2 antiarytmik a katetrizační léčba byla považována do určité míry za experimentální techniku, poznání patofyziologie FiS a rozvoj ablačních technik a technologií současně s narůstající klinickou evidencí a zkušenostmi center poskytující tuto léčbu dovolují indikaci dřívější. Podle současných doporučených postupů [29] jsou k této léčbě indikováni symptomatičtí pacienti, u nichž selhalo alespoň 1 antiarytmikum. Optimální výběr antiarytmik se řídí přítomností (resp. absencí) dalšího kardiálního onemocnění (schéma 2). Na preferenci pacienta a ošetřujícího lékaře (po zvážení všech rizik a přínosu výkonu) je pak alternativně zvolena možnost buď vyzkoušet jiné antiarytmikum, nebo indikovat RFA.
Schéma 2. Strategie léčby FiS antiarytmiky a RF katétrovou ablací (upraveno podle [29]). ![Schéma 2. Strategie léčby FiS antiarytmiky a RF katétrovou ablací (upraveno podle [29]).](https://pl-master.mdcdn.cz/media/image/5aaf58629bbe9fd5c419552c7dec6e18.jpg?version=1537794141)
ICHS – ischemická choroba srdeční, HLK – hypertrofi e levé komory, Amio – amiodaron, RFA – radiofrekvenční katétrová ablace. Iatrogenní síňové tachykardie
Organizované levosíňové tachykardie se po ablačních zákrocích objevují v 1,2–31 % případů. Hlavním rizikovým faktorem pro vznik těchto tachykardií je použitá ablační technika. Např. centra používající široké cirkumferenční ablace kolem plicních žil doplněné liniemi v levé síni mají až 3krát větší incidenci těchto síňových arytmií, což platí zvláště, pokud blok vedení přes lineární léze není elektrofyziologickými manévry ověřován [30,31]. Většina těchto tachykardií představuje mechanizmus makroreentry kroužící kolem mitrálního anulu nebo kolem ipsilaterálních plicních žil a typicky využívá zóny pomalého vedení způsobené netransmurálními ablačními lézemi (obr. 3). Pokud dojde ke vzniku organizované tachykardie po prosté izolaci plicních žil, jedná se většinou o fokální nebo mikroreentry arytmii pocházející z rekonexe plicní žíly [32,33] a většina z nich se bude manifestovat časně v poablačním období. Arytmie jsou většinou vysoce symptomatické, protože díky organizované aktivitě síní vedou 2 : 1 na komory. Navíc jsou vcelku rezistentní na veškerá antiarytmika a i po elektrické kardioverzi časně recidivují. S RF reablací se přesto doporučuje nějaký čas vyčkat, neboť až 50 % těchto arytmií může spontánně odeznít s ukončením hojící fáze po RFA [34].
Obr. 3. Povrchové EKG makroreentry síňové tachykardie po RF ablaci pro permanentní FiS (levý panel). Tachykardie využívá zónu pomalého vedení mezi kontralaterálními plicními žilami. Reentry okruh je naznačen šipkami. Šedě je zobrazena jizva (síňová tkáň kolem plicních žil po předchozích RF ablacích). Nejčasnější aktivace je zobrazena červenou barvou, nejpozdější pak purpurovou. Série ablačních lézí (cihlově červené tečky) terminovala arytmii, která následně nebyla vyvolatelná (pravý panel). 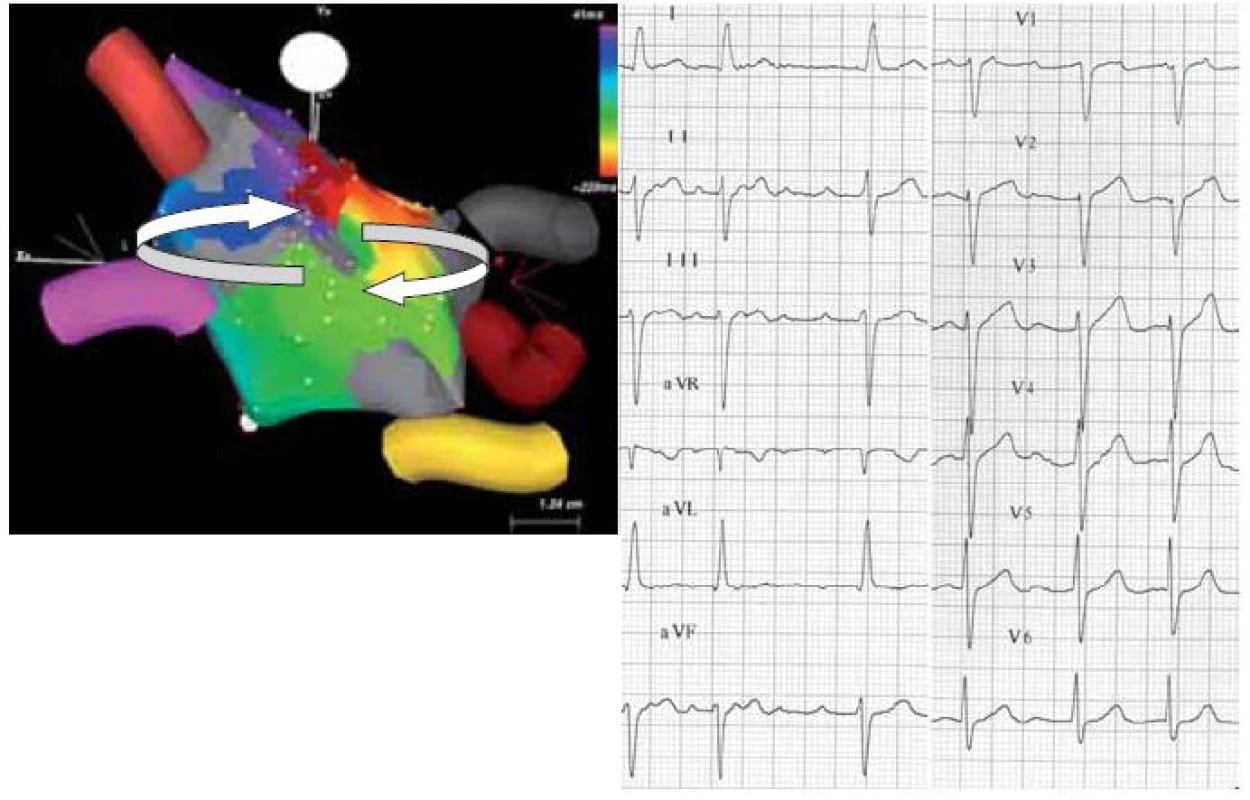
Péče o pacienty po RFA pro fibrilaci síní
Péče o pacienty po RFA pro FiS je mírně odlišná od jiných RFA. Pacienti musí (alespoň prvních 24 hod po výkonu) ležet na lůžku s možností telemetrické monitorace tlaku a srdečního tepu. Jakákoliv hypotenze musí vést k okamžitému echokardiografickému vyšetření u lůžka a k vyloučení tamponády srdeční. U řady pacientů se po RFA vyskytují symptomy z ablací indukované perikarditidy, někdy doprovázené i mírnými subfebriliemi. Tyto symptomy většinou spontánně odezní do týdne po výkonu a lze je zvládnout běžnými nesteroidními antirevmatiky. Systémová aplikace steroidů je naprosto výjimečná.
Doposud neexistují žádná univerzální doporučení, jak pacienty po RFA pro FiS antikoagulovat. Dokonce neexistuje ani jednoznačná shoda v tom, do jaké míry mají být pacienti heparinizováni během výkonu. V doporučeních se objevují hodnoty ACT od 250 do 400 s. Sami v naší elektrofyziologické laboratoři užíváme hodnoty ACT mezi 280–320 s.
Po extrakci sheathů z třísel po odeznění účinku heparinu jsou pacienti převedeni zpět na perorální antikoagulační léčbu, přičemž 2 až 3 dny do nastoupení účinku Warfarinu (INR > 2,0) jsou pacienti překryti nízkomolekulárním heparinem (Fraxiparine) v dávce 0,01 ml/kg s. c. 2krát denně. Existuje jednoznačná shoda v tom, že po výkonu mají být pacienti antikoagulováni minimálně po dobu 3 měsíců. Důvodem je především relativně vyšší výskyt recidiv FiS v období tzv. blanking periody (tj. prvních 2−3 měsíců po ablaci), které pak spontánně mizí (proces hojení, reverzní remodelace atd.). Další postup se pak liší od centra k centru. Někde se antikoagulace vysazuje již po 3 měsících, jinde až rok po výkonu. Dlouhodobá data však chybějí a je žádoucí uspořádat multicentrickou studii sledující nejen výskyt FiS v delším odstupu od RFA, ale i incidenci cévní mozkové příhody u pacientů po RFA s vysazenou antikoagulací, zvláště u těch, kteří jsou ohroženi faktory vyvolávajícími tromboembolickou příhodu.
Také přístup k antiarytmické léčbě se liší od centra k centru. Jedním z přístupů je antiarytmika vysadit již před RFA a po výkonu je nepodávat, ledaže by došlo k recidivě arytmie. Jiný přístup zachovává předablační antiarytmickou léčbu i po první 2−3 měsíce po zákroku s cílem co nejdéle udržet sinusový rytmus a podpořit tak reverzní remodelaci síní a teprve pokud pacient nemá recidivy arytmie, antiarytmika vysadit. Problémem je samozřejmě způsob sledování pacientů. Bylo ukázáno, že po RFA se zvyšuje počet asymptomatických epizod FiS (díky denervaci síní?) [35] a také že senzitivita záchytu arytmie se rapidně zvyšuje s délkou EKG monitorace pacienta [36].
Závěr
RFA pro FiS je metoda zavedená do klinické praxe teprve před několika lety, ale přesto se dočkala širokého použití. Díky RFA se značně rozšířilo poznání v oblasti patofyziologie FiS, přesto zůstává řada otázek stále otevřená. Účinnost této léčby FiS podstatně převyšuje účinnost všech běžně dostupných antiarytmik a u paroxyzmální formy fibrilace přesahuje 90 %. U forem permanentních je účinnost v udržení sinusového rytmu podstatně nižší a zřejmě nepřevyšuje 70 %. Největší limitaci této metody lze v současné době spatřovat ve variabilitě výsledků v jednotlivých centrech (zejména u permanentních forem arytmie), relativně vyšší počet komplikací ve srovnání s konvenčními RFA jiných supraventrikulárních arytmií a v neposlední řadě časová náročnost výkonu a při daném počtu center (a lékařů) nabízejících tuto léčbu i omezený počet takto léčených pacientů.
Zdroje
1. Chen LY, Shen WK. Epidemiology of atrial fibrillation: a current perspective. Heart Rhythm 2007; 4: S1-S6.
2. Lloyd-Jones DM, Wang TJ, Leip EP et al. Lifetime risk for development of atrial fibrillation: the Framingham Heart Study. Circulation 2004; 110 : 1042-1046.
3. Miyasaka Y, Barnes ME, Gersh BJ et al. Secular trends in incidence of atrial fibrillation in Olmsted County, Minnesota, 1980 to 2000, and implications on the projections for future prevalence. Circulation 2006; 114 : 119-125.
4. Fuster V, Ryden LE, Asinger RW et al. ACC/AHA/ESC Guidelines for the Management of Patients With Atrial Fibrillation: Executive Summary A Report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines and the European Society of Cardiology Committee for Practice Guidelines and Policy Conferences (Committee to Develop Guidelines for the Management of Patients With Atrial Fibrillation) Developed in Collaboration With the North American Society of Pacing and Electrophysiology. Circulation 2001; 104 : 2118-2150.
5. Calkins H, Brugada J, Packer DL et al. HRS/EHRA/ECAS expert Consensus Statement on catheter and surgical ablation of atrial fibrillation: recommendations for personnel, policy, procedures and follow-up. A report of the Heart Rhythm Society (HRS) Task Force on catheter and surgical ablation of atrial fibrillation. Heart Rhythm 2007; 4 : 816-861.
6. Allessie MA, Boyden PA, Camm AJ et al. Pathophysiology and prevention of atrial fibrillation. Circulation 2001; 103 : 769-777.
7. Haissaguerre M, Jais P, Shah DC et al. Spontaneous initiation of atrial fibrillation by ectopic beats originating in the pulmonary veins. N Engl J Med 1998; 339 : 659-666.
8. Jais P, Weerasooriya R, Shah DC et al. Ablation therapy for atrial fibrillation (AF): past, present and future. Cardiovasc Res 2002; 54 : 337-346.
9. de Bakker JM, Ho SY, Hocini M. Basic and clinical electrophysiology of pulmonary vein ectopy. Cardiovasc Res 2002; 54 : 287-294.
10. Pappone C, Oreto G, Lamberti F et al. Catheter ablation of paroxysmal atrial fibrillation using a 3D mapping system. Circulation 1999; 100 : 1203-1208.
11. Oral H, Knight BP, Tada H et al. Pulmonary vein isolation for paroxysmal and persistent atrial fibrillation. Circulation 2002; 105 : 1077-1081.
12. Haissaguerre M, Marcus FI, Fischer B et al. Radiofrequency catheter ablation in unusual mechanisms of atrial fibrillation: report of three cases. J Cardiovasc Electrophysiol 1994; 5 : 743-751.
13. Jais P, Haissaguerre M, Shah DC et al. A focal source of atrial fibrillation treated by discrete radiofrequency ablation. Circulation 1997; 95 : 572-576.
14. Saad EB, Rossillo A, Saad CP et al. Pulmonary vein stenosis after radiofrequency ablation of atrial fibrillation: functional characterization, evolution, and influence of the ablation strategy. Circulation 2003; 108 : 3102-3107.
15. Nakashima H, Kumagai K, Noguchi H et al. Evaluation of the recurrence of atrial fibrillation after pulmonary venous ablation. J Cardiol 2002; 40 : 87-94.
16. Haissaguerre M, Jais P, Shah DC et al. Electrophysiological end point for catheter ablation of atrial fibrillation initiated from multiple pulmonary venous foci. Circulation 2000; 101 : 1409-1417.
17. Pappone C, Oreto G, Rosanio S et al. Atrial electroanatomic remodeling after circumferential radiofrequency pulmonary vein ablation: efficacy of an anatomic approach in a large cohort of patients with atrial fibrillation. Circulation 2001; 104 : 2539-2544.
18. Daoud EG, Weiss R, Augostini R et al. Proarrhythmia of circumferential left atrial lesions for management of atrial fibrillation. J Cardiovasc Electrophysiol 2006; 17 : 157-165.
19. Nademanee K, McKenzie J, Kosar E et al. A new approach for catheter ablation of atrial fibrillation: mapping of the electrophysiologic substrate. J Am Coll Cardiol 2004; 43 : 2044-2053.
20. Scherlag BJ, Yamanashi W, Patel U et al. Autonomically induced conversion of pulmonary vein focal firing into atrial fibrillation. J Am Coll Cardiol 2005; 45 : 1878-1886.
21. Scherlag BJ, Patterson E, Po SS. The neural basis of atrial fibrillation. J Electrocardiol 2006; 39: S180-S183.
22. Pappone C, Santinelli V, Manguso F et al. Pulmonary vein denervation enhances long-term benefit after circumferential ablation for paroxysmal atrial fibrillation. Circulation 2004; 109 : 327-334.
23. Schauerte P, Scherlag BJ, Pitha J et al. Catheter ablation of cardiac autonomic nerves for prevention of vagal atrial fibrillation. Circulation 2000; 102 : 2774-2780.
24. Scherlag BJ, Nakagawa H, Jackman WM et al. Electrical stimulation to identify neural elements on the heart: their role in atrial fibrillation. J Interv Card Electrophysiol 2005; 13(suppl 1): 37-42.
25. Verma A, Saliba WI, Lakkireddy D et al. Vagal responses induced by endocardial left atrial autonomic ganglion stimulation before and after pulmonary vein antrum isolation for atrial fibrillation. Heart Rhythm 2007; 4 : 1177-1182.
26. Scanavacca M, Pisani CF, Hachul D et al. Selective atrial vagal denervation guided by evoked vagal reflex to treat patients with paroxysmal atrial fibrillation. Circulation 2006; 114 : 876-885.
27. Haissaguerre M, Sanders P, Hocini M et al. Catheter ablation of long-lasting persistent atrial fibrillation: critical structures for termination. J Cardiovasc Electrophysiol 2005; 16 : 1125-1137.
28. O'Neill MD, Jais P, Takahashi Y et al. The stepwise ablation approach for chronic atrial fibrillation-evidence for a cumulative effect. J Interv Card Electrophysiol 2006; 16 : 153-167.
29. Fuster V, Ryden LE, Cannom DS et al. ACC/AHA/ESC 2006 guidelines for the management of patients with atrial fibrillation: full text: a report of the American College of Cardiology/American Heart Association Task Force on practice guidelines and the European Society of Cardiology Committee for Practice Guidelines (Writing Committee to Revise the 2001 guidelines for the management of patients with atrial fibrillation) developed in collaboration with the European Heart Rhythm Association and the Heart Rhythm Society. Europace 2006; 8 : 651-745.
30. Karch MR, Zrenner B, Deisenhofer I et al. Freedom from atrial tachyarrhythmias after catheter ablation of atrial fibrillation: a randomized comparison between 2 current ablation strategies. Circulation 2005; 111 : 2875-2880.
31. Pappone C, Manguso F, Vicedomini G et al. Prevention of iatrogenic atrial tachycardia after ablation of atrial fibrillation: a prospective randomized study comparing circumferential pulmonary vein ablation with a modified approach. Circulation 2004; 110 : 3036-3042.
32. Gerstenfeld EP, Callans DJ, Dixit S et al. Mechanisms of organized left atrial tachycardias occurring after pulmonary vein isolation. Circulation 2004; 110 : 1351-1357.
33. Ouyang F, Antz M, Ernst S et al. Recovered pulmonary vein conduction as a dominant factor for recurrent atrial tachyarrhythmias after complete circular isolation of the pulmonary veins: lessons from double Lasso technique. Circulation 2005; 111 : 127-135.
34. Chugh A, Oral H, Lemola K et al. Prevalence, mechanisms, and clinical significance of macroreentrant atrial tachycardia during and following left atrial ablation for atrial fibrillation. Heart Rhythm 2005; 2 : 464-471.
35. Hindricks G, Piorkowski C, Tanner H et al. Perception of atrial fibrillation before and after radiofrequency catheter ablation: relevance of asymptomatic arrhythmia recurrence. Circulation 2005; 112 : 307-313.
36. Kottkamp H, Tanner H, Kobza R et al. Time courses and quantitative analysis of atrial fibrillation episode number and duration after circular plus linear left atrial lesions: trigger elimination or substrate modification: early or delayed cure? J Am Coll Cardiol 2004; 44 : 869-877.
37. Kanagaratnam L, Tomassoni G, Schweikert R et al. Empirical pulmonary vein isolation in patients with chronic atrial fibrillation using a three-dimensional nonfluoroscopic mapping system: long-term follow-up. Pacing Clin Electrophysiol 2001; 24 : 1774-1779.
38. Oral H, Scharf C, Chugh A et al. Catheter ablation for paroxysmal atrial fibrillation: segmental pulmonary vein ostial ablation versus left atrial ablation. Circulation 2003; 108 : 2355-2360.
39. Khaykin Y, Marrouche NF, Saliba W et al. Pulmonary vein antrum isolation for treatment of atrial fibrillation in patients with valvular heart disease or prior open heart surgery. Heart Rhythm 2004; 1 : 33-39.
40. Vasamreddy CR, Dalal D, Eldadah Z et al. Safety and efficacy of circumferential pulmonary vein catheter ablation of atrial fibrillation. Heart Rhythm 2005; 2 : 42-48.
41. Ouyang F, Ernst S, Chun J et al. Electrophysiological findings during ablation of persistent atrial fibrillation with electroanatomic mapping and double Lasso catheter technique. Circulation 2005; 112 : 3038-3048.
42. Oral H, Pappone C, Chugh A et al. Circumferential pulmonary-vein ablation for chronic atrial fibrillation. N Engl J Med 2006; 354 : 934-941.
43. Pappone C, Augello G, Sala S et al. A randomized trial of circumferential pulmonary vein ablation versus antiarrhythmic drug therapy in paroxysmal atrial fibrillation: the APAF Study. J Am Coll Cardiol 2006; 48 : 2340-2347.
44. Nakagawa H, Antz M, Wong T et al. Initial experience using a forward directed, high-intensity focused ultrasound balloon catheter for pulmonary vein antrum isolation in patients with atrial fibrillation. J Cardiovasc Electrophysiol 2007; 18 : 136-144.
45. Kanj MH, Wazni O, Fahmy T et al. Pulmonary vein antral isolation using an open irrigation ablation catheter for the treatment of atrial fibrillation: a randomized pilot study. J Am Coll Cardiol 2007; 49 : 1634-1641.
Štítky
Dětská kardiologie Interní lékařství Kardiochirurgie Kardiologie
Článek vyšel v časopiseKardiologická revue – Interní medicína
Nejčtenější tento týden
2008 Číslo Mimořádné- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Moje zkušenosti s Magnosolvem podávaným pacientům jako profylaxe migrény a u pacientů s diagnostikovanou spazmofilní tetanií i při normomagnezémii - MUDr. Dana Pecharová, neurolog
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Katetrizační ablace síňových tachyarytmií: které pacienty indikovat a jak o ně následně pečovat
- Elektromagnetické interference u pacientů s implantáty
- Intervenční kardiologie 2008: historické poznámky, současnost, trendy
- Nefarmakologická léčba AIM - současnost a budoucnost
- Úvod ke speciálnímu vydání Kardiologické revue věnované sympoziu Medtronic Czechia s.r.o. konané v rámci XVI. sjezdu ČKS 2008: Rizika a přínosy nefarmakologických terapií
- BIOPROTÉZA PRO VÝMĚNU SRDEČNÍ CHLOPNĚ: závěry po 10letých zkušenostech s 1 673 nezúženými bioprotézami
- Beating Heart Treatment of Atrial Fibrillation
- Léčba poruchy srdečního rytmu
- Kardiologická revue – Interní medicína
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Elektromagnetické interference u pacientů s implantáty
- Katetrizační ablace síňových tachyarytmií: které pacienty indikovat a jak o ně následně pečovat
- Intervenční kardiologie 2008: historické poznámky, současnost, trendy
- Léčba poruchy srdečního rytmu
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



