-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Možnosti využití fekální bakterioterapie
Possible uses of fecal bacteriotherapy
The problematic of intestinal dysbiosis is currently an object of intensive research, alteration of microbiota is related to pathogenesis of a whole array of disease states. A certain prototype of illness at which disruption of natural balance of intestinal microbial ecosystem plays a key role is recurrent Clostridium difficile colitis. A very hopeful method having the potential to therapeutically intervene exactly at the level of altered intestinal microbiota is fecal bacteriotherapy. It is already globally established method with aim to achieve the restoration of natural microbial homeostasis in the intestine using stool of healthy donor which is transplanted into the intestines of a patient. By restoring the colonization resistance of large intestine, the transplantation of intestinal microbiota can break an imaginary vicious cycle of repeated attacks of Clostridium difficile colitis. Within secondary prophylaxis of recurrent Clostridium difficile colitis, fecal bacteriotherapy is a very effective, safe, and by patients well-tolerated method. We can see its future in both improvement of the fecal transplant administration method (including enteric capsules) and more targeted manipulation with intestinal microbiota which will lead to extension of indications by an array of other illnesses.
Keywords:
Clostridioides difficile – intestinal dysbiosis – pseudomembranous enterocolitis – faecal microbiota transplantation
Autoři: Stebel Roman; Husa Petr
Působiště autorů: Klinika infekčních chorob Lékařské fakulty Masarykovy univerzity a Fakultní nemocnice Brno
Vyšlo v časopise: Geriatrie a Gerontologie 2023, 12, č. 2: 83-87
Kategorie: Přehledový článek
Souhrn
Problematika střevní dysbiózy je v současnosti předmětem intenzivního výzkumu, alterace mikrobioty je dávána do souvislosti s patogenezí řady chorobných stavů. Určitým prototypem nemoci, u které hraje narušení přirozené rovnováhy mikrobiálního ekosystému střeva klíčovou roli, je rekurentní klostridiová kolitida. Velmi nadějnou metodou mající potenciál terapeuticky zasáhnout právě na úrovni alterované intestinální mikrobioty je fekální bakterioterapie. Jedná se dnes již o globálně plně etablovanou metodu, která má za cíl dosáhnout obnovy přirozené mikrobiální homeostázy ve střevě pomocí stolice od zdravého dárce, která je přenesena do střeva pacienta. Obnovením kolonizační rezistence tlustého střeva dokáže transplantace střevní mikrobioty prolomit pomyslný bludný kruh opakovaných atak klostridiové kolitidy. V rámci sekundární profylaxe rekurentní klostridiové kolitidy je fekální bakterioterapie metodou velmi efektivní, bezpečnou a pacienty dobře tolerovanou. Její budoucnost vidíme jednak ve zdokonalování způsobu podání fekálního transplantátu (včetně enterosolventních kapslí), jednak v cílenější manipulaci s intestinální mikrobiotou, což povede k rozšíření indikací o řadu dalších onemocnění.
Klíčová slova:
Clostridioides difficile – pseudomembranózní enterokolitida – intestinální dysbióza – transplantace střevní mikrobioty
ÚVOD
Díky moderním genetickým metodám dnes víme, že organismus člověka je osídlen řadou symbiotických mikroorganismů. Odhaduje se, že počet mikrobiálních buněk převyšuje počet buněk lidských nejméně desetinásobně.(1) Jedná se o tzv. mikrobiotu, společenství mikrobů přežívajících v různých částech hostitele. Mluvíme o mikrobiotě (starším názvem mikroflóře) kožní, střevní, respirační, urogenitální apod. Pod pojmem mikrobiom rozumíme kompletní sestavu genů všech mikrobů, které jsou součástí mikrobioty.(2)
Byla prokázána řada mechanismů, kterými se mikrobiota podílí na chodu lidského organismu. Je známa funkce při metabolismu živin a xenobiotik, biosyntéze vitaminů a stimulaci obnovy epitelu střeva.(3) Mikroorganismy také ovlivňují střevní motilitu, stimulují prokrvení střevní sliznice, modulují imunitní systém, tvorbou substrátů se účastní výživy buněk střevní sliznice a zasahují rovněž do metabolismu žlučových kyselin.(4) Mezi další významné funkce střevní mikrobioty patří produkce mastných kyselin s krátkým řetězcem (short chain fatty acids, SCFA) a zajištění tzv. kolonizační rezistence (ochrany před invazí patogenních mikrobů i přerůstáním komenzálů).(2)
Složení střevní mikrobioty je u každého člověka unikátní, nicméně již po prvním roce života zůstává dlouhodobě stabilní.( 4) K narušení mikrobioty (mluvíme o tzv. dysbióze) dochází nejčastěji během antibiotické (ATB) terapie, kdy bakterie rezistentní k podávanému ATB získají selekční výhodu a přemnoží se. Nepozorujeme kvantitativní, ale spíše kvalitativní poškození mikrobioty, převažuje alterace její přirozené diverzity.(5) Mezi onemocnění, která jsou patogeneticky spojována s alterovaným mikrobiálním ekosystémem střeva, dnes řadíme řadu nozologických jednotek. Určitým prototypem nemoci, u které byl význam poškozené mikrobioty popsán nejdříve a dosud nejlépe, je klostridiová (také pseudomembranózní) enterokolitida (Clostridioides difficile infection, CDI). Vliv dysbiózy je široce diskutován rovněž např. v patogenezi idiopatických střevních zánětů,(2,5) syndromu dráždivého tračníku,(6) jaterní encefalopatie(7,8) či dokonce nozologických jednotek, jako je metabolický syndrom( 2,9) nebo některá neuropsychiatrická onemocnění (autismus, roztroušená skleróza, Parkinsonova nemoc).(2,10,11)
TRANSPLANTACE STŘEVNÍ MIKROBIOTY
Terapeuticky ovlivnit dysbiózu se snažíme různými způsoby. Zkoušíme změny stravovacích návyků, užívání probiotik spolu s prebiotiky, někdy dokonce podáváme specifická ATB (např. rifaximin u jaterní encefalopatie).(12) Velmi perspektivní metodou mající potenciál zasáhnout na úrovni střevní dysbiózy je fekální bakterioterapie. Jedná se o metodu, která má za cíl dosáhnout restituce přirozené mikrobiální homeostázy ve střevě pomocí stolice od zdravého dárce, která je přenesena do trávicího systému nemocného. V zahraniční literatuře se pro tuto metodu ujal název fecal microbiota transplantation (FMT),(13) ten se do českého jazyka také překládá jako transplantace střevní mikrobioty.
Z historických pramenů víme, že již naši dávní předkové využívali přenos stolice k léčbě řady chorobných stavů. První zmínky o léčebném využití stolice nacházíme již ve čtvrtém století našeho letopočtu, kdy staří Číňané podávali extrakty z lidské stolice perorální cestou nemocným s průjmy.(4) V historii moderní medicíny je z hlediska FMT průlomový rok 1958, kdy americký chirurg Ben Eiseman podal stolici zdravého dárce klyzmatem čtyřem pacientům s blíže nespecifikovaným střevním zánětem.(14) První léčebné použití FMT v rámci neinfekčního onemocnění se datuje do roku 1989, kdy Bennet trpící refrakterní ulcerózní kolitidou realizoval sám na sobě FMT s kladným efektem.(15)
MANIPULACE SE STŘEVNÍ MIKROBIOTOU
Aktuálně během FMT postupujeme do velké míry nespecificky, předpokládáme, že přenosem stolice od zdravého dárce do trávicího traktu nemocného dokážeme „opravit“ narušenou rovnováhu střevního mikrobiálního ekosystému a tím pacienta vyléčit. Mechanismy, kterými FMT dokáže léčit, jsou předmětem intenzivního výzkumu.(2) Potenciální efekt FMT v léčbě mnoha onemocnění dokážeme již dnes vysvětlit řadou cílených mechanismů. Ve zjednodušené podobě jsou některé vybrané mechanismy uvedeny na obrázku 1.
Obr. 1. Přehled mechanismů účinku FMT(2)
short chain fatty acids (SCFA), inflammatory bowel disease (IBD)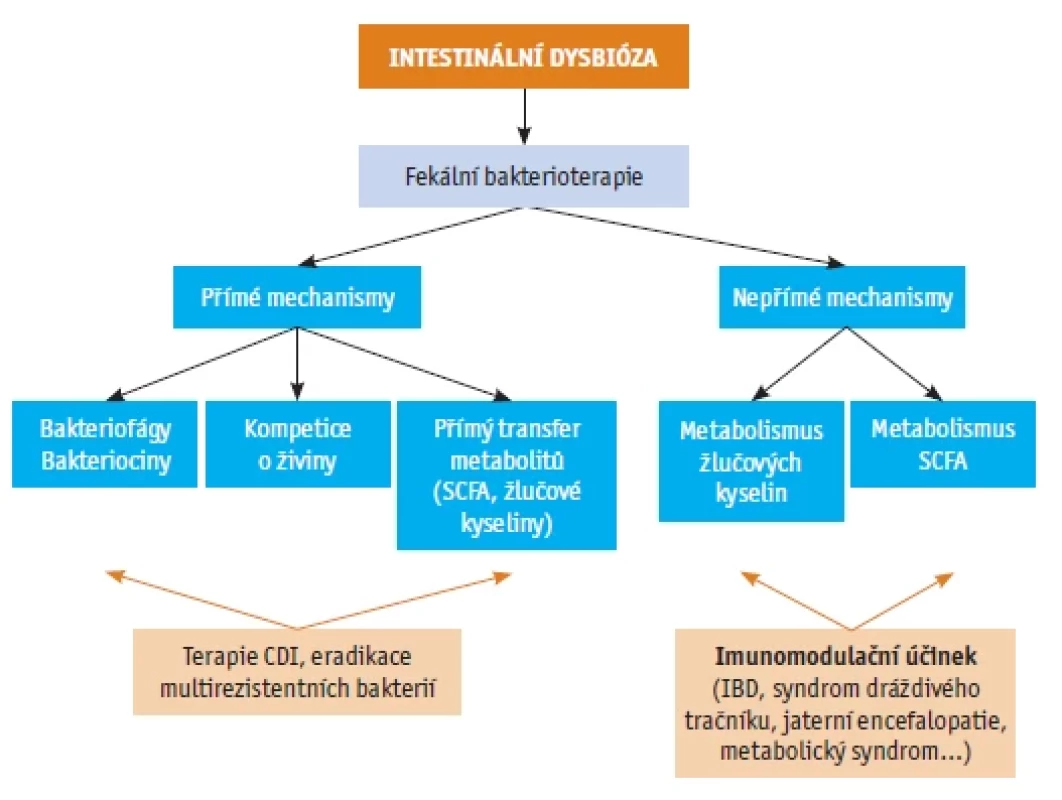
Mezi přímé mechanismy (nezávislé na organismu člověka) řadíme např. kompetici s patogenními bakteriemi o živiny a blokování adherence patogenů na povrchu sliznice,(2) dále účinek specifických enzymů a peptidů s antimikrobiálním účinkem (tzv. bakteriocinů)(16) a v neposlední řadě i působení bakteriofágů (virů s lytickým účinkem na určité bakterie).(17) Mezi nepřímé mechanismy pak patří zejména ovlivnění metabolismu SCFA a žlučových kyselin ve střevě.(18)
SCFA vznikají v tlustém střevě činností bakterií během fermentace nestravitelných cukrů. Mezi nejvýznamnější patří acetát a propionát (produkovaný bakteriemi kmene Bacteroidetes) a butyrát (produkovaný Firmicutes).(19) SCFA vykazují imunomodulační účinek, inhibují produkci prozánětlivých cytokinů a zvyšují zastoupení regulačních CD4+ lymfocytů ve sliznici střeva.(20) Dále také stimulují proliferaci střevních epiteliálních buněk, čímž posilují bariérovou funkci střevní stěny.(20)
U pacientů s intestinální dysbiózou pozorujeme rovněž deficit bakterií vybavených enzymovým komplexem 7α‑dehydroxylázy.(21) Jedná se o enzym klíčový pro přeměnu (dekonjugaci a dehydroxylaci) primárních žlučových kyselin (kyseliny cholové a chenodeoxycholové) na sekundární (kyselinu deoxycholovou a litocholovou).(21) Úloha žlučových kyselin je v současnosti diskutována zejména v patogenezi rekurentní CDI. Je známo, že primární žlučové kyseliny podporují germinaci spor C. difficile. Naopak sekundární žlučové kyseliny jsou potentními inhibitory růstu klostridií.(22)
FEKÁLNÍ BAKTERIOTERAPIE V LÉČBĚ KLOSTRIDIOVÉ KOLITIDY
Aktuálně má FMT své nezpochybnitelné místo v algoritmu léčby rekurentní CDI. FMT je doporučovanou (po předchozí léčbě vankomycinem či fidaxomicinem) profylaktickou metodou u opakovaných rekurencí (tj. u druhé a další recidivy) CDI, vždy po individuálním zvážení vhodnosti této modality u konkrétního pacienta. Použití fekální bakterioterapie jako sekundárně profylaktické metody je zahrnuto v aktuálně platných zahraničních(23,24) i českých(25) doporučených postupech pro diagnostiku a léčbu klostridiové kolitidy. Aktuální verze českého doporučeného postupu je dostupná on-line na stránkách Společnosti infekčního lékařství ČLS JEP (https://infektologie.cz/zprava22-39.htm). V rámci ČR je FMT indikována v řadě případů i po první rekurenci CDI. Tato časnější indikace FMT je podmíněna zejména omezenou dostupností a finanční náročností jiných, sekundárně profylaktických postupů při výborné efektivitě a dobré toleranci této modality ze strany pacientů.(25)
FMT se dnes stala v řadě zemí rutinní součástí péče o pacienty s rekurentní CDI. Přesto je stále doprovázena řadou medicínských, etických a právních otázek. Nejedná se o metodu globálně standardizovanou. Z medicínského hlediska probíhají intenzivní diskuse na téma výběru optimálního dárce stolice (příbuzný, či nepříbuzný, tzv. univerzální, dárce), použití čerstvé, nebo zamrazené stolice, rozsahu vyšetření dárce a způsobu přípravy pacienta před FMT.(26) Diskuse probíhají rovněž u optimální cesty podání fekálního transplantátu do trávicího systému nemocného. Doporučený postup Americké gastroenterologické společnosti (American College of Gastroenterology) jako preferované cesty podání uvádí endoskopickou aplikaci FMT koloskopem do tračníku nebo perorální podání v podobě enterosolventních kapslí.( 23) Podání cestou retenčního klyzmatu přes konečník je akceptováno v případě nedostupnosti ostatních preferovaných metod.(23–25) V případě selhání FMT je doporučeno podání fekálního transplantátu opakovat.(23,24) Vzhledem ke komplexitě této problematiky byl v roce 2018 vypracován samostatný doporučený postup pro léčbu rekurentní klostridiové kolitidy pomocí FMT.(26) Tento podrobný guideline je volně k dispozici on-line na https://infektologie.cz/DPFMT18.htm.
V rámci ČR byla fekální bakterioterapie poprvé podána na Klinice infekčních chorob Fakultní nemocnice Brno (KICH FN Brno) na jaře 2010. První výsledky léčby byly publikovány dr. Polákem v roce 2011.(27) Od té doby byla FMT podána již více než 600 pacientů.(28–30) Počty FMT aplikovaných během posledních osmi let (a úspěšnost této léčby) ilustruje graf 1. Terapie byla hodnocena jako úspěšná, pokud nedošlo k recidivě klostridiové kolitidy (3 a více řídkých stolic za 24 hodin po dobu dvou po sobě následujících dnů a pozitivní průkaz volných klostridiových toxinů ve stolici či pozitivita detekce genů pro klostridiové toxiny) do osmi týdnů od výkonu. FMT vykazuje na KICH FN Brno dlouhodobě stabilní úspěšnost, ta kolísá mezi 66 % až 85 %(28) a je plně srovnatelná s výsledky zahraničních studií a metaanalýz.( 31–33)
Graf 1. Vývoj realizovaných (a úspěšných) FMT v letech 2015 až 2022 
BUDOUCNOST FMT
Vývoj FMT očekáváme hned v několika rovinách. Již dnes pozorujeme nové, jednodušší a bezpečnější způsoby podání fekálního transplantátu. Budoucnost bude s velkou pravděpodobností patřit perorální formě podání – ať již v podobě individuálně připravovaných enterosolventních kapslí se zamrazenou či lyofilizovanou stolicí,(34) nebo jako komerčně vyráběné fekální deriváty.(21) Cílem bude zajistit co nejlepší toleranci ze strany pacienta, maximální jednoduchost při aplikaci a současně bezpečnost při standardizovaném screeningu dárců. V literatuře již nalézáme první zkušenosti s FMT pomocí kapslí z reálné praxe.(34) V roce 2019 Allegretti et al. publikovali studii, ve které byl 51 pacientům s rekurentní CDI podáván fekální transplantát v podobě dvou druhů tobolek.(34) Jednalo se jednak o běžné kapsle rozpustné v žaludku (gastric release), jednak také o kapsle přizpůsobené cílenému uvolňování suspenze stolice až v tlustém střevě (colonic release). Tyto speciální tobolky byly potaženy směsí polymerů citlivých na specifické pH a směsí polysacharidů degradovatelných enzymy, jež jsou produkovány pouze střevními bakteriemi.(34)
Lze očekávat také další rozvoj institucí fungujících jako tzv. banky stolice. Jedná se o instituce, které deponují podle jednotných standardů připravené vysoce kvalitní suspenze stolice získané od podrobně vyšetřených a podle přísných kritérií předem vybraných dárců.(35) Banky stolice jsou schopny doručit k aplikaci připravený zamrazený fekální transplantát prakticky kamkoliv na světě. Centrálně přitom mohou monitorovat případné nežádoucí události po FMT, často rovněž nabízejí individuální konzultace při plánování optimální strategie péče o pacienta.(35) Mají tak potenciál rozšířit dostupnost FMT i na pracoviště, která s touto metodou nemají zkušenosti, a to při zachování adekvátní kvality a bezpečnosti.
ZÁVĚR
Problematika transplantace střevní mikrobioty je v současnosti předmětem intenzivního výzkumu a je diskutována v řadě odborných publikací. Velmi obtížně dnes nalezneme klinickou jednotku, u níž by se FMT minimálně v rámci základního výzkumu či experimentu na zvířatech netestovala.(2) Pro použití FMT v klinické praxi nicméně musíme vycházet z medicíny založené na důkazech. Výsledky randomizovaných kontrolovaných klinických hodnocení dnes máme prozatím pouze u léčby rekurentní klostridiové kolitidy.( 23,24,36,37) V ostatních indikacích je nutno FMT považovat stále za metodu striktně experimentální.
Podpořeno MZ ČR – RVO (FNBr, 65269705).
MUDr. Roman Stebel, Ph.D.
Je odborníkem v oblasti infekčních chorob. Svá studia dokončil na Lékařské fakultě Masarykovy univerzity, kde získal tituly MUDr. a Ph.D. Od roku 2012 působí na Klinice infekčních chorob FN Brno. Pracuje také jako odborný asistent na Lékařské fakultě MU. Jeho výzkum je zaměřen na široké spektrum infekčních onemocnění, zabývá se i významem změn střevní mikrobioty na zdraví člověka. Je aktivním členem Evropské společnosti pro klinickou mikrobiologii a infekční nemoci (ESCMID).
MUDr. Roman Stebel, Ph.D.
Klinika infekčních chorob LF MU a FN Brno
Jihlavská 20, 625 00 Brno
e-mail: stebel.roman@fnbrno.czGeri a Gero 2023; 12(2): 83–87
Zdroje
1. Rao K, Young VB. Fecal microbiota transplantation for the management of Clostridium difficile infection. Infect Dis Clin North Am 2015; 29(1): 109–122.
2. Ooijevaar RE, Terveer EM, Verspaget HW, et al. Clinical application and potential of fecal microbiota transplantation. Annu Rev Med 2019; 70(1): 335–351.
3. Kohout P, Vejmelka J. Fekální bakterioterapie v léčbě recidivující klostridiové enterokolitidy. Postgraduální Medicína 2014; 16(7): 729–734.
4. Gens KD, Elshaboury RH, Holt JS. Fecal microbiota transplantation and emerging treatments for Clostridium difficile infection. J Pharm Pract 2013; 26(5): 498–505.
5. Wilson BC, Vatanen T, Cutfield WS, et al. The super-donor phenomenon in fecal microbiota transplantation. Front Cell Infect Microbiol 2019; 9 : 2.
6. Johnsen PH, Hilpüsch F, Cavanagh JP, et al. Faecal microbiota transplantation versus placebo for moderate-to-severe irritable bowel syndrome: a double-blind, randomised, placebo-controlled, parallel - group, single-centre trial. Lancet Gastroenterol Hepatol 2018; 3(1): 17–24.
7. Bajaj JS, Kassam Z, Fagan A, et al. Fecal microbiota transplant from a rational stool donor improves hepatic encephalopathy: A randomized clinical trial. Hepatology 2017; 66(6): 1727–1738.
8. Mullish BH, Mcdonald JAK, Thursz MR, et al. Fecal microbiota transplant from a rational stool donor improves hepatic encephalopathy: A randomized clinical trial. Hepatology 2017; 66(4): 1354–1355.
9. Marotz CA, Zarrinpar A. Treating obesity and metabolic syndrome with fecal microbiota transplantation. Yale J Biol Med 2016; 89(3): 383–388.
10. Kang DW, Adams JB, Gregory AC, et al. Microbiota transfer therapy alters gut ecosystem and improves gastrointestinal and autism symptoms: an open-label study. Microbiome 2017; 5(1).
11. Yang Y, Tian J, Yang B. Targeting gut microbiome: A novel and potential therapy for autism. Life Sci 2018; 194 : 111–119.
12. Ooijevaar RE, van Beurden YH, Terveer EM, et al. Update of treatment algorithms for Clostridium difficile infection. Clin Microbiol Infect 2018; 24(5): 452–462.
13. Wang JW, Kuo CH, Kuo FC, et al. Fecal microbiota transplantation: Review and update. J Formos Med Assoc 2019; 118, 23–31.
14. Wang T, Kraft CS, Woodworth MH, et al. Fecal microbiota transplant for refractory Clostridium difficile infection interrupts 25-year history of recurrent urinary tract infections. Open Forum Infect Dis 2018; 5(2).
15. Moutinho BD, Baima JP, Rigo FF, et al. Fecal microbiota transplantation in refractory ulcerative colitis – a case report. J Int Med Res 2019; 47(2): 1072–1079.
16. Cotter PD, Ross RP, Hill C. Bacteriocins – a viable alternative to antibiotics? Nat Rev Microbiol 2013; 11(2): 95–105.
17. Ofir G, Sorek R. Contemporary phage biology: from classic models to new insights. Cell. 2018; 172(6): 1260–1270.
18. Khoruts A, Sadowsky MJ. Understanding the mechanisms of faecal microbiota transplantation. Nat Rev Gastroenterol Hepatol 2016; 13(9): 508–516.
19. Morrison DJ, Preston T. Formation of short chain fatty acids by the gut microbiota and their impact on human metabolism. Gut Microbes 2016; 7(3): 189–200.
20. Corrêa-Oliveira R, Fachi JL, Vieira A, et al. Regulation of immune cell function by short-chain fatty acids. Clin Transl Immuno 2016; 5(4): e73.
21. Mills JP, Rao K, Young VB. Probiotics for prevention of Clostridium difficile infection: Curr Opin Gastroenterol 2018; 34(1): 3–10.
22. Winston JA, Theriot CM. Impact of microbial derived secondary bile acids on colonization resistance against Clostridium difficile in the gastrointestinal tract. Anaerobe 2016; 41 : 44–50.
23. Kelly CR, Fischer M, Allegretti JR, et al. ACG Clinical Guidelines: prevention, diagnosis, and treatment of Clostridioides difficile infections. Am J Gastroenterol 2021; 116(6): 1124–1147.
24. van Prehn J, Reigadas E, Vogelzang EH, et al. European Society of Clinical Microbiology and Infectious Diseases: 2021 update on the treatment guidance document for Clostridioides difficile infection in adults. Clin Microbiol Infect 2021; 27: S1–S21.
25. Beneš J, Stebel R, Musil V, et al. Aktualizovaný doporučený postup pro léčbu nemocných s kolitidou vyvolanou Clostridioides difficile. Klin Mikrobiol Inf Lék 2022; 28(3): 77–94.
26. Polívková S, Vojtilová L, Husa P, et al. Doporučený postup fekální bakterioterapie pro léčbu rekurentní klostridiové kolitidy. Klin Mikrobiol Inf Lék 2018; 24(2): 57–64.
27. Polák P, Freibergerová M, Juránková J, et al. První zkušenosti s fekální bakterioterapií v léčbě relabující pseudomembranózní kolitidy způsobené Clostridium difficile. Klin Mikrobiol Inf Lék 2011; 17(6): 214–217.
28. Stebel R, Vojtilová L, Svačinka R, et al. Faecal microbiota transplantation in the treatment of Clostridioides difficile infection. Hum Microbiome J 2020; 16 : 100070.
29. Stebel R, Svačinka R, Vojtilová L, et al. Fekální bakterioterapie v léčbě klostridiové kolitidy. Epidemiol Mikrobiol Imunol 2018; 67(3): 104–109.
30. Polák P, Freibergerová M, Husa P, et al. Fekální bakterioterapie v léčbě rekurentní kolitidy způsobené Clostridium difficile na Klinice infekčních chorob Fakultní nemocnice Brno v letech 2010–2014 – prospektivní studie. Epidemiol Mikrobiol Imunol 2015; 64(4).
31. Tariq R, Pardi DS, Bartlett MG, et al. Low cure rates in controlled trials of fecal microbiota transplantation for recurrent Clostridium difficile infection: a systematic review and meta-analysis. Clin Infect Dis 2019; 68(8): 1351–1358.
32. Hui W, Li T, Liu W, et al. Fecal microbiota transplantation for treatment of recurrent C. difficile infection: An updated randomized controlled trial meta-analysis. PLOS ONE 2019; 14(1): e0210016.
33. Li YT, Cai HF, Wang ZH, et al. Systematic review with meta - -analysis: long-term outcomes of faecal microbiota transplantation for Clostridium difficile infection. Aliment Pharmacol Ther 2016; 43(4): 445–457.
34. Allegretti JR, Fischer M, Sagi SV, et al. Fecal microbiota transplantation capsules with targeted colonic versus gastric delivery in recurrent Clostridium difficile infection: a comparative cohort analysis of high and lose dose. Dig Dis Sci 2019; 64(6): 1672 – 1678.
35. Terveer EM, van Beurden YH, Goorhuis A, et al. How to: Establish and run a stool bank. Clin Microbiol Infect 2017; 23(12): 924–930.
36. Cammarota G, Ianiro G, Tilg H, et al. European consensus conference on faecal microbiota transplantation in clinical practice. Gut 2017; 66(4): 569 – 580.
37. van Nood E, Vrieze A, Nieuwdorp M, et al. Duodenal infusion of donor feces for recurrent Clostridium difficile. N Engl J Med 2013; 368(5): 407–415.
Štítky
Geriatrie a gerontologie Praktické lékařství pro dospělé Protetika
Článek Editorial
Článek vyšel v časopiseGeriatrie a Gerontologie
Nejčtenější tento týden
2023 Číslo 2- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Magnosolv a jeho využití v neurologii
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Trazodon pohledem praktického lékaře
-
Všechny články tohoto čísla
- Editorial
- Psychický a fyzický stav pacientů v následné nemocniční péči – analýza výsledků review české literatury
- Výsledky operačního léčení zlomenin proximálního femuru u pacientů operovaných na Traumatologické klinice Fakultní nemocnice Olomouc v letech 2017–2021
- Frailty – prevalence výskytu u akutně hospitalizovaných seniorů v letech 1995–2022
- Popis péče o seniory s diabetem v České republice: výsledky z Diabetologického registru
- Prevalence křehkosti a rizikové faktory jejího rozvoje u české populace starší 50 let – výsledky studie SHARE
- Možnosti využití fekální bakterioterapie
- Jak ještě na bércové vředy? Lokální léčba ulcerací bérce žilní etiologie podtlakovou terapií
- Presbyfagie versus dysfagie – role logopeda v řešení poruch polykání
- Hepatální osteodystrofie u fragilní geriatrické pacientky s cirhózou jaterní
- Geriatrie a Gerontologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Presbyfagie versus dysfagie – role logopeda v řešení poruch polykání
- Frailty – prevalence výskytu u akutně hospitalizovaných seniorů v letech 1995–2022
- Výsledky operačního léčení zlomenin proximálního femuru u pacientů operovaných na Traumatologické klinice Fakultní nemocnice Olomouc v letech 2017–2021
- Psychický a fyzický stav pacientů v následné nemocniční péči – analýza výsledků review české literatury
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání




