-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Nárůst prevalence celiakie – kde hledat odpovědi?
Increasing prevalence of celiac disease – where to look for answers?
Celiac disease or gluten-sensitive enteropathy is a relevant health concern in today’s world. Three prerequisites need to be met to trigger the disease, namely a genetic predisposition, gluten consumption, and environmental factors. Retrospective studies conducted across all age groups have ruled out the possibility that improved diagnostic methods were behind the increased prevalence. Since the genetic predisposition is more or less constant in the population, it is assumed that external factors may play a major role in this increase. Although it is generally believed that modern wheat varieties are to be blamed for the increase in gluten intolerance-related diseases, this assumption is refuted based on the analysis of the current and 100-year-old varieties. However, the increased prevalence could be related to modern lifestyles, changes in food preparation technology or composition, disruption of the intestinal barrier in viral disease, and other factors leading to intestinal dysbiosis. A possible preventive strategy in predisposed individuals could be the avoidance of gluten from the diet when ill, especially with a viral infection. This article openup a new perspective on the currently common autoimmune disease.
Keywords:
autoimmune diseases – causes of increasing prevalence – viruses as disease triggers
Autoři: M. Šťastná 1,2; A. Norek 1; J. Řádková 3; M. Sluková 4; M. Hrunka 5,6; P. Jabandžiev 5,6; L. Janda 1
Působiště autorů: Výzkumný ústav veterinárního lékařství, Brno 2Masarykova univerzita, Ústav biochemie, Brno 3Nemocnice AGEL Šternberk, Šternberk 1; Ústav sacharidů a cereálií, Vysoká škola chemicko-technologická v Praze, Praha 4; Pediatrická klinika Fakultní nemocnice Brno, Brno 5; Lékařská fakulta Masarykovy Univerzity, Brno 6
Vyšlo v časopise: Epidemiol. Mikrobiol. Imunol. 72, 2023, č. 3, s. 172-183
Kategorie: Souhrnné sdělení
Souhrn
Celiakie neboli glutenová enteropatie je relevantním problémem moderní doby. Pro rozvoj nemoci jsou nezbytné tři předpoklady, a to genetická predispozice, konzumace lepku a environmentální faktory. Retrospektivní studie vedené napříč všemi věkovými skupinami vyloučily, že by za nárůstem prevalence byl pokrok v diagnostických metodách. Vzhledem k tomu, že je genetická predispozice v populaci víceméně konstantní, předpokládá se, že zásadní roli v nárůstu nemocných hrají vnější vlivy. V současné době je přijímán názor, že za nárůst onemocnění spojených s glutenovou intolerancí mohou moderní odrůdy pšenice, tento předpoklad ale vyvracejí analýzy současných i 100 let starých odrůd. Příčina by však mohla souviset s moderním životním stylem, změnami v technologiích přípravy potravin nebo jejich složení, narušením střevní bariéry při virovém onemocnění a dalšími faktory vedoucími ke střevní dysbióze. Možnou preventivní strategií by u predisponovaných jedinců mohlo být vynechání lepku ze stravy v době onemocnění, a to především v případě onemocnění virového původu. Tento článek přináší nový pohled na toto v současnosti časté autoimunitní onemocnění.
Klíčová slova:
autoimunitní onemocnění – příčiny zvyšující se prevalence – viry jako spouštěč onemocnění
ÚVOD
Podstatou celiakie je nesnášenlivost glutenu a jiných jemu podobných proteinů, které se vyskytují v obilovinách. Jedná se o multifaktoriální geneticky podmíněné chronické autoimunitní onemocnění, které provází lidstvo zřejmě již od zavedení obilovin do stravy, tedy přibližně od doby 8–10 tisíc let před naším letopočtem [35]. První zmínka pochází od starořeckého lékaře Aretaea z Kappadokie (85–138 n. l.) [30]. Na začátku 20. století popsal celiakii jako chronickou poruchu trávení Samuel Gee a také vypozoroval souvislost mezi onemocněním a stravovacími návyky dětských pacientů. Již tehdy Gee navrhoval, že „povolené množství jídel z mouky by mělo být malé“ [31]. V roce 1928 Guido Fanconi popsal metabolické změny u dětí trpících celiakií, především hypokalcemii, hypofosfatemii a acidózu [24]. Zlomovou událostí bylo spojení obtíží pacientů s konzumací pšenice nizozemským pediatrem Willem Karlem Dickem [20]. Následně Charlotte Andersonová doporučila vynechání glutenu ze stravy u pacientů se zvýšeným množstvím tuku ve stolici [1]. Atrofie střevních klků typická pro celiakii byla definována v roce 1954 Johnem W. Paulleym [61]. Antigliadinové protilátky třídy IgA a IgG byly popsány roku 1964, protilátky proti endomysiu o dvacet let později [5, 41]. Genetické pozadí celiakie popsal imunolog Ludvig Sollid v roce 1989 [74]. V roce 1997 byl identifikován nejdůležitější marker pro diagnostiku onemocnění, kterým je tkáňová transglutamináza [21].
Obilný lepek neboli gluten obsažený v potravě působí jako prozánětlivý faktor, který ovlivňuje propustnost střevní bariéry a v malém množství se běžně dostává do krve konzumenta [68, 69]. Po požití glutenu dochází k interakci gliadinových peptidů se střevním epitelem, vedoucí k produkci interleukinu 8 enterocyty a aktivaci neutrofilů v lamina propria. Při navázání gliadinu na receptor CXCR3 dochází k uvolnění zonulinu, molekuly zvyšující propustnost těsných spojů enterocytů [14, 25]. U celiaků nebo také u pacientů s diabetem I. typu se hladina zonulinu významně zvyšuje již 15 minut po požití glutenu a maxima dosahuje 30 minut od konzumace [16]. K uvolnění prozánětlivých cytokinů v důsledku konzumace obilovin přispívají mimo gliadinů také inhibitory alfa amylázy a trypsinu. Tento sled dějů pak vede ke zvýšené propustnosti střevní bariéry a zvýšenému průsaku lepkových peptidů. Prolaminy se dostávají do lymfoidní tkáně tenkého střeva a způsobují aktivaci imunitní odpovědi a produkci především Th2, ale i Th1 lymfocytů. Tyto děje jsou v menší míře běžné, a u zdravých jedinců je Th2 odpověď imunitního systému tlumena Treg lymfocyty nebo produkcí protizánětlivého IL-10. U pacientů s celiakií je naopak poškození střevní sliznice akcelerováno produkcí prozánětlivých cytokinů (TNFα, INFγ, IL15, IL-21), enterocyty a intraepiteliálními lymfocyty [14]. Aktivace imunitní odpovědi vůči prolaminům (prolomení orální tolerance) vede k proliferaci Th1 lymfocytů, stimulaci cytotoxické odpovědi a k dalšímu poškození enterocytů. Tyto děje pak způsobují vyplavení a následně deregulaci tkáňové transglutaminázy 2 (TG2), což je především intracelulární enzym zprostředkovávající celou řadu reakcí. U savců se transglutamináza vyskytuje v extracelulární matrix a intracelulárních kompartementech téměř všech tkání a indukuje hojení a sestavování extracelulární matrix, buněčný růst, diferenciaci a také apoptózu [46, 82]. Po aktivaci TG2 dochází k deamidaci prolaminů a tím ke vzniku negativního náboje, což vede ke zvýšené afinitě těchto toxických prolaminových peptidů vůči HLA-DQ2/8 [63]. Tímto se rozbíhá kaskádovitá prozánětlivá reakce vedoucí k dalšímu poškození enterocytů, což překračuje jejich regenerační schopnost, a vznikají tak charakteristická zánětlivá ložiska (obr. 1).
Obr. 1. Mechanismus rozvoje celiakieFigure 1. Pathogenetic mechanism of celiac disease 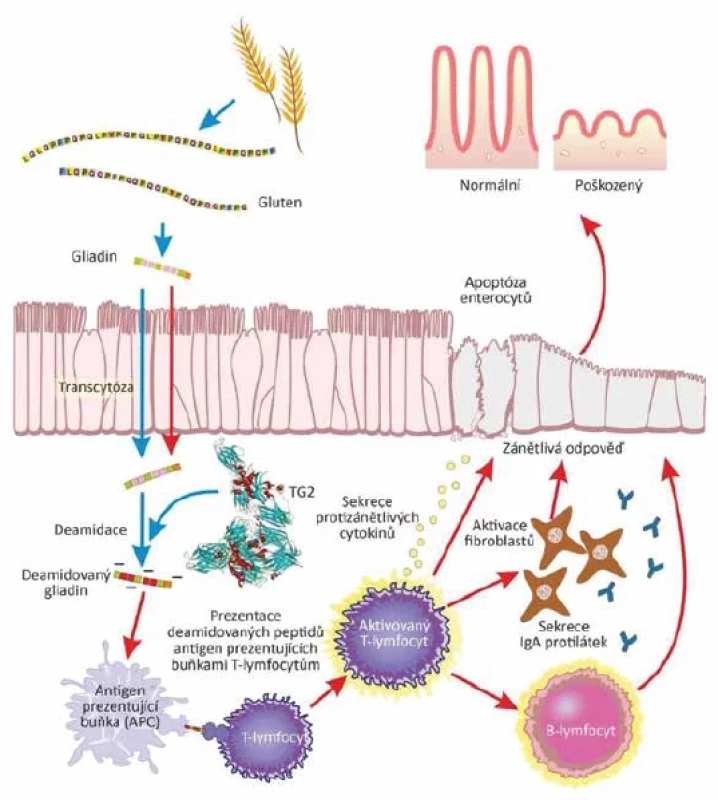
Diagnostika onemocnění je založena na průkazu protilátek třídy IgA a IgG proti tkáňové transglutamináze či lepkovým peptidům a biopsii tenkého střeva. Jedinou v dnešní době známou léčbou tohoto onemocnění je dodržování bezlepkové diety, které jednak představuje nákladnou variantu stravování a také s sebou přináší snížený příjem některých vitaminů, minerálních látek a vlákniny, což může vést k dalším zdravotním obtížím.
Nárůst onemocnění
Na celiakii bylo v historii nahlíženo spíše jako na vzácné onemocnění vyskytující se u dětí. Jedním z důvodů byly tehdejší možnosti diagnostiky, která byla založena na přítomnosti typických zažívacích obtíží nebo průkazu atrofie klků střevní sliznice. Nicméně zavedení sérologické diagnostiky, a tím zvýšení záchytu pacientů, nelze považovat za příčinu zvyšující se prevalence onemocnění, která je v dnešní době udávána celosvětově jako 1,4 % [71]. Retrospektivní studie poukazují na skutečný nárůst onemocnění bez ohledu na diagnostické metody. Příkladem je americká studie z roku 2009, v níž autoři porovnávali 9 133 mladých zdravých jedinců, jimž byla odebrána séra v letech 1948–1954 s 12 768 zdravými jedinci ze současné studie, kdy byl brán zřetel na stejný poměr mezi muži a ženami v obou skupinách. Z výsledků vyplývá, že za posledních padesát let došlo až k čtyřnásobnému nárůstu onemocnění [65]. Dalším příkladem je studie z Finska, kde byl zjištěn dvojnásobný výskyt onemocnění za posledních 20 let (1980–2000) [54]. Vzhledem k tomu, že zastoupení rizikového genotypu je v populaci víceméně konstantní, předpokládá se, že významnou roli ve vzrůstající prevalenci hrají environmentální faktory. V České republice je dle statistiky z roku 2021 (obr. 2) udáváno 25 127 prokázaných celiaků (0,23 % z celkové populace), za posledních sedm let se počet diagnostikovaných zvedl o 15 % (0,036 % v absolutních číslech; ÚZIS DATA). Prevalence je vyšší u žen než u mužů, a to v poměru 2–3 : 1 [27, 28].
Narůstající počet nových pacientů s celiakií nutí k zamyšlení, které faktory přispěly ke zvyšujícímu se výskytu tohoto onemocnění a k hledání možností, jak křivku narůstajících případů zploštit.
Obr. 2. Identifikace pacientů s celiakií v letech 2015–2021Figure 2. Identification of patients with celiac disease in 2015-2021 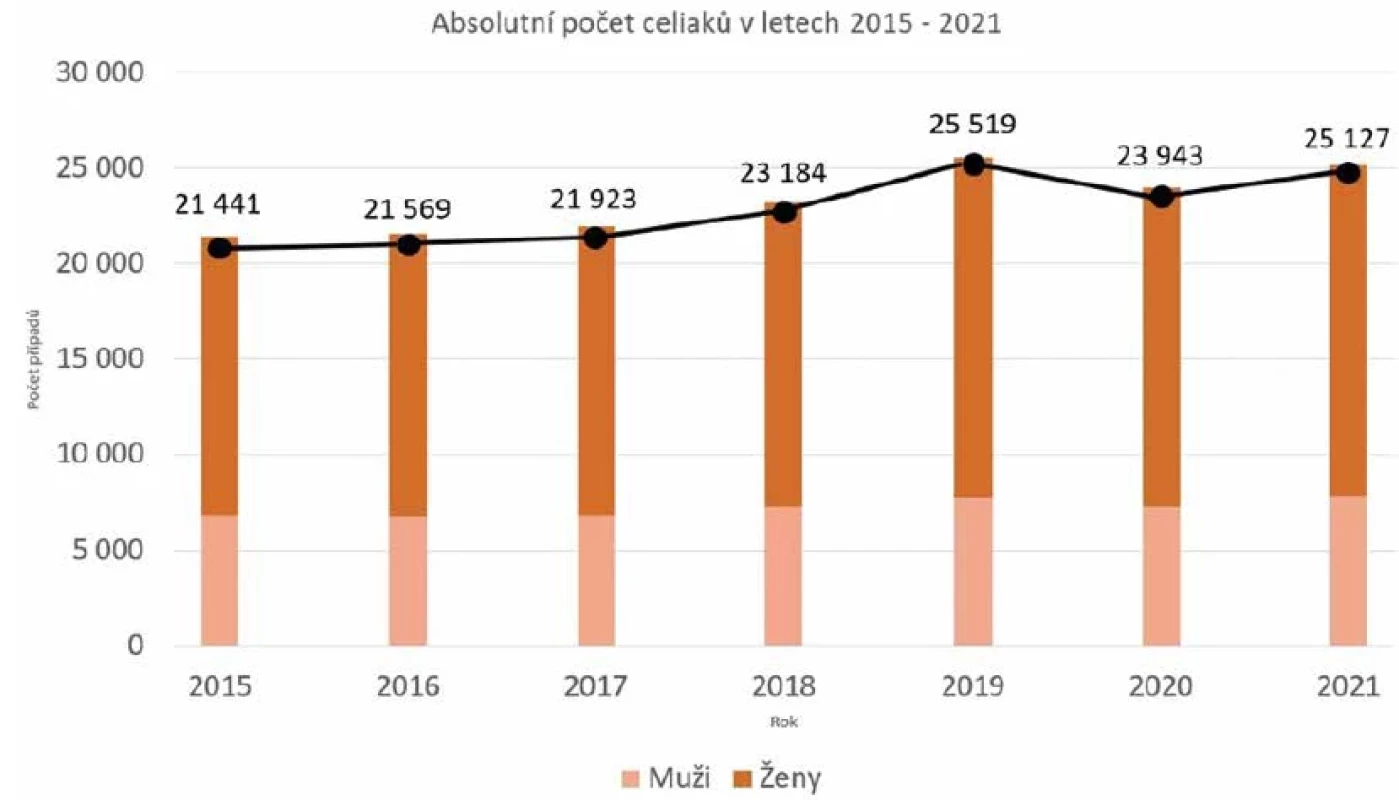
Pacient s celiakií je identifikován na základě vykázání diagnózy K 90.0 Střevní malabsorpce – Celiakie nebo L13.0 Jiná bulózní onemocnění – Dermatitis herpetiformis. V roce 2015 bylo na základě výše uvedených kritérií v datech NRHZS identifikováno 21 441 osob s celiakií v populaci ČR a v roce 2021 se počet osob zvýšil na 25 127. Tato statistika však nezahrnuje jedince, kteří ve vybraných letech nenavštívili lékaře anebo nebyli vykázáni pod zmíněnými diagnózami. Uvedená čísla vycházejí z analýzy Ústavu zdravotnických informací a statistiky ČR (ÚZIS), která je vytvořena z dat zdravotních pojišťoven v Národním registru hrazených zdravotních služeb (NRHZS).A patient with celiac disease is identified based on the report of diagnosis K 90.0 Intestinal malabsorption - Celiac disease or L13.0 Other bullous disorders - Dermatitis herpetiformis. In 2015, using the above criteria, 21,441 persons with celiac disease were identified in the Czech Republic from the National Register of Covered Health Services data, and their number increased to 25,127 in 2021. However, these statistics do not include individuals who either did not see a physician or were not reported under the aforementioned diagnoses in the selected years. These figures are based on the analysis of the Institute of Health Information and Statistics of the Czech Republic (IHIS), using compiled health insurers’ data from the National Register of Covered Health Services. FAKTORY HRAJÍCÍ ROLI VE ZVÝŠENÉ PREVALENCI
Může šlechtění pšenice za zvyšující se prevalenci?
Pšenice představuje jeden z nejvýznamnějších zdrojů výživy, a to především pro své využití při přípravě značného množství potravin, kde mezi nutričně nejdůležitější patří pečivo a těstoviny [45]. Triticum aestivum se vyvinulo zhruba před 250 tisíci lety díky dvěma polyploidizačním událostem (obr. 3). Nejprve křížením mezi Triticum urartu (genom AA) a příbuzným druhem Aegilops speltoides (genom BB), kdy vzniklo Triticum turgidum spp. diccocoides (AABB), a poté křížením mezi touto tetraploidní odrůdou a divokou diploidní trávou Aegilops tauschii (genom DD). Dnes známá pšenice tedy vznikla křížením asi před 10 tisíci lety a obsahuje genom AABBDD [36, 45]
Geny pro gliadin jsou u pšenice lokalizovány napříč celým genomem a liší se v homologii. S nárůstem polyploidie se významně mění i celiakální reaktivita (obr. 4). Diploidní druhy jednozrnek s A genomem, s výjimkou T. urartu (270 000 ppm), mají obsah reaktivního lepku okolo 4 000 ppm, tetraploidní druhy (T. durum, T. turgidum, T. dicoccum) cca 50 000 ppm a hexaploidní pšenice setá okolo 100 000 ppm [34]. Z publikovaných dat vyplývá, že odrůdy pěstované v českých zemích od třicátých let 20. století měly v průměru o 20 % vyšší obsah reaktivního lepku než odrůdy pěstované po roce 1990, což je znázorněno v obrázku 4 [83]. V současné době šlechtitelé při křížení obilí kromě dříve sledovaných znaků (výnos, odolnost proti chorobám, odolnost vůči suchu) berou při šlechtění nových odrůd snížený obsah reaktivního lepku jako důležitý znak. Za posledních 60 let navíc došlo ke změně v poměru gliadinů ke gluteninům ve prospěch gluteninových proteinů, přičemž celkový obsah proteinů zůstal stejný [83]. Vzhledem k pozitivnímu trendu křížení obilovin můžeme tento aspekt vyloučit jako příčinu zvyšující se prevalence celiakie.
Obr. 3. Vývoj hexaploidní pšenice seté se sestavou tří odlišných sad chromozomů AABBDDFigure 3. Development of hexaploid wheat with three different sets of AABBDD chromosomes 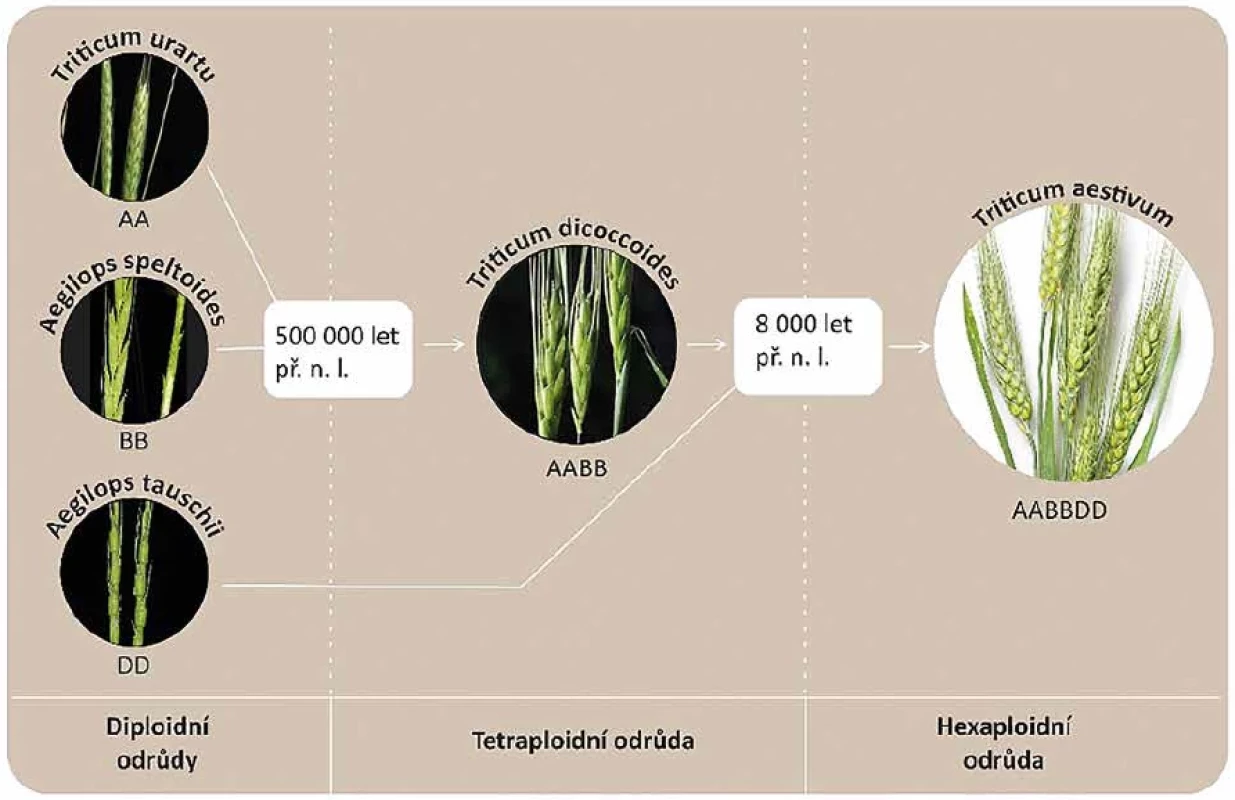
Donorem A sady je pravděpodobně doposud existující druh T. urartu, dále genomu B nám doposud neznámý (nedochovaný) předek Ae. speltoides a genom D: Ae. tauschiiThe donor of the A set is probably the extant species T. urartu, set B originates from a hitherto unknown (not extant) ancestor of Ae. speltoides, and set D is from Ae. tauschii Obr. 4. Grafy znázorňující změny obsahu reaktivního lepku (33-mer) v pšenici pěstované od začátku 20. století do dnešní doby a obsah reaktivního lepku v různých obilovinách (Zdroj dat: Thrackl, 2017).Figure 4. Graphs showing the changes in the reactive gluten (33-mer) content of wheat grown from the beginning of the 20thcentury to the present day and the reactive gluten content of different cereals (Data source: Thrackl, 2017). 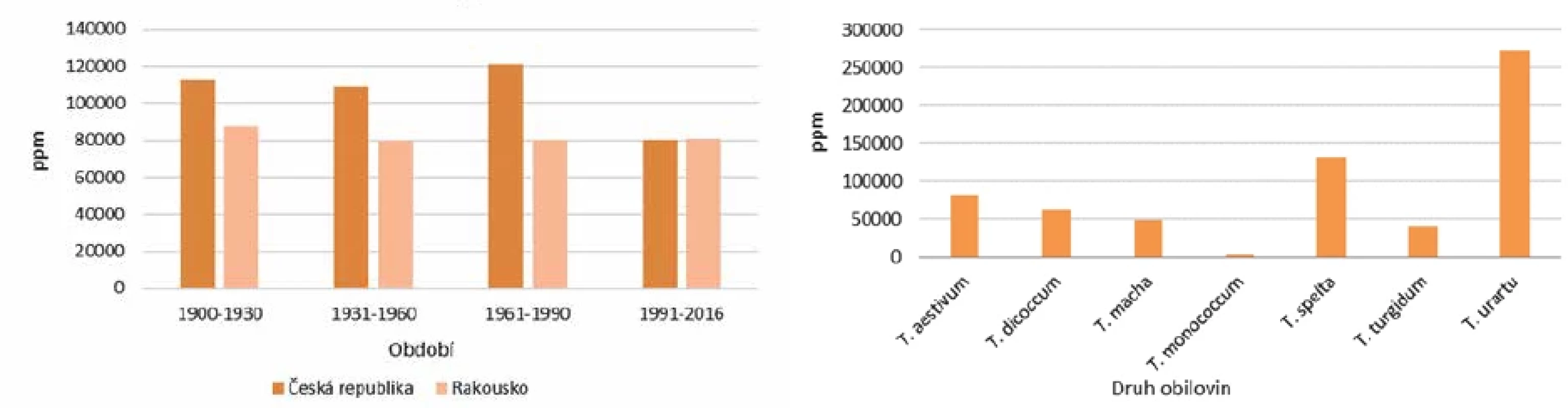
Obr. 5. Spotřeba pekárenských výrobků na jednoho obyvatele ČR od 1989 do 2021 (Zdroj: Český statistický úřad)Figure 5. Per capita consumption of bakery products in the Czech Republic from 1989 to 2021 (Source: Czech Statistical Office) 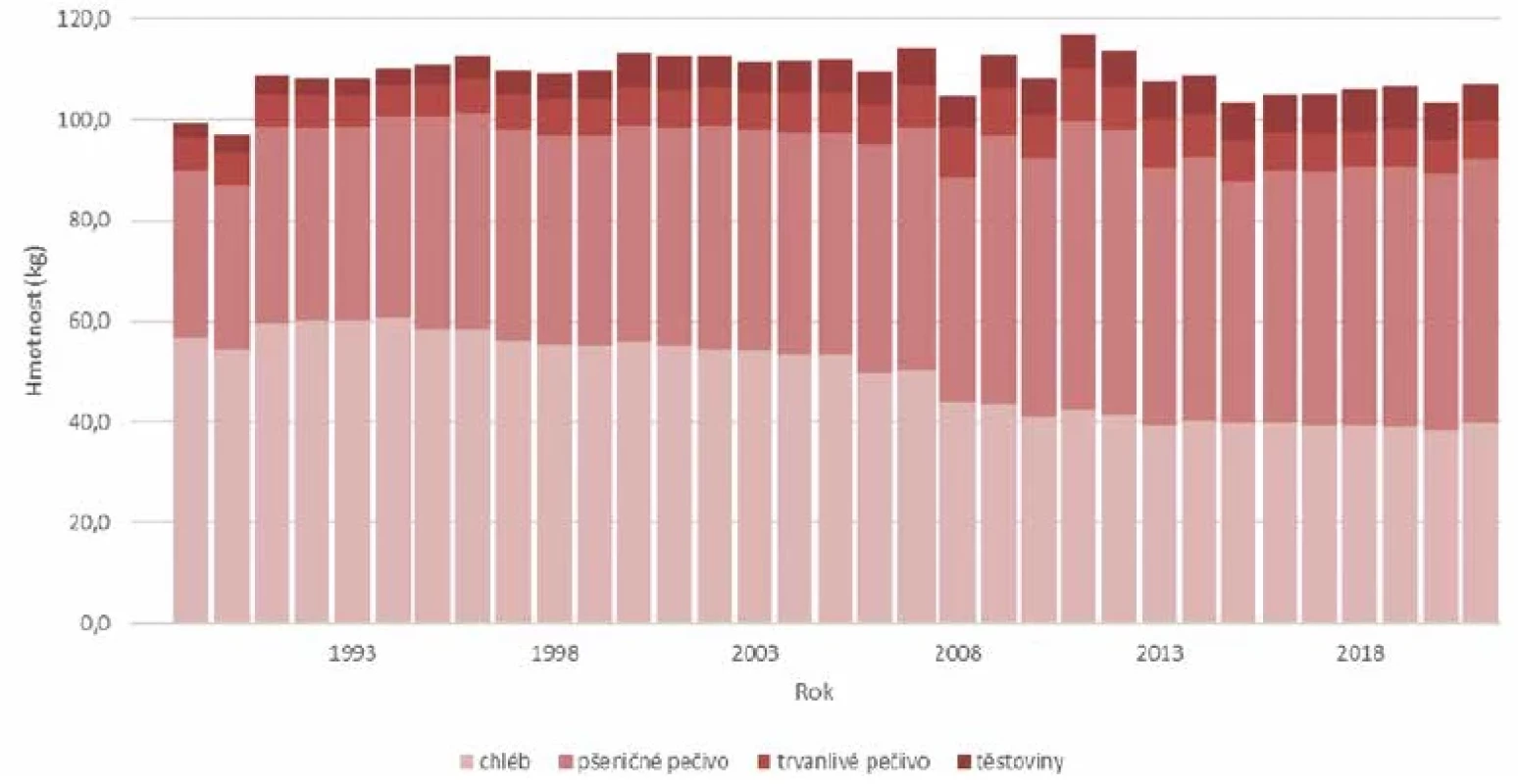
Může za zvyšující se prevalenci zvýšená spotřeba pečiva?
U mouky z běžně dostupné a námi pěstované hexaploidní pšenice, kterou dostáváme na stůl, jsou v obsahu reaktivní části lepku velké rozdíly v rámci jednotlivých odrůd. Obilné zrno obsahuje průměrně 60–80 % polysacharidů, 7–20 % proteinů a asi 1–5 % tuků a je významným zdrojem některých vitaminů a minerálních látek [49]. Hlavním produktem zpracování zrna je mouka a krupice, které jsou tvořeny převážně složkami endospermu, což znamená škrobem a bílkovinami [29]. Právě lepek (neboli gluten) dodává těstu potřebné viskoelastické vlastnosti a používá se také jako plnivo a zahušťovadlo [70]. Je to komplexní směs zásobních proteinů, které se nacházejí v obilném zrnu. Glutenové proteiny rozdělujeme na prolaminy a gluteniny, prolaminy jsou pak nazývány různě podle druhu obilí, ze kterého pocházejí. Nejvíce prolaminů najdeme u pšenice (Triticum spp.), která je základním zdrojem výživy pro asi 40 % lidské populace. Obsah prolaminů je zde zhruba 80–85 % z celkového proteinu [33, 38]. Kromě pšenice se gluten vyskytuje také v ječmenu, žitu a ovsu, což jsou hlavní zdroje glutenu ve stravě. Od poloviny padesátých let dvacátého století se spotřeba pšenično-žitného chleba v České republice postupně snižuje. V roce 1950 byla spotřeba v tehdejším Československu na obyvatele 87,4 kg chleba za rok a v současné době se ustálila kolem 40 kg za rok (obr. 5). U pšeničného pečiva dochází k opačnému trendu. V padesátých letech 19. století to bylo 16 kg a dnes je to kolem 50 kg pečiva na obyvatele (Český statistický úřad, 2014). V absolutních číslech je to mírný pokles (103,4 kg – 1950, respektive 90 kg – 2016), ale co se týká kvality, zvyšuje se spotřeba pšeničných výrobků zhruba o 15 %. Tato změna je ovšem pozvolná a změny v preferenci k bílému pečivu nekorelují se zvýšením prevalence za posledních dvacet let. Pokud zohledníme pokles reaktivního lepku v obilí o 20 % se zvýšenou spotřebou pšeničných výrobků o 15 %, nemůže změna preferencí obyvatel ke světlému pečivu stát za narůstající prevalencí celiakie.
Může za zvýšenou prevalenci celiakie revoluce v potravinářské technologii?
Pekárenský průmysl se u nás od roku 1990, kdy došlo k rozvolnění trhu, dynamicky vyvíjí. Již v té době byly při přípravě pečiva používány pekařské zlepšující přípravky, které zahrnovaly mléčné deriváty, sladovou mouku, emulgátor polynol či kyselinu askorbovou. Jako stabilizátory se u výrobků s prodlouženou trvanlivostí používaly například propionan (anebo samotná propionová kyselina), sorban (nebo sorbová kyselina) a siřičitany. Po roce 1990 se začaly v pekárenském průmyslu ve větším měřítku používat enzymy nebo enzymové preparáty, které slouží nejen k modifikaci vlastností těsta a senzorických parametrů pečiva, ale také k optimalizaci parametrů výrobního procesu. Spolu se změnou trendu v používání přídatných látek došlo také ke změně technologie výroby pečiva. Na přelomu 80. a 90. let se postupně odstoupilo od používání technologie třístupňově vedeného žitného kvasu. Příčinou bylo snížení konzumace chleba ve prospěch pšeničného pečiva, což vedlo k omezení ve výrobě a nemožnosti udržovat tradiční kvas. V dnešní době se používají hlavně vitální kvasy s vývojem kyselin, které obsahují převážně bakterie mléčného kvašení. Od tradičních kvasů se výše uvedené vitální kvasy liší vyšší kyselostí a stabilitou při přerušení výroby chleba a pečiva. Velké množství řemeslných pekáren pak připravuje kvas pomocí startovací kultury a přídavku pekařského droždí, kdy tento kvas má podobné vlastnosti a nutriční hodnotu jako dříve vyráběný třístupňově vedený žitný kvas, nelze jej však použít opakovaně. Významnou změnou v pekárenství je nabídka zamražených polotovarů s jejich následným dopečením přímo v prodejně. Tento typ výrobku je předpečen ve výrobně, následně šokově zamražen a dopraven do prodejny, kde je dopečen až před samotným uvedením na pult. Složení předpečených polotovarů se od běžného pečiva výrazně neliší, pro stabilizaci těsta však mohou být použity emulgátory nebo vybrané hydrokoloidy, které ovlivňují vaznost vody v těstě [72, 73].
Postupy přípravy pečiva prošly za posledních 40 let mnoha změnami jak z pohledu technologie výroby, tak i složení pečiva. Přestože má chleba připravený za použití startovací kultury a droždí podobné senzorické vlastnosti, při použití třístupňového vedení kvasu dochází k naštěpení části lepkových peptidů jak za účasti enzymů produkovaných mikroorganismy přítomnými v kvasu, tak i enzymy přítomnými v samotných obilovinách [15, 17, 56, 78]. Dle jedné ze studií použití probiotických kultur spolu s prodlouženou dobou fermentace při přípravě chleba vede ke snížení obsahu lepkových peptidů a tím ke snížení reaktivity pacientů s celiakií na takovýto chléb [19]. Co se týká přídatných látek, stále více lidí věnuje pozornost složení kupovaných výrobků a potravinám s vysokým obsahem aditiv se vyhýbá, což vede výrobce ke snaze tyto látky eliminovat. Přesto se však na trhu najde určité množství potravin, například různé druhy jemného pečiva, obsahující značné množství přídatných látek (zejména konzervačních), což může mít kumulativní negativní dopad na mikrobiom, respektive na střevní bariéru a tím i na zdraví jedince.
Aditiva
Přídatné látky neboli aditiva se používaly již v dobách před naším letopočtem, nicméně s industrializací a změnou stravovacích návyků došlo k významnému nárůstu používání těchto látek. Mezi první aditiva se řadí například prášek do pečiva, emulgátory do margarínů či barviva přidávaná do sýrů [86]. Při posuzování vlivu aditiv na lidské zdraví je nutné zohledňovat denní příjem jednotlivých látek a byla tedy zavedena hodnota ADI (Acceptable Daily Intake – přijatelná denní dávka). Tato hodnota vyjadřuje množství látky, které by při běžné denní konzumaci nemělo představovat zdravotní riziko pro konzumenta [55]. Problémem je však synergické působení některých aditiv. Například v jedné ze studií zkoumajících účinek aditiv na mikrobiom, konkrétně vliv benzoátu sodného (E211), dusitanu sodného (E250) a sorbanu draselného (E202), byl prokázán vliv těchto látek na střevní mikroorganismy. Některé z bakteriálních kmenů vykazovaly vůči těmto aditivům vysokou citlivost, např. Bacteroides coprocola, který je součástí zdravé mikrobioty, a Clostridium tyrobutyricum, což je kmen s protizánětlivými účinky. Nejvíce byly zkoumané bakterie citlivé na dusitan sodný. Nejvyšší inhibiční účinek byl zjištěn v případě, že se aditiva podávala současně, což poukazuje na synergický efekt [39]. Mezi další přídatné látky, které pravděpodobně vedly k redukci mikrobiálního osídlení, mohou patřit emulgátory. Příkladem může být polysorbát 80, který společně s hydrokoloidní karboxymethylcelulózou způsobuje redukci mikrobiální diverzity u myší, usnadňuje prostup bakterií přes střevní stěnu a také snižuje množství butyrátu ve střevě [40, 64]. Dále bylo zjištěno, že náhradní sladidla zvyšují riziko glukózové intolerance kvůli změně mikrobiálního osídlení, neboť jejich působením dochází ke zvýšení množství bakterií rodu Bacteroidetes a snížení množství bakterií rodu Firmicutes [80]. Konzumace sacharinu může vést ke snížení protizánětlivého potenciálu střevních bakterií a zvýšení rizika výskytu jaterního zánětu [7]. Přídatné látky v potravinách mají kumulativní účinek projevující se na zdraví člověka nepřímo, především vlivem na pestrost jeho mikrobiomu.
Enzymy v potravinářství
Mezi potravinová aditiva patří také enzymy, které jsou v potravinářství běžně používané. Příkladem je transglutamináza (TG) katalyzující tvorbu izopeptidových vazeb mezi proteiny. TG se v přírodě vyskytuje běžně. Tento enzym je součástí tkání savců, mikrobiálních buněk či rostlinných pletiv. Uplatňuje se v řadě klíčových fyziologických procesů, jakými jsou koagulace, antimikrobiální imunitní reakce nebo fotosyntéza. Nicméně její použití v potravinářství, především schopnost nespecificky spojovat polypeptidické řetězce, může vést k tvorbě nových antigenních struktur, podobně jako v případě interakce s lepkovými peptidy [2]. Zesíťování proteinů za použití transglutaminázy je využíváno při přípravě celé řady produktů, jako jsou sýry, zpracované maso či pečivo. Opracování suroviny pomocí TG zlepšuje pevnost, viskozitu, elasticitu i schopnost produktu vázat vodu. Kvůli nízké ceně je v průmyslu používána především transglutamináza mikrobiální (mTG). Mikrobiální TG se hojně používá při zpracování potravin, například při výrobě takzvaných proteinových vrstev, kterými se potahuje čerstvá zelenina, ovoce a zpracované potraviny pro prodloužení trvanlivosti. Dále se mTG používá při výrobě mléčných produktů či při zpracování masa [44]. V pekárenském průmyslu, zejména v zahraničí, je transglutamináza používána pro zlepšení vlastností těsta a textury chleba. Přídavek transglutaminázy zvyšuje pružnost a objem těsta až o 14 % [44]. Jedním z nejdiskutabilnějších problémů při používání transglutaminázy je však příprava bezlepkového pečiva [59]. U bezlepkového pečiva je zásadní otázka bezpečnosti používání tohoto enzymu, neboť přestože je mikrobiální TG od lidské tkáňové transglutaminázy na úrovni aminokyselinové sekvence odlišná, ve funkci jsou si tyto enzymy podobné [32]. mTG je schopná, stejně jako lidská tTG, zasíťovat či pospojovat řadu molekul s gliadinovými peptidy a tím vytvářet škálu epitopů, které rozpoznává imunitní systém. Jedna z publikací poukázala na zvýšenou reaktivitu protilátek třídy IgA pacientů s celiakií vůči gliadinům deamidovaným mTG [6]. U dalších výzkumů byla pozorována zvýšená reaktivita sér pacientů s celiakií na gliadin z chleba, při jehož výrobě byla použita mTG [13]. Tým A. Lernera vyslovil hypotézu, že by právě používání mTG mohlo stát za zvyšující se prevalencí celiakie [84]. Na druhou stranu, jiné výzkumy poukázaly na to, že zesíťování proteinů za použití mTG nevedlo k ovlivnění vazebné kapacity protilátek [67]. Při zkoumání rozdílů mezi tradičním chlebem a chlebem, který byl připraven za použití mTG, nebyl zjištěn žádný rozdíl v reaktivitě monoklonálních protilátek proti gliadinu ani proti deamidovanému gliadinu [37]. Dle nařízení 1332/2008/ES je v Evropské Unii zaveden jednotný systém používání a označování enzymů, které nepatří mezi aditiva nebo pomocné látky. Přidaná transglutamináza je poté na výrobcích zapsána pouze pod obecným pojmem „enzymy“. Ani samotní pekaři nemají možnost zjistit, zda některé používané přípravky obsahují daný enzym, protože dostávají enzymatické přípravky pod komerčními názvy jako např. Perfekt, Diapol Instant a Perfekt BACK. Odpověď na otázku bezpečnosti používání transglutamináz v potravinářském průmyslu je tedy stále nejednoznačná, vyhnutí se transglutaminázám v potravinách však znesnadňuje fakt, že konkrétní enzym nemusí být dle legislativy jmenovitě uveden ve složení výrobku.
Jakou roli hrají v nemoci virová onemocnění?
První spojitost mezi zvýšeným výskytem celiakie a virovou infekcí byla zjištěna v roce 1980, kdy byla nalezena homologie mezi EIB proteinem lidského adenoviru 12 a α‐gliadinem [42]. Virová infekce jako stimulační mechanismus nebo spouštěč celiakie je jednou z hlavních hypotéz prolomení orální tolerance i dnes. Předpokládá se, že reoviry, rotaviry, adenoviry, respirační syncyciální virus, herpes simplex typu 1, viry hepatitidy C a B, enteroviry, chřipkový virus, cytomegalovirus nebo virus Epstein-Barrové mohou hrát roli při prolomení orální tolerance a rozvoji celiakie [66]. Některé studie spojily opakované infekce rotaviry a parechoviry se zvýšeným rizikem rozvoje celiakie [77, 81]. V TEDDY studii bylo zjištěno, že gastrointestinální infekce zvyšují riziko rozvoje celiakie o 33 % u predisponovaných dětí v následujících třech měsících po infekci [43]. Jiné studie zabývající se spojitostí mezi virovými infekcemi a rozvojem onemocnění poukázaly na vliv enterovirů. Dle jedné z norských studií měly děti s více než deseti infekcemi před 18. měsícem věku významně vyšší riziko rozvoje onemocnění než děti, které měly maximálně čtyři infekce před dosažením 18. měsíce [57]. Dále Lindfords et al. poukázali na kumulativní efekt enterovirových infekcí a vyššího množství lepku ve stravě u dětí do dvou let věku [52]. Riziko rozvoje celiakie v dětském věku bylo spojeno také s vyšším výskytem infekcí dýchacích cest během prvních dvou let života [3]. Vliv virů je pravděpodobně kmenově specifický. Příkladem jsou izoláty reovirů T1L a T3D, které se liší způsobem replikace, patogenezí, a navíc také tím, že T1L na rozdíl od T3D je schopen infikovat střevo a narušit zde homeostázu imunitního systému [8]. Důkazem je experiment, při němž byly myši infikovány T1L reovirem a následně u nich bylo pozorováno prolomení orální tolerance k ovalbuminu. Při infekci HLA-DQ8 transgenních myší reovirem T1L došlo k navození imunitní odpovědi vůči gliadinu a spuštění prozánětlivé reakce vůči tomuto antigenu. Mechanismus prolomení orální tolerance je pravděpodobně způsoben stimulací interferonů I. typu, které inhibují Treg lymfocyty, a naopak podporují prozánětlivé prostředí a tvorbu Th1 lymfocytů. Reoviry jsou běžnými původci infekcí v dětském věku a protilátky proti těmto virům bývají u lidí s celiakií zvýšené, což může poukazovat na možnou souvislost mezi virovou infekcí a rozvojem celiakie [8,9]. Další možný mechanismus prolomení orální tolerance souvisí s rotaviry, které jsou nejčastějším původcem akutních gastroenteritid u kojenců a dětí po celém světě. Rotaviry infikují zralé enterocyty tenkého střeva a způsobují nadměrnou stimulaci transepiteliální sekrece iontů, která vede k malabsorpci a osmotickému průjmu. Rotaviry také zvyšují koncentraci intracelulárního vápníku (Ca2+), a to působením nestrukturálního proteinu 4 (NSP4), což je enterotoxin indukující vyplavení vápenatých iontů z endoplasmatického retikula mechanismem závislým na fosfolipáze C (obr. 6). Zvýšení koncentrace vápníku uvnitř a po jejím prasknutí i vně buňky může vést k aktivaci transglutaminázy a tím deamidaci lepkových peptidů [11, 12, 85]. Vzhledem ke zjištěným faktům, je jednou z navrhovaných preventivních strategií očkování proti virovým infekcím především u dětí s genetickou predispozicí. Mezi odbornou vědeckou i lékařskou komunitou panuje shoda, že virová onemocnění mohou spouštět celiakii. K tomuto faktu by se mělo přihlížet u dětí z rodin, kde se vyskytuje genetická predispozice pro celiakii a jako preventivní opatření by mohlo působit vynechání lepku ze stravy v průběhu virového onemocnění.
Obr. 6. Možný mechanismus vlivu rotavirové infekce na rozvoj celiakieFigure 6. Mechanism of possible involvement of rotavirus infection in celiac diseas 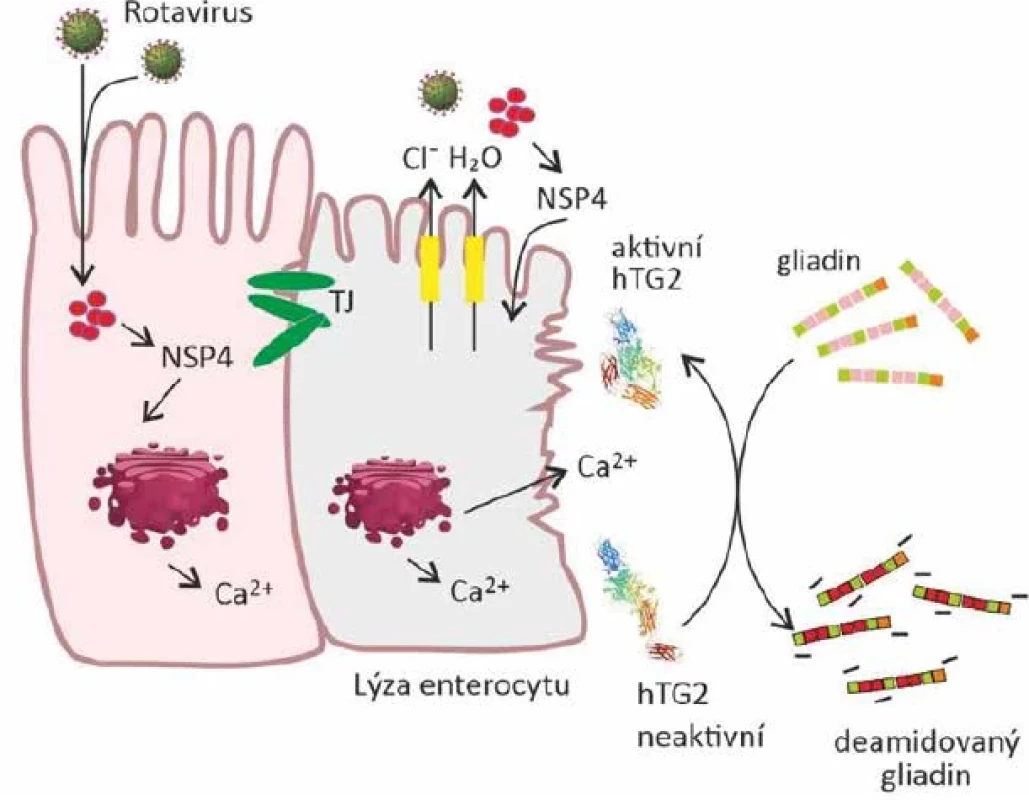
Nemůže za zvýšenou prevalenci celiakie změna v odolnosti střevní bariéry?
Syndrom zvýšené střevní propustnosti neboli takzvaně „leaky gut syndrome“ je používán pro abnormální translokaci velkých molekul a je často spojován s celiakií [26]. Vzhledem k tomu, že je trávicí ústrojí neustále vystavováno kontaktu s vnějším prostředím skrze přijatou potravu, je správná funkce střevní bariéry nezbytná pro udržení homeostázy a ochranu před vnějším prostředím. Slizniční bariérová funkce střeva je dynamickou entitou zahrnující mechanickou, chemickou, imunologickou a biologickou složku [87]. Při ochraně organismu před vnějšími stimuly je nezbytně nutná vzájemná interakce a kooperace těchto složek, kdy nesprávná funkce bariéry vede k zvýšenému prostupu mikroorganismů, antigenů ze stravy či xenobiotik do subepiteliálních vrstev střev, což může vést k imunologicky mediovanému poškození organismu a jak je tomu v případě celiakie – k propuknutí chronického onemocnění [26, 50]. Jedním z mechanismů rozvolnění těsných spojů enterocytů je výše zmíněné uvolnění zonulinu přes navázání gliadinu na receptor CXCR3. Stejná aktivace zonulinové dráhy probíhá přes navázání většího množství bakterií, které se děje především při bakteriálním přerůstání v tenkém střevě (SIBO – small intestinal bacterial overgrowth) souvisejícím s dysbiózou mikrobiomu. Tyto mechanismy pravděpodobně představují obrannou reakci těla a přispívají k vrozeným obranným mechanismům hostitele při reakci na změny v ekosystému mikrobiálního osídlení [22, 23, 26]. Jedna z prací zabývajících se hladinou zonulinu u žen s různým BMI poukázala na to, že skupina s nižší hladinou zonulinu měla vyšší množství bakterií rodu Ruminococcaceae a Faecalibacterium. Tyto bakterie produkují butyrát, což je mastná kyselina s krátkým řetězcem, která slouží jako výživa pro enterocyty a pravděpodobně snižuje střevní permeabilitu cestou snížení množství zonulinu a snížení prozánětlivé reakce [60]. Příznivý vliv mikrobiomu na zdraví hostitele je uskutečňován mimo jiné skrze jeho produkty, takzvaná postbiotika. Mezi nejvýznamnější postbiotika patří mastné kyseliny s krátkým řetězcem neboli SCFA (short chain fatty acids), kam patří acetát, propionát nebo butyrát [62]. Tyto látky ovlivňují homeostázu střeva minimálně třemi způsoby. Zaprvé podporují buněčnou proliferaci a diferenciaci, zadruhé ovlivněním metabolismu samotné buňky a zatřetí působí jako inhibitor histon deacetylázy, enzymu podílejícím se na posttranslačních modifikacích. SCFA vykazují imunomodulační potenciál a hrají roli v balancování mezi zánětlivým a protizánětlivým stavem organismu skrze multi-proteinové inflamazomové komplexy a ovlivněním maturace a aktivity T-lymfocytů ve prospěch regulačních namísto prozánětlivých T-lymfocytů [48, 62]. Mezi další mechanismy, kterými mikrobiom působí na hostitele, patří soupeření s patogeny o nutrienty a místo, syntéza látek (např. některých vitaminů), regulace střevní motility prostřednictvím působení na enterický nervový systém nebo produkce antimikrobiálních látek (bakteriocinů) [76]. Příznivý vliv probiotických mikroorganismů je kmenově specifický. Příkladem jsou studie, kdy bylo použito mléko fermentované bakterií Lacticaseibacillus paracasei CBAL74 u dětí předškolního věku jako prevence běžných infekčních respiračních a gastrointestinálních onemocnění. Z výsledků vyplývá, že u testované skupiny dětí došlo ke snížení výskytu těchto zánětlivých onemocnění [18]. Bruno et al. zkoumali vliv postbiotik obsažených v mléce, které bylo fermentováno L. paracasei, na rotavirovou infekci in vitro. Přestože nedošlo k ochraně před infikováním buňky virem, preinkubace buněk se sušeným mlékem vedla ke snížení produkce prozánětlivých cytokinů a poškození enterocytů [10].
V dnešní době je zdravé mikrobiální osidlování narušováno takzvaným „západním životním stylem“, přemírou antibiotik, některými aditivy a emulgátory, pesticidy a jinými environmentálními faktory. Problematiku narušení zdravého mikrobiálního osídlení také popisuje hygienická hypotéza, anebo v modernějším pojetí „hypotéza mizejícího mikrobiomu“. Obě tyto hypotézy tvrdí, že trvale snížená diverzita mikrobiomu ve vyspělých zemích může být příčinou vyššího výskytu chronických onemocnění [53, 79]. Jednou z příčin ztráty mikrobiální diverzity je strava bohatá na tuky a rafinovaný cukr. Myši na tomto typu diety vykazovaly nižší mikrobiální rozmanitost. Obnovení mikrobiálního osídlení lze docílit stravou bohatou na vlákninu [75]. Obecným názorem je, že dysbióza střevního mikrobiomu představuje významný faktor v patogenezi střevních onemocnění, jako jsou idiopatické střevní záněty, syndrom dráždivého tračníku, ale také mimostřevních poruch včetně autoimunitních onemocnění, diabetu I. typu nebo obezity [58].
Vhodným příkladem pro studium environmentálních faktorů na prevalenci celiakie je porovnání výskytu onemocnění v Karélii a Finsku. Tyto dva regiony mají velice podobné geografické podmínky, konzumují podobné množství obilovin a žijí zde geneticky příbuzní obyvatelé (Karelové, Finové a Vepsové), kteří se liší především socioekonomickými podmínkami. Při posuzování prevalence celiakie byl výskyt onemocnění u dětí z Finska 1 : 107, u dětí z Karélie 1 : 496. Celiakie byla stanovena na základě protilátek proti transglutamináze a následně potvrzena biopticky. Vzhledem k podobnému příjmu glutenu ve stravě, výskytu HLA-DQ2/8 a jiných rizikových faktorů, je nejpravděpodobnějším vysvětlením velkého rozdílu v incidenci celiakie rozdíl v socioekonomických podmínkách. V Karélii je také obecně nižší výskyt autoimunitních onemocnění jako diabetes I. typu nebo atopických onemocnění u dětí do patnácti let. Přestože je v této problematice nutno zohlednit také úroveň a dostupnost lékařské péče v obou zemích, mohl by být rozdílný výskyt autoimunitních onemocnění vysvětlen právě „hypotézou mizejícího mikrobiomu“ a kvalitou střevního mikrobiomu [4, 47]. Na spojitost mezi změnou v mikrobiálním osídlení před propuknutím celiakie navíc poukazuje studie, ve které zjistili, že prolomení orální tolerance předchází zvýšený výskyt prozánětlivých střevních mikroorganismů [51].
Škála působení mikrobiomu a probiotických mikroorganismů na lidské zdraví je velká a pochopení mechanismů jejich působení může vést k předcházení patofyziologických mechanismů vedoucích k rozvolnění jeho bariérové funkce. V dnešní době se vracíme k tomu, co řekl Hippokrates před 2 500 lety, tedy že „všechny nemoci začínají ve střevech“. Dle dostupných poznatků má mikrobiom a jeho produkty významný vliv na kondici střeva a střevní bariéry. Podpora pestrého mikrobiálního osídlení by měla být jednou ze zásadních strategií při snaze o prevenci propuknutí celiakie.
ZÁVĚR
Pro rozvoj celiakie je zásadní genetická predispozice, konzumace glutenu a spolupůsobení environmentálních faktorů. Ne u všech jedinců s genetickou dispozicí se rozvine klinické onemocnění navzdory přítomnosti glutenu ve stravě. Důležitou roli má také střevní bariéra, která chrání predisponovaného jedince před vlivem okolí. Zvýšená střevní propustnost dovoluje vyšší interakci prolaminových peptidů s imunitním systémem a rozvoj patofyziologického procesu končícího celiakií. Zásadní otázkou je, zda je propuknutí celiakie důsledkem dlouhodobé kumulace změn životního stylu, vedoucí k soustavnému narušování střevní bariéry, anebo samotné genetické pozadí vede k deregulaci bariérových mechanismů.
S přibývajícími znalostmi o vlivu environmentálních faktorů na lidské zdraví i kondici mikrobiomu začíná být zřejmé, že kombinací zvýšené střevní propustnosti, dysbiózy mikrobiomu spolu s genetickou predispozicí a konzumací lepku vytvoříme dokonalý koktejl spouštěcích faktorů vedoucích k rozvoji celiakie. Přestože neexistuje jen jeden činitel, který ovlivňuje rozvoj onemocnění, je možné, že faktory jako změna životního stylu, která zahrnuje důraz na vyšší čistotu, změny ve zpracování potravin a stravování, možný zvýšený výskyt virových onemocnění, délka kojení dětí a mnoho dalších, redukují bariérovou funkci střeva, především na úrovni mikrobiomu. Potenciálním řešením by mohlo být doplňování mikrobiomu prospěšnými bakteriálními kmeny jak prostřednictvím probiotických preparátů, tak například fermentovanými potravinami a dále v případě onemocnění, zejména virového původu, vyloučení protizánětlivého lepku na přechodnou dobu ze stravy. Tato opatření by mohla vést ke snížení rizika rozvoje onemocnění především u dětských pacientů z rodin, kde se celiakie vyskytuje.
Poděkování
Podpořeno z programového projektu Ministerstva zdravotnictví ČR s registračním číslem NU23-06-00553
Do redakce došlo dne 10. 3. 2023.
Adresa pro korespondenci:
RNDr. Lubomír Janda, Ph.D.
Výzkumný ústav veterinárního lékařství, Brno
Hudcova 296/70 621 00 Brno
e-mail: lubomir.janda@vri.cz
Zdroje
- Anderson CM, Frazer AC, French JM, et al. Coeliac disease: gastro-intestinal studies and the effect of dietary wheat flour. The Lancet, 1952;259.6713 : 836–842.
- Agardh D, Matthias T, Wusterhausen P, et al. Antibodies against neo-epitope of microbial and human transglutaminase complexes as biomarkers of childhood celiac disease. Clin Exp Immunol, 2020;199(3):294–302.
- Auricchio R, Cielo D, de Falco R, et al. Respiratory Infections and the Risk of Celiac Disease. Pediatrics, 2017;140(4):e20164102.
- Bach JF. The hygiene hypothesis in autoimmunity: the role of pathogens and commensals. Nature Reviews Immunology, 2018;18(2):105–120.
- Berger E, Buergin-Wolff A, Freudenberg E. Diagnostic value of the demonstration of gliadin antibodies in celiac disease. Klinische Wochenschrift, 1964;42 : 788–790.
- Berti C, Roncoroni L, Falini ML, et al. Celiac-related properties of chemically and enzymatically modified gluten proteins. J Agric Food Chem, 2007;21;55(6):2482–2488.
- Bian X, Tu P, Chi L, et al. Saccharin induced liver inflammation in mice by altering the gut microbiota and its metabolic functions. Food and Chemical Toxicology, 2017;107(Pt B):530–539.
- Bouziat R, Hinterleitner R, Brown JJ, et al. Reovirus infection triggers inflammatory responses to dietary antigens and development of celiac disease. Science, 2017;356(6333):44–50.
- Brown JJ, Jabri B, Dermody TS. A viral trigger for celiac disease. PLoS pathogens, 2018;14(9):e1007181.
- Bruno C, Paparo L, Pisapia L, et al. Protective effects of the postbiotic deriving from cow’s milk fermentation with L. paracasei CBA L74 against Rotavirus infection in human enterocytes. Scientific Reports, 2022;12(1):6268.
- Buccigrossi V, Laudiero G, Russo C, et al. Chloride secretion induced by rotavirus is oxidative stress-dependent and inhibited by Saccharomyces boulardii in human enterocytes. PloS one, 2014;9(6): e99830.
- Buccigrossi V, Poeta M, Cioffi V, et al. Lacticaseibacillus rhamnosus GG counteracts rotavirus-induced ion secretion and enterocyte damage by inhibiting oxidative stress and apoptosis through specific effects of living and postbiotic preparations. Frontiers in Cellular and Infection Microbiology, 2022;12 : 854989.
- Cabrera-Chávez F, Rouzaud-Sández O, Sotelo-Cruz N, Calderón de la Barca AM. Transglutaminase treatment of wheat and maize prolamins of bread increases the serum IgA reactivity of celiac disease patients. Journal of agricultural and food chemistry, 2008;56(4): 1387–1391.
- Caio G, Volta U, Sapone A, et al. Celiac disease: a comprehensive current review. BMC Medicine, 2019;17(1):142. doi:10.1186/ s12916-019-1380-z.
- Caputo I, Lepretti M, Martucciello S, Esposito C. Enzymatic strategies to detoxify gluten: implications for celiac disease. Enzyme research, 2010.
- Clemente MG, De Virgiliis S, Kang JS, et al. Early effects of gliadin on enterocyte intracellular signalling involved in intestinal barrier function. Gut, 2003;52(2):218–223.
- Comino I, de Lourdes Moreno M, Real A, et al. The gluten-free diet: testing alternative cereals tolerated by celiac patients. Nutrients, 2013;5(10):4250–4268.
- Corsello G, Carta M, Marinello, et al. Preventive effect of cow’s milk fermented with Lactobacillus paracasei CBA L74 on common infectious diseases in children: A multicenter randomized controlled trial. Nutrients, 2017;9(7):669.
- Di Cagno R, De Angelis M, Auricchio S, et al. Sourdough bread made from wheat and nontoxic flours and started with selected lactobacilli is tolerated in celiac sprue patients. Applied and environmental mikrobiology, 2004;70(2):1088–1096.
- Dicke WK, Weijers HA, Kamer JH VD. “Coeliac disease the presence in wheat of a factor having a deleterious effect in cases of coeliac disease.” Acta paediatrica, 1953;42.1 : 34–42.
- Dieterich W, Ehnis T, Bauer M, Donner P, Volta U, Riecken EO, Schuppan D. Identification of tissue transglutaminase as the autoantigen of celiac disease. Nature Medicine volume, 1997;3 : 797–801.
- Drago S, El Asmar R, Di Pierro M, et al. Gliadin, zonulin and gut permeability: Effects on celiac and non-celiac intestinal mucosa and intestinal cell lines. Scandinavian journal of gastroenterology, 2006;41(4):408–419.
- El Asmar R, Panigrahi P, Bamford P, et al. Host-dependent zonulin secretion causes the impairment of the small intestine barrier function after bacterial exposure. Gastroenterology, 2002;123(5):1607–1615.
- Fanconi G. Der intestnal infantlismus und ähnliche formen der chronischenver-dauungstörung: Ihre behandlung mit früchten und gemüsen. Berlin: S. Karger; 1928.
- Fasano A. Leaky gut and autoimmune diseases. Clinical Reviews in Allergy and Immunology, 2012;42(1):71–78. doi:10.1007/ s12016-011-8291-x.
- Fasano A. All disease begins in the (leaky) gut: role of zonulin-mediated gut permeability in the pathogenesis of some chronic inflammatory diseases. F1000Res, 2020;9:F1000 Faculty Rev-69.
- Frič P, Nevoral J. Cílený screening celiakie. Interní medicína pro praxi, 2009;11(11):484–487.
- Frühauf P, Bronský J, Dědek P, et al. Celiakie-doporučený postup pro diagnostiku a terapii u dětí a dospívajících. Pediatrie pro praxi, 2016;17(3):i-vii.
- Gabrovská D, Hálová I, Chrpová MID, et al. Obiloviny v lidské výživě. Praha: Potravinářská komora České republiky, Česká technologická platforma pro potraviny, 2015.
- García Nieto VM. A History of Celiac Disease. In Rodrigo L, Pena A.S. (eds.). Celiac Disease and Non-Celiac Gluten Sensitivity. Barcelona, Spain: OmniaScience. 2014 : 45–59.
- Gee S. J. “On the coeliac affection”. St Bartholomew’s Hospital Report, 1888;4 : 17–20.
- Gerrard JA, Sutton KH. Addition of transglutaminase to cereal products may generate the epitope responsible for coeliac disease. Trends in Food Science & Technology, 2005;16(11):510–512.
- Giraldo P, Benavente E, Manzano-Agugliaro F, Gimenez E. Worldwide research trends on wheat and barley: A bibliometric comparative analysis. Agronomy, 2019;9(7):352.
- Grausgruber H. Content of the immunodominant 33-mer peptide from α2-gliadin in common and ancient wheat flours determined by the G12 sandwich ELISA, 2018.
- Guandalini S. Historical perspective of celiac disease. In Fasano A., Troncone R., Branski D (eds.). Frontiers in celiac disease. Pediatric and Adolescent Medicine, 2008;12 : 1–11. doi:10.1159/000128267.
- Hancock J. F. Plant evolution and the origin of crop species. CABI: 2012.
- Heil A, Ohsam J, van Genugten B, et al. Microbial transglutaminase used in bread preparation at standard bakery concentrations does not increase immunodetectable amounts of deamidated gliadin. Journal of agricultural and food chemistry, 2017;65(32):6982–6990.
- Hoffmanová I. Celiakie. Praha: Mladá fronta, 2019. Edice postgraduální medicíny. ISBN 978-80-204-5414-0.
- Hrncirova L, Hudcovic T, Sukova E, et al. Human gut microbes are susceptible to antimicrobial food additives in vitro. Folia Microbiol, 2019;64 : 497–508.
- Chassaing B, Koren O, Goodrich JK, et al. Dietary emulsifiers impact the mouse gut microbiota promoting colitis and metabolic syndrome. Nature, 2015;519(7541):92–96. doi:10.1038/nature14232.
- Chorzelski TP, Beutner EH, Sulej J, et al. IgA anti-endomysium antibody. A new immunological marker of dermatitis herpetiformis and coeliac disease. British Journal of Dermatology, 1984;111(4):395–402.
- Kagnoff MF, Austin RK, Hubert JJ, Bernardin JE, Kasarda DD. Possible role for a human adenovirus in the pathogenesis of celiac disease. J Exp Med, 1984;1;160(5):1544–1557. doi: 10.1084/ jem.160.5.1544. PMID: 6491604; PMCID: PMC2187489.
- Kemppainen KM, Lynch KF, Liu E, et al. Factors That Increase the Risk of Celiac Disease Autoimmunity After a Gastrointestinal Infection in Early Life. Clin Gastroenterol Hepatol, 2017;15 : 694 – 702. doi: 10.1016/j.cgh.2016.10.033.
- Kieliszek M, Misiewicz A. Microbial transglutaminase and its application in the food industry. A review. Folia Microbiologica, 2014;59(3):241–250.
- Kiszonas AM, Morris CF. Wheat breeding for quality: A historical review. Cereal Chemistry, 2018;95(1):17–34.
- Klöck C, DiRaimondo TR, Khosla C. Role of transglutaminase 2 in celiac disease pathogenesis. Seminars in immunopathology, 2012;34(4):513–522.
- Kondrashova A, Mustalahti K, Kaukinen K, et al. Lower economic status and inferior hygienic environment may protect against celiac disease. Annals of Medicine, 2008;40(3):223–231.
- Kostovcikova K, Coufal S, Galanova N, et al. Diet rich in animal protein promotes pro-inflammatory macrophage response and exacerbates colitis in mice. Frontiers in immunology, 2019;10 : 919.
- Kucek LK, Veenstra LD, Amnuaycheewa P, Sorrells ME. A grounded guide to gluten: how modern genotypes and processing impact wheat sensitivity. Comprehensive Reviews in Food Science and Food Safety, 2015;14(3):285–302.
- Lata J, Juránková J. Střevní mikroflóra, slizniční bariéra a probiotika u některých interních chorob. Interní Med, 2011;13(2):63–69.
- Leonard MM, Valitutti F, Karathia H, Pujolassos M, Kenyon V, Fanelli B, Troisi J, Subramanian P, Camhi S, Colucci A, Serena G, Cucchiara S, Trovato CM, Malamisura B, Francavilla R, Elli L, Hasan NA, Zomorrodi AR, Colwell R, Fasano A; CD-GEMM Team. Microbiome signatures of progression toward celiac disease onset in at-risk children in a longitudinal prospective cohort study. Proc Natl Acad Sci U S A, 2021;20;118(29):e2020322118. doi: 10.1073/ pnas.2020322118. PMID: 34253606; PMCID: PMC8307711.
- Lindfors K, Lin J, Lee HS, Hyöty H, Nykter M, Kurppa K, Liu E, Koletzko S, Rewers M, Hagopian W, Toppari J, Ziegler AG, Akolkar B, Krischer JP, Petrosino JF, Lloyd RE, Agardh D; TEDDY Study Group. Metagenomics of the faecal virome indicate a cumulative effect of enterovirus and gluten amount on the risk of coeliac disease autoimmunity in genetically at risk children: the TEDDY study. Gut, 2020;69(8):1416–1422. doi: 10.1136/gutjnl-2019-319809. Epub 2019 Nov 19. PMID: 31744911; PMCID: PMC7234892.
- Lloyd-Price J, Abu-Ali G, Huttenhower C. The healthy human microbiome. Genome medicine, 2016;8(1):1–11.
- Lohi S, Mustalahti K, Kaukinen K, Laurila K, Collin P, Rissanen H, Mäki M. Increasing prevalence of coeliac disease over time. Alimentary pharmacology & therapeutics, 2007;26(9):1217–1225.
- Lu FC. Acceptable daily intake: inception, evolution, and application. Regul Toxicol Pharmacol, 1988;8(1):45–60. doi: 10.1016/0273-2300(88)90006-2. PMID: 3368586.
- M’hir S, Ziadi M, Chammem N, Hamdi M. Gluten proteolysis as alternative therapy for celiac patients: A mini-review. African Journal of Biotechnology, 2012;11(29).
- Marild K, Kahrs CR, Tapia G, Stene L, Stordal K. Infections and Risk of Celiac Disease in Childhood: A Prospective Nationwide Cohort Study. Am J Gastroenterol, 2015;110 : 1475–1484. doi: 10.1038/ajg.2015.287
- Mohajeri MH, Brummer RJ, Rastall RA, Weersma RK, Harmsen HJ, Faas M, Eggersdorfer M. The role of the microbiome for human health: from basic science to clinical applications. European journal of nutrition, 2018;57 : 1–14.
- Moore MM, Heinbockel M, Dockery P, Ulmer HM, Arendt EK. Network formation in gluten-free bread with application of transglutaminase. Cereal chemistry, 2006;83(1):28–36.
- Mörkl S, Lackner S, Meinitzer A, Mangge H, Lehofer M, Halwachs B, Holasek SJ. Gut microbiota, dietary intakes and intestinal permeability reflected by serum zonulin in women. European journal of nutrition, 2018;57 : 2985–2997.
- Paulley JW. Observations on the aetiology of idiopathic steatorrhoea. British medical journal, 1954;2(4900):1318.
- Ratajczak W, Rył A, Mizerski A, Walczakiewicz K, Sipak O, Laszczyńska M. Immunomodulatory potential of gut microbiome-derived short-chain fatty acids (SCFAs). Acta Biochimica Polonica, 2019;66(1):1–12.
- Rauhavirta T, Hietikko M, Salmi T, Lindfors K. Transglutaminase 2 and transglutaminase 2 autoantibodies in celiac disease: a review. Clinical reviews in allergy & immunology, 2019;57(1):23–38.
- Roca-Saavedra P, Mendez-Vilabrille V, Miranda JM, et al. Food additives, contaminants and other minor components: effects on human gut microbiota-a review. Journal Physiology and Biochemistry, 2018;74(1):69–83. doi:10.1007/s13105-017-0564-2.
- Rubio-Tapia A, Kyle RA, Kaplan EL, Johnson DR, Page W, Erdtmann F, Brantner TL, Kim WR, Phelps TK, Lahr BD, Zinsmeister AR, Melton LJ 3rd, Murray JA. Increased prevalence and mortality in undiagnosed celiac disease. Gastroenterology, 2009;137(1):88–93. doi: 10.1053/j.gastro.2009.03.059. Epub 2009 Apr 10. PMID:19362553; PMCID: PMC2704247.
- Sánchez D, Hoffmanová I, Szczepanková A, Hábová V, Tlaskalová-Hogenová H. Contribution of infectious agents to the development of celiac disease. Microorganisms, 2021;9(3):547.
- Scarnato L, Gadermaier G, Volta U, De Giorgio R, Caio G, Lanciotti R, Del Duca S. Immunoreactivity of Gluten-Sensitized Sera Toward Wheat, Rice, Corn, and Amaranth Flour Proteins Treated With Microbial Transglutaminase. Front Microbiol, 2019;10 : 470. doi: 10.3389/fmicb.2019.00470. PMID: 30972033; PMCID: PMC6445063.
- Scherf KA, Brockow K, Biedermann T, Koehler P, Wieser H. Wheat-dependent exercise-induced anaphylaxis. Clin Exp Allergy, 2016;46(1):10–20. doi: 10.1111/cea.12640. PMID: 26381478.
- Scherf KA, Lindenau AC, Valentini L, et al. Cofactors of wheat-dependent exercise-induced anaphylaxis do not increase highly individual gliadin absorption in healthy volunteers. Clinical and Translational Allergy, 2019;9 : 19. doi:10.1186/s13601-019-0260-0.
- Sievers S, Rohrbach A, Beyer K. Wheat-induced food allergy in childhood: ancient grains seem no way out. Eur J Nutr, 2020;59(6):2693–2707. doi: 10.1007/s00394-019-02116-z. Epub2019 Oct 25. PMID: 31654113.
- Singh P, Arora A, Strand TA, et al. Global Prevalence of Celiac Disease: Systematic Review and Meta-analysis. Clinical Gastroenteroly and Hepatology, 2018;16(6):823–836.e2. doi:10.1016/j. cgh.2017.06.037.
- Skřivan P, Sluková M, Hradecká B, Jurkaninová L, Švec I. Cereální chemie a technologie II: Sekundární zpracování obilovin – pekárenská technologie. Skripta VŠCHT Praha, Vydavatelství VŠCHT Praha, 2022. 1. vydání, 176 s.. ISBN 978-80-7592-135-2.
- Skřivan P. Kvasy v pekárenské technologii. Výživa a potraviny 3, 2022 : 7–8. ISSN 1211-846X.
- Sollid LM, Markussen GEkJ, Gjerde H. Vartdal F. Thorsby E. Evidence for a primary association of celiac disease to a particular HLA-DQ alpha/beta heterodimer. Journal of Experimental Medicine, 1989;169(1):345–350.
- Sonnenburg JL, Bäckhed F. Diet–microbiota interactions as moderators of human metabolism. Nature, 2016;535(7610):56 – 64.
- Stavropoulou E, Bezirtzoglou E. Probiotics in medicine: a long debate. Frontiers in immunology, 2020;11 : 2192.
- Stene LC, Honeyman MC, Hoffenberg EJ, Haas JE, Sokol RJ, Emery L, et al. Rotavirus Infection Frequency and Risk of Celiac Disease Autoimmunity in Early Childhood: A Longitudinal Study. Am J Gastroenterol, 2006;1001 : 2333–2340. doi: 10.1111/j.15720241.2006.00741.x.
- Stenman SM, Venäläinen JI, Lindfors K, Auriola S, Mauriala T., Kaukovirta-Norja A, Mäki M. Enzymatic detoxification of gluten by germinating wheat proteases: implications for new treatment of celiac disease. Annals of medicine, 2009;41(5):390–400.
- Strachan DP. Hay fever, hygiene, and household size. The British Medical Journal, 1989; 299(6710):1259–1260. doi:10.1136/ bmj.299.6710.1259.
- Suez J, Korem T, Zeevi D, Zilberman-Schapira G, Thaiss CA, Maza O, Israeli D, Zmora N, Gilad S, Weinberger A, Kuperman Y, Harmelin A, Kolodkin-Gal I, Shapiro H, Halpern Z, Segal E, Elinav E. Artificial sweeteners induce glucose intolerance by altering the gut microbiota. Nature, 2014;514(7521):181–186. doi: 10.1038/ nature13793. Epub 2014 Sep 17. PMID: 25231862.
- Tapia G, Chudá K, Kahrs CR, Stene LC, Kramna L, Marild K, et al. Parechovirus Infection in Early Childhood and Association With Subsequent Celiac Disease. Am J Gastroenterol, 2020;116(4):788–795. doi: 10.14309/ajg.0000000000001003.
- Tatsukawa H, Furutani Y, Hitomi K, Kojima S. Transglutaminase 2 has opposing roles in the regulation of cellular functions as well as cell growth and death. Cell death & disease, 2016;7(6):e2244.
- Thrackl K. Quantitative und qualitative Analyse von Gluten in unterschiedlichen Weizenarten und Sorten. Diplomarbeit / Masterarbeit – Abteilung Pflanzenzüchtung, 2017, BOKU-Universität für Bodenkultur, pp 63.
- Torsten M, Aaron L. Microbial transglutaminase is immunogenic and potentially pathogenic in pediatric celiac disease. Frontiersin pediatrics, 2018 : 389.
- Vlasova AN, Amimo JO, Saif LJ. Porcine rotaviruses: epidemiology, immune responses and control strategies. Viruses, 2017;9(3):48.
- Vrbová T. Víme, co jíme?: aneb: průvodce “Éčky” v potravinách. EcoHouse, 2001. ISBN 9788023875041.
- Yu LCH, Wang JT, Wei SC, Ni YH. Host-microbial interactions and regulation of intestinal epithelial barrier function: From physiology to pathology. World journal of gastrointestinal pathophysiology, 2012;3(1):27.
Štítky
Hygiena a epidemiologie Infekční lékařství Mikrobiologie
Článek vyšel v časopiseEpidemiologie, mikrobiologie, imunologie
Nejčtenější tento týden
2023 Číslo 3- Stillova choroba: vzácné a závažné systémové onemocnění
- Diagnostika virových hepatitid v kostce – zorientujte se (nejen) v sérologii
- Perorální antivirotika jako vysoce efektivní nástroj prevence hospitalizací kvůli COVID-19 − otázky a odpovědi pro praxi
- Jak souvisí postcovidový syndrom s poškozením mozku?
-
Všechny články tohoto čísla
- Monitoring hladiny protilátok v súvislosti s očkovaním proti SARS-CoV-2 – 11-mesačné sledovanie
- Úloha endogénnych retrovírusov v ľudskom organizme
- Mykobakteriózy – nejčastější původci
- Extracelulární vezikuly v infekčním lékařství – význam a perspektivy
- Nárůst prevalence celiakie – kde hledat odpovědi?
- Lidská babesióza
- Detekce superantigenů u izolátů Streptococcus pyogenes na základě dat celogenomové sekvenace
- Prevalencia meticilín-rezistentného Staphylococcus aureus medzi obyvateľmi domovov dôchodcov na Slovensku
- Vzpomínka na RNDr. Václava Rupeše, CSc.
- Epidemiologie, mikrobiologie, imunologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Mykobakteriózy – nejčastější původci
- Lidská babesióza
- Nárůst prevalence celiakie – kde hledat odpovědi?
- Extracelulární vezikuly v infekčním lékařství – význam a perspektivy
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



