-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Osteoporóza a zlomeniny u roztroušené sklerózy: patogeneze, rizikové faktory, možnosti léčby a prevence
Osteoporosis and fractures in multiple sclerosis: pathogenesis, risk factors, treatment options, and prevention
Patients with neurological diseases are at higher risk of osteoporosis and fragility fractures compared to age-matched controls. This review summarizes the risk factors and pathophysiologic pathways that play a role in development of osteoporosis and fractures in multiple sclerosis (MS) patients. The research in this area has been active over recent years. Osteoporosis related fractures cause increased morbidity and mortality and add to the burden of having MS. There are currently no guidelines how to best prevent and treat osteoporosis in patients with neurological diseases. The work proposes an algorithm for the screening, prevention and treatment of osteoporosis in patients with MS.
Keywords:
Pathogenesis – Multiple sclerosis – osteoporosis – type 2 diabetes mellitus
Autoři: Zikán Vít 1; Kvasničková Ivana 1; Týblová Michaela 2
Působiště autorů: III. interní klinika 1. LF UK a VFN v Praze 1; Neurologická klinika 1. LF UK a VFN v Praze 2
Vyšlo v časopise: Clinical Osteology 2018; 23(4): 146-161
Kategorie: Přehledové články
Souhrn
Pacienti s neurologickými chorobami mají vyšší riziko osteoporózy a nízkotraumatických zlomenin ve srovnání s věkově srovnatelnými jedinci. V tomto přehledu jsou shrnuty rizikové faktory a patofyziologické cesty, které hrají roli při rozvoji osteoporózy a zlomenin u pacientů s roztroušenou sklerózou (RS). V této oblasti je výzkum v posledních letech zvláště aktivní. Osteoporotické zlomeniny zvyšují morbiditu a mortalitu a znamenají další zhoršení kvality života u pacientů s RS. V současné době neexistují žádné doporučené postupy, jak nejlépe předcházet a léčit osteoporózu u pacientů s neurologickými chorobami. Práce navrhuje algoritmus pro vyhledávání, prevenci a léčbu osteoporózy u pacientů s RS.
Klíčová slova:
roztroušená skleróza – osteoporóza – patogeneze – zlomeniny
Rozsah problému
Roztroušená skleróza (RS), je chronické zánětlivé onemocnění centrálního nervového systému (CNS), v jehož patogenezi se uplatňují jak autoimunitní děje, tak následná neurodegenerace. Incidence RS se udává 3 až 7 osob na 100 000 obyvatel a prevalence 100–120 osob na 100 000 obyvatel [1]. Klinická symptomatologie je u pacientů s RS velmi rozmanitá: poruchy zraku, poruchy rovnováhy a sfinkterů, kognitivní deficit, poruchy čití a hybnosti s postupným rozvojem poruchy chůze a imobilizace [2].
Omezení hybnosti a ztráta svalové hmoty a síly je spojena s rozvojem osteoporózy a zlomenin [3,4]. Osteoporóza a zlomeniny se vyskytují u pacientů s RS častěji než ve zdravé populaci [5–8]. Zlomeniny jsou přitom u pacientů s RS zvláště závažné, jelikož mají za následek další zhoršení hybnosti i kvality života a dále prohlubují závislost postižených osob na dopomoci. U pacientů s RS ubývá kostní denzita (Bone Mineral Density – BMD) zejména v oblasti proximálního femoru [5,9]. Retrospektivní kohortová studie, která hodnotila údaje z databáze britských praktických lékařů (UK General Practice Research Database) z let 1996–2007, zjistila, že pacienti s RS mají téměř 3krát vyšší riziko zlomenin kyčle ve srovnání s kontrolní skupinou osob (HR = 2,79; 95% CI: 1,83–4,26) [6]. Riziko všech osteoporotických zlomenin bylo zvýšeno 1,4 krát (HR = 1,35; 95% CI: 1,13–1,62) a u pacientů, kteří v posledním půlroce užívali perorálně nebo intravenózně glukokortikoidy (GK) bylo riziko zlomenin zvýšeno 1,9krát (HR = 1,85; 95% CI: 1,14–2,98). Rovněž užívání antidepresiv v posledních 6 měsících vedlo ke zvýšení rizika zlomenin přibližně 1,8krát (HR = 1,79; 95% CI: 1,37–2,35 [6]. Téměř 2krát vyšší riziko zlomenin kyčle u pacientů s RS dokumentovali Bazelier et al 2012 také v populační kohortové studii v dánské populaci (Danish National Health Registers a Danish MS Registry) [10].
Byť je osteoporóze u pacientů s RS věnováno v posledních letech již mnohem více pozornosti, tak zatím chybějí ověřené preventivní a léčebné postupy ke snížení rizika zlomenin. Práce se podrobněji zabývá patogenezí a rizikovými faktory osteoporózy a zlomenin a navrhuje algoritmus pro vyhledávání, prevenci a léčbu osteoporózy u pacientů s RS.
Patogeneze osteoporózy a zlomenin
Kvalita a množství kostní hmoty u dospělých osob závisí na věku, genetické dispozici a dalších převážně modifikovatelných faktorech, jako jsou fyzická aktivita, tělesná váha, výživa, hormonální stav nebo toxické vlivy prostředí. Osteoporóza se rozvíjí v případě, že je dlouhodobě porušená rovnováha mezi tvorbou nové kostní hmoty a jejím odbouráváním. U dospělých pacientů s RS přispívá k rozvoji sekundární osteoporózy zejména hybný deficit [4,9] a centrální zánětlivé a neurodegenerativní procesy, které zasahují do centrální neurální a neurohumorální regulace kostní remodelace [11,12]. Negativní vliv má dlouhodobá léčba glukokortikoidy [13] a nutriční faktory, např. nedostatek vitaminu D [14]. Výsledky recentních studií ukazují, že významnou úlohu v rozvoji osteoporózy i RS mohou mít změny ve střevním mikrobiomu.
Motorický deficit a nízká fyzická aktivita
Svalová síla je nezbytná pro udržení rovnováhy mezi tvorbou kosti a její resorpcí [15]. Sval a kost jsou odvozeny ze společných mezenchymálních progenitorových buněk v průběhu embryogeneze a jejich vývoj je úzce koordinován působením řady překrývajících se genů a růstových faktorů [16]. Pozitivní korelace mezi obsahem kostního minerálu (Bone Mineral Content – BMC) a svalovou hmotou přetrvává po celou dobu života [17]. Množství a kvalitu kostní a svalové tkáně během života určují jak genetické, tak environmentální faktory. Pojem svalově kostní jednotka (Muscle-Bone Unit – MBU) zdůrazňuje úzký vztah, který existuje mezi kostní a svalovou tkání [18] (schéma 1). Hybný deficit a rovněž dlouhodobá léčba GK mají katabolické účinky na tělesné složení, zejména na svalovou hmotu. Ztráta svalové hmoty a síly a fyzická inaktivita u pacientů s RS vede ke snížení mechanického zatížení skeletu a k navození negativní nerovnováhy v kostní remodelaci s následným rozvojem osteoporózy. Pro hodnocení motorického deficitu, zejména schopnosti chůze se u pacientů s RS standardně užívá tzv. Kurtzkeho rozšířená stupnice stavu invalidity (disability) – EDSS (Expanded Disability Status Scale) [19]. Při EDSS < 3,5 není omezení v chůzi a hodnocen je hlavně neurologický deficit, EDSS 4–5,5 je definováno jako chůze bez asistence, ale s limitací vzdálenosti, kterou pacient ujde bez odpočinku na 100–500 m, přičemž EDSS 4 je omezení na vzdálenost 500 m a u EDSS 5,5 na vzdálenost 100 m. Pacienti s hodnotami EDSS 6,0 potřebují jednostrannou oporu a délka chůze je alespoň 100 m a při EDSS 6,5 je nutná bilaterální opora a délka chůze je alespoň 20 m. Nemocní s EDSS ≥ 7 nejsou schopni samostatné chůze (pouze přesunu z lůžka na vozík). Bylo zjištěno, že EDSS negativně koreluje s BMD, zejména v oblasti proximálního femoru [5,20–22]. U pacientů s dobrou fyzickou aktivitou a s nízkým EDSS skóre (< 3,5) bývá BMD v normě, i když některé práce dokumentovaly úbytek BMD i u pacientů s minimálním motorickým deficitem [23]. Větší ztráta BMD v proximálním femoru u pacientů s RS pravděpodobně odpovídá nižšímu zatížení dolních končetin na rozdíl od páteře, na kterou působí relativně větší síly při pohybech trupem a horními končetinami i u pacientů s omezením chůze. S tímto typem úbytku BMD se setkáváme také u pacientů s centrální míšní lézí nebo po cévní mozkové příhodě. Bazelier et al 2012 zjistili, že pacienti s vyšším stupněm disability s EDSS ≥ 6 mají 2,6krát vyšší riziko osteoporotické zlomeniny ve srovnání s pacienty s EDSS ≤ 3 (adj. OR: 2,6; 95% CI: 1,0–6,6) [10]. Podobně i Marrie et al 2009 zjistili nárůst zlomenin s rostoucím stupněm motorického deficitu. Prevalence zlomenin obratlů, kyčle nebo zápěstí byla po 13 letech 11,2% u pacientů bez významného omezení v chůzi (EDSS ≤ 3), 17,1% u pacientů se středně těžkým motorickým deficitem ( EDSS 4–5,5) a 20,3% u pacientů s EDSS ≥ 6 [9].
Schéma 1. Svalově kostní jednotka a lokální a endokrinní regulační faktory. Na regulaci se podílejí jak společné systémové mechanizmy (endokrinní a neurální regulace), tak komunikace mezi svalovou a kostní tkání na orgánové úrovni (biomechanické signály během fyzické zátěže) a na buněčné (intercelulární komunikace) a molekulární úrovni (myokiny, cytokiny nebo růstové faktory). Upraveno podle [16,70] ![Schéma 1. Svalově kostní jednotka a lokální a endokrinní regulační faktory. Na regulaci se podílejí jak společné
systémové mechanizmy (endokrinní a neurální regulace), tak komunikace mezi svalovou a kostní tkání na
orgánové úrovni (biomechanické signály během fyzické zátěže) a na buněčné (intercelulární komunikace)
a molekulární úrovni (myokiny, cytokiny nebo růstové faktory). Upraveno podle [16,70]](https://pl-master.mdcdn.cz/media/image/83b990a646e99e7e43061ced97aeb273.png?version=1558604850)
FGF23 – fibroblast growth factor 23 IGF1 – insulin-like growth factor 1 TGFβ1 – transforming growth factor β1 IL – interleukin, MMP-2 – matrix metalloproteinase 2 BMP – bone morphogenetic protein Studie, které hodnotily tělesné složení u pacientů s RS, dokumentovaly významnou asociaci mezi svalovou (beztukovou) tělesnou hmotou a BMD, zejména u imobilních pacientů s výrazným motorickým deficitem (EDSS ≥ 7), ale nikoli u nemocných s lehčím hybným postižením [13,24]. V naší práci jsme prokázali, že svalová hmota dolních končetin u mužů s RS negativně asociovala s EDSS. Multivariační analýza potvrdila, že svalová hmota dolních končetin je u mužů nezávislým prediktorem celotělového obsahu kostního minerálu (BMC) [20]. Multivariační analýza u premenopauzálních žen (ale nikoliv u postmenopauzálních žen) prokázala, že celotělové množství svalové hmoty je významným prediktorem BMD v oblasti bederní páteře, celotělové BMD a BMC [21]. Studie hodnotící svalové biopsie stehenního svalu (m. vastus lateralis) prokázala menší plochu průřezu svalových vláken (Cross Sectional Area – CSA) a sníženou svalovou sílu dolních končetin (m. quadriceps) i u pacientů s lehčím hybným deficitem ve srovnání s kontrolní skupinou zdravých osob [25].
Riziko pádů a poruchy rovnováhy
K vyšší prevalenci zlomenin u pacientů s RS přispívá i zvýšené riziko pádů v důsledku hybného deficitu a ztráty svalové síly a koordinace a poruchy rovnováhy [26]. K vyššímu riziku pádů u pacientů s RS přispívá dále nedostatek vitaminu D a léčba glukokortikoidy, která má katabolické účinky na svalovou tkáň. Pády jsou u pacientů s RS časté a jejich frekvence je pravděpodobně vyšší než u osob starších 65 let v běžné populaci bez RS, z nichž přibližně 30 % padá alespoň 1krát ročně. Ve studii Marrie et al 2009 u nemocných s RS referovalo alespoň 1 pád za poslední rok 41,6 % pacientů s lehkým stupněm hybného postižení, 66,4 % pacientů se středním stupněm disability a 62,1 % pacientů s těžkým stupněm motorického deficitu [9]. Nejvyšší riziko pádů bylo tedy u pacientů, kteří jsou ještě mobilní, ale k chůzi již potřebují jednostrannou nebo oboustrannou oporu (EDSS 6–6,5).
Poruchy rovnováhy patří mezi časté obtíže u pacientů s RS. Příčinou nemusí být jen hybný deficit a ztráta svalové síly a koordinace, ale také centrální (léze v oblasti mozkového kmene, mozečku a demyelinizace senzorických drah) nebo porucha rovnováhy v důsledku periferní vestibulopatie [27,28]. Byť vliv poruchy rovnováhy na kostní remodelaci nebyl u pacientů s RS zkoumán, recentní práce ukazují na významnou úlohu vnitřního ucha a vestibulárního systému v regulaci sympatiku a remodelace kosti. Vestibulární léze u myší vede k úbytku kostní hmoty převážně v oblasti dolních končetin [29]. Také změna vestibulární funkce v důsledku stavu beztíže u astronautů může zvýšením sympatického tonu přispívat ke ztrátě kostní hmoty, a to nezávisle na pohybové aktivitě [30]. Recentní klinické práce ukazují, že starší pacienti v populaci bez RS, ale s poruchou vestibulární funkce mají významně nižší BMD, zejména v oblasti kyčle a dolních končetin [31]. Často pozorovaný úbytek BMD v oblasti dolních končetin u RS tedy pravděpodobně nesouvisí pouze s hybným deficitem, ale mohla by se uplatňovat i autonomní dysregulace anebo porucha vestibulárních funkcí.
Poruchy hormonální regulace svalově kostní jednotky
Svaly a kosti sdílejí mnoho endokrinních, parakrinních a autokrinních signálních cest. Mezi nejvýznamnější patří růstový hormon (GH)/IGF1, receptor pro vitamin D (VDR), receptor pro glukokortikoidy a pohlavní hormony. Také svalové myokiny myostatin a folistatin a příbuzné proteiny mohou působit nejen lokálně, ale i systémově podobně jako hormony. U pacientů s RS byly dokumentovány poruchy osy GH-IGF1, osy hypotalamus-hypofýza-nadledviny (Hypothalamic-Pituitary-Adrenal – HPA) i osy hypotalamus-hypofýza-gonády. Nižší koncentrace GH byly zjištěny opakovaně, zejména u žen s těžším průběhem RS [32]. Lanzillo et al 2011 zjistili nižší poměr IGF1/IGFBP3 u pacientu s RS ve srovnání s kontrolní skupinou [33]. Také řada experimentálních studií dokumentovala, že deficit nebo rezistence na GH/IGF1 při fyzické inaktivitě nebo imobilizaci přispívá ke snížené reakci svalů na mechanické podněty a ke svalové atrofii se ztrátou kostní hmoty. K poruše osy HPA může dojít buď přímým poškozením hypotalamu nebo sekundárně v důsledku globální stresové reakce při RS [34]. Pacienti s vyšší zánětlivou aktivitou vykazovali sníženou aktivitu HPA osy, a to jak v klidu, tak během fyzické zátěže [35]. U mužů s RS byl dokumentován hypogonadotropní hypogonadizmus [36] a úbytek kostní hmoty [5]. Nízké koncentrace testosteronu u mužů s RS asociovaly také se zhoršením funkčních testů a s hybným deficitem (EDSS) [36]. Androgeny mají anabolické účinky na svalstvo a v populaci mužů bez RS byly nižší koncentrace testosteronu spojeny rovněž s vyšším rizikem pádů [37]. Na buněčné úrovni aktivuje mechanická stimulace estrogenové receptory alfa (ERα), které jsou klíčové pro regulaci kostní remodelace. U žen po menopauze bylo zjištěno, že snížení počtu receptorů ERα významně snižuje schopnost kostních buněk indukovat osteoanabolickou odpověď na mechanické zatížení skeletu [38]. Wei et al 1997 dokumentovali nízké hladiny estradiolu až u 25 % žen s RS před menopauzou [39].
Nedostatek vitaminu D
U nemocných s RS byly opakovaně dokumentovány nízké koncentrace 25OHD < 20–30 ng/ml [5,42]. Snížené koncentrace 25OHD se mohou častěji vyskytovat u pacientů s vyšším stupněm hybného deficitu vzhledem k nízké expozici slunečnímu záření. Pacienti s RS se také více chrání před slunečním zářením vzhledem k časté intoleranci tepla. Na základě klinických studií v populacích bez RS je nedostatek vitaminu D definován při hodnotách 25-hydroxyvitaminu D (25OHD) v séru < 30 ng/ml (75 nmol/l). Střevní absorpce vápníku významně klesá při koncentracích 25OHD < 20 nmol/l a nízké sérové koncentrace 25OHD přispívají k rozvoji sekundární hyperparatyreózy a k úbytku kostní hmoty. Nedostatek vitaminu D vede i ke snížení svalové síly. Kalcitriol stimuluje ve svalech expresi VDR a indukuje diferenciaci svalových buněk tím, že zvyšuje expresi IGF2 a folistatinu a snižuje expresi myostatinu [40]. Nízké sérové koncentrace 25OHD (< 50 nmol/l) zvyšují u starší populace bez RS riziko neobratlových zlomenin včetně zlomenin proximálního femoru [41]. Receptor pro vitamin D (VDR) je vysoce exprimován v tenkém a v tlustém střevě a experimentální práce ukazují, že vitamin D má důležitou roli při udržování integrity střevní bariéry a jeho nedostatek vede ke střevní dysbióze a narušení střevní bariery [43]. Vitamin D je kladně hodnocen i ve vztahu k průběhu a aktivitě RS, ale zatím chybí prospektivní studie, které by prokázaly, že vyšší koncentrace 25OHD (> 80 nmol/l) mají tyto příznivé extraskeletální účinky.
Léčba glukokortikoidy
Nadbytek glukokortikoidů (GK) významně snižuje pevnost kostí a může se projevit zlomeninami již za 3–6 měsíců po zahájení léčby GK [44]. U pacientů s RS je časté užití pulzní léčby GK po dobu 3–5 dní v době akutní exacerbace („ataky“) onemocnění. Naopak dlouhodobá perorální léčba GK dnes již nepatří ke standardní léčbě u většiny pacientů s RS, jelikož jsou dostupné další imunomodulační léky. Publikované prospektivní studie, ve kterých pacienti s RS dostávali opakovaně intravenózní pulzy metylprednisolonu, neprokázaly úbytek BMD během ročního sledování [45]. Byť pulzní léčba GK hluboce potlačuje kostní novotvorbu a zvyšuje přechodně kostní resorpci, tak po ukončení pulzní léčby dochází k významnému vzestupu ukazatelů kostní novotvorby [46]. Negativní vliv na skelet se však může projevit při častějším opakování pulzů (více než 3krát ročně) a při dlouhodobé léčbě. Pouze 2 průřezové studie poukázaly na možnou souvislost mezi úbytkem BMD a léčbou GK u RS [13,47]. Formica et al 1997 zjistili deficit celotělového obsahu kostního minerálu u pacientů s těžkým hybným deficitem, což autoři vysvětlovali současným úbytkem svalů, jelikož doba trvání léčby GK významně korelovala s množstvím svalové hmoty [13]. Ozgocmen et al 2005 zjistili, že kumulativní dávka GK negativně korelovala s BMD v oblasti velkého trochanteru, ale už nikoliv s BMD v krčku stehenní kosti nebo v bederní páteři [47]. Absence negativních účinků pulzní léčby GK na BMD, ale nemusí znamenat nižší riziko zlomenin, jelikož GK postihují zejména kvalitu kosti a zlomeniny se vyskytují i u pacientů bez významného úbytku BMD [48].
Imunitní systém, cytokiny a střevní mikrobiom
V patogenezi RS se uplatňuje zvýšená permeabilita hematoencefalické bariéry, destrukce myelinové vrstvy v CNS a infiltrace perivaskulárních tkání buňkami zánětu. Experimentální práce ukázaly, že existují vzájemné interakce mezi střevní mikrobiotou, střevní bariérou a imunitním systémem, které se mohou uplatňovat v patofyziologii zánětlivých demyelinizačních onemocnění např. RS. Fyziologická mikrobiota má lokální i systémové protizánětlivé účinky a vytváří chemické substance, které ovlivňují enterické neurony i funkce CNS. U pacientů s RS byly dokumentovány významné změny střevní mikrobioty (střevní dysbióza) [49], zvýšená permeabilita střev a změny metabolizmu žlučových kyselin [50]. Experimentální práce zjistily, že změny střevní mikrobioty přispívají ve střevní sliznici modelových zvířat k indukci efektorových Th17-lymfocytů, které se podílejí na rozvoji experimentální autoimunitní encefalomyelitidy (model RS). Naproti tomu kolonizace probiotickou mikroflórou (např. Bifidobacterium animalis) brání rozvoji nebo tlumí u těchto myší intenzitu zánětlivých změn CNS. Imunologické změny u RS jsou charakterizovány zvýšením prozánětlivých buněk, jako jsou CD4+ T-lymfocyty, monocyty, makrofágy, zánětlivé dendritické buňky a B-lymfocyty a poklesem CD8+ T-lymfocytů a CD4 + CD25 + FoxP3 + regulačních T-lymfocytů [51]. Aktivované T-lymfocyty exprimují prozánětlivé cytokiny, především TNFα, interleukin 1 (IL1), IL6 a IL11, které dále stimulují expresi RANKL (ligand pro receptor aktivující nukleární faktor kappa B) v kostním mikroprostředí. RANKL produkují i samotné aktivované T-lymfocyty. V menších studiích byly u pacientů s RS zjištěny vyšší sérové koncentrace RANKL, ale i osteoprotegerinu (OPG) ve srovnání se zdravými osobami [52]. Objasnění významu střevního mikrobiomu ve vztahu k imunitnímu systému a kostní remodelaci u RS nepochybně vyžaduje další experimentální a klinický výzkum.
Poruchy centrální a neurální regulace kostní remodelace
Objevy, které ukázaly, že na regulaci kostní hmoty se přímo podílí i CNS a neurohumorální systém, přinesly nový pohled i na patogenezi osteoporózy, která je chápána jako neuroskeletální onemocnění [53]. CNS komunikuje s osteoblasty (a pravděpodobně i s osteocyty) pomocí sympatického nervového systému (SNS, eferentní dráhy). Recentní práce však přinášejí důkazy i pro zapojení parasympatického nervového systému (buď nepřímo prostřednictvím muskarinových sympatických nervů v mozku, nebo přímo přes nikotinové receptory na osteoklastech) a pozornost je věnována také senzorické inervaci kosti [11,12].
Kostní remodelace je dynamický vysoce koordinovaný proces kostní resorpce a následné tvorby nové kostní hmoty. V souladu se známou cirkadiánní variabilitu biochemických markerů kostní remodelace bylo prokázáno, že kostní remodelace je rovněž pod kontrolou hodinových genů [54–56]. Cirkadiánní rytmy v periferních tkáních jsou synchronizovány s centrálním oscilátorem („master clock“) v suprachiazmatických jádrech (suprachiasmatic nuclei – SCN) hypotalamu. To umožňuje, aby signály z vnějšího prostředí byly synchronizovány s periferními hodinovými geny. Tato synchronizace je důležitá pro optimální buněčný metabolizmus [57]. Například v každé aktivní kostní základní mnohobuněčné jednotce (Basic Multicellular Unit – BMU) je fáze resorpce a novotvorby kosti urychlena během noci a zpomalena během dne. To umožňuje, aby reparační procesy a obnova kostní hmoty nenarušily rovnováhu v jednotlivých BMU, která by vedla ke ztrátě kosti. V případě desynchronizace mezi centrálními a periferními hodinovými geny dochází k negativní nerovnováze v kostní remodelaci, kost ubývá a zhoršuje se její kvalita. Mezi onemocnění, u nichž dochází k poruchám cirkadiánního rytmu řady fyziologických procesů (např. spánku) a hormonů (např. melatoninu a leptinu) patří i RS (schéma 2). Je pravděpodobné, že zánětlivé a neurodegenerativní procesy CNS mohou narušit i cirkadiánní rytmus řady systémů, které mají významný vliv i na kostní remodelaci. K desynchronizaci u RS může přispívat řada poruch: (1) autonomní dysfunkce (zejména SNS – sympatického nervového systému), která je u RS častá a může se uplatňovat již v počátcích onemocnění [58]. SNS působí přes β2AR na osteoblastech a reguluje kostní novotvorbu a resorpci prostřednictvím hodinových genů [59]; (2) klinické i experimentální studie dokumentují u RS změny cirkadiánního rytmu melatoninu, leptinu a kortizolu, které se podílejí na synchronizaci cirkadiánního rytmu kostní remodelace [60]; (3) u pacientů s RS se častěji vyskytují další poruchy s vlivem na cirkadiánní systém, jako jsou poruchy spánku, poruchy rovnováhy, deprese, poruchy termoregulace, chronická únava nebo kognitivní deficit.
Schéma 2. Schéma systémů s poruchou cirkadiánního rytmu u roztroušené sklerózy a synchronizace mezi centrálními (suprachiazmatická jádra hypotalamu - SCN) a periferními hodinovými geny v kostní mnohobuněčné jednotce (BMU) 
BMU – kostní mnohobuněčná jednotka/Bone Multicellular Unit) β2AR –β2-adrenergní receptory, FGF 23 – fibroblastový růstový faktor 23/Fibroblaste Growth Factor 23 Cry2 – kryptochrom Per – Period (hodinové geny) SCN – suprachiazmatická jádra hypotalamu/SupraChiasmatic Nucleus Poruchy spánku
Poruchy spánku jsou u pacientů s RS častější než v běžné populaci [61]. U lidí se normální spánek skládá z cyklů REM (rychlé pohyby očí/Rapid Eye Movement) a non-REM fází; každá etapa se vyznačuje výraznými vzory mozkové aktivity a pohybů svalů a očí. Pomalé spánkové vlny se nacházejí ve fázi non-REM spánku, která je považována za nejvíce regenerační [62]. Pomalé spánkové vlny jsou spojeny se zvýšenou parasympatickou aktivitou a se snížením aktivity SNS a také se zvýšeným uvolňováním některých hormonů, včetně růstového hormonu. Cyklus spánek a bdění je řízen cirkadiánními hodinami. Melatonin, jehož koncentrace narůstají v nočních hodinách má význam v regulaci spánku a synchronizaci centrálního cirkadiánního rytmu s hodinovými geny v periferních tkáních. Změny cirkadiánního rytmu melatoninu jsou časté mezi pacienty s relaps-remitující RS [63]. Cardinali et al 2003 předpokládají, že melatonin může částečně bránit involučnímu úbytku kostní hmoty tím, že prodlužuje fázi spánku s pomalými spánkovými vlnami a zvyšuje produkci růstového hormonu [64]. Receptory pro melatonin se nacházejí i na lidských osteoblastech, ale vztahy mezi melatoninem a kostním metabolizmem zatím nebyly zcela objasněny. Roční léčba melatoninem u postmenopauzálních žen s osteopenií vedla k nárůstu BMD v krčku stehenní kosti a při vyšším dávkování i BMD v páteři [65]. U lidí bylo zjištěno, že produkce melatoninu klesá s věkem [66]. Nižší koncentrace (nebo přerušovaná sekrece) melatoninu a snížená citlivost vůči melatoninu v důsledku snížené dostupnosti receptoru by mohla vést i k nižší novotvorbě kosti a/nebo k vyšší osteoresorpci. U RS ale zatím nebyl melatonin ve vztahu ke kostnímu nebo svalovému metabolizmu zkoumán.
Sympatický nervový systém, leptin
Hladina leptinu v séru vykazuje cirkadiánní rytmus a u lidí dosahuje vrcholu v noci, tedy během spánku a lačnění [67]. Hlavním mediátorem působení leptinu na kost je SNS, který inhibuje kostní novotvorbu a podporuje resorpci kosti [68]. Leptin ovlivňuje hodinové geny osteoblastů a pravděpodobně i osteocytů prostřednictvím SNS a β2-adrenergních receptorů (β2AR) [59]. Aktivace β2AR stimuluje expresi hodinových genů BMAL1, CLOCK, Per1 a Per2. SNS se podílí nejen na inhibici kostní novotvorby, ale také na regulaci kostní resorpce, přitom zvyšuje expresi RANKL [69] a také expresi CART (Cocaine - and Amphetamine-Regulated Transcript), která naopak snižuje resorpci kosti. Biologický význam β2AR-signalizace v regulaci kostní remodelace potvrdily nejen experimentální studie [12], ale i řada klinických pozorování [71,72]. Skutečnost, že leptin zasahuje do kostní remodelace tím, že zvyšuje tonus sympatiku, může nabývat na významu u pacientů s RS, u nichž je častá autonomní dysfunkce [58]. U pacientů s RS dochází v různé míře k postižení sympatického i parasympatického nervového systému. Autonomní dysfunkce je způsobena demyelinizaci specifických struktur CNS, které se podílí na řízení a modulaci autonomního nervového systému, např. locus coeruleus [73]. Locus coeruleus, hlavní místo pro syntézu noradrenalinu, je zapojen do fyziologické odpovědi na stres a má další funkce (mj. zasahuje do regulace cyklu spánku a bdění, držení těla a rovnováhy). Pacienti s RS vykazují sníženou hladinu noradrenalinu v mozku [73] a sníženou intracelulární koncentraci katecholaminů v lymfocytech periferní krve [74], což naznačuje dysfunkci centrálních i periferních sympatických funkcí. Autonomní dysfunkce vede k řadě klinických příznaků, např. k poruchám spánku, kognitivní dysfunkci nebo depresi.
Deprese a antidepresiva
Epidemiologické studií svědčí o zvýšené prevalenci depresivních poruch a úzkosti u pacientů s RS [75]. Deprese je spojena s dysfunkcí imunitního systému a s narušením cirkadiánního rytmu řady hormonů, mj. je doprovázena narušením hypotalamo-hypofyzární–adrenální HPA osy a s porušenou sekrecí adrenokortikotropního hormonu (ACTH) [35]. U premenopauzálních žen s depresí je zvýšená produkce nočního leptinu [76]. Leptin moduluje několik endokrinních os, včetně HPA-osy negativní zpětnou vazbou v hypotalamu a zvýšené koncentrace leptinu jsou spojovány se zvýšenou aktivací sympatického nervového systému a s osteopenií [77]. Asociace mezi osteoporózou a depresí by mohla být alespoň částečně vysvětlena zvýšenou aktivitou SNS, což podporují i výsledky na myším modelu deprese [78]. Deprese anebo léčba antidepresivy také zvyšuje riziko pádů [79]. Bylo zjištěno, že s vyšším rizikem osteoporotických fraktur je spojeno také užívání antidepresiv s vysokou afinitou k 5-HTT (5-hydroxytryptamin reuptake transporter) [80]. BMD byla nižší u nemocných, kteří užívali selektivní inhibitory zpětného vychytávání serotoninu (SSRI), ale nikoliv mezi uživateli jiných antidepresiv. Další výzkum je třeba k potvrzení těchto výsledků i s ohledem na rozšířené užití SSRI u lidí.
Hodnocení klinických faktorů rizika zlomenin
Rizikové faktory osteoporózy a zlomenin u RS jsou v přehledu uvedeny v tab.
Tab. 1. Rizikové faktory osteoporózy a zlomenin se zdůrazněním rizikových faktorů u nemocných s roztroušenou sklerózou 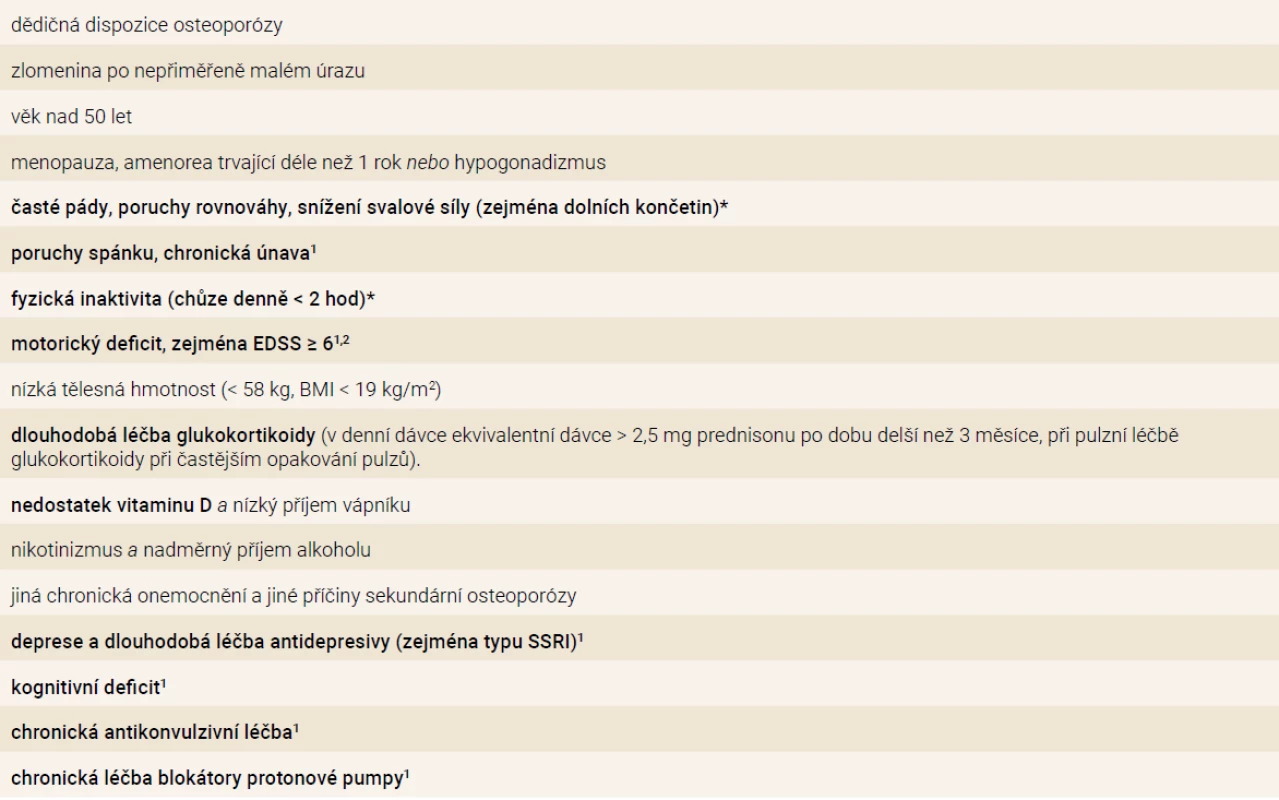
1vyžadují ověření v prospektivních klinických studiích
2 u pacientů s EDSS ≥ 4 a < 6 může být vyšší riziko rozvoje osteoporózy a zlomenin, pokud jsou přítomny další rizikové faktory osteoporózy a zlomenin (věk, menopauza, léčba glukokortikoidy atd)
BMI – index tělesné hmotnosti/body mass index EDDS – Kurtzkeho rozšířená stupnice stavu invalidity/Expanded Disability Status Scale SSRI –selective serotonin reuptake inhibitorsObecné rizikové faktory
Mezi významné neovlivnitelné rizikové faktory nízkotraumatických zlomenin v běžné populaci patří věk, pohlaví a rodinná anamnéza zlomeniny proximálního femoru. Riziko osteoporotických zlomenin narůstá s věkem. S věkem klesá kvalita kostní hmoty a věk představuje významný na BMD nezávislý rizikový faktor. Rodinná anamnéza zlomeniny proximálního femoru u rodičů podmiňuje riziko jakékoliv nízkotraumatické zlomeniny. Velmi důležité pro rozhodování o prognóze a léčbě pacienta je identifikace předchozích nízkotraumatických zlomenin. Prodělaná osteoporotická zlomenina je ukazatel poškozené kvality kosti a je silným nezávislým rizikovým faktorem další zlomeniny. Pozornost bychom měli zaměřit zejména na zlomeniny obratlů, které mohou být zpočátku mírného stupně s minimální symptomatikou (až 50 % zlomenin obratlů), a mohou tak uniknout pozornosti. Zlomeniny obratlů se vyskytují až u 30–50 % pacientů, kteří jsou dlouhodobě léčeny GK [81]. U pacientů s RS jsou častěji popisovány i zlomeniny tibie nebo pánve.
Rizikové faktory specifické pro RS
Motorický deficit, ztráta svalové hmoty a pády
Za praktické se ukazuje hodnocení stavu disability pomocí EDSS skóre, jelikož je hodnocena zejména schopnost chůze, jejíž omezení je samo o sobě významným rizikovým faktorem zlomenin. EDSS navíc koreluje se ztrátou svalové hmoty a s rizikem pádů. Hodnota EDSS ≥ 6 je považována za práh, od nějž je vždy indikováno vyšetření BMD [82]. Už hodnota 6 EDSS je totiž ve většině případů spojena s nevratnou progresí motorického postižení, při EDSS ≥ 6 významně klesá BMD v proximálním femoru a významně se zvyšuje riziko pádů a zlomenin [26]. Další výzkum je nezbytný k zodpovězení otázky, zda i lehčí omezení schopnosti chůze (EDSS ≥ 4) neznamená, zvláště v kombinaci s dalšími rizikovými faktory vyšší riziko úbytku kostní a svalové hmoty a nárůstu výskytu zlomenin [20,21].
Omezená schopnost chůze spolu s dalšími faktory vede obecně ke snížení fyzické aktivity. Hybný deficit a snížená fyzická aktivita dále přispívá k úbytku svalové hmoty a síly [20,21]. Ztráta svalové hmoty a síly u pacientů s RS přímo souvisí se ztrátou kostní hmoty a s nárůstem rizika pádů a zlomenin. Anamnéza opakovaných pádů v běžné populaci zvyšuje riziko zlomenin přibližně dvojnásobně [83], u pacientů s RS může být toto riziko ještě vyšší [9]. Hodnocení svalové síly a poruchy rovnováhy by mělo být nedílnou součástí vyšetření u pacientů s RS. K vyššímu riziku pádů mohou přispívat i některé léky, např. anxiolytika a hypnotika.
Odhad individuálního rizika zlomeniny
U postmenopauzálních žen a u mužů bez RS ve věku 40–90 let je vhodné k odhadu individuálního desetiletého rizika zlomenin využít algoritmus FRAX (Fracture Risk Assessment) [84], zejména v primární péči, pokud nemáme k dispozici denzitometrické vyšetření. FRAX je algoritmus (http://www.shef.ac.uk/FRAX), který hodnotí individuální pravděpodobnost prodělat jednu z hlavních osteoporotických zlomenin (kyčle, klinické zlomeniny obratle, humeru a zápěstí) nebo zlomeninu kyčle v následujících 10 letech. Mezi validované klinické faktory rizika zlomenin hodnocené v algoritmu FRAX patří: věk, pohlaví, BMI, prodělaná nízkotraumatická zlomenina v dospělosti (včetně obratlové morfometrické zlomeniny), zlomenina proximálního femoru u rodičů, současný nikotinizmus, léčba glukokortikoidy (pokud užívá ≥ 3 měsíce p.o. ≥ 5 mg prednisonu nebo jeho ekvivalentu), revmatoidní artritida, sekundární osteoporóza, příjem alkoholu (≥ 24–30 g denně) a může být zadána hodnota BMD v krčku femoru. Nemocným s RS můžeme přiřadit kategorii „sekundární příčiny osteoporózy“, pokud nezadáváme současně hodnotu BMD. U pacientů s RS nejsou zatím při výpočtu FRAX zohledněny klinicky významné rizikové faktory, jako jsou stupeň disability (EDSS ≥ 6), poruchy rovnováhy a riziko pádů, tedy ve skutečnosti u nemocných s RS podhodnocuje riziko zlomenin. V případě dlouhodobé léčby GK by mohl FRAX přispět k lepší identifikaci rizikových pacientů, avšak FRAX nerozlišuje dávkování GK a rovněž není jasné, jakým způsobem bychom měli hodnotit vliv pulzní léčby GK, která se u pacientů s RS užívá nejčastěji. U premenopauzálních žen a u mužů mladších 40 let nelze algoritmus FRAX využít. Rozhodnutí o zahájení preventivního nebo léčebného opatření tedy v tomto případě zůstává na klinickém úsudku. U pacientů s RS byly navrženy i další algoritmy pro výpočet rizika zlomenin [85].
Diagnostika osteoporózy u roztroušené sklerózy
Roztroušená skleróza je chronické onemocnění, které přispívá k rozvoji sekundární osteoporózy a zvyšuje riziko zlomenin [84]. Vyhodnocení stavu skeletu a rizika zlomenin by mělo být nedílnou součástí plánu péče pro pacienty s RS, a to nejen u žen po menopauze a u mužů starších 50 let věku, ale i u mladších pacientů při vyšším stupni motorického postižení (EDSS ≥ 6) nebo při EDSS ≥ 4, pokud jsou přítomny další rizikové faktory, např. v případě dlouhodobé léčby GK (v denní dávce ekvivalentní ≥ 2,5 mg prednisonu po dobu delší než 3 měsíce nebo při intermitentní pulzní léčbě GK, pokud jsou pulzy opakovány více než 3krát ročně). Pracovní návrh algoritmu pro vyšetření při osteoporóze nebo jejím zvýšeném riziku u pacientů s RS znázorňuje schéma 3. Návrh vychází ze současných doporučených postupů pro postmenopauzální ženy a muže ve věku od 40 do 90 let a je doplněn o specifické rizikové faktory u RS.
Schéma 3. Algoritmus pro vyhledávání a vyšetření osteoporózy u pacientů s roztroušenou sklerózou 
*Selhání léčby – signifikantní snížení BMD, případně nedostatečná odpověď kostního markeru na léčbu a nová osteoporotická zlomenina [91]
DXA– dvouenergiová rentgenová absorpciometrie/Dual-energy X-ray Absorptiometry EDDS – Kurtzkeho rozšířená stupnice stavu invalidity/Expanded Disability Status Scale FRAX – algoritmus pro výpočet individuálního rizika zlomeniny/ Fracture Risk Assessment 25-OHD – 25-hydroxyvitamin DDiagnostika
Postup diagnostiky osteoporózy u pacientů s RS se v zásadě neliší od doporučených postupů pro primární a sekundární osteoporózu.
Anamnéza
Anamnéza zahrnuje rodinnou anamnézu nízkotraumatických zlomenin v první linii příbuzných (zejména zlomeniny proximálního femoru), osobní anamnézu nízkotraumatických (či atraumatických) zlomenin a klinických rizikových faktorů osteoporózy a zlomenin (tab). Důležitá je nutriční anamnéza s ohledem na řadu faktorů, které přispívají ke změně stravovacích zvyklostí u pacientů s RS.
Fyzikální vyšetření
Fyzikální vyšetření je zaměřeno na klinické příznaky osteoporózy a onemocnění, které vedou k sekundární osteoporóze. U pacientů s RS je důležité neurologické vyšetření včetně stanovení Kurtzkeho EDSS, případně vyhodnocení svalové síly, rovnováhy a rizika pádů.
Přístrojové vyšetření
Standardní metodou pro diagnostiku osteoporózy je měření BMD pomocí dvouenergiové rentgenové absorpciometrie (Dual-energy X-ray absorptiometry – DXA) v oblasti bederní páteře (v rozsahu L1-L4) a proximálního femoru (celkový proximální femur a krček femoru). U pacientů s RS a hybným deficitem je vhodné přihlédnou k hybnému deficitu a tedy k rozdílům v úbytku BMD mezi bederní páteří a proximálním femorem a zvažovat i stranovou diferenci u hemiparetických pacientů. DXA umožňuje současné měření tělesného složení, zejména množství svalové a tukové tkáně. Tyto parametry zatím nejsou využívány v běžné klinické praxi, ale nabývají na významu u pacientů s hybným deficitem. Provedení rentgenového snímku páteře bychom měli zvažovat u všech pacientů s lokalizovanou bolestí v zádech (akutní bolest nebo chronická bolest neobjasněné příčiny) nebo v případě snížení tělesné výšky o více než 2 cm ve srovnání s předchozím měřením nebo při poklesu tělesné výšky alespoň o 4 cm oproti maximální (anamnestické) výšce. Pro posouzení přítomnosti zlomenin obratlů lze s výhodou užít také boční projekci páteře v rozsahu T4 až L4 pomocí DXA (vertebral fracture assessment – VFA). U pacientů s RS, zvláště při paraplegii, musíme pomýšlet i na netypicky se manifestující zlomeniny proximálního femoru [86].
Diferenciální diagnostika
Diferenciálně diagnostické vyšetření, jehož součástí je i laboratorní vyšetření, je nezbytné provést u všech pacientů s nálezem nízké BMD a/nebo nízkotraumatické zlomeniny, a vyloučit tak možné sekundární příčiny úbytku BMD anebo jiné metabolické nebo nádorové onemocnění. U nemocných s RS je důležité neopomenout i vyšetření 25OHD, případně vyšetření pohlavních hormonů při podezření na hypogonadizmus, a to i u mladších osob.
Prevence osteoporózy u roztroušené sklerózy
Možnosti prevence a léčby osteoporózy u pacientů s RS zahrnují jak obecná doporučení, která se týkají životního stylu, zejména omezení špatných návyků (nikotinizmu, nadměrného příjmu alkoholu), pravidelné fyzické aktivity a úpravy nutričních faktorů (optimalizace stavu vitaminu D), tak specializované cvičební nebo rehabilitační programy. Substituční léčba estrogeny u žen nebo testosteronem u mužů je důležitá u všech osob s jejich deficitem, alespoň v údobí reprodukčního věku při respektování známých kontraindikací této léčby.
Fyzická aktivita a prevence pádů
Hybný deficit je u pacientek s RS velmi významným faktorem, který přispívá k úbytku BMD v oblasti proximálního femoru i při léčbě osteoporózy [87]. Úbytek svalové hmoty, ztráta svalové síly a poruchy rovnováhy vedou k častým pádům. Proto je u pacientů s RS důležitá snaha o zajištění přiměřené pravidelné fyzické aktivity, a to jak cvičení, které zatěžuje skelet a stimuluje osteocyty a osteoblasty k novotvorbě kostní hmoty, tak cvičení, které pomáhá upravit svalovou koordinaci, a snižuje tak riziko pádů. Pravidelné cvičení zlepšuje u pacientů s RS kvalitu života, přispívá k odstranění únavy a depresivní symptomatiky a také snižuje strach z pádu. Krátkodobé programy cvičení ukázaly objektivní zlepšení svalové síly dolních končetin a prodloužila se vzdálenost, kterou pacienti ujdou [87]. Recentní metaanalýza prokázala, že pravidelný cvičební trénink u pacientů s RS vede ke zlepšení chůze [89]. Předchozí studie u mladých i starších lidí v populaci bez RS dokumentovaly, že pravidelná fyzická zátěž snižuje riziko pádů, zvyšuje množství svalové hmoty a vede k nárůstu BMD v oblasti krčku femoru [90]. U pacientů s RS zatím podobné studie ve vztahu ke kostnímu metabolizmu chybí. Důležité je nezapomínat i na možný vliv léků, které mohou přispívat k vyššímu riziku pádů, jako jsou například anxiolytika nebo hypnotika.
Nutriční faktory
Pacienti s RS jsou častěji ohroženi ztrátou tělesné hmotnosti a malnutricí. Nedostatek bílkovin ve stravě způsobuje ztrátu svalové i kostní hmoty a zvyšuje riziko pádů. Mezi rizikové faktory malnutrice patří u RS hybný deficit, únava, nechutenství, poruchy zraku, kognitivní deficit a dysfagie. Důležitá je podrobná nutriční anamnéza a individualizace nutriční podpory.
Substituce vápníkem
Nízký denní příjem vápníku (< 500 mg) je u starších osob v běžné populaci (zvláště v kombinaci s nedostatkem vitaminu D) spojen se zvýšeným rizikem zlomenin. U pacientů s RS se může navíc uplatňovat i snížená střevní absorpce vápníku při nedostatku vitaminu D a pohlavních hormonů nebo při léčbě GK. Doporučený denní příjem vápníku (1 000 mg u premenopauzálních žen a u mužů do 70 let věku a 1 200 mg u postmenopauzálních žen a mužů nad 70 let věku) je vhodné zajistit u všech osob s RS. Pro suplementaci vápníkem se doporučují na prvním místě mléčné výrobky (zejména fermentované). Vždy je na místě snaha o zlepšení vstřebávání a retence vápníku v těle, namísto navyšování dávek vápníku [91]. Je nezbytné zajistit i doporučené dávky vitaminu D a snížit příjem zpracovaných potravin s vysokým obsahem fosfátů a kuchyňské soli. Vápník se špatně vstřebává v případě současného příjmu kyseliny fytové a šťavelové nebo při nadměrném příjmu vlákniny. Střevní absorpci vápníku může ovlivnit také střevní mikrobiota [92]. Vstřebávání vápníku nalačno z přípravků uhličitanu vápenatého je významně snížené v případě achlorhydrie (např. při užívání blokátorů protonové pumpy). Na druhé straně, omezení příjmu vápníku je nezbytné v některých případech hyperkalciurie a také při těžké imobilizaci, zvláště pokud se vyskytují další vlivy, které stimulují osteoresorpci (např. vyšší kostní obrat při deficitu sexagenů).
Substituce vitaminem D
Nedostatek vitaminu D v populaci bez RS je spojen se svalovou slabostí, zejména proximálních svalových skupin a s vyšším rizikem pádů. Fyzická výkonnost u starších osob klesá, pokud sérové koncentrace 25OHD klesají < 50 nmol/l, a dále se zrychluje, pokud je 25OHD < 30 nmol/l [93]. Metaanalýza randomizovaných klinických studií v populacích bez RS potvrdila, že dostatek vitaminu D může snížit výskyt pádů, přitom ke snížení rizika pádů je nutná koncentrace 25OHD alespoň 60 nmol/l [94]. Podobně kvalitní studie v populaci pacientů s RS zatím nebyly publikovány, ale je pravděpodobné, že i u pacientů s RS bude suplementace vitaminem D příznivě působit na metabolizmus svalů [95]. Nedostatek vitaminu D je u pacientů s RS častější, zejména u pacientů s vyšším stupněm motorického deficitu vzhledem k nízké expozici slunečnímu záření. Rovněž intolerance tepla, únava a svalová slabost u pacientů s RS přispívá k jejich menší expozici slunečnímu záření. Doporučený denní příjem vitaminu D 800–1 000 IU denně je vhodné zajistit u všech pacientů s RS celoročně. Účinnost suplementace lze ověřit stanovením sérové koncentrace 25OHD. Měření koncentrací 25OHD se doporučuje zejména u pacientů s vyšším stupněm motorického deficitu a při léčbě GK. Cílové koncentrace 25OHD v populaci pacientů s RS nebyly stanoveny, ale v běžné populaci je doporučovanou cílovou hodnotou koncentrace 25OHD alespoň 75 nmol/l (optimálně 75–110 nmol/l) [96]. Vyšší substituční dávka 4 000 IU denně může být potřebná k normalizaci sérových koncentrací 25OHD u pacientů léčených dlouhodobě GK a při omezené expozici UV-záření, zejména v zimních měsících. Denní příjem až 4 000 IU vitaminu D se považuje za bezpečný u většiny populace s výjimkou nemocných s urolitiázou a při vyšší střevní absorpci vápníku (např. při sarkoidóze). Podle některých doporučení je po omezenou dobu možné podávat 10 000 IU cholekalciferolu denně a horním limitem koncentrace 25OHD v séru je 125 nmol/l [97]. Potřebná dávka vitaminu D se bude mezi pacienty lišit, mj. v závislosti na věku, BMI (množství tukové tkáně) nebo na míře expozice slunečnímu záření. Nežádoucí účinky se mohou vyskytnout až při vyšším dávkování (hyperkalciurie až hyperkalcemie), a proto je nezbytné kontrolovat i kalciurii. Ve vyšších koncentracích 1,25(OH)2D3 také stimuluje kostní resorpci [98]. Intermitentně podávané vysoké dávky cholekalciferolu (150 000 IU 1krát za 3 měsíce) nebyly účinné ve snížení rizika pádů, zlepšení mobility nebo zlepšení svalové síly u starších žen bez RS [99].
Další nutriční faktory
Z dalších složek stravy je významný zejména dostatečný příjem bílkovin. Nedostatek bílkovin ve stravě vede k úbytku svalové hmoty, a zvyšuje se tak riziko pádů. Je doporučena vyvážená strava, zejména zajistit odpovídající příjem nenasycených tuků a esenciálních mastných kyselin a omezit příjem zpracovaných potravin s vyšším obsahem NaCl, fosfátů a jednoduchých cukrů, zajistit dostatečný příjem vlákniny, antioxidantů a upravit případný nedostatek stopových prvků, minerálů a vitaminů (zejména D, C a B). Recentní studie dokumentovaly významné spojení mezi stravovacími zvyklostmi a kvalitou života u pacientů s RS [100]. U pacientů s RS jsou stravovací zvyklosti ovlivněny řadou faktorů, např. únavou, depresí, kognitivním deficitem, dysfagií a hybným deficitem. To může vést např. k vyššímu příjmu energeticky bohatých „rychlých“ jídel nebo tzv. „pohodlných“ potravin, čímž se zvyšuje riziko řady chronických metabolických chorob se zhoršením průběhu onemocnění a kvality života. Nevhodná strava má prozánětlivé účinky a vede ke střevní dysbióze, která se může významně uplatňovat v patogenezi jak RS, tak osteoporózy [101]. Střevní mikrobiota je mimo jiné nezbytná pro tvorbu mastných kyseliny s krátkým řetězcem (SCFA – acetát, butyrát, propionát), které posilují bariérové funkce střeva a působí protizánětlivě (přispívají k nárůstu regulačních T-lymfocytů). Nové studie naznačují, že úprava střevní mikrobioty, např. pomocí probiotik a prebiotik, může být slibnou cestou v léčbě a prevenci nejen RS, ale i osteoporózy [102–104].
Imunomodulační léčba RS s vlivem na kostní metabolizmus
Interferon β (IFNβ), který je užíván k léčbě RS, potlačuje osteoklastogenezi a diferenciaci osteoklastů prostřednictvím signální dráhy JAK/STAT [105] a dlouhodobá léčba interferonem β nemá negativní vliv na BMD.
Fingolimod (FTY720) je analog sfingosinu používaný pro léčení relabující remitentní RS. Nemoc modifikující účinek fingolimodu na relaps-remitentní RS je zprostředkován přes modulaci receptorů pro sfingosin 1-fosfát (S1P) na lymfoidní a nervové tkáni, ale S1P signalizace má vliv na patogenezi mnoha dalších onemocnění, včetně osteoporózy [106]. Léčba fingolimodem u žen s RS potlačuje osteoresorpci [106]. Účinky novějších imunomodulačních léků na kostní metabolizmus zatím nebyly zkoumány.
Farmakologická léčba osteoporózy u roztroušené sklerózy
Cílem farmakologické intervence je prevence zlomenin. Většina léčiv je ale primárně určena pro prevenci a léčbu postmenopauzální, resp. involuční osteoporózy a průkaz jejich účinnosti v randomizovaných klinických studiích u pacientů s RS zatím chybí. Užití těchto léků u sekundární osteoporózy při RS je proto zatím většinou mimo schválená indikační kritéria. Přesto můžeme z hlediska patogeneze osteoporózy u RS očekávat, že tyto léky budou alespoň z části účinné.
Antiosteoresorpční léčba
Aminobisfosfonáty
Aminobisfosfonáty (BP) jsou nejčastěji užívanými léky v léčbě primární i sekundární osteoporózy. Byť chybí prospektivní studie s užitím BP u pacientů s RS, řada studií svědčí pro účinnost BP při osteoporóze spojené s imobilizací [107]. BP zpomalují remodelaci kosti a snižují imobilizací navozenou hyperkalcemii. Zvýšené hladiny vápníku při imobilizaci snižují sekreci parathormonu (PTH) a produkci 1,25(OH)2D3. Léčba BP potlačením osteoresorpce vede k poklesu kalcemie, a zvyšuje tak nepřímo i střevní absorpci vápníku. Nevýhodou dlouhodobé léčby BP, zvláště u mladších pacientů s RS je riziko snížení kostního obratu na úroveň nedostatečnou pro podporu normální kostní remodelace a zvýšená akumulace mikropoškození v kosti. Jelikož zatím neznáme důsledky dlouhodobé léčby BP na kvalitu kosti, jsou zejména u mladších žen a mužů doporučovány BP s menší účinnosti z hlediska potlačení kostní resorpce (aktivační frekvence) a s kratším poločasem v kosti (např. risedronát) nebo s výrazně delším intervalem mezi aplikacemi, který umožňuje zachovat kostní novotvorbu (např. kyselina zoledronová) [107]. BP se dlouhodobě akumulují ve skeletu a také pronikají skrze placentární bariéru, je tedy u žen ve fertilním věku nutná opatrnost. K možným častějším vedlejším účinkům léčby BP patří iritace horní části zažívacího traktu. S ohledem na častější dysfagie horního typu u pacientů s RS lze s výhodou užít intravenózní formy BP (kyselina zoledronová). Dvouletá léčba risedronátem u osteoporotických postmenopauzálních žen s různým stupněm hybného deficitu léčených nízkou dávkou GK vedla ke statisticky významnému poklesu biochemických markerů kostní remodelace (Carboxy-terminal telopeptide – CTX a amino-terminal propeptide – PINP) a k vzestupu BMD v oblasti bederní páteře (+4,8 ± 3,6 %) [86]. Změny BMD v oblasti proximálního femoru nebyly statisticky významné. Tyto výsledky svědčí pro příznivý účinek antiresorpční léčby risedronátem na metabolicky aktivnější trabekulární kost bederní páteře u žen s RS dlouhodobě léčených nízkou dávkou GK bez ohledu na hybný deficit. Signifikantní pokles ukazatelů kostního obratu (Bone Turnover Markers – BTM: βCTX i PINP) svědčí pro zpomalení remodelačního cyklu, při němž se může plněji uplatnit sekundární mineralizace kosti. Tyto výsledky jsou v souladu s předchozími studiemi hodnotícími vliv risedronátu u pacientů s glukokortikoidy indukovanou osteoporózou (GIO) [108] a podporují příznivé působení risedronátu, zejména na bederní páteř i u pacientek s hybným deficitem při RS.
Selektivní modulátory estrogenních receptorů
Selektivní modulátory estrogenních receptorů (SERM), např. raloxifen, jsou další možností léčby u žen po menopauze s rychlým úbytkem trámčité kosti a zvýšeným rizikem zlomenin obratlů. SERM podobně jako estrogeny stimulují produkci osteoprotegerinu (OPG) a tlumí produkci RANKL, a tím upravují narušený poměr RANKL/OPG u žen po menopauze a snižují kostní obrat. Na rozdíl od léčby aminobisfosfonáty nebo denosumabem upravuje léčba pomocí SERM kostní remodelaci do pásma premenopauzálních hodnot se zachováním fyziologických funkcí osteoklastů. I když je tato léčba bez nežádoucích gastrointestinálních účinků, zvýšené riziko žilní trombózy vylučuje tento preparát u žen s vyšším stupněm invalidity. U pacientek s nižším stupněm motorického deficitu, ale může raloxifen příznivě působit jak na skelet, tak na další tkáně (snížení rizika karcinomu prsní žlázy, zlepšení střevní absorpce vápníku a vyšší vnímavost svalů k mechanické zátěži). Nedostatek estrogenů přispívá k rychlejšímu úbytku BMD u žen po menopauze nejen urychlením resorpce kosti, ale také snížením citlivosti skeletu k biomechanické zátěži. Bylo zjištěno, že snížení počtu receptorů ERα po menopauze významně snižuje schopnost kostních buněk indukovat osteoanabolickou odpověď po mechanické zátěži. Experimentální práce s raloxifenem podporují tuto hypotézu [109].
Denosumab
Denosumab je plně humánní monoklonální protilátka třídy IgG2 proti RANKL (ligand pro receptor aktivující NF-ƘB), která je užívána pro léčbu postmenopauzální osteoporózy a dalších onemocnění se zvýšenou osteoresorpcí. U žen s postmenopauzální osteoporózou byla prokázána účinnost ve snížení výskytu obratlových i neobratlových zlomenin, včetně zlomenin proximálního femoru. Výhodou léčby denosumabem na rozdíl od léčby aminobisfosfonáty je jistě lepší průnik do kortikální kosti, a tak je možná i větší účinnost u pacientů s hybným deficitem a s úbytkem kortikální kosti dolních končetin. Léčba denosumabem vede ale také k výraznému potlačení kostní novotvorby [110], a tedy i obnovy kostní hmoty. Reverzibilita účinku denosumabu je nevýhodou v případě vynechání další dávky, jelikož po vysazení denosumabu dochází ke klinicky významnému „rebound“ fenoménu s rychlým úbytkem BMD a s nárůstem rizika zlomenin, zvláště u pacientů s těžkou osteoporózou [111]. Denosumab je novou možností léčby i u pacientů s RS, zejména při nesnášenlivosti nebo kontraindikaci léčby BP, i když podobně jako u léčby BP a raloxifenem se jedná o užití „off label“. Žádné klinické studie s denosumabem u pacientů s RS dosud nebyly publikovány a chybí tak informace nejen s ohledem na účinnost, ale i na bezpečnost léčby.
Osteoanabolická léčba
Aminobisfosfonáty a denosumab potlačují remodelaci kosti snížením počtu základních mnohobuněčných jednotek (Basic Multicellular Unit – BMU) a snížením objemu resorbované kosti v jednotlivých BMU. Nevýhodou antiresorpční léčby zejména u pacientů, kteří mají poruchu hybnosti nebo dlouhodobě užívají GK, je další snížení kostního obratu na úroveň, která může být nedostatečná pro normální obnovu kosti. U těchto pacientů je proto vhodné užití osteoanabolické léčby.
Teriparatid
V současné době je k dispozici pouze rekombinantní lidský parathormon, resp. N-terminální část molekuly parathormonu (rhPTH 1–34; teriparatid – TPTD). Podle současného úhradového omezení je možné aplikovat teriparatid v případě GIO u žen i mužů léčených GK v denní dávce odpovídající ≥ 5 mg prednisonu po dobu delší než 6 měsíců, pokud je T-skóre v oblasti bederní páteře ≤ -2,5 SD. Léčba TPTD ovlivňuje hlavní patogenetický mechanizmus GIO, útlum kostní novotvorby, a tato léčba je proto řádově účinnější než léčba BP [112]. Také při osteoporóze z inaktivity, při níž dochází k apoptóze osteocytů a k útlumu kostní novotvorby, bude TPTD účinnější [113]. V této indikaci však zatím chybí klinické studie. U osteoporotických žen s různým stupněm hybného deficitu při RS a současně léčených GK vedla roční osteoanabolická léčba teriparatidem k významnému vzestupu markeru kostní novotvorby PINP již po 6 měsících léčby a k signifikantnímu zvýšení BMD v bederní páteři, ale nikoliv v oblasti proximálního femoru [114]. V oblasti proximálního femoru má nepochybně negativní vliv snížená svalová síla dolních končetin při hybném deficitu. Rovněž krátká doba sledování bez plného uplatnění sekundární mineralizace kosti může vysvětlovat nesignifikantní změny BMD v proximálním femoru. Předchozí studie s TPTD prokazovaly největší nárůst BMD v oblasti proximálního femoru až po 18 měsících léčby. Dlouhodobější longitudinální studie by měly ověřit, zda dlouhodobá sekvenční nebo kombinovaná léčba (osteoanabolická a antiosteoresorpční) povede ke zlepšení BMD a pevnosti kosti i v oblasti proximálního femoru.
Protilátka proti sklerostinu
Romosozumab
Velmi slibné jsou výsledky experimentálních i klinických studií s protilátkou proti sklerostinu. Sklerostin ve zvýšené míře uvolňují osteocyty, pokud skelet není dostatečně zatěžován a jeho nadbytek vede k útlumu kostní novotvorby. U postmenopauzálních žen s osteoporózou byla léčba monoklonální protilátkou proti sklerostinu romosozumabem (v dávce 210 mg měsíčně) spojena se snížením rizika zlomenin obratlů v porovnání s placebem již po roce léčby [115]. Podávání sklerostin neutralizačních protilátek u imobilizovaných krys vedlo k dramatickému zvýšení novotvorby kosti a rovněž ke snížení osteoresorpce s navýšením objemu trámčité i kortikální kostní hmoty [116]. Protilátka proti sklerostinu by tak mohla být velmi účinnou variantou léčby i u imobilizovaných pacientů s RS.
Závěr
Vyhodnocení stavu skeletu a rizika zlomenin by mělo být nedílnou součástí plánu péče o pacienty s RS, a to i u mladších pacientů, zejména při vyšším stupni hybného deficitu (EDSS ≥ 6). Možnosti prevence však začínají nepochybně již u premenopauzálních žen a u mladších mužů s lehčím stupněm motorického deficitu (EDSS ≥ 4). Navržený algoritmus vyšetření u pacientů s RS je pracovní a vyžaduje další rozpracování a ověření v prospektivních studiích. Zvláštní prioritou je najít způsob, jak začlenit stupeň hybného deficitu (EDSS) a riziko pádů do algoritmu výpočtu rizika zlomenin. Vzhledem k preferenční ztrátě kostní i svalové hmoty v oblasti dolních končetin bude vhodné v dalších klinických studiích posuzovat interakce farmakologické léčby s dalšími nefarmakologickými postupy zaměřenými na posílení svalové hmoty a síly v oblasti dolních končetin. V patogenezi osteoporózy a zlomenin se uplatňují jak centrální zánětlivé a neurodegenerativní procesy, tak společné imunopatologické mechanizmy, zejména změny střevní mikrobioty mohou mít podstatnou úlohu v patogenezi obou onemocnění. Další výzkum v těchto oblastech nepochybně přinese i nové možnosti pro prevenci a léčbu osteoporózy u pacientů s RS.
Publikace byla podpořena MZ ČR – RVO VFN64165.
doc. MUDr. Vít Zikán, Ph.D.
Received | Doručené do redakcie | Doručeno do redakce 2. 11. 2018
Accepted | Prijaté po recenzii | Přijato po recenzi 22. 11. 2018
Zdroje
- Blahová-Dušánková J, Kalinčik T, Doležal T et al. Cost of multiple sclerosis in the Czech Republic: the COMS study. Mult Scler 2012; 18(5): 662–668. Dostupné z DOI: <http://dx.doi.org/10.1177/1352458511424422>.
- Compston A, Coles A. Multiple sclerosis. Lancet 2008; 372(9648): 1502–1517. Dostupné z DOI: <http://dx.doi.org/10.1016/S0140–6736(08)61620–7>.
- Štěpán JJ, Havrdová E, Týblová M et al. Markers of bone remodeling predict rate of bone loss in multiple sclerosis patients treated with low dose glucocorticoids. Clin Chim Acta 2004; 348(1–2): 147–154. Dostupné z DOI: <http://dx.doi.org/10.1016/j.cccn.2004.05.012>.
- Havrdová E. Roztroušená skleróza. 2. ed. Maxdorf: Praha 2009. ISBN 978–80–7345–187–5.
- Weinstock-Guttman B, Gallagher E, Baier M et al. Risk of bone loss in men with multiple sclerosis. Mult Scler 2004; 10(2):170–175. Dostupné z DOI: <http://dx.doi.org/10.1191/1352458504ms993oa>.
- Bazelier MT, van Staa T, Uitdehaag BM et al. The risk of fracture in patients with multiple sclerosis: the UK general practice research database. J Bone Miner Res 2011; 26(9): 2271–2279. Dostupné z DOI: <http://dx.doi.org/10.1002/jbmr.418.>.
- Dobson R, Ramagopalan S, Giovannoni G et al. Risk of fractures in patients with multiple sclerosis: a population-based cohort study. Neurology 2012; 79(18): 1934–1935. Dostupné z DOI: <http://dx.doi.org/10.1212/01.wnl.0000422676.74031.07>.
- Gregson CL, Dennison EM, Compston JE et al. Disease-specific perception of fracture risk and incident fracture rates: GLOW cohort study. Osteoporos Int 2014; 25(1): 85–95. Dostupné z DOI: <http://dx.doi.org/10.1007/s00198–013–2438-y>.
- Marrie RA, Cutter G, Tyry T et al. A cross-sectional study of bone health in multiple sclerosis. Neurology 2009; 73(17):1394–1398. Dostupné z DOI: <http://dx.doi.org/10.1212/WNL.0b013e3181beece8>.
- Bazelier MT, Bentzen J, Vestergaard P et al. The risk of fracture in incident multiple sclerosis patients: The Danish National Health Registers. Mult Scler 2012; 18(11): 1609–1616. Dostupné z DOI: <http://dx.doi.org/10.1177/1352458512442755>.
- Dimitri P, Rosen C. The Central Nervous System and Bone Metabolism: An Evolving Story. Calcif Tissue Int 2017; 100(5): 476–485. Dostupné z DOI: <http://dx.doi.org/10.1007/s00223–016–0179–6>.
- Elefteriou F, Campbell P, Ma Y. Control of bone remodeling by the peripheral sympathetic nervous system. Calcif Tissue Int 2014; 94(1):140–151. Dostupné z DOI: <http://dx.doi.org/10.1007/s00223–013–9752–4>.
- Formica CA, Cosman F, Nieves J et al. Reduced bone mass and fat-free mass in women with multiple sclerosis: effects of ambulatory status and glucocorticoid use. Calcif Tissue Int 1997; 61(2): 129–133.
- Gupta S, Ahsan I, Mahfooz N et al. Osteoporosis and multiple sclerosis: risk factors, pathophysiology, and therapeutic interventions. CNS Drugs 2014; 28(8): 731–742. Dostupné z DOI: <http://dx.doi.org/10.1007/s40263–014–0173–3>.
- Bloomfield SA. Disuse osteopenia. Curr Osteoporos Rep 2010; 8(2): 91–97. Dostupné z DOI: <http://dx.doi.org/10.1007/s11914–010–0013–4.
- Hamrick MW, McNeil PL, Patterson SL. Role of muscle-derived growth factors in bone formation. J Musculoskelet Neuronal Interact 2010; 10(1): 64–70.
- Cianferotti L, Brandi ML. Muscle-bone interactions: basic and clinical aspects. Endocrine 2014; 45(2): 165–177. Dostupné z DOI: <http://dx.doi.org/10.1007/s12020–013–0026–8>.
- Laurent MR, Dubois V, Claessens F et al. Muscle-bone interactions: From experimental models to the clinic? A critical update. Mol Cell Endocrinol 2016; 432 : 14–36. Dostupné z DOI: <http://dx.doi.org/10.1016/j.mce.2015.10.017>.
- Kurtzke JF. Rating neurologic impairment in multiple sclerosis: an expanded disability status scale (EDSS). Neurology 1983; 33(11): 1444–1452.
- Zikán V, Týblová M, Raška I jr et al. Bone mineral density and body composition in men with multiple sclerosis chronically treated with low-dose glucocorticoids. Physiol Res 2012; 61(4): 405–417.
- Týblová M, Zikán V, Luchavová M et al. Snížená denzita kostního minerálu u žen s roztroušenou sklerózou: vliv motorického deficitu, úbytku svalové hmoty a léčby glukokortikoidy. Článek: Cesk Slov Neurol 2013; 76(1): 35–44.
- Týblová M, Kalinčík T, Zikán V, Havrdová E. Impaired ambulation and steroid therapy impact negatively on bone health in multiple sclerosis. Eur J Neurol 2015; 22(4): 624–632. Dostupné z DOI: <http://dx.doi.org/10.1111/ene.12479>.
- Moen SM, Celius EG, Sandvik L et al. Low bone mass in newly diagnosed multiple sclerosis and clinically isolated syndrome. Neurology 2011; 77(2): 151–157. Dostupné z DOI: <http://dx.doi.org/10.1212/WNL.0b013e3182242d34>.
- Sioka C, Fotopoulos A, Georgiou A et al. Body composition in ambulatory patients with multiple sclerosis. J Clin Densitom 2011; 14(4): 465–470. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jocd.2011.04.012>.
- Wens I, Dalgas U, Vandenabeele F et al. Multiple sclerosis affects skeletal muscle characteristics. PLoS One 2014; 9(9): e108158. Dostupné z DOI: <http://dx.doi.org/10.1371/journal.pone.0108158>.
- Nilsagard Y, Lundholm C, Denison E et al. Predicting accidental falls in people with multiple sclerosis – a longitudinal study. Clin Rehabil 2009; 23(3): 259–269. Dostupné z DOI: <http://dx.doi.org/10.1177/0269215508095087>.
- Zeigelboim BS, Arruda WO, Mangabeira-Albernaz PL et al. Vestibular findings in relapsing-remitting multiple sclerosis: a study of thirty patients. Int Tinnitus J 2008; 14(2): 139–145.
- Ozgen G, Karapolat H, Akkoc Y et al. Is customized vestibular rehabilitation effective in patients with multiple sclerosis? A randomized controlled trial. Eur J Phys Rehabil Med 2016; 52(4):466–478.
- Vignaux G, Ndong JD, Perrien DS et al. Inner Ear Vestibular Signals Regulate Bone Remodeling via the Sympathetic Nervous System. J Bone Miner Res 2015; 30(6): 1103–1111. Dostupné z DOI: <http://dx.doi.org/10.1002/jbmr.2426>.
- Vignaux G, Besnard S, Ndong J et al. Bone remodeling is regulated by inner ear vestibular signals. J Bone Miner Res 2013; 28(10): 2136–2144. Dostupné z DOI: <http://dx.doi.org/10.1002/jbmr.1940>.
- Bigelow RT, Semenov YR, Anson E et al. Impaired Vestibular Function and Low Bone Mineral Density: Data from the Baltimore Longitudinal Study of Aging. J Assoc Res Otolaryngol 2016; 17(5): 433–440. Dostupné z DOI: <http://dx.doi.org/10.1007/s10162–016–0577–5>.
- Gironi M, Solaro C, Meazza C et al. Growth hormone and disease severity in early stage of multiple sclerosis. Mult Scler Int 2013; 2013 : 836486. Dostupné z DOI: <http://dx.doi.org/10.1155/2013/836486>.
- Lanzillo R, Di Somma C, Quarantelli M et al. Insulin-like growth factor (IGF)-I and IGF-binding protein-3 serum levels in relapsing-remitting and secondary progressive multiple sclerosis patients. Eur J Neurol 2011; 18(12): 1402–1406. Dostupné z DOI: <http://dx.doi.org/10.1111/j.1468–1331.2011.03433.x>.
- Ysrraelit MC, Gaitan MI, Lopez AS et al. Impaired hypothalamic-pituitary-adrenal axis activity in patients with multiple sclerosis. Neurology 2008; 71(24): 1948–1954. Dostupné z DOI: <http://dx.doi.org/10.1212/01.wnl.0000336918.32695.6b>.
- Melief J, de Wit SJ, van Eden CG et al. HPA axis activity in multiple sclerosis correlates with disease severity, lesion type and gene expression in normal-appearing white matter. Acta Neuropathol 2013; 126(2): 237–249. Dostupné z DOI: <http://dx.doi.org/10.1007/s00401–013–1140–7>.
- Bove R, Musallam A, Healy BC et al. Low testosterone is associated with disability in men with multiple sclerosis. Mult Scler 2014; 20(12): 1584–1592. Dostupné z DOI: <http://dx.doi.org/10.1177/1352458514527864>.
- Vandenput L, Mellström D, Laughlin GA et al. Low Testosterone, but not Estradiol, Is Associated with Incident Falls in Older Men – The International MrOS Study. J Bone Miner Res 2017; 32(6): 1174–1181. Dostupné z DOI: <http://dx.doi.org/10.1002/jbmr.3088>.
- Lee KC, Lanyon LE. Mechanical loading influences bone mass through estrogen receptor alpha. Exerc Sport Sci Rev 2004; 32(2): 64–68.
- Wei T, Lightman SL. The neuroendocrine axis in patients with multiple sclerosis. Brain 1997; 120(Pt 6): 1067–1076.
- Garcia LA, King KK, Ferrini MG et al. 1,25(OH)2vitamin D3 stimulates myogenic differentiation by inhibiting cell proliferation and modulating the expression of promyogenic growth factors and myostatin in C2C12 skeletal muscle cells. Endocrinology 2011; 152(8): 2976–2986. Dostupné z DOI: <http://dx.doi.org/10.1210/en.2011–0159>.
- Swanson CM, Srikanth P, Lee CG et al. Osteoporotic Fractures in Men MrOS Study Research Group. Associations of 25-Hydroxyvitamin D and 1,25-Dihydroxyvitamin D With Bone Mineral Density, Bone Mineral Density Change, and Incident Nonvertebral Fracture. J Bone Miner Res 2015; 30(8): 1403–1413. Dostupné z DOI: <http://dx.doi.org/10.1002/jbmr.2487>.
- Terzi T, Terzi M, Tander B et al. Changes in bone mineral density and bone metabolism markers in premenopausal women with multiple sclerosis and the relationship to clinical variables. J Clin Neurosci 2010; 17(10): 1260–1264. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jocn.2010.01.044>.
- Jin D, Wu S, Zhang YG et al. Lack of vitamin D receptor causes dysbiosis and changes the functions of the murine intestinal microbiome. Clin Ther 2015; 37(5): 996–1009. Dostupné z DOI: <http://dx.doi.org/10.1016/j.clinthera.2015.04.004>.
- Manolagas SC. Birth and death of bone cells: basic regulatory mechanisms and implications for the pathogenesis and treatment of osteoporosis. Endocr Rev 2000; 21(2): 115–137. Dostupné z DOI: <http://dx.doi.org/10.1210/edrv.21.2.0395>.
- Olsson A, Oturai DB, Sørensen PS et al. Short-term, high-dose glucocorticoid treatment does not contribute to reduced bone mineral density in patients with multiple sclerosis. Mult Scler 2015; 21(12): 1557–1565. Dostupné z DOI: <http://dx.doi.org/10.1177/1352458514566417>.
- Dovio A, Perazzolo L, Osella G et al. Immediate fall of bone formation and transient increase of bone resorption in the course of high-dose, short-term glucocorticoid therapy in young patients with multiple sclerosis. J Clin Endocrinol Metab 2004; 89(10): 4923–4928. Dostupné z DOI: <http://dx.doi.org/10.1210/jc.2004–0164>.
- Ozgocmen S, Bulut S, Ilhan N et al. Vitamin D deficiency and reduced bone mineral density in multiple sclerosis: effect of ambulatory status and functional capacity. J Bone Miner Metab 2005; 23(4): 309–313. Dostupné z DOI: <http://dx.doi.org/10.1007/s00774–005–0604–9>.
- Van Staa TP, Laan RF, Barton IP et al. Bone density threshold and other predictors of vertebral fracture in patients receiving oral glucocorticoid therapy. Arthritis Rheum 2003; 48(11): 3224–3229. Dostupné z DOI: <http://dx.doi.org/10.1002/art.11283>.
- Swidsinski A, Dörffel Y, Loening-Baucke V et al. Reduced Mass and Diversity of the Colonic Microbiome in Patients with Multiple Sclerosis and Their Improvement with Ketogenic Diet. Front Microbiol 2017; 8 : 1141. Dostupné z DOI: <http://dx.doi.org/10.3389/fmicb.2017.01141>.
- Camara-Lemarroy CR, Metz LM, Yong VW. Focus on the gut-brain axis: Multiplesclerosis, the intestinal barrier and the microbiome. World J Gastroenterol 2018; 24(37): 4217–4223. Dostupné z DOI: <http://dx.doi.org/10.3748/wjg.v24.i37.4217>.
- Dendrou CA, Fugger L, Friese MA. Immunopathology of multiple sclerosis. Nat Rev Immunol 2015; 15(9): 545–558. Dostupné z DOI: <http://dx.doi.org/10.1038/nri3871>.
- Kurban S, Akpinar Z, Mehmetoglu I. Receptor activator of nuclear factor kappa B ligand (RANKL) and osteoprotegerin levels in multiple sclerosis. Mult Scler 2008; 14(3): 431–432. Dostupné z DOI: <http://dx.doi.org/10.1177/1352458507084028>.
- Takeda S. Osteoporosis: a neuroskeletal disease? Int J Biochem Cell Biol 2009; 41(3): 455–459. Dostupné z DOI: <http://dx.doi.org/10.1016/j.biocel.2008.08.002>.
- Takarada T, Xu C, Ochi H et al. Bone Resorption Is Regulated by Circadian Clock in Osteoblasts. J Bone Miner Res 2017; 32(4): 872–881. Dostupné z DOI: <http://dx.doi.org/10.1002/jbmr.3053>.
- Hirai T, Tanaka K, Togari A. beta-adrenergic receptor signaling regulates Ptgs2 by driving circadian gene expression in osteoblasts. J Cell Sci 2014; 127(Pt 17): 3711–3719. Dostupné z DOI: <http://dx.doi.org/10.1242/jcs.148148>.
- Fujihara Y, Kondo H, Noguchi T et al. Glucocorticoids mediate circadian timing in peripheral osteoclasts resulting in the circadian expression rhythm of osteoclast-related genes. Bone 2014; 61 : 1–9. Dostupné z DOI: <http://dx.doi.org/10.1016/j.bone.2013.12.026>.
- Golombek DA, Casiraghi LP, Agostino PV et al. The times they’re a-changing: effects of circadian desynchronization on physiology and disease. J Physiol Paris 2013; 107(4): 310–322. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jphysparis.2013.03.007>.
- Videira G, Castro P, Vieira B et al. Autonomic dysfunction in multiple sclerosis is better detected by heart rate variability and is not correlated with central autonomic network damage. J Neurol Sci 2016; 367 : 133–137. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jns.2016.05.049>.
- Yao Q, Liang H, Huang B et al. Beta-adrenergic signaling affect osteoclastogenesis via osteocytic MLO-Y4 cells' RANKL production. Biochem Biophys Res Commun 2017; 488(4): 634–640. Dostupné z DOI: <http://dx.doi.org/10.1016/j.bbrc.2016.11.011>.
- Buenafe AC. Diurnal rhythms are altered in a mouse model of multiple sclerosis. J Neuroimmunol 2012; 243(1–2): 12–17. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jneuroim.2011.12.002>.
- Braley TJ, Boudreau EA. Sleep Disorders in Multiple Sclerosis. Curr Neurol Neurosci Rep 2016; 16(5): 50. Dostupné z DOI: <http://dx.doi.org/10.1007/s11910–016–0649–2>.
- Tononi G, Massimini M, Riedner BA. Sleepy dialogues between cortex and hippocampus: who talks to whom? Neuron 2006; 52(5):748–749. Dostupné z DOI: <http://dx.doi.org/10.1016/j.neuron.2006.11.014>.
- Damasceno A, Moraes AS, Farias A et al. Disruption of melatonin circadian rhythm production is related to multiple sclerosis severity: A preliminary study. J Neurol Sci 2015; 353(1–2): 166–168. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jns.2015.03.040>.
- Cardinali DP, Ladizesky MG, Boggio V et al. Melatonin effects on bone: experimental facts and clinical perspectives. J Pineal Res 2003; 34(2): 81–87.
- Amstrup AK, Sikjaer T, Heickendorff L et al. Melatonin improves bone mineral density at the femoral neck in postmenopausal women with osteopenia: a randomized controlled trial. J Pineal Res 2015; 59(2): 221–229. Dostupné z DOI: <http://dx.doi.org/10.1111/jpi.12252>.
- Hood S, Amir S. The aging clock: circadian rhythms and later life. J Clin Invest 2017; 127(2): 437–446. Dostupné z DOI: <http://dx.doi.org/10.1172/JCI90328>.
- Pan W, Kastin AJ. Leptin: a biomarker for sleep disorders? Sleep Med Rev 2014; 18(3): 283–290. Dostupné z DOI: <http://dx.doi.org/10.1016/j.smrv.2013.07.003>.
- Motyl KJ, Rosen CJ. The skeleton and the sympathetic nervous system: it's about time! J Clin Endocrinol Metab 2012; 97(11): 3908–3911. Dostupné z DOI: <http://dx.doi.org/10.1210/jc.2012–3205>.
- Kondo H, Togari A. Continuous treatment with a low dose beta-agonist reduces bone mass by increasing bone resorption without suppressing bone formation. Calcif Tissue Int 2011; 88(1): 23–32. Dostupné z DOI: <http://dx.doi.org/10.1007/s00223–010–9421–9>.
- Guo B, Zhang ZK, Liang C et al. Molecular Communication from Skeletal Muscle to Bone: A Review for Muscle-Derived Myokines Regulating Bone Metabolism. Calcif Tissue Int 2017; 100(2): 184–192. Dostupné z DOI: <http://dx.doi.org/10.1007/s00223–016–0209–4>.
- Tosun A, Dogru MT, Aydn G et al. Does autonomic dysfunction exist in postmenopausal osteoporosis? Am J Phys Med Rehabil 2011; 90(12): 1012–1019. Dostupné z DOI: <http://dx.doi.org/10.1097/PHM.0b013e31822dea1a>.
- Farr JN, Charkoudian N, Barnes JN et al. Relationship of sympathetic activity to bone micro-structure, turnover, and plasma osteopontin levels in women. J Clin Endocrinol Metab 2012; 97(11): 4219–4227. Dostupné z DOI: <http://dx.doi.org/10.1210/jc.2012–2381>.
- Polak PE, Kalinin S, Feinstein DL. Locus coeruleus damage and noradrenaline reductions in multiple sclerosis and experimental autoimmune encephalomyelitis. Brain 2011; 134(Pt 3): 665–677. Dostupné z DOI: <http://dx.doi.org/10.1093/brain/awq362>.
- Rajda C, Bencsik K, Füvesi J et al. The norepinephrine level is decreased in the lymphocytes of long-term interferon-beta-treated multiple sclerosis patients. Mult Scler 2006; 12(3): 265–270. Dostupné z DOI: <http://dx.doi.org/10.1191/135248506ms1269oa>.
- Boeschoten RE, Braamse AM, Beekman AT et al. Prevalence of depression and anxiety in Multiple Sclerosis: A systematic review and meta-analysis. J Neurol Sci 2017; 372 : 331–341. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jns.2016.11.067>.
- Cizza G, Primma S, Csako G. Depression as a risk factor for osteoporosis. Trends Endocrinol Metab 2009; 20(8): 367–373. Dostupné z DOI: <http://dx.doi.org/10.1016/j.tem.2009.05.003>.
- Iwamoto I, Douchi T, Kosha S et al. Relationships between serum leptin level and regional bone mineral density, bone metabolic markers in healthy women. Acta Obstet Gynecol Scand 2000; 79(12): 1060–1064.
- Yirmiya R, Goshen I, Bajayo A et al. Depression induces bone loss through stimulation of the sympathetic nervous system. Proc Natl Acad Sci USA 2006; 103(45): 16876–16881. Dostupné z DOI: <http://dx.doi.org/10.1073/pnas.0604234103>.
- Marcum ZA, Perera S, Thorpe JM et al. Health ABC Study. Antidepressant Use and Recurrent Falls in Community-Dwelling Older Adults: Findings from the Health ABC Study. Ann Pharmacother 2016; 50(7): 525–533. Dostupné z DOI: <http://dx.doi.org/10.1177/1060028016644466>.
- Wang CY, Fu SH, Wang CL et al. Serotonergic antidepressant use and the risk of fracture: a population-based nested case-control study. Osteoporos Int 2016; 27(1): 57–63. Dostupné z DOI: <http://dx.doi.org//10.1007/s00198–015–3213-z>.
- Weinstein RS. Clinical practice. Glucocorticoid-induced bone disease. N Engl J Med 2011; 365(1): 62–70. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMcp1012926>.
- Hearn AP, Silber E. Osteoporosis in multiple sclerosis. Mult Scler 2010; 16(9): 1031–1043. Dostupné z DOI: <http://dx.doi.org/10.1177/1352458510368985>.
- Edwards MH, Jameson K, Denison H et al. Clinical risk factors, bone density and fall history in the prediction of incident fracture among men and women. Bone 2013; 52(2): 541–547. Dostupné z DOI: <http://dx.doi.org/10.1016/j.bone.2012.11.006>.
- Kanis JA, McCloskey E, Johansson H et al. FRAX (®) with and without bone mineral density. Calcif Tissue Int 2011; 90(1): 1–13. Dostupné z DOI: <http://dx.doi.org/10.1007/s00223–011–9544–7>.
- Binks S, Dobson R. Risk Factors, Epidemiology and Treatment Strategies for Metabolic Bone Disease in Patients with Neurological Disease. Curr Osteoporos Rep 2016; 14(5):199–210. Dostupné z DOI: <http://dx.doi.org/10.1007/s11914–016–0320–5>.
- Williams P, Frank A, Crawford CM et al. Unrecongised femoral fractures in patients with paraplegia due to multiple sclerosis. Br Med J (Clin Res Ed) 1984; 289(6443): 501.
- Raška I Jr, Týblová M, Rašková M et al. Omezená schopnost chůze významně přispívá k úbytku kostní denzity v proximálním femuru u premenopauzálních i postmenopauzálních žen s roztroušenou sklerózou. Osteologický bulletin 2012; 17(4): 128–135.
- Dalgas U, Stenager E, Jakobsen J et al. Resistance training improves muscle strength and functional capacity in multiple sclerosis. Neurology 2009; 73(18): 1478–1484. Dostupné z DOI: <http://dx.doi.org/10.1212/WNL.0b013e3181bf98b4>.
- Snook EM, Motl RW. Effect of exercise training on walking mobility in multiple sclerosis: a meta-analysis. Neurorehabil Neural Repair 2009; 23(2): 108–116. Dostupné z DOI: <http://dx.doi.org/10.1177/1545968308320641>.
- Ryan AS, Ivey FM, Hurlbut DE et al. Regional bone mineral density after resistive training in young and older men and women. Scand J Med Sci Sports 2004; 14(1): 16–23.
- Štěpán J. Osteoporóza a metabolická onemocnění skeletu. In: Pavelka K et al (eds). Revmatologie. Maxdorf: Praha 2012 : 544–553. ISBN 978–80–7345–295–7.
- Krupa-Kozak U, Markiewicz LH, Lamparski G, Juśkiewicz J. Administration of Inulin-Supplemented Gluten-Free Diet Modified Calcium Absorption and Caecal Microbiota in Rats in a Calcium-Dependent Manner. Nutrients 2017; 9(7): pii:E702. Dostupné z DOI: <http://dx.doi.org/10.3390/nu9070702>.
- Wicherts IS, van Schoor NM, Boeke AJ et al. Vitamin D status predicts physical performance and its decline in older persons. J Clin Endocrinol Metab 2007; 92(6): 2058–2065. Dostupné z DOI: <http://dx.doi.org/10.1210/jc.2006–1525>.
- Bischoff-Ferrari HA, Dawson-Hughes B, Staehelin HB et al. Fall prevention with supplemental and active forms of vitamin D: a metaanalysis of randomised controlled trials. BMJ 2009; 339:b3692. Dostupné z DOI: <http://dx.doi.org/10.1136/bmj.b3692>.
- Tanner SB, Harwell SA. More than healthy bones: a review of vitamin D in muscle health. Ther Adv Musculoskelet Dis 2015; 7(4):152–159. Dostupné z DOI: <http://dx.doi.org/10.1177/1759720X15588521>.
- Bouillon R, Van Schoor NM, Gielen E et al. Optimal vitamin D status: a critical analysis on the basis of evidence-based medicine. J Clin Endocrinol Metab 2013; 98(8): E1283–1304. Dostupné z DOI: <http://dx.doi.org/10.1210/jc.2013–1195>.
- Rizzoli R, Boonen S, Brandi ML et al. Vitamin D supplementation in elderly or postmenopausal women: a 2013 update of the 2008 recommendations from the European Society for Clinical and Economic Aspects of Osteoporosis and Osteoarthritis (ESCEO). Curr Med Res Opin 2013; 29(4): 305–313. Dostupné z DOI: <http://dx.doi.org/10.1185/03007995.2013.766162>.
- Lieben L, Carmeliet G. The delicate balance between vitamin D, calcium and bone homeostasis: lessons learned from intestinal - and osteocyte-specific VDR null mice. J Steroid Biochem Mol Biol 2013; 136 : 102–106. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jsbmb.2012.09.019>.
- Glendenning P, Inderjeeth CA. Controversy and consensus regarding vitamin D: Recent methodological changes and the risks and benefits of vitamin D supplementation. Crit Rev Clin Lab Sci 2016; 53(1):13–28. Dostupné z DOI: <http://dx.doi.org/10.3109/10408363.2015.1074157>.
- Hadgkiss EJ, Jelinek GA, Weiland TJ et al. The association of diet with quality of life, disability, and relapse rate in an international sample of people with multiple sclerosis. Nutr Neurosci 2015; 18(3):125–136. Dostupné z DOI: <http://dx.doi.org/10.1179/1476830514Y.0000000117>.
- Chu F, Shi M, Lang Y et al. Gut Microbiota in Multiple Sclerosis and Experimental Autoimmune Encephalomyelitis: Current Applications and Future Perspectives. Mediators Inflamm 2018; 2018 : 8168717.
- Marietta E, Horwath I, Balakrishnan B et al. Role of the intestinal microbiome in autoimmune diseases and its use in treatments. Cell Immunol 2018; pii: S0008–8749(18)30418–0. Dostupné z DOI: <http://dx.doi.org/10.1016/j.cellimm.2018.10.005>.
- Whisner CM, Castillo LF. Prebiotics, Bone and Mineral Metabolism. Calcif Tissue Int 2018; 102(4): 443–479. Dostupné z DOI: <http://dx.doi.org/10.1007/s00223–017–0339–3>.
- Biver E, Durosier-Izart C, Merminod F et al. Fermented dairy products consumption is associated with attenuated cortical bone loss independently of total calcium, protein, and energy intakes in healthy postmenopausal women. Osteoporos Int 2018; 29(8): 1771–1782. Dostupné z DOI: <http://dx.doi.org/10.1007/s00198–018–4535–4>.
- Seeliger C, Schyschka L, Kronbach Z et al. Signaling pathway STAT1 is strongly activated by IFN-β in the pathogenesis of osteoporosis. Eur J Med Res 2015; 20 : 1. Dostupné z DOI: <http://dx.doi.org/10.1186/s40001–014–0074–4>.
- Miyazaki Y, Niino M, Kanazawa I et al. Fingolimod sDostupné z DOI: uppresses bone resorption in female patients with multiple sclerosis. J Neuroimmunol 2016; 298 : 24–31. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jneuroim.2016.06.007>.
- Bubbear JS, Gall A, Middleton FR et al. Early treatment with zoledronic acid prevents bone loss at the hip following acute spinal cord injury. Osteoporos Int 2011; 22(1):271–279. Dostupné z DOI: <http://dx.doi.org/10.1007/s00198–010–1221–6>.
- Mok CC, Tong KH, To CH et al. Risedronate for prevention of bone mineral density loss in patients receiving high-dose glucocorticoids: a randomized double-blind placebo-controlled trial. Osteoporos Int 2008; 19(3): 357–364. Dostupné z DOI: <http://dx.doi.org/10.1007/s00198–007–0505-y>.
- Siu WS, Ko CH, Hung LK et al. Effect of anti-osteoporotic agents on the prevention of bone loss in unloaded bone. Mol Med Rep 2013, 8(4): 1188–1194. Dostupné z DOI: <http://dx.doi.org/10.3892/mmr.2013.1647>.
- Dempster D, Zhou HH, Recker RR et al. A longitudinal study of skeletal histomorphometry at 6 and 24 months across four bone envelopes in postmenopausal women with osteoporosis receiving teriparatide or zoledronic acid in the SHOTZ trial. J Bone Miner Res 2016; 31(7):1429–1439. Dostupné z DOI: <http://dx.doi.org/10.1002/jbmr.2804>.
- Lamy O, Gonzalez-Rodriguez E, Stoll D et al. Severe rebound-associated vertebral fractures after denosumab discontinuation: nine clinical cases report. J Clin Endocrinol Metab 2017; 102(2): 354–358. Dostupné z DOI: <http://dx.doi.org/10.1210/jc.2016–3170>.
- Saag KG, Zanchetta JR, Devogelaer JP et al. Effects of teriparatide versus alendronate for treating glucocorticoid-induced osteoporosis: thirty-six-month results of a randomized, double-blind, controlled trial. Arthritis Rheum 2009; 60(11): 3346–3355. Dostupné z DOI: <http://dx.doi.org/10.1002/art.24879>.
- Turner RT, Evans GL, Lotinun S et al. Dose-response effects of intermittent PTH on cancellous bone in hindlimb unloaded rats. J Bone Miner Res 2007; 22(1): 64–71. Dostupné z DOI: <http://dx.doi.org/10.1359/jbmr.061006>.
- Michalská D, Zikán V, Týblová M et al. Srovnání léčby teriparatidem a risedronatem v prevenci úbytku kostní hmoty u postmeno-pauzálních žen s roztroušenou sklerózou léčených nízkou dávkou glukokortikoidů. Osteologický Bulletin 2015; 20(1): 3–9.
- Cosman F, Crittenden DB, Adachi JD et al. Romosozumab Treatment in Postmenopausal Women with Osteoporosis. N Engl J Med 2016; 375(16): 1532–1543. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMoa1607948>.
- Tian X, Jee WS, Li X et al. Sclerostin antibody increases bone mass by stimulating bone formation and inhibiting bone resorption in a hindlimb-immobilization rat model. Bone 2011; 48(2): 197–201. Dostupné z DOI: <http://dx.doi.org/10.1016/j.bone.2010.09.009>.
Štítky
Biochemie Dětská gynekologie Dětská radiologie Dětská revmatologie Endokrinologie Gynekologie a porodnictví Interní lékařství Ortopedie Praktické lékařství pro dospělé Radiodiagnostika Rehabilitační a fyzikální medicína Revmatologie Traumatologie Osteologie
Článek vyšel v časopiseClinical Osteology
Nejčtenější tento týden
2018 Číslo 4- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
-
Všechny články tohoto čísla
- 18-mesačná liečba teriparatidom zlepšuje u pacientov s glukokortikoidmi indukovanou osteoporózou hodnoty hustoty kostného minerálu a trabekulárne kostné skóre: výsledky prospektívneho sledovania (register OSTEO.sk)
- Osteoporóza a zlomeniny u roztroušené sklerózy: patogeneze, rizikové faktory, možnosti léčby a prevence
- Incidencia zlomenín femoru na Slovensku v rokoch 2000–2016
- Miesto a postavenie vitamínu D v liečbe sekundárnej osteoporózy u onkologických pacientov
- Klinický význam komponentov systému RANK/RANKL/OPG u reumatoidnej artritídy
- Interdisciplinárny prístup k pacientke s akútnou lymfoblastovou leukémiou
- Clinical Osteology
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Klinický význam komponentov systému RANK/RANKL/OPG u reumatoidnej artritídy
- Interdisciplinárny prístup k pacientke s akútnou lymfoblastovou leukémiou
- Incidencia zlomenín femoru na Slovensku v rokoch 2000–2016
- Osteoporóza a zlomeniny u roztroušené sklerózy: patogeneze, rizikové faktory, možnosti léčby a prevence
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



