-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Sekundárna osteoporóza pri nádorových ochoreniach
Secondary osteoporosis in patients with malignancies
Continual improvement of antineoplastic therapy and early diagnosis of malignancies – especially in breast and prostate cancer cause better survival but it can caused late toxicity. Estrogens have a dominant position in bone turnover. Using inhibitors of aromatase cause blockade of extragonadal synthesis of estrogens. Also androgen deprivation therapy block production of androgens in men with prostate cancer. Chemotherapy and cancer cells by themselves can caused lowering of BMD (bone mineral density) also and low BMD correlate with low traumatic fractures. These fractures, especially those of hip and spine not only reduce the quality of life, but can reduce survival as well. That is the reason why we need to think about osteoporosis, malignancy, breast cancer, prostate cancer, prevention and treatment of secondary osteoporosis it, we need to make some preventive measures, we need to try to make the diagnosis as soon as possible, and we need to treat osteoporosis when it appears.
Key words:
breast cancer – malignancy – osteoporosis – prevention and treatment of secondary osteoporosis – prostate cancer
Received 6. 8. 2018
Accepted 28. 8. 2018
Autoři: Špániková Beata
Působiště autorů: Osteocentrum pre onkologické diagnózy, interná a praktická ambulancia, Onkologický ústav sv.
Vyšlo v časopise: Clinical Osteology 2018; 23(1): 9-17
Kategorie: Přehledové články
Souhrn
Pri rozvoji protinádorovej liečby ako aj včasnom vyhľadávaní nádorových ochorení dochádza k predlžovaniu prežívania pacientov. To vedie k nárastu prejavov neskorej toxicity. Jednou z nich je vznik sekundárnej osteoporózy. Ide najmä o pacientov, u ktorých sa v liečbe využíva dlhodobá hormónová manipulácia. Je to liečba inhibítormi aromatázy pri karcinóme prsníka a androgén-deprivačná liečba pri karcinóme prostaty. Aj systémová chemoterapia a rádioterapia môže viesť ku zníženiu kostnej denzity. Pokles kostnej denzity koreluje so vznikom nizkotraumatických zlomenín. Tieto nielen že zhoršujú kvalitu života, ale môžu ho aj skrátiť. Preto je dôležité na sekundárnu osteoporózu myslieť, pokúsiť sa jej predísť, alebo aspoň včas ju diagnostikovať a liečiť.
Kľúčové slová:
karcinóm prostaty – karcinóm prsníka – malignity – osteoporóza – prevencia a liečba sekundárnej osteoporózy
Úvod
Pokles kostnej denzity a vznik sekundárnej osteoporózy onkologických pacientov je podmienený niekoľkými etiopatogenetickými faktormi. Ide o vplyv samotného nádorového ochorenia ako aj protinádorovej liečby. Nádorové bunky produkujú tkanivové mediátory ako sú PGE2 (prostaglandín), IL (interluekín) 6, IL8, PTHrP (parathyroid hormone-related protein), TNF (tumor nekrotizujúci faktor) alfa, CSF (kolónie stimulujúci faktor/colony stimulating factor) 1, ktoré stimulujú osteoklastogenézu, a tým zvyšujú kostnú resorpciu v dôsledku čoho vzniká osteoporóza (schéma 1) [1,2].
Schéma 1 | Vplyv nádorových buniek na proliferáciu osteoklastov 
Schéma 2 | Mechanizmus účinku inhibítorov aromatázy 
V protinádorovej liečbe sa používa hormónová manipulácia. Liečba inhibítormi aromatázy (IA), ku ktorým patrí letrozol, anastrozol, exemestan, vedie k poklesu hladiny estrogénov až na nulové hodnoty. Liečba trvá od 5–10 rokov. Uprednostňuje sa v liečbe pomenopauzálnych žien pred tamoxifenom, modulátorom estrogénových receptorov, pre lepší protinádorový efekt ako aj menšie vedľajšie nežiaduce účinky, ako sú gynekologické nádory, tromboembolické príhody [2].
Podobný efekt poklesu kostnej denzity má aj androgén-deprivačná liečba karcinómu prostaty. Hormónová deprivácia vzniká aj po chirurgickej kastrácii pri gynekologických malignitách a testikulárnych nádoroch. Estrogény majú dominantné postavenie v procese kostnej remodelácie, bránia osteoresorpcii a zvyšujú novotvorbu kosti, priaznivo ovplyvňujú aj metabolizmus vápnika, zvyšujú jeho resorpciu z čreva a obličiek [3,4].
Mnohé práce potvrdili aj nízku hladinu D-vitamínu práve v skupine onkologických pacientov, ktorá môže participovať na vzniku sekundárnej osteoporózy onkologických pacientov.
Inhibítory aromatázy zablokujú tvorbu estrogénov, ich hladina klesá na nemerateľné hodnoty, čo vedie k urýchlenej kostnej resorpcii a utlmeniu kostnej novotvorby a k zníženiu kostnej hustoty. Pri 5-ročnej liečbe IA klesla hustota kostného minerálu (Bone Mineral Density – BMD) priemerne o 10%. Po 5-ročnom sledovaní až o 18–20%. Keď sa extendovala dĺžka liečby na 10 rokov, pokles BMD bol ešte o 2–3% ročne vyšší. [2] Riziko poklesu BMD je aj pri systémovej chemoterapii, pokles za 1 rok je o 7,7 % [3,4] Zdá sa, že je aj prepojenie medzi nádorovým tkanivom a kostnými bunkami – osteoklastmi a osteblastmi, ktoré sa navzájom ovplyvňujú prostredníctvom cytokínov a rastových faktorov. A preto ku kostnej strate môže viesť už samotné nádorové ochorenie. Mnohé štúdie na niekoľkých tisícoch pacientok dokazujú pokles kostnej denzity v tejto skupine a aj zvýšené riziko vzniku patologických zlomenín – ATAC (Arimidex, Tamoxifen, Alone or in Combination), BIG 1–98 (Breast International Group 1–98 study), ARNO, MA.17 (graf 1) [6,7,8,9]. Dôležitým faktorom pri poklese kostnej denzity je prítomnosť aj iných rizikových faktorov a stav kostnej denzity pred začatím liečby. Ak nie sú prítomné rizikové faktory a kostný minerál má normálnu hustotu, aj pri liečbe inhibítormi aromatázy nedochádza k výraznému poklesu BMD ako je tomu v prípade už iniciálne nižšej kostnej denzity alebo prítomnosti iných rizikových faktorov[11].
Graf 1. Porovnanie rizika patologických zlomenín pri liečbe inhibítormi aromatázy 
ATAC – Arimidex Tamoxifen Alone or in Combination trial BIG 1–98 – Breast International Group 1–98 Study F/U – follow-up/sledovanie IES – Intergroup Exemestane Study collaborative group MA.17 – Study with letrozole in the extended adjuvant setting7 NS – not significant/štatisticky nevýznamne TEAM – Tamoxifen Exemestane Adjuvant Multinational Pacientom s karcinómom prostaty podstupujúcim androgén-deprivačnú liečbu klesá kostná denzity až o 4,6 % za 1 rok a zvyšuje sa aj riziko vzniku nízkotraumatických zlomenín v oblasti proximálneho femuru a chrbtice [12]. Ide o dôsledok poklesu hladiny testosterónu, ktorý sa konvertuje na estradiol, hormón s kľúčovým postavením pri kostnej remodelácii. Po 9-mesačnej androgénovej deprivácii klesá hladina testosterónu na hodnoty ako po bilaterálnej orchiektómii (graf 2).
Graf 2. Pokles kostnej denzity v závislosti od liečby 
ADT – androgén-deprivačná liečba CHT – chemoterapie a hormonální léčba CTIBL – protinádorovou liečbou indukovaná strata kostnej hmoty/cancer therapy induced bone loss IA – inhibítory aromatázy GnHR – gonadotropíny uvoľňujúci hormón/Gonadotrophin Releasing Hormone preMŽ – premenopauzálne ženy poMŽ – pomenopauzálne ženy ZM – zdraví muži Diagnostika
Základnou diagnostickou metódou osteoporózy je duálna dvojfotónova absorpčná denzitometria. Na základe metodického pokynu Ministerstva zdravotníctva Slovenskej republiky z roku 2014 ju môže indikovať aj onkológ. Vstupné vyšetrenie v skupine pacientov, ktorí majú byť liečených hormónovou manipuláciou, sa odporúča urobiť ešte pred začiatkom terapie. Kontrolné vyšetrenie sa odporúča vzhľadom na riziko poklesu BMD už po 1 roku. Ak kostná denzita neklesne a nie je indikovaná antiporotická liečba, tak sa meranie opakuje v 1-ročnom intervale. Ak je indikovaná antiporotická liečba stačí realizovať kontrolné vyšetrenie po 2 rokoch.
Z laboratórnych vyšetrení okrem metabolizmu kalcia a fosforu, D-vitamínu, je dôležitá diferenciálna diagnostika inej príčiny osteoporózy, rovnako ako pri pomenopauzálnej osteoporóze. Zvýšené markery kostnej remodelácie a onkomarkery, môžu byť prvým signálom generalizácie základného ochorenia.
Zo zobrazovacích metód v rámci diagnostiky patologických zlomenín používame klasický röntgen (RTG), obr. 1, citlivejšia je diagnostika pomocou výpočtovej tomografie (Computed Tomography – CT), obr. 2, alebo pomocou zobrazenia magnetickou rezonanciou (Magnetic Resonance Imaging – MRI), obr. 4 a obr. 5. Zobrazovacie vyšetrovacie metódy ako je RTG, CT, MRI a PET/CT využívame aj pri diferenciálnej diagnostike osteoporotických zlomenín a skeletálnych metastáz (obr. 3, 5–8). Skeletálne metastázy sa vyskytujú najmä pri karcinóme prsníka, prostaty a pľúc (tab).
Obr. 1. Vyšetrenie zobrazovacími metódami: RTG osteoporotickej zlomeniny stavcov. Archív Onkologického ústavu sv. Alžbety, s.r.o., Bratislava 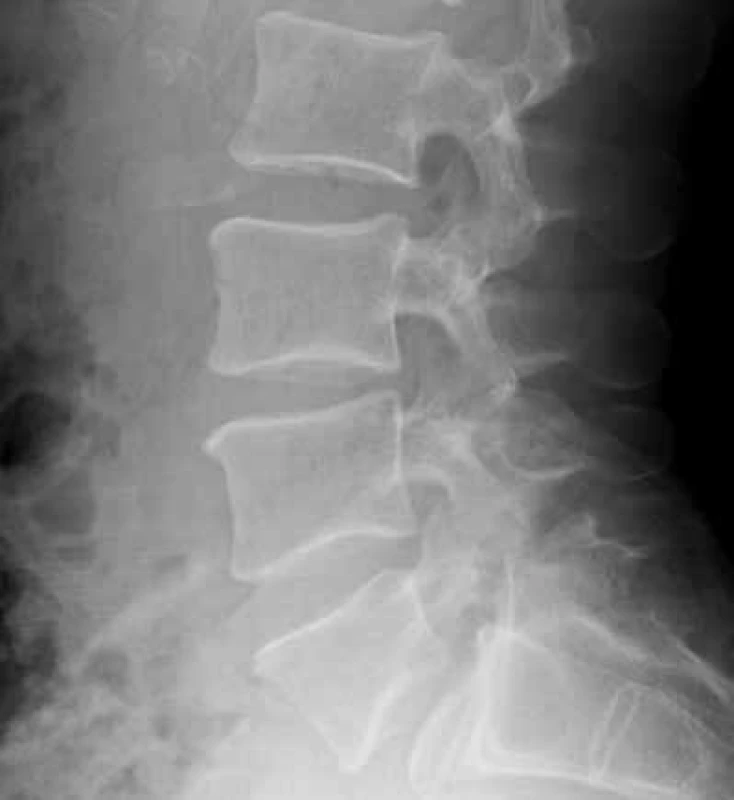
Obr. 2. Vyšetrenie zobrazovacími metódami: CT-zobrazenie osteoporotické kompresívne fraktúry. Archív Onkologického ústavu sv. Alžbety, s.r.o., Bratislava 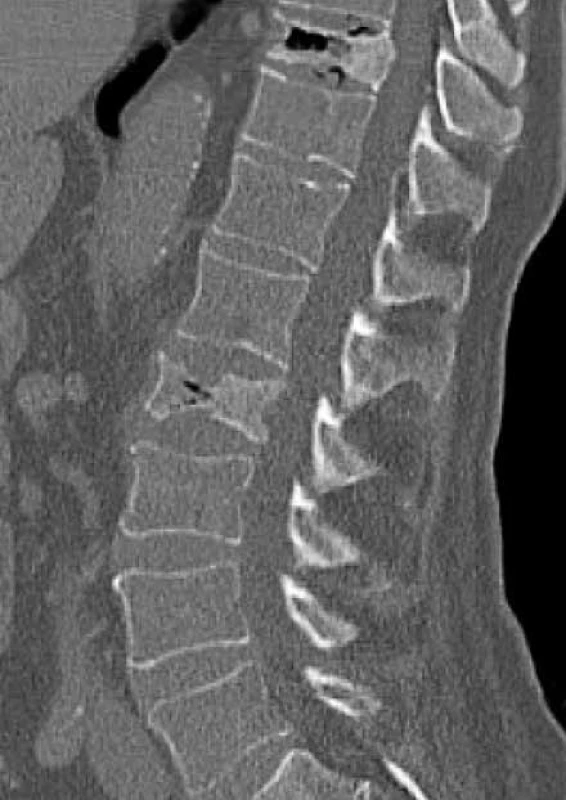
Obr. 3. Vyšetrenie zobrazovacími metódami: CT-zobrazenie metastázy L3,5 stavca. Archív Onkologického ústavu sv. Alžbety, s.r.o., Bratislava 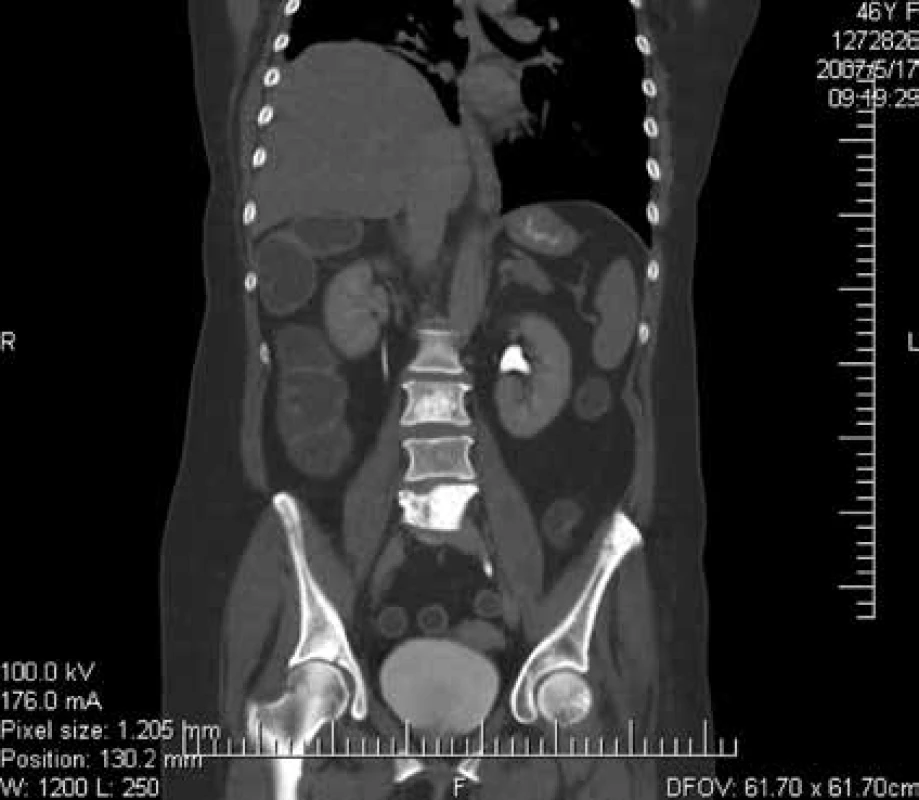
Obr. 4. Vyšetrenie zobrazovacími metódami: MRI osteoporotické kompresívne fraktúry. Archív Onkologického ústavu sv. Alžbety, s.r.o., Bratislava 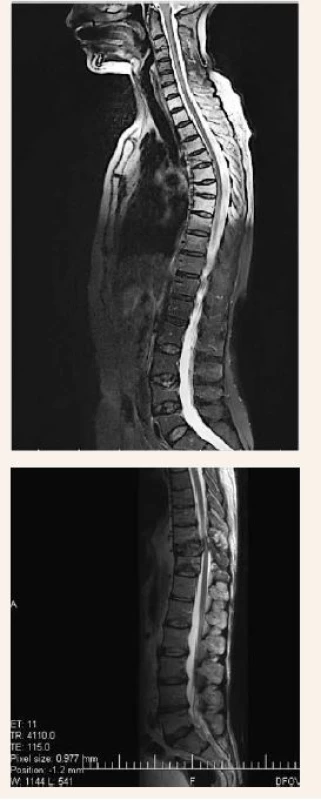
Obr. 5. Vyšetrenie zobrazovacími metódami: RTG-nález osteolytických metastáz v oblasti panvy. Archív Onkologického ústavu sv. Alžbety, s.r.o., Bratislava 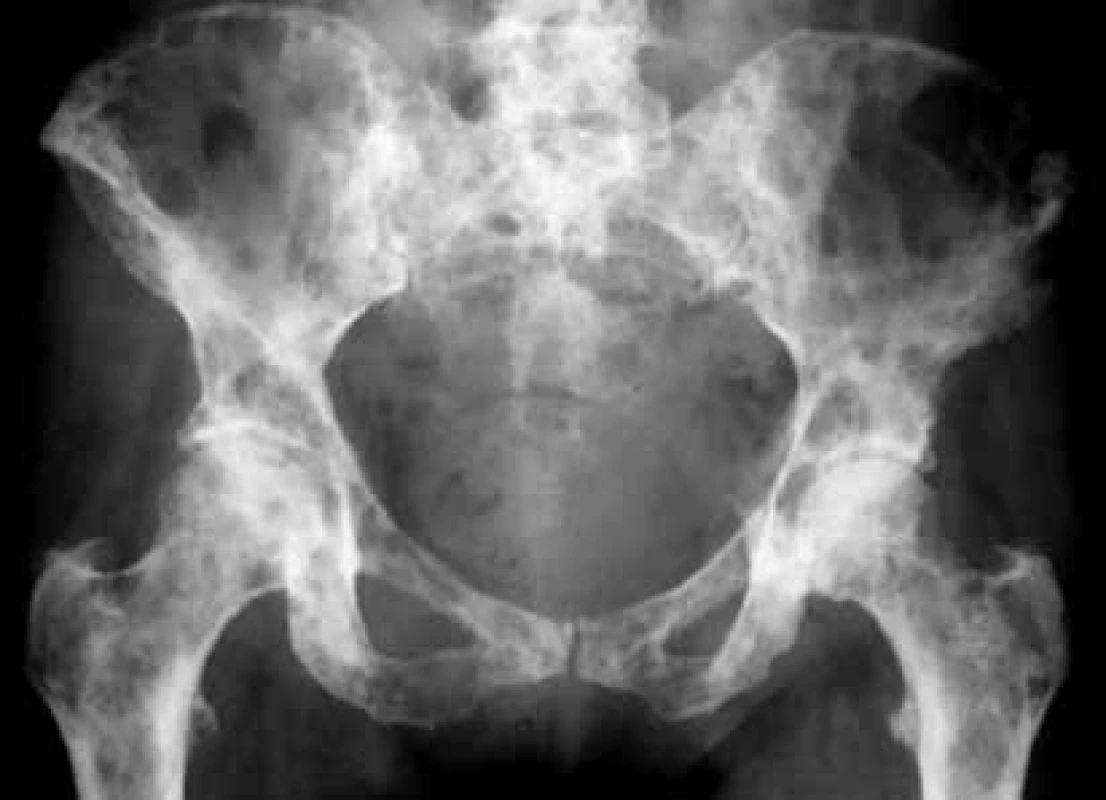
Obr. 6. Vyšetrenie zobrazovacími metódami: MRI-zobrazenie metastáz chrbtice. Archív Onkologického ústavu sv. Alžbety, s.r.o., Bratislava 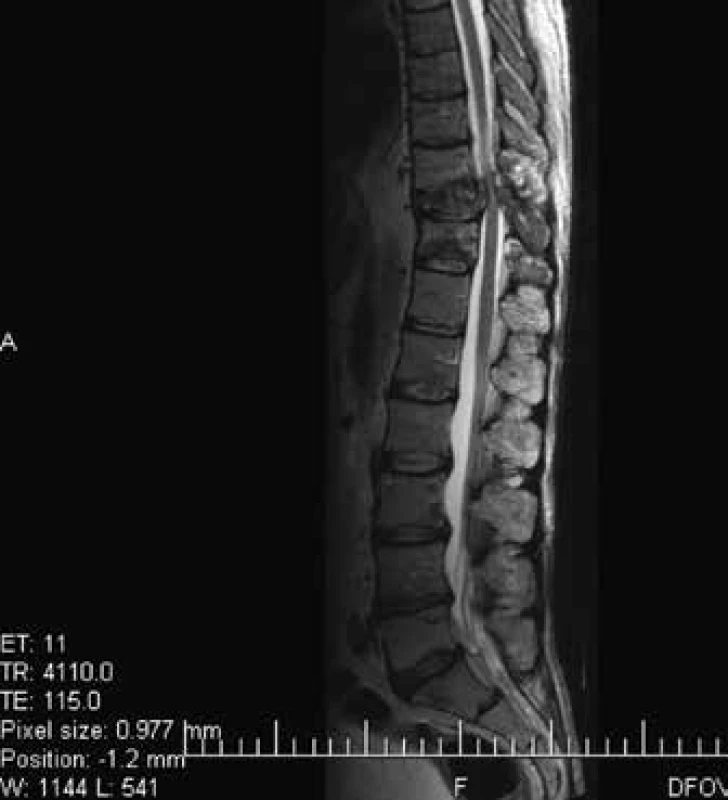
Obr. 7. Vyšetrenie zobrazovacími metódami: scintigrafia – skeletálne metastázy. Archív Onkologického ústavu sv. Alžbety, s.r.o., Bratislava 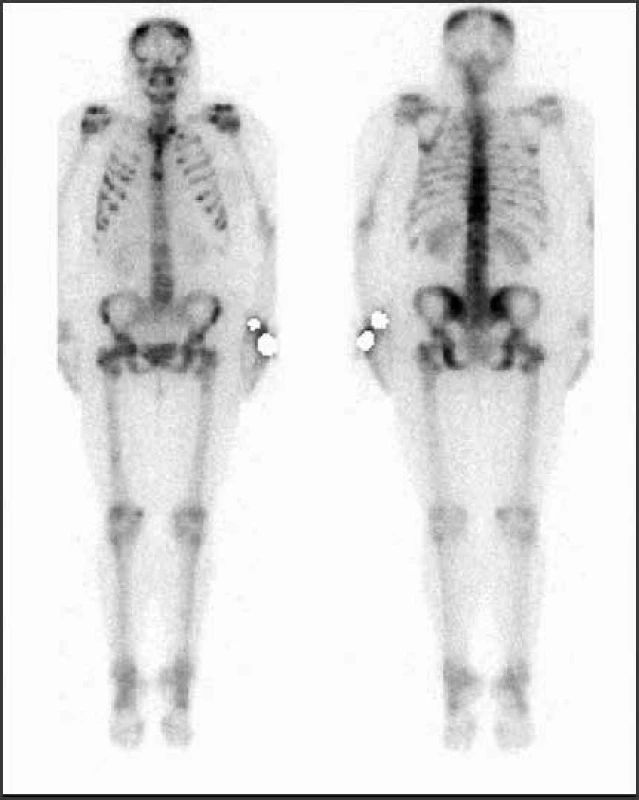
Obr. 8. Vyšetrenie zobrazovacími metódami: PET-CT – skeletálne metastázy. Archív Onkologického ústavu sv. Alžbety, s.r.o., Bratislava 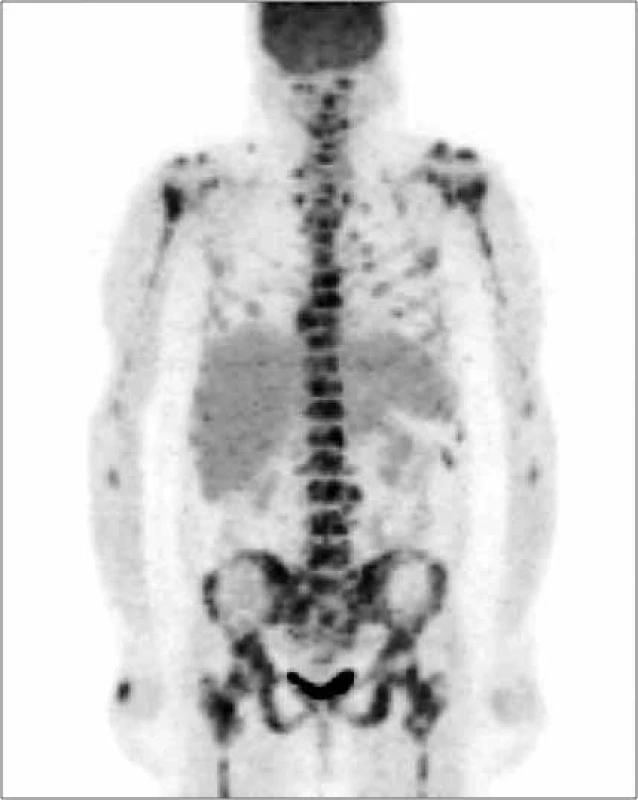
Tab | Osteotropné tumory a kostné metastázy: incidencia a medián prežívania 
Odporúča sa zohľadniť aj iné rizikové faktory osteoporózy, ktoré môžu značne ovplyvniť pokles BMD a riziko vzniku nizkotraumatických zlomenín pri protinádorovej liečbe. Na tento odhad rizika používame kalkulátor FRAX – tento odhad rizika vypracovala WHO v spolupráci s Centrom v Shefilde v Spojenom kráľovstve. Odhad rizika je vypočítaný z dát širokej a veľkej populácie s ohľadom na vek, BMI (Body Mass Index/index telesnej hmotnosti), anamnézu fajčenia, rodinnej anamnézy, prítomnosti sekundárnej etiológie osteoporózy, kortikoterapie (obr. 9).
Obr. 9. Webová stránka kalkulátoru FRAX – dostupné na http://www.shef.ac.uk/FRAX/ 
Liečba sekundárnej osteoporózy pri nádorových ochoreniach
Neoddeliteľnou súčasťou liečby je úprava životného štýlu. Primeraný dostatočný pohyb stimuluje kostnú tvorbu. Imobilní pacienti strácajú za rok 40 % kostnej hmoty. Pohyb zvyšuje svalovú silu. Dôležitá je ale taká fyzická aktivita, pri ktorej nie je zvýšené riziko pádov. Pri osteoporóze sa odporúča vytrvalostný šport, pri ktorom nie je zvýšené riziko úrazov. Kostné tkanivo ovplyvňuje aj telesná hmotnosť. Pri nízkej BMI, je zmenšený objem svalovej hmoty, ktorá stimuluje osteoprodukciu, je nižšia hladina bielkovín a nižšia produkcia estrogénov.
K základnej medikamentóznej liečbe patrí suplementácia vápnika a D-vitamínu. Fyziologický príjem vápnika je aspoň 1 000 mg denne. Pri poklese kostnej denzity na úroveň osteoporózy sa odporúča denný príjem 1 500 mg vápnika. Hladinu vápnika treba monitorovať u onkologických pacientov aj preto, že môže byť zvýšená aj v dôsledku paraneoplastických syndrómov, alebo pri vzniku oseálnych metastáz. Absorpciu vápnika zlepšuje C-vitamín. Pre absorpciu vápnika sú potrebné aj iné prvky ako magnézium, fosfor, zinok, stroncium alebo fluorid.
Ďalšou dôležitou súčasťou liečby je vitamín D. Pacienti s nádorovým ochorením majú častejší výskyt insuficiencie vitamínu D a tiež je vyšší výskyt nádorových ochorení pacientov, ktorí majú insuficienciu D-vitamínu. Podobne v černošskej populácii, vzhľadom na kompetíciu melanínu s UV-žiarením, je častejšia insuficiencia D-vitamínu a je vyšší aj výskyt niektorých onkologických ochorení. Optimálny príjem je denne 1 000 IU. Pri nedostatočnom prijme D-vitamínu je možnosť medikamentóznej substitúcie. D-vitamín pôsobí ako hormón, prostredníctvom receptorov (Vitamín D-receptor – VDR). Receptory sa našli v mnohých tkanivách – v kostiach, svaloch, mozgu, srdci, hrubom čreve, pankrease, monocytoch, prostate a vaječníkoch. D-vitamín sa viaže na VD receptor a tak sa dostáva do cieľovej bunky. Predpokladá sa, že vitamín D by mohol mať priaznivý efekt v prevencii aj liečbe pacientov s vybranými onkologickým ochoreniami. D vitamín má efekt antiproliferatívny, indukuje apoptózu, stimuluje diferenciáciu, redukuje inflamáciu, inhibuje inváziu a metastázovanie a inhibuje angiogenézu [13]. Potvrdili to mnohé štúdie pôsobenia D-vitamínu na karcinóm prsníka, prostaty, pľúc, hrubého čreva, ovárií. Protinádorový efekt D-vitamínu sa preukázal pri substitúcii vo vyšších dávkach ako pri liečbe osteoporózy. Sú ale aj také práce, ktoré nepotvrdili priaznivý efekt. Dáta sú ale zatiaľ len preliminárne a vyžadujú dôkladnejšie analýzy a overenia. Pri predávkovaní D-vitamínu vzniká hyperkalciémia. Ide o zriedkavý prejav ale aj tak pri substitúcii odporúčame vyšetriť hladinu Ca a P a D-vitamínu pred začatím a aj kontrolovať hladinu Ca a P počas liečby a podľa hladiny upravovať dávku substitúcie.
Z cielenej antiporotickej liečby sa používajú najmä antiresorpčné skupiny liekov. Aktivácia apoptózy osteoklastov (bisfosfonáty) alebo blokácia ich tvorby (denosumab) blokuje aj rast nádorových buniek a odďaľuje vznik skeletálnych metastáz. Preto tieto skupiny antiporotickej liečby využívame v liečbe sekundárnej osteoporózy onkologických pacientov najčastejšie a používajú aj v liečbe skeletálnych metastáz, ale v oveľa vyššej dávke (schéma 3).
Schéma 3 | Denosumab aj bisfosfonáty môžu prerušiť „ začarovaný kruh“ kostnej deštrukcie a rastu tumoru. Zverejnené s láskavým dovolením spoločnosti Amgen Slovakia s.r.o. 
Coleman et al potvrdili v štúdii EBCTCG ( Early Breast Cancer Trialists Collaborative Group) pokles výskytu recidív karcinómu prsníka až o 34 % a zníženie mortality o 17 % v skupine pacientok s adjuvantnou liečbou inhibítormi aromatázy a bisfosfonátmi (kyselinou zoledrónovou). Pri liečbe došlo k signifikantnému nárastu BMD, ale nedošlo k poklesu výskytu nízkotraumatických zlomenín [14,2]. Z bisfosfonátov je to najmä zoledronát, ktorý v štúdiách potvrdil protinádorový efekt v dávke 4 mg 1-krát za pol roka v intravenóznej infúzii. Perorálne bisfosfonáty, ako je risedronát, ibandronát a alendronát, tiež preukázali priaznivý efekt aj u onkologických pacientov. Bisfosfonáty majú schopnosť fixovať sa na kostný minerál a ich efekt pretrváva aj po ukončení liečby. Optimálna dĺžka podávania je 5 rokov. Z vedľajších nežiaducich účinkov je najčastejším tzv. flu like syndróm a hypokalciémia, perorálne formy majú horšiu komplianciu a perzistenciu. Ale všeobecne je tolerancia dobrá (schéma 4).
Schéma 4 | Protinádorový mechanizmus účinku bisfosfonátov 
Ďalšou možnosťou antiresorpčnej liečby je použitie monoklonových protilátok proti ligandu aktivátora nukleárneho faktoru kapa B“ (Receptor Activator of Nuclear factor κ-Β Ligand – RANKL). Tým, že nedochádza k spojeniu RANK (Receptor Activator of Nuclear factor κ B) a RANKL, sa blokuje osteoklastogenéza. Podáva sa subkutánne 1-krát za 6 mesiacov. V štúdii ABCSG 18 (Adjuvant denosumab in Breast Cancer) sa potvrdil efekt redukcie vzniku zlomenín [15]. Najväčší pokles BMD je v skupine pacientov, ktorí majú aj iné rizikové faktory a majú nízku kostnú denzitu ešte pred začatím hormónovej manipulácie [16]. Denosumab nemá takú afinitu ku kostnému minerálu a jeho efekt je len v čase podávania, preto pri liečbe osteoporózy je potrebné dlhodobé podávanie. Pri prerušení liečby dochádza k „rebound“ fenoménu a poklesu BMD s rizikom vzniku nízkotraumatických zlomenín [17]. Ak je potreba liečbu ukončiť, odporúča sa pred jej prerušením podávať aspoň 1 rok intravenózne bisfosfonáty. Tolerancia je zväčša dobrá, majú menej vystupňovaný „after dose“ syndróm ako bisfosfonáty, môžu spôsobovať hypokalciémiu a mierne zvyšujú riziko vzniku osteonekrózy čeľuste, najmä po extrakcii zubov V skupine pacientov pri podávaní denosumabu 60 mg 1-krát za 6 mesiacov sa nezaznamenal ani vyšší výskyt osteonekrózy čeľuste, na rozdiel od štúdie, v ktorej sa podávala denosumab 120 mg 1-krát mesačne pri liečbe skeletálnych metastáz, u ktorých bol výskyt osteonekrózy čeľuste 1%. Podobne to bolo aj pri liečbe 4 mg zoledronátu každé 4 týždne. Ale aj tak sa odporúčajú dodržiavať preventívne opatrenia u všetkých, ktorí túto liečbu dostávajú (schéma 5).
Schéma 5 | Antiporotická liečba v onkológii 
BP – bisfosfonáty Záver
Sekundárna osteoporóza onkologických pacientov najmä pri využívaní liečby hormónovou manipuláciou alebo systémovou chemoterapiou nie je zriedkavým vedľajším prejavom. Osteoporóza vedie ku zvýšenému riziku vzniku nízkotraumatických zlomenín a tie nielen znižujú kvalitu života ale môžu aj skrátiť prežívanie pacientov s dobrou prognózou samotného nádorového ochorenia. Preto je treba na tento prejav neskorej toxicity protinádorovej liečby myslieť, vyšetrovať kostnú denzitu a podľa odporúčaní iniciovať antiresorpčnú liečbu v kombinácii s kalciom a D-vitamínom. Vzhľadom na časté metastázovanie tejto skupiny nádorov do skeletu je nutná aj diferenciálna diagnostika osteoporózy a kostných metastáz a spolupráca osteológa s onkológom.
MUDr. Beata Špániková, PhD.
Doručené do redakcie: 6. 8. 2018
Prijaté po recenzii: 28. 8. 2018
Zdroje
-
Coleman RE, Abrahamsson PA, Hadji P (eds). Handbook of cancer-related Bone Diseases. BioScientifica: Bristol 2010 : 91–131. ISBN 13 : 978–1–901978–28–5. ISBN 10 : 1–901978–28–1
-
Hadji P, Aapro MS, Body JJ et al. Management of Aromatase Inhibitor-Associated Bone Loss (AIBL) in postmenopausal women with hormone sensitive breast cancer: Joint position statement of the IOF, CABS, ECTS, IEG, ESCEO IMS, and SIOG. J Bone Oncol 2017; 7 : 1–12. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jbo.2017.03.001>.
-
Bartl R, Frisxh B et al. Osteoporosis. Diagnosis, prevention, therapy. 2nd ed. Springer-Verlag: 2009. ISBN 978–3540795261.
-
Marcus R, Bouxsein ML. The Nature od Osteoporosis. In: Marcus R, Feldman D, Nelson D et al. Osteoporosis. 3rd ed. Academic Press: Oxford 2007. ISBN 9780123705440.
-
Shapiro CL, Manola J, Leboff M. Ovarian failure after adjuvant chemoterapy is aasociated with rapid bone loss in women with early-stage breast cancer. J Clin Onkol 2001; 19(14): 3306–3316. Dostupné z DOI: <http://dx.doi.org/10.1200/JCO.2001.19.14.3306>.
-
DeVita VT, Lawrence TS, Rosenberg SA (Eds). Cancer: Principles & Practice of Oncology: Primer of the Molecular Biology of Cancer. 2nd Ed. Philadelphia, PA, Wolters Kluwer Health/Lippincott, Williams, and Wilkins 2015. ISBN-13 : 978–1496310637. ISBN-10 : 1496310632
-
Howell A, Cuzick J, Baum M et al. Results of the ATAC (Arimidex, Tamoxifen, Aone or in Combination) trial after completed 5 years adjuvant treatment for breast cancer. Lancet 2005; 365(9453): 60–62. Dostupné z DOI: <http://dx.doi.org/10.1016/S0140–6736(04)17666–6>.
-
Coleman RE. Effect of Anastrozol on bone mineral density: 5-years results from the „ Arimidex“, Tamoxifen, alone or in combination (ATAC) trial. J Clin Oncol 2006; 24(18 Suppl): 511. Dostupné z DOI: <http://dx.doi.org/10.1200/jco.2006.24.18_suppl.511>.
-
Špánik S, Špániková B. Bone mineral density in early breast cancer patients. Bratisl Lek Listy 2010; 111(1): 27–32.
-
Špániková B, Špánik S. Studies of Osteoporosis in Cancer Patients in Slovakia – Experience from single Institute. In: Dionyssiotis Y. Osteoporosis. Intech: Rijeka (Croatia) 2012. ISBN 978–953–51–0026–3. Dostupné z DOI: <http://dx.doi.org/10.5772/29828>.
-
Markopoulos C, Tzoracoleftherakis E, Koukouras D et al. Age effect on bone mineral density changes in breast cancer patients receiving anastrozole: results from the ARBI prospective clinical trial. J CancerRes Clin Oncol 2012; 138(9): 1569–1577. Dostupné z DOI: <http://dx.doi.org/10.1007/s00432–012–1233-z>.
-
Shahinian VB, Kuo YF, Freeman JL et al. Risk of fracture after androgen deprivation for prostate cancer. N Engl J Med 2005; 352(2): 154–164. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMoa041943>.
-
Ness RA, Miller DD, Li W. The role of vitamin D in cancer prevention. Chin J Nat Med 2015; 13(7): 481–497. Dostupné z DOI: <http://dx.doi.org/10.1016/S1875–5364(15)30043–1>.
-
[Early Breast Cancer Trialists’ Collaborative Group (EBCTCG)]. Adjuvant bisfosfonate treatment in early breast cancer: metaanalyses of individual patient data from randomised trials. Lancet 2015; 386(10001): 1353–1361. Dostupné z DOI: <http://dx.doi.org/10.1016/S0140–6736(15)60908–4>. Erratum in Lancet 2016; 387(10013): 30.
-
Gnant M. Denosumab and fracture risk in women with breast cancer. Lancet 2015; 386(10008): 2057–2058. Dostupné z DOI: <http://dx.doi.org/10.1016/S0140–6736(15)00975–7>.
-
Planas Morin J, Celma Domenech A, Placer Santos J et al. Bone mass behavior after 1 year of different treatment strategies in prostate cancer patients subjected to androgen deprivation therapy. Rheumatol Int 2014; 34(10): 1419–1425. Dostupné z DOI: <http://dx.doi.org/10.1007/s00296–014–2977–3>.
-
Popp AW, Zysset K, Lippuner K. Rebound associated vertebral fractures after disscontinuation of denosumab from clinic and biomechanics. Osteoporos Int 2016; 27(5): 1917–1921. Dostupné z DOI: <http://dx.doi.org/10.1007/s00198–015–3458–6>.
-
Kanis JA. Pathogenesis of osteoporosis and fracture. In: Kanis JA (ed). Osteoporosis. Blackwell Healthcare Communications; London 1997 : 22–55.
-
Eastell R, Hannon RA, Cuzick J et al. Effect of an aromatase inhibitor on BMD and bone turnover markers: 2-year results of the Anastrozole, Tamoxifen, Alone or in Combination (ATAC) trial (18233230). J Bone Miner Res 2006; 21(8): 1215–1223.20. Maillefert JF, Sibilia J, Michel F et al. Bone mineral density in men treated with synthetic gonadotropin-releasing hormone agonists for prostatic carcinoma. J Urol 1999; 161(4): 1219–1222.21. Gnant M, Mlineritsch B, Luschin-Ebengreuth G et al. Adjuvant endocrine therapy plus zoledronic acid in premenopausal women with early-stage breast cancer: 5-year follow-up of the ABCSG-12 bone-mineral density substudy. Lancet Oncol 2008; 9(9): 840–849.
Štítky
Biochemie Dětská gynekologie Dětská radiologie Dětská revmatologie Endokrinologie Gynekologie a porodnictví Interní lékařství Ortopedie Praktické lékařství pro dospělé Radiodiagnostika Rehabilitační a fyzikální medicína Revmatologie Traumatologie Osteologie
Článek Chvála vzdělanosti
Článek vyšel v časopiseClinical Osteology
Nejčtenější tento týden
2018 Číslo 1- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
-
Všechny články tohoto čísla
- Postmenopauzálna osteoporóza: štandardný diagnostický a terapeutický postup
- Sekundárna osteoporóza pri nádorových ochoreniach: štandardný diagnostický a terapeutický postup u pacientov s protinádorovou liečbou navodenou kostnou stratou – osteoporózou
- Dlouhodobá léčba osteoporózy denosumabem a její přerušení: odborné stanovisko pracovní skupiny Společnosti pro metabolická onemocnění skeletu České lékařské společnosti J. E. Purkyně
- Hypofosfatemická křivice vázaná na chromosom X (XLH) – léčba přípravkem KRN 23 (burosumab): odborné stanovisko Společnosti pro metabolická onemocnění skeletu České lékařské společnosti J. E. Purkyně
- Chvála vzdělanosti
- Od Osteologického bulletinu ku Clinical Osteology
- Vliv střevního mikrobiomu na metabolizmus kostní tkáně
- Sekundárna osteoporóza pri nádorových ochoreniach
- Clinical Osteology
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Postmenopauzálna osteoporóza: štandardný diagnostický a terapeutický postup
- Dlouhodobá léčba osteoporózy denosumabem a její přerušení: odborné stanovisko pracovní skupiny Společnosti pro metabolická onemocnění skeletu České lékařské společnosti J. E. Purkyně
- Hypofosfatemická křivice vázaná na chromosom X (XLH) – léčba přípravkem KRN 23 (burosumab): odborné stanovisko Společnosti pro metabolická onemocnění skeletu České lékařské společnosti J. E. Purkyně
- Sekundárna osteoporóza pri nádorových ochoreniach: štandardný diagnostický a terapeutický postup u pacientov s protinádorovou liečbou navodenou kostnou stratou – osteoporózou
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



