-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Apremilast v léčbě ulcerací při suspektní non-uremické kalcifylaxi. Popis případu
Apremilast in the Treatment of Ulcerations in Possible Non-uremic Calciphylaxis. Case report
The authors report a case of a 55-year-old woman, who has been developing deep ulcers on the trunk and limbs for 5 years. They were based on non-uremic calciphylaxis and extended to the total area of 988 cm2. Treatment with corticosteroids and azathioprine was not successful, the administration of apremilast led to healing of 97% of the ulcers. Apremilast could represent a new alternative in the treatment of this disease.
Keywords:
pyoderma gangrenosum – non-uremic calciphylaxis – immunosuppression – apremilast
Autoři: H. Kristlová 1,3; J. Bočková 1; J. Horažďovský 1; Martina Kadlecová 1; H. Kořínková 1; A. Rosolová 1; M. Pešková 2; M. Rendlová 3
Působiště autorů: Kožní oddělení, Nemocnice České Budějovice, primář MUDr. Jiří Horažďovský, Ph. D. 1; Interní oddělení, Nemocnice České Budějovice, primář MUDr. Marie Pešková 2; Dermatovenerologie Rendlová s. r. o., České Budějovice 3
Vyšlo v časopise: Čes-slov Derm, 96, 2021, No. 3, p. 142-148
Kategorie: Kazuistika
Souhrn
Autoři popisují případ 55leté ženy s 5 let trvající tvorbou hlubokých ulcerací na trupu i končetinách vzniklých na podkladě non-uremické kalcifylaxe dosahujících celkové plochy až 988 cm2. Léčba kortikosteroidy a azathioprinem byla bez efektu. Nasazení apremilastu vedlo ke zhojení 97 % plochy vředů. Apremilast může představovat alternativu léčby tohoto onemocnění.
Klíčová slova:
pyoderma ganrenosum – non-uremická kalcifylaxe – imunosuprese – apremilast
ÚVOD
Kalcifylaxe je relativně vzácné onemocnění způsobené vaskulární kalcifikací cév v dermis a podkožním tuku vedoucí k následné okluzi postižených cév s ischemií přilehlých tkání [21]. Závažná bolestivost vzniklých defektů spolu s náchylností k ranným infekcím vyústí v těžké oslabení celkového stavu pacienta s úmrtností 40–80 % [2, 17, 10]. Uvádíme případ pacientky léčené apremilastem s dobrým efektem.
POPIS PŘÍPADU
Pacientkou je 55letá žena s 5 let trvajícími ulceracemi hypogastria, hýždí a stehen, které vznikly poprvé v srpnu 2017. Podle anamnestického popisu pacientky se na počátku jednalo o červenou okrouhlou tuhou papulu v oblasti jizvy levého podbřišku po prodělané resekci střeva (2010 – reoperace pupeční kýly), s následně vzniklou bolestivou indurací a tvorbou vředu s rychlou progresí v hloubce i šířce. Pacientka byla v počátku onemocnění sledována ve spádové chirurgické ambulanci. Postupně během několika měsíců (srpen 2017 až listopad 2017) došlo k tvorbě drobnějších defektů stejného charakteru, krytých tuhým příškvarem na levé hýždi a obou stehnech. Pacientka byla léčena lokálně obklady s peroxidem a sterilním betadinovým krytím. Rány byly opakovaně chirurgicky ošetřovány včetně nekrektomie. Z anamnézy se u rodičů pacientky vyskytovala Alzheimerova choroba, bratr zemřel v 39 letech na maligní onemocnění nejasného původu. Pacientka se chronicky léčila s diabetes mellitus 2. typu a s hypertenzí. V roce 2009 prodělala cévní uzávěr arteria femoralis levé dolní končetiny, 2010 resekci střeva pro nekrózu a 2015 plicní embolií. V době vzniku onemocnění užívala tyto léky: esomeprazol, diosmin/hesperidin, bisoprolol, atorvastatin, perindopril, gliclazid, empagliflozin, metformin, warfarin. Jednalo se tedy o polymorbidní pacientku s polypragmazií, stav byl navíc komplikován těžkou obezitou (v době první hospitalizace na kožním oddělení výška 168 cm, váha 115 kg, BMI 40,75). V listopadu 2017 byla poprvé vyšetřena dermatologem, který vyslovil podezření na pyoderma gangrenosum. V období mezi listopadem 2017 a březnem 2018 docházelo stále ke tvorbě dalších projevů podobného vzhledu (stehna, hýždě, pravý podbřišek obr. 1, obr. 2). Kultivačně byla opakovaně zachycena kolonizující flóra. Pacientka byla léčena lokálními i systémovými antibiotiky podle citlivosti: ampicilin, oxacilin, klindamycin, ciprofloxacin. Vzhledem ke stálé progresi byly v březnu 2018 provedeny 2 probatorní excize (z okraje vředu v oblasti hypogastria a z proximální části levé dolní končetiny). V diferenciální diagnóze byla kromě pyoderma gangrenosum zvažována i malignita dále pak atypická infekce, kalcifylaxe a warfarinové nekrózy. Histologický nález však pro klinicky zvažovanou diagnózu pyoderma gangrenosum nesvědčil, nebyly zachycené ani dysplastické, či maligní struktury. Vzhledem k rozsahu onemocnění a neúspěšnosti dosavadní terapie byl pacientce nasazen azathioprin v dávce 50 mg/den, současně nadále pokračováno v podpůrné léčbě (analgetika, intenzivní lokální léčba vlhkým krytím). Nižší dávka imunosupresiva byla volena s ohledem na možné lékové interakce, komorbidity pacientky, celkový stav a ambulantně vedenou terapii s rizikem horší compliance.
Obr. 1. Pravé koleno bolestivý nodulus s ulcerací a nekrózou 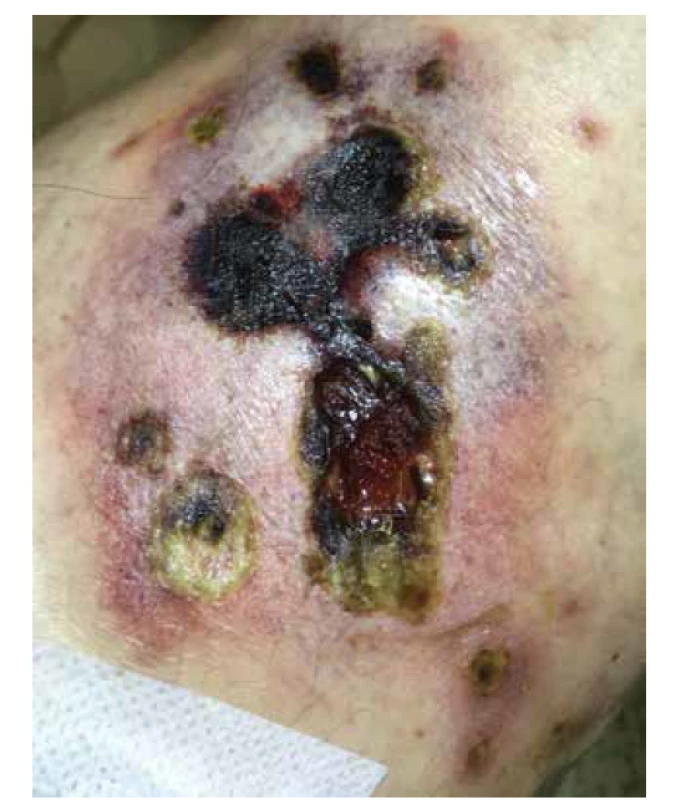
Obr. 2. Pravý podbřišek – hluboký vřed velikosti 13 x 7 cm s podminovanými okraji a spodinou krytou fibrinem 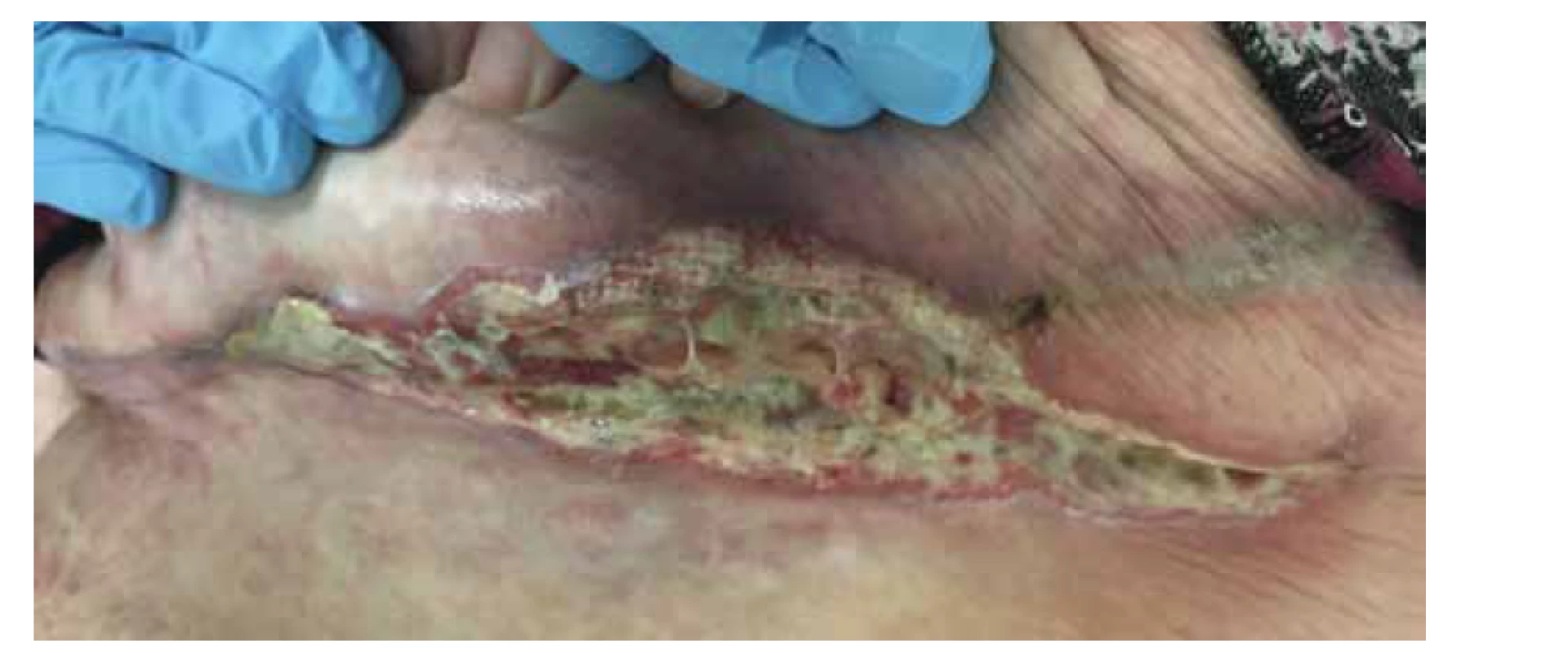
Vzhledem k progredujícímu stavu pacientky byla provedena další vyšetření: stěr z ulcerace na bakteriologii i mykologii byl negativní, gynekologické vyšetření vyloučilo malignitu, gastroskopie a kolonoskopie byly bez patologického nálezu. Laboratorně byly pozitivní ANA protilátky 1 : 160, ASCA pozitivní ++, ve stolici zvýšený kalprotektin 301 ug/l (podle názoru interního lékaře se však vzhledem k množství užívaných léků jednalo o horní hranici normy kalprotektinu i ASCA). Ostatní imunologická vyšetření byla negativní – ENA, ANCA, kryoglobuliny, ASLO, RRR, TPHA.
V květnu 2018 byla pacientka znovu přijata na kožní lůžka pro subfebrilie, a vysoké zánětlivé parametry. Přechodně byl vysazen azathioprin, zahájena léčba cefazolinem podle citlivosti bakteriologické flóry z defektů, antibiotická terapie podávána po dobu 7 dní, po stabilizaci infekce intravenózně zahájena medikace methylprednisolonem v dávce 1 mg/kg/den, rozděleno na 40 mg třikrát denně (podle zvyklosti oddělení). Po poklesu zánětlivých parametrů byla dávka celkových kortikoidů ústupově snižována do 32 mg methylprednisolonu perorálně na den a do medikace opět navrácen azathioprin 50 mg na den. Vzhledem k neúčinnosti a zhoršení komorbidit (zejména diabetes mellitus, psychického stavu) byla imunosupresivní léčba následně zcela vysazena.
Vzhledem k rentgenovému nálezu (červen 2018) měkkých tkání v oblasti defektu levého stehna, kde byly jasně prokázány hrudkovité kalcifikace a mediokalcinóza arteria femoralis superficialis (AFS), byla opět zvažována diagnóza kalcifylaxe. Echokardiografické vyšetření prokázalo lehkou kalcifikovanou aortální stenózu a nevýznamnou mitrální vadu, ultrazvuk žil dolních končetin a proximálního tepenného systému vyloučil hemodynamicky významné stenózy periferního cévního řečiště.
V srpnu 2018 byla pacientka přijata k hospitalizaci na kožní lůžka pro febrilie a vysoké zánětlivé parametry. Ve stěrech z defektů byl opakovaně vykultivován multirezistentní Staphylococcus aureus (MRSA). Podle poslední citlivosti byla léčena dvojkombinací antibiotik (vankomycin a ciprofloxacin). Následně byl podán intravenózní pulz kortikoidů (methylprednisolon 1 g/den, celkem 3krát), pro dobrý efekt pacientka pokračovala v perorálním užívání methylprednisolonu v denní dávce 16 mg, tedy v dávce 0,15 mg/kg/den. Warfarin byl pro krvácení z rány vysazen a nahrazen kyselinou acetylsalicylovou. Biopsie z okraje defektu tentokrát nevyloučila diagnózu pyoderma gangrenosum.
V lednu 2019 byla pacientka opět přijata pro febrilie a zvýšení zánětlivých parametrů na kožní oddělení. V té době již činila plocha všech defektů asi 988 cm2 (obr. 3). Převaz ran na celém těle již nebyla schopna pro bolestivost zvládnout. Bezprostředně po přijetí byla pro poruchu vědomí s podezřením na předávkování opiáty přeložena na interní JIP. V říjnu 2019 bylo nutné z důvodu mumifikace amputovat II. a III. prst LDK. Rentgen levé nohy po amputaci zobrazil částečně metatarzové hlavičky II a III, s dekalcinovanými okraji pahýlů a zneostřenou strukturou. Konstatována opět mediokalcinóza tepen. Doplněná vyšetření (oční, kožní, cévní, rentgenologické, psychiatrické) byla bez pozoruhodností.
Obr. 3. Krvácení při převazu levé hýždě 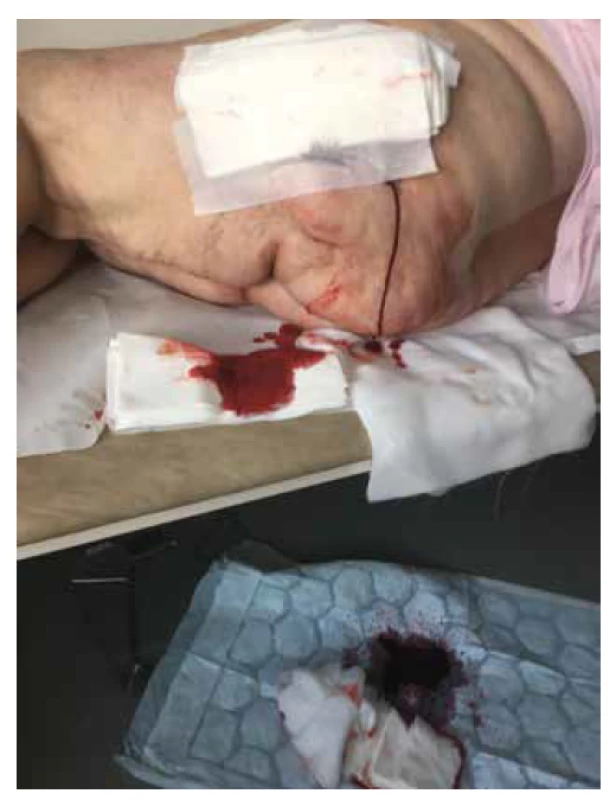
V prosinci 2019 byla pacientka hospitalizována v Revmatologickém ústavu v Praze. Pacientka aktuálně nesplňovala kritéria žádného revmatologického systémového zánětlivého onemocnění, PET CT neprokázalo přítomnost neoplastického procesu ani zánětlivého ložiska. CT angiografické vyšetření prokázalo difuzní aterosklerotické postižení tepen dolních končetin. Diagnóza pyoderma gangraenosum nebyla prokázána.
Vzhledem k neustálé postupné progresi stavu komplikované opakovanými infekcemi byl v květnu (2019) nasazen apremilast ve standardním dávkování (schválen jako off-label indikace při pracovní diagnóze pyoderma gangrenosum, žádost schválena revizním lékařem, paragraf 16). Apremilast byl zvolen z důvodu jednoduchého užívání (perorální tablety) a mírných nežádoucích účinků. Po úvodních nízkých dávkách (10 mg 2krát denně), poté vzestupně podle dávkovacího schématu bylo pokračováno v dávce apremilastu (30 mg 2krát denně) a v intenzivní lokální terapii. Postupně došlo k epitelizaci kožních defektů z okrajů. Ranná plocha se snížila za 8 měsíců z původních 900 cm2 na plochu 30 cm2. Postupně byly vysazeny systémové kortikoidy a opiáty. V terapii apremilastem pacientka pokračuje doposud v zavedeném schématu. Dále užívá amiodaron, bisoprolol, kyselinu acetylsalicylovou a suledoxid, perorální i intramuskulární analgetika, inzulin v intenzifikovaném inzulinovém režimu. Při poslední kontrole (5 let od vzniku onemocnění) ranná plocha činila 2 cm2, pacientka sama chodí pomocí francouzských holí a je v invalidním důchodu (obr. 4).
Obr. 4. Jizvy hvězdicovitého tvaru po zhojených projevech 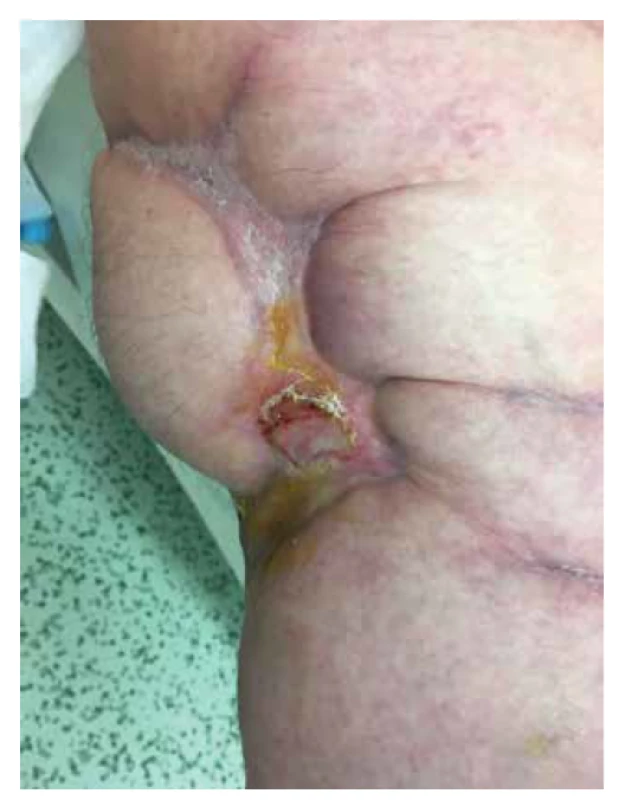
DISKUSE
Slovo „calciphylaxis“ je odvozené od calci (kalcifikace) a phylaxis (ochrana). Roku 1898 Bryant and White poprvé popsali souvislost kalcifylaxe s urémií [1, 17]. Kalcifylaxe, někdy označovaná jako uremická kalcifikující arteriolopatie, je vzácný život ohrožující stav spojený s kalcifikací cévních stěn mikrocikulace vedou k jejich okluzi a ischemii s tvorbou bolestivých ulcerací. Nejčastěji nastává u pacientů s chronickým renálním selháním léčených hemodialýzou. Kalcifylaxe u pacientů se zachovanými renálními funkcemi se označuje jako non-uremická kalcifylaxe [5]. Dokumentovány jsou též případy s normálními hodnotami kalcia a fosfátů v séru [9]. Prevalence, incidence a epidemiologie non-uremické kalcifylaxe je v České republice dosud neznámá, odhadem méně než 1 % [9].
Rizikové faktory kalcifylaxe se dají shrnout do 4 klíčových znaků [1, 7, 10]:
a) renální selhání ESRD, dialyzovaný pacient, transplantace ledvin;
b) porucha homeostázy kalcia a fosfátu (včetně hyperfosfatemie, hyperkalcemie a hyper - a hypoparathyreoidismu);
c) deficience vitaminu K (vitamin K je potentní inhibitor kalcifikace);
d) obezita, diabetes mellitus a ženské pohlaví.
Mezi méně časté rizikové faktory patří: příslušnost ke kavkazské rase, přípravky s obsahem kalcia, hyperkalcemizující medikace (suplementace vitaminem D, parikalcitol), deficience proteinů C a S, užívání systémových kortikosteroidů, erytropoetinu a léků typu iron-dextran (lék obsahující hydroxidy železa a dextran) [9].
Kalcifylaxe je komplexní onemocnění podmíněné kalcifikací cévní stěny se subintimální fibroplazií s následnou obliterující trombózou vznikající na podkladě progredující kalcifikace a endoteliální dysfunkce, která vede k ischemii a nekróze příslušné tkáně.
Nejčastějším spouštěčem mediální kalcifikace je nedostatek inhibitorů kalcifikace v cévních stěnách [2]. Tento nedostatek je běžně přisuzován nedostatku vitaminu K [2, 17]. Vitamin K aktivuje silný inhibitor kalcifikace nazývaný matrix Gla protein (MGP), vylučovaný endoteliálními buňkami a buňkami hladké svaloviny cév [2, 7].
Náchylnost k trombóze je vysvětlována vysokou prevalencí vrozených a získaných hyperkoagulačních stavů u pacientů s kalcifylaxí [2]. Mezi nejčastější příčiny hyperkoagulačních stavů patří deficit antitrombinu, lupus antikoagulans a deficit proteinu C a S [2]. Antitrombotická odpověď organismu, exprese receptoru pro protein C a protein S, exprese trombomodulinu, a cévních heparin-like molekul, může být potlačena prozánětlivými cytokiny např. IL 1, 6, TNF alfa [15].
Hlavním příznakem všech projevů je závažná bolest špatně reagující na analgetickou terapii. Původ bolesti je nejspíše kombinací ischemie a neuropatie [5]. Bolest může předcházet před prvními makroskopickými změnami na kůži [5].
Podle retrospektivní studie z roku 2006 mají tito pacienti převážně 5 odlišných typů kožních lézí zahrnujících: nekrotické vředy, livedo racemosa, bolestivé prokrvácené makuly či buly a tuhé červené tumory [21].
Livedo racemosa – červenofialový erytém vzhledu nepravidelně potrhané sítě, bývá přítomný v počátcích procesu kalcifylaxe [2, 5]. Tumory jsou nejčastějšími kožními nálezy u kalcifylaxe (až 80 % pacientů) [1, 5]. Tumory jsou horké, napjaté na pohmat a výrazně bolestivé. Zhruba 1/3 těchto projevů následně ulceruje [5]. Vředy u kalcifylaxe jsou hluboké, často oboustranné, postupně splývají a nabývají hvězdicovitého vzhledu [5, 9]. Zasahují tkáně bohaté na podkožní tuk (oblast břicha, boků, hýždí a proximálních partií stehen). Typický obraz chronické rány u non-uremické kalcifylaxe je nekrotický kožní vřed na stehnech či v podbřišku s erytémem a indurací kůže v okolí, s černým příškvarem na spodině defektu [1, 10]. Častá superinfekce ran může vyústit v sepsi, která je poté příčinou smrti u pacientů s kalcifylaxí [9, 15]. Projevy kalcifylaxe se objevují v místech opakovaného kožního traumatu, například při opakované subkutánní aplikaci léků [1, 5]. Zatímco kožní postižení je nejvýraznějším klinickým projevem, mohou být postiženy i další orgány jako plíce, kosterní svaly, slinivka, mozek, oči a zažívací trakt [7].
Histologicky je typický nález kalcifikace ve stěnách cév, subintimální fibroplazie a trombotické změny v lumen krevních cév dermis a podkožního tuku [2]. Kalcifikace také mohou být nalezeny v dermálním kolagenu v okolí cév, okolo ekrinních potních žláz a v okolí adipocytů a septech v podkožní tukové tkáni [2]. Kalciová depozita prokazuje barvení podle Alizarona a podle von Kossa [2, 9, 15]. Nález mikrovaskulárních kalcifikací však nestačí pro diagnózu kalcifylaxe [17]. Vždy je nutná korelace histologického nálezu s klinickým stavem pacienta a dalšími výsledky vyšetřovacích metod. Některé práce popisují i nález dermální angioplazie, svědčící pro určitý nízký stupeň ischemie v postižených tkáních (17). Depozita kalcia mohou být však přítomna v histologickém obraze dalších onemocnění jako např. aterosklerotické postižení periferních tepen, calcinosis cutis a skleróza arterií s degenerací medie a kalcifikací (Mönckebergova skleróza) [6]. Histologické vyšetření nenachází žádné známky vaskulititidy [1].
Tab. 1. Rizikové faktory pacienta s kalcifylaxí neuremického typu 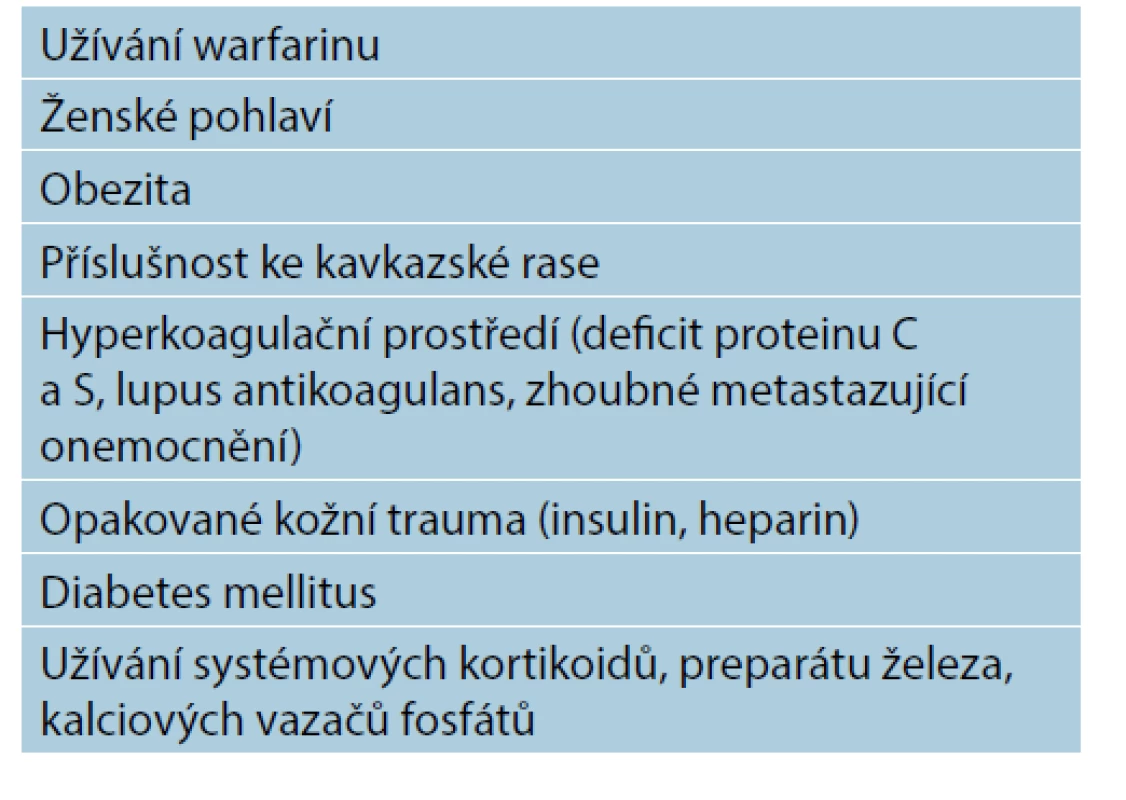
V diferenciální diagnóze je nutné odlišit pyoderma gangraenosum, Martorelliho hypertonický ischemický vřed, embolizace cholesterolu, warfarinem indukovanou nekrózu, cellulitis [15].
Diagnózu lze stanovit podle klinického nálezu. Někdy však může k diagnostice přispět i histologické vyšetření z důvodu odlišení jiných (klinicky podobných) diagnóz. Obzvlášť když se kalcifylaxe objeví v klinicky nevýznamných lézích, jako je malá papula nebo eroze [2]. Preferovanou metodou je biopsie rotačním průbojníkem široká až 8 mm, z okraje léze, zahrnující hluboký podkožní tuk. Biopsie excizí bychom se měli spíše vyvarovat z důvodu možných komplikací (ulcerace, nekróza, krvácení). Dalšími možnostmi neinvazivní diagnostiky je rentgenové a tomografické vyšetření, či Ramanova spektroskopie vedoucí k odhalení depozit kalcia i v jiných oblastech, než jsou kosti [2, 7, 15). Laboratorní vyšetření jsou diagnosticky nespecifická [2]. Zatímco hyperfosfatemie, hyperkalcemie a hypo/hyperparathyroidismus jsou rizikovými faktory kalcifylaxe, většina pacientů má zcela normální hodnoty těchto látek v séru [2].
Léčba žádá multidisciplinární přístup (nefrolog, dermatolog, plastický chirurg, dietolog, specialista chronických ran). Strategií v léčbě je zástava kalcifikace cévních stěn, obnova průtoku v již kalcifikovaných cévách, důležitá je i péče o chronické rány a úleva od bolesti [2]. Hyperfosfatemie je léčena snížením příjmů fosfátů v potravě a nasazením léků snižujících fosfatemii (u dialyzovaných hemodialýza 5krát týdně). Cílová hladina fosfátů je okolo 3 mg/dl [2]. Hyperkalcemie je korigována hemodialýzou, omezením příjmu kalcia a hyperkalcemizující medikace [2]. Cílová hladina kalcia by měla být okolo 8 mg/dl. Ideální hladina parathormonu u kalcifylaxe není známa, ale měli bychom se vyvarovat extrémně vysokých i nízkých hladin. Hladina parathormonu může být snížena pomocí cinacalcetu, u těžkých případů kalcifylaxe by měla být zvážena parathyreoidektomie [5]. Přísun derivátů vitaminu D by měl být pozastaven, stejně jako užívání warfarinu [2].
Tab. 2. Charakteristické léze u pacientů s kalcifylaxí 
Thiosulfát sodný je standardní léčbou kalcifylaxe u dialyzovaných. Působí jako chelát kalcia, čímž dekalcifikuje již kalcifikované stěny. Thiosulfát sodný se uplatňuje i jako antioxidant, neutralizující volné kyslíkové radikály, které by jinak způsobovaly trombózu, vazokonstrikci a zánětlivou odpověď organismu [2, 17, 20].
Bisfosfonáty jsou analogy pyrofosfátu, jenž je potentním inhibitorem tvorby formací hydroxyapatitu kalcia [17]. Zároveň mají bisfosfonáty protizánětlivý efekt, který zřejmě ovlivňuje snižování tvorby kalcifikací v hladké svalovině cévních stěn [17]. Podání bisfosfonátů může zmírnit bolestivost a závažnost kožních lézí [17].
Vitamin K zpomaluje progresi kalcifikace v koronárních arteriích a v aortálních chlopních [2, 17].
Péče o chronickou ránu spočívá v kontrole vlhkosti přikládaných krytí, odstranění devitalizované tkáně, a prevenci infekce [2]. Další z možností léčby u nehojících se ran je hyperbarická oxygenoterapie [2, 17]. Některé léky mohou zpomalovat hojení ran (mTOR inhibitory – imunosupresiva typu sirolimus, everolimus) [17]. U pacientů užívajících léky se subkutánní aplikací je vhodné měnit místa aplikace, a minimalizovat tak opakovaná kožní traumata [17]. Zhodnocení stavu nutrice a podávání výživné stravy je též důležité [17]. Přísné diety a rychlé snižování tělesného tuku se u tohoto onemocnění nedoporučují [2].
Kontrola bolesti hraje velmi důležitou roli v léčbě a zásadně ovlivňuje kvalitu života pacientů s kalcifylaxí [17]. Morfin by neměl být používán z důvodu možného ledvinného selhání při akumulaci aktivních metabolitů či útlumu dechového centra [5]. Preferovanými opiáty jsou fentanyl a methadone [2, 17].
Prognóza pacientů s kalcifylaxí je nepříznivá, první rok po vzniku onemocnění přežije pouze 50 % pacientů, druhý rok již jen 20 % [1]. Zhoršení stavu kalcifylaxe nastává zpravidla při infektu (bakteriálním, virovém i kvasinkovém) nebo při zvýšené psychické či fyzické námaze (zkušenosti autorů). Doporučuje se proto včas informovat rodinné příslušníky, včetně seznámení s postupem léčby, eventuálně vypracováním paliativního plánu (zkušenosti autorů). Většina pacientů umírá na sepsi z infikovaných ran. Je třeba mít na paměti, že pokud již dojde k vytvoření ulcerace, pacient pravděpodobně zemře v intervalu 6–12 měsíců [5].
ZÁVĚR
Přestože bylo původně žádáno o schválení apremilastu pro pacientku s pracovní diagnózou pyoderma gangrenosum, autoři se po zkoumání celého případu zpětně přiklánějí k diagnóze non-uremické kalcifylaxe. Diagnózu podporuje nález kalcifikací v měkkých tkáních v okolí ran a zároveň nepravidelné hvězdicovitě tvarované jizvy. Rozsáhlý obraz ulcerací po celém těle s netypickou distribucí i diabetes a výborná odpověď na imunomodulační terapii také diagnózu podporuje. Původní pracovní diagnóza pyoderma gangrenosum nebyla nikdy zcela podpořena histologickým nálezem ani jasným klinickým obrazem (např. nepřítomnost vyvýšených okrajů ulcerací a kribriformních jizev po zhojení). Nebyly prokázány další komorbidity spojené s pyoderma gangrenosum. Zvažované warfarinové nekrózy se vyskytují spíše periferně, a navíc po vysazení warfarinu nedošlo ke zlepšení stavu. Ateroskleróza a diabetes mellitus se na špatném hojení ulcerací jistě podílely, považujeme je ale spíše za komplikující diagnózy než za diagnózy primární. Ledvinné funkce pacientky byly po celou dobu sledování v normě.
Vzhledem k neúčinnosti a nežádoucím účinkům systémové imunosupresivní léčby byla zahájena léčba apremilastem, jehož užití u pyoderma gangrenosum (původní pracovní diagnózy) bylo publikováno doposud podle databáze PubMed ve dvou případech. Poprvé užití v roce 2017 publikoval Laird et al., následně v roce 2020 v duální terapii s vedolizumabem Vernero et al. [14, 22]. U. Wollina ve své práci Emerging treatments for pyoderma gangrenosum a D. N. Sari et al. v práci Off-label use of apremilast for autoimunne skin disorders treatment také uvádějí možné využití apremilastu v této indikaci [18, 25]. Na podkladě těchto prací bylo žádáno o schválení apremilastu i pro naši pacientku. Nasazení apremilastu vedlo jako jediné ze všech dosavadních terapií k hojení ulcerací a stabilizaci stavu pacientky. Apremilast je inhibitor fosfodiesterázy 4 (PDE4). Je to hlavní enzym při degradaci cyklického monofosfátu (cAMP) a cytokinů produkovaných zánětlivými buňkami. Apremilast brání prozánětlivým aktivitám imunitního systému u chronických zánětlivých chorob blokádou prozánětlivých cytokinů, chemokinů, včetně TNFα a IL23. Zároveň přes cAMP moduluje také protizánětlivé cytokiny jako IL-10 a působí tedy i imunomodulačně, což je nesporná výhoda oproti klasické imunosupresivní terapii. Přesný mechanismus účinku léčby kalcifylaxe apremilastem není znám, nicméně nejspíše souvisí právě s jeho protizánětlivými účinky. Zároveň pravděpodobně může ovlivňovat i patologické potlačování antitrombotické odpovědi organismu prozánětlivými molekulami, a tedy zabraňovat vzniku trombóz, které jsou v patogenezi kalcifylaxe typické.
V dostupné literatuře nebyl apremilast v indikaci léčby kalcifylaxe dosud použit, nicméně je v off-label indikaci využíván u řady jiných diagnóz právě pro svůj potenciál v léčbě chronických zánětlivých onemocnění a zároveň bezpečnost oproti klasické imunosupresivní terapii [16]. Uvedený případ tedy naznačuje možnost uplatnění apremilastu jako alternativy v léčbě tohoto často fatálního onemocnění.
Prohlášení o střetu zájmů
Autorka v souvislosti s tématem práce v posledních 12 měsících nespolupracovala s žádnou farmaceutickou firmou.
Do redakce došlo dne 11. 3. 2021.
Adresa pro korespondenci:
MUDr. Helena Kristlová
Kožní oddělení, Nemocnice České Budějovice
B. Němcové 585/54
370 01 České Budějovice
e-mail: helena.kristlova@yahoo.com
Zdroje
1. AL KHAFAJI, A. O A., TAHA, M., MALIK, S. Fatal Case of Non-Uremic Calciphylaxis: A Case Report and Literature review. American Journal of Case Report, 2018, 19, p. 804–807
2. BAJAJ, R., COURBEBAISSE, M., KROSHINSKY, D. et al. Calciphylaxis in patients with normal renal func-tion, a case series and systematic review. Mayo Clinic Proc, 2018, 93(9), p. 1202–1212
3. BISSONETTE, C., KAUZMEN, A., MAINVILLE, G. N. Oral Pyoderma Gangrenosum – Diagnosis, Treat-ment and Challenges: A Systematic Review. Head and Neck Pathol, 2017, 11, p. 427–441.
4. BRENT, M. C., LOGAN, T. W., DANN, F. J. Apremilast for the Treatment of Psoriatic Arthritis. Dermatology Online Journal, 2017, 23(2), p. 1–11.
5. CHANG, J. Calciphylaxis: Diagnosis, Pathogenesis and Treatment. Advances in skin and wound care, 2019, p. 205–214.
6. COURRI, C. E. et al. Monckeberg´s sclerosis – is the artery the only target of calcification? Case report. Cardiovascular Disorder, 2005, Free PMC Article.
7. DEEPAK, B., MEENAKSHI, U. M., DERICK, J. et al. Calciphylaxis and its diagnosis: A review. Journal of Family Medicine and Primary Care, 2019, 8(9), p. 2763–2767.
8. DUSILOVA SULKOVA, S. Cinacalceti hydrochlori-dum. Remedia 3/2005 Lékové profily, p. 235–245.
9. GARCÍA-LOZANO, J. A., OCAMPO-CANDIANI, J., MARTÍNEZ-CABRIALES, S. A. et al. An Update on Calciphylaxis. Am J Clin Dermatol, 2018, 19, p. 599–608.
10. HORAKOVA, M., POCK, L., BURES, I. et al. Kalcifylaxe s kožními ulceracemi – popis případu. Čes-slov derm, 2012, 87(3), p. 81–124.
11. JEONG, S. HANEOL, DOMINGUEZ, R., ARTURO Calciphylaxis: Controversies in Pathogenesis, Diagnosis and Treatment. The American Journal of the Medical Sciences, 2016, 351(2), p. 217–227.
12. KEATING, G. M. Apremilast: A Reiew in Psoriasis and Psoriatic Arthritis. Drugs, 2017, 77, p. 459–472.
13. KOVACEVICOVA, M., SVESTKOVA, S. Retikulární exantémy – patofyziologie, etiopatogeneze, klasifikace. Čes-slov Derm, 2012, 87(6), p. 211–219.
14. LAIRD, M. E., TONG, L. X., LO, SICCO, K. I. et al. Novel use of apremilast for adjunctive treatment of recalcitrant pyoderma gangrenosum. JAAD Case Rep., 2017, 14, 3(3), p. 228–229. doi: 10.1016/j.jdcr.2017.02.019. PMID: 28443317; PMCID: PMC539 4202.
15. PENG, T., ZHUO, L., WANG, Y. et al. Systematic review of sodium thiosulfate in treating calciphylaxis in chronic kidney disease patients. Nephrology, 2018, 23, p. 669–675.
16. MALONEY, N. J., ZHAO, J., TEGTMEYER. K. et al. Off-label studies on apremilast in dermatology: a review. Journal of Dermatological Treatment [online]. 2020, 31(2), p. 131–140 [cit. 2021-02-18]. ISSN 0954-6634.
17. SAGAR, U., NIGWEKAR, RAVI THADHANI Calciphylaxis (calcific uremic arteriolopathy). UpToDate, 2020, p. 1–37.
18. SARI, D. N., SUKMAWATI, L. I., FITRIANI, T. Off-Label Use of Apremilast For Autoimmune Skin Disor-ders Treatment. International Journal of Advances in Science Engineering and Technology [online], 2017, 5(4), 28 [cit. 2021-02-18]. ISSN 2321-9009. Dostupné z www: http://www.iraj.in/journal/journal_file/journal_pdf/6-413-151495881525-28.pdf.
19. SEETHAPATHY, H., BRANDENBURG, V. M., SINHA, S. et al. Review: update on the management of calciphylaxis. QJM An International Journal of Medicine, 2019, p. 29–34.
20. SEETHAPATHY, H., NOUREDDINE, L. Calciphylaxis: Approach to Diagnosis and Management. Advanced Chronic Kidney Disease, 2019, 26(6), p. 484–490.
21. SELYE, H., GENTILE, G., PRIORESCHI, P. Cutaneous molt induced by calciphylaxis in the rat. Science, 1961, 134(3493), p. 1876–1877.
22. VERNERO, M., RIBALDONE, D. G., CARITI, C. et al. Dual-targeted therapy with apremilast and vedolizumab in pyoderma gangrenosum associated with Crohn‘s disease. J Dermatol., 2020, 47(6), p. e216–e217. doi: 10.1111/1346-8138.15283.
23. WANG, Y. A., LI G., JUN M., WANG L. Systematic review of sodium thiosulfate in treating calciphylaxis in chronic kidney disease patients. Nephrology, 2017, p. 669–673
24. WEENING, R. H., SEWELL, L. D., DAVIS, M. D. et al. Calciphylaxis: natural history, risk factor analysis, and outcome. Journal of American Academy of Dermatology, 2007, 56(4), p. 569–579.
25. WOLLINA, U. Emerging treatments for pyoderma gangrenosum. Expert Opinion on Orphan Drugs [online] [cit. 2021-02-18], 2017, 5(10), p. 827–832. ISSN 2167-8707.
Štítky
Dermatologie Dětská dermatologie
Článek vyšel v časopiseČesko-slovenská dermatologie
Nejčtenější tento týden
2021 Číslo 3- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Condylomata accuminata a jejich prevence i léčba
- Miniinvazivní léčba pilonidálního sinu: laserová a podtlaková terapie jako šetrná a účinná modalita
- Proces hojení ran krok za krokem a co ho může zkomplikovat
- HydroCleanem efektivně hojíme onkologické rány po radioterapii
-
Všechny články tohoto čísla
- KONTROLNÍ TEST
- Porovnání hospitalizačních záznamů pacientů se syfilis z let 2007–2009 a 2017–2019
- Atopická dermatitida v registru BIOREP
- Apremilast v léčbě ulcerací při suspektní non-uremické kalcifylaxi. Popis případu
- Mnohočetné drsné papuly s pozitivním Auspitzovým fenoménem. Stručný přehled
- Zápis z on-line schůze výboru ČDS konané dne 13. 5. 2021
- The Business of Dermatology
- Odborné akce 2021
- Vaskulitidy z pohledu dermatologa
- Česko-slovenská dermatologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Vaskulitidy z pohledu dermatologa
- Porovnání hospitalizačních záznamů pacientů se syfilis z let 2007–2009 a 2017–2019
- Atopická dermatitida v registru BIOREP
- Mnohočetné drsné papuly s pozitivním Auspitzovým fenoménem. Stručný přehled
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



