-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Kongenitální forma dermatofibrosarkoma protuberans
Congenital Dermatofibrosarcoma Protuberans
Dermatofibrosarcoma protuberans is a slowly growing skin tumor of low malignant potential and high local recurrence rate. It appears in adults, infantile and congenital forms are rare and their diagnosis is often delayed. We present a case of 32-year-old female with congenital tumour and discuss its differential diagnosis and therapeutic possibilities.
Key words:
dermatofibrosarcoma protuberans – congenital dermatofibrosarcoma protuberans – differential diagnosis – wide local excision – imatinib mesylate
Autoři: Z. Plzáková 1; M. Důra 1,2; P. Dundr 1,2; J. Štork 1
Působiště autorů: Dermatovenerologická klinika 1. LF UK a VFN, Praha přednosta prof. MUDr. J. Štork, CSc. 1; Ústav patologie 1. LF UK a VFN, Praha přednosta doc. MUDr. P. Dundr, Ph. D. 2
Vyšlo v časopise: Čes-slov Derm, 91, 2016, No. 1, p. 18-21
Kategorie: Kazuistika
Souhrn
Dermatofibrosarcoma protuberans je kožní nádor nízké agresivity charakteristický pomalým růstem a častými lokálními recidivami. Nejčastěji se vyskytuje v dospělém věku, dětské a kongenitální nádory jsou vzácné a jejich diagnóza často pozdní. Kazuistika uvádí případ 32leté pacientky s kongenitální formou nádoru a diskutuje se v ní o diferenciální diagnóze a možnostech léčby.
Klíčová slova:
dermatofibrosarcoma protuberans – kongenitální dermatofibrosarkom – diferenciální diagnóza – široká excize – imatinib mesylátÚVOD
Dermatofibrosarcoma protuberans je nádor nízké až intermediární agresivity, typický pomalým růstem, častými recidivami (lokálně invazivní) a nízkým metastatickým potenciálem. Nádor se může objevit i u dětí, popsány jsou i kongenitální formy.
POPIS PŘÍPADU
Dermatoonkologickou ambulanci navštívila dvaatřicetiletá pacientka udávající 4 roky rostoucí projev pod pravým prsem, který vznikl v místě, kde bylo od narození přítomno hnědo-růžové místy vkleslé ložisko, které podle popisu matky pacientky bylo zpočátku velikosti asi 1 cm a pozvolna se zvětšovalo s růstem pacientky. Pacientka neužívala žádné léky, nebyla na nic alergická, v rodinné anamnéze neudávala žádné kožní onemocnění.
Objektivně byla pod pravým prsem patrná makula růžově-hnědé barvy o rozměrech 30 x 40 mm s mírně zřaseným a místy vkleslým kožním povrchem, v jejíž horní části se nacházel tuhý nodulus 10 x 10 x 6 mm růžově-hnědé barvy (obr. 1). Při vyšetření regionálních uzlin byla v pravé axile hmatná hladká oválná rezistence do 15 mm.
Obr. 1. Nodulární útvar rostoucí pod pravým prsem v ložisku přítomném od narození 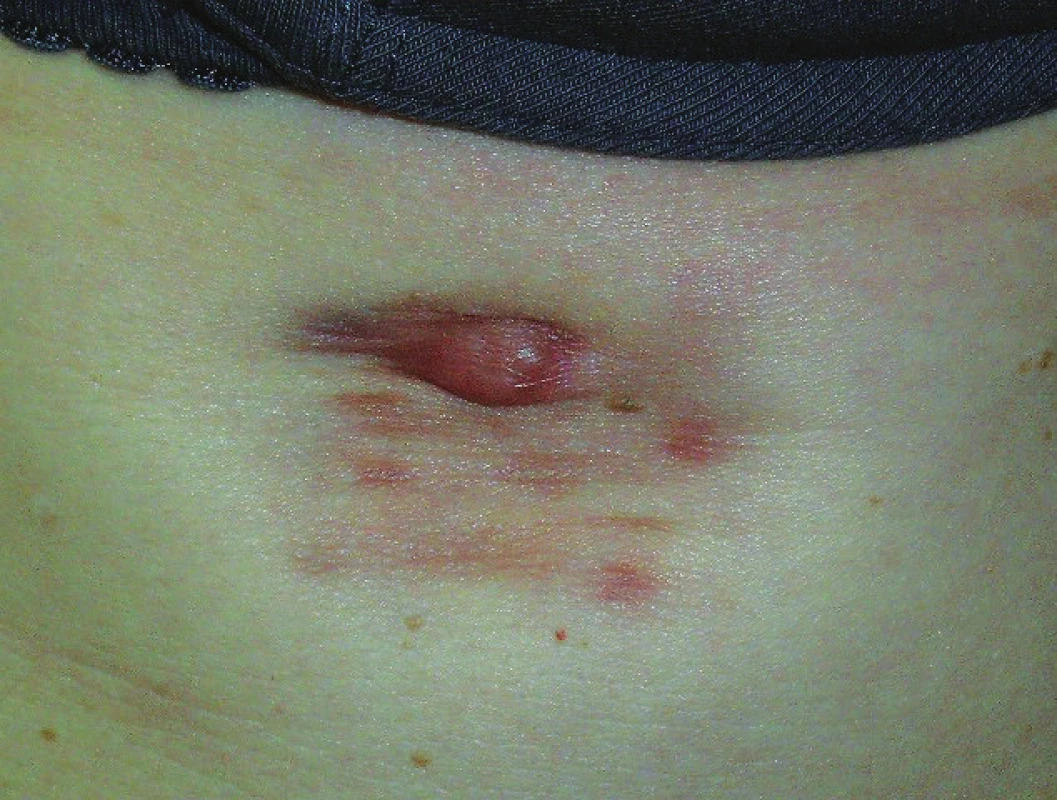
Na základě klinického obrazu byla stanovena diagnóza dermatofibrosarcoma protuberans (DFSP). Vzhledem k dlouhé anamnéze původního projevu pod prsem jsme diferenciálně diagnosticky uvažovali i o vzniku nádoru v terénu regredující vaskulární malformace, eventuálně kongenitálního névu.
Indikovali jsme excizi rostoucí nodulární části projevu k ověření diagnózy a naplánování dalšího léčebného postupu. Vzhledem k hmatné spádové uzlině byla pacientka odeslaná k vyšetření RTG S + P a k sonografickému vyšetření axilárních uzlin. Skiagram hrudníku neprokázal infiltrativní ani jiné ložiskové změny, sonograficky byly popsány pouze běžné chronické uzliny bez nádorové infiltrace.
Histologický nález (obr. 2) ukázal nepravidelně akantotickou epidermis, celé korium a část podkožní tukové tkáně byla prostoupena svazky hustě nakupených vřetenitých buněk místy vírovitě uspořádaných, které prostupovaly mezi adipocyty v širokých pruzích (obr. 3, 4). Nález v některých řezech dosahoval do blízkosti jednoho laterálního okraje excize. Vyšetření potvrdilo diagnózu DFSP.
Obr. 2. Přehledný snímek excidovaného nodulárního útvaru, hematoxylin-eosin 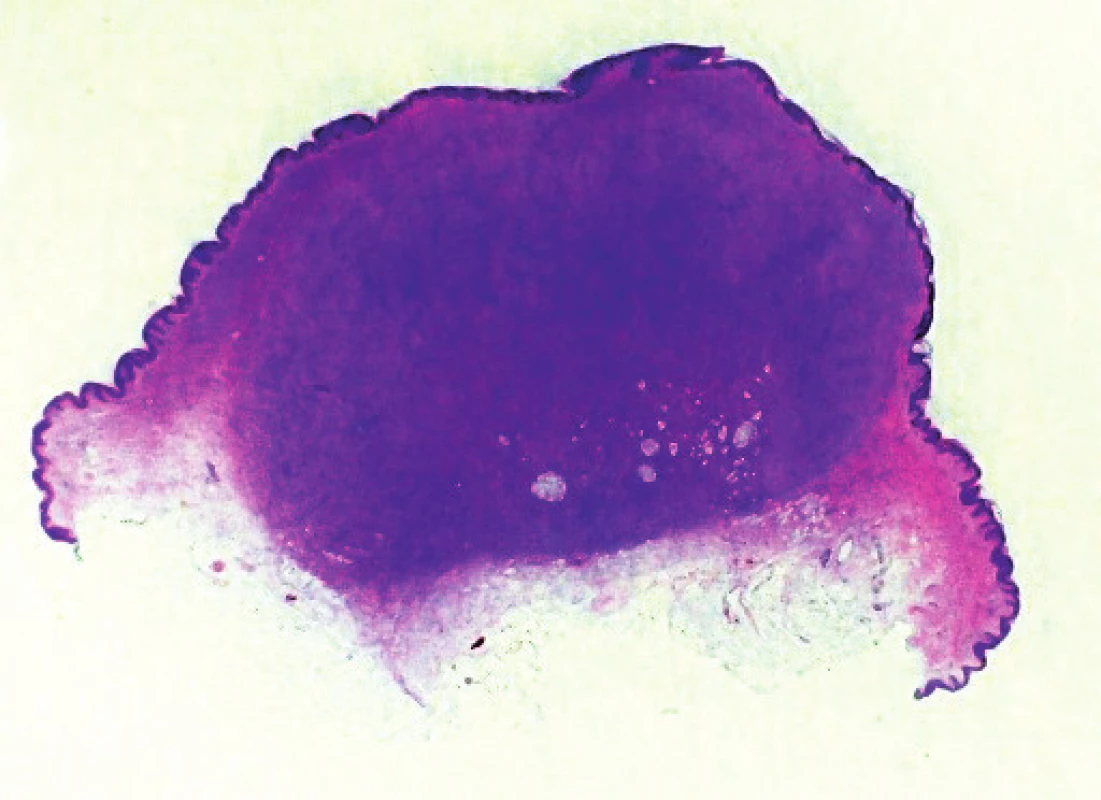
Obr. 3. Proliferace vřetenitých buněk zasahující až do podkoží, nodulární část, hematoxylin-eosin, 40krát 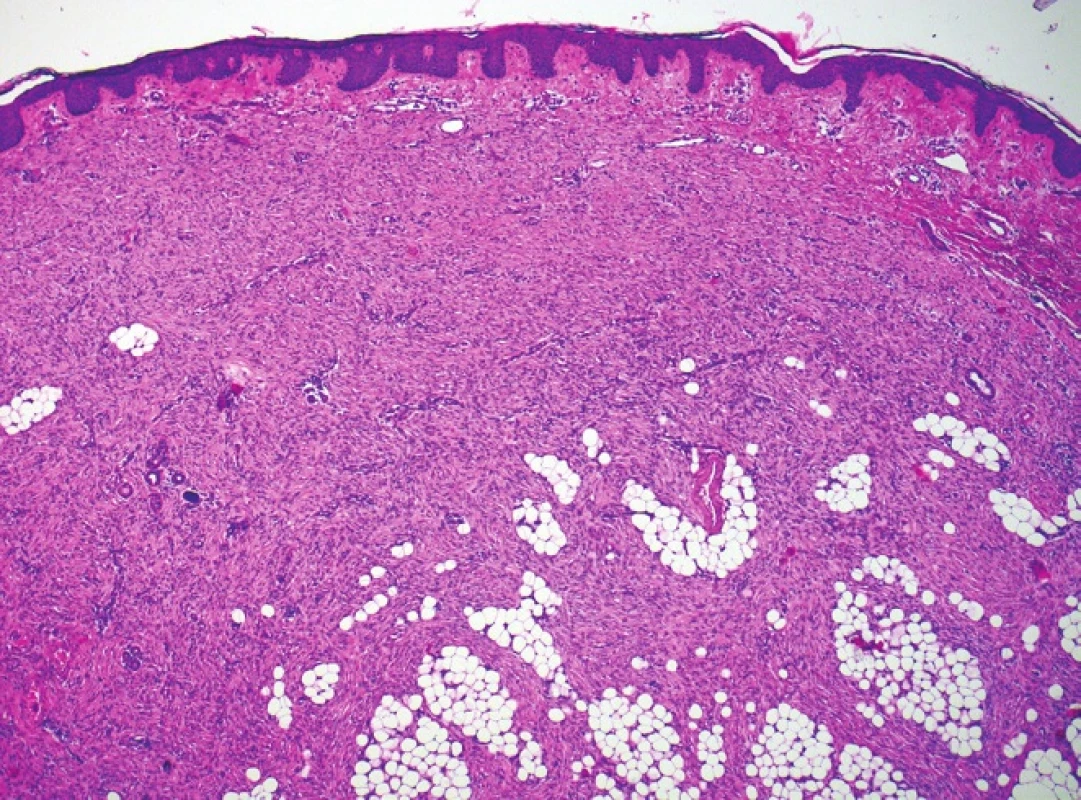
Obr. 4. Detail nádorových vřetenitých fibroblastů, nodulární část, hematoxylin-eosin, 200krát 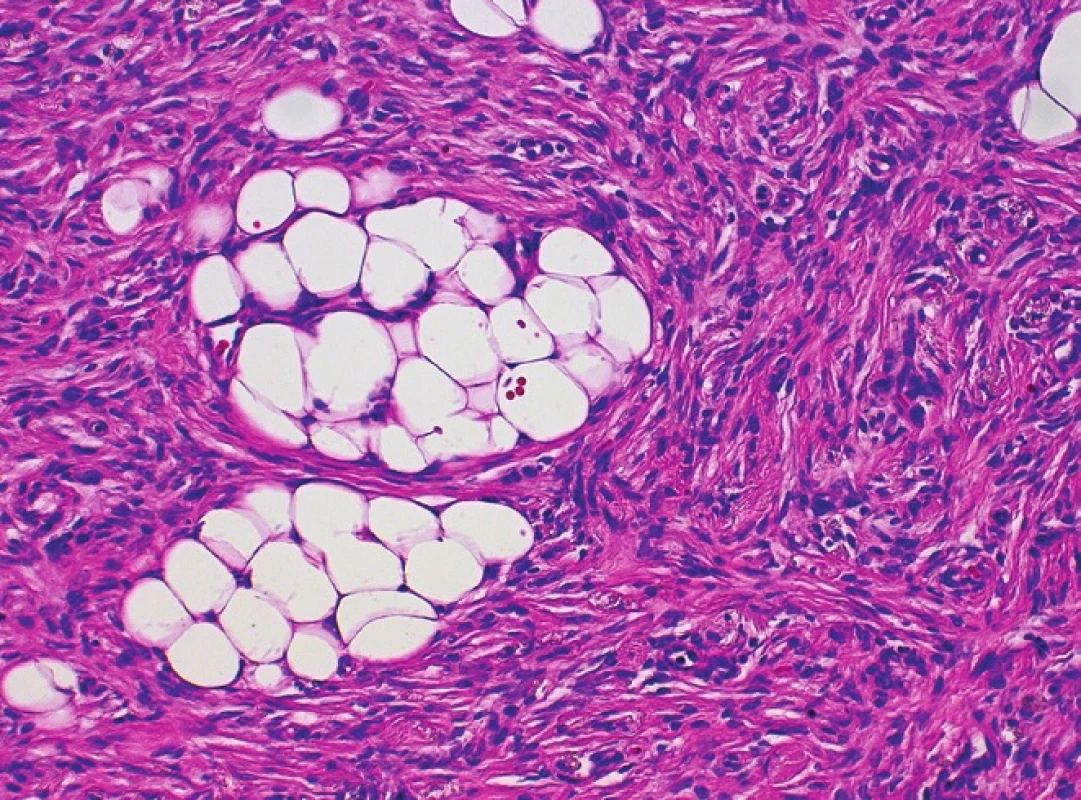
Pacientka byla odeslána na pracoviště plastické chirurgie k excizi celého projevu s lemem 2 cm (s přihlédnutím k habitu pacientky a kosmeticky problematické lokalizaci pod prsem).
Histologicky byla potvrzena diagnóza DFSP. Ve vyšetřené excizi byly téměř v celém rozsahu zastiženy struktury léze, která má zastoupenými znaky charakter DFSP, včetně imunohistochemického vyšetření s nálezem difuzní pozitivity CD34 v buňkách leze (obr. 5). Barvení k průkazu S100 proteinu bylo v nádorových buňkách negativní.
Obr. 5. Pozitivita CD 34 ve vřetenitých fibroblastech, kongenitální část, 200krát 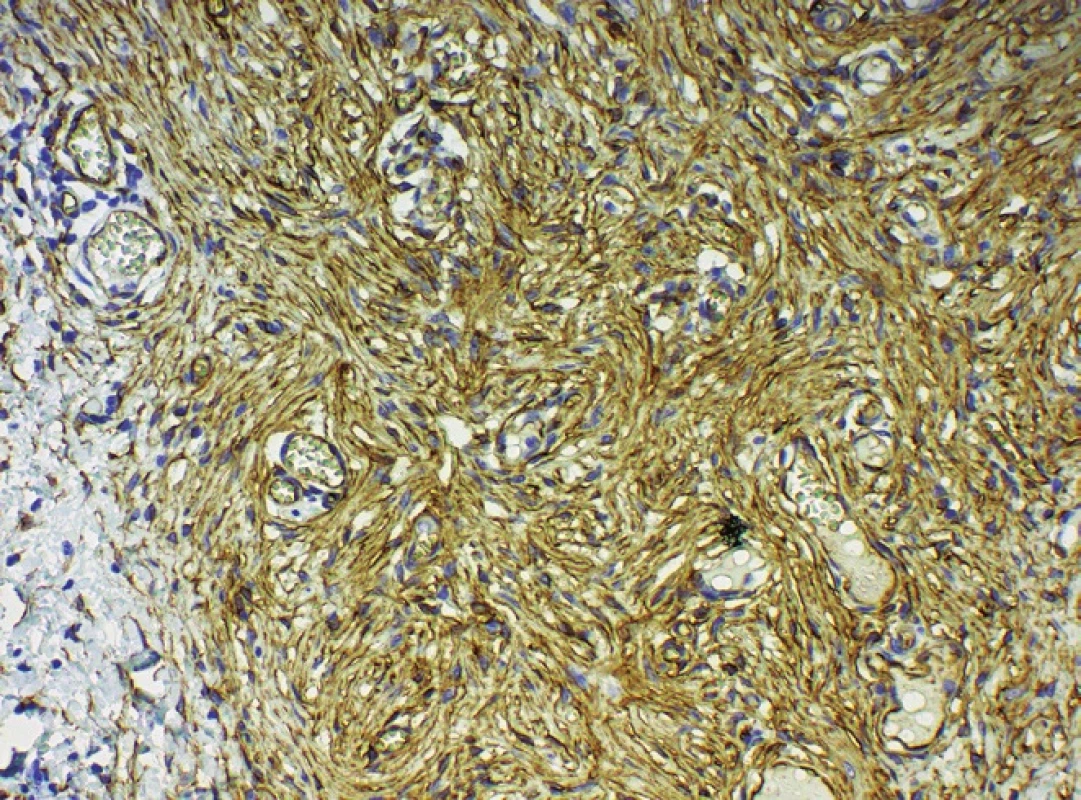
Vzhledem k přítomnosti nádoru od narození jsme případ uzavřeli jako kongenitální DFSP. Pacientka je v pravidelných intervalech sledována na dermatoonkologické ambulanci naší kliniky. Při kontrole 5 měsíců po excizi byla hmatná drobná uzlina v axile levé, uzlina v pravé axile již hmatná nebyla, sonografický nález v axilách opět nepotvrdil nádorovou infiltraci. V místě jizvy je kůže bez známek recidivy onemocnění.
DISKUSE
Název DFSP byl poprvé uveden v r. 1925 Hoffmanem. Za nejstarší publikovanou zmínku pravděpodobně můžeme pokládat publikaci R. Taylora z r. 1890, kde popisuje sarkom připomínající nádory podobné keloidům.
DFSP tvoří asi 6 % maligních nádorů měkkých tkání. Nejčastěji vzniká v třetí až páté dekádě na kůži trupu a proximálních končetin. Postižení mužů a žen je téměř stejně časté, i když různé studie uvádějí někdy častější postižení mužů, někdy žen [1]. Nádor se skoro dvakrát častěji vyskytuje u lidí černé pleti [5].
Za příčinu nádorové transformace se považuje mutace genu pro destičkový růstový faktor β (PDGFB). Translokace t (17;22) (q22;q13) způsobí fúzi PDGFB (transmembránová kináza) s kolagenem typu 1α1 a navodí transformaci fibroblastů na vřetenité buňky s nekontrolovatelným růstem.
V dětském věku je DFSP popisován zřídka (asi 6 % DFSP), první zmínka pochází z padesátých let minulého století. Kongenitální formy jsou ještě vzácnější a tvoří asi 1,5 % DFSP [14]. Někdy je nález popsán v dokumentaci novorozence, většina případů se opírá o výpovědi rodičů či pacienta. Typická lokalizace se neliší od dospělých, ale častěji se vyskytuje u ženského pohlaví [7].
Diagnosticky však dětská a kongenitální forma činí mnohem větší obtíže. Nejčastěji bývá popisována jako růžově-hnědá/fialová makula nebo nodulus a klinicky je často považována za cévní malformaci, či nádor cévního původu, méně často za neurofibrom, infantilní myofibromatózu, lipom, fibrom, lymfom, keloid, sarkom. Některé nádory připomínají atrophoderma/anetoderma anebo morpheu, mohou být i hypopigmentované, zřídka ochlupené. Průměrný věk pacienta při stanovení diagnózy kongenitálního dermatofibrosarkomu byl v 70. letech 33 let, v roce 2000 se snížil na14 let a poslední práce uvádějí průměrně věk 6 let [10]. V nejasných případech je možné vzít v úvahu časový vývoj ložiska. Například hemangiomy po počáteční několikaměsíční růstové fázi posléze regredují, morphea v průběhu let podléhá změnám hypo/hyperpigmentačním a tuhé ložisko měkne, zatímco DFSP pozvolna roste a spontánně neregreduje. Pokročilé nádory mohou být fixovány k fascii či ke kosti. Většinou je projev asymptomatický, někdy může být bolestivý či exulcerovaný.
Existují zvláštní formy DFSP vyskytující se jak u dospělých, tak i u dětí a kongenitálně:
- Atrofický DFSP – barvy kůže až růžový s atrofickou, někdy řasící se kůží, někdy s přítomností teleangiektazií. Dermální složka nádoru je výrazně redukována a u malého vzorku tkáně může být problém s histologickou diagnózou.
- Pigmentovaný DFSP tzv. Bednářův tumor (v r. 1957 popsaný Bednářem jako pigmentovaný storiformní neurofibrom) – je velmi vzácný, klinicky zbarven více dofialova.
- Myxoidní DFSP – diagnóza je histologická – obsahuje více než 50 % myxoidního stromatu. Je popsána kombinace pigmentovaného a myxoidního nádoru u dítěte [6].
- Obrovskobuněčný fibroblastom (giant cell fibroblastoma – GSF) – je považován za dětskou variantu DFSP. Jsou si klinicky, histologicky a geneticky (stejná mutace) podobné a mohou koexistovat, nebo DFSP recidivovat jako GSF a obráceně. Nejedná se ale o stejný nádor. Pro GSF je typický histologický nález atypických obrovských buněk kolem pseudovaskulárních štěrbin, perivaskulární zánětlivý infiltrát.
- Někdy může dojít k fibrosarkomatózní transformaci původního či recidivujícího DFSP. Postihuje různé procento nádoru a projeví se vyšší celularitou a četností nukleárních atypií a mitóz, sníženou intenzitou CD34 pozitivity a klinicky vyšší agresivitou nádoru. Velmi zřídka má část nádoru charakter „high-grade“ sarkomu [4].
Mnohočetné projevy jsou popisovány zejména u onemocnění způsobeném deficitem adenosindeaminázy. Tento kombinovaný imunodeficit projevující se v prvních týdnech či měsících života je bez léčby smrtelný. Práce z roku 2011 popisuje asociaci této nemoci s vysokou incidencí kongenitálních a dětských DFSP včetně multicentrických (8 z 12 sledovaných pacientů). Pravděpodobnou příčinou je potenciace mutace genu PDGFB v důsledku narušené reparace DNA [9].
Histologicky je nádor v časném stadiu tvořen vřetenitými buňkami s podlouhlými jádry a minimální nukleární atypií a minimálním počtem mitóz uspořádáných ve svazcích paralelně s povrchem kůže, jsou přítomny v dermis až v subcutis. V nodulárním stadiu se zvyšuje celularita nádoru, buňky vytvářejí krátké svazky – tzv. storiformní, rohožkovité uspořádaní a infiltrace podkoží připomíná obraz včelí plástve. Přibývá mitóz a jádra jsou hyperchromatická. Méně než 5 % nádorů obsahuje dendritické melanocyty s diferenciací podobnou Schwannovým buňkám (Bednářův tumor). Někdy je přítomna hyperplazie epidermis, spíše typická pro dermatofibrom. Imunohistochemicky je typická difuzní pozitivita CD34 a negativita S-100 a faktoru XIIIa. U kongenitálních forem nemusí být časné histologické vyšetření přínosné, typický histologický obraz a CD34 pozitivita se mohou objevit až později [8, 12].
Diferenciální diagnóza je široká. Nejčastěji zahrnuje vazivové nádory: dermatofibrom (CD34 negativní a faktor XIIIa pozitivní buňky, v nerozhodných případech je popisována pozitivita stromolysinu-3 a apolipoproteinu D u DFSP, dermatofibrom je negativní), dermatomyofibrom, plakovitý CD34 pozitivní dermální fibrom (popsán v r. 2004, kongenitální atrofické ohraničené, někdy i nodulární ložisko, CD34 pozitivní, negativní PDGFB mutace, s benigním průběhem), ale i neurofibrom, morphea, nádor cévního původu či cévní malformace, leiomyom, pilomatrixom zejména u kongenitálních a dětských forem.
Terapie je chirurgická. U dospělé i dětské formy je doporučován 2–3cm lem zdravé tkáně. Práce z roku 1997 udává u 70 % pacientů přesah nádoru 1 cm a u 5 % pacientů dokonce 5 cm mimo klinicky viditelný projev [11]. V některých zemích je preferována Mohsova mikrografická chirurgie, která sníží riziko lokální recidivy. Její použití u dětí je však sporné z důvodu opakované expozice lokálním anestetikům. Rozsáhlé nádory se doporučuje před výkonem vyšetřit pomocí magnetické rezonance, která umožní lepší naplánování rozsahu operace a metody uzavření rány. U dospělých některá pracoviště doplňují adjuvantní radioterapii.
U neresekabilních nádorů nebo v paliativní léčbě je možné použít radioterapii. Chirurgicky neřešitelné, či opakovaně rekurentní a metastazující nádory jsou v klinických studiích léčeny imatinib mesylátem, který je antagonistou PDGF receptoru. Léčebná odpověď je příznivá asi u 50 % pacientů.
Dispenzarizace zahrnuje klinické vyšetření jizvy a regionálních uzlin, skiagram hrudníku, některá pracoviště doporučují CT hrudníku (plíce jsou nejčastější lokalizací metastáz), a to zejména u dlouhotrvajících či lokálně agresivních nádorů. Uzlinové metastázy jsou vzácné. Podle nejnovějších údajů metastazuje dokonce jenom 0,3 % nádorů (dříve uváděno 1–5 %). Většinou se jedná o opakovaně recidivující nádory. Nedoporučuje se proto rutinně provádět vyšetření sentinelových uzlin [2]. Vzhledem k tomu, že riziko lokální recidivy je největší v prvních letech po excizi, doporučují se v prvních 3 letech 3–6měsíční intervaly klinických kontrol.
Četnost recidiv po náležité chirurgické léčbě je kolem 7 %, u Mohsovy mikrografické chirurgie 1% [10]. Po neširoké excizi recidivovalo až 50 % nádorů. Vyšší procento recidiv je u nádoru hlavy a krku, nejspíše z důvodu problematičnosti radikální chirurgické léčby [10]. Pětileté přežití u DFSP je 99,2% [5].
ZÁVĚR
Kongenitální formy DFSP jsou poměrně vzácné a jejich prognóza a terapie se většinou neliší od dospělé formy DFSP. Problematická a často pozdní diagnóza vyplývá z netypického obrazu, ani histologický nález nemusí být u velmi malých dětí charakteristický. U naší pacientky byla diagnóza stanovená až ve 32 letech. Původní, od narození přítomný projev jí nečinil klinické ani kosmetické potíže, lékaře navštívila až poté, co se v tomto místě objevil pozvolna rostoucí nodulus.
Základem léčby nadále zůstává chirurgické odstranění nádoru s dostatečným lemem. Pravidelná dispenzarizace je nutností.
Do redakce došlo dne 14. 9. 2015.
Adresa pro korespondenci:
MUDr. Zuzana Plzáková, Ph.D.
Dermatovenerologická klinika 1. LFUK a VFN
U Nemocnice 499/2
128 08 Praha 2
e-mail: zuzana.plzakova@lf1.cuni.cz
Zdroje
1. Bendix-Hansen, K., Myhre-Jensen, D., KAAE, S. Dermatofibrosarcoma protuberans. A clinico-pathological study of nineteen cases and review of world literature. Scand. J. Plast. Reconstr. Surg. Hand Surg., 1983, 17, 3, p. 247–252.
2. Bogucki, B., Neuhaus, I., Hurst, E. A. Dermatofibrosarcoma protuberans: a review of the literature. Dermatol. Surg., 2012, 38, 4, p. 537–551.
3. BOLOGNA, J. L., JORIZZO, J. L., SCHAFFER, J. V. Dermatology. 3rd ed. Elsevier Limited, 2012, 1973 p., ISBN 9780723435716.
4. CALONJE, E., BRENN, T., LAZAR, A. et al. McKee´s pathology of the skin with clinical correlations. 4th ed. Elsevier Limited, 2012, 1634 p. ISBN-13 : 9781416056492.
5. CRISCIONE, V. D., WEINSTOCK, M. A. Descriptive epidemiology of dermatofbrosarcoma protuberans in the United States, 1973 to 2002. J. Am. Acad. Dermatol., 2007, 56, 6, p. 968–973.
6. El Hachem, M., Diociaiuti, A., Latella, E. et al. Congenital myxoid nad pigmented dermatofbrosarcoma protuberans: a case report. Pediatr. Dermatol., 2013, 30, 5, p. e74–77.
7. Checketts, S. R., HAMILTON, t. k., bAUGHMAN, r. d. Congenital and childhood dermatofibrosarcoma protuberans. A case report and review of literature. J. Am. Acad. Dermatol., 2000, 42, 5, 2, p. 907–913.
8. Iwata, Y., Kodera, M., Usuda, T. et al. Case of congenital dermatofibrosarcoma protuberans: change of clinical features and pathological findings over 10 years. J. Dermatol., 2013, 40, 11, p. 943–944.
9. Kesserwan, C., Sokolic, R., Cowen, E. W. et al. Multicentric dermatofibrosarcoma protuberans in patients with adenosine deaminase-deficient severe combined immune deficiency. J. Allergy Clin. Immunol., 2012, 129, 3, p. 762–769.
10. Posso-De Los Rios, C. J., Lara-Corrales, I., Ho, N. Dermatofibrosarcoma protuberans in pediatric patients: A report of 17 cases. J. Cutan. Med. Surg., 2014, 18, 3, p. 180–185.
11. Ratner, D., Thomas, C., Johnson, T. et al. Mohs micrographic surgery for the treatment of dermatofibrosarcoma protuberans. Results of multiinstitutional series with an analysis of the extent of microscopic spread. J. Am. Acad. Dermatol., 1997, 37, 4, p. 600–613.
12. Suzuki, D., Kobayashi, R., Yasuda, K. et al. Congenital dermatofibrosarcoma protuberans in a newborn infant with a massive back tumor: favorable effects of oral imatinib on the control of residual tumor growth. J. Pediatr. Hematol. Oncol., 2011, 33, 7, p. e304–306.
13. THORNTON, S. L., REID, J., PAPAY, F. A. et al. Childhood dermatofibrosarcoma protuberans: Role of preoperative imaging. J. Am. Acad. Dermatol., 2005, 53, 1, p. 76–83.
14. TOPAR, G., HÖNLINGER, B., EISNEDLE, K. et al. An unusual congenital lesion in a 26-year old woman. Clin. Exp. Dermatol., 2008, 33, 3, p. 373–374.
Štítky
Dermatologie Dětská dermatologie
Článek vyšel v časopiseČesko-slovenská dermatologie
Nejčtenější tento týden
2016 Číslo 1- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Condylomata accuminata a jejich prevence i léčba
- Isoprinosine nově bez indikačních a preskripčních omezení
- HydroCleanem efektivně hojíme onkologické rány po radioterapii
- Co s NSTI? NPWT!
-
Všechny články tohoto čísla
-
DOŠKOLOVÁNÍ LÉKAŘŮ
KONTROLNÍ TEST - Psoriáza, psoriatická artritida a tofózní dna
- Kongenitální forma dermatofibrosarkoma protuberans
- Klinický prípad: Solitárna papulózna lézia na tvári
-
Dermatoskopie nepigmentovaných kožních nádorů.
Cévní nádory a krvácivé projevy -
Zápisnica zo zasadania výboru Slovenskej dermatovenerologickej spoločnosti
3. 10. 2015 Bratislava - Hereditární ichtyózy
-
Zápis ze schůze výboru ČDS
Praha 26. listopadu 2015 - Odborné akce v roce 2016
-
Zpráva z 19. mítinku Evropského dermatologického fóra (EDF)
Curych 21.–23. 1. 2016
-
DOŠKOLOVÁNÍ LÉKAŘŮ
- Česko-slovenská dermatologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Hereditární ichtyózy
-
Dermatoskopie nepigmentovaných kožních nádorů.
Cévní nádory a krvácivé projevy - Kongenitální forma dermatofibrosarkoma protuberans
- Psoriáza, psoriatická artritida a tofózní dna
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



