-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Granuloma anulare
Granuloma Annulare
Granuloma annulare is a benign dermatosis. The etiology of granuloma annulare is unclear and the delayed type of hypersensitive reaction to unknown antigen is supposed. We distinguish localized, generalized, perforating, subcutaneous and patch form of granuloma annulare. Localized form is usually self-limited and disappears within two years. Generalized form of granuloma annulare is a therapeutic problem. Many patiens have been treated with many systemic drugs with the poor therapeutic effect. Phototherapy, immunosuppressants, antibiotics, antimalarials, antileprotic drugs, vitamins, cytostatics and biologic agents have been used for the generalized granuloma annulare treatment.
Key words:
granuloma annulare – etiopathogenesis – therapy
Autoři: J. Pavlas
Působiště autorů: Kožní oddělení, Fakultní nemocnice Ostrava primářka MUDr. Yvetta Vantuchová, Ph. D.
Vyšlo v časopise: Čes-slov Derm, 88, 2013, No. 6, p. 267-276
Kategorie: Souborné referáty (doškolování lékařů)
Souhrn
Granuloma anulare je benigní kožní onemocnění nejasné etiologie. Patogeneticky se předpokládá pozdní typ hypersenzitivní reakce na neznámý antigen. Klinicky se rozlišuje lokalizovaná, generalizovaná, podkožní, perforující a erytémová forma granuloma anulare. Zatímco lokalizovaná forma většinou spontánně odeznívá v průběhu dvou let, generalizovaná forma je terapeuticky problematická a výjimkou není pacient s generalizovanou formou granuloma anulare, který byl bez výraznějšího efektu léčen několika systémovými terapiemi. Byly publikovány kazuistiky a malé studie používající k terapii generalizovaného granuloma anulare fototerapii, imunosupresiva, antibiotika, antimalarika, antileprotika, vitamíny, cytostatika i biologika.
Klíčová slova:
granuloma anulare – etiopatogeneze – léčbaÚVOD
Granuloma anulare (GA) je nepříliš vzácné benigní kožní onemocnění s histologickým obrazem nekrobiotického granulomatózního zanětu, klinicky se nejčastěji projevujícím anulárně uspořádanými papulami barvy kůže. Calcott Fox poprvé popsal „prstencovité vyrážky prstů“ v roce 1895, Radcliffe-Crocker nazval tuto jednotku granuloma anulare (GA) v roce 1902. Není zavedeno přesné dělení forem GA, nejčastěji nyní rozlišuje lokalizovanou formu GA [32], generalizovanou formu GA (GGA) s variantami generalizované anulární formy GGA, diseminované papulózní formy GGA, atypické generalizované formy GGA (32), podkožní formu GA, perforující formu GA a odlišnou erytémovou formu GA. Dodnes neexistuje doporučení účinné léčby GA, jsou popisovány jen kazuistiky, nebo malé studie, srovnávající většinou efektivitu jen jednoho druhu terapie na různě velkém vzorku pacientů [2, 32].
ETIOPATOGENEZE
Všeobecně se etiopatogeneticky předpokládá pozdní typ hypersenzitivní reakce na neznámý antigen, charakterizovaný převážně CD4+ Th1 lymfocytární zánětlivou reakcí se zvýšenými hladinami interleukinu-2 (IL-2), interferonu γ (INF-γ) a tumor necrosis faktoru α (TNF-α). Tyto cytokiny stimulují migraci makrofágů a T-lymfocytů. Makrofágy produkují TNF-α, zesilují tak zánětlivou odpověď a produkují tkáňové metaloproteázy destruující kolagen a další extracelulární proteiny [23]. IL-1β a TNF-α jsou primární cytokiny a spolu s IL-18 vedou k Th-1 dominantním cytokinovým reakcím. Všechny tyto tři uvedené cytokiny jsou lokálně nebo systémově zvýšeny u pacientů s GA. Vyvolávající faktor pozdní hypersenzitivní reakce je nejasný, u lokalizovaného GA se etiologicky zvažuje poštípání hmyzem, mechanické podráždění, aplikace tuberkulinového testu, sluneční expozice, nežádoucí účinek léků, virové infekce a jiné [8]. V posledních letech je zvažována i borreliová etiologie. Průkaz borrelií ve tkáních se však nedaří provést PCR technikou, příčinou může být malé množství DNA borrelií, stejně jako velké množství různých druhů borrelií. V této souvislosti je zajímavé zkoumání histopatologických řezů technikou focus floating mikroskopie (FFM). FFM je upravená imunohistochemická technika, která kombinuje několik postupů používaných k detekci miniaturních organismů ve tkáňových řezech. FFM prohlíží tkáňový řez ve dvou rovinách. Horizontálně meandrovitě jako při klasické mikroskopii a současně vertikálně při zaostřování přes tloušťku řezu (širokého 3–4 μm) ve 200–400násobném zvětšení. Tato metoda umožňuje detekovat borrelie (s průměrem 0,2 μm, ve srovnání s kolagenovým vláknem šířky 2 μm), které řezy procházejí pod různými úhly, a proto se objevují jako undulované, tečkovité, nebo čárkovité struktury. Současně se používá imunohistochemického barvení s 3-amino-9-ethylkarbazolem (AEC), kdy obarvené mikroorganismy světle červeně září proti světle žluté barvě neobarvených kolagenních vláken a dalších tkáňových struktur. Dále jsou při vyšetření FFM použity méně specifické polyklonální protilátky, které mohou detekovat více druhů borrelií. Přibývají totiž nově objevené druhy borrelií, mimo známých Borrelia burgorferi sensu lato, obsahující B. burgorferi sensu stricto, B. garinii a VS 461 (které je možné vyšetřit PCR technikou), jsou detekovány již B. valaisiana, B. hermsii, B. turicatae, B. duttoni, B. parkeri, B. spielmanii. Byly již publikovány případy, kdy tyto druhy borrelií vyvolaly borreliové onemocnění. PCR technika umožňuje detekovat jen B. burgdorferi sensu lato, zatímco imunohistochemické vyšetření v kombinaci s FFM užívá méně specifické polyklonální protilátky, které pravděpodobně detekují mnohem více borreliových druhů. V souvislosti s FFM je zajímavé, že u diseminované formy GA byl detekován výrazně menší počet borreliových struktur než u ostatních forem GA. Dále se uvádí pozitivní sérologie borreliových protilátek u 26 až 65 % případů GA [37]. Sérologické vyšetření je však, stejně jako vyšetření PCR technikou, limitováno možnostmi průkazu protilátek jen proti některým druhům borrelií. Jsou popsány kazuistiky [14], které stejně jako zkušenosti z našeho pracoviště popisují negativní nález sérologie protilátek proti borreliím při vyšetření screeningovou ELISA technikou, s pozitivním nálezem při vyšetření technikou western-blotu (WB) [14].
Generalizovaná forma GA, zvláště generalizovaná forma s atypickým klinickým obrazem, může být asociována s diabetes mellitus, onemocněními štítné žlázy, malignitami, dyslipidémiemi, infekcí HIV, hepatitidou B a hepatitidou C. Studie z roku 2002, se 126 pacienty, nepotvrdila uváděnou souvislost mezi diabetes mellitus a GA [32].
KLINICKÝ OBRAZ
Klinicky jsou u lokalizované formy GA patrná obloukovitě až anulárně uspořádaná ložiska (obr. 1), přibližně v 60 % se ložiska vyskytují jen na rukou a pažích, ve 20 % jen na dolních končetinách a nohou, v 7 % na horních i dolních končetinách, v 5 % jen na trupu a přibližně v 5 % ve všech lokalitách. Na obličeji jsou projevy zřídka. Ložiska jsou barvy kůže, růžová, nebo fialová, okraj ložisek je složený z jednotlivých drobných, několikamilimetrových papul, v centru obloukovitých až anulárních ložisek je intaktní kůže (obr. 2). Anulární ložisko má zpravidla průměr několika centimetrů. Solitární papuly s centrální depresí v úrovní kůže (papulárně-umbilikální forma) nebo noduly se nejčastěji vyskytují na prstech. Lokalizovaná forma GA se objevuje nejčastěji u pacientů do 30 let věku, 2krát častěji u žen [2].
Obr. 1. Granuloma anulare – mnohačetná anulární ložiska 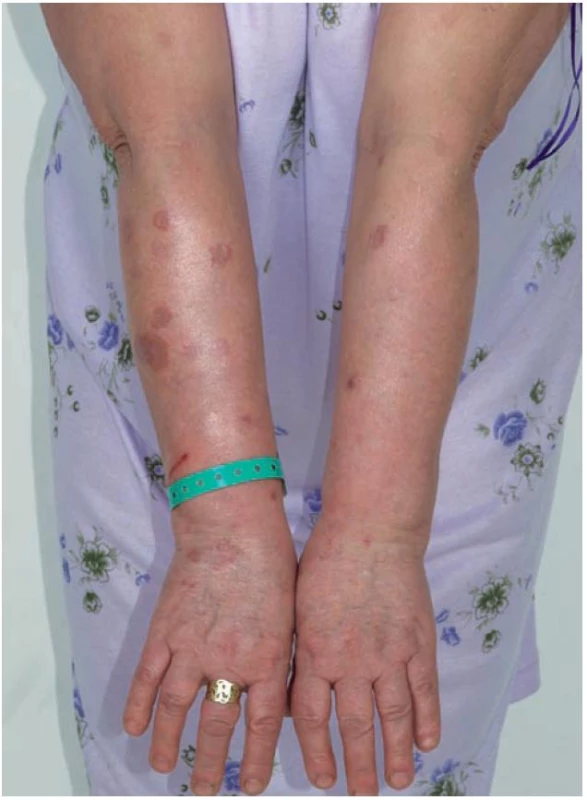
Obr. 2. Granuloma anulare – anulárního ložisko 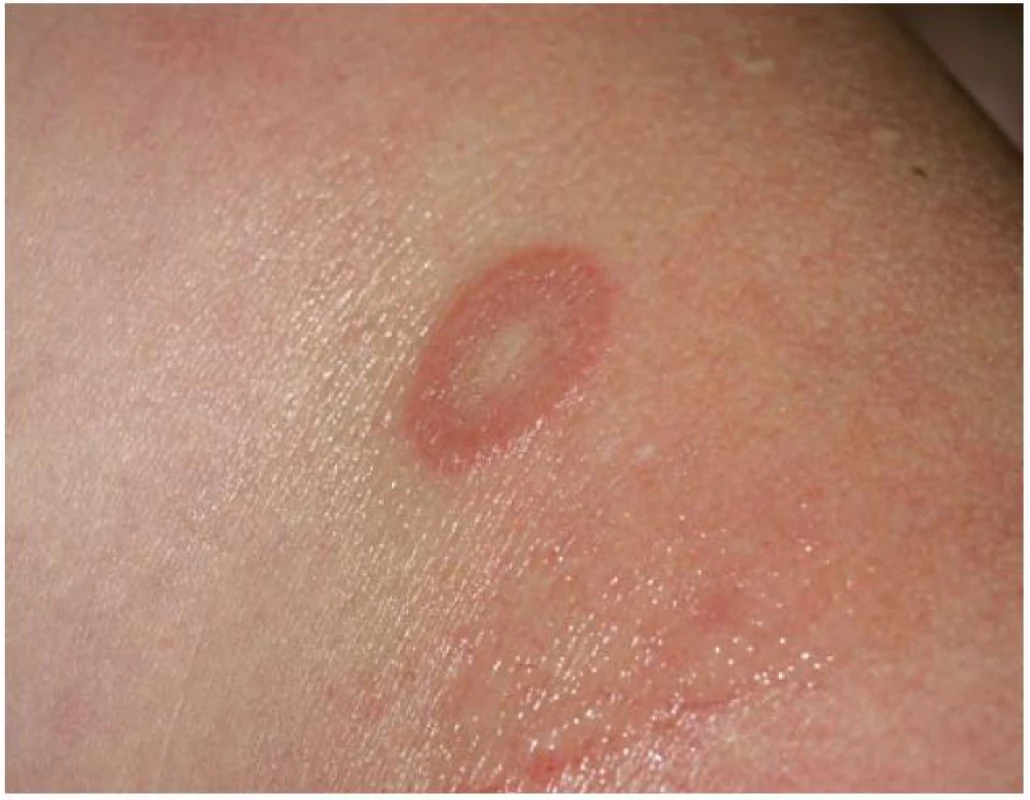
Generalizovaná forma GA (GGA) se vyskytuje v 8,5–15 % všech případů GA [5]. Je definována přítomností nejméně deseti současně se vyskytujícími anulárními ložisky nebo rozsáhlými anulárními ložisky (obr. 3) [32]; většinou jsou přítomny stovky malých, růžovo-fialových papul na trupu i končetinách, které mohou tvořit anulární ložiska [2]. Nejčastěji postihuje děti ve věku do 10 let a ženy ve věku nad 40 let [5]. Generalizovaná forma GA se vyznačuje dlouhou dobou trvání a mnohem nižším počtem spontánních zhojení. Výskyt generalizované formy bývá spojen s pozitivitou HLA-Bw35 antigenu [8].
Obr. 3. Granuloma anulare – rozsáhlé anulární projevy 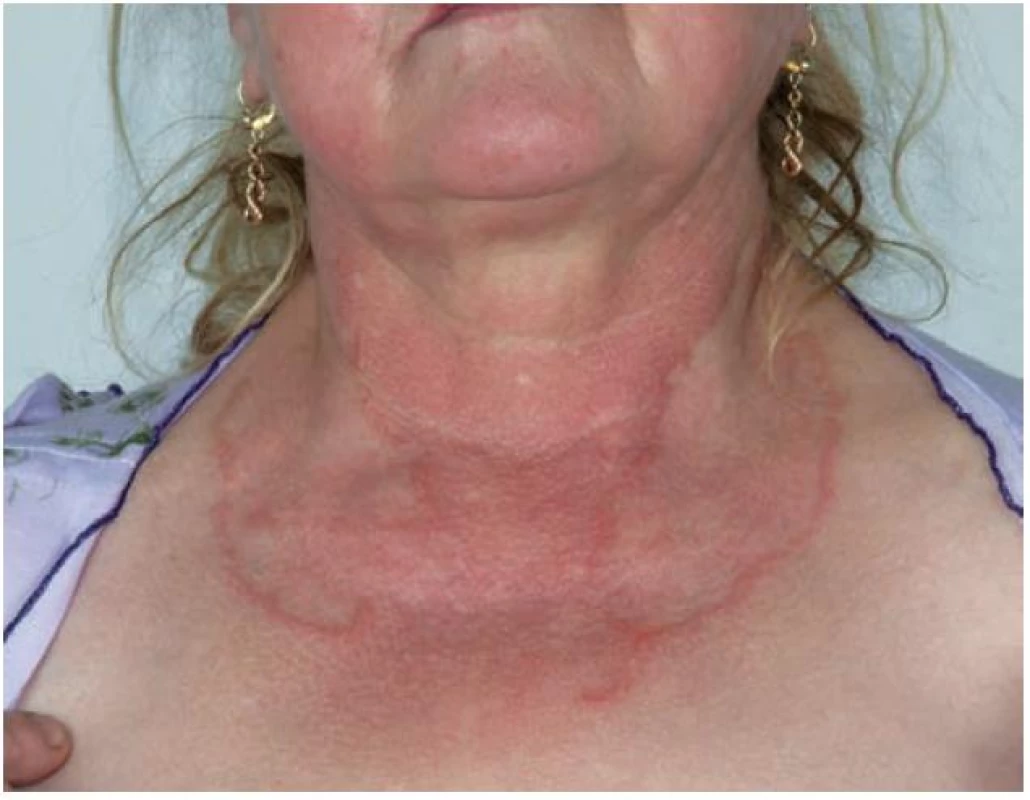
Podkožní forma GA je charakterizovaná velkými nebolestivými noduly barvy kůže, které mohou být zaměněny za revmatoidní uzly. Typickou lokalizací jsou dlaně, ruce, pretibiální oblast a nohy, stejně jako hýždě, kapilitium, sporadicky oční víčka. Nejčastěji se objevuje u dětí v prvních 5–6 letech života [2].
Perforující forma GA se klinicky projevuje jako malé papuly s centrálními prohlubněmi krytými krustami nebo fokálními ulceracemi na hřbetech rukou a prstech [2, 12]. Představuje asi 5 % všech případů GA, histologicky představuje transepidermální eliminaci degenerovaného kolagenu [2].
Erytémová forma GA je odlišnou variantou projevující se erytémovými ložisky na končetinách a trupu. Může zcela scházet anulární uspořádání ložisek a diagnóza je určována na základě typického histopatologického nálezu (obr. 4) [2].
Obr. 4. Granuloma anulare – erytematózní forma (Dermatovenerologická klinika 1. LF UK a VFN) 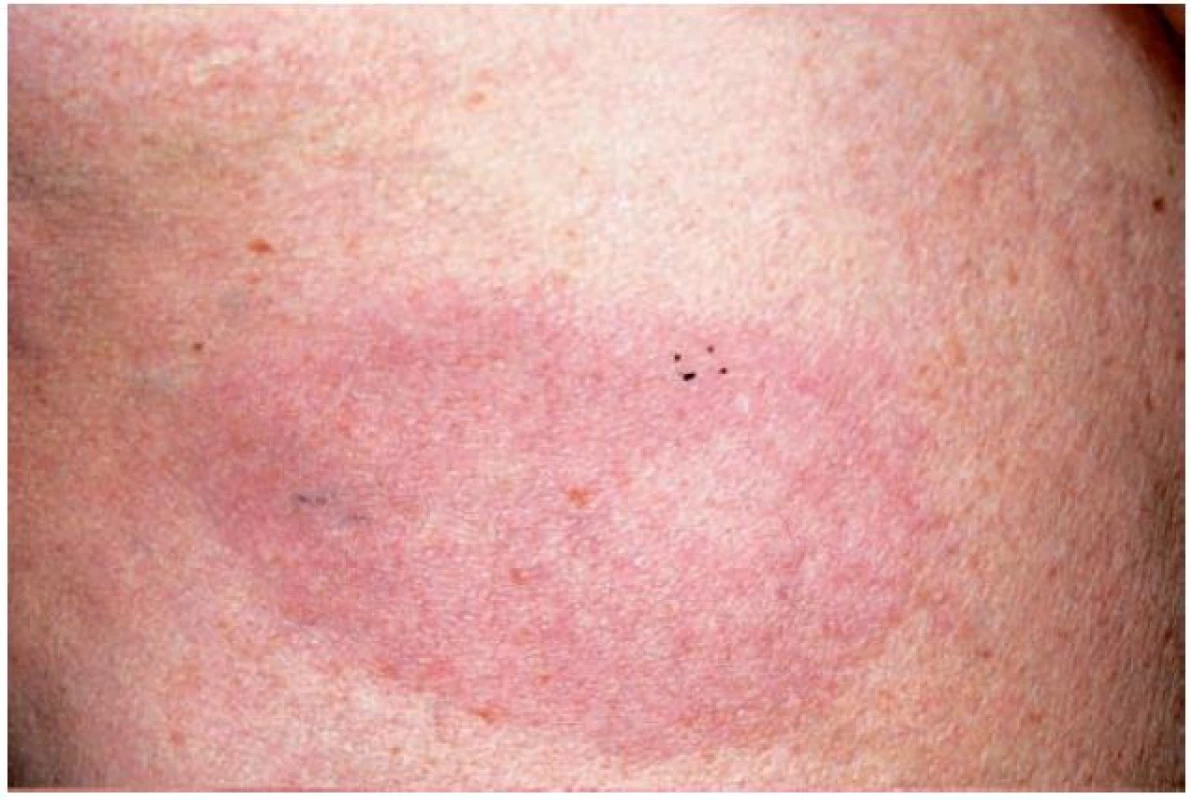
HISTOPATOLOGIE
Histopatologické vyšetření je nezbytné k jednoznačnému určení diagnózy. Největší histopatologické změny nacházíme nejčastěji v horním a středním koriu, kde prokazujeme okrsky perivaskulárního a intersticiálního lymfohistiocytárního infiltrátu, často s příměsí eozinofilů, s nekrobiotickými změnami vaziva s depozity mucinu (obr. 5). Klíčová je přítomnost histiocytů. Asi ve 25 % případů jsou nekrobioticky změněná vlákna kolagenu částečně palisádovitě obklopená histiocyty a infiltráty lymfocytů. Klinicky i histopatologicky podobná jednotka, anulární elastolytický velkobuněčný granulom, neobsahuje depozita mucinu, pro elastolýzu a elastofagocytózu ani elastické vazivo, není přítomna výraznější nekrobióza vaziva. Intersticiální zánět s mucinem může někdy provázet systémová onemocnění pojiva, sklerodermii i jiná onemocnění. V případě podkožní formy GA jsou většinou přítomny palisádovitě uspořádané granulomy vyskytující se v hlubokém koriu nebo podkožním tuku. U perforující formy je přítomen povrchový histiocytární infiltrát s transepidermální eliminací degenerovaných kolagenních vláken [2]. Imunohistochemickou analýzou byl v ložiscích GA specificky i senzitivně na histiocytech detekován receptor CD68/PGM1, dále byl pravidelně, avšak v menší míře, detekován receptor CD68/KP-1. Tyto receptory jsou obdobně přítomny na histiocytech i u dalších granulomatózních onemocnění. Exprese molekuly PGM1, která je součástí receptoru CD68, je považována za nejspecifičtější znak histiocytů v celé monocyto-makrofágové řadě (ve srovnání např. s MAC-387, KP-1, Ki-M1P) a pomáhá například rozlišit hlubokou formu GA od epiteloidního sarkomu. V případě klasického GA v T-lymfocytárním infiltrátu převažují CD4+ lymfocyty nad CD8+ lymfocyty (všechny jsou CD3+). Kožní granulomy bez infekčního podkladu se u dětí i dospělých s humorálním i buněčným imunodeficitem vyskytují velmi zřídka. V případech klinicky atypických projevů GA, které nejsou asociovány s primární imunodeficiencí, převažují v granulomech infiltráty CD8+ lymfocytů, stejně jako u pacientů s HIV, kteří mají nízkou hladinu CD4+ lymfocytů v periferním krevním diferenciálním rozpočtu. I u HIV pozitivních pacientů má GA atypický klinický obraz [30]. Je však otázka, nakolik jsou klinicky typické projevy GA etiologicky závislé na CD4+ lymfocytech, a vůbec lymfocytech, když u myší bez thymu vedla produkce monokinů, např. interleukinu-1 a tumor necrosis faktoru tkáňovými makrofágy, k tvorbě kožních granulomatózních ložisek [11].
Obr. 5 a. Nekrobiotický granulom – okrsek koria se setřelou strukturou kolagenních snopců obklopený zánětlivým infiltrátem (HE 100 x) 
Obr. 5 b. Detail nekrobiotického granulomu (HE 200 x) se zánětlivým lemem z epiteloidních histiocytů s naznačeně palisádovitým uspořádáním s nevýraznými infiltráty lymfocytů (doc. MUDr. Pock, CSc.) 
DIFERENCIÁLNÍ DIAGNOSTIKA
Zahrnuje lichen planus, tineu, mycosis fungoides, anulární elastolytický velkobuněčný granulom. Papulární projevy GA mohou dále napodobovat hmyzí bodnutí, syfilis, xantomy, non-X-histiocytózy (např. eruptivní histiocytom), lupus vulgaris. Erytémová forma GA napodobuje erythema anulare centrifugum, erythema anulare rheumaticum, erythema gyratum a další onemocnění ze skupiny anulárních erytémů. Podkožní forma GA může klinicky napodobovat revmatoidní uzly, noduly při revmatické horečce, epiteloidní sarkom, podkožní formu sarkoidózy a hluboké granulomatózní infekce. Perforující forma GA musí být odlišena od perforující kolagenózy, perforující folikulitidy, morbus Kyrle (hyperkeratosis follicularis et parafollicularis in cutem penetrans), elastosis perforans serpiginosa, keratoakantomu a pityriasis lichenoides et varioliformis acuta [2].
TERAPIE
Chybí větší studie, které by srovnávaly účinnost jednotlivých terapeutických postupů. Výsledky studií mohou být vždy zkresleny i skutečností, že lokalizované GA většinou spontánně odezní v průběhu 2 let a GGA, u kterého je nejčastěji volena systémová terapie, může, i když s mnohem menší pravděpodobností než lokalizovaná forma GA, také ustoupit spontánně. Relativním úskalím lokální a především systémové terapie GA je benignost onemocnění. Při srovnávání poměru rizika léčby k benefitu léčby je vždy nutno pamatovat, že indikace terapie bude při výskytu nežádoucích účinků vždy snadno zpochybněna. Některá pracoviště proto zdůrazňují podpis zevrubného informovaného souhlasu před zahájením léčby [21]. Dalším terapeutickým problémem GGA jsou časté relapsy po ukončení léčby, které mohou být způsobeny přetrváváním histopatologických změn po vymizení klinických projevů [28]. Mnoho pacientů s GGA vystřídá pro neefektivitu několik typů systémové léčby.
Lokální terapie
V lokální terapii se jako lék první volby vždy zmiňují topicky aplikované středně silné a silné kortikosteroidy, v posledních letech se používá i takrolimus. Kazuistiky zabývající se terapií GA takrolimem popisují zhojení výsevů následované remisí až nulový efekt této terapie. Terapeuticky takrolimus působí především na zánětlivé buňky. Mechanismus účinku u GA není přesně znám, může se uplatňovat primární inhibice tvorby interleukinu 2 a sekundární inhibice tvorby interferonu, které jsou v granulomatózní tkáni nalézány ve velkém množství. Jedním z hlavních mechanismů účinku takrolimu je jeho supresivní efekt na aktivaci různých cytokiny kódujících genů. Takrolimus tak indukuje protizánětlivé a imunomodulační účinky supresí tvorby granulomatózních infiltrátů včetně redukce chemotaktické aktivity fibroblastů a inhibice syntézy kolagenu [13]. Jsou popsány i kazuistiky zhojení GA terapií lokálními kortikosteroidy, zahájené po neefektivní terapii takrolimem.
Používají se intralezionálně aplikované kortikosteroidy, např. triamcinolon v nejvyšší koncentraci 5 mg/ml. Proběhla také studie, ve které byl intralezionálně aplikován interferon γ v dávce 2,5 x 105 IU/ložisko v sedmi po sobě jdoucích dnech s následnou aplikací 3krát týdně po dobu dalších dvou týdnů [32].
Ložiska GA lze kryalizovat, ošetřovat laserem, kazuistiky popisují vymizení projevů GA po probatorní excizi nebo poranění [18, 32].
Je popisováno použití fotodynamické terapie (s metyl aminolevulanátem i delta-aminolevulátem), kdy byl přibližně u 2/3 pacientů pozorován efekt po 2–3 sezeních [32].
Fototerapie
Při neefektivitě lokální terapie a v případě GGA je nečastěji volena PUVA terapie, v poslední době i UVA-1 fototerapie. Kazuistik i malých studií, zabývajících se efektivitou PUVA terapie na malém množství pacientů, je řada [15, 26, 27].
Při PUVA terapii je podáván metoxypsoralen v dávce až 1 mg/kg, terapie probíhá 2–4krát týdně, kompletního zhojení je dosaženo po desítkách sezení a kumulativní dávky se pohybují od 120 J/cm2 do 665 J/cm2, relapsy byly pozorovány po 3–20 měsících od ukončení PUVA terapie [15, 26]. Sporadicky je popisováno zhojení některých ložisek GGA při PUVA terapii jizvou. PUVA terapie je indikována i při selhání jiné systémové terapie GGA [27]. Používá se také koupelová PUVA (bath-PUVA) terapie s koupelí v 1 mg/l koncentrovaném roztoku metoxypsoralenu s následnou UVA iradiací a sprchou [1, 31].
Nověji je sledován efekt UVA-1 fototerapie využívající dlouhovlnné UVA-1 záření (340–400 nm) na přechodu spektra viditelného světla v ultrafialové záření. Dávky UVA-1 záření jsou proto o více než řád vyšší, než jsme zvyklí u širokospektré UVA fototerapie. UVA-1 fototerapie má podobný efekt na GA jako bath-PUVA terapie a lehce nižší efekt než PUVA terapie [28].
Pro časté relapsy, po 3 měsících od ukončení léčby, je vhodné pokračovat v udržovací fototerapii i po dosažení klinické remise. Časté relapsy mohou být vysvětleny přetrváváním histopatologických změn při klinickém vyhojení ložisek. Ve studii s 20 pacienty léčených UVA-1 fototerapií byly u 10 pacientů provedeny biopsie z oblasti přiléhající k projevu GA před zahájením léčby a po jejím ukončení. U 8 pacientů byly po ukončení léčby stále zjistitelné histopatologické změny odpovídající GA (z tohoto počtu pacientů byli 3 pacienti s podstatným zlepšením a 2 kompletně zhojení pacienti), u dalších 2 pacientů přetrvávaly histopatologické změny odpovídající nespecifickým zánětlivým změnám. Následně bylo sledováno 9 z 10 pacientů vykazujících podstatné zlepšení nebo zhojení. Dva pacienti byli zhojeni po 3 i 6 měsících, zatímco u 7 zbylých pacientů došlo k relapsu po mediánu 3 měsíců [28].
Hlavními akutními nežádoucími účinky fototerapie jsou zarudnutí, pigmentace, vyvolání polymorfní světelné erupce nebo jiné fotodermatózy. Hlavním chronickým nežádoucím účinkem je fotoaging a rozvoj kožních nádorů. UVA-1 fototerapie působí, stejně jako PUVA a UVB fototerapie, hlavně indukcí apoptózy [28].
Allopurinol
Jsou publikovány kazuistiky terapie GGA allopurinolem. Allopurinol byl podáván v úvodní dávce 300 mg/den, později byla navýšena na 600 mg/den. V řádu týdnů byl pozorován zřetelný klinický efekt. U všech pacientů byla dosažena téměř kompletní remise. Po vysazení terapie došlo v řádu měsíců u jedné pacientky k relapsu, po opětovném nasazení allopurinolu došlo již jen k částečné regresi projevů. Allopurinol byl úspěšně použit i při léčbě granulomatózních onemocnění jako sarkoidóza, leishmanióza, trypanozomiáza, reakcí na polymetylmetakrylátové výplně. Mechanismus, jakým allopurinol inhibuje tvorbu granulomů, není jasný. Mizuno usuzuje, že tento lék může blokovat tvorbu granulomů down regulací intercelulární adhezivní molekuly-1 (ICAM-1) a exprese receptorů P2X7 monocytů, které se účastní adheze a fúze při tvorbě mnohojaderných obrovských buněk [21].
Doxycyklin
Jsou popsány kazuistiky úspěšné terapie GGA doxycyklinem. Doxycyklin se při terapii GGA používá v dávce 100 mg/den po dobu až 10 týdnů. Tetracykliny jsou širokospektrá antibiotika, která ovlivňují syntézu proteinů, zánětlivou reakci, mají imunomodulační účinky, ovlivňují buněčnou proliferaci a angiogenezi, dokonce i v subantibiotických koncentracích. Tetracykliny inhibují in vitro formování granulomů vyvolaných monocyty exponovanými kapičkám dextrinu. Usuzuje se, že tento účinek je vyvolán inhibicí proteinové kinázy C a tkáňových metaloproteáz, které se podílejí na průběhu zánětlivé reakce, hojení ran i angiogenezi. Kromě toho minocyklin inhibuje in vitro T-buněčnou proliferaci. A incyklinid, chemicky modifikovaný doxycyklin, bez antibiotické aktivity, ale se zvýrazněným protizánětlivým účinkem, prokázal aktivitu v supresi tkáňových metaloproteáz. Dalším důvodem, proč zvažovat terapii doxycyklinem, je i možná borreliová etiologie GA [8]. Vhodná je při terapii kontrola jaterních transamináz.
Retinoidy (isotretinoin, etretinát)
V léčbě GGA je možné využít isotretinoin v dávce 40 mg/den (0,5 mg/kg) až 70 mg/den (1 mg/kg), v řádu měsíců došlo k úplnému zhojení projevů GA následovanému několika měsíční remisí [36]. Účinná je také kombinace isotretinoinu s fototerapií. Obdobné výsledky v léčbě GGA systémovými retinoidy byly popsány i při použití etretinátu. Předpokládají se dva mechanismy účinku systémových retinoidů při terapii GA, snížení mechanismů buněčné imunity, tedy přímý imunomodulační efekt, a inhibice proliferace fibroblastů a z toho vyplývající inhibice syntézy kolagenu [5, 36]. Vhodné jsou pravidelné kontroly lipidogramu a jaterních transamináz.
Cyklosporin A
U některých pacientů může být účinná systémová terapie cyklosporinem A v dávce 3 mg/kg/den, projevy GGA mohou vymizet v průběhu několika měsíců, po vysazení cyklosporinu A může následovat několikaměsíční remise. Nejdůležitějším mechanismem účinku cyklosporinu A, supresoru buněčné imunity, je inhibice produkce lymfokinů (primárně interleukinu-2) aktivovanými Th (pomocnými) lymfocyty. Teoreticky by se tedy cyklosporin A jevil jako ideální lék k terapii GGA. Tvorba granulomatózních ložisek však může být nezávislá na T-lymfocytech, kdy u myší bez thymu vedla produkce monokinů, např. interleukinu-1 a tumor necrosis faktoru tkáňovými makrofágy, k tvorbě kožních granulomatózních ložisek. Je otázkou, zda má cyklosporin A efekt i na supresi produkce monokinů [11]. Vhodné jsou pravidelné kontroly krevního tlaku a renálních parametrů, vhodné je i monitorování hladiny cyklosporinu A.
Antimalarika (hydroxychloroquin, chloroquin)
Jsou popsány soubory pacientů s GGA úspěšně léčených antimalarikem hydroxychloroquinem v dávce 9 mg/kg/den po dobu prvních 2 měsíců, následně byla dávka snížena na 6 mg/kg/den. Po 15 dnech až 1 měsíci byl patrný efekt terapie, kompletní remise bylo dosaženo po 6–7 týdnech, k relapsu nedošlo v následujících 9 měsících. In vitro v RAW 264.7 makrofázích stimulovaných lipopolysacharidy byla prokázána specifická inhibiční aktivita chloroquinu na syntézu tumor necrosis factoru (TNF). Dále mohou chloroquin a hydroxychloroquin různými způsoby inhibovat kolagenázy [6]. Antimalarika rovněž stabilizují membrány lysozomů, inhibují prezentaci antigenu a buňkami zprostředkovanou cytotoxicitu, inhibují syntézu prostaglandinů, inhibují peroxidaci lipidů a inhibují, nebo indukují apoptózu [34]. Pro riziko retinopatie je vhodné oftalmologické vyšetření před zahájením terapie antimalariky, oftalmologické kontroly je vhodné nejméně jedenkrát ročně opakovat. Dále jsou vhodné pravidelné kontroly krevního obrazu.
Sulfony (dapson)
Jsou popsány kazuistiky pacientů s GGA úspěšně léčených dapsonem, podává se v dávce až 200 mg/den. Czarnecki podával šesti pacientům dapson v optimální dávce 100 mg/den, remise bylo dosaženo za čtyři týdny až tři měsíce od zahájení terapie, po vysazení dapsonu došlo k relapsu GGA u dvou pacientů. Po opětovném nasazení dapsonu došlo opět do tří měsíců k remisi projevů GA. Nejvážnějším nežádoucím účinkem je při terapii dapsonem vznik anémie a methemoglobinémie. K hemolytické anémii dochází u pacientů s deficitem glukóza 6-fosfát dehydrogenázy. Naproti tomu aplastická anémie je sice raritní, ale nejčastější příčinou úmrtí na komplikace léčby dapsonem. Předpokládá se, že protizánětlivý účinek dapsonu je způsoben blokádou myeloperoxidázy [3, 7, 35]. Vhodné jsou pravidelné kontroly krevního obrazu a methemoglobinémie.
Metotrexát
Jsou popisovány kazuistiky terapie GGA metotrexátem, podává se v dávce 15 mg týdně, v dalším dni je podána kyselina listová. Zhojení GGA je popisováno v řádu týdnů (6 týdnů), po vysazení terapie dochází v řádech týdnů (4 týdny) k relapsům, opětovné nasazení metotrexátu mělo efekt, po vysazení došlo opět k relapsu. Tradičně je metotrexát považován za antiproliferační lék pro inhibici dihydrofolát reduktázy a syntézy nukleotidů, ale klinický efekt lze u GA přičíst jeho protizánětlivým vlastnostem. Polyglutamátové deriváty metotrexátu jsou metabolity metotrexátu s dlouhým biologickým poločasem, které inhibují enzym nutný k syntéze purinů: 5-aminoimidazol-4-karboxamid ribonukleotid (AICAR) transformylázu. Zvýšené hladiny AICAR vedou ke zvýšeným hladinám intra a extracelulárního adenosinu, zvýšené hladiny extracelulárního adenosinu vykazují supresi aktivace T-lymfocytů, snižují expresi adhezivních molekul nutných k migraci zánětlivých buněk a mezibuněčným interakcím, inhibují uvolnění prozánětlivých cytokinů z monocytů a makrofágů a inhibují neutrofilní a monocytové oxidační účinky. Všemi těmito mechanismy může metotrexát účinně snižovat granulomatózní zánět při GA [23]. Vhodné jsou pravidelné kontroly krevního obrazu a jaterních transamináz.
Nikotinamid (vitamin B3)
Byl kazuisticky s efektem podáván v dávce až 1 500 mg/den. Úvodní dávka byla 200 mg nikotinamidu perorálně 2krát denně, po dvou měsících byla zvýšena na 500 mg 3krát denně a v této dávce byl nikotinamid podáván po dobu jednoho roku. Remise GGA bylo dosaženo po 9 měsících terapie. Po celkem 14 měsících terapie byla dávka nikotinamidu snížena na 900 mg/den a po dalších třech měsících došlo k relapsu GGA. Opětovné remise GGA bylo dosaženo po dalších dvou měsících terapie opětovně zvýšenou dávkou nikotinamidu na 1 500 mg/den. Nikotinamid, v odpovídající koncentraci, je potentním supresorem antigenně a mitogenně indukované transformace lymfocytů, dále mimo jiné inhibuje sérovou fosfodiesterázu a následně i cyklický adenosinmonofosfát. Nikotinamid byl v minulosti podáván při léčbě schizofrenie v dávce 3–12 gramů na den. Při dávkách překračujících 8 gramů na den se projevují gastrointestinální nežádoucí účinky, bolesti hlavy a flu-like syndrom. Výskyt hepatotoxických reakcí je nízký [19].
Kalcitriol (1,25 dihydroxycholekalciferol, vitamin D3)
Byla publikována kazuistika efektivní terapie GGA kalcitriolem v dávce 0,25 μg/den. Po třech měsících terapie došlo k regresi původních projevů GGA a nedocházelo k dalším výsevům GA. Kalcitriol zvyšuje gastrointestinální absorpci vápníku, snižuje renální exkreci vápníku a stimuluje resorpci vápníku z kostí osteoklasty. Po expozici kalcipotriolu, analogu kalcitriolu, je popsáno snížení bakteriálním superantigenem indukované proliferace lidských lymfocytů, přiměřeně snížena byla i tvorba TNF-α, IL-2 a INF-γ. Při terapii kalcitriolem je vhodné monitorování kalcémie [4].
Inhibitory 5-lipooxygenázy (zileuton) a vitamin E
Jsou popsány kazuistiky úspěšné terapie GGA kombinací vitaminu E v dávce 400 IU/den a zileutonu v dávce 600 mg 4krát denně. Po vysazení trvala remise v řádu měsíců. Zileuton je inhibitor 5-lipooxygenázy, původně se používal k terapii bronchiálního astmatu, má široké protizánětlivé a imunomodulační účinky při minimálních nežádoucích účincích, jen se 3–4% incidencí se objevuje elevace aspartát aminotransferázy (u 2 % léčených pacientů proti 0,2 % pacientů léčených placebem), která vyžaduje ukončení terapie. Zileutonem navozená inhibice 5-lipooxygenázy snižuje transaktivaci nukleárního faktoru kB (NF-κB), která je indukována TNF-α. Transaktivace NF-κB je dominatním mechanismem, kterým TNF-a indukuje tvorbu dalších cytokinů, stejně jako bioaktivních lipidů a COX-2 genovou expresi. Inhibice 5-lipooxygenázy také snižuje produkci leukotrienu B4 (LTB4) a cysteinylových lekotrienů (LTC4, LTD4 a LTE4). Alfa-tokoferol, vitamin E, snižuje uvolňování IL-1β a IL-18 z monocytů, jejichž množství jsou zvýšená ve tkáni s projevy GA [29].
Estery kyseliny fumarové (FAE)
V letech 2005–2007 probíhala studie, ve které bylo léčeno osm pacientů s GGA; byla podávána jen třetina až šestina dávky FAE používané k léčbě psoriázy. U šesti z osmi pacientů bylo zaznamenáno klinické zlepšení projevů GA. Nejčastějšími nežádoucími účinky při léčbě FAE jsou zarudnutí kůže, gastrointestinální obtíže a relativní lymfopenie, vážná lymfopenie vyžaduje přerušení terapie. Přesný mechanismus účinku FAE zůstává nejasný. Léčba FAE suprimuje s Th-1 buňkami asociované cytosiny, jako interleukin-12 a interferon-γ, a podporuje syntézu Th-2 cytokinů jako interleukiny 4, 5, nebo 10 (IL-4, IL-5, IL-10). Také inhibuje NF-κB translokaci a indukuje fenomén apoptózy [33]. Léčba estery kyseliny fumarové není v České republice dostupná.
Defibrotide
Byl s efektem použit kazuisticky v dávce 400 mg/den intramuskulárně při terapii GGA. Po 30 dnech byla pozorována regrese výsevů GGA a dávka defibrotidu byla redukována na 200 mg/den intramuskulárně. Po celkem 90 dnech intramuskulární aplikace defibrotidu bylo dosaženo remise GGA, pacientovi byl dále podáván defibrotide perorálně v dávce 400 mg/den po dobu 7 měsíců. Defibrotide je sodná sůl komplexní směsi jednovláknových oligodeoxyribonukleotidů z DNA prasečí sliznice. Používá se k prevenci hluboké žilní trombozy, k léčbě tromboflebitidy, při postižení periferních cév. Fibrinolytické účinky jsou mimo jiné způsobeny redukcí hladiny inhibitoru aktivátoru plazminogenu. Působí protiischemicky inhibicí adheze neutrofilů k endoteliálním buňkám, podporuje tvorbu prostacyklinu a oxidu dusného endotelem, které se podílejí na udržování endoteliální glykosaminoglykanové vrstvy i na deaktivací trombocytů [25]. V České republice není dostupný.
Pentoxyfilin
Kazuisticky bylo po čtyřech týdnech terapie pentoxyfilinem dosaženo remise u pacienta s 10 let trvajícími výsevy GA. Pentoxyfilin je většinou podáván v dávce 400 mg 2–3krát denně. Pentoxyfilin je reologikum a vazodilatans, snižuje agregaci trombocytů i erytrocytů, hladinu fibrinogenu, adhezi neutrofilů k endotelu [32].
Chlorambucil
Je popsána léčba nízce dávkovaným chlorambucilem pro GGA u šesti pacientů. Chlorambucil byl podáván 2krát denně v dávce po 2 mg (4 mg/den), uspokojivý klinický efekt byl pozorován u čtyř pacientů po 12 týdnech terapie, chlorambucil byl pro GGA nejdéle podáván po dobu 10 měsíců. Delší než dvanáctitýdenní terapie není vhodná pro myelotoxické nežádoucí účinky chlorambucilu. Chlorambucil je bifunkční alkylační cytostatikum, v případě léčby GA se uplatňují jeho široké protizánětlivé účinky, kdy může snižovat opožděnou hypersenzitivní reakci a funkce T-lymfocytů. Při terapii chlorambucilem jsou vhodné pravidelné kontroly krevního obrazu a krevního diferenciálu [16].
Biologická léčba
Objevují se i kazuistiky používající biologickou léčbu buď přímo pro GGA, nebo z jiné indikace, u pacienta se současným výskytem GGA.
Infliximab je chimérická monoklonální protilátka, která s vysokou afinitou váže TNF-α. Vysoké titry TNF-α jsou nalézány v kůži postižené GA, stejně jako v séru těchto pacientů. Infliximab byl použit k terapii GGA u 62leté ženy se současnou anamnézou Sjögrenova syndromu a osteoporózy. Infliximab byl podáván intravenózně v dávce 5 mg/kg v týdnu 0., 2. a 6. a dále v měsíčních intervalech po dalších 10 měsíců. V osmém týdnu došlo k rychlému a zřetelnému hojení většiny ložisek GA, které dále pokračovalo. Po deseti týdnech terapie přetrvával jen zbytkový erytém a hyperpigmentace. Remise pokračovala po dobu čtyřiceti měsíců od přerušení terapie [22]. Infliximab byl použit i k léčbě GGA 51leté ženy s anamnézou ileokolické Crohnovy nemoci. Pro Crohnovu nemoc bylo podáno celkem pět infuzí infliximabu v dávce 5 mg/kg. V průběhu léčby se GGA zhojilo, následně došlo k opětovnému výsevu GGA při selhání léčby Crohnovy nemoci. V roce 2008 byla proto zahájena léčba adalimumabem, která indukovala dlouhodobou remisi Crohnovy nemoci a zároveň došlo po šesti měsících léčby k výraznému zlepšení GA [10]. Léčba adalimumabem byla popsána i v kazuistice léčby GGA u 50leté ženy, dávkování bylo stejné jako při terapii psoriázy, po úvodní dávce 2 x 40 mg následovalo podání 40 mg každé dva týdny. Zlepšení bylo patrné po prvním týdnu, terapie pokračovala po dobu dalších šesti týdnů až do úplného zhojení. Terapie adalimumabem byla ještě podávána po dobu dalšího měsíce a pak byla ukončena. Po dalších dvou měsících byla pacientka stále v remisi. Předpokládá se, že anti-TNF-α protilátky – infliximab a adalimumab – neutralizují solubilní, membránově vázaný TNF-α a zprostředkovávají cytolýzu cílových buněk nesoucích TNF-receptor, tedy i granulomů [17]. Dále jsou publikovány kazuistiky terapie GGA anti-TNF-α protilátkou etanerceptem nebo na CD11a receptor leukocytů se vázajícím efalizumabem.
Na druhou stranu byla v roce 2009 publikována řecká studie popisující v letech 2000–2009 výsevy GA u 10 pacientů z 252 pacientů léčených biologiky pro revmatoidní artritidu. Tři pacienti byli léčení infliximabem, šest pacientů bylo léčeno adalimumabem a jeden pacient byl léčen etanerceptem. Dále byl zaznamenán výskyt GA u 1 pacienta ze 183 pacientů léčených biologiky pro spondylartritidu. Dva pacienti s GA přerušili terapii anti-TNF pro závažnost projevů GA a dobře reagovali na terapii lokálními kortikosteroidy. Není ovšem jasné, jaká je incidence GA u pacientů s revmatoidní artritidou a spondylartritidou [9].
Systémová terapie pacientů hospitalizovaných na kožním oddělení FN Ostrava s diagnózou generalizované formy GA v letech 2005–2011
V letech 2005–2011 bylo na kožním oddělení FN Ostrava hospitalizováno 15 pacientů (4 muži, 11 žen) s generalizovanou formou granuloma anulare (tab. 1). Většina pacientů měla v době prvních projevů GGA mezi 60 a 70 lety (od 26 let do 71 let). Diabetes mellitus měli 4 pacienti. Sérologie lymeské borreliózy byla vyšetřena u 4 pacientů, z nichž jeden měl pozitivní protilátky proti borreliím, třítýdenní léčba doxycyklinem v dávce 200 mg/den u něj neovlivnila projevy GGA. Pacienti byli sledováni od 12 měsíců do 7 let, doba trvání GGA byla od 2 po 12 let. Všichni pacienti byli v úvodu neúspěšně léčeni středně silnými a silnými lokálními kortikosteroidy, takrolimus nebyl v lokální léčbě použit u žádného pacienta. Jen jeden druh terapie byl použit u šesti pacientů, vždy se jednalo o nějaký typ fototerapie. Zbývajících devět pacientů mělo více než jeden druh terapie. K remisi projevů GGA trvající minimálně po dobu terapie došlo u osmi pacientů z patnácti. Z těchto pacientů byli dva pacienti léčeni UVA fototerapií, dva pacienti byli léčeni PUVA terapií, jeden pacient byl léčen úzkospektrou UVB fototerapií 311 nm (Nb-UVB), jedna pacientka byla v remisi po dobu 24 měsíců od ukončení PUVA terapie, následně přestala docházet na kontroly. U zbývajících čtyř pacientů došlo po ukončení fototerapie prokazatelně k exacerbaci projevů GA. Dále byl jeden pacient účinně léčen systémovými kortikosteroidy (prednisonem v dávce 5 mg obden, úvodem byly parenterálně aplikovány pulzy metylprednisolonu). Jeden pacient byl účinně léčen hydroxychloroquinem (v dávce 200 mg/den, úvodem v dávce dávce 400 mg/den). Dva pacienti byli účinně léčeni kombinovanou terapií dapsonem (v dávce 25 mg/den, úvodem v dávce 50 a 100 mg/den) s metylprednisolonem (v dávce 4 mg obden, úvodem v dávce 0,25 mg/kg). I u těchto pacientů došlo, s menší intenzitou, k relapsu výsevů GA po ukončení systémové terapie.
Tab. 1. Celková terapie pacientů hospitalizovaných na kožním oddělení FN Ostrava s diagnózou generalizovaného GA v letech 2005–2011 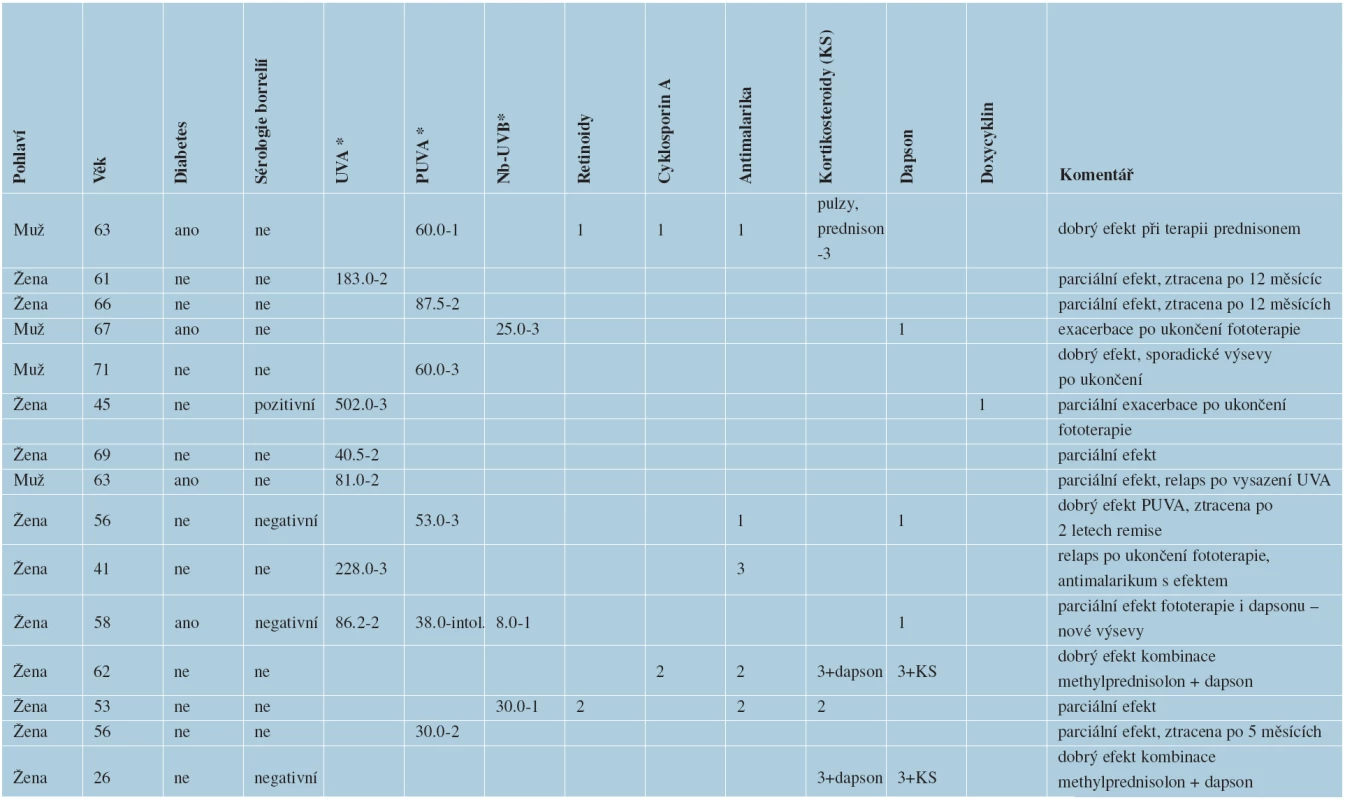
1 – znamená malou účinnost terapie 2 – znamená regresi stávajících projevů a současně nové výsevy granuloma anulare 3 – znamená remisi onemocnění při terapii * vyjádřeno v J/cm2 ZÁVĚR
Systémová terapie GGA je svízelná, nelze jednoznačně označit nějaký druh terapie jako nejúčinnější. Vždy je nutné brát v úvahu i možnost spontánní remise GGA a benignost onemocnění. Pacienti, kteří se i přesto rozhodnou pro systémovou terapii GGA, mají počítat s možnou neúčinnosti zvolené terapie, s dlouhodobější terapií a s velkou pravděpodobností relapsu onemocnění po vysazení terapie.
Hlavním klíčem k výběru systémové terapie GGA jsou komorbidity pacienta, aby dlouhodobější léčbou GGA nedocházelo ke zhoršování průběhu ostatních přidružených onemocnění. V neposlední řadě jsou podstatné i možnosti pacienta docházet dlouhodobě na plánované kontroly, případně na fototerapii.
U pacientů s GGA je vhodné i vyšetření sérologie lymeské boreliózy metodou western blot a přeléčení případného pozitivního nálezu antibiotiky. U pacientů s atypickým klinickým obrazem GA je vhodné vyloučení paraneoplastické a infekční etiologie.
Do redakce došlo 21. 11. 2013.
Adresa pro korespondenci:
MUDr. Jaroslav Pavlas
Kožní oddělení FN Ostrava
17. listopadu 1790
708 52 Ostrava
e-mail: jaroslav.pavlas@centrum.cz
Zdroje
1. BATCHELOR, R., CLARK, S. Clearance of Generalized Papular Umbilicated GA in a Child with Bath PUVA Therapy. Pediatric Dermatology, 2006, 23, p. 72–74.
2. BOLOGNIA, J. L., JORIZZO, J. L., RONALD, P. R. Dermatology. Volume two, 2003, p. 1460–1463.
3. BORRÁS-BLASCO, J., CONESA-GARCIA, V. et al. Dapsone: First Report of Pure Red Cell Aplasia in an Eldlery Patient: Case Report. Adis Data Infromation BV. Case Reports, Reactions, 18 Jun 2005, No 1056, p. 8.
4. BOYD, A. S. Granuloma annulare responsive to oral calcitriol. International Journal of Dermatology, 2012, 51, p. 120–122.
5. BUENÍA-EISMAN, A., RUIZ-VILLAVERDE, R., BLASCO-MEGUIZO, J., SERRANO-ORTEGA, S. Generalized annular granuloma: response to isotretinoin. International Journal of Dermatology, 2003, 42, p. 318–322.
6. CANNISTRACI, C., LESNONI LA PAROLA, I., FALCHI, M. Treatment of Generalized Granuloma annulare with Hydroxychloroquine. Dermatology, 2005, 211, p. 167–168.
7. CZARNECKI, D. B., GIN, D. The response of generalized granuloma annulare to dapsone. Acta Derm. Venerol., 66, 1986, p. 82–84.
8. DUARTE, A. F., MOTA, A. Generalized granuloma annulare – response to doxycykline. JEADV, 2009, 23, p. 84–85, Journal compilation.
9. EXARCHOU, S. A., LOULGARI, P. V., MARKATSELI, T. E., ZIOGA, A., DROSSOS, A. A., Immune-mediated skin lesions in patiens treated with anti-tumor necrosis factor alpha inhibitors. Scand. J. Rheumatol., 2009, 38, p. 328–331.
10. FANNING, S. B., CHAPMAN, G.,YAU, Y., LEONG, R. W. Gastrointestinal: Improvement of GA with anti-tumor necrobiosis factor alpha therapy for Crohn’s dinase. Journal of Gastroenterology and Hepatology, 2010, 25, p. 215.
11. FIALLO, P. Cyclosporin for the treatment of granuloma annulare. British Journal of Dermatology, 1998, 138, p. 357–373.
12. FRIGERIO, E., FRANCHI, C., GARUTTI, C., SPADINO, S., ALTOMARE, G. F. Multiple localized granuloma annulare: ultraviolet A1 phototherapy. Clinical and experimental Dermatology, 2007, 32, p. 749–764.
13. GRIECO, T., CANTISANI, C., FAINA, P., CANTORESI, F., IACOBELIS, F., SILVESTRI, E., FAINA, V., CALVIERI, S. Tacrolimus 0.1 % and granuloma annulare: descripiton of three cases. JEADV, 2009, 23, p. 1445–1446.
14. GUALCO, F., ZACCARIA, E. Interstitial granuloma annulare and borreliosis: a new case. JEADV, 2007, 21, p. 1107–1118.
15. KERKER, B. J., HUANG, C. P., MORISON, W. L. Photochemotherapy of generalized granuloma annulare. Arch. Dermatol., 1990, 126, p. 359–361.
16. KOSSARD, S., WINKELMANN, R. K., Low-Dose Chlorambucil in the Treatment of Generalized Granuloma annulare. Dermatologica, 1979, 158, p. 443–450.
17. KOZIC, H., WEBSTER, G. F. Treatment of Widespread Granuloma annulare with Adalimumab, a Case Report. Clinical and Aesthetic Dermatology, 2011, Vol. 4, No 11.
18. LEVIN, N. A., PATTERSON, J. W. et al. Resolution of patch-type granuloma annulare lesions after biopsy. Journal of the American Academy of Dermatology, Volume 46, Issue 3, March 2002, p. 426–429.
19. MA, A., MEDENICA, M. Response of Generalized Granuloma Annulare to High-Dose Niacinamide. Arch. Dermatol., 1983, Vol. 119, p. 836–839.
20. MANG, R., KRUTMANN, J. U. UVA-1 Phototherapy. Photodermatology, Photoimmunology and Photomedicine, 2005, 21, p. 103–108.
21. MAZZATENTA, C., GHILARDI, A., GRAZZINI, M. Treatment of disseminated granuloma annulare with allopurinol. Dermatologic therapy, 2010, 23, p. 24–27.
22. MURDACA, G., COLOMBO, B. M., BARABINO, G., CAITI M., CAGNATI, P., PUPPO, F. Anti-Tumor Necrosis Factor-alfa Treatment with Infliximab for Disseminate GA. Clin. Dermatol., 2010, 11 (6), p. 437–439.
23. PLOTNER, A. N., MUTASIM, D. F. Successful treatment of disseminated GA with methotrexate. British Journal of Dermatol., 2010, 163, p. 1123–1124.
24. ROMBOLD, S., LOBISCH, K., KATZER, K., GRAZZIOTIN, T. C., RING, J., EBERLEIN, B. Efficacy of UVA1 phototherapy in 230 patients with various skin diseases. Journal compilation, Photodermatology, Photoimmunology and Photomedicine, 2008, 24, p. 19–23.
25. RUBEGNI, P. et al. A case of disseminated granuloma annulare treated with defibrotide: complete clinical remission and progressive hair darkening. British Journal of Dermatology, 2003, 149, p. 437-438
26. SETTERFIELD, J., HUIGOL, S. C., BLACK, M. M. Generalized granuloma annulare successfully treated with PUVA. Clinical and experimental Dermatology, 1999, 24, p. 458–460.
27. SCHMUTZ, J. L. PUVA therapy of granuloma annulare. Clinical and Experimental Dermatology, 2000, 25, p. 451–453.
28. SCHNOPP, C., TZANEVA, S., MEMPEL, M., SCHULMEISTER, K., ABECK, D., TANEW, A. UVA1 phototherapy for disseminated granuloma annulare. Photodermatology, Photoimmunology and Photomedicine, 2005, 21, p. 68–71.
29. SMITH, K. J., NORWOOD, C., SKELTON, H. Treatment of disseminated granuloma annulare with 5-lipoxygenase inhibitor and vitamin E. British Journal of Dermatology, 2002, 146, p. 667–670.
30. STEFANAKI, K. et al. Histological and immunohistochemical study of granuloma annulare and subcutaneous granuloma annulare in children. Journal of Cutaneous Pathology, 2007, 34, p. 392–396.
31. SZEGEDI, A., BÉGÁNY, A., HUNYADI, J. Successful Treatment of Generalized Granuloma annulare with Polyethylene Sheet Bath PUVA. Acta Derm. Venerol., 1998, 79, Letters to the Editor.
32. THORNSBERRY, L. O., ENGLISH III, J. C. Etiology, Diagnosis, and Therapeutic Management of Granuloma Annulare: An Update. American Journal of Clinical Dermatology, 2013, 14, p. 279–290.
33. WEBER, O. H., BORELLF, C., RÖCKEN, M., SCHALLER, M. Treatment of Disseminated Granuloma Annulare with Low-dose Fumaric Acid. Acta Dermato-Venerologica, 2009, 89, p. 295–298.
34. WOZNIACKA, A., CARTER, A., MC CAULIDDE, D. P. Antimalarials in cutaneous lupus erythematosus: mechanism of therapeutic benefit. Lupus, 2002, 11, p. 71–80.
35. YAZDANYAR, S. et al. Dapsone, various toxicities: 10 case reports. Case reports. 2011 Adis Data information BV. Reactions, 5 Nov 2011, No 1376, p. 13.
36. YOUNG, H. S., COULSON, I. H. Granuloma annulare following waxing induced pseudofolliculitis – resolution with isotretinoin. Clinical and Experimental Dermatology, 2000, 25, p. 274–276.
37. ZIEMER, M. et al. Granuloma annulare – a manifestation of infection with Borrelia? Journal of Cutaneous Pathology, 2008, 35, p. 1050–1057.
Štítky
Dermatologie Dětská dermatologie
Článek vyšel v časopiseČesko-slovenská dermatologie
Nejčtenější tento týden
2013 Číslo 6- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Condylomata accuminata a jejich prevence i léčba
- Co s NSTI? NPWT!
- Isoprinosine nově bez indikačních a preskripčních omezení
- HydroCleanem efektivně hojíme onkologické rány po radioterapii
-
Všechny články tohoto čísla
- Granuloma anulare
- Doškolování lékařů – kontrolní test
- Prognostický význam osteoprotegerinu a osteopontinu u maligního melanomu
- Onemocnění ruka-noha-ústa
- Atrophodermia vermiculata u chlapce s Marfanovým syndromem
- Klinický případ: Bělavé makuly na zádech
- Symetrické léze – superficiální maligní melanomy s nízkými hodnotami ABCD skóre
- Soubor některých platných právních předpisů pro venerologii – část II.
- Celková léčba psoriázy u dětí
- Zápisnica zo zasadania výboru Slovenskej dermatovenerologickej spoločnosti
- Zápis ze schůze Výboru ČDS konané dne 17. října 2013
- Zápis ze schůze Výboru ČDS konané dne 21. listopadu 2013
- Některé poznatky ze 3. mezinárodní letní akademie praktické dermatologie
- 7. konference Akné a obličejové dermatózy
- Za prof. MUDr. Jiřím Záhejským, DrSc.
- Odborné akce v roce 2014
- Rejstřík
- Česko-slovenská dermatologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Granuloma anulare
- Onemocnění ruka-noha-ústa
- Symetrické léze – superficiální maligní melanomy s nízkými hodnotami ABCD skóre
- Klinický případ: Bělavé makuly na zádech
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



