-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
ENUKLEÁCIA PO STEREOTAKTICKEJ RÁDIOCHIRURGII U PACIENTOV S MALÍGNYM MELANÓMOM UVEY
Autoři: P. Zahorjanová 1; J. Sekáč 2; P. Babál 3; M. Štubňa 1
Působiště autorů: Očné oddelenie, FNsP Žilina, Primár: MUDr. Michal Štubňa, Ph. D. 1; Klinika Oftalmológie LF UK a UNB Ružinov, Prednosta: doc. MUDr. Vladimír Krásnik, Ph. D. 2; Ústav patologickej anatómie LF UK a UNB, Prednosta: prof. MUDr. Ľudovít Danihel, Ph. D. 3
Vyšlo v časopise: Čes. a slov. Oftal., 76, 2020, No. 1, p. 46-51
Kategorie: Původní práce
doi: https://doi.org/10.31348/2020/6Souhrn
Úvod: V minulosti bola enukleácia liečbou voľby u všetkých pacientov s malígnym melanómom uvey. V súčasnosti sa prednostne rozhodujeme pre bulbus zachovávajúce liečebné metódy, pokiaľ sa nejedná o nález veľkého tumoru alebo o slepé bolestivé oko. Väčšina pacientov je liečených rádioterapiou alebo lokálnou resekciou nádoru. Na Slovensku je jedinou možnosťou rádioterapia na lineárnom urýchľovači LINAC. Napriek tomu sa niektorí pacienti nevyhnú enukleácii následne po rádioterapii. Dôvodom bývajú postradiačné komplikácie, najmä neovaskulárny glaukóm, recidíva alebo progresia tumoru, a v niektorých prípadoch aj osobné rozhodnutie pacienta.
Materiál a metodika: Retrospektívna nerandomizovaná štúdia 168 očí u pacientov, ktorí podstúpili stereotaktickú rádiochirurgiu na lineárnom urýchľovači LINAC v rokoch 2007-2016. Dáta o postradiačných komplikáciách boli vyhodnocované na základe zdravotnej dokumentácie a dáta o enukleovaných bulboch na základe histopatologických nálezov.
Výsledky: Výskyt enukleácie po rádioterapii v našom súbore bol 17 % (28 pacientov), s mediánom časového obdobia od ožiarenia do enukleácie 21,5 mesiaca. Najčastejšou príčinou bol neovaskulárny glaukóm (82 %), ďalšie príčiny boli progresia tumoru (14 %) a osobné rozhodnutie pacienta (4 %). Na histopatologickom vyšetrení enukleovaných očí bol najčastejším nálezom vretenobunkový typ melanómu.
Diskusia: V prácach iných autorov je podobný výskyt a príčiny enukleácie po rádioterapii. Na základe histopatologických vyšetrení boli prítomné životaschopné melanómové bunky u pacientov, ktorí podstúpili enukleáciu pre recidívu tumoru, vo väčšom počte ako u tých, ktorí podstúpili enukleáciu z iných príčin. Enukleácia a jej pooperačný priebeh môžu byť náročnejšie u pacientov po rádioterapii v porovnaní s primárnou enukleáciou.
Záver: Starostlivosť o pacientov s malígnym melanómom uvey je náročná, a vyžaduje spoluprácu oftalmológa, onkológa, radiačného fyzika a patológa. Napriek snahe o zachovanie očného bulbu je aj po rádioterapii niekedy nutná enukleácia.
Klíčová slova:
malígny melanóm uvey – enukleácia – histopatologické nálezy
ÚVOD
Enukleácia bola v minulosti liečbou voľby prakticky u všetkých pacientov s malígnym melanómom uvey, keďže sa predpokladalo, že jedine tak je možné zabezpečiť prežívanie pacientov. Zmena nastala po veľkej randomizovanej multicentrickej štúdii Collaborative Ocular Melanoma Study, ktorá prebiehala v rokoch 1987-1998 v USA. Pacienti v štúdii boli rozdelení na základe veľkosti tumoru, pričom tí s melanómom strednej veľkosti boli rozdelení do dvoch skupín – jedna skupina absolvovala brachyterapiu, druhá enukleáciu. Preukázalo sa, že medzi prežívaním týchto dvoch skupín pacientov nebol signifikantný rozdiel [1,3,4,6,8,14].
V súčasnosti je trendom v liečbe melanómu uvey rádioterapia. V zahraničí sa praktizuje aj lokálna resekcia nádoru, prípadne v kombinácii s rádioterapiou. Enukleácia ako primárna liečba sa volí u pacientov s veľkými tumormi, s extrasklerálnym šírením alebo s doloróznym, slepým okom [5,10,17,19]. V Collaborative Ocular Melanoma Study sa pacienti s veľkými melanómami randomizovali do dvoch skupín, pričom v jednej z nich podstúpili pred enukleáciou externú rádioterapiu, a v druhej nie. Po štatistickom vyhodnotení nebol rozdiel v prežívaní medzi týmito dvomi skupinami, preto sa na základe tejto štúdie neoadjuvantná externá rádioterapia pred enukleáciou nedoporučuje [15]. Na základe nerandomizovanej prospektívnej štúdie Kilic et al., ktorá zahŕňala 167 pacientov, však bolo prežívanie pacientov, ktorí absolvovali externú rádioterapiu pred enukleáciou, lepšie ako u pacientov, ktorí podstúpili len enukleáciu [18].
Enukleované bulby sú následne histopatologicky zhodnotené, pričom nález po primárnej enukleácii sa čiastočne odlišuje od predtým ožiarených očí. U každého tumoru sa vyšetruje typ buniek, pričom sa rozlišuje na vretenobunkový typ A a B, epiteloidný typ, zmiešaný typ a nekrotický typ. Vretenobunkový typ A sa typicky vystytuje u névov chorioidey. Prítomnosť vretenovitých buniek v melanóme svedčí pre lepšiu prognózu. Epiteloidný typ morfologicky pripomína bunky epitelu. Ich nález svedčí pre horšiu prognózu, pričom býva asociovaný aj s ďalšími nepriaznivými prognostickými faktormi, ako je monozómia 3. chromozómu. Ak sú prítomné vretenovité aj epiteloidné bunky v rôznom pomere, jedná sa o zmiešaný typ melanómu. Nekrotický typ obsahuje miesta nekrózy, ktoré môžu zapríčiniť sekundárnu zápalovú reakciu. Jeho prognóza je podobná ako epiteloidného typu.
Medzi ďalšie negatívne prognostické faktory určené histopatologickým vyšetrením patria veľké jadierka, väčší počet mitóz a niektoré typy extravaskulárnej matrix, ako je prítomnosť kľučiek a sietí.
Ďalšie prognostické faktory sa určujú imunohistochemickým vyšetrením. Mikrovaskulárna denzita ako dôkaz výraznejšej vaskularizácie je asociovaná s vyšším rizikom metastáz, rovnako ako vyšší počet makrofágov a lymfocytov vo vyšetrovanej vzorke [16,20,25]. Medzi antigény bunkovej proliferácie svedčiace o horšej prognóze patrí PCNA (proliferating cell nuclear antigen) a Ki-67 antigén [24].
Medzi príčiny enukleácie po ožiarení patrí neovaskulárny glaukóm, ktorý býva liečbou ťažko zvládnuteľný a etiopatogeneticky súvisí s ischémiou predného segmentu alebo sietnice. Ďalšími sú recidíva alebo progresia tumoru aj po ožiarení, a osobné rozhodnutie pacienta pre jeho strach z ochorenia [7,9,11,13,23].
Pri histopatologickom vyšetrení očí enukleovaných po rádioterapii nachádzame vo všeobecnosti viac nekrotických miest a mikrovaskulárna denzita je menšia, pre rádiosenzitivitu ciev. Z buniek tu nachádzame viac epiteloidných, čo je prekvapujúce, keďže epiteloidné bunky sa pokladajú za rádiosenzitívnejšie. V tumoroch po ožiarení sú často prítomné aj viabilné melanómové bunky. Typickým nálezom je obliterácia krvných ciev a degeneratívne zmeny, ako je prítomnosť balónovitých buniek [1].
MATERIÁL A METODIKA
Retrospektívne sme analyzovali súbor 168 očí u pacientov s malígnym melanómom chorioidey alebo corpus ciliare, ktorí podstúpili stereotaktickú rádiochirurgiu na Onkologickom ústave Sv. Alžbety v Bratislave v spolupráci s Klinikou oftalmológie LF UK a UNB Ružinov v rokoch 2007-2016. Sledovacie obdobie bolo 13-122 mesiacov. Prehliadali sme zdravotnú dokumentáciu pacientov, kde sme získali údaje o postradiačných komplikáciách, a takisto sme prezerali histopatologické nálezy enukleovaných bulbov. Výsledky ohľadom makulopatie v tomto súbore sme už publikovali v časopise Česká a slovenská oftalmologie [26]. V tomto článku sa zameriavame na počet a príčiny enukleácií, pričom využívame deskriptívnu štatistiku, a takisto sa zameriavame na histopatologické zhodnotenie enukleovaných bulbov, ktoré sme spracovali v spolupráci s patológom.
VÝSLEDKY
V našom súbore boli pacienti vo veku od 20 do 92 rokov, pričom najviac z nich bolo vo vekovej skupine 60-69 rokov (33 %). Žien bolo 85 (51%) a mužov 83(49 %). Tumor na pravom oku malo 82 pacientov (49 %), na ľavom oku 86 pacientov (51 %). U 21 pacientov (12,5 %) vyrastal tumor z oblasti corpus ciliare, u 147 pacientov z chorioidey (87,5 %). Tumory lokalizované preekvatoriálne – teda vyrastajúce z corpus ciliare alebo z preekvatoriálnej časti chorioidey – malo 41 pacientov (24 %), z postekvatoriálnej časti chorioidey 127 pacientov (76 %). Priemerný objem tumoru pred ožiarením bol 0,4402 cm3. Dávka ožiarenia na oblasť tumoru bola od 35,0 do 62,05 Gy, medián dávky 40,13 Gy.
Počas celého sledovacieho obdobia podstúpilo enukleáciu v našom súbore 28 pacientov (17 %). Najčastejšou príčinou bol neovaskulárny glaukóm, a to u 23 pacientov (82 %). U 4 očí (14 %) bola nutná enukleácia pre progresiu lokálneho nálezu, pričom sa u všetkých pacientov jednalo o veľké tumory s objemom nad 1 cm3. U 1 pacienta (4 %) bolo dôvodom enukleácie rozhodnutie pacienta a jeho strach z ochorenia. Časový interval od ožiarenia po enukleáciu bol od 1 do 99 mesiacov, v priemere 26 mesiacov, medián 21,5 mesiaca.
Celkový výskyt sekundárneho glaukómu (Obrázok 1, Obrázok 2) v našom súbore bol u 49 pacientov (29 %). Z nich malo 12 melanóm corpus ciliare (24 %) a 37 malo melanóm chorioidey (76 %). Liečba glaukómu bola u všetkých pacientov medikamentózna a 12 pacientov podstúpilo cyklokryokoaguláciu, ktorá mala dobrý efekt u 4 pacientov (33 %).
Obr. 1. Pacient s postradiačnou kataraktou a neovaskulárnym glaukómom 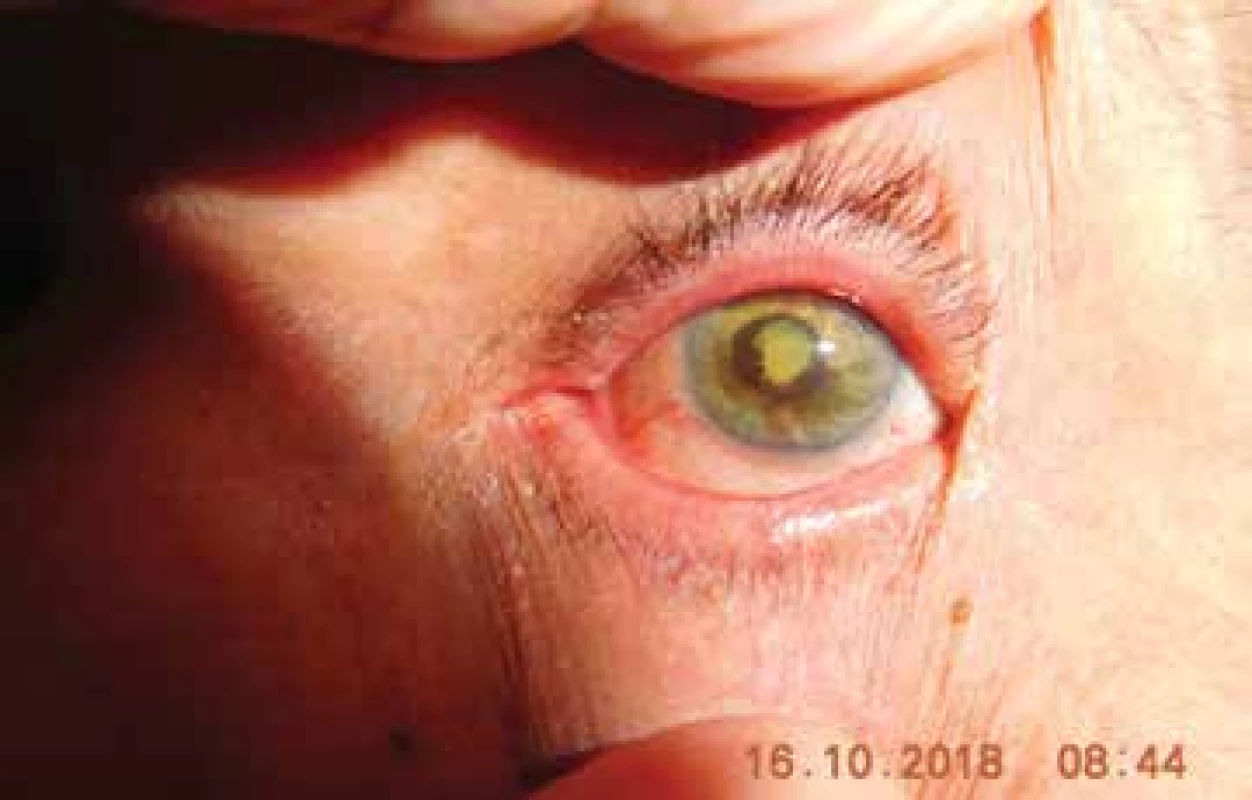
Obr. 2. Pacient s postradiačnou optikoneuropatiou a makulopatiou 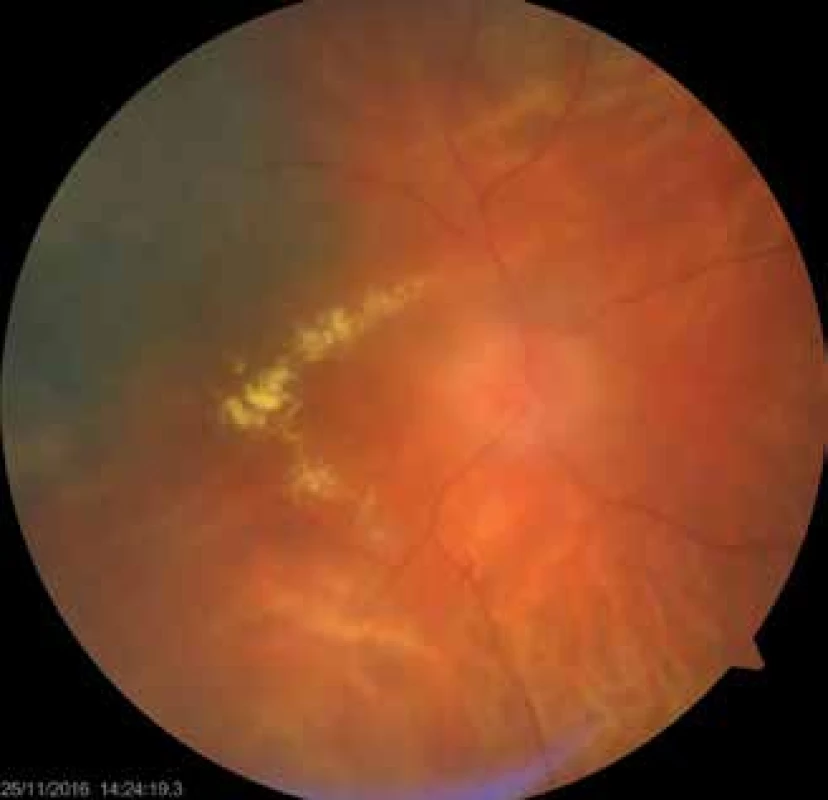
Po enukleácii boli oči s MMU histopatologicky zhodnotené. Najväčšie zastúpenie mali tumory zložené z vretenovitých buniek, ktorých bolo 13 (46 %). Z toho patrili 4 k vretenobukovému typu A, 7 bolo vretenobunkový typ B a 2 boli zmiešaný vretenobunkový A+B typ. Epiteloidný typ vykazovalo 5 tumorov (18 %). Zmiešaný vretenobunkový a epiteloidný typ predstavovalo 5 tumorov (18 %). U 5 pacientov (18 %) bol histopatologický typ tumoru neznámy, a to najčastejšie z dôvodu, ak absolvovali enukleáciu na inom pracovisku (Tabuľka 1).
Tab. 1. Prehľad enukleovaných bulbov 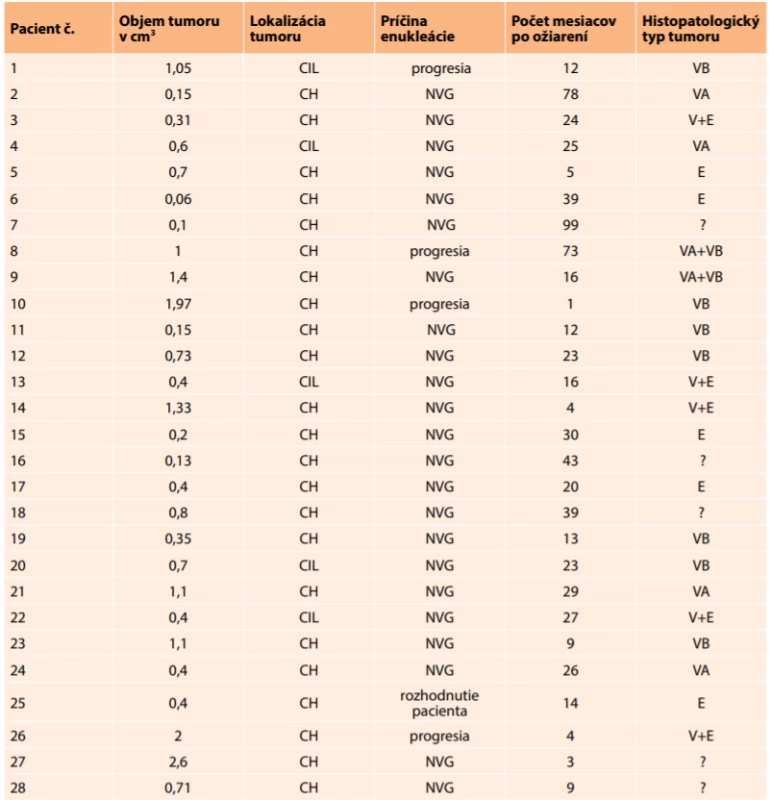
(poznámky: objem tumoru v cm3 - v čase diagnostikovania ochorenia, CH – tumory vychádzajúce z choroidey, CIL – tumory vychádzajúce z corpus ciliare, NVG – neovaskulárny glaukóm, V – vretenobunkový typ, VA – vretenobunkový typ A, VB – vretenobunkový typ B, E – epiteloidný typ, ? – neznámy typ) Na obrázku 3 a 4 je histopatologický nález recidivujúceho melanómu corpus ciliare u pacientky z nášho súboru s infiltráciou laterálnej steny bulbu, vretenobunkový typ B, farbenie hematoxylín-eozín v 25 - a 100-násobnom zväčšení.
Obr. 3. Recidivujúci melanóm corpus ciliare, vretenobunkový typ B, zväčšenie 25x 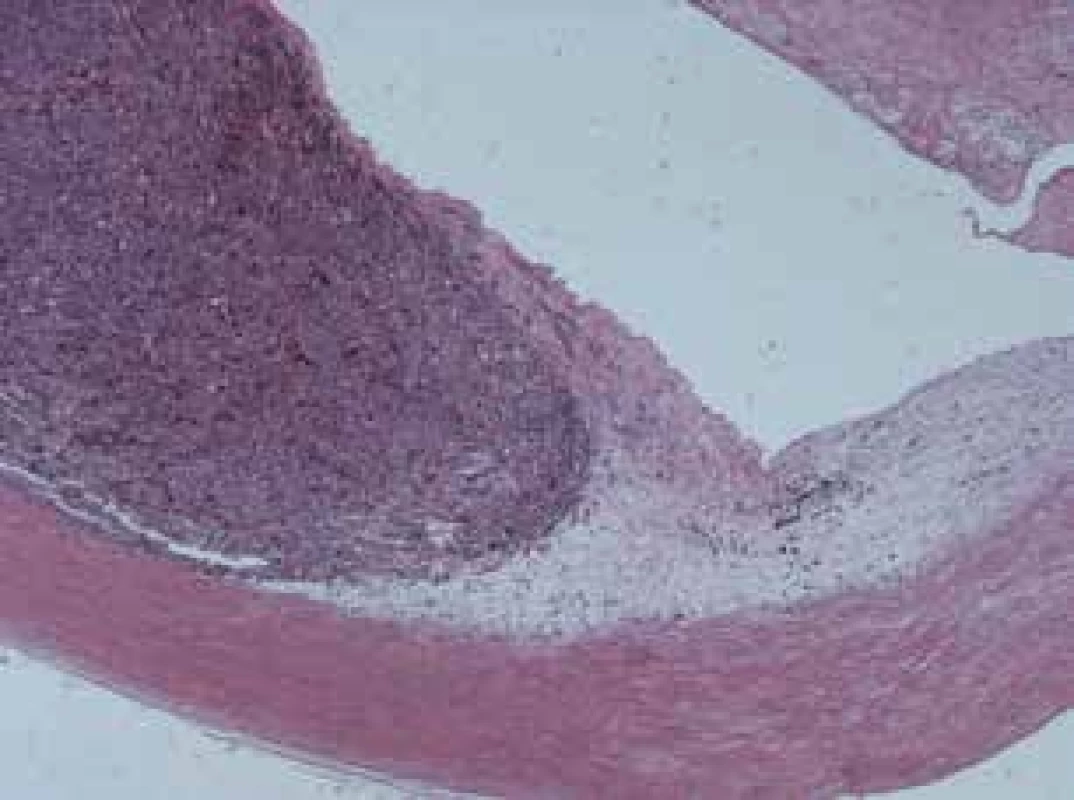
Obr. 4. Ten istý melanóm, zväčšenie 100x 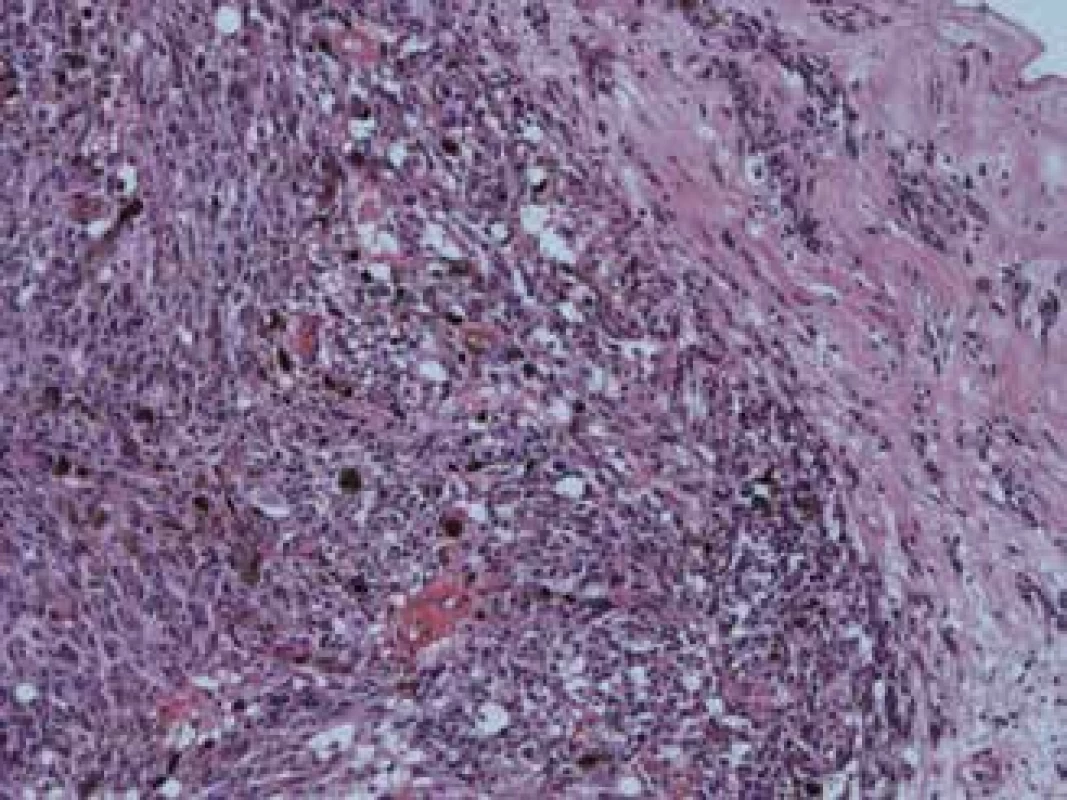
DISKUSIA
Autori z London Ocular Oncology Service analyzovali enukleácie u pacientov po rádioterapii v rokoch 2008-2014. Išlo o súbor 99 enukleovaných očí, z ktorých bolo 21 lokalizovaných v corpus ciliare (21 %), juxtapapilárne bolo lokalizovaných 31 (31 %) a v ostatných častiach chorioidey 47 tumorov (48 %). Ako primárna liečba bola brachyterapia s využitím Ru106 u 85 pacientov, protónová terapia u 11 pacientov a a transpupilárna termoterapia u 3 pacientov. Indikácie na sekundárnu enukleáciu boli: recidíva tumoru u 60 očí (61 %), neovaskulárny glaukóm u 21 očí (21 %) a absencia odpovede na liečbu u 18 očí (18 %). U 20 pacientov (20 %) boli diagnostikované metastázy, pričom 12 z nich exitovalo. Na základe multivariačnej analýzy bola juxtapapilárna lokalizácia tumoru preukázaná ako rizikový faktor pre absenciu odpovede na liečbu (p = 0,004) a zároveň absencia odpovede na liečbu bola asociovaná s vyšším rizikom rozvoja metastáz (p = 0,04). Juxtapapilárne lokalizované tumory sa teda preukázali ako viac rádiorezistentné a takisto u nich bolo vyššie riziko tvorby metastáz [2].
Furdová et al. analyzovali počet sekundárnych enukleácií a prežívanie v súbore 150 pacientov ožiarených na lineárnom urýchľovači LINAC v rokoch 2001-2015. Enukleácia po ožiarení bola nutná u 20 pacientov (13,3 %), a to najmä pre neovaskulárny glaukóm. Prežívanie pacientov bolo 96 % po 1 roku od liečby, 93 % po 2 rokoch, 84 % po 5 rokoch, 80 % po 7 rokoch a 53 % po 11 rokoch [12].
Seregard et al. skúmali viabilitu zadných melanómov uvey po brachyterapii ruténiovými žiaričmi na základe histopatologického hodnotenia sekundárne enukleovaných očí. V súbore 266 pacientov bolo 46 sekundárne enukleovaných. Príčiny boli: recidíva tumoru u 27 pacientov (64 %), nežiaduce účinky ožiarenia u 12 (29 %) a pacientove osobné rozhodnutie v 3 prípadoch (7 %). Zo 46 enukleovaných bulbov bolo 42 histopatologicky zhodnotených. Medián časového obdobia od rádioterapie po enukleáciu bol 23 mesiacov v skupine s recidívou tumoru a 19 mesiacov u pacientov bez recidívy. Napriek tomu, že u všetkých melanómov bol na histopatologickom vyšetrení nájdený istý stupeň regresie, len 5 bolo kompletne nekrotických a viabilné melanómové bunky boli nájdené u zvyšných 37 predtým ožiarených tumorov (88 %). Proliferujúce bunky sa našli u 17 z 23 očí (74 %) enukleovaných pre recidívu. Tento nález bol podobný ako u očí s melanómom, ktoré sú primárne enukleované bez predošlej rádioterapie. Na rozdiel od toho, proliferujúce bunky sa našli len u 4 z 13 (31 %) tumorov bez klinickej recidívy, čo svedčí pre to, že liečba rádioterapiou je efektívna [22].
Pham et al. analyzovali peroperačný priebeh a pooperačné výsledky primárnej enukleácie a enukleácie po brachyterapii pre MMU. Medzi skupinou primárne enukleovaných (n=54) a enukleovaných po brachyterapii (n = 34) nebol rozdiel čo sa týka veku, pohlavia a laterality. Väčšie peroperačné ťažkosti boli v skupine enukleovaných po rádioterapii (28 z 32 pacientov; 87,5 %), ako v skupine primárne enukleovaných (1 z 54 pacientov; 1,8 %), p < 0,0001. Čas operácie nad 2 hodiny bol u 3 z 51 primárne enukleovaných (6 %) a u 8 z 32 enukleovaných po rádioterapii (25 %), p = 0,02. Priemerná veľkosť implantátu bola v oboch skupinách podobná (20,6 mm), avšak 2 z 34 enukleovaných po rádioterapii (6 %) potrebovalo štep podkožného tuku. Ptóza mihalnice bola prítomná u 8 zo 49 primárne enukleovaných (16 %) a u 13 z 30 enukleovaných po rádioterapii (43 %), p = 0,02. Anoftalmus sa objavil u 0 primárne enukleovaných a u 5 z 30 enukleovaných po rádioterapii (17 %), p = 0,006. Záverom štúdie bolo, že enukleácia po brachyterapii bola technicky náročnejšia a mala viac komplikácií ako primárna enukleácia. Je to vhodná liečebná modalita pre pacientov, ktorí sú kontraindikovaní na rádioterapiu [21].
ZÁVER
Primárna enukleácia sa v súčasnosti volí ako liečba melanómu uvey len pri pokročilom náleze. Pokiaľ je to možné, rozhodujeme sa pre bulbus zachovávajúce liečebné metódy, medzi ktoré patrí najmä rádioterapia, a takisto aj resekcia tumoru. Aj po liečbe melanómu žiarením sa niektorí pacienti nevyhnú enukleácii. Príčinou bývajú postradiačné komplikácie, ako je sekundárny glaukóm, recidíva a progresia rastu tumoru a niektorí pacienti sa pre enukleáciu rozhodnú sami, najmä pre strach z ochorenia. Výskyt sekundárnej enukleácie v našom súbore bol 17 %, s mediánom času od ožiarenia po enukleáciu 21,5 mesiaca. Najčastejšou príčinou bol neovaskulárny glaukóm, a na histopatologickom vyšetrení sa u enukleovaných bulbov najčastejšie jednalo o vretenobunkový typ melanómu. Starostlivosť o pacientov s melanómom uvey je náročná a vyžaduje si spoluprácu oftalmológa, radiačných onkológov a radiačných fyzikov a takisto spoluprácu s patológom.
Autori práce prehlasujú, že vznik a téma odborného článku a jeho zverejnenie nie je predmetom stretu záujmov a nie je podporené žiadnou farmaceutickou firmou.
Práca nebola zadaná inému časopisu ani inde vytlačená, s výnimkou kongresových abstraktov a doporučených postupov.
Do redakce doručeno dne: 18. 12. 2019
Do tisku přijato dne: 27. 1. 2020
MUDr. Pavlína Zahorjanová
Očné oddelenie, FNsP Žilina
V. Spanyola 43
012 07 Žilina
Zdroje
1. Damato, B., Singh, A.D: Clinical Ophthalmic Oncology: Uveal Tumors. Berlin, Springer, 2014, 382 p.
2. Fabian, I.D., Tomkins-Netzer, O., Stoker, I., et al: Secondary Enucleations for Uveal Melanoma: A 7-Year Retrospective Analysis. Am J Ophthalmol, 160(6); 2015 : 1104-1110.
3. Furdová, A., Babál, P.: Giant Orbital Melanoma in a Heroin Abuser. Case Rep Ophthalmol, 8(1); 2017 : 288-293.
4. Furdová, A., Babál, P., Kobzová, D., et al.: Uveal melanoma suvrival rates after single dose stereotactic radiosurgery, 65(6); 2018 : 965-971.
5. Furdová, A., Horkovičová, K., Justusová, P., et al.: Is it sufficient to repeat linear accelerator stereotactic radiosurgery in choroidal melanoma? Bratisl Lek Listy, 117(8); 2016 : 456-462.
6. Furdová, A., Oláh, Z.: Nádory oka a okolitých štruktúr. Akademické nakladatelství CERM, 2010, 152 s.
7. Furdová, A., Růžička, J., Šramka, M., et al.: Choroidal melanoma stage T1 – comparison of the planning protocol for stereotactic radiosurgery and proton beam irradiation. Cesk Slov Oftalmol, 68(4); 2012, 156-161.
8. Furdová, A., Slezák, P., Chorváth, M., et al.: No differences in outcome between radical surgical treatment (enucleation) and stereotactic radiosurgery in patients with posterior uveal melanoma. Neoplasma, 57(4); 2010 : 377-381.
9. Furdová, A., Strmeň, P., Šramka, M.: Complications in patients with uveal melanoma after stereotactic radiosurgery and brachytherapy. Bratisl Lek Listy, 106(12); 2005 : 401-406.
10. Furdová, A., Strmeň, P., Waczulíková, I., et al.: One-day session LINAC-based radiosurgery of posterior uveal melanoma. European Journal of Ophthalmology, 22(2); 2012 : 226-235.
11. Furdová, A., Šramka, M.: Uveal malignant melanoma and stereotactic radiosurgery. Saarbrucken, LAP LAMBERT Academic Publishing, 2014, 181 s.
12. Furdová, A., Šramka, M., Chorváth, M., et al.: Clinical experience of stereotactic radiosurgery at a linear accelerator for intraocular melanoma. Melanoma Res, 27(5); 2017 : 463-468.
13. Furdová, A., Šramka, M., Chorváth, M., et al.: Stereotactic radiosurgery in intraocular malignant melanoma – retrospective study. Neuro Endocrinol Lett, 35(1); 2014 : 28-36.
14. Furdová, A., Waczulíková, I., Šramka, M., et al.: Relative survival rates and presence of complications in uveal melanoma patients after stereotactic radiosurgery. Adv Ophthalmol Vis Syst, 8(6); 2018 : 283-289.
15. Group TCOMS: The Collaborative Ocular Melanoma Study (COMS) randomized trial of large choroidal melanoma: IV. Ten-year mortality findings and prognostic factors. COMS report number 24. Am J Ophthalmol, 138(6); 2004 : 936-51.
16. Chen, X., Maniotis, A.J., Majumdar, D., et al.: Uveal melanoma cell staining for CD34 and assessment of tumor vascularity. Invest Ophthalmol Vis Sci, 43(8); 2002 : 2533-9.
17. Justusová, P., Štubňa, M., Veselovský, M., et al.: Exenterácia orbity u pacienta s generalizovaným choroidálnym melanómom. Cesk Slov Oftalmol, 72(3); 2016 : 92-96.
18. Kilic, E., Stijnen, T., de Jong, P.T., et al.: Reduced melanoma-related mortality in uveal melanoma by preenucleation radiotherapy. Arch Ophthalmol, 123(10); 2005 : 1363-7.
19. Krantz, B.A., Dave, N., Komatsubara, K.M., et al.: Uveal melanoma: epidemiology, etiology and treatment of primary disease. Clin Ophthalmol. 2017;11 : 279-289.
20. Mäkitie, T., Summanen, P., Tarkkanen, A., et al.: Tumor-infiltrating macrophages (CD68+ cells) and prognosis in malignant uveal melanoma. Invest Ophthalmol Vis Sci, 42(7); 2001 : 1414-21.
21. Pham, C.M., Custer, P.L., Couch, S.M.: Comparison of primary and secondary enucleation for uveal melanoma. Orbit, 36(6); 2017 : 422-7.
22. Seregard, S., Lundell, G., Lax, I., et al.: Tumour cell proliferation after failded ruthenium plaque radiotherapy for posterior uveal melanoma. Acta Ophthalmol Scand, 75; 1995 : 148-154.
23. Sekáč, J., Ferková, S.L., Kollárová, A., et al.: Secondary glaucoma in small versus large uveal melanoma patients treated with stereotactic radiosurgery on linear accelerator. Bratisl Med J, 120(12); 2019 : 945-949.
24. Singh, A.D., Kalyani, P., Topham, A.: Estimating the risk of malignant transformation of a choroidal nevus. Ophthalmology, 112(10); 2005 : 1784-9.
25. Smolková, B., Horváthová Kajabová, V., Zmetáková, I., et al.: Role of epigenetic deregulation in hematogenous dissemination of malignant uveal melanoma. Neoplasma, 65(6); 2018 : 840-854.
26. Zahorjanová, P., Furdová, A., Waczulíková, I., et al.: Postradiačná makulopatia u pacientov s malígnym melanómom corpus ciliare a chorioidey po stereotaktickej rádiochirurgii. Cesk Slov Oftalmol, 75(1); 2019 : 3-10.
Štítky
Oftalmologie
Článek vyšel v časopiseČeská a slovenská oftalmologie
Nejčtenější tento týden
2020 Číslo 1- Stillova choroba: vzácné a závažné systémové onemocnění
- Familiární středomořská horečka
- První schválený léčivý přípravek pro terapii Leberovy hereditární optické neuropatie dostupný rovněž v ČR
- Diagnostický algoritmus při podezření na syndrom periodické horečky
- Možnosti využití přípravku Desodrop v terapii a prevenci oftalmologických onemocnění
-
Všechny články tohoto čísla
- TRANSSKLERÁLNÍ EXTRAKCE NITROOČNÍHO CIZÍHO TĚLESA ZE ZADNÍHO SEGMENTU OKA BEZ PARS PLANA VITREKTOMIE
- PLEOPTICKÝ TRÉNING VO VIRTUÁLNEJ REALITE U DOSPELÝCH PACIENTOV S ANIZOMETROPICKOU AMBLYOPIOU
- NAŠE ZKUŠENOSTI S MIKROPULZNÍ CYKLOFOTOKOAGULACÍ V TERAPII GLAUKOMŮ
- SOUČASNÉ VYUŽITÍ AUTOMATICKÉ RETINÁLNÍ OXYMETRIE. PŘEHLEDOVÝ ČLÁNEK
- Význam PET/CT vyšetrenia u pacientov s malígnym melanómom uvey
- ENUKLEÁCIA PO STEREOTAKTICKEJ RÁDIOCHIRURGII U PACIENTOV S MALÍGNYM MELANÓMOM UVEY
- Česká a slovenská oftalmologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Význam PET/CT vyšetrenia u pacientov s malígnym melanómom uvey
- NAŠE ZKUŠENOSTI S MIKROPULZNÍ CYKLOFOTOKOAGULACÍ V TERAPII GLAUKOMŮ
- PLEOPTICKÝ TRÉNING VO VIRTUÁLNEJ REALITE U DOSPELÝCH PACIENTOV S ANIZOMETROPICKOU AMBLYOPIOU
- TRANSSKLERÁLNÍ EXTRAKCE NITROOČNÍHO CIZÍHO TĚLESA ZE ZADNÍHO SEGMENTU OKA BEZ PARS PLANA VITREKTOMIE
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



