-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Posouzení účinnosti fotodynamické terapie u pacientů s chronickou centrální serózní chorioretinopatií
Autoři: K. Manethová 1,2; J. Ernest 1; M. Hrevuš 1; N. Jirásková 3
Působiště autorů: Oční klinika, Ústřední vojenská nemocnice – všeobecná fakultní nemocnice v Praze, U Vojenské nemocnice 1200, Praha 6, Přednosta: doc. MUDr. Martin Šín, Ph. D., FEBO 1; Oční oddělení, Thomayerova nemocnice, Vídeňská 800, Praha 4 Primářka: MUDr. Kateřina Manethová, FEBO 2; Oční klinika, Fakultní nemocnice Hradec Králové, Sokolská 581, Hradec Králové, Přednostka: prof. MUDr. Naďa Jirásková, Ph. D., FEBO 3
Vyšlo v časopise: Čes. a slov. Oftal., 75, 2019, No. 6, p. 298-308
Kategorie: Původní práce
doi: https://doi.org/10.31348/2019/6/2Souhrn
Cíl: Cílem této prospektivní klinické studie bylo zhodnotit anatomické a funkční výsledky léčby 54 očí s chronickou formou centrální serózní chorioretinopatie (CSC) pomocí fotodynamické terapie v redukovaném (polovičním) dávkovacím režimu verteporfinu (HD-PDT).
Metodika a soubor: Do naší prospektivní studie bylo zařazeno 54 očí 52 pacientů (40 mužů, 12 žen) v průměrném věku 50,1 let (medián 49,5, rozmezí 30–75 let) léčených na Oční klinice 1. LF UK a ÚVN-VFN v Praze od ledna 2012 do ledna 2018 pro chronickou formu CSC s minimální délkou trvání onemocnění 3 měsíce. V našem souboru jsme hodnotili vývoj nejlépe korigované zrakové ostrosti (NKZO) a centrální retinální tloušťky (CRT) před léčbou a 1., 3., 6. a 12. měsíc po provedení HD-PDT.
Výsledky: Průměrná hodnota vstupní NKZO před léčbou činila 68,91 ± 10,5 písmen ETDRS optotypů (medián 71; v intervalu od 35 do 85 písmen ETDRS) a průměrná hodnota vstupní CRT byla 385,6 ± 118,5 µm (medián 367,5 µm; v rozmezí od 245 µm do 1000 µm). Na konci sledovacího období byla průměrná hodnota NKZO 79 ± 11 písmen ETDRS (medián 82, rozmezí 38–93). Zlepšení NKZO před léčbou a po ní bylo ve všech měřeních statisticky signifikantní (p < 0,0001). Průměrná hodnota CRT na konci sledovacího období činila 263,5 ± 52 µm (medián 258,5 µm; rozmezí 162–404 µm). Pokles CRT ve všech časech měření byl statisticky signifikantní v porovnání se vstupní hodnotou (p < 0,0001). V našem souboru pacientů bylo na konci sledovacího období dosaženo zlepšení či stabilizace sítnicového nálezu u 50 očí (92,6 %). V průběhu sledovacího období jsme zaznamenali ve 2 případech rozvoj sekundární choroidální neovaskularizace (CNV).
Závěr: HD-PDT je v dlouhodobém měřítku bezpečnou a efektivní metodou léčby chronických forem centrální serózní chorioretinopatie. Navzdory redukované dávce verteporfinu se však mohou vyskytnou komplikace.
Klíčová slova:
chronická centrální serózní chorioretinopatie – redukovaná fotodynamická terapie – sekundární choroidální neovaskularizace
ÚVOD
Centrální serózní chorioretinopatie je onemocnění charakterizované serózním odchlípením neuroretiny zejména v zadním pólu oka [13]. CSC je často doprovázená serózním odloučením retinálního pigmentového listu (RPE) a sdružená s prosakováním tekutiny do subretinálního prostoru skrze defektní RPE. CSC nejčastěji postihuje muže v produktivním věku [15]. Přesná patofyziologie onemocnění není zcela známa. Na základě vyšetření angiografie s indocyaninovou zelení (ICG), která odhalila zvýšenou permeabilitu choroidálních cév [47], a optické koherenční tomografie (OCT) ukazující zvýšenou tloušťku choroidey [19] se předpokládá choroidální vaskulopatie jako primární příčina vzniku CSC. Povětšinou má CSC dobrou prognózu se spontánní resorpcí subretinální tekutiny (SRT) a úpravou zrakových funkcí. U malého procenta pacientů však onemocnění přechází do chronického či rekurentního průběhu a může vést k nevratným funkčním i anatomickým změnám sítnice s konečným klinickým obrazem difuzní retinální pigmentové epitelopatie (DRPE) [47].
Optimální léčebný přístup k pacientům s CSC zůstává kontroverzní. V posledních dekádách se v léčbě chronických forem CSC (cCSC) používalo nespočet léčebných přístupů; tyto zahrnovaly například laserovou fotokoagulaci [25], medikamentózní léčbu [14,41], standardní PDT [9] či působky proti růstovému endoteliálnímu faktoru (anti-VEGF) [16]. V posledních letech se odborníci v léčbě cCSC přiklání k méně destruktivním metodám, jakými je fotodynamická terapie v redukovaných dávkovacích schématech (rPDT), ať už s redukovanou dávkou Visudynu („reduced-dose“) nebo použité energie laserového paprsku („reduced-fluence“) [21,22,43]. Chan, Uetani a Alkin prokázali srovnatelnou účinnost a bezpečnost při použití redukovaných schémat PDT (reduced-dose nebo reduced-fluence PDT) u pacientů s cCSC, u kterých došlo ke zlepšení nejlépe korigované zrakové ostrosti (NKZO) i redukci subretinální tekutiny, přičemž nebyly zaznamenány žádné komplikace ve sledovaném souboru [1,7,49].
V České republice dosud neexistují standardy pro léčbu této klinické jednotky. Protože onemocnění postihuje typicky mladší pacienty v produktivním věku s vysokými nároky na kvalitu zraku, zůstává nadále správné načasování a stanovení léčby akutní, zejména pak chronické formy CSC, výzvou. Zatímco dříve se léčba opírala výhradně o laserové ošetření sítnice [29], v posledních letech se v léčbě zvláště chronických forem CSC uchyluje k šetrnějším metodám, jakými jsou fotodynamická terapie nebo intravitreální aplikace antiangiogenních látek (anti-VEGF) [26,28].
CÍL PRÁCE
Hlavním cílem této prospektivní, nerandomizované klinické studie bylo zhodnotit anatomické a funkční výsledky léčby 52 pacientů (54 očí) léčených na Oční klinice 1.LF UK a ÚVN-VFN Praha v letech 2014–2018 pro cCSC pomocí fotodynamické terapie v redukovaném dávkovacím režimu (HD-PDT, poloviční dávka verteporfinu). HD-PDT byla indikována jako primární intervence u symptomatických chronických forem trvajících déle než 3 měsíce, u kterých nedošlo k resorpci subretinální tekutiny (SRT) spontánně či po nedostatečném efektu konzervativní terapie.
Cíl klinického hodnocení:
- změna nejlépe korigované zrakové ostrosti (NKZO) před HD-PDT a 1., 3., 6. a 12. měsíc po léčbě.
- změna centrální retinální tloušťky (CRT) před HD-PDT a 1., 3., 6. a 12. měsíc po léčbě.
METODIKA
Hlavní vstupní kritéria zahrnovala: pacienti starší 18 let, na OCT zřejmá SRT a/nebo ablace RPE po dobu nejméně 3 měsíců, přítomnost aktivní hyperfluorescence na fluorescenční angiografii (FAG) typická pro CSC, přítomnost choroidální cévní hyperpermeability a abnormálně dilatovaných choroidálních cév na ICG.
Hlavní vylučující kritéria zahrnovala: známky jiné patologie makuly (choroidální neovaskularizace - CNV, věkem podmíněná makulární degenerace, angioid streaks, polypoidální choroidální vaskulopatie, patologická myopie, tilted disk apod.), laserové ošetření nebo intravitreální aplikace anti-VEGF během 3 měsíců před zařazením do studie, předchozí provedení PDT, netransparentní optická média znemožňující vyšetření i provedení samotného PDT, známá přecitlivělost na jakoukoliv formu přípravku pro FAG, ICG nebo PDT.
U všech pacientů jsme vstupně provedli kompletní oftalmologické vyšetření zahrnující: vyšetření NKZO (ETDRS optotypy) a nitroočního tlaku bezkontaktní tonometrií (NOT), biomikroskopie předního a zadního segmentu oka v arteficiální mydriáze, fotodokumentace dle protokolu - OCT (Heidelberg Spectralis, Heidelberg Engineering, Germany) - lineární horizontální makulární scany o vysokém stupni rozlišení, mapa centrální retinální tloušťky s určením hodnoty CRT, enhanced deep imaging (EDI), autofluorescence k určení rozsahu poškození RPE (Heidelberg Spectralis, Heidelberg Engineering, Germany), angiografické FAG/ICG vyšetření (samostatné nebo simultánní na přístroji Heidelberg Spectralis, Heidelberg Engineering, Germany).
Na základě vstupních vyšetření byla potvrzena cCSC definovaná jako difuzní oblast hyperfluorescence v makulární krajině se serózní elevací RPE a/nebo neuroepitelu nebo jako ložisko průsaku lokalizované v oblasti do 500 µm od centra fovey kontraindikované k ložiskové laserové fotokoagulaci, u něhož nedošlo ke spontánní resorpci SRT. Pacienti byli indikováni k provedení HD-PDT, které jsme provedli nejpozději do 30 dnů od vstupních vyšetření. Pacienti byli poté sledováni a vyšetřeni 1., 3., 6., 12. měsíc od provedení HD-PDT. Vždy bylo provedeno kontrolní vyšetření NKZO, NOT, předního i zadního segmentu oka (biomikroskopicky). Vždy jsme zhotovili kontrolní OCT snímky ve formátu “follow-up”, který díky funkci “eye-tracking” umožnil zcela přesné porovnání snímků v jednotlivých měřeních. V indikovaných případech jsme zopakovali FAG/ICG.
Za stabilizaci nálezu jsme považovali nepřítomnost SRT, normalizaci CRT, zlepšení NKZO o 5 a více písmen ETDRS optotypů. Za aktivitu nálezu (přetrvávající SRT nebo recidivu) jsme považovali přítomnost SRT či ablace RPE na OCT, aktivitu na FAG/ICG, pokles NKZO o 5 a více písmen ETDRS v kombinaci s jedním z předchozích dvou faktorů. V případě přetrvávající aktivity onemocnění, nedostatečném efektu HD-PDT či relapsu onemocnění jsme zvolili aditivní léčbu pomocí fokálního laserového ošetření, aplikaci anti-VEGF preparátu intravitreálně nebo jsme HD-PDT zopakovali. Kontrolní FAG/ICG jsme v průběhu sledovacího období zopakovali, pokud jsme nezaznamenali efekt HD-PDT, tedy byla-li na OCT patrná perzistující tekutina, došlo-li k recidivě onemocnění nebo pokud se vyskytly známky CNV komplikující průběh onemocnění.
Aditivní laserovou fotokoagulaci jsme provedli v případě průkazu aktivního ložiskového zdroje průsaku vzdáleného nejméně 500 µm od centra fovey. HD-PDT jsme zopakovali v případě průkazu přetrvávající aktivity nebo nálezu nových aktivních ložisek znázorněných na kontrolním angiogramu. Anti-VEGF preparáty (bevacizumab, aflibercept) jsme do intravitreálního prostoru aplikovali, pokud jsme diagnostikovali komplikující CNV po provedené HD-PDT nebo pokud při přetrvávající exsudaci byl již natolik poškozený RPE, že další sezení HD-PDT by mohlo ložisko atrofie RPE dále rozšířit či prohloubit.
Obecná charakteristika souboru
Do naší prospektivní studie bylo zařazeno 54 očí 52 pacientů (40 mužů, 12 žen) v průměrném věku 50,1 let (medián 49,5, rozmezí 30–75 let) léčených na Oční klinice 1. LF UK a ÚVN-VFN v Praze od ledna 2012 do ledna 2018 pro chronickou formu CSC s minimální délkou trvání onemocnění 3 měsíce. Pacienti byli k HD-PDT léčbě indikováni na základě vstupních vyšetření, při kterých byla stanovena diagnóza základního onemocnění – cCSC. Průměrná délka trvání onemocnění v době zahájení léčby byla přibližně 11,5 měsíců (rozmezí 3–120 měsíců). V našem souboru mělo 5 pacientů anamnézu celkové kortikoidní terapie (9,4 %), 13 pacientů bylo léčeno pro hypertenzi (25 %), 2 pacienti pro depresi (3,8 %), u 3 pacientů byla diagnostikována roztroušená skleróza (RS) (5,8 %), přičemž u 1 pacienta diagnóza cCSC předcházela diagnóze RS. Na základě vstupního OCT/FAG/ICG vyšetření byl bodový zdroj průsaku zjištěn u 6 očí (11,1 %), difuzní ložiska hyperfluorescence u 48 očí (88,9 %). Známky oboustranné cCSC jsme zaznamenali u 23 očí (42,6 %). Průměrná hodnota vstupní NKZO před léčbou činila 68,91 ± 10,5 písmen ETDRS optotypů (medián 71; v intervalu od 35 do 85 písmen ETDRS) a průměrná hodnota vstupní CRT byla 385,6 ± 118,5 µm (medián 367,5 µm; v rozmezí od 245 µm do 1000 µm) (Tabulka 1).
Tab. 1. Základní charakteristika souboru a vstupní hodnoty centrální retinální tloušťky a nejlépe korigované zrakové ostrosti 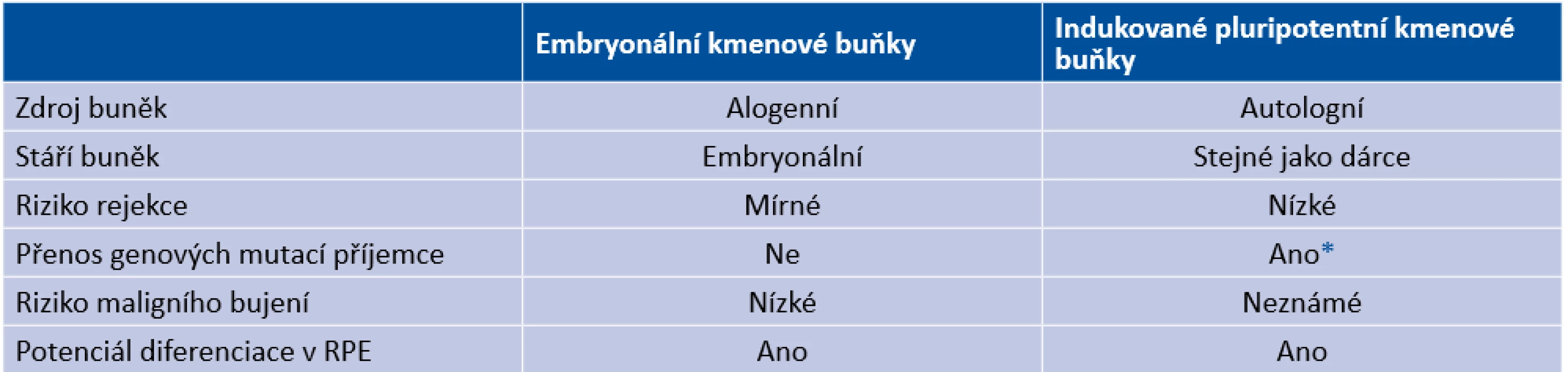
CRT – centrální retinální tloušťka, NKZO – nejlépe korigovaná zraková ostrost, SD – standardní deviace (směrodatná odchylka) Ačkoliv se považuje přítomnost cystoidní makulární degenerace (CMD) jako komplikace dlouhotrvající cCSC za negativní prognostický faktor léčby [18,38], nebyli pacienti s CMD z našeho souboru vyřazeni. Z hodnocení byl v průběhu sledovacího období vyřazen pacient, u něhož se později rozvinul uveální efúzní syndrom a původní projevy charakteristické pro CSC byly maskujícím syndromem této vzácné patologie.
Statistická analýza dat
Hodnoty CRT a NKZO v časech 1M, 3M, 6M a 12M byly statisticky porovnány s bazickou hodnotou (0M) pomocí neparametrického Wilcoxonova párového t-testu za účelem řešení stanoveného cíle (Tabulka 2). Pro statistické testování byla zvolena oboustranná alternativní hypotéza a vybrána 5% hladina významnosti. Uvedené P hodnoty byly upraveny Benjamini-Hochbergovou korekcí pro vícečetné testování.
Tab. 2. Deskriptivní statistika věku, centrální retinální tloušťky a nejlépe korigované zrakové ostrosti a statistické porovnání změn sledovaného znaku se vstupní hodnotou (0M) 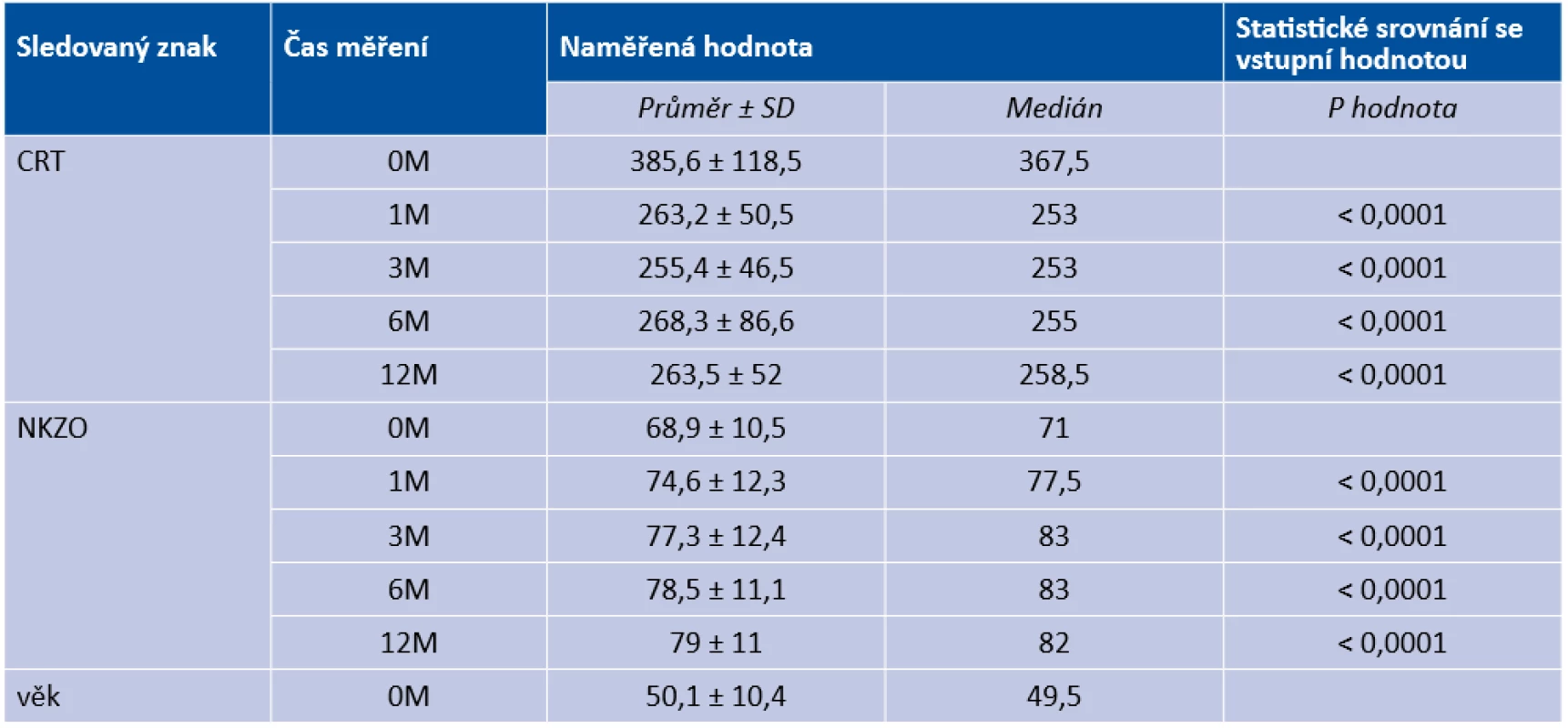
CRT - centrální retinální tloušťka, NKZO - nejlépe korigovaná zraková ostrost, SD - standardní deviace (směrodatná odchylka) Bezpečnost a komplikace
V průběhu sledovacího období se nevyskytly žádné systémové komplikace v přímé souvislosti s provedenou fotodynamickou léčbou ani intravitreální aplikací anti-VEGF látky.
Z našeho souboru 54 očí s cCSC léčených pomocí HD-PDT jsme ve 2 případech odhalili vznik komplikující CNV 1 měsíc od provedení zákroku v místě ozáření angiograficky prokázané aktivní léze a tyto 2 případy hodnotíme jako komplikaci léčby. V obou případech se jednalo o subfoveolární, respektive juxtafoveolární drobnou (avšak vysoce aktivní) CNV klasického typu (Obrázek 1,2). Pacienti s rozvinutou sekundární CNV byli zaléčeni anti-VEGF léčbou (aflibercept); v jednom případě vznikla drobná klidná fibrovaskulární jizva juxtafoveolárně, v druhém případě došlo k anatomické úpravě prakticky ad integrum s regresí celé klasické porce neovaskulárního komplexu (Obrázek 3).
Obr. 1. (A) Simultánní fluorescenční a indocyaninová angiografie v prearteriální a (B) pozdní venózní fázi angiogramu znázorňuje okrouhlé subfoveolární ložisko pozvolné hyperfluorescence s vyznačenou šířkou stopy pro fotodynamickou terapii (žluté ohraničení), na angiogramu nejsou známky choroidální neovaskularizace (C) Transfoveolární lineární sken prokazující undulující linii retinálního pigmentového epitelu, subretinální tekutinu a poměrně dobře zachované jednotlivé retinální vrstvy 
Obr. 2. (A) Komplikující drobná klasická porce sekundární choroidální neovaskularizace 1 měsíc po provedené fotodynamické terapii (B,C,D) Průkaz vysoce aktivní choroidální neovaskularizace na fluorescenční angiografii 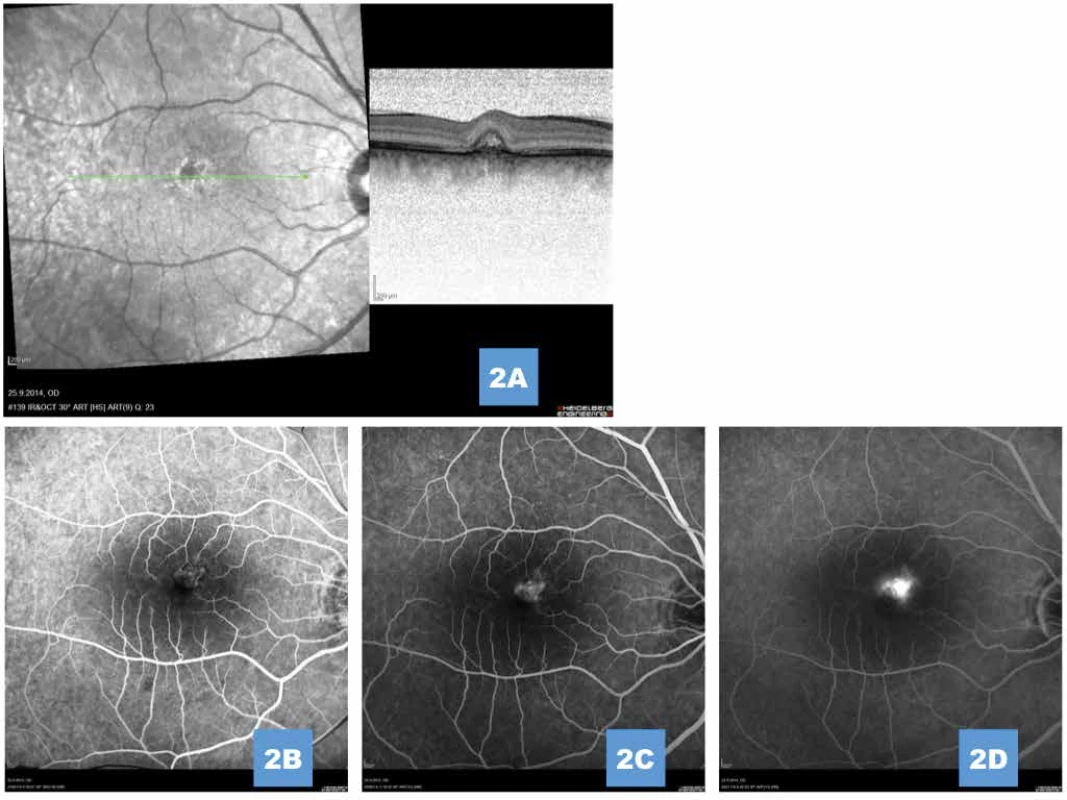
Obr. 3. (A,B) Postupná absolutní regrese klasické porce, ústup subretinální tekutiny, zachování zevní limitující membrány, obnova zóny interdigitací a náznak vyhlazení linie retinálního pigmentového epitelu 1 měsíc, respektive 1 rok po aplikaci anti-VEGF 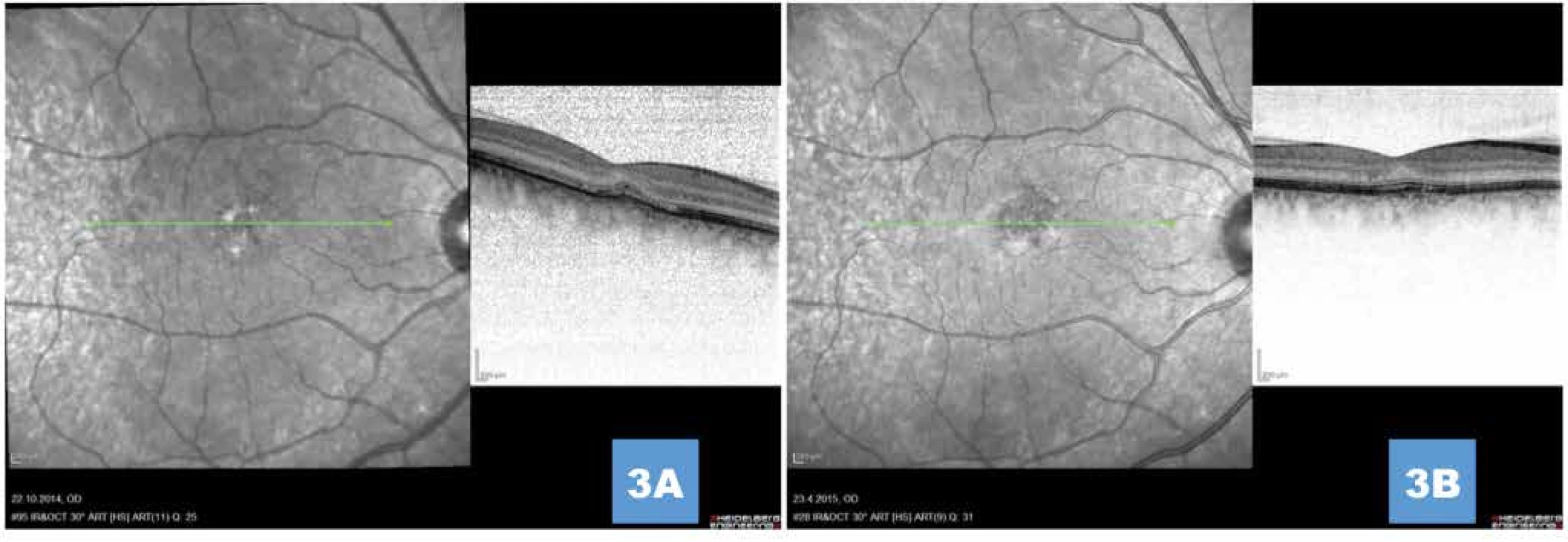
VÝSLEDKY
Anatomické výsledky
Primárním cílem této práce bylo zhodnotit anatomický efekt HD-PDT v léčbě cCSC, tedy posoudit kvantitativní změny centrální retinální tloušťky (CRT) v průběhu sledovacího období (Graf 1).
Graf 1. Krabicový graf zachycující hodnoty centrální retinální tloušťky v jednotlivých časech měření (před léčbou a 1., 3., 6., 12. měsíc po léčbě) 
U všech očí byl zaznamenán pozitivní efekt po provedené FAG/ICG navigované HD-PDT ve smyslu snížení CRT v průběhu sledovacího období. Průměrný počet HD-PDT sezení byl 1,07 (rozmezí 1–2). Průměr velikosti použité laserové stopy byl 1352 µm (v intervalu od 800 µm do 2800 µm), přičemž ozáření jedinou stopou jsme provedli ve 45 případech, zbylých 9 očí jsme ozářili 2 a více laserovými stopami v jednom sezení. Kompletní resoluce subretinální tekutiny po samostatném provedení HD-PDT byla dosažena u 43 očí (79,6 %) na konci sledovacího období (Obrázek 4, 5).
Obr. 4. (A) Simultánní snímek fluorescenční a indocyaninové angiografie zobrazující pozdní hyperfluorescenci (pooling) pod ablacemi retinálního pigmentového listu, drobnou ložiskovou hyperfluorescenci v parapapilární oblasti, vyznačení velikosti a umístění stop pro fotodynamickou terapii (žlutá ohraničení); je patrné odstínění plnění choroidey pod serózními ablacemi, snímek zároveň vylučuje přítomnost choroidální neovaskularizace (B) Vysoké ostře odstupující serózní ablace retinálního pigmentového listu na transfoveolárním lineárním snímku před léčbou 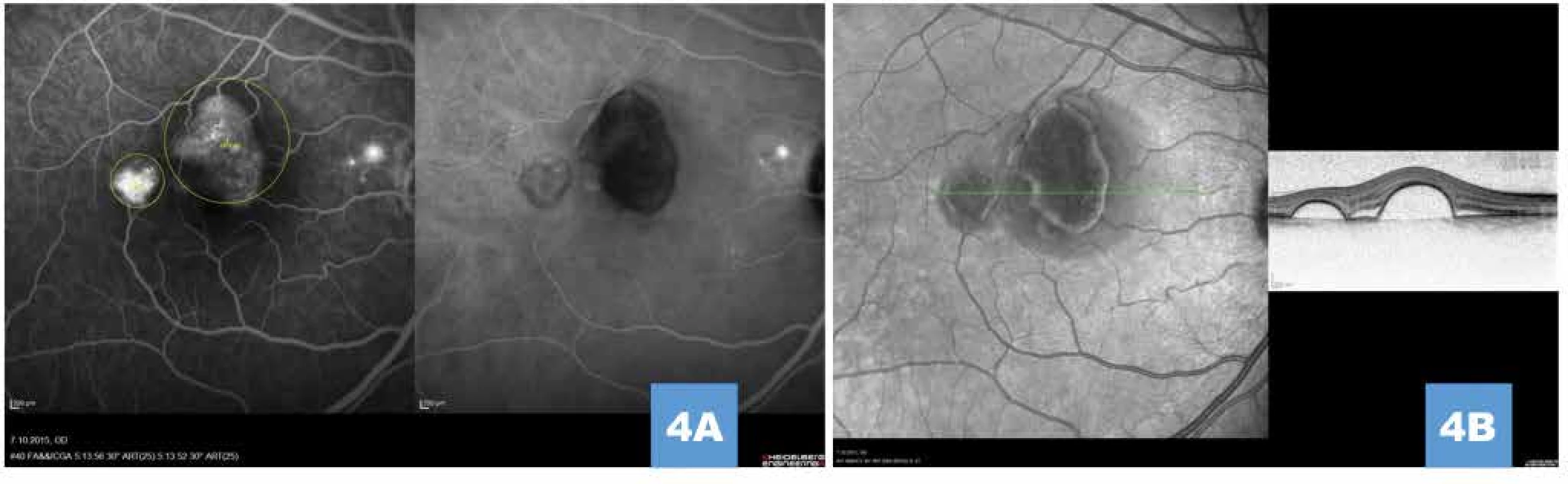
Obr. 5. (A) Ústup aktivity onemocnění s postupnou normalizací retinálních vrstev 1 měsíc, respektive (B) 1 rok po provedení fotodynamické léčby 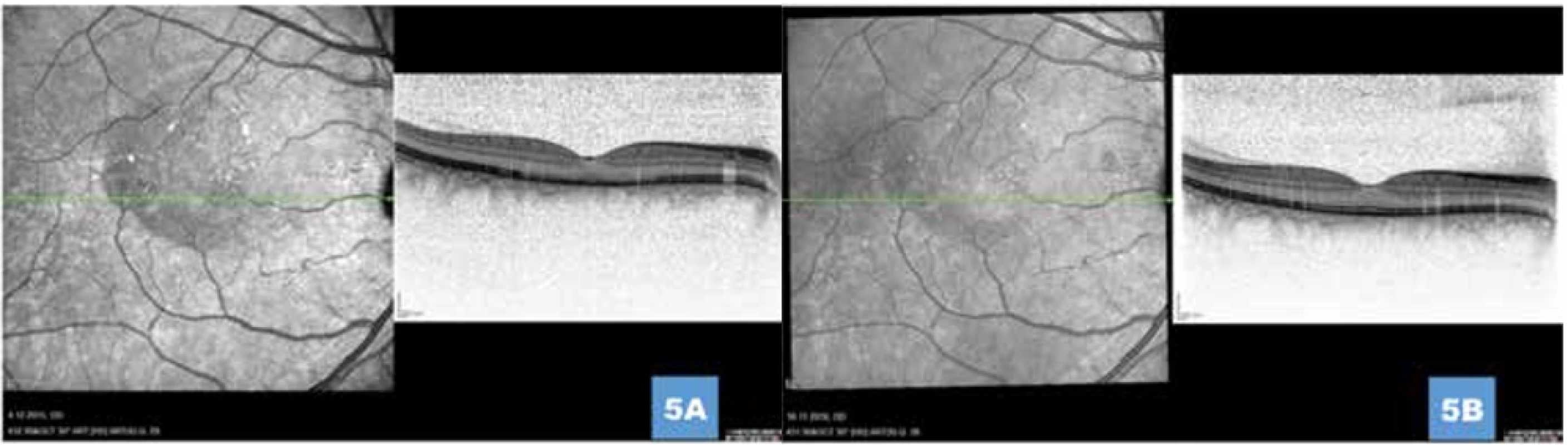
Perzistentní SRT jsme zaznamenali u zbylých 11 očí (20,4 %), u nichž byla zvolena aditivní léčba intravitreální aplikací anti-VEGF celkem v 10 případech, u 4 očí bylo HD-PDT zopakováno s odstupem 3 a více měsíců, přičemž ve 3 případech byl zvolen přístup kombinovaný s aplikací anti-VEGF do sklivce.
Průměrná hodnota vstupní CRT činila 385,3 ± 118,5 µm (medián 367,5 µm; rozmezí od 245–1000 µm). První měsíc od provedení HD-PDT bylo snížení CRT pozorováno u 92,6 % očí s průměrným snížením o 107,5 µm s průměrnou CRT 263,2 ± 50,5 µm (medián 253 µm; rozmezí 158–423 µm). Po třech měsících byl průměr CRT 255,4 ± 46,5 µm (medián 253 µm; rozmezí 156–393 µm). Na konci sledovacího období byl průměr CRT 263,5 ± 52 µm (medián 258,5 µm; rozmezí 162–404 µm). Pokles CRT ve všech časech měření byl statisticky signifikantní v porovnání se vstupní hodnotou (p < 0,0001).
V průběhu sledovacího období byly zaznamenány případy recidivy onemocnění s nárůstem CRT až o 506 µm, pro což bylo HD-PDT na základě kontrolní FAG/ICG zopakováno (celkem 4x) s pozitivním anatomickým i funkčním efektem na konci sledovacího období. U 10 očí byla s odstupem 1–12 měsíců indikována intravitreální aplikace anti-VEGF látky (bevacizumab 2x, aflibercept 8x) pro ne zcela uspokojivý efekt primárního či opakovaného HD-PDT s reziduální subretinální tekutinou, z čehož ve dvou případech bylo anti-VEGF aplikováno pro rozvoj sekundární CNV (2 oči, 3,7 %) v souvislosti s provedeným ošetřením s odstupem maximálně 1 měsíc od HD-PDT.
Na konci sledovacího období jsme uspokojivého výsledku bez exsudativní aktivity dosáhli u 49 očí (90,7 %). U dvou očí byla i přes počáteční dobrý efekt léčby zaznamenána recidiva a nárůst aktivity ve 12. měsíci s diskrétní plochou elevací neuroretiny. U jednoho pacienta došlo k progresi změn ve vitreoretinálním rozhraní se zvýrazněním trakce epiretinální membrány (ERM), která se zřejmě podílela na přítomnosti reziduální diskrétní SRT a ve finále limitovala výsledný efekt HD-PDT. Pacienti s rozvinutou sekundární CNV byli zaléčeni anti-VEGF léčbou (aflibercept); v jednom případě došlo k anatomické úpravě prakticky ad integrum s regresí celého neovaskulárního komplexu a obnovou OS/IS linie i membrány limitans externa (MLE), v druhém případě vznikla drobná klidná fibrovaskulární jizva juxtafoveolárně s narušením OS/IS linie i MLE.
Funkční výsledky
Primárním cílem této práce bylo zhodnotit i funkční efekt HD-PDT v léčbě cCSC, tedy posoudit změnu nejlépe korigované zrakové ostrosti v průběhu sledovacího období (Graf 2).
Graf 2. Krabicový graf zachycující hodnoty nejlépe korigované zrakové ostrosti v jednotlivých časech měření (před léčbou a 1., 3., 6., 12. měsíc po léčbě) 
Průměrná NKZO na počátku sledování činila 68,9 ± 10,5 písmen ETDRS (medián 71, rozmezí 35–85). Vyšší věk a vyšší hodnota subretinální tekutiny nekorelovaly s horšími zrakovými funkcemi na počátku léčby. Hodnoty NKZO se 1., 3., 6. i 12. měsíc po léčbě postupně zlepšily na 74,6 ± 12,3 písmen ETDRS (medián 77,5, rozmezí 33–89), 77,3 ± 12,4 písmen ETDRS (medián 83, rozmezí 35–95), 78,5 ± 11,1 písmen ETDRS (medián 83, rozmezí 38–95) a 79 ± 11 písmen ETDRS (medián 82, rozmezí 38–93). Zlepšení NKZO před léčbou a po ní bylo ve všech měřeních statisticky signifikantní (p < 0,0001). Navíc existuje významný rozdíl mezi hodnotami naměřenými v 1. a 6. nebo 12. měsíci (p = 0,0089, resp. p = 0,0002). V průměru došlo k zisku 11 písmen na konci sledovacího období. Věk pacienta nesouvisel s relativní změnou NKZO v jednotlivých časech měření 1., 3., 6., ani 12. měsíc od provedení HD-PDT (p = 0,8929, p = 0,4411, p = 0,1336, resp. p = 0,4172).
Z celkového počtu 54 očí mělo před zahájením léčby HD-PDT 7 očí (12,7 %) NKZO nejméně 80 písmen ETDRS, na konci sledování 33 očí (61,1 %). 14 očí (25,9 %) mělo při vstupním vyšetření NKZO horší než 60 písmen ETDRS, na konci sledování 4 oči (7,5 %).
Na konci sledovacího období jsme zaznamenali zlepšení centrální zrakové ostrosti u 50 očí (92,6 %), z toho zlepšení NKZO o minimálně 3 řádky u 13 očí (24,1 %). U 4 očí došlo po léčbě ke stabilizaci zrakových funkcí se zachováním vstupní NKZO. U pacientů, u nichž vznikla sekundární CNV, přechodně poklesla NKZO (ne více než o 1 řádek ETDRS optotypů) s úpravou zraku po intravitreální aplikaci anti-VEGF na výsledných 85, resp. 68 písmen ETDRS. V našem souboru jsme v žádném případě nepozorovali pokles NKZO o 5 a více písmen ETDRS na konci sledovacího období.
Po provedené HD-PDT jsme nezaznamenali žádné signifikantní atrofizující změny RPE v porovnání se vstupním nálezem, a to i rok po provedení léčby. Na základě analýzy OCT považujeme jako nepříznivý faktor výsledné NKZO nepravidelné uspořádání zevních retinálních vrstev, atrofii RPE, přítomnost perzistujícího denzního subretinálního hyperreflexivního materiálu (HRM) a vznik CNV. Právě tyto změny byly i přes velmi uspokojivé celkové výsledky léčby dány do souvislosti se subjektivním vnímáním zhoršeného vidění, se snížením kontrastní citlivosti či diskrétními metamorfopsiemi.
DISKUSE
Centrální serózní chorioretinopatie je charakterizována idiopatickým odchlípením neuroretiny a/nebo retinálního pigmentového listu na zadním pólu oka způsobená průsakem z patologicky změněných choroidálních cév. Tekutina se do subretinálního prostoru dostává přes oslabení nebo defekt v RPE. CSC se vyskytuje nejčastěji v mladším produktivním věku jako akutně vzniklé zhoršení centrální zrakové ostrosti. V naprosté většině případů dojde ke spontánní resorpci subretinální tekutiny s dobrou prognózou quo ad visum [34]. V některých případech však onemocnění přechází do chronického stádia, kdy se exsudace pod neuroretinou a/nebo RPE nevstřebá do 3 měsíců od propuknutí nemoci anebo má onemocnění rekurentní charakter. Chronická forma CSC je asociována s perzistující subretinální exsudací, progresivními změnami sítnice a tomu odpovídajícím trvalým zhoršením centrální zrakové ostrosti. Chronická či rekurentní CSC může být vleklým onemocněním a v důsledku dlouhodobě přetrvávající separace neuroretiny vede k irreverzibilním funkčním změnám, doprovázené dysfunkcí RPE [20], subretinálními exsudáty a fibrózou [17], cystoidní makulární degenerací [18], komplikující CNV [4,30]. Přesná příčina vzniku CSC zůstává i nadále nejasná, předpokládá se, že abnormální choroidální cévy hrají klíčovou roli v patogenezi tohoto onemocnění [36,42,47]. Zvýšená tloušťka choroidey, patrná na EDI-OCT [19], a zvýšená choroidální permeabilita, demonstrovaná na ICG, vybízí k domněnce, že léčba cílená právě na tato ložiska patologicky změněných choroidálních cév může být v terapii CSC efektivní [31,50]. I přes přesvědčivé výsledky mnohých prospektivních klinických studií neexistuje v současné době zlatý standard léčby tohoto onemocnění. Názory odborníků na zahájení léčby, její radikalitu a volbu nejvhodnějšího léčebného postupu se značně liší.
V minulých dekádách byl standardem léčby u ložiskových lézí s extrafoveolárním průsakem konvenční laser. Ačkoliv tato léčba může urychlit resorpci subretinální tekutiny, nemá vliv na choroidální hyperpermeabilitu [44]. V roce 2003 byly publikovány práce ukazující uspokojivé výsledky při užití fotodynamické léčby [6,50]. Mechanismus verteporfinové PDT v ozářené lokalizaci spočívá v selektivní, non-termální dočasné či permanentní okluzi choroidálního řečiště způsobené singlety molekul kyslíku emitované z fotosenzitizující látky (verteporfin) po ozáření laserovou energií (PDT, Visulas, ZEISS, Německo) [32,39]. Fotodynamická terapie ve standardním dávkovacím režimu byla prvotní metodou volby v léčbě cCSC; ačkoliv anatomické i funkční výsledky jsou uspokojivé v mnoha mezinárodních publikacích [6,34,50], užití konvenční PDT může vést k častějšímu výskytu komplikací - atrofie RPE, hypoperfuze choriokapilaris, časná hypoxie chorioretinální tkáně a vznik sekundární CNV [6]. Někteří autoři se domnívají, že užití PDT v šetrnějším režimu (reduced-dose, reduced-fluence či jejich vzájemná kombinace) vede k podobným anatomickým i funkčním výsledkům, avšak s lepším bezpečnostním profilem a minimem zmiňovaných nežádoucích účinků [1,12,22]. Princip účinku redukované PDT pak shledávají spíše v remodelaci choroidálního řečiště s redukcí průsaku choroidálních cév, než v jejich okluzi [9].
V doposud největším publikovaném souboru, který byl zveřejněn Limem, bylo hodnoceno celkem 256 očí léčených standardní či redukovanou PDT. Ke kompletní resorpci SRT došlo v 81 % případů. Ačkoliv byla demonstrována efektivita PDT léčby, nemusí být užití i redukovaných forem PDT zcela neškodné. Komplikace tohoto souboru byly uvedeny v 5,5 %, z toho atrofie RPE v 4 %, závažný akutní pokles NKZO u 1,5 % pacientů. Zdůvodnění poklesu zrakových funkcí nebylo v tomto případě uvedeno [26]. S ohledem na možné komplikace vznikla řada klinických studií potvrzující efektivitu i bezpečnost PDT v modifikovaných dávkovacích schématech. Autoři Nicoló, Smretschnig, Rouvas ve svých pracích publikovali efekt poloviční energie PDT (25 J/cm2, HF-PDT), která vedla ke kompletnímu vstřebání SRT v 84–100 % očí s mírou rekurence 0–29 % [37,45,46]. Podobné výsledky byly prezentovány autory Chanem, Nicolem a Fujitou při užití redukované dávky verteporfinu (3 mg/m2 HD-PDT), kdy došlo k resorpci SRT u 89,2–100 % s mírou rekurence 0–17,2 % [7,12,37]. Ačkoliv Alkin a Kim nezaznamenali signifikantní rozdíl v anatomickém a funkčním efektu mezi jednotlivými léčebnými modifikacemi [1,22], Nicoló prezentoval rychlejší absorpci SRT a dlouhodobější efekt při HD-PDT v porovnání s HF-PDT [37]. Fujita a kol. publikoval doposud největší soubor pacientů s cCSC léčených HD-PDT na jednom klinickém pracovišti. Na konci sledovacího období mělo 89,2 % z 204 očí kompletní resorpci subretinální tekutiny, 5,4 % očí perzistující SRT a míra rekurence onemocnění byla 5,9 % [12].
V našem prospektivním nerandomizovaném klinickém hodnocení jsme posuzovali anatomické a funkční výsledky 52 pacientů (54 očí) léčených na Oční klinice 1.LF UK a ÚVN-VFN Praha v letech 2012–2018 pro cCSC pomocí metody HD-PDT. V našem souboru pacientů jsme na konci sledovacího období dosáhli zlepšení či funkčně-anatomické stabilizace u 50 očí (92,7 %), perzistující SRT byla zaznamenána u 2 očí (3,7 %) a u 3 očí (5,6 %) jsme v průběhu ročního sledování zaznamenali recidivu, přičemž u 2 očí na konci ročního sledování. Průměrný věk pacientů byl 50,1 let (medián 49,5, rozmezí 30–75), průměrný počet HD-PDT sezení byl 1,07 (rozmezí 1–2), průměr velikosti použité laserové stopy byl 1352 µm (v intervalu od 800 µm do 2800 µm).
Z celkového počtu 54 očí s cCSC došlo ke kompletnímu vstřebání subretinální tekutiny u 49 očí (90,7 %). Průměrná hodnota vstupní CRT 385,6 ± 118,5 µm (medián 367,5 µm) klesla na hodnotu 263,5 ± 52 µm (medián 258,5 µm) na konci sledovacího období. Míra resorpce SRT po HD-PDT léčbě se v dosavadních klinických studiích uvádí v rozmezí 85–100 %, naše míra úspěšnosti u 90,7 % očí je s těmito údaji srovnatelná [7,12,21,24,37].
V průběhu 12-ti měsíční sledovací doby se zraková ostrost signifikantně zlepšila. Největší zisk písmen byl pozorován 1. měsíc (5,7 ± 6,1, medián 5 písmen ETDRS) po HD-PDT s pozvolným dalším zlepšením v 3. (8,4 ± 6,4, medián 8 písmen ETDRS) a 6. měsíci (9,6 ± 7,6, medián 10 písmen ETDRS), stabilizace NKZO byla dosažena půl roku po léčbě a byla udržena do konce sledovacího období, kdy činil průměrný zisk 10,1 ± 7,2 písmen ETDRS (medián 10). Postupné další zlepšování NKZO i po přiložení neuroretiny je pravděpo-dobně dáno pozvolným zlepšením integrity retinálních vrstev, obnovou zóny interdigitací mezi fotoreceptory a buňkami RPE [40]. Na konci sledovacího období bylo v našem souboru pozorováno zlepšení centrální zrakové ostrosti u 50 z 54 očí (92,6 %). Zaznamenali jsme zlepšení průměrné NKZO z počáteční hodnoty 68,9 ± 10,5 písmen ETDRS (medián 71) na hodnotu 79 ± 11 písmen ETDRS (medián 82) na konci sledovacího období. V žádném případě nedošlo k poklesu zrakové ostrosti o 5 a více písmen ETDRS. Zlepšení či stabilizace NKZO jsme dosáhli celkem u 50 očí (92,6 %), u 13 očí (24,1 %) se NKZO zlepšila o více jak 3 řádky, u 53,7 % o více jak 2 řádky ETDRS optotypů. Naše výsledky jsou v souladu s dostupnou literaturou [1,12,21,26,35].
Fotodynamická terapie však může mít potenciální vedlejší účinky jako jsou RPE atrofie, trhlina RPE, sub-RPE hemoragie, choroidální ischemie nebo sekundární CNV [6,9,10]. Většina pacientů, u kterých byly tyto komplikace popisovány byli léčeni PDT ve standardním dávkovacím režimu [26]. Dle dostupné literatury jsou anatomické i funkční výsledky mezi standardní a HD-PDT srovnatelné, zdá se však, že HD-PDT je metodou bezpečnější. Fujita a kol. nepozorovali u žádného z 204 léčených očí pomocí HD-PDT komplikující CNV [12], podobně jako Karakus a kol., kteří stejnou metodou léčili 27 očí [21]. Na rozdíl od těchto autorů popisuje Tseng vznik komplikující CNV v souvislosti s HD-PDT u 2 z 56 očí (3,6 %) [48]. V naší studii došlo rovněž u 2 očí (3,7 %) k rozvoji zřetelně prokázané komplikující CNV do 1 měsíce od provedení léčby, v obou případech se jednalo o CNV typu II (tedy drobná klasická CNV). Rozvoj sekundární CNV u cCSC byl popisován zejména v souvislosti se standardní PDT nebo laserovou fotokoagulací, CNV však může být komplikací samotné cCSC [6,11,47]. Za předpokladu, že do naší studie byli zařazeni pouze pacienti, u nichž vstupní vyšetření (OCT/FAG/ICG) neprokázala přítomnost CNV, považujeme vznik CNV (typu II) do 1 měsíce od provedení HD-PDT v našem souboru jako komplikaci této léčby. Další skutečností, která nás o tomto přesvědčuje je fakt, že CNV vznikající na podkladě dlouhotrvající cCSC bývá zpravidla typ I neovaskularizace, tedy okultní CNV [4].
Vzhledem k patofyziologii onemocnění je užití anti-VEGF preparátů k léčbě CSC sporné. Řada klinických studií poskytla nejednoznačné výsledky efektu anti-VEGF preparátů v léčbě CSC [3,8,28]. Onemocnění samo o sobě není spojováno s vyšší hladinou VEGF ve sklivci a účinek anti-VEGF léčby u CSC bez přítomné CNV nebyl vesměs prokázán [27]. Jiná situace však nastává u komplikovaných případů sekundární CNV na podkladě CSC. Předchozí klinické studie prokázaly anatomický i funkční efekt bevacizumabu, ranibizumabu a afliberceptu v léčbě CNV asociované s CSC [5,8,23]. Existují však jen velmi omezená data dokazující účinnost a bezpečnost kombinované léčby PDT a anti-VEGF. Asahi demonstroval pozitivní výsledky kombinované terapie HD-PDT + aflibercept u pacientů nereagujících na konvenční léčbu (laserfotokoagulace, monoterapie PDT, monoterapie anti-VEGF), větší úspěch zaznamenal především u očí komplikovaných CNV [2].
Za výhody naší studie považujeme prospektivní design, kompletní roční sledovací dobu u všech pacientů, statisticky hodnotitelná data, konzistentní poměrně velký soubor pacientů léčený a sledovaný 1 examinátorem na 1 klinickém pracovišti. Limitujícím faktorem je absence kontrolní skupiny (placebo či jiný léčebný přístup), nejedná se tedy o randomizované klinické hodnocení.
ZÁVĚRY
Fotodynamická terapie v redukovaném dávkovacím režimu je bezpečnou a efektivní léčbou chronických forem centrální serózní chorioretinopatie. Je však zřejmé, že léčba pokročilých difuzních a recidivujících forem CSC je často velmi svízelná a volba pouze jedné léčebné modality nemusí vést k uspokojivému anatomicko-funkčnímu výsledku. Nabízí se tedy myšlenka, že kombinovaná terapie by měla být vyhrazena zvláště pro komplikované stavy CSC, kdy i šetrný režim PDT může v ischemickém terénu chronicky poškozené choriokapilaris a přítomné CNV dále zvýšit expresi VEGF faktorů. Aplikace anti-VEGF by vedle snížení aktivity CSC mohla tento negativní dopad PDT neutralizovat a snížit tak riziko progrese CNV.
Dnešní technické pokroky v diagnostice a léčbě CSC v kombinaci se zkušenostmi našeho pracoviště představují výrazné zlepšení prognózy našich pacientů s cCSC, u kterých je nutná nejen správná diagnostika onemocnění založená na multimodálním zobrazení, ale především správné nastavení a načasování adekvátní léčby. Z našich dosavadních výsledků také vyplývá, že by léčba chronických forem CSC měla být zahájena v časných stádiích, abychom docílili co možná nejlepších anatomických a funkčních výsledků, dokud ještě nejsou vyjádřeny irreverzibilní změny jako DRPE nebo komplikující CNV.
- Autoři práce prohlašují, že vznik i téma odborného sdělení a jeho zveřejnění není ve střetu zájmů a není podpořeno žádnou farmaceutickou firmou.
- Autoři práce prohlašují, že práce nebyla zadána jinému časopisu ani jinde otištěna, s vyjímkou kongresových abstrakt či doporučených postupů.
MUDr. Kateřina Manethová, FEBO
Thomayerova nemocnice, Vídeňská 800
140 59 Praha 4 – Krč
Do redakce doručeno dne: 17. 4. 2019
Do tisku přijato dne: 15. 1. 2020
Zdroje
1. Alkin, Z., Perente, I., Ozkaya, A. et al.: Comparison of efficacy between low-fluence and half-dose verteporfin photodynamic therapy for chronic central serous chorioretinopathy. Clin Ophthalmol, 8; 2014 : 685–690.
2. Asahi, MG., Chon, AT., Gallemore, E. et al.: Photodynamic therapy combined with antivascular endothelial growth factor treatment for recalcitrant chronic central serous chorioretinopathy. Clin Ophthalmol, 11; 2017 : 2051–2056.
3. Bae, SH., Heo, J., Kim, C. et al.: Low-fluence photodynamic therapy versus ranibizumab for chronic central serous chorioretinopathy: one-year results of a randomized trial. Ophthalmology, 121; 2014 : 558–565.
4. Bonini Filho, MA., de Carlo, TE., Ferrara, D. et al.: Association of Choroidal Neovascularization and Central Serous Chorioretinopathy With Optical Coherence Tomography Angiography. JAMA Ophthalmol, 133; 2015 : 899–906.
5. Broadhead, GK., Chang, A.: Intravitreal aflibercept for choroidal neovascularisation complicating chronic central serous chorioretinopathy. Graefes Arch Clin Exp Ophthalmol, 253; 2015 : 979–981.
6. Cardillo Piccolino, F., Eandi, CM., Ventre, L. et al.: Photodynamic therapy for chronic central serous chorioretinopathy. Retina, 23; 2003 : 752–763.
7. Chan, WM., Lai, TY., Lai, RY. et al.: Safety enhanced photodynamic therapy for chronic central serous chorioretinopathy: one-year results of a prospective study. Retina, 28; 2008 : 85–93.
8. Chan, WM., Lai, TY., Liu, DT. et al.: Intravitreal bevacizumab (avastin) for choroidal neovascularization secondary to central serous chorioretinopathy, secondary to punctate inner choroidopathy, or of idiopathic origin. Am J Ophthalmol, 143; 2007 : 977–983.
9. Chan, WM., Lam, DS., Lai, TY. et al.: Choroidal vascular remodelling in central serous chorioretinopathy after indocyanine green guided photodynamic therapy with verteporfin: a novel treatment at the primary disease level. Br J Ophthalmol, 87; 2003 : 1453–1458.
10. Colucciello, M.: Choroidal neovascularization complicating photodynamic therapy for central serous retinopathy. Retina, 26; 2006 : 239–242.
11. Daruich, A., Matet, A., Dirani, A. et al.: Central serous chorioretinopathy: Recent findings and new physiopathology hypothesis. Prog Retin Eye Res, 48; 2015 : 82–118.
12. Fujita, K., Imamura, Y., Shinoda, K. et al.: One-year outcomes with half-dose verteporfin photodynamic therapy for chronic central serous chorioretinopathy. Ophthalmology, 122; 2015 : 555–561.
13. Gass, JDM.: Stereoscopic Atlas of Macular Diseases: Diagnosis and Treatment. 4th edition. St. Louis, Mosby, 1997, 1061 p.
14. Golshahi, A., Klingmuller, D., Holz, FG. et al.: Ketoconazole in the treatment of central serous chorioretinopathy: a pilot study. Acta Ophthalmol, 88; 2010 : 576–581.
15. Haimovici, R., Rumelt, S., Melby, J.: Endocrine abnormalities in patients with central serous chorioretinopathy. Ophthalmology, 110; 2003 : 698–703.
16. Huang, WC., Chen ,WL., Tsai, YY. et al.: Intravitreal bevacizumab for treatment of chronic central serous chorioretinopathy. Eye (Lond), 23; 2009 : 488–489.
17. Ie, D., Yannuzzi, LA., Spaide, RF. et al.: Subretinal exudative deposits in central serous chorioretinopathy. Br J Ophthalmol, 77; 1993 : 349–353.
18. Iida, T., Yannuzzi, LA., Spaide, RF. et al.: Cystoid macular degeneration in chronic central serous chorioretinopathy. Retina, 23; 2003 : 1–7; quiz 137–8.
19. Imamura, Y., Fujiwara, T., Margolis, R. et al.: Enhanced depth imaging optical coherence tomography of the choroid in central serous chorioretinopathy. Retina, 29; 2009 : 1469–1473.
20. Jalkh, AE., Jabbour, N., Avila, MP. et al.: Retinal pigment epithelium decompensation. I. Clinical features and natural course. Ophthalmology, 91; 1984 : 1544–1548.
21. Karakus, SH., Basarir, B., Pinarci, EY. et al.: Long-term results of half-dose photodynamic therapy for chronic central serous chorioretinopathy with contrast sensitivity changes. Eye (Lond), 27; 2013 : 612–620.
22. Kim, YK., Ryoo, NK., Woo, SJ. et al.: Comparison of visual and anatomical outcomes of half-fluence and half-dose photodynamic therapy in eyes with chronic central serous chorioretinopathy. Graefes Arch Clin Exp Ophthalmol, 253; 2015 : 2063–2073.
23. Konstantinidis, L., Mantel, I., Zografos, L. et al.: Intravitreal ranibizumab in the treatment of choroidal neovascularization associated with idiopathic central serous chorioretinopathy. Eur J Ophthalmol, 20; 2010 : 955–958.
24. Lai, TY., Chan, WM., Li, H. et al.: Safety enhanced photodynamic therapy with half dose verteporfin for chronic central serous chorioretinopathy: a short term pilot study. Br J Ophthalmol, 90; 2006 : 869–874.
25. Leaver, P., Williams, C.: Argon laser photocoagulation in the treatment of central serous retinopathy. Br J Ophthalmol, 63; 1979 : 674–677.
26. Lim, JI., Glassman, AR., Aiello, LP. et al.: Collaborative retrospective macula society study of photodynamic therapy for chronic central serous chorioretinopathy. Ophthalmology, 121; 2014 : 1073–1078.
27. Lim, JW., Kim, MU., Shin, MC.: Aqueous humor and plasma levels of vascular endothelial growth factor and interleukin-8 in patients with central serous chorioretinopathy. Retina, 30; 2010 : 1465–1471.
28. Lim, SJ., Roh, MI., Kwon, OW.: Intravitreal bevacizumab injection for central serous chorioretinopathy. Retina, 30; 2010 : 100–106.
29. L’Esperance, FA.: Ophthalmic lasers: Photocoagulation, photoradiation, and surgery. 2nd edition. St. Louis, Mosby, 1983, 606 p.
30. Manayath, GJ., Shah, VS., Saravanan, VR. et al.: Polypoidal choroidal vasculopathy associated with central serous chorioretinopathy: Pachychoroid Spectrum of Diseases. Retina, 38; 2018 : 1195–1204.
31. Maruko, I., Iida, T., Sekiryu, T. et al.: Morphologic changes in the outer layer of the detached retina in rhegmatogenous retinal detachment and central serous chorioretinopathy. Am J Ophthalmol, 147; 2009 : 489–494.
32. Michels, S., Hansmann, F., Geitzenauer, W. et al.: Influence of treatment parameters on selectivity of verteporfin therapy. Invest Ophthalmol Vis Sci, 47; 2006 : 371–376.
33. Moon, JW., Yu, HG., Kim, TW. et al.: Prognostic factors related to photodynamic therapy for central serous chorioretinopathy. Graefes Arch Clin Exp Ophthalmol, 247; 2009 : 1315–1323.
34. Mudvari, SS., Goff, MJ., Fu, AD. et al.: The natural history of pigment epithelial detachment associated with central serous chorioretinopathy. Retina, 27; 2007 : 1168–1173.
35. Naseripour, M., Falavarjani, KG., Sedaghat, A. et al.: Half-dose Photodynamic Therapy for Chronic Central Serous Chorioretinopathy. J Ophthalmic Vis Res, 11; 2016 : 66–69.
36. Nicholson, B., Noble, J., Forooghian, F. et al.: Central serous chorioretinopathy: update on pathophysiology and treatment. Surv Ophthalmol, 58; 2013 : 103–126.
37. Nicolo, M., Eandi, CM., Alovisi, C. et al.: Half-fluence versus half-dose photodynamic therapy in chronic central serous chorioretinopathy. Am J Ophthalmol, 157; 2014 : 1033–1037.
38. Nicolo, M., Zoli, D., Musolino, M. et al.: Association between the efficacy of half-dose photodynamic therapy with indocyanine green angiography and optical coherence tomography findings in the treatment of central serous chorioretinopathy. Am J Ophthalmol, 153; 2012 : 474–480.
39. Obana, A., Gohto, Y., Kaneda, K. et al.: Selective occlusion of choroidal neovascularization by photodynamic therapy with a water-soluble photosensitizer, ATX-S10. Lasers Surg Med, 24; 1999 : 209–222.
40. Piccolino, FC., de la Longrais, RR., Ravera, G. et al.: The foveal photoreceptor layer and visual acuity loss in central serous chorioretinopathy. Am J Ophthalmol, 139; 2005 : 87–99.
41. Pikkel, J., Beiran, I., Ophir, A. et al.: Acetazolamide for central serous retinopathy. Ophthalmology, 109; 2002 : 1723–1725.
42. Prunte, C., Flammer, J.: Choroidal capillary and venous congestion in central serous chorioretinopathy. Am J Ophthalmol, 121; 1996 : 26–34.
43. Reibaldi, M., Cardascia, N., Longo, A. et al.: Standard-fluence versus low-fluence photodynamic therapy in chronic central serous chorioretinopathy: a nonrandomized clinical trial. Am J Ophthalmol. 149; 2010 : 307–315.
44. Robertson, DM.: Argon laser photocoagulation treatment in central serous chorioretinopathy. Ophthalmology, 93; 1986 : 972–974.
45. Rouvas, A., Stavrakas, P., Theodossiadis, PG. et al.: Long-term results of half-fluence photodynamic therapy for chronic central serous chorioretinopathy. Eur J Ophthalmol, 22; 2012 : 417–422.
46. Smretschnig, E., Ansari-Shahrezaei, S., Hagen, S. et al.: Half-fluence photodynamic therapy in chronic central serous chorioretinopathy. Retina, 33; 2013 : 316–323.
47. Spaide, RF., Campeas, L., Haas, A. et al.: Central serous chorioretinopathy in younger and older adults. Ophthalmology, 103; 1996 : 2070–2079.
48. Tseng, CC., Chen, SN.: Long-term efficacy of half-dose photodynamic therapy on chronic central serous chorioretinopathy. Br J Ophthalmol, 99; 2015 : 1070–1077.
49. Uetani, R., Ito, Y., Oiwa, K. et al.: Half-dose vs one-third-dose photodynamic therapy for chronic central serous chorioretinopathy. Eye (Lond), 26; 2012 : 640–649.
50. Yannuzzi, LA., Slakter, JS., Gross, NE. et al.: Indocyanine green angiography-guided photodynamic therapy for treatment of chronic central serous chorioretinopathy: a pilot study. Retina, 23; 2003 : 288–298.
Prezentace: Dlouhodobé výsledky léčby chronických forem CSC v ÚVN (Manethová K, Ernest J, Hrevuš M, Hradcová Z), 19. Vejdovského olomoucký vědecký den, 17. 3. 2018, Olomouc.
Štítky
Oftalmologie
Článek OCENĚNÍ ČLS JEPČlánek CENA PREZIDENTA ČLK
Článek vyšel v časopiseČeská a slovenská oftalmologie
Nejčtenější tento týden
2019 Číslo 6- Stillova choroba: vzácné a závažné systémové onemocnění
- Familiární středomořská horečka
- Diagnostický algoritmus při podezření na syndrom periodické horečky
- Možnosti využití přípravku Desodrop v terapii a prevenci oftalmologických onemocnění
- Selektivní laserová trabekuloplastika nesnižuje nitroční tlak více než argonová laserová trabekuloplastika
-
Všechny články tohoto čísla
- Inovativní postupy v léčbě sítnicových onemocnění
- Posouzení účinnosti fotodynamické terapie u pacientů s chronickou centrální serózní chorioretinopatií
- Senzitivita a specificita metod pro měření astigmatismu oka
- Hodnocení rozptylu světla na sítnici, zrakové ostrosti, refrakce a subjektivní spokojenosti u pacientů po implantaci nitrooční čočky Acrysof IQ PanOptix
- Edém mihalníc ako prvý príznak lymfómového ochorenia
- OČNÍ PROJEVY PŘI CELKOVÉM ONEMOCNĚNÍ ROSACEA
- 100 let od narození prof. MUDr. Heleny Lomíčkové, DrSc. 40 let oční kliniky dětí a dospělých v Motole
- OCENĚNÍ ČLS JEP
- CENA PREZIDENTA ČLK
- Česká a slovenská oftalmologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- OČNÍ PROJEVY PŘI CELKOVÉM ONEMOCNĚNÍ ROSACEA
- Edém mihalníc ako prvý príznak lymfómového ochorenia
- Posouzení účinnosti fotodynamické terapie u pacientů s chronickou centrální serózní chorioretinopatií
- Inovativní postupy v léčbě sítnicových onemocnění
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



