-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Současný pohled na retinopatii nedonošených
Autoři: M. Odehnal; J. Malec; J. Štěpánková; D. Dotřelová
Působiště autorů: Oční klinika dětí a dospělých UK 2. LF a FN Motol, primář MUDr. Milan Odehnal, MBA
Vyšlo v časopise: Čes. a slov. Oftal., 67, 2011, No. 2, p. 35-41
Kategorie: Souborný referát
1. Úvod
Retinopatie nedonošených (ROP) je onemocnění vyvíjející se sítnice u novorozenců nízkých porodních hmotností. Bujení novotvořených sítnicových cév, spolu s vazivovou proliferací, může u malé, ale významné skupiny predisponovaných dětí způsobit trakční odchlípení sítnice s vážným poškozením zrakových funkcí. Přes všechny pokroky v neonatologické péči, screeningu a terapii, zaujímá ROP stále přední místo mezi příčinami nevidomosti u dětí ve vyspělých zemích. Klinický obraz akutní ROP většinou probíhá v postupném fázovitém vývoji, který může být následován jizevnatým procesem různého rozsahu. Hlavní patologické změny probíhají v terénu nezralé sítnice na rozhraní její vaskulární a avaskulární části. Další specifickou vlastností ROP je poměrně značná tendence ke spontánní regresi, dosahující až 70 %.
Používané pojmy v neonatologické literatuře a problematice ROP:
- Nedonošený novorozenec: dítě narozené před 38. gestačním týdnem.
- Novorozenec s nízkou porodní hmotností (méně 2500 g), novorozenec s velmi nízkou porodní hmotností (méně 1500 g) a novorozenec s extrémně nízkou porodní hmotností (méně 1000 g) (schéma 1).
- Gestační týden: počet ukončených týdnů v děloze.
- Postkoncepční týden: je součtem gestačního týdnu při narození a chronologického věku dítěte v týdnech (např. dítě narozené v 28. gestačním týdnu je vyšetřeno 4 týdny po porodu. Tzn. oftalmologická prohlídka probíhá v 32. postkoncepčním týdnu). Vzhledem k tomu, že není známo přesné datum koncepce, používá se rovněž přesnější termín postmenstruální nebo postmenstruační týden.
- Chronologický neboli postnatální týden představuje počet týdnů po narození.
- Korigovaný věk je chronologický věk snížený o počet týdnů, o které se dítě narodilo předčasně.
- Viabilita je životaschopnost plodu ve smyslu schopnosti přežití v extrauterinním prostředí po předčasném porodu.
Schéma 1. Stanovení věku novorozence 
Etiologie ROP je komplexní a multifaktoriální. Onemocnění je známo již 70 let, bylo zkoumáno více než 60 možných etiologických faktorů, a přesto je patogeneze ROP nevyjasněná. Naše současné poznání problematiky ROP se opírá především o laboratorní výzkumy a klinické multicentrické studie: CRYO-ROP STUDY, ICROP, LIGHT ROP, STOP-ROP, ETROP, ICROP revised [12, 15, 17]. Klinickým pozorováním bylo zjištěno, že existuje těsná vazba rozvoje ROP na stupeň nezralosti dítěte. Faktory, jako je porodní hmotnost pod 1000g a gestační stáří před 30. týdnem, predikují incidenci, průběh i prognózu ROP. Skupiny extrémně nezralých dětí představují největší rizika často oboustranného poškození očí. Pro vznik ROP je nebezpečná také dysregulace hladin VEGF nebo fluktuace parciálních tlaků kyslíku při oxygenoterapii.
V této souvislosti je třeba zdůraznit, že historie ROP je spjata s vývojem péče o nedonošené děti. Onemocnění probíhalo v podobě tří „epidemií“. První vlna ROP se objevila v 50. a 60. letech a zasáhla relativně hmotnostně větší děti, které byly špatně monitorované při oxygenoterapii. Rozvoj neonatologické péče paradoxně zapříčinil vznik druhé vlny ROP, která tentokrát postihla děti extrémně malé, tj. s porodní hmotností pod 1000 g, které přežívaly v zemích s vysokou úrovní neonatologické péče. Třetí vlna ROP je založena na kombinaci špatné monitorace vitálních funkcí a extrémní prematurity a postihuje především děti východní Evropy nebo Latinské Ameriky.
Incidence ROP ve vyspělých zemích prošla také značným vývojem. Např. v ČR se ročně narodí 8000 nedonošených dětí, z toho 1650 dětí s porodní hmotností pod 1000 g. V posledních letech jsme svědky snížení celkové incidence ROP a dokonce určité stabilizace incidence zrakově těžce postižených dětí v důsledku ROP (např. v r. 2000 bylo v ČR 39 dětí těžce zrakově postižených po proběhlé ROP, v r. 2009 to bylo jen 13 dětí). Tyto skutečnosti jsou především výsledkem zdokonalující se neonatologické péče jako je např. monitoring základních funkcí, aplikace surfaktantu či antenatálního podání kortikoidů matce nebo uvážlivá oxygenoterapie. Celková incidence ROP se pohybuje kolem 8 %. Ve skupinách dětí pod 700 g je však kolem 15 %.
2. Klinický obraz a průběh ROP jsou založeny na třech základních charakteristikách
2.1. Stupeň onemocnění, který nás informuje o pokročilosti ROP:
Stupeň 1: demarkační linie mezi vaskulární a vaskulární částí sítnice.
Stupeň 2: elevovaný hřeben mezi vaskulární a avaskulární částí sítnice.
Stupeň 3: extraretinální neovaskularizace a fibroproliferace (prahový stupeň).
Stupeň 4: částečné odchlípení sítnice: 4a makula zachována, 4b makula odchlípena.
Stupeň 5: totální odchlípení sítnice.
2.2. Lokalizace ROP a rozsah onemocnění nás informují o patologických změnách sítnice, udávaných v zónách a sektorech sítnice (schéma 2):
Zóna I sítnice představuje nejvnitřnější kruh sítnice zahrnující makulární krajinu.
Zóna II sítnice je oblast střední třetiny sítnice, nazálně dosahující periferního okraje sítnice.
Zóna III sítnice zahrnuje nejzevnější temporální část sítnice.
2.3. Plus forma (plus disease):
Je charakterizována přítomností vaskulární tortuozity a dilatace na zadním pólu oka. Je příznakem pokračující hypoxie sítnice a proto může být přítomna v jakémkoliv stupni ROP. Zároveň vyjadřuje i vysoké riziko další progrese ROP.
Pre-plus forma (disease) – toto kritérium bylo stanoveno v rámci revize mezinárodní klasifikace ROP v r. 2006. Znamená dilataci a tortuozitu cév větší než fysiologický stav, ale nedosahující kritérií Plus formy ROP. Podobně jako u Plus formy se píše celým názvem za vývojovým stupněm ROP. Např. Stupeň 1 ROP s Pre-plus formou.
Projevy:
- Přední segment: rigidita zornice, neovaskularizace cév na duhovce, vitreální zkalení.
- Fundus: dilatace sítnicových vén a tortuozita sítnicových arterií.
3. Screening ROP
Screeningové metody u ROP jsou vypracovány na základě empirických zkušeností, statistického zpracování výsledků multicentrických studií a poznatků v oboru dětské oftalmologie a neonatologie. Z těchto údajů vyplývá, že poměrně malá část nedonošených dětí vyžaduje oftalmologickou léčbu.
Cílem současného screeningu ROP je včasná detekce rizikových forem ROP, kterými jsou prahová a předprahová stadia ROP (viz oddíl D).
3.1. Pro zahájení a následné ukončení screeningu je důležité:
3.1.1. Hmotnostní a věkové kritérium nedonošených dětí
Podle doporučení Britské společnosti pro perinatální medicínu a Americké asociace pro pediatrickou oftalmologii a strabismus jsou do screeningu ROP zařazeny děti s porodní hmotností pod 1500 g a narozené před 31. gestačním týdnem. Do screeningového programu však mohou být zařazeny individuálně i děti s vyšší porodní hmotností než 1500 g nebo děti narozené později, po 31. gestačním týdnu. Jsou to děti s potencionálním rizikem vzniku ROP, především z těchto důvodů: respiratory distress syndrom, sepse, krevní transfuze, vícečetné porody, apnoické pauzy, intraventrikulární hemoragie, opakované krevní transfuze a opakovaná oxygenoterapie, hlavně v prvních dnech života [26]. O indikaci k jejich zařazení do screeningu rozhoduje neonatolog spolu s oftalmologem. Kritéria screeningu ROP v různých zemích ukazuje tabulka 1.
Tab. 1. Kritéria screeningu ROP v různých zemích 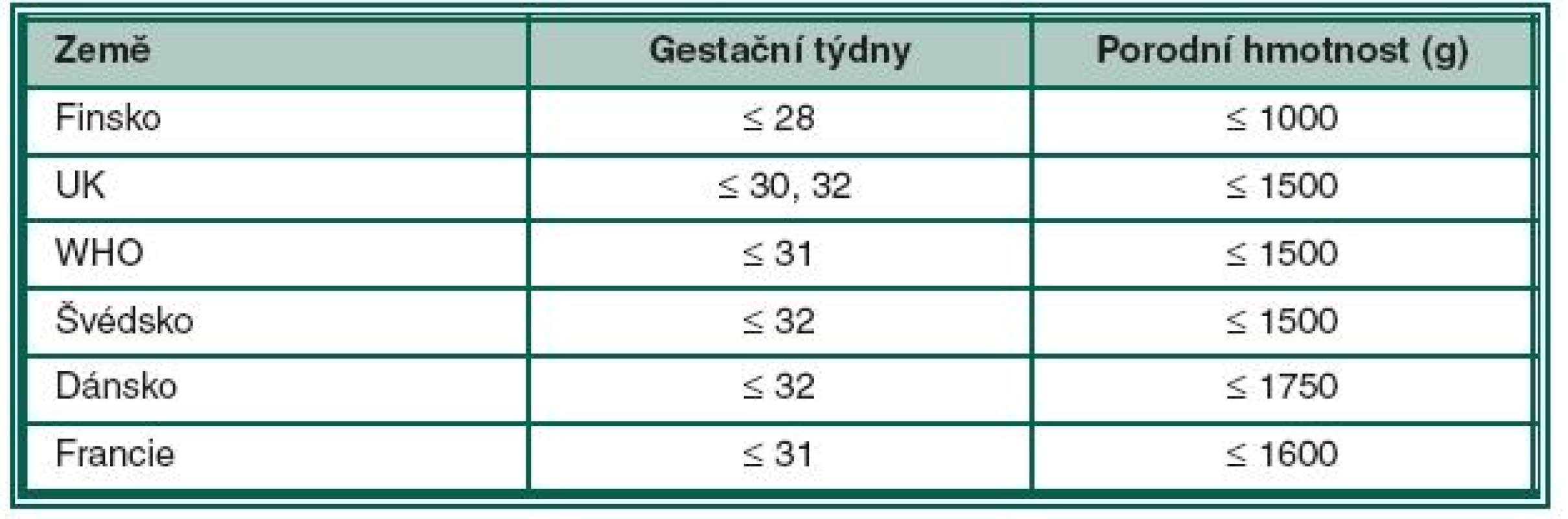
3.1.2. Stanovení optimálního termínu prvního vyšetření nedonošených dětí
Termín prvního oftalmologického vyšetření je považován za klíčový moment screeningu a prošel dlouhou dobou vývoje a názorových diskusí. V praxi jde o to, nalézt takový algoritmus, abychom nepropásli začátek vysoce rizikových forem ROP u dětí extrémně nezralých, ale i rozvoj ROP u dětí větších. Impulzem pro screening ROP byly multicentrické studie CRYO-ROP a ETROP (včasná terapie retinopatie nedonošených), ale také LIGHT-ROP (vliv světla na ROP) [15]. Tyto studie ukazují, že rizikové nálezy ROP (předprahové a prahové stadium ROP) se vyskytují pouze u 1 % dětí do 31. postkoncepčního týdne a pouze u 1 % u dětí do 46. postkoncepčního týdne. Většina ROP se tedy vyvíjí mezi 31. a 46. postkoncepčním týdnem (resp. mezi 5. až 19. postnatálním týdnem). U dětí po 46. postkoncepčním týdnu jich 99 % nemívá navíc rizikovou formu ROP. Diskuse probíhala o tom, zda při detekci ROP použijeme jako kritérium postnatální věk anebo postkoncepční věk. Pro postnatální kritérium platí, že čím je dítě nezralejší, hmotnostně menší, tím časově později (v týdnech) je diagnostikováno prahové nebo předprahové stadium ROP. Např. u dítěte narozeném v 25. gestačním týdnu je obvykle diagnostikováno prahové stadium ROP za 12 týdnů od porodu tzn. v 37. postkoncepčním týdnu. Zralejší dítě narozené v 30. gestačním týdnu může dosáhnout prahové stadium za 7 týdnů, tedy za kratší dobu. Při posuzování incidence rizikových stadií podle postnatálního věku tedy vidíme, že medián četnosti výskytu prahového stadia ROP je pro děti s různou zralostí, resp. porodní hmotností různý. Jiná je situace u postkoncepčního věku, který jako kritérium vývoje ROP je považován mnohými autory jako výhodnější algoritmus. Při jeho použití vidíme, že medián incidence prahových stadií ROP se pohybuje pro děti všech hmotnostních kategorií v úzkém časovém rozmezí, kolem 36. až 37. týdne (tabulka 2). Optimální variantou zahájení vyšetření se ukázala kombinace postnatálního a postkoncepčního věku konkrétně 5. postnatálního a 31. postkoncepčního týdne věku, podle toho, který termín nastane dříve. Časovým pilířem tohoto algoritmu je 31. postkoncepční týden a 5. postnatální týden, protože pod těmito časovými momenty je riziko vzniku akutní formy ROP jen 1 %. Kombinace postnatálního a postkoncepčního věku se nazývá duální systém detekce ROP. Tento typ sledování je možno použít jako univerzální screening nedonošených dětí různých porodních hmotností a zralosti. To je výhodou, protože u dříve prováděných screeningových postupů někdy „unikly“ děti extrémně nezralé, narozené např. kolem 22.–23. gestačního týdne nebo naopak větší děti narozené kolem 30. nebo 31. gestačního týdne. Nelze pominout i ekonomický benefit této metody (cost-benefits). Riziko pochybení u této metodiky se uvádí kolem 1 %. Tabulka č. 2 ukazuje algoritmus timingu prvního vyšetření u dětí s různým gestačním věkem vzhledem k postkoncepčnímu týdnu. Z tabulky vyplývá, že počínaje 26. gestačním týdnem zahajujeme screening ROP až v 31. postkoncepčním týdnu. Vidíme, že duální systém detekce ROP redukuje i předčasná, zavádějící a pro novorozence mnohdy velmi zatěžující vyšetření.
Tab. 2. Načasování prvního vyšetření ROP 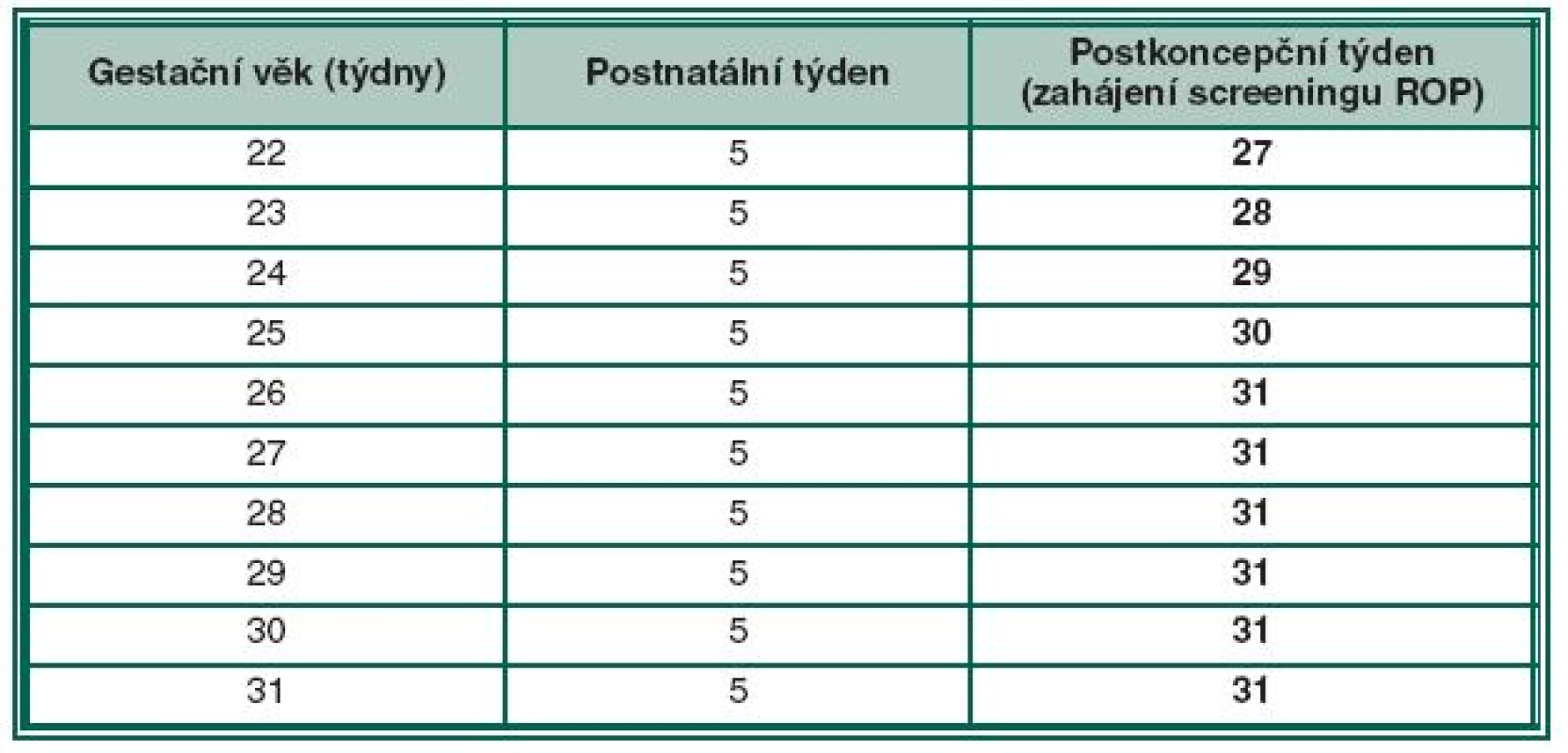
3.1.3. Vlastní vyšetření očního pozadí nedonošeného dítěte
Dítě má být lačné 30 minut před vyšetřením. Doporučuje se přítomnost neonatologa a využití pulsní oxymetrie. Pro oftalmoskopické vyšetření dilatujeme zornici kombinací 2,5% Phenylephrinu a 2% Homatropinu nebo použijeme 1% Unitropic. Vyšetření provádíme nepřímou oftalmoskopií spojnými čočkami 20, 25 nebo 28 Dpt. Někdy musíme použít víčkový rozvěrač, podobně tak jako sklerální indentaci. Velmi dobré je provádět tyto procedury v topické anestezii (Benoxi 0,5%). Vlastní vyšetření se zahájí examinací zadního pólu k posouzení event. dilatace a tortuozity cév (pre - a plus disease), poté se vyšetřuje nazální polovina sítnice a nakonec temporální část k určení vaskularizované zóny a event. stadia ROP. Po skončení vyšetření by dítě nemělo jednu hodinu jíst. Vyšetřování nedonošených dětí vyžaduje zkušenost jak v technice vlastního vyšetření, tak i v hodnocení nálezů.
3.1.4. Algoritmus oftalmologických kontrol
Časový algoritmus kontrol je ovlivněn výše uvedenými základními charakteristikami ROP: lokalizací, stupněm a přítomností plus nebo pre-plus formy ROPK dispozici jsou doporučené postupy (guidelines) kontrolních vyšetření ROP (tabulka 3). Dnes je zdůrazňována role zkušeného oftalmologa a jeho anticipace při odhadu vývoje ROP.
Tab. 3. Algoritmus oftalmologických kontrol ROP (ETROP study Guidelines) 
3.1.5. Kritéria ukončení screeningu ROP jsou založena na individuálním zhodnocení postkoncepčního věku dítěte v závislosti na oftalmologickém nálezu
Hodnotíme:
- a) ukončení vaskularizace zóny III sítnice,
- b) věk dítěte: dosažení 45.–46. postkoncepčního týdne,
- c) regrese ROP: je optimální provést během poslední kontroly fotodokumentaci fundu.
3.2. Některé praktické poznámky pro screening ROP
3.2.1. Necelé 1 % rizikových forem ROP je diagnostikováno před 31. postkoncepčním týdnem a 1 % po 45. postkoncepčním týdnu
3.2.2. Stav zralosti sítnice je pro vývoj ROP důležitější, než neonatální okolnosti (nemocnost, terapie kyslíkem atd.)
3.2.3. Čím větší je avaskulární zóna sítnice, tím je větší riziko ROP
3.2.4. Progrese ROP je závislá na lokalizaci prvních projevů ROP a na jejich rozsahu
3.2.5. Gestační věk dítěte ovlivňuje lokalizaci prvních projevů ROP:
- a) děti narozené před 27. gestačním týdnem mají první známky ROP v nazální polovině sítnice,
- b) děti narozené před 29. gestačním týdnem mají první známky ROP v temporální polovině sítnice,
- c) děti narozené mezi 27.–29. gestačním týdnem mají první známky ROP nazálně i temporálně na sítnici,
- d) ROP v horních kvadrantech sítnice má tendenci k rychlé progresi.
4. Kritéria indikace k terapii
4.1. Prahové stadium ROP
Prahové stadium, resp. stadium 3 ROP představuje klasický klinický obraz ROP, kdy oftalmolog indikuje intervenční terapii. Základní kritéria k indikaci terapie u prahového stadia položila pionýrská studie CRYO-ROP v r. 1988 (Trial of Cryotherapy for Retinopathy of Prematurity).
Definice prahového stadia: stadium 3 ROP v zóně I nebo II sítnice v rozsahu nejméně 5 kontinuálních nebo 8 kumulativních sektorů sítnice (hodin). Přítomna je plus forma ROP.
4.2. Předprahové stadium ROP
Kritéria předprahového stadia stanovila v r. 2003 studie ETROP (studie tzv. včasné terapie ROP). Indikace k včasné terapii byla založena na základě lepších anatomických a funkčních výsledků.
Studie ETROP [17] stanovila nové 2 typy předprahového stadia ROP:
4.2.1. Typ 1 ROP – předprahové stadium s vysokým rizikem indikovaným k terapii
- a) Zóna I sítnice: jakékoliv stadium ROP s plus formou (plus disease) či stadium 3 ROP bez plus formy.
- b) Zóna II sítnice: stadium 2 nebo 3 ROP s plus formou.
4.2.2. Typ 2 ROP – předprahové stadium ROP s nízkým rizikem (doporučeno zvýšeně sledovat – „wait and watch“)
- a) Zóna I sítnice: stadium ROP 1 nebo 2 bez plus formy.
- b) Zóna II sítnice: stadium ROP 3 bez plus formy.
4.3. Agresivní posteriorní formy (AP-ROP = Agressive Posterior ROP)
Tyto atypické formy ROP byly nově popsány v rámci revize mezinárodní klasifikace ROP v roce 2006. Jde o rapidně probíhající formy s diagnostickými a léčebnými obtížemi, pro které je charakteristické:
4.3.1. Lze obtížně diagnostikovat prahové nebo předprahové stadium
4.3.2. Jednotlivé vývojové stupně ROP jsou nezřetelné
4.3.3. Lokalizace zón sítnice je obtížná
4.3.4. Typický hřeben s proliferacemi není patrný, diagnostikujeme pouze plochý cirkulární arteriovenózní shunt na rozmezí vaskulární a avaskulární sítnice
4.3.5. Forma plus je pravidlem
5. Možnosti chirurgické léčby ROP
5.1. Léčba ROP
Včasná terapie předprahových stadií ROP je indikována do 72 nebo i do 48 hodin od stanovení diagnózy [18]. Současná metodika doporučuje ošetřit avaskulární část sítnice v rozsahu 360 stupňů laserem nebo kryoterapií, podle kritérií uvedených v dalším oddílu. Fotokoagulace je zlatým standardem dnešních terapeutických postupů [25]. Ošetřujeme avaskulární část sítnice. Názory na přímé ošetření valu mezi vaskulární a avaskulární částí sítnice se liší [2, 3, 6, 11, 13, 14]. Analgosedace připraví dítě k výkonu a jeho monitorace je v rukou neonatologa nebo dětského anesteziologa. Výkon by měl být proveden v adekvátní místnosti (operační sál, nebo JIP na neonatologickém oddělení), kde je k dispozici resuscitační a ventilační technika. Postoperační péči řídí neonatolog, lokálně aplikujeme oftalmologika se steroidy po dobu jednoho týdne.
5.1.2. Poznámky k technice kryoterapie
- a) Výkon by neměl celkově překročit 60 minut.
- b) Ke kryoterapii se používá speciálně zakřivená a upravená dětská sonda k ošetření sítnice.
- c) Indentace skléry není nutná.
- d) Většinou se aplikují 4 body v každém kvadrantu avaskulární části sítnice, ale je možné ošetřit sítnici cirkulární aplikací bodů. Při technice minimální kryopexe se aplikují pouze 2 body v každém kvadrantu.
- e) Ošetření avaskulární zóny sítnice je tradičním postupem.
- f) Ošetření vlastního hřebenu mezi vaskulární a vaskulární sítnicí je ale také doporučováno [11].
- g) Body po kryopexi sítnice musí být oftalmologicky viditelné jako zbělení sítnice. Odstup mezi jednotlivými body kryopexe by měl být v rozsahu jednoho bodu (kryobody v pooperačním období expandují).
- h) Potenciální rizika:
- h1) systémová (apnoe, bradykardie),
- h2) lokální (subkonjunktivální hematom, otok víček, lacerace spojivky, vitreální či sítnicové hemoragie, nadměrné či nežádoucí jizvení sítnice).
5.1.3. Poznámky k technice laserové fotokoagulace
- a) Výkon by neměl celkové překročit 90 minut.
- b) Používá se nejčastěji diodový laser pro transsklerální i pro transpupilární ošetření.
- c ) Charakteristika použití
laseru:
- transsklerální: intenzita 1000–1500 mW, trvání 100–200 ms, počet bodů 50–100
- transpupilární: intenzita 200–500 mW, trvání 200 ms, počet bodů 1000–1500.
- d) Tradičně se ošetřuje avaskulární temporální část sítnice. U agresivních typů ROP ošetřujeme sítnici cirkulárně. Tam, kde není zřetelný val nebo nelze odlišit vaskulární a avaskulární zónu (ROP v zóně I sítnice), ošetřujeme sítnici cirkulárně ve 2 nebo 3 řadách.
- e) Někteří autoři doporučují ošetřit i vlastní val s neovaskularizacemi [1, 6, 11, 14, 18].
- f) Jednotlivé laserové body se mohou překrývat ve tvaru olympijských kruhů. Novější varianta doporučuje konfluentní ošetření sítnice (nearly or paint confluent) [24].
- g ) Potenciální rizika:
- g1) systémové: apnoe, bradykardie,
- g2) lokální: spáleniny rohovky, katarakta, vitreální či sítnicové hemoragie, nadměrné či nežádoucí jizvení sítnice.
Efektivita laserové fotokoagulace nebo kombinace fotokoagulace s kryopexí se pohybuje kolem 83 % anatomického úspěchu a kolem 75 % funkčního úspěchu [2, 3, 25]. Pomocí laserové fotokoagulace jsou zvláště posteriorní formy ROP lépe ošetřitelné a konečné výsledky anatomické a funkční jsou lepší.
5.2. Doplňující terapie ROP
Intravitreální aplikace anti-VEGF se jeví jako nadějný způsob léčby sítnice u dětí s ROP v zóně I resp. u agresivních forem AP–ROP, které špatně reagují na terapii fotokoagulací nebo kryopexí [4, 5, 11, 21, 23]. Redukce tvorby VEGF faktoru je signifikantní a klinický obraz u infaustních forem se může stabilizovat [4, 24]. Výsledky prvních studií ukazují na relativní bezpečnost aplikace a jsou povzbuzením pro další studie k potvrzení efektivity této metody. Nelze vyloučit, že anti-VEGF léčba může jednou nahradit laserovou terapii.
5.3. Pozdní komplikace ROP a možnosti léčby
Trakční odchlípení sítnice je výsledkem kontrakce fibrovaskulární tkáně na vitreoretinálním rozhraní podél hřebenu sítnice mezi vaskulární a avaskulární částí sítnice. Rovněž je nutné uvést, že anatomické poměry oka nedonošených dětí jsou specifické, od nedokonale vyvinuté pars plana corporis ciliaris k relativně velké čočce. Pozdní jizevnatá stadia ROP jsou charakteristická velmi různorodou anatomickou konfigurací sítnicových změn, hlavně pro značnou variabilitu trakčních vektorů u jednotlivých typů trakčního odchlípení sítnice (viz dále). Proto tyto nálezy mají různou prognózu i možnost operability [13, 16]. Jmenujme patologické změny od prognosticky infaustních k relativně příznivým: vaskularizovaná retrolentální membrána, subretinální organizovaný hematom, persistující hyaloidní systém, difuzní sítnicové záhyby (retina fold), trakční retinoschíza či retinální vlečná síť (retina dragging).
Zajímavé jsou nálezy u proběhlých agresivních typů ROP, kde ultrasonograficky nacházíme vždy cirkulární trakční záhyb (circumferential fold). Vlastní konfigurace trakčního odchlípení sítnice závisí na lokalizace hřebenu mezi vaskulární a avaskulární částí sítnice a na orientaci vitreoretinálních trakčních sil.
Mohou nastat tyto situace [8, 13, 16, 19, 24]:
5.3.1. Trakční vektor působí směrem intraretinálním. V tomto případě proliferace probíhá podél hřebenu a výsledkem je radiální záhyb.
5.3.2. Trakční vektor působí od hřebenu k čočce.
5.3.3. Trakční vektor působí od hřebenu k ciliárnímu tělísku.
5.3.4. Trakční vektor působí od hřebenu k sítnici: vektor probíhá od hřebenu anteriorně k avaskulární části sítnice
5.3.5. Trakční vektor působí mezi hřebenem a terčem zrakového nervu a způsobuje deformaci zrakového terče a temporální trakci makuly.
5.3.6. Trakční vektor působí od hřebenu k hřebenu: tento vektor probíhá uvnitř trychtýřovitého tvaru odchlípené sítnice (funnel–shaped retina detachement)
Mohou nastat tyto situace [7, 8, 9, 10, 11,15]:
- a) Trychtýř je otevřený.
- b) Trychtýř je úzký a částečně uzavřen v přední části nebo částečně v části.
- c) Trychtýř je v přední a zadní části uzavřen.
- d) Trychtýř je totálně uzavřen.
Stadium 5 ROP není v současné době doporučováno k vitreoretinálním zákrokům [10,11,15]. Nicméně studium tohoto terminálního stupně ROP je zdrojem poučení a poměrně intenzivních studií. Při hodnocení morfologie odchlípení je nejdůležitější konfigurace trychtýře (funnel configuration).
Pars plicata vitrektomie
Pro stadia ROP s částečným odchlípením sítnice stupeň 4a, 4b, nebo s úplným odchlípením sítnice, tj. stupeň 5 ROP, nejsou k dispozici žádná mezinárodní doporučení ani multicentrické studie, které by hodnotily načasování výkonu. Také nejsou k dispozici guidelines nebo výsledky klinických studií pro popis optimálního chirurgického postupu. Cerclage v terapii stadia 4 není dnes doporučenou technikou [12, 25] pro riziko perforace skléry při zakládání stehu pro cerclage, obtížné dozování při natažení pásku pro cerclage, anisometropickou druhotnou myopii a poruchy růstu oka. Technika vitrektomie je určena pro řešení vyšších stadií ROP a intenzivně se vyvíjí 25 let. Za optimální způsob se dnes považuje vitrektomie šetřící čočku (LSV – lens sparing vitrectomy) se 2 vstupy (2-port vitrectomy) v oblasti pars plicata pro světlo a mikrovitrektom. Poslední novinkou je LSV vitrektomie se 3 vstupy (3-port vitrectomy). Některé zprávy hovoří o uspokojivých anatomických a snad i funkčních výsledcích [20, 22, 23]. Indikace je přísně individuální s ohledem na oftalmologický nález, na celkový stav dítěte a probíhá ve spolupráci s neonatology a anesteziology. Operační zákrok má provádět zkušený vitreoretinální chirurg a celkovou anestezii má vést zkušený dětský anesteziolog za úzké spolupráce s neonatologem.
6. Dispenzarizace dětí po proběhlé ROP
U dětí po spontánně proběhlé nebo úspěšně léčené ROP je třikrát vyšší incidence strabismu, myopie a amblyopie. U dětí s vážným průběhem ROP se setkáváme se sekundárním glaukomem, dystrofiemi předního segmentu či atrofií bulbu. Je žádoucí, aby tito pacienti (optimálně všechny nedonošené děti) byli po propuštění z porodnice dispenzarizováni specialistou, nejlépe dětským oftalmologem. Dalším dispenzárním počinem jsou zařízení se statutem „Centra péče“, např. Centrum pro péči o děti s ROP nebo specializovaná zařízená jako je Centrum zrakových vad ve FN Motol. Centra jsou důležitá nejen pro medicínskou, ale i sociální, právní a další péči o tyto děti. U dospělých po proběhlé ROP se můžeme se setkat s komplikovanou kataraktou (nejčastěji nukleární), exsudativní retinopatií nebo trakčním, či kombinovaným trakčním a rhegmatogenním odchlípením sítnice. Posledně jmenovaná komplikace je specifická pro nález atypicky lokalizovaných trhlin a abnormalit vitreroretinálního rozhraní.
7. Telemedicína
Objektivní zobrazování očních nálezů, trojdimenzionální „skládání“ obrazů sítnice, digitalizace, přenos dat spolu s možností konzultace se specializovanými centry je výrazným impulsem ke zlepšování screeningu ROP. Malé přenosné kamery, které může obsluhovat i nezkušený lékař, sestra nebo technik a které objektivně detailně zobrazí oční pozadí, vykazují stejnou validitu a senzitivitu v určení diagnózy, jako kdyby vyšetření prováděl zkušený lékař. Tyto přístroje mohou být umístěny na neonatologických jednotkách a nejasné nálezy mohou být prostřednictvím digitálního obrazu konzultovány s odbornými centry. Tento způsob screeningu „na dálku“ (online) se jeví jako odborně optimální, protože diagnostické a terapeutické nálezy hodnotí zkušený odborník. Nedílnou součástí je i ekonomický benefit. Studie ukazují [20, 22, 27], že např. RetCam snímky mají 100% senzitivitu při diagnóze ROP oproti 97% senzitivitě vyšetření prováděného zkušeným oftalmologem. RetCam screening ukázal, že indikace k ošetření sítnice se posunuje až o 3 týdny dříve.
8. Závěr
Z oftalmologického pohledu optimální postup v terapii ROP spočívá v načasovaném screeningu, správné indikaci a provedení terapie fotokoagulací nebo kryopexí sítnice. Dalším terapeutickým nástrojem se jeví aplikace preparátů anti -VEGF [1], které dávají nové léčebné možnosti, zvláště u atypicky probíhajících forem. Problematika vitrektomií není dořešena z pohledu neuspokojivých funkčních výsledků. Nové diagnostické procedury, exprese genetických rizikových faktorů a hematologických markerů [4, 11, 21, 23, 24] by mohly dát přesnější odpověď, které z rizikových forem ROP budou pravděpodobně progredovat. Nelze přehlédnout objektivní fakt, že poslední roky sledujeme díky neonatologickým pokrokům [27,28] stabilizaci až snížení celkové incidence rizikových forem ROP. Tato komplexní péče možná v budoucnu změní, bez ohledu na nastupující mikroprematuritu, náš pohled na toto onemocnění.
Podpořeno MZO FNM 2005 CZ.2. 16/3.1.00/24022
MUDr. Milan Odehnal, MBA
Oční klinika dětí a dospělých UK 2. LF a FN v Motole
150 00 Praha 5
e-mail: milan.odehnal@fnmotol.cz
Zdroje
1. Ahmed, AE., Chabna, R., Durrani, J. et al.: Early experience with intravitreal Bevacizumab combined with laser treatment for retinopathy of prematurity. Middle East Afr J Ophthalmol, 17, 2010; 3 : 264–267.
2. Autrata, R., Holousová, M., Řehůřek, J.: Kryoterapie a fokokoagulace v terapii retinopatie nedonošených. Čes Slov Oftalmol, 58, 2002; 1 : 30–35.
3. Autrata, R., Šenková, K., Holousová, M. et al.: Combined treatment with laser photocoagulation and cryotherapy for threshold retinopathy of prematurity. Eur J Ophthalmol, 18, 2008; 1 : 112–117.
4. Autrata, R.: Retinopatie nedonošených – možnosti léčby, 14–18. In: Trendy v dětské oftalmologii a strabologii, Vol. XI. Supplementum I, Litomyšl, 2010, 80 s.
5. Borghesi, A., Garofoli, F., Vabank, R. et al.: Circulating endothelial progenitor cells and diseases of the preterm infant. Minerva Pediatr, 62, 2010; 21–30.
6. Coats, DK., Miller, AM., Brady, M. et al: Involution of threshold retinopathy of prematurity after diode laser photocoagulation. Ophthalmology, 111, 2004; 10 : 1894–1898.
7. Davitt, BV., Wallace, DK.: Plus disease. Surv Ophthalmol, 54, 2009; 6 : 663–670.
8. Drenser, KA., Trese, MT., Capone, A Jr.: Aggressive posterior retinopathy of prematurity. Retina, 30, 2010; 4 : 37–40.
9. Fulton, AB., Hansen, RM., Moskowitz, A. et al.: The neurovascular retina in retinopathy of prematurity. Prog Retin Eye Res, 28, 2009; 6 : 452–482.
10. Fulton, AB., Hansen, RM., Moskowitz, A. et al.: The neurovascular retina in retinopathy of prematurity. Prog Retin Eye Res, 28, 2009; 6 : 452–482.
11. Harrell, SN., Brandon, DH.: Retinopathy of prematurity: the disease process, classifications, screening, treatment, and outcomes. Neonatal Netw, 26, 2007; 6 : 371–378.
12. Heckmann, M.: Pathogenesis of retinopathy of prematurity. Ophthalmologe, 105, 2008; 12 : 1101–1107.
13. Hubbard, GB 3rd.: Surgical management of retinopathy of prematurity. Curr Opin Ophthalmol, 19, 2008; 5 : 384–390.
14. Hurley, BR., McNamara, JA., Fineman, MS. et al: Laser treatment for retinopathy of prematurity: evolution in treatment technique over 15 years. Retina, 26, 2006; 7 : 16–17.
15. International Committee for the Classification of Retinopathy of Prematurity. The International Classification of Retinopathy of Prematurity revisited. Arch Ophthalmol, 123, 2005; 7 : 991–999.
16. Jandech, C.: New therapeutic approaches in the treatment of retinopathy of prematurity. Klin Monbl Augenheilkd, 226, 2009; 11 : 914–920.
17. Jones, JG., MacKinnon, B., Good, WV. et al: The early treatment for ROP (ETROP) randomized trial: study results and nursing care adaptations. Early Treatment for Retinopathy of Prematurity Cooperative Group. Insight. 30, 2005; 2 : 7–13.
18. McLoone, E., O’Keefe, M., McLoone, S.: Long term functional and structural outcomes of laser therapy for retinopathy of prematurity. Br J Ophthalmol, 90, 2006; 6 : 754–759.
19. Odehnal, M., Malec, J., Šťěpánková, J. et.al.: Nové poznatky o retinopatii nedonošených dětí. Čes Slov Oftalmol, 64, 2008; 4 : 162–166.
20. O’Keefe, M., Kirwan, C.: Screening for retinopathy of prematurity. Early Hum Dev, 84, 2008; 2 : 89–94.
21. Penn, JS., Madan, A., Caldwell, RB. et al.: Vascular endothelial growth factor in eye disease. Prog Retin Eye Res, 27, 2008; 4 : 331–371.
22. Salcone, EM., Johnston, S., VanderVeen, D. et al.: Review of the use of digital imaging in retinopathy of prematurity screening. Semin Ophthalmol, 25, 2010; 5–6 : 214–217.
23. Smith, LE.: IGF-1 and retinopathy of prematurity in the preterm infant. Biol Neonate, 88, 2005; 3 : 237–244.
24. Sylvester, CL.: Retinopathy of prematurity. Semin Ophthalmol. 23, 2008; 5 : 318–323.
25. Šenková, K.: Long-term results of cryotherapy versus transpupillary diode laser photocoagulation for threshold retinopathy of prematurity. Fol Strab Neuroophthalmol, 8, 2007; 5 : 32–35.
26. Thomas, WJ., Rauser, M., Dovich, JA. et al.: Dustin L, Flaxel CJ. Oxygen saturation in premature infants at risk for threshold retinopathy of prematurity. Eur J Ophthalmol, 2010; 23–28.
27. Ugurbas, SC., Gulcan, H., Canan, H. et al.: Comparison of UK and US screening criteria for detection of retinopathy of prematurity in a developing nation. J AAPOS, 14, 2010; 6 : 506–10.
28. Wiwatwongwana, A., Persey, JP., Gardiner, JA.: The effect of changing oxygen saturation protocols on the incidence of laser treatment for retinopathy of prematurity. Can J Ophthalmol, 45, 2010; 6 : 585–589.
Štítky
Oftalmologie
Článek EPI-LASEK – naše skúsenosti
Článek vyšel v časopiseČeská a slovenská oftalmologie
Nejčtenější tento týden
2011 Číslo 2- Stillova choroba: vzácné a závažné systémové onemocnění
- Familiární středomořská horečka
- První schválený léčivý přípravek pro terapii Leberovy hereditární optické neuropatie dostupný rovněž v ČR
- Selektivní laserová trabekuloplastika nesnižuje nitroční tlak více než argonová laserová trabekuloplastika
- Léčba chronické blefaritidy vyžaduje dlouhodobou péči
-
Všechny články tohoto čísla
- Současný pohled na retinopatii nedonošených
- Keratoconjunktivitis sicca (KCS) při folikulární konjunktivitidě u dospělých pacientů s etiologií Chlamydia pneumoniae (souhrnná dvanáctiletá studie)
- Zrakové funkce a kvalita života u pacientů s keratokonem
- EPI-LASEK – naše skúsenosti
- Porovnanie topickej mydriázy a mydriázy pomocou nasiaknutej celulózy vo fornixe
- Denní dávka benzalkonium chloridu – významné kritérium v léčbě glaukomu
- Očné príznaky po operácii skoliózy
- Prof. MUDr. Zoltán Oláh, DrSc. – osemdesiatnik
- Česká a slovenská oftalmologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Denní dávka benzalkonium chloridu – významné kritérium v léčbě glaukomu
- Současný pohled na retinopatii nedonošených
- Očné príznaky po operácii skoliózy
- Zrakové funkce a kvalita života u pacientů s keratokonem
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání




