-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaVýznam inzulinové rezistence a NAFLD po transplantaci jater na přežívání pacientů a rozvoj chronického onemocnění ledvin
The impact of insulin resistance and NAFLD after liver transplantation on patient survival and development of chronic kidney disease
Introduction: Insulin resistance (IR) is a hallmark of non-alcoholic fatty liver disease (NAFLD), which has been associated with worse long-term survival and more frequent occurrence of chronic kidney disease (CKD) than in patients without NAFLD. The aim of our study was to evaluate the impact of NAFLD and IR on survival and renal function in patients after liver transplantation (LT). Methods: Our prospective study included 96 LT candidates who were observed after LT. We evaluated patient survival and occurrence of CKD (defined as estimated glomerular filtration [eGFR] ≤1.00 mL/s/1.73 m2 or overt proteinuria) 5 years after LT and at the end of follow-up. Clinical, laboratory, MR and elastographic evaluation before and 1 year after LT were performed as well as liver biopsy 1 year after LT. Results: Of the factors present 1 year after LT, higher ALT (P = 0.021), ALP (P = 0.012) and everolimus treatment (P = 0.025) increased the risk of death at the end of follow-up, borderline significance was found also for higher waist circumference (P = 0.058), AST (P = 0.059), HOMA-IR (P = 0.056) and presence of fibrosis stage ≥3 in biopsy (P = 0.055). In addition to the presence of CKD 1 year after LT (P <0.001), other independent posttransplant risk factors of CKD 5 years after LT included presence of IR defined as HOMA-IR ≥3 (OR 4.33; 95% CI 1.25–15.04; P = 0.021) and higher serum high-molecular-weight (HMW) adiponectin (OR 1.25; 95% CI 1.03–1.50; P = 0.021). Of the factors present 1 year after LT, diabetes treated by antidiabetics (P = 0.008), higher serum levels od triglycerides (P = 0.031), C-peptide (P = 0.022) and leptin (P = 0.002) and lower total bilirubin (P = 0.006) were associated with lower eGFR at the end of follow-up. We observed a trend towards higher eGFR levels in patients treated with everolimus (P = 0.055). We did not observe an impact of grade of steatosis and presence of steatohepatitis on biopsy 1 year after LT on survival or renal functions. Conclusion: Presence of IR 1 year after LT independently increased the risk of CKD 5 year after LT. Patients with higher HOMA-IR 1 year after LT had a trend towards worse survival at the end of follow-up.
Keywords:
liver transplantation – non-alcoholic fatty liver disease – insulin resistance – chronic kidney disease – survival
Autoři: Irena Míková 1
; D. Erhartová Kyselová 1,2
; K. Dvořáková 1
; M. Dezortová 3
; M. Hájek 3
; M. Cahová 4
; H. Daňková 4
; V. Lánská 5
; Julius Špičák 1
; Pavel Trunečka 1
Působiště autorů: Klinika hepatogastroenterologie, Institut klinické a experimentální medicíny, Praha 1; Fyziologický ústav 1. LF UK, Praha 2; Pracoviště radiodiagnostiky a intervenční radiologie, Institut klinické a experimentální medicíny, Praha 3; Centrum experimentální medicíny, Institut klinické a experimentální medicíny, Praha 4; Oddělení datových analýz, statistik a umělé inteligence OI, Institut klinické a experimentální medicíny, Praha 5
Vyšlo v časopise: Gastroent Hepatol 2022; 76(5): 429-441
Kategorie: Hepatologie: původní práce
doi: https://doi.org/10.48095/ccgh2022429Souhrn
Úvod: U pacientů s nealkoholovou tukovou chorobou jater (NAFLD), jejímž typickým znakem je inzulinová rezistence (IR), bylo popsáno horší dlouhodobé přežívání a častější výskyt chronického onemocnění ledvin (CKD) než u pacientů bez NAFLD. Cílem naší studie bylo zhodnotit, zda má NAFLD a IR vliv na přežívání a renální funkci u pacientů po transplantaci jater (LT – liver transplantation). Metody: Naše prospektivní studie zahrnula 96 kandidátů LT, kteří byli sledováni po LT. Hodnotili jsme přežívání pacientů a výskyt CKD (definované jako odhadovaná glomerulární filtraci [eGFR] ≤ 1,00 ml/s/1,73 m2 nebo zjevná proteinurie) 5 let po LT a ke konci sledování. U pacientů bylo provedeno klinické, laboratorní, MR a elastografické vyšetření před LT a 1 rok po LT a biopsie jater 1 rok po LT. Výsledky: Z faktorů přítomných 1 rok po LT zvyšovaly riziko úmrtí ke konci sledování vyšší ALT (p = 0,021), ALP (p = 0,012), léčba everolimem (p = 0,025), hraničně významné byly vyšší obvod pasu (p = 0,058), AST (p = 0,059), HOMA-IR (p = 0,056) a fibróza stupně ≥ 3 v biopsii (p = 0,055). Kromě přítomnosti CKD již 1 rok po LT (p < 0,001) patřila mezi potransplantační nezávislé rizikové faktory CKD 5 let po LT přítomnost IR definované jako HOMA-IR ≥ 3 (odds ratio [OR] 4,33; 95% konfidenční interval [CI] 1,25–15,04; p = 0,021) a vyšší sérový vysokomolekulární (HMW) adiponektin (OR 1,25; 95% CI 1,03–1,50; p = 0,021). Z faktorů 1 rok po LT byly s nižšími hodnotami eGFR ke konci sledování spojeny diabetes léčený antidiabetiky (p = 0,008), vyšší sérové hladiny triglyceridů (p = 0,031), C-peptidu (p = 0,022) a leptinu (p = 0,002) a nižší celkový bilirubin (p = 0,006). U pacientů léčených everolimem jsme pozorovali trend k vyšším hodnotám eGFR (p = 0,055). Stupeň steatózy nebo přítomnost steatohepatitidy v biopsii 1 rok po LT neměly vliv na přežívání nebo renální funkce. Závěr: Přítomnost IR 1 rok po LT nezávisle zvyšovala riziko CKD 5 let po LT. Pacienti s vyšším HOMA-IR 1 rok po LT vykazovali trend k horšímu přežívání ke konci sledování.
Klíčová slova:
transplantace jater – nealkoholová tuková choroba jater – inzulinová rezistence – chronické onemocnění ledvin – přežívání
Úvod
Inzulinová rezistence (IR) je patologický stav charakterizovaný nedostatečnou odpovědí tkání na působení inzulinu, který je společným charakteristickým znakem nealkoholové tukové choroby jater (NAFLD – non-alcoholic fatty liver disease), obezity, diabetu 2. typu (T2DM), metabolického syndromu a kardiovaskulárních chorob [1,2]. K posouzení IR lze v běžné klinické praxi použít index HOMA-IR, který vychází z hodnot lačné glykemie a inzulinemie [3]. Za kritérium IR se nejčastěji používá hodnota HOMA-IR ≥ 2,5–3,0 [4,5].
U pacientů s NAFLD byla popsána vyšší mortalita než u pacientů bez NAFLD [6–9]. Některé studie naznačují, že zvýšená mortalita se může týkat i pacientů s NAFLD/NASH (nealkoholovou steatohepatitidou) po transplantaci jater (LT – liver transplantation). V naší předchozí retrospektivní studii 548 příjemců LT jsme pozorovali trend k horšímu dlouhodobému přežívání pacientů s významnou steatózou (> 33 %) oproti pacientům bez významné steatózy (81,3 vs. 89,0 % v 10 letech a 56,2 vs. 74,6 % v 15 letech po LT) [10]. Trend k vyšší dlouhodobé mortalitě u pacientů s potransplantační NAFLD byl patrný i v jiné práci [11]. Další dvě studie [12,13] prokázaly nepříznivý průběh u pacientů s NASH de novo po LT s úmrtím 28 % pacientů do 5 let od diagnózy [12] nebo pouhým 30% kumulativním přežíváním 15 let po LT (oproti 65,8 % u pacientů bez NASH) [13].
U pacientů s NAFLD byla popsána významně vyšší prevalence chronického onemocnění ledvin (CKD – chronic kidney disease) než u pacientů bez steatózy [14,15], přičemž vyšší prevalence CKD (15 vs. 9 % u pacientů bez NAFLD; p < 0,001) byla nezávislá na složkách metabolického syndromu, trvání diabetu, glykemické kontrole, léčbě hypolipidemiky, antihypertenzivy a antiagregancii [15].
Chronické onemocnění ledvin (CKD) je nejčastěji definováno jako odhadovaná (estimated) glomerulární filtrace (eGFR) ≤ 60 ml/min/1,73 m2 nebo zjevná proteinurie trvající ≥ 3 měsíce. Pro odhad glomerulární filtrace ze sérových hladin kreatininu existuje řada rovnic, v současné době se nejčastěji užívají rovnice podle MDRD (modification of diet in renal disease equation) a CKD-EPI (chronic kidney disease epidemiology collaboration), které zahrnují sérový kreatinin, věk, rasu a pohlaví. Rovnice CKD-EPI má vyšší přesnost a obecnější využití. Od použití rovnice podle Cockcroft-Gault se ustupuje vzhledem k tomu, že nebere do úvahy vliv pohlaví a rasy a má omezenou přesnost [16]. U pacientů s cirhózou je hodnocení glomerulární filtrace založené na sérových hladinách kreatininu velmi nepřesné, lze u nich s výhodou použít hodnocení eGFR založené na plazmatické hladině cystatinu C, který je na rozdíl od kreatininu nezávislý na pohlaví, věku a svalové hmotě [17].
U příjemců LT byla popsána vysoká (až 60%) prevalence CKD, která byla spojena s horším přežíváním pacientů a štěpů [18]. Příčiny CKD po LT zahrnují předoperační faktory (věk, ženské pohlaví, anamnéza diabetes mellitus [DM], hypertenze, hyperlipidemie) a potransplantační faktory (protrahovaná ischemie, hemodynamická nestabilita, toxicita kalcineurinových inhibitorů [CNI]) [18–21]. Nezávislým prediktorem potransplantační CKD byla NASH cirhóza jako indikace k LT [22]. Vztah potransplantační IR a NAFLD (ať již jako rekurujícího, nebo de novo onemocnění) s CKD po LT nebyl v literatuře popsán.
Cílem naší studie bylo u prospektivně sledované kohorty příjemců LT posoudit význam potransplantační IR a NAFLD (hodnocených 1 rok po LT) na přežívání a renální funkce 5 let po LT a ke konci sledování.
Soubor pacientů a metodika
Soubor pacientů
Tato studie vychází z prospektivně sledované kohorty 122 dospělých pacientů zařazených na čekací listinu k LT v období 5/2015 až 4/2017, kteří podepsali informovaný souhlas se studií a MR vyšetřením. Do studie byli zahrnuti pouze pacienti se stabilním klinickým stavem umožňujícím účast ve studii. Ze 105 pacientů, kteří podstoupili LT, byla u 96 pacientů k dispozici kontrola 1 rok po LT, ti tvořili soubor pacientů této studie, v níž jsme hodnotili přežívání a renální funkce 5 let po LT a ke konci sledování (pacienti s úmrtím do 1 roku po LT nebyli do studie zahrnuti). Medián sledování byl 64,9 měsíců po LT (rozmezí 15,2–84,6 měsíců).
Klinické a laboratorní vyšetření
Před LT (v době zařazení na čekací listinu k LT) a 1 rok po LT byla zhodnocena klinická a laboratorní data, podávaná medikace (imunosupresiva, kortikoidy, statiny, antidiabetika – tzn. inzulin [INZ] a/nebo perorální antidiabetika [PAD]) a konzumace alkoholu (tab. 1). Pacientům byla po celonočním lačnění odebrána krev na stanovení standardních biochemických parametrů včetně glykemie, C-peptidu a inzulinemie. Z hodnot lačné glykemie a lačné inzulinemie byl vypočten HOMA-IR {[lačná inzulinemie (μU/ml) ] × [lačná glykemie (mol/l) ]}/22,5 a QUICKI index 1/{log [lačná inzulinemie (μU/ml) ] + log [lačná glykemie (mg/dl) ]} [2]. IR byla definována jako HOMA-IR ≥ 3,0. K posouzení IR byl dále použit i nízký QUICKI index (< 0,357). Hodnotili jsme i hladiny sérového leptinu, vysokomolekulárního (HMW) adiponektinu a TNFa.
Tab. 1. Faktory před LT a 1 rok po LT (n = 96).
Tab. 1. Factors before LT and 1 year after LT (N = 96).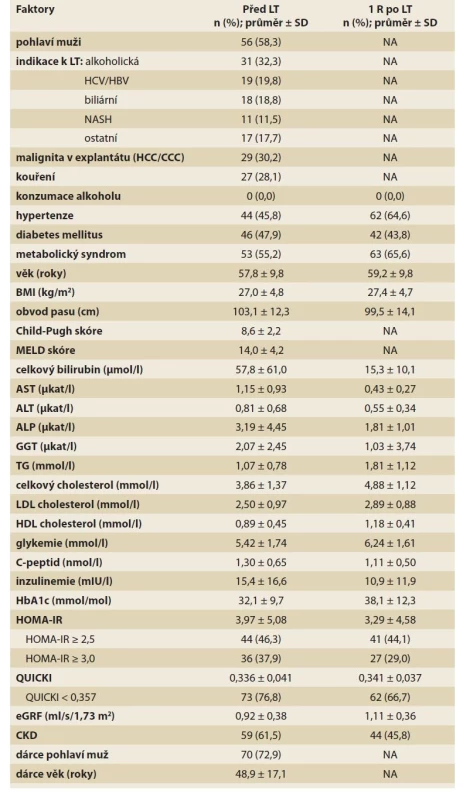
Hypertenze byla definována jako krevní tlak ≥130/85 mmHg nebo antihypertenzní léčba. Diabetes mellitus (DM) byl definován jako koncentrace glukózy v plazmě nalačno ≥ 7,0 mmol/l (alespoň 2krát v posledních 6 měsících) nebo koncentrace glukózy v plazmě při orálním glukózovém tolerančním testu po 120 minutách ≥ 11,1 mmol/l nebo léčený DM. Metabolický syndrom byl definován jako přítomnost alespoň tří z následujících pěti faktorů:
• obvod pasu ≥ 102 cm u mužů a ≥ 88 cm u žen;
• hypertenze;
• glykemie nalačno ≥ 5,6 mmo/l nebo DM;
• hypertriglyceridemie ≥ 1,7 mmol/l;
• HDL cholesterol < 1,0 mmol/l u mužů a < 1,3 mmol/l u žen.
MR vyšetření a elastografie
Před LT a 1 rok po LT bylo po alespoň 3hodinovém lačnění stanoveno metodou 1H MR spektroskopie procento objemu tuku v játrech, toto měření bylo prováděno ve třech standardizovaných částech jater. Vyšetření se prováděla na 3T celotělovém tomografu Trio (Siemens, Německo). Dále byla pacientům provedena shear wave elastografie s měřením tuhosti jater (kPa).
Biopsie jater
V 1 roce po LT byla v rámci standardního protokolu programu LT v IKEM pacientům provedena necílená biopsie jater. Vzorek biopsie jater byl získán Menghiniho technikou a zpracován standardním způsobem v naší laboratoři. Biopsie byly klasifikovány dle Kleinera [23] a steatóza byla rozdělena dle procenta postižených hepatocytů na stupeň 0 u < 5 %, stupeň 1 u 5–33 %, stupeň 2 u 33,1–66 % a stupeň 3 u > 66 %. V biopsiích byly hodnoceny i další složky NAFLD aktivity skóre (NAS), přítomnost NASH a stadium fibrózy [23].
Hodnocení přežívání a renálních funkcí
Hodnotili jsme přežívání pacientů a renální funkce 5 let po LT a ke konci sledování. CKD byla definována jako eGFR ≤ 1,00 ml/s/1,73 m2 nebo zjevná proteinurie.
Pro odhad eGFR po LT byl použit výpočet podle rovnice CKD-EPI:
eGFR = 141 × min (Scr/k, 1) a × × max (Scr/k, 1) –1,209 × 0,993věk × f × k
(pro přepočet na ml/s/1,73m2 se výsledek násobí 0,0167)
f = 1,018 pro ženy; 1 pro muže; k = 1,159 pro černou populaci, 1 pro ostatní; Scr = sérový kreatinin; k = 0,7 pro ženy; 0,9 pro muže; a = –0,329 pro ženy a –0,411 pro muže; min = minimum Scr/k nebo 1; max = maximum Scr/k nebo 1 [24].
Pro odhad eGFR před LT byl použit výpočet založený na plazmatické koncentraci cystatinu C (eGFR dle CKD-EPI [Scys]/; v ml/s/1,73m2) [25]:
1. pro Scyst ≤ 0,8 mg/l: eGFR = 2,217 × × (Scyst/0,8) –0,499 × 0,996věk × 0,932 (pro ženy);
2. pro Scyst > 0,8 mg/l: eGFR = 2,217 × × (Scyst/0,8) –1,328 × 0,996věk × 0,932 (pro ženy).
Statistické hodnocení
Kategorické proměnné jsou udávány v absolutních počtech a procentech, spojité proměnné jako průměr a směrodatná odchylka. Rozdíly veličin mezi skupinami byly hodnoceny podle typu rozložení buď Studentovým t-testem, nebo Kruskal-Wallisovým testem pro spojité veličiny a Fisherovým testem (pokud jsou očekávané počty v buňce < 5) anebo Pearsonovým chí-kvadrát testem pro diskrétní veličiny. Vztah eGFR ke kategorickým proměnným byl hodnocen Kruskal-Wallisovým testem a vztah ke spojitým proměnným byl popsán Spearmanovým korelačním koeficientem. Vztah CKD ke kategorickým proměnným byl hodnocen chí-kvadrát testem a vztah ke spojitým proměnným byl hodnocen Kruskal-Wallisovým testem. Přežívání pacientů bylo hodnoceno Kaplan-Meierovou metodou a rozdíly byly hodnoceny log-rank testem. Do multivariantní analýzy (logistická regrese, Coxův regresní model nebo mnohorozměrná lineární regrese) byly použity hodnoty s p < 0,08 z univariantní analýzy. Za statisticky významnou byla použita hodnota p < 0,05; všechny testy byly oboustranné. Pro statistické hodnocení jsme použili JMP 15.2.0 statistický software, SAS Institute Inc. 2019.
Výsledky
Prevalence IR, NAFLD a NASH před LT a 1R po LT
Inzulinovou rezistenci (IR) definovanou jako HOMA-IR ≥3 mělo 36 (37,9 %) pacientů před LT. Jedenáct pacientů (11,5 %) bylo k LT indikováno pro NASH cirhózu.
Jeden rok po LT mělo IR 27 (29,0 %) pacientů. U 80 pacientů byla 1 rok po LT provedena biopsie jater. U 50 (62,5 %) pacientů byla v biopsii nalezena steatóza, a to stupně 1 u 32 (40,0 %) pacientů, stupně 2 u 10 (12,5 %) pacientů a stupně 3 u 8 (10,0 %) pacientů. U 10 (12,5 %) pacientů byl v jaterní biopsii patrný obraz NASH. Žádný z pacientů neudával konzumaci alkoholu před LT ani 1 rok po LT.
Rizikové faktory úmrtí 5 let po LT
Pět let po LT bylo 81 pacientů naživu a 15 pacientů zemřelo. Mezi významné předtransplantační rizikové faktory úmrtí do 5 let po LT patřilo v univariantní analýze mužské pohlaví (p = 0,021), vyšší věk (p = 0,022), alkoholová nebo virová (HBV nebo HCV) etiologie cirhózy (p = 0,026) a přítomnost hepatocelulárního (HCC) nebo cholangiocelulárního karcinomu (CCC) v explantátu jater (p = 0,034; tab. 2). Trend k horšímu přežívání byl patrný i pro vyšší glykovaný hemoglobin (p = 0,063) a BMI (p = 0,082). Multivariantní analýzu nebylo možné provést vzhledem k malému počtu úmrtí.
Tab. 2. Předtransplantační rizikové faktory úmrtí 5 let po LT (univariantní analýza).
Tab. 2. Pretransplant risk factors of death 5 years after LT (univariate analysis).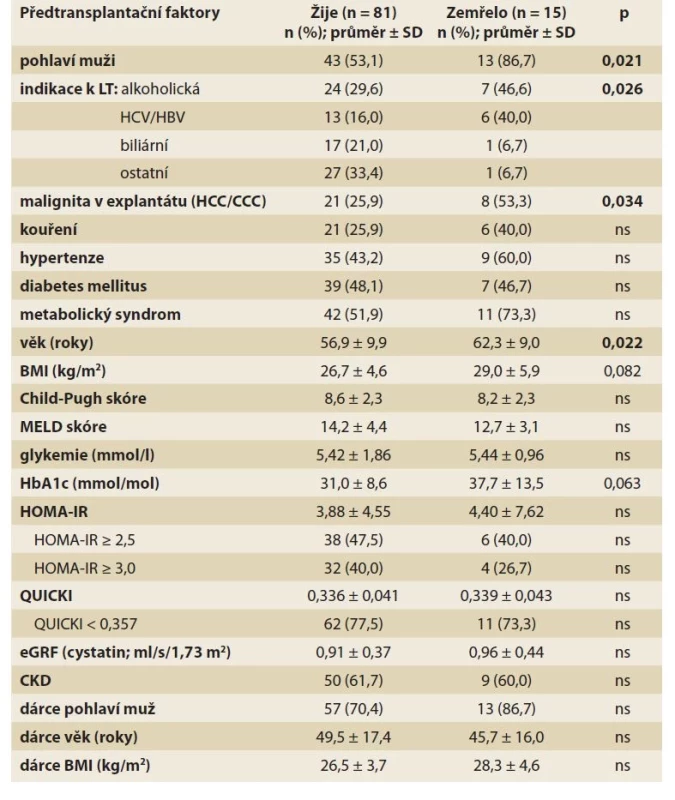
Při hodnocení vlivu faktorů zjištěných 1 rok po LT na přežívání 5 let po LT jsme pozorovali trend k horšímu přežívání pacientů s vyšším obvodem pasu (p = 0,075; tab. 3a).
Tab. 3. Potransplantační rizikové faktory úmrtí a) 5 let po LT; b) ke konci sledování (univariantní analýza).
Tab. 3. Posttransplant risk factors of death a) 5 years after LT; b) at the end of observation (univariate analysis).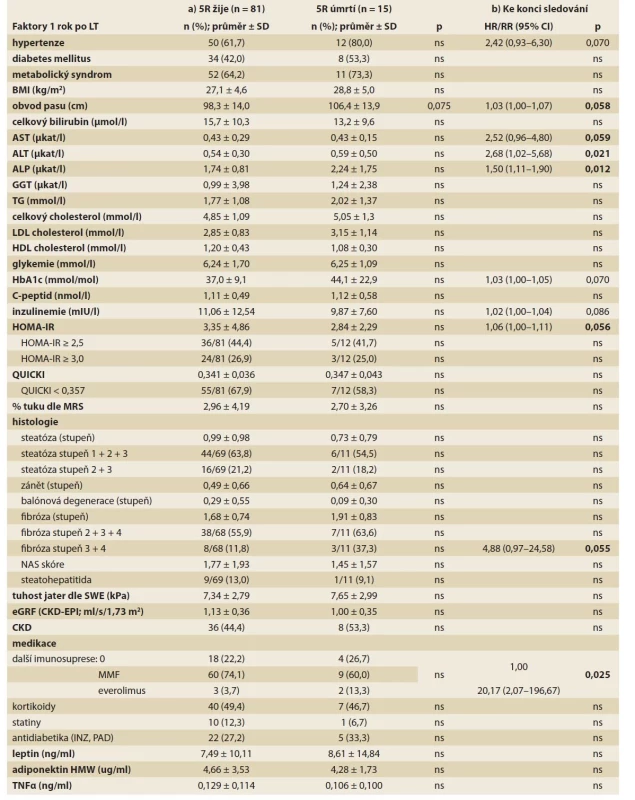
Rizikové faktory úmrtí ke konci sledování
Ke konci sledování bylo 78 pacientů naživu a 18 pacientů zemřelo (medián sledování 64,9 měsíců, rozmezí 15,2–84,6 měsíců).
Při hodnocení vlivu faktorů zjištěných 1 rok po LT na přežívání ke konci sledování (tab. 3b) jsme v univariantní analýze pozorovali zvýšené riziko úmrtí u pacientů s vyšší aktivitou alaninaminotransferázy (ALT) (p = 0,021) a alaninaminotransferázy (ALP) (p = 0,012), patrné bylo i častější úmrtí pacientů léčených kombinací takrolimu (FK) s everolimem (3 z 5 pacientů), oproti pacientům léčeným monoterapií FK (5 z 22) nebo kombinací FK s mykofenolát mofetilem (MMF) (10 z 69; p = 0,025). Hraniční významnost ve vztahu k přežívání jsme nalezli pro vyšší obvod pasu (p = 0,058), aspartátaminotransferázu (AST; p = 0,059), HOMA-IR (p = 0,056) a přítomnost fibrózy stupně ≥ 3 v biopsii (p = 0,055). Trend byl patrný i pro hypertenzi (p = 0,070) a vyšší koncentraci glykovaného hemoglobinu (p = 0,070). Multivariantní analýzu nebylo možné provést vzhledem k malému počtu úmrtí.
Prevalence CKD před LT a 1R po LT
Předtransplantační CKD byla nalezena u 59 (61,5 %) pacientů. Jeden rok po LT byla CKD přítomna u 44 (45,8 %) pacientů.
Předtransplantační rizikové faktory CKD 5 let po LT/eGFR ke konci sledování
Z 81 pacientů, kteří přežili 5 let po LT, byla CKD přítomna u 40 (49,4 %) pacientů. Při analýze významu předtransplantačních faktorů měla na rozvoj CKD 5 let po LT významný vliv pouze přítomnost CKD již před LT (tab. 4a).
Tab. 4. a) Předtransplantační rizikové faktory CKD 5 let po LT (univariantní analýza).
Tab. 4a) Pretransplant risk factors of CKD 5 years after LT (univariate analysis).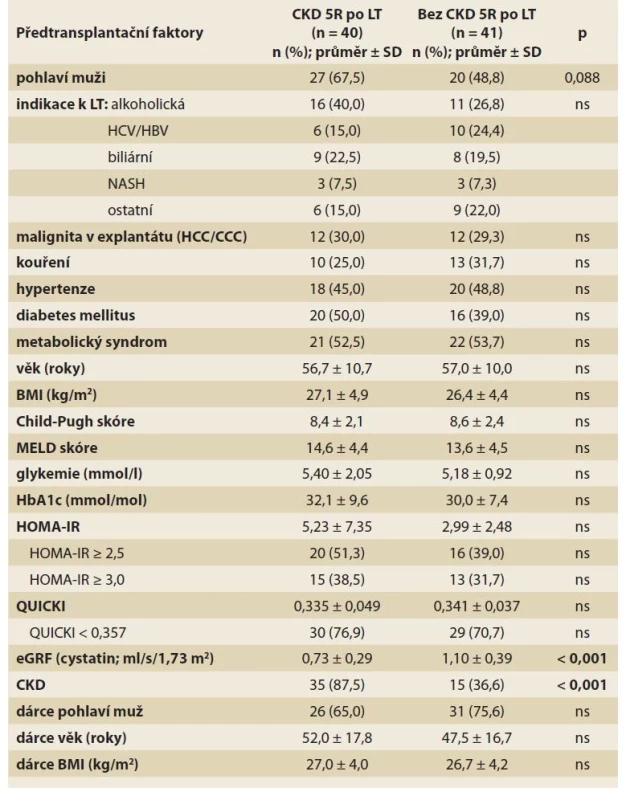
U všech 96 pacientů byla hodnocena eGFR při poslední kontrole. Nejnižších průměrných hodnot eGFR ke konci sledování dosahovali pacienti indikovaní pro NASH cirhózu oproti pacientům indikovaným pro jiné diagnózy (p = 0,054; tab. 4b). Mezi další předtransplantační faktory nízké eGFR ke konci sledování patřil v univariantní analýze vyšší věk (p < 0,001), vyšší glykemie (p = 0,019) a mladší dárce (p = 0,009).
V multivariantní analýze patřil k významným nezávislým rizikovým faktorům nízké eGFR ke konci sledování předtransplantační vyšší věk (p < 0,001) a nižší věk dárce (p = 0,024; tab. 4b).
Tab. 4b) Předtransplantační rizikové faktory eGFR (ml/s/1,73 m2) ke konci sledování.
Tab. 4b) Pretransplant risk factors of eGFR (ml/s/1,73 m2) at the end of observation.
Faktory přítomné 1 rok po LT jako rizikové faktory CKD 5 let po LT/eGFR ke konci sledování
Na přítomnost CKD 5 let po LT měla v univariantní analýze významný vliv CKD 1 rok po LT (p < 0,001), nižší HDL cholesterol (p = 0,021) a přítomnost IR definovaná jako HOMA-IR ≥ 3 (p = 0,046). Hraniční významnost měla vyšší glykemie (p = 0,054) a trend jsme pozorovali pro vyšší HMW adiponektin (p = 0,078; tab. 5a).
Tab. 5. a) Potransplantační rizikové faktory CKD 5 let po LT (univariantní analýza).
Tab. 5a) Posttransplant risk factors of CKD 5 years after LT (univariate analysis).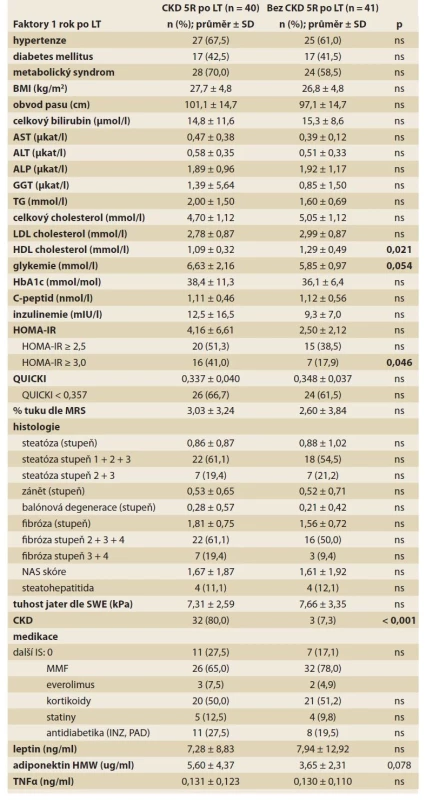
Kromě CKD již 1 rok po LT (p < 0,001) patřila v multivariantní analýze k nezávislým faktorům CKD 5 po LT přítomnost HOMA-IR ≥ 3 (OR 4,33; 95% CI 1,25–15,04; p = 0,021) a vyšší HMW adiponektin (OR 1,25; 95% CI 1,03–1,50; p = 0,021).
S nižší eGFR ke konci sledování (tab. 5b) byly asociovány diabetes léčený antidiabetiky (p = 0,008), vyšší sérové hladiny triglyceridů (p = 0,031), C-peptidu (p = 0,022) a leptinu (p = 0,002) a nižší celkový bilirubin (p = 0,006). Nejvyšších hodnot eGFR dosahovali pacienti léčení kombinací FK s everolimem oproti pacientům léčeným kombinací FK s MMF nebo monoterapií FK (p = 0,055).
Tab. 5b) Potransplantační rizikové faktory eGFR (ml/s/1,73 m2) ke konci sledování.
Tab. 5b) Posttransplant risk factors of eGFR (ml/s/1,73 m2) at the end of observation.
V multivariantní analýze faktorů hodnocených 1 rok po LT patřil k nezávislým rizikovým faktorům nízké eGFR ke konci sledování pouze diabetes léčený antidiabetiky (p = 0,021; tab. 5b).
Diskuze
V této studii jsme hodnotili vliv NAFLD a inzulinové rezistence (IR) 1 rok po LT na přežívání a renální funkce u prospektivně sledované kohorty příjemců po LT. Zjistili jsme, že pacienti s vyšším HOMA-IR 1 rok po LT měli trend k horšímu dlouhodobému přežívání po LT a přítomnost IR definované jako HOMA-IR ≥ 3,0 1 rok po LT zvyšovala riziko CKD 5 let po LT.
V obecné populaci bylo popsáno horší přežíváním pacientů s obezitou [26], DM 2. typu [27] i NAFLD [6–9], jejichž společným rysem je přítomnost IR. Podobně i u pacientů po LT byla popsána vyšší mortalita pacientů s potransplantačním DM [28,29] a s větším množstvím abdominálního viscerálního tuku [30]. Trend k vyšší dlouhodobé mortalitě byl popsán i u pacientů s vyšším stupněm steatózy po LT [10] a nepříznivý potransplantační průběh byl pozorován u NASH de novo po LT [12,13]. Přítomnost IR a souvisejících chorob má tedy význam pro dlouhodobou prognózu nejen v obecné populaci, ale i u pacientů po LT. V současné studii jsme vliv steatózy a steatohepatitidy v biopsii na přežívání neprokázali, počet pacientů s dostupnou biopsií i délka sledování však byly omezené.
Zvýšené hodnoty ALT, ALP a hraničně i AST 1 rok po LT byly spojeny s horším přežíváním ke konci sledování. U všech pacientů byl štěp ke konci sledování plně funkční bez nutnosti retransplantace (s výjimkou tří retransplantací provedených do 5 dní od první LT). Zvýšené hodnoty jaterních testů po LT mohou být způsobeny rejekcí štěpu, chronickou aloreaktivitou, která nedosáhla stupně klinicky manifestní rejekce, poruchou biliární drenáže, mezi další možné příčiny patří potransplantační NAFLD nebo poléková toxicita. Popsané příčiny mohou mít dopad i na další orgánové systémy a celkový stav organizmu. Žádný z 12 pacientů indikovaných k LT pro HCV neměl pozitivní HCV RNA 1 rok po LT. Mnohé z výše uvedených příčin elevace jaterních testů po LT mohou vést k rozvoji významné fibrózy štěpu, která v naší práci byla rovněž hraničně významná pro horší přežívání pacientů.
Pozorovali jsme častější úmrtí pacientů léčených kombinací FK s everolimem oproti pacientům léčeným monoterapií FK nebo kombinací s MMF. U všech pěti pacientů léčených 1 rok po LT everolimem byla indikací k LT přítomnost HCC, příčiny úmrtí u tří z nich však byly rozdílné (recidiva HCC, karcinom plic, sepse s multiorgánovým selháním). Vzhledem k velmi malým počtům pacientů léčených everolimem nemá náš nález větší klinický význam a vyžaduje ověření většími studiemi. Kombinace FK a everolimu se po LT často podává v rámci prevence nebo léčby rekurentního HCC, u de novo malignit [31] nebo jako záchranná léčba chronické rejekce štěpu [32]. Mimo transplantační medicínu se everolimus užívá např. při léčbě pacientů s neuroendokrinními tumory [33].
Mezi předtransplantační faktory, které u našich pacientů významně zvyšovaly riziko úmrtí po LT, patřily dle očekávání mužské pohlaví, vyšší věk, alkoholová nebo virová etiologie cirhózy a přítomnost hepatocelulárního (HCC) nebo cholangiocelulárního (CCC) karcinomu histologicky potvrzených v explantátu jater, což odpovídá výsledkům známým z rozsáhlejších studií [34].
Prevalence CKD 5 let po LT byla v naší studii 49,4 %, což odpovídá dalším pracím, které rovněž popisují vysokou (15–60%) prevalenci CKD po LT [18,35,36]. Až 18 % příjemců LT může do 5 let dospět k renálnímu selhání s nutností dialyzační léčby nebo transplantace ledviny [37]. Poškození ledvin po LT je komplexní proces, na němž se mohou podílet předtransplantační i potransplantační faktory vč. toxicity CNI [38].
Jediným významným předtransplantačním rizikovým faktorem CKD 5 let po LT byl pokles renální funkce již před LT, což se týkalo 61,5 % našich kandidátů. K častému výskytu renální dysfunkce u pacientů s pokročilou cirhózou přispívá kromě klasických rizikových faktorů CKD (DM, hypertenze, vyšší věk) [39] i hemodynamická dysregulace související s portální hypertenzí s poklesem efektivního arteriálního volumu a s následnou renální vazokonstrikcí, dále i hypovolemie v důsledku např. gastrointestinálního krvácení s následnou akutní tubulární nekrózou, následky infekcí/zánětu nebo nefrotoxicita běžně podávaných diuretik [40].
Nejnižší hodnoty eGFR ke konci sledování jsme zaznamenali u pacientů indikovaných k LT pro NASH cirhózu. U NAFLD byla popsána významně vyšší prevalence [14,15] a incidence [41,42] CKD než u pacientů bez steatózy a NASH je nejrychleji rostoucí indikací ke kombinované transplantaci jater a ledviny [43]. NASH jako indikace k LT byla i nezávislým prediktorem CKD po LT [22,44]. Vyšší věk byl nezávislým faktorem nižší eGFR ke konci sledování, což odpovídá údajům z literatury [18,39].
Překvapivě jsme zjistili nezávislý vztah nižšího věku dárců s horší eGFR ke konci sledování. Pro tento nález je obtížné hledat oporu v literatuře. V jiných studiích docházelo naopak u mladších dárců po LT k častější úpravě renálních funkcí [16,45]. Ve studii Trunečky et al měl věk dárce vliv na optimální imunosupresivní protokol s ohledem na minimalizaci renálního poškození po LT [47]. Možným vysvětlením našich výsledků by mohla být pečlivější selekce starších dárců, kde nález komorbidit mohl přispět k zamítnutí dárcovství, zatímco u mladšího dárce byla i přes eventuální nález dalších chorob a patologických nálezů, které mohly mít negativní vliv na peritransplantační průběh, očekávána dobrá dlouhodobá funkce jaterního štěpu.
Z faktorů přítomných 1 rok po LT měla k rozvoji CKD 5 let po LT nezávislý vztah přítomnost IR definovaná jako HOMA-IR ≥ 3. IR tak hraje roli v patogenezi CKD nejen v obecné populaci [14,48], ale i po LT. IR je spojena s chronickým zánětlivým stavem a zvýšeným oxidačním stresem, jejichž role byla popsána i u CKD [14].
Dalším potransplantačním nezávislým faktorem CKD 5 let po LT byl vyšší HMW adiponektin. Adiponektin cirkulující v plazmě existuje ve třech hlavních izoformách – trimer, hexamer a vysokomolekulární (HMW) multimer (6–9), který je nejaktivnější formou proteinu [49]. U pacientů s peritoneální dialýzou nebo hemodialýzou byly zjištěny cca 2,5násobně vyšší hladiny adiponektinu než u zdravých osob [48,50]. Na jedné straně byly pro adiponektin u zvířecích modelů nebo buněčných linií popsány protizánětlivé, antiaterogenní a inzulin-senzitizující účinky [51], na druhé straně data z velkých studií u pacientů nasvědčují, že je vyšší hladina adiponektinu spojena s vyšší celkovou a kardiovaskulární mortalitou [52] a vyšší mortalitou u pacientů s CKD [53]. Příčiny tohoto adiponektinového paradoxu nebyly plně objasněny. Výsledky nedávné studie nasvědčují, že by mohl být adiponektin spíše biomarkerem renální dysfunkce než faktorem podílejícím se na patogenezi progrese CKD [54], čemuž nasvědčuje i fakt, že hladiny adiponektinu významně klesají po úspěšné transplantaci ledviny. Ledviny tak hrají významnou roli v biodegradaci nebo eliminaci tohoto proteinu [55].
Jediný významný nezávislý potransplantační faktor snížené eGFR ke konci sledování byl léčený DM, což je v souladu s literaturou. Nižší hodnoty eGFR jsme dále pozorovali u pacientů s vyšším sérovým C-peptidem, leptinem a triglyceridy, které mají všechny vztah k obezitě, IR a/nebo NAFLD. Hladiny C-peptidu korelují s funkcí ß-buněk pankreatu, s BMI a IR [56]. Leptin je malý peptidový hormon produkovaný zejména tukovou tkání, jehož cirkulující hladiny odrážejí množství celkového tělesného tuku. Leptin je eliminován zejména ledvinami a jeho hladiny stoupají u pokročilé renální dysfunkce [57]. Leptin působí v ledvinách jako růstový a profibrogenní faktor, což může přispět k renálnímu poškození v patofyziologických stavech s jeho vysokými hladinami, jako je obezita, DM a metabolický syndrom [58]. Zvýšené lačné hladiny triglyceridů jsou nejčastěji způsobeny zvýšenou jaterní sekrecí lipoproteinů s velmi nízkou hustotou (VLDL), typickou pro NAFLD, která byla opakovaně ve velkých studiích spojována se zvýšenou prevalencí i incidencí CKD.
V naší studii jsme pozorovali vztah vyššího sérového bilirubinu 1 rok po LT s lepší funkcí ledvin po LT. Pro mírně zvýšené hodnoty bilirubinu u dospělých byly popsány protektivní účinky před kardiovaskulárními chorobami [59,60], celkovou úmrtností [61,62] a dále i před renálním poškozením a dysfunkcí [63–65]. Při absenci jaterního poškození a bakteriální infekce byly mírně zvýšené hodnoty bilirubinu opakovaně spojeny s poklesem cévní rezistence [66], se zlepšením glomerulární filtrace [64] a renální tubulární funkce a se zpomalením progrese renálního poškození [63,67]. U pacientů po transplantaci ledviny měly zvýšené hodnoty bilirubinu protektivní účinky před pozdní rejekcí štěpu [68]. U bilirubinu byly popsány i antioxidační účinky, což je dobře známé u pacientů s Gilbertovým syndromem [69].
U pacientů léčených po LT kombinací FK s everolimem jsme pozorovali trend ke zlepšení renálních funkcí oproti kombinaci FK s MMF nebo monoterapii FK. Léčba everolimem umožňuje minimalizaci dávek FK s následným zlepšením renálních funkcí oproti standardním dávkám FK [70].
Ačkoli byla přítomnost renální dysfunkce/CKD před LT a 1 rok po LT rizikovým faktorem CKD 5 let po LT, hodnoty eGFR na konci sledování nekorelovaly s hodnotami eGFR před LT ani 1 rok po LT. U pacientů tak bylo v průběhu sledování běžné jak zhoršování, tak i zlepšování renálních funkcí. Transplantace jater může na jedné straně vést k úpravě narušené hemodynamiky v ledvinách běžné u pokročilé cirhózy s možnou reparací renálních funkcí, na druhé straně se mohou renální funkce po LT zhoršit vlivem hypoperfuze např. při výkonu komplikovaném velkou krevní ztrátou nebo sepsí. Nedávná studie prokázala, že u pacientů transplantovaných po roce 2010 není léčba takrolimem prediktorem potransplantační CKD za podmínek dodržení terapeutického monitorování hladin [71].
Jsme si vědomi skutečnosti, že u pacientů před transplantací jater klasifikovaných jako pacient s CKD nemusela být porucha funkce ledvin způsobena vždy chronickým onemocněním ledvin, ale na snížení renálních funkcí se mohl podílet i hepatorenální syndrom (HRS). Vzhledem k tomu, že u většiny nemocných s déletrvajícím HRS přetrvává renální porucha i po transplantaci a v případě biopsie navíc byly u těchto pacientů popsány strukturální změny glomerulů [40], nepovažujeme tento rozpor v klasifikaci za podstatný.
Za silnou stránku naší studie je možné považovat stanovení funkce ledvin před LT na základě měření koncentrací sérového cystatinu C. Hodnocení glomerulární filtrace pomocí běžně dostupných metod založených na sérových hladinách kreatininu je u pacientů s cirhózou velmi nepřesné. U pacientů s cirhózou dochází k poklesu produkce kreatininu v důsledku snížené jaterní syntézy kreatinu, ke zvýšené tubulární sekreci kreatininu a k poklesu svalové hmoty, což vše přispívá k falešně nízkým sérovým koncentracím kreatininu i v případě středně těžkého nebo těžkého poškození renálních funkcí. Hladina sérového kreatininu, měřená kreatininová clearance a vypočtená kreatininová clearance tak mohou významně nadhodnocovat skutečnou GFR (běžně i o 95 %) [72]. Cystatin C je nízkomolekulární protein syntetizovaný na rozdíl od kreatininu všemi jadernými buňkami. Cystatin C je téměř kompletně katabolizován v proximálním tubulu, jeho renální clearance tak nelze měřit. Jeho plazmatické hladiny odpovídají GFR a dokážou odlišit normální a sníženou renální funkci i u pacientů s dekompenzovanou cirhózou. Výhodou cystatinu C je, že jeho koncentrace jsou na rozdíl od kreatininu nezávislé na pohlaví, svalové hmotě a věku, takže existuje stejný referenční interval pro celou populaci [17].
Limitací naší studie je heterogenita příjemců i dárců, jejich často komplikovaný potransplantační průběh, který přes prospektivní charakter studie vede ke značně nesourodé medikamentózní léčbě v potransplantačním období.
Závěr
Naše práce prokázala, že k vysoké prevalenci CKD u pacientů po LT přispívá potransplantační inzulinová rezistence (IR), která hraje roli nejen v patogenezi obezity, NAFLD a DM, ale přispívá i k rozvoji CKD. Zaznamenali jsme trend k horšímu dlouhodobému přežívání pacientů s vyšším HOMA-IR. Inzulinové rezistenci, která typicky souvisí s obezitou a nadměrným kalorických příjmem, je tak u příjemců transplantovaných jater nutno věnovat náležitou pozornost, vzhledem k jejím možným negativním dlouhodobým důsledkům pro morbiditu i mortalitu pacientů.
ORCID autorů
I. Míková ORCID 0000-0001-7928-7558,
D. Kyselová ORCID 0000-0001-6652-653X,
K. Dvořáková ORCID 0000-0002-1815-488X,
M. Dezortová ORCID 0000-0003-0194-1200,
M. Hájek ORCID 0000-0003-4704-6164,
M. Cahová ORCID 0000-0003-2640-5084,
H. Daňková ORCID 0000-0002-8686-1041,
V. Lánská ORCID 0000-0002-2832-5689,
J. Špičák ORCID 0000-0002-3823-2881,
P. Trunečka ORCID 0000-0002-4753-4419.
Doručeno/Submitted: 30. 8. 2022
Přijato/Accepted: 20. 9. 2022
MUDr. Mgr. Irena Míková
Klinika hepatogastroenterologie
Institut klinické a experimentální medicíny
Vídeňská 1958/9
140 21 Praha 4
Zdroje
1. Gaggini M, Morelli M, Buzzigoli E et al. Non-alcoholic fatty liver disease (NAFLD) and its connection with insulin resistance, dyslipidemia, atherosclerosis and coronary heart disease. Nutrients 2013; 5 (5): 1544–1560. doi: 10.3390/nu5051544.
2. Muniyappa R, Lee S, Chen H et al. Current approaches for assessing insulin sensitivity and resistance in vivo: advantages, limitations, and appropriate usage. Am J Physiol Endocrinol Metab 2008; 294 (1): E15–26. doi: 10.1152/ajpendo.00645.2007.
3. Wallace TM, Matthews DR. The assessment of insulin resistance in man. Diabet Med 2002; 19 (7): 527–534. doi: 10.1046/j.1464-5491.2002.00745.x.
4. Younossi Z, Stepanova M, Afendy M et al. Changes in the prevalence of the most common causes of chronic liver diseases in the United States from 1988 to 2008. Clin Gastroenterol Hepatol 2011; 9 (6): 524–530. doi: 10.1016/ j.cgh.2011.03.020.
5. Magri CJ, Fava S, Galea J. Prediction of insulin resistance in type 2 diabetes mellitus using routinely available clinical parameters. Diabetes Metab Syndr Clin Res Rev 2016; 10 (2): S96–S101. doi: 10.1016/j.dsx.2016.03.002.
6. Calori G, Lattuada G, Ragogna F et al. Fatty liver index and mortality: The cremona study in the 15th year of follow-up. Hepatology 2011; 54 (1): 145–152. doi: 10.1002/hep.24356.
7. Ekstedt M, Hagström H, Nasr P et al. Fibrosis stage is the strongest predictor for disease-specific mortality in NAFLD after up to 33 years of follow-up. Hepatology 2015; 61 (5): 1547–1554. doi: 10.1002/hep.27368.
8. Liu Y, Zhong GC, Tan HY et al. Nonalcoholic fatty liver disease and mortality from all causes, cardiovascular disease, and cancer: a meta-analysis. Sci Rep 2019; 9 (1): 11124. doi: 10.1038/s41 598-019-47687-3.
9. Sōoderberg C, Stål P, Askling J et al. Decreased survival of subjects with elevated liver function tests during a 28-year follow-up. Hepatology 2010; 51 (2): 595–602. doi: 10.1002/hep.23314.
10. Hejlova I, Honsova E, Sticova E et al. Prevalence and risk factors of steatosis after liver transplantation and patient outcomes. Liver Transplant 2016; 22 (5): 644–655. doi: 10.1002/lt.24393.
11. Galvin Z, Rajakumar R, Chen E et al. Predictors of De Novo Nonalcoholic Fatty Liver Disease After Liver Transplantation and Associated Fibrosis. Liver Transpl 2019; 25 (1): 56–67. doi: 10.1002/lt.25338.
12. Narayanan P, Mara K, Izzy M et al. Recurrent or De Novo Allograft Steatosis and Long-term Outcomes After Liver Transplantation. Transplantation 2019; 103 (1): e14–e21. doi: 10.1097/TP.0000000000002317.
13. Gitto S, De Maria N, Di Benedetto F et al. De-novo nonalcoholic steatohepatitis is associated with long-term increased mortality in liver transplant recipients. Eur J Gastroenterol Hepatol 2018; 30 (7): 766–773. doi: 10.1097/MEG.0000000000001105.
14. Targher G, Chonchol M, Zoppini G et al. Risk of chronic kidney disease in patients with non-alcoholic fatty liver disease: is there a link? J Hepatol 2011; 54 (5): 1020–1029. doi: 10.1016/j.jhep.2010.11.007.
15. Targher G, Bertolini L, Rodella S et al. Non-alcoholic fatty liver disease is independently associated with an increased prevalence of chronic kidney disease and proliferative/laser-treated retinopathy in type 2 diabetic patients. Diabetologia 2008; 51 (3): 444–450. doi: 10.1007/ s00125-007-0897-4.
16. Madero M, Sarnak MJ. Creatinine-based formulae for estimating glomerular filtration rate: is it time to change to chronic kidney disease epidemiology collaboration equation? Curr Opin Nephrol Hypertens 2011; 20 (6): 622–630. doi: 10.1097/MNH.0b013e32834ba210.
17. Orlando R, Mussap M, Plebani M et al. Diagnostic value of plasma cystatin C as a glomerular filtration marker in decompensated liver cirrhosis. Clin Chem 2002; 48 (6 Pt 1): 850–858.
18. Guo D, Wang H, Liu J et al. Prediction of chronic kidney disease after orthotopic liver transplantation: development and validation of a nomogram model. BMC Nephrol 2022; 23 (1): 33. doi: 10.1186/s12882-021-02650-1.
19. Li Y, Li B, Wang W et al. Risk factors for new-onset chronic kidney disease in patients who have received a liver transplant. Exp Ther Med 2018; 15 (4): 3589–3595. doi: 10.3892/etm.2018. 5823.
20. Lamattina JC, Foley DP, Mezrich JD et al. Chronic kidney disease stage progression in liver transplant recipients. Clin J Am Soc Nephrol 2011; 6 (8): 1851–1857. doi: 10.2215/CJN.00650111.
21. Kang GW, Lee IH, Ahn KS et al. One-Year Follow-up of the Changes in Renal Function After Liver Transplantation in Patients Without Chronic Kidney Disease. Transplant Proc 2016; 48 (4): 1190–1193. doi: 10.1016/j.transproceed.2016.02. 013.
22. Fussner LA, Charlton MR, Heimbach JK et al. The impact of gender and NASH on chronic kidney disease before and after liver transplantation. Liver Int 2014; 34 (8): 1259–1266. doi: 10.1111/liv.12381.
23. Kleiner DE, Brunt EM, Van Natta M et al. Design and validation of a histological scoring system for nonalcoholic fatty liver disease. Hepatology 2005; 41 (6): 1313–1321. doi: 10.1002/hep.20701.
24. Levey AS, Stevens LA, Schmid CH et al. A new equation to estimate glomerular filtration rate. Ann Intern Med 2009; 150 (9): 604–612. doi: 10.7326/0003-4819-150-9-200905050-00006.
25. Zima T, Racek J, Ryšavá R et al. Doporučení k diagnostice chronického onemocnění ledvin (odhad glomerulární filtrace a vyšetřování proteinurie). Klin Biochem Metab 2021; 29 (2): 94–103.
26. Flegal KM, Kit BK, Orpana H et al. Association of all-cause mortality with overweight and obesity using standard body mass index categories: a systematic review and meta-analysis. JAMA 2013; 309 (1): 71–82. doi: 10.1001/jama.2012.113905.
27. Tancredi M, Rosengren A, Svensson A-M et al. Excess Mortality among Persons with Type 2 Diabetes. N Engl J Med 2015; 373 (18): 1720–1732. doi: 10.1056/NEJMoa1504347.
28. Pelaez-Jaramillo MJ, Cardenas-Mojica AA et al. Post-Liver Transplantation Diabetes Mellitus: A Review of Relevance and Approach to Treatment. Diabetes Ther 2018; 9 (2): 521–543. doi: 10.1007/s13300-018-0374-8.
29. Parekh J, Corley DA, Feng S. Diabetes, hypertension and hyperlipidemia: prevalence over time and impact on long-term survival after liver transplantation. Am J Transplant 2012; 12 (8): 2181––2187. doi: 10.1111/j.1600-6143.2012.04077.x.
30. Terjimanian MN, Harbaugh CM, Hussain A et al. Abdominal adiposity, body composition and survival after liver transplantation. Clin Transplant 2016; 30 (3): 289–294. doi: 10.1111/ctr.12688.
31. De Simone P, Fagiuoli S, Cescon M et al. Use of Everolimus in Liver Transplantation: Recommendations From a Working Group. Transplantation 2017; 101 (2): 239–251. doi: 10.1097/TP.0000000000001438.
32. Ueno T, Hiwatashi S, Saka R et al. Everolimus Rescue Treatment for Chronic Rejection After Pediatric Living Donor Liver Transplantation: 2 Case Reports. Transplant Proc 2018; 50 (9): 2872–2876. doi: 10.1016/j.transproceed.2018.03.079.
33. Faggiano A, Malandrino P, Modica R et al. Efficacy and Safety of Everolimus in Extrapancreatic Neuroendocrine Tumor: A Comprehensive Review of Literature. Oncologist 2016; 21 (7): 875–886. doi: 10.1634/theoncologist.2015-0420.
34. Roberts MS, Angus DC, Bryce CL et al. Survival after liver transplantation in the United States: a disease-specific analysis of the UNOS database. Liver Transplant 2004; 10 (7): 886–897. doi: 10.1002/lt.20137.
35. Giusto M, Berenguer M, Merkel C et al. Chronic kidney disease after liver transplantation: pretransplantation risk factors and predictors during follow-up. Transplantation 2013; 95 (9): 1148–1153. doi: 10.1097/TP.0b013e3182884890.
36. Kalisvaart M, Schlegel A, Trivedi PJ et al. Chronic Kidney Disease After Liver Transplantation: Impact of Extended Criteria Grafts. Liver Transplant 2019; 25 (6): 922–933. doi: 10.1002/lt.25468.
37. Ojo AO, Held PJ, Port FK et al. Chronic renal failure after transplantation of a nonrenal organ. N Engl J Med 2003; 349 (10): 931–940. doi: 10.1056/NEJMoa021744.
38. Kim JY, Akalin E, Dikman S et al. The variable pathology of kidney disease after liver transplantation. Transplantation 2010; 89 (2): 215–221. doi: 10.1097/TP.0b013e3181c353e5.
39. Stevens LA, Coresh J, Greene T et al. Assessing kidney function – measured and estimated glomerular filtration rate. N Engl J Med 2006; 354 (23): 2473–2483. doi: 10.1056/NEJMra054415.
40. Adebayo D, Morabito V, Davenport A et al. Renal dysfunction in cirrhosis is not just a vasomotor nephropathy. Kidney Int 2015; 87 (3): 509–515. doi: 10.1038/ki.2014.338.
41. Chang Y, Ryu S, Sung E et al. Nonalcoholic fatty liver disease predicts chronic kidney disease in nonhypertensive and nondiabetic Korean men. Metabolism 2008; 57 (4): 569–576. doi: 10.1016/j.metabol.2007.11.022.
42. Targher G, Chonchol M, Bertolini L et al. Increased risk of CKD among type 2 diabetics with nonalcoholic fatty liver disease. J Am Soc Nephrol 2008; 19 (8): 1564–1570. doi: 10.1681/ASN. 2007101155.
43. Singal AK, Hasanin M, Kaif M et al. Nonalcoholic Steatohepatitis is the Most Rapidly Growing Indication for Simultaneous Liver Kidney Transplantation in the United States. Transplantation 2016; 100 (3): 607–612. doi: 10.1097/TP. 0000000000000945.
44. Houlihan DD, Armstrong MJ, Davidov Y et al. Renal function in patients undergoing transplantation for nonalcoholic steatohepatitis cirrhosis: time to reconsider immunosuppression regimens? Liver Transplant 2011; 17 (11): 1292–1298. doi: 10.1002/lt.22382.
45. Northup PG, Argo CK, Bakhru MR et al. Pretransplant predictors of recovery of renal function after liver transplantation. Liver Transplant 2010; 16 (4): 440–446. doi: 10.1002/lt.22008.
46. Iglesias J, Frank E, Mehandru S et al. Predictors of renal recovery in patients with pre-orthotopic liver transplant (OLT) renal dysfunction. BMC Nephrol 2013; 14 : 147. doi: 10.1186/14 71-2369-14-147.
47. Trunečka P, Klempnauer J, Bechstein WO et al. The Effect of Donor Age and Recipient Characteristics on Renal Outcomes in Patients Receiving Prolonged-Release Tacrolimus After Liver Transplantation: Post-Hoc Analyses of the DIAMOND Study. Ann Transplant 2019; 24 : 319–327. doi: 10.12659/AOT.913103.
48. Huang JW, Yen CJ, Chiang HW et al. Adiponectin in peritoneal dialysis patients: a comparison with hemodialysis patients and subjects with normal renal function. Am J Kidney Dis 2004; 43 (6): 1047–1055. doi: 10.1053/j.ajkd. 2004.02.017.
49. Liu M, Liu F. Regulation of adiponectin multimerization, signaling and function. Best Pract Res Clin Endocrinol Metab 2014; 28 (1): 25–31. doi: 10.1016/j.beem.2013.06.003.
50. Zoccali C, Mallamaci F, Tripepi G et al. Adiponectin, metabolic risk factors, and cardiovascular events among patients with end-stage renal disease. J Am Soc Nephrol 2002; 13 (1): 134–141. doi: 10.1681/ASN.V131134.
51. Przybyciński J, Dziedziejko V, Puchałowicz K et al. Adiponectin in Chronic Kidney Disease. Int J Mol Sci 2020; 21 (24): 9375. doi: 10.3390/ijms 21249375.
52. Wu ZJ, Cheng YJ, Gu WJ et al. Adiponectin is associated with increased mortality in patients with already established cardiovascular disease: a systematic review and meta-analysis. Metabolism 2014; 63 (9): 1157–1166. doi: 10.1016/j.metabol.2014.05.001.
53. Menon V, Li L, Wang X et al. Adiponectin and mortality in patients with chronic kidney disease. J Am Soc Nephrol 2006; 17 (9): 2599–2606. doi: 10.1681/ASN.2006040331.
54. Song SH, Oh TR, Choi HS et al. High serum adiponectin as a biomarker of renal dysfunction: Results from the KNOW-CKD study. Sci Rep 2020; 10 (1): 5598. doi: 10.1038/s41598-020-62465-2.
55. Chudek J, Adamczak M, Karkoszka H et al. Plasma adiponectin concentration before and after successful kidney transplantation. Transplant Proc 2003; 35 (6): 2186–2189. doi: 10.1016/j.trans proceed.2003.08.001.
56. Banu S, Jabir NR, Manjunath CN et al. C-peptide and its correlation to parameters of insulin resistance in the metabolic syndrome. CNS Neurol Disord Drug Targets 2011; 10 (8): 921–927. doi: 10.2174/187152711799219271.
57. Wolf G, Chen S, Han DC et al. Leptin and renal disease. Am J Kidney Dis 2002; 39 (1): 1–11. doi: 10.1053/ajkd.2002.29865.
58. Wolf G, Hamann A, Han DC et al. Leptin stimulates proliferation and TGF-beta expression in renal glomerular endothelial cells: potential role in glomerulosclerosis. Kidney Int 1999; 56 (3): 860–872. doi: 10.1046/ j.1523-1755.1999.00626.x.
59. Vítek L, Jirsa M, Brodanová M et al. Gilbert syndrome and ischemic heart disease: a protective effect of elevated bilirubin levels. Atherosclerosis 2002; 160 (2): 449–456. doi: 10.1016/ s0021-9150 (01) 00601-3.
60. Vítek L, Novotný L, Sperl M et al. The inverse association of elevated serum bilirubin levels with subclinical carotid atherosclerosis. Cerebrovasc Dis 2006; 21 (5–6): 408–414. doi: 10.1159/000091966.
61. Temme EH, Zhang J, Schouten EG et al. Serum bilirubin and 10-year mortality risk in a Belgian population. Cancer Causes Control 2001; 12 (10): 887–894. doi: 10.1023/a: 1013794407325.
62. Horsfall LJ, Rait G, Walters K et al. Serum bilirubin and risk of respiratory disease and death. JAMA 2011; 305 (7): 691–697. doi: 10.1001/jama. 2011.124.
63. Chin HJ, Cho HJ, Lee TW et al. The mildly elevated serum bilirubin level is negatively associated with the incidence of end stage renal disease in patients with IgA nephropathy. J Korean Med Sci 2009; 24 (1): S22–S29. doi: 10.3346/jkms.2009.24.S1.S22.
64. Shin HS, Jung YS, Rim H. Relationship of serum bilirubin concentration to kidney function and 24-hour urine protein in Korean adults. BMC Nephrol 2011; 12 : 29. doi: 10.1186/1471-2369 - 12-29.
65. Boon AC, Bulmer AC, Coombes JS et al. Circulating bilirubin and defense against kidney disease and cardiovascular mortality: mechanisms contributing to protection in clinical investigations. Am J Physiol Renal Physiol 2014; 307 (2): F123–F136. doi: 10.1152/ajprenal.00039.2014.
66. Bhuiyan AR, Srinivasan SR, Chen W et al. Association of serum bilirubin with pulsatile arterial function in asymptomatic young adults: the Bogalusa Heart Study. Metabolism 2008; 57 (5): 612–616. doi: 10.1016/j.metabol.2007.12.003.
67. Adin CA, Croker BP, Agarwal A. Protective effects of exogenous bilirubin on ischemia-reperfusion injury in the isolated, perfused rat kidney. Am J Physiol Renal Physiol 2005; 288 (4): F778–F784. doi: 10.1152/ajprenal.00215.2004.
68. Deetman PE, Zelle DM, Homan van der Heide JJ et al. Plasma bilirubin and late graft failure in renal transplant recipients. Transpl Int 2012; 25 (8): 876–881. doi: 10.1111/j.1432-2277.2012.01515.x.
69. Bulmer AC, Blanchfield JT, Toth I et al. Improved resistance to serum oxidation in Gilbert’s syndrome: a mechanism for cardiovascular protection. Atherosclerosis 2008; 199 (2): 390–396. doi: 10.1016/j.atherosclerosis.2007.11.022.
70. De Simone P, Nevens F, De Carlis L et al. Everolimus with reduced tacrolimus improves renal function in de novo liver transplant recipients: a randomized controlled trial. Am J Transplant 2012; 12 (11): 3008–3020. doi: 10.1111/j.1600 - 6143.2012.04212.x.
71. Maurel P, Prémaud A, Carrier P et al. Evaluation of Longitudinal Exposure to Tacrolimus as a Risk Factor of Chronic Kidney Disease Occurrence Within the First-year Post-Liver Transplantation. Transplantation 2021; 105 (7): 1585–1594. doi: 10.1097/TP.0000000000003384.
72. Sherman DS, Fish DN, Teitelbaum I. Assessing renal function in cirrhotic patients: problems and pitfalls. Am J Kidney Dis 2003; 41 (2): 269–278. doi: 10.1053/ajkd.2003.50035.
Štítky
Dětská gastroenterologie Gastroenterologie a hepatologie Chirurgie všeobecná
Článek vyšel v časopiseGastroenterologie a hepatologie
Nejčtenější tento týden
2022 Číslo 5- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Cinitaprid – v Česku nová účinná látka nejen pro léčbu dysmotilitní dyspepsie
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
-
Všechny články tohoto čísla
- Screening kolorektálního karcinomu v České republice v roce 2022
- Gastrointestinálna onkológia
- Program kolorektálního screeningu v České republice – hodnocení výkonnosti center za rok 2021
- Je možné individualizovat vysazení antikoagulační terapie před preventivní koloskopií?
- Zriedkavá príčina nebolestivého obštrukčného ikteru u starších ľudí – séria kazuistík
- Malabsorpce žlučových kyselin u onkologických pacientů
- Multimodální přístup v léčbě generalizovaných malignit gastrointestinálního traktu
- Endosonografia a elastografia v diagnostike neuroendokrinných nádorov pankreasu
- Význam inzulinové rezistence a NAFLD po transplantaci jater na přežívání pacientů a rozvoj chronického onemocnění ledvin
- Stent jako řešení perforace „černého jícnu“
- Přínos biosimilárních monoklonálních protilátek v terapii idiopatických střevních zánětů
- Výběr z mezinárodních časopisů
- Správná odpověď na kvíz Syndrom arteria mesenterica superior, syndrom Wilkie
- Kreditovaný autodidaktický test: gastrointestinální onkologie
- Sekundární selhání biologické léčby – hlavní výzva pro biobetters
- Gastroenterologie a hepatologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Malabsorpce žlučových kyselin u onkologických pacientů
- Program kolorektálního screeningu v České republice – hodnocení výkonnosti center za rok 2021
- Správná odpověď na kvíz Syndrom arteria mesenterica superior, syndrom Wilkie
- Stent jako řešení perforace „černého jícnu“
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



