-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Prežívateľnosť produkčných probiotických kmeňov vo vybranej aplikačnej forme
Surviving of production probiotic strains in a selected application form
Research in probiotics for aquaculture is at an early stage of development and much work is still needed. Lactiplantibacilli belong to the microorganisms most frequently used to prepare the probiotics. The available information is inconclusive, since few experiments with sufficiently robust design have been conducted to permit critical evaluation. The development of probiotics applicable to commercial use in aquaculture is a multistep and multidisciplinary process requiring both empirical and fundamental research, full-scale trials, and an economic assessment of its use. The aim of the study was to prepare a probiotic aquafeed via excipients and subsequently to observe the survival of probiotic bacterial cells in the feed during the nine months storage period at a refrigerator (4 °C) or room temperature (22 °C). The strain Lactobacillus plantarum R2 Biocenol™ (CCM 8674) (according to the new taxonomy Lactiplantibacillus plantarum), potentially usable as a probiotic in aquaculture, was administered to prepare the aquafeed. Better survival of probiotic bacterial cells was recorded in a samples of pellets A (Aquatex 41 HMD) compared to the samples of probiotic pellets B (Inicio 918-2). Since oxidation of fatty acids in feed affects the nutritional quality of individual feed components, we assume that higher amounts of oil in feed B negatively affected the survival of probiotic bacterial cells. The highest numbers of viable probiotic bacteria cells were recorded at 4 °C storage of probiotic feed samples. The number of lactiplantibacilli dropped from 7.30 log10CFU . g–1 to 5.57 log10CFU . g–1 after the nine months storage period of feed samples A at 4 °C. Temperature is considered as a critical factor influencing probiotic viability and survival during storage period.
Keywords:
viability – excipients – coating – aquafeed – Lactiplantibacillus plantarum
Autoři: Adriána Fečkaninová; Jana Koščová; Aleš Franc; Dagmar Mudroňová; Peter Popelka
Vyšlo v časopise: Čes. slov. Farm., 2022; 71, 27-33
Kategorie: Původní práce
doi: https://doi.org/https://doi.org/10.5817/CSF2022-1-27Souhrn
Výskum probiotík pre akvakultúru je v ranom štádiu a pre ich implementáciu je potrebné vykonať ešte množstvo experimentov. Laktiplantibacily patria medzi mikroorganizmy, ktoré sa najčastejšie používajú na prípravu probiotických preparátov. Doterajšie výsledky nie sú postačujúce, práve preto sú potrebné ďalšie štúdie. Výber probiotík pre akvakultúru a ich vývoj pre komerčné využitie v akvakultúre je mnohostupňový a multidisciplinárny proces vyžadujúci si v prvej etape základný a neskôr aj aplikovaný výskum a posúdenie jeho použitia v praxi. Cieľom štúdie bolo pripraviť probiotické krmivo pre ryby s využitím pomocných látok a následne sledovať prežívateľnosť probiotických bakteriálnych buniek v krmive počas 9-mesačného skladovania pri chladničkovej (4 °C) a izbovej teplote (22 °C). Na prípravu krmiva bol použitý kmeň Lactobacillus plantarum R2 Biocenol™ (CCM 8674) (podľa novej taxonómie Lactiplantibacillus plantarum), potenciálne využiteľný pre probiotické účely v akvakultúre. Lepšia prežívateľnosť probiotických bakteriálnych buniek bola zaznamenaná vo vzorkách krmiva A (Aquatex 41 HMD) v porovnaní so vzorkami probiotických peliet B (Inicio 918-2). Keďže oxidácia mastných kyselín v krmive ovplyvňuje nutričnú kvalitu jednotlivých komponentov krmiva, predpokladáme, že vyššie množstvo oleja v krmive B negatívne ovplyvnilo prežívateľnosť probiotických bakteriálnych buniek. Najvyššie počty životaschopných probiotických baktérií boli zaznamenané pri 4 °C skladovania krmiva. Po 9 mesiacoch skladovania pri chladničkovej teplote počty laktiplantibacilov vo vzorkách krmiva A klesli z hodnoty 7,30 log10KTJ/g na počet 5,57 log10KTJ/g. Teplota je považovaná za rozhodujúci faktor ovplyvňujúci životaschopnosť a prežívateľnosť probiotických baktérií počas doby skladovania.
Klíčová slova:
životaschopnost – pomocné látky – obaľovanie – krmivo určené pre ryby – Lactiplantibacillus plantarum
Úvod
Akvakultúra je neustále narastajúce odvetvie a za posledných desať rokov sa stala dôležitou hospodárskou aktivitou v mnohých krajinách1). V podmienkach intenzívnej produkcie sú ryby vystavené vysokému stresu, čím sa zvyšuje výskyt ochorení, ktorý spôsobuje pokles produktivity2, 3). Bakteriálne ochorenia vo veľkej miere ohrozujú prosperitu chovu rýb4). Negatívny vplyv na zdravotný stav rýb majú aj zmeny v chemizme vodného prostredia a skrmovanie nevhodného krmiva5). Masívne používanie antimikrobiálnych látok pri liečbe a prevencii chorôb zvyšuje selektívny tlak na mikroorganizmy a prispieva k prirodzenému vzniku bakteriálnej rezistencie6). Rezistentné patogénne baktérie rýb predstavujú problém tak v sektore akvakultúry, ako aj v prípade transferu génov rezistencie na baktérie patogénne pre ľudí7). Bolo navrhnutých niekoľko alternatívnych stratégií pre použitie antibiotík, pričom medzi nové bezpečné riešenia zaraďujeme aj využitie probiotických mikroorganizmov, ktorých perspektíva v akvakultúre je veľmi sľubná8).
Probiotické preparáty obsahujú živé mikroorganizmy, ktorých podávanie v dostatočných množstvách má preukázateľne pozitívny vplyv na hostiteľa9). Vhodný kandidát pre probiotické použitie v akvakultúre by mal prežívať počas technologického spracovania ako aj počas skladovania prežiť pasáž gastrointestinálnym traktom, dosiahnuť miesto svojho pôsobenia, byť schopným pôsobiť v prostredí čreva a zároveň byť pre hostiteľa nepatogénnym a prospešným10, 11).
Mikrobiologickú kvalitu krmív ovplyvňujú podmienky skladovania, a to najmä teplota a vlhkosť. Prežívateľnosť probiotických bakteriálnych buniek v krmive je kritická hodnota, pretože určuje efektívnosť krmiva pre hostiteľa12).
Doposiaľ nebolo vykonaných veľa štúdií, ktoré by sa zaoberali inkorporáciou probiotík do krmiva rýb, a práve preto bola naša štúdia zameraná na prípravu aplikačnej formy probiotík vhodnej pre použitie v akvakultúre. Cieľom experimentálnej časti štúdie bola príprava krmiva obohateného o autochtónny probiotický kmeň a určenie najvyššej miery prežívateľnosti probiotických bakteriálnych buniek v krmive počas skladovania pri izbovej a chladničkovej teplote.
Pokusná časť
Materiál a metódy
Kultivácia probiotických baktérií pre prípravu krmiva
V experimente bol použitý kmeň Lactobacillus plantarum R2 Biocenol™ (CCM 8674) (podľa novej taxonómie Lactiplantibacillus plantarum)13), ktorý bol izolovaný z črevného obsahu jedincov pstruha dúhového (Oncorhynchus mykiss) chovaného na slovenskej farme Rybárstvo Požehy s.r.o. a vybraný na základe selekčných kritérií pre probiotické baktérie14). Pre jednotlivé skupiny peliet bola pripravená 18-hodinová kultúra kmeňa v 1 l MRS bujónu (HiMedia, India) pri 37 °C na trepačke, ktorá sa následne centrifugovala (4500 ot./min po dobu 40 min) pri 22 °C (ROTINA 420R, Nemecko).
Príprava krmiva obohateného o probiotiká pre ryby použitím pomocných látok
Celkovo boli pripravené dve šarže kŕmnych peliet s obsahom laktiplantibacilov, ktoré sa líšili druhom použitých peliet, na ktoré boli naadsorbované probiotiká. Jedna šarža obsahovala kŕmne pelety Aquatex 41 HMD, Dibaq, ČR (ďalej len A) a druhú skupinu tvorilo krmivo Inicio 918-2 mm, BioMar, Dánsko (ďalej len B). Zloženie probiotických peliet (tab. 1) a postup prípravy boli identické.
Tab. 1. Navážka komponentov k príprave probiotického krmiva 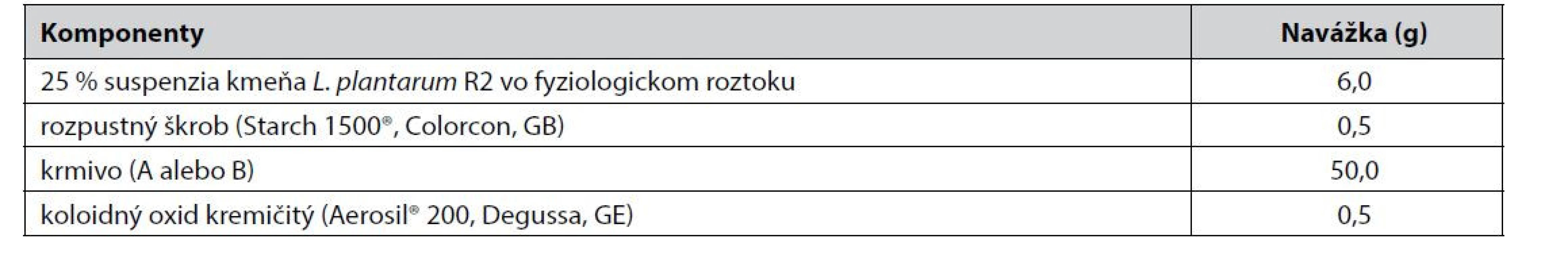
Najprv bola pripravená bakteriálna kultúra s obsahom kmeňa Lactobacillus plantarum R2 (1011 KTJ/ml) v MRS bujóne podľa už zverejnenej metodiky14). Probiotická kultúra bola následne centrifugovaná po dobu 15 min pri otáčkach 4000 rpm (ROTINA 420R, Nemecko), pričom supernatant bol dekantovaný a sediment dvakrát premytý sterilným fyziologickým roztokom (jeho množstvo bolo približne rovnaké ako supernatantu) a znova odstredený za identických podmienok. Po dekantácii bol k sedimentu pridaný sterilný fyziologický roztok v takom množstve, aby vznikla 25% suspenzia probiotických bakteriálnych buniek kmeňa L. plantarum R2 vo fyziologickom roztoku, do ktorej bol prisypaný rozpustný škrob. Vzniknutá disperzia sa miešala 60 minút na elektromagnetickej platničke (AccuPlate™ Stirrer, Labnet International Inc., USA) až do vzniku bakteriálno-škrobového hydrogélu. Do NTS fľaše (150 ml) boli odvážené pelety (A alebo B) a následne sa pridal koloidný oxid kremičitý a na trepačke (C2 Platform Shaker, Edison NJ, USA) sa pelety pretrepávali po dobu 2 – 5 min pri 380 rpm, dovtedy, kým vznikla homogénna zmes. Do fľaše sa následne opatrne prilial pripravený bakteriálno-škrobový hydrogél. Fľaša sa uzavrela a miešala na trepačke pri identických podmienkach, až sa hydrogél rovnomerne naadsorboval na povrch peliet. Pelety sa potom sušili pri 35 °C počas 4 hodín v teplovzdušnej sušiarni (Universal Oven UN 55, Memmert, Nemecko). Fyzikálne hodnotenie pripravených peliet nie je súčasťou tejto štúdie a bude vyhodnotené v ďalšej publikácii.
Stanovenie prežívateľnosti probiotických mikroorganizmov
V testovaných skupinách obalených peliet sme sledovali prežívateľnosť baktérií počas skladovania krmiva pri chladničkovej (4 °C) a izbovej teplote (22 °C). Odber vzoriek sme uskutočnili v 1-mesačných intervaloch po dobu 9 mesiacov skladovania. Počet živých probiotických buniek bol stanovený kultivačnou metódou na MRS agarových platniach. Z oboch skupín peliet sme odoberali v stanovených intervaloch 1 g vzorky, ktorý sa podrvil v trecej miske a riedil desiatkovým riedením s fyziologickým roztokom. Na MRS agarové platne sa rozotrelo sterilnou roztierkou v tvare L 100 μl jednotlivých riedení a po anaeróbnej kultivácii (BBL GasPak vyvíjače anaeróbneho prostredia, Becton Dickinson) počas 48 hod pri 37 °C (Universal Oven UN 55, Memmert, Nemecko) sa odčítali počty solitárnych kolónií.
Štatistická analýza
Pre hodnotenie prežívateľnosti probiotických mikroorganizmov počas skladovania bola použitá analýza dynamiky časových radov, ktorá bola vykonaná v programe Microsoft Excel. Prežívateľnosť v oboch druhoch krmiva bola porovnaná na základe priemerného absolútneho a relatívneho prírastku (záporné hodnoty vyjadrujú pokles) a priemerného koeficientu rastu (hodnoty < 1 vyjadrujú pokles).
Výsledky a diskusia
V štúdii bol použitý kmeň pre probiotické využitie v akvakultúre Lactobacillus plantarum R2 Biocenol™ (CCM 8674), ktorý sme získali zo vzoriek črevného obsahu jedincov pstruha dúhového (Oncorhynchus mykiss) na základe in vitro selekčných kritérií14).
Je dôležité zvážiť koncentráciu probiotických bakteriálnych buniek v krmive určenom pre ryby. Na základe výsledkov doterajších štúdií možno konštatovať, že počet bakteriálnych buniek 107 KTJ/g krmiva je dostatočný na kontrolu voči patogénom rýb a použitie vyšších koncentrácií probiotík nevedie k lepšej ochrane voči ochoreniu, resp. k zníženiu mortality15, 16). Bolo preukázané, že kontinuálna aplikácia probiotických buniek pomocou suchého krmiva obsahujúceho 105 – 109 KTJ/g viedla ku kolonizácii črevného epitelu17, 18), intestinálnej mukózy19, 20–22) a pylorických príveskov17). V pripravenom probiotickom krmive hneď po sušení koncentrácia probiotických bakteriálnych buniek v peletách A predstavovala hodnotu 1 x 107 KTJ/g a v prípade peliet B bola koncentrácia probiotických baktérií 1 x 106 KTJ/g.
Probiotické krmivo bolo pripravené s využitím koloidného oxidu kremičitého, čo je fyziologicky inertná látka s vysokým merným povrchom schopná fixovať účinnú látku na povrchu peliet, a rozpustného škrobu, ktorý je rovnako fyziologicky inertný a ktorý vytvoril obalovú vrstvu, fixujúcu laktiplantibacily k povrchu pripravených probiotických peliet.
V krmive určenom pre pstruhy, ktoré tvorilo základ pre inkorporáciu probiotických baktérií, musí byť zahrnutý aj zdroj škrobu, ktorý slúži ako nutričné spojivo. Mletá alebo celá pšenica, pšeničný alebo kukuričný škrob sú príklady zložiek používaných v krmivách23). Práve použitie kukuričného škrobu pri príprave probiotického krmiva môže zohrávať zaujímavú úlohu v in vivo experimente, keďže sa jedná o rezistentný škrob (nestráviteľný sacharid), ktorý pôsobí v organizme hostiteľa ako prebiotikum. Na zvieracích modeloch bolo preukázané, že začlenenie rezistentných škrobov a probiotík do krmiva zvýšilo hmotnostné prírastky a odolnosť voči patogénom24, 25). Výhody použitia rezistentného škrobu prevyšujú tradičné prebiotiká, pretože rezistentný škrob ponúka ideálny povrch pre adhéziu probiotických baktérií, čím poskytuje odolnosť probiotík voči vplyvom prostredia, ako je príprava, skladovanie krmiva a transport probiotík cez gastrointestinálny trakt (GIT)26). Adhézia probiotických baktérií ku molekulám škrobu môže predstavovať výhody pre nové technológie v oblasti prípravy probiotických krmív a pri zvýšení odolnosti životaschopných a metabolicky aktívnych probiotických mikroorganizmov počas prechodu tráviacim traktom až do miesta pôsobenia.
Ďalším faktorom, ktorý pozitívne ovplyvnil prežívateľnosť probiotík, je prítomnosť polynenasýtených mastných kyselín (PUFA) v rybom oleji, ktorých podiel v potrave rýb zvyšuje počty baktérií mliečneho kvasenia. Bolo to potvrdené v experimente27), v ktorom jedinci sivoňa alpského (Salvelinus alpinus) boli kŕmení diétou obohatenou o PUFA. Vo všetkých častiach GIT rýb z Gram-pozitívnych baktérií dominovali kyslomliečne baktérie. Predpokladá sa, že PUFA v potrave ovplyvňujú väzbové miesta v mikrobiote GIT s možnou modifikáciou zloženia mastných kyselín v stene čreva. Naopak v probiotickom krmive uskladnenom pri 22 °C životaschopnosť probiotických buniek klesala rýchlo, pretože prítomnosť PUFA v rybom oleji zapríčinila oxidáciu v krmive, ktorá ovplyvňuje nutričnú kvalitu jednotlivých komponentov krmiva28).
Vo vzorkách štandardného komerčného krmiva A/B suplementovaného probiotickými bakteriálnymi bunkami kmeňa Lactobacillus plantarum R2 Biocenol™ CCM 8674 počas 9 mesiacov skladovania pri 4 °C sa znížila prežívateľnosť buniek približne o dva logaritmy (obr. 1), zatiaľ čo pri uchovaní peliet pri 22 °C v 3. mesiaci životaschopné baktérie klesli na nulovú hodnotu (obr. 2). Predpokladáme, že oxidácia tuku v krmive pri vyššej teplote skladovania aj v našom prípade negatívne ovplyvnila prežívateľnosť probiotických baktérií. Rozdielom v množstve tuku v krmive si vysvetľujeme aj určitý rozdiel medzi krmivom A a B, kde v prípade krmiva B je obsah tuku o 2 % vyšší v porovnaní s peletami A (tab. 2), čo mohlo zapríčiniť nižšie počty probiotických baktérií. Analýzou dynamiky prežívateľnosti sme však nezaznamenali významný rozdiel medzi týmito krmivami, keďže priemerný relatívny prírastok v krmive A bol –62,8 % a v krmive B –62,2 % a priemerný koeficient rastu bol v krmive A 0,372 a v krmive B 0,378. Avšak pri skladovaní pri 4 °C už tento rozdiel bol výraznejší, keď v krmive A bol priemerný relatívny pokles len na úrovni 2,97 % s priemerným koeficientom rastu 0,97 a v krmive B došlo k priemernému relatívnemu poklesu na úrovni 4,15 % s koeficientom rastu 0,95.
Obr. 1. Prežívateľnosť baktérií kmeňa Lactobacillus plantarum v krmive A a B počas skladovania pri 4 °C 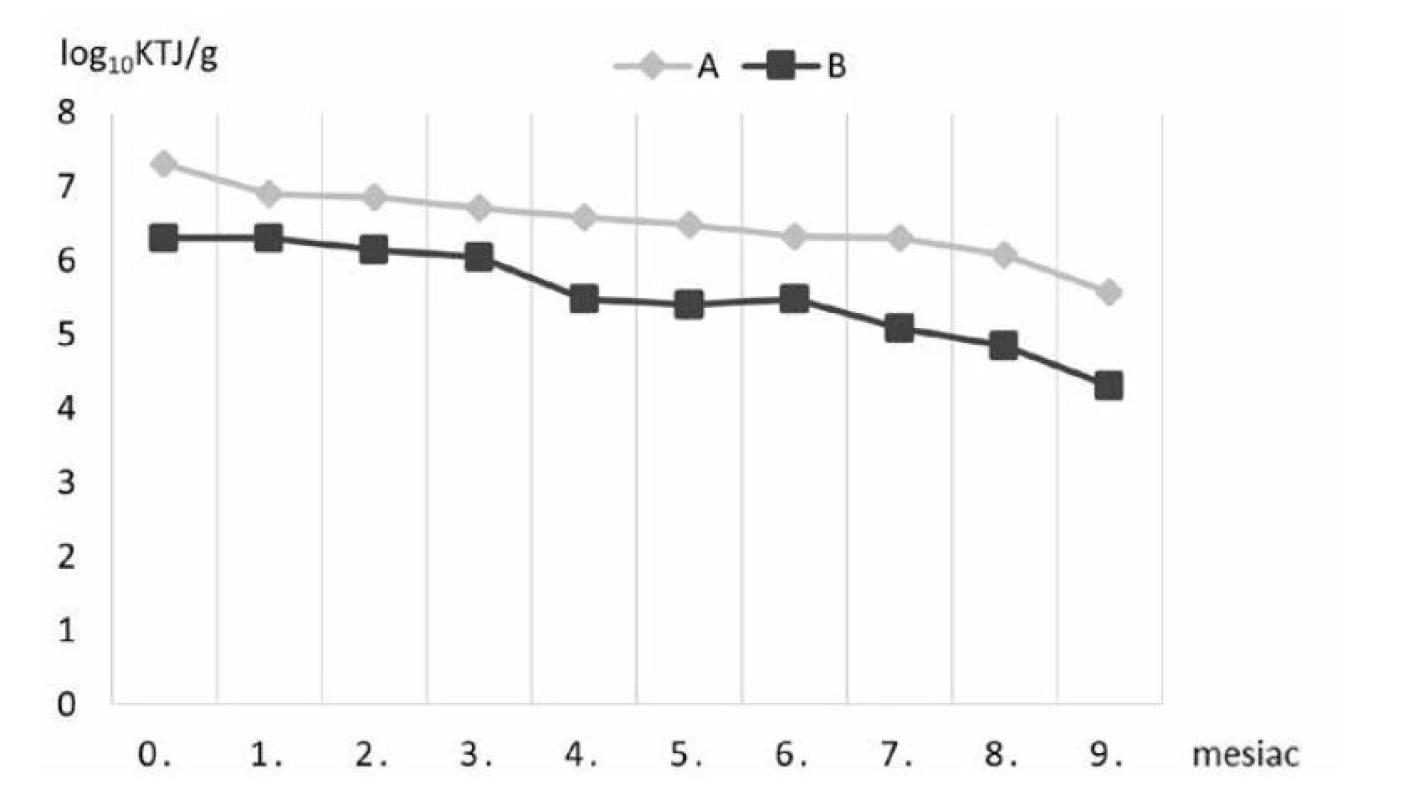
Obr. 2. Prežívateľnosť baktérií kmeňa Lactobacillus plantarum v krmive A a B počas skladovania pri 22 °C 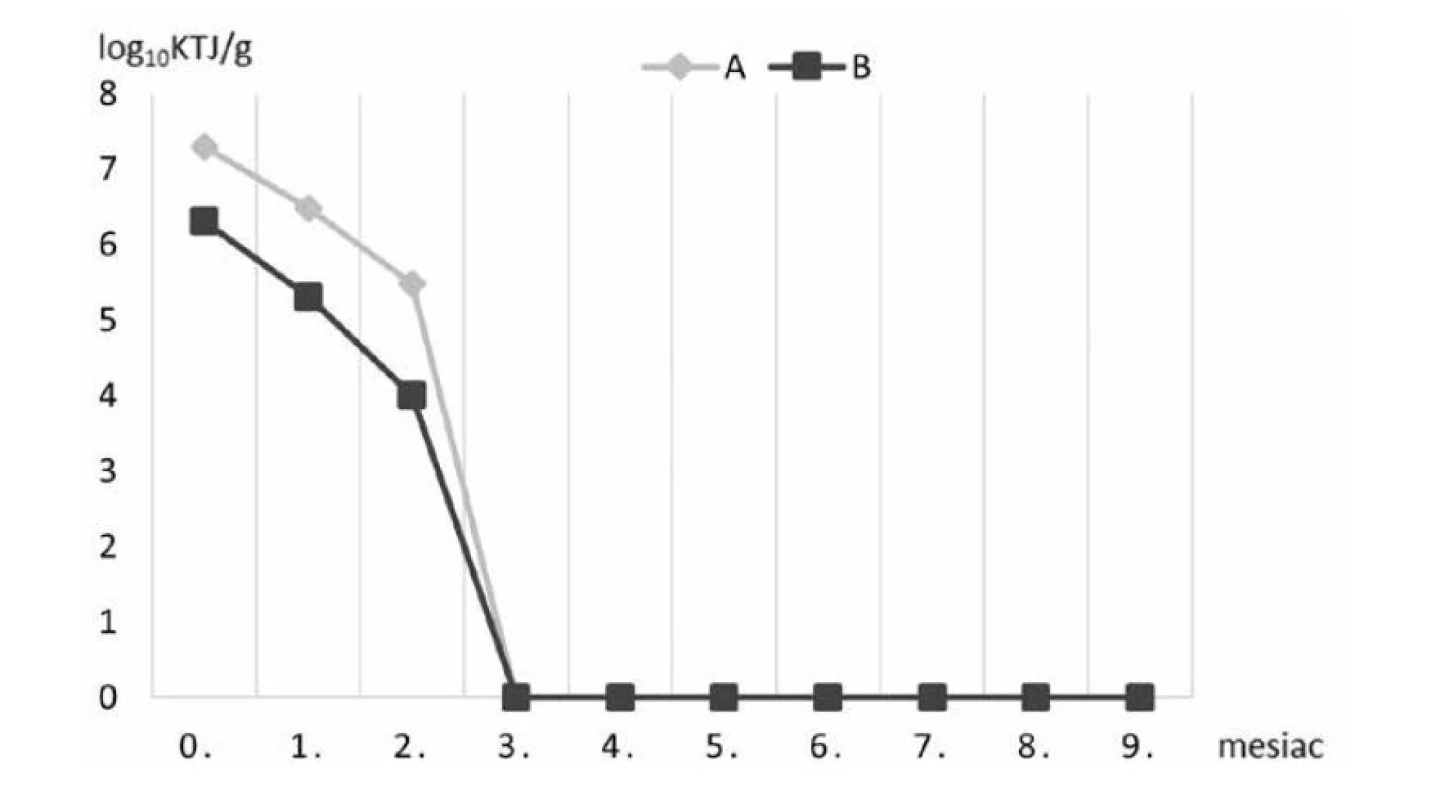
Tab. 2. Zloženie komerčného krmiva určeného pre ryby 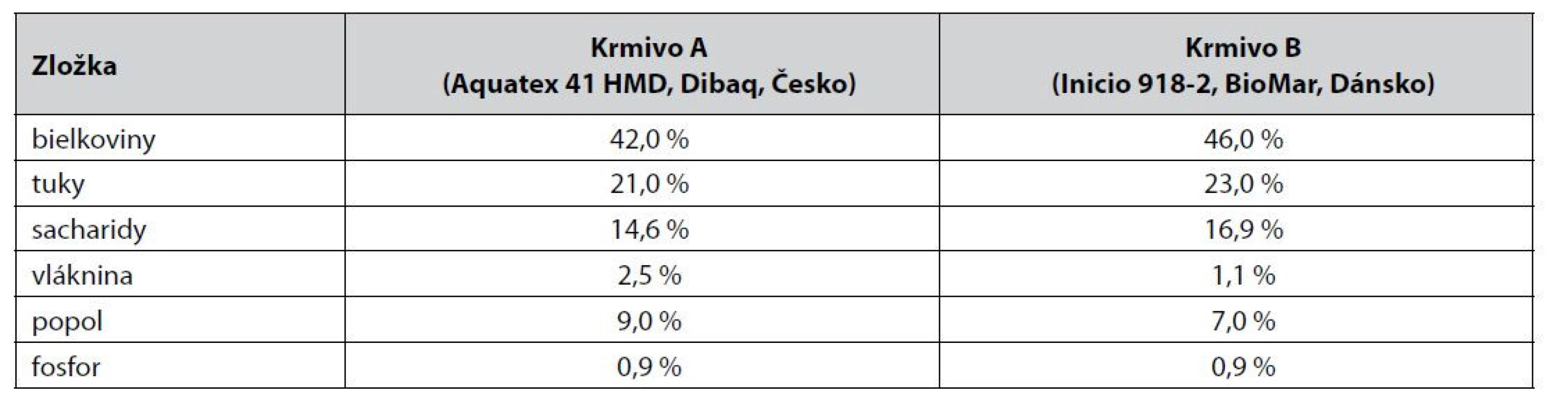
V práci autorov29), ktorí sa zaoberali podobnou problematikou, bol autochtónny probiotický kmeň Acinetobacter haemolyticus začlenený do krmiva pre ryby rovnakým spôsobom ako v našej štúdii, avšak bez použitia pomocných látok. Komerčné krmivo (R-3 Europe 22 %, 3 mm, Skretting, Nórsko) pretrepávali vo fľaši s probiotickými bakteriálnymi bunkami resuspendovanými vo fyziologickom roztoku do rovnomerného obalenia28). Toto obaľovanie vykonali dvakrát za sebou a následne sa pelety sušili po dobu 30 minút pri izbovej teplote za pomoci ventilátora do pôvodnej hmotnosti. Prežívateľnosť probiotických bakteriálnych buniek vo vzorkách sledovali na 14., 23. a 54. deň skladovania pri 4 °C pomocou platňovej kultivačnej metódy. Wanka et al.29) dosiahli počiatočnú koncentráciu probiotík v krmive 10,63 log10KTJ/g, ktorá v priebehu 54 dní skladovania klesla minimálne, a to na hodnotu 10,46 log10KTJ/g. Na základe týchto výsledkov, nie je možné objektívne zhodnotiť, či táto metóda prípravy probiotického krmiva je lepšia, resp. horšia, pre prežívateľnosť probiotických bakteriálnych buniek v krmive počas skladovania, keďže testovanie prežívateľnosti bolo vykonané iba 54 dní a len pri chladničkovej teplote. Jedná sa o jednoduchú prípravu probiotického krmiva, čo je výhodné, a práve preto by bolo zaujímavé do budúcna vykonať experiment s touto metodikou a sledovať prežívateľnosť probiotických bakteriálnych buniek v krmive počas dlhodobého skladovania pri chladničkovej a izbovej teplote, ako aj v in vivo podmienkach.
Amstrong et al.12) sledovali prežívateľnosť probiotických bakteriálnych buniek aj autochtónneho kmeňa Lactobacillus plantarum. Oproti našej štúdii baktérie boli do krmiva začlenené sprejovou metódou (10 ml baktérií/1 kg krmiva) a následne premiešané do výslednej koncentrácie baktérií 8,51 log10KTJ/g. Pripravené probiotické krmivo bolo skladované pri chladničkovej a izbovej teplote a vzorky boli odoberané v intervale 5 dní počas 25 dní skladovania. V porovnaní so získanými výsledkami z našej štúdie môžeme konštatovať, že počet životaschopných probiotických baktérií v krmive A po 25 dňoch skladovania pri chladničkovej teplote klesol o hodnotu 0,1 log10KTJ/g rovnako ako v experimente Amstronga et al.12) (tab. 3). Rovnaké zníženie počtu životaschopných probiotických baktérií o 0,2 log10KTJ/g bolo zaznamenané vo vzorkách krmiva A ako aj vo vzorkách probiotického krmiva Amstronga et al.12) pri izbovej teplote skladovania. Nie je možné však porovnať, či príprava probiotického krmiva sprejovou metódou má rovnaký vplyv na prežívateľnosť probiotických baktérií počas skladovania ako obalenie probiotík prostredníctvom pomocných látok na povrch krmiva, keďže nebolo sledovanie prežívateľnosti probiotík vykonané v rovnakom intervale skladovania vzoriek.
Tab. 3. Porovnanie prežívateľnosti probiotík v krmive A so zahraničnou štúdiou12) 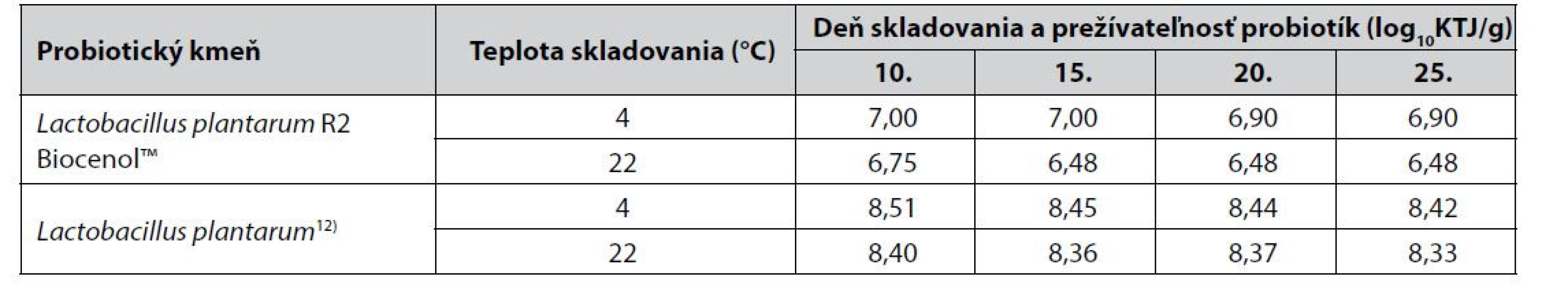
Wirunpan et al.30) obohatili krmivo určené pre garnáty o probiotický kmeň Lactobacillus lactis 1464 izolovaný zo sedimentu rybníka tilapie nílskej (Oreochromis niloticus). Čerstvá bakteriálna kultúra (25 % objemu na hmotnosť) bez a s úpravou pH na hodnotu 7 bola zmiešaná so zložkami krmiva pred procesom peletizácie pri izbovej teplote. Mokré pelety boli vysušené na fluidizovanom podklade sušičom pri 50 °C, 60 °C, 70 °C a 80 °C, aby sa dosiahol obsah vlhkosti peliet pod 11 %. Výsledky životaschopnosti bakteriálnych buniek kmeňa záviseli od teploty sušenia s počtom životaschopných buniek v intervale 106 – 108 KTJ/g ako aj od pH bakteriálnej kultúry. Pri všetkých teplotách sušenia sa prežívateľnosť bakteriálnych buniek kmeňa po sušení pohybovala od 75,94 % do 92,28 % pri pH 3,8 a v intervale 89,54 % do 96,87 % pri pH 7,0. Navyše bolo zistené, že použitie prídavných látok do zmesi probiotík zvyšuje prežitie baktérií počas sušenia. A to najmä pridanie sušeného mlieka a glutamanu sodného vykazovalo signifikantne významný (p < 0,05) ochranný účinok na životaschopnosť baktérií pri teplote sušenia 80 °C. Podobne ako v našej štúdii aj tu skladovanie krmiva pri nízkej teplote 4 °C malo pozitívny vplyv na prežívateľnosť probiotických buniek v porovnaní s vyššou teplotou 30 °C.
Ayo-Olalusi et al.31) sledovali prežívateľnosť probiotických bakteriálnych buniek kmeňov Lactobacillus brevis 1, Lactobacillus plantarum a Pediococcus pentosaceus 2 izolovaných z čreva rôznych druhov rýb – barakuda guinejská (Sphyraena afra), sumček africký (Clarias gariepinus) a tilapia (Tilapia guineensis). Oproti našej štúdii baktérie boli do krmiva začlenené sprejovou metódou (10 ml baktérií/1 kg krmiva) a následne premiešané do výslednej koncentrácie baktérií 3,2 x 108 KTJ/ml. Tri skupiny krmiva boli skladované pri 4 rôznych teplotách 0, 4, 8 a 22 °C a vzorky boli odoberané v intervale 5 dní počas 25 dní skladovania. Výsledky preukázali najvyššiu životaschopnosť bakteriálnych buniek kmeňov pri teplote skladovania 0 °C, avšak pri tejto teplote dochádzalo ku chemickým zmenám zložiek krmiva, kvôli zmrazovaniu/rozmrazovaniu, čím boli niektoré živé bakteriálne bunky usmrtené. Z týchto dôvodov krmivo obohatené o probiotiká by malo byť skladované aspoň pri 4 °C. Po 15 dňoch skladovania krmiva pri 22 °C počty bakteriálnych buniek začali klesať. Rovnaké zistenia sme zaznamenali aj z našich výsledkov. Pri teplote skladovania 4 °C prežívali probiotické bunky vo vyšších počtoch v oboch skupinách krmiva ako počas skladovania pri 22 °C. Je zrejmé, že krmivo uskladnené pri 4 °C vykazovalo vyššiu stabilitu počtov probiotických buniek počas 9 mesiacov skladovania. Avšak chladenie je nevýhodné pre predajcu a zásobovateľa vzhľadom na jeho vysoké náklady. Preto je veľkou výzvou vyrábať probiotické krmivo, ktoré by bolo stále aj pri izbovej teplote. V našej štúdii sa udržali počty životaschopných probiotických bakteriálnych buniek v krmive po dobu 2 mesiacov uskladnenia pri 22 °C. V treťom mesiaci skladovania oboch vzoriek probiotického krmiva pri 22 °C sme nezaznamenali prítomnosť živých probiotických baktérií.
Autochtónny probiotický kmeň Bacillus licheniformis KCCM 43270 izolovaný z platesy japonskej (Paralichthys olivaceus) bol začlenený do krmiva rýb32). Spóry tohto kmeňa prežili prípravu krmiva extrúziou, čím by kmeň Bacillus licheniformis mohol byť použitý ako kŕmne aditívum, ktoré odoláva vysokej teplote. Je však potrebné probiotické krmivo s obsahom spór bacilov otestovať v in vivo experimente, či sú probiotiká vo forme spór schopné byť aktivované a tým pádom aj účinné pri kolonizácii krátkeho tráviaceho traktu rýb.
Živé bunky v probiotických preparátoch strácajú životaschopnosť, a preto obsahujú rôzne pomery populácií živých a odumretých buniek. Okrem toho ďalšie straty životaschopných probiotických bakteriálnych buniek nastávajú po prechode tráviacou sústavou vodných živočíchov (kde sú vystavené nízkemu pH v žalúdku a zásaditému pH v čreve). Tento fenomén je známy u endotermických zvierat a prebieha aktívna diskusia, či odumreté prospešné bakteriálne bunky zohrávajú úlohu pri poskytovaní výhod pre hostiteľa. Táto téma si vyžaduje ďalší výskum aj u vodných živočíchov33).
V súvislosti s používaním probiotík, prebiotík a synbiotík v akvakultúre patrí k dôležitým faktorom aj ekonomická rentabilita. V experimente juvenilných jedincov tilapie nílskej (Oreochromis nileticus) kontrolné krmivo vykazovalo horšiu ekonomickú efektivitu než krmivo obohatené o probiotiká, prebiotiká a synbiotiká na základe hodnotenia konverzie krmiva, priemerných nákladov krmiva na kilogram prírastku živej hmotnosti, konečnej biomasy, celkových nákladov na produkciu a indexu ekonomickej efektivity34).
Záver
Predpokladáme, že vyššie množstvo oleja v krmive B negatívne ovplyvnilo prežívateľnosť probiotických bakteriálnych buniek. Výsledky tejto štúdie nie je možné objektívne porovnať s inou štúdiou, keďže dlhodobé sledovanie prežívateľnosti probiotických baktérií po začlenení do krmiva rýb nebolo doposiaľ publikované. Avšak výsledky koncentrácie životaschopných probiotických baktérií v krmive A pri chladničkovej teplote skladovania po dobu 9 mesiacov postačujú k ich efektívnemu účinku a kolonizácii tráviaceho traktu rýb.
Vyššia prežívateľnosť probiotických bakteriálnych buniek počas 9-mesačného skladovania bola zaznamenaná v skupine probiotického krmiva skladovaného pri chladničkovej teplote (4 °C) v porovnaní s izbovou teplotou (22 °C). Vzhľadom k tomu, že teplota je rozhodujúcim faktorom udržania životaschopnosti bakteriálnych buniek, môžeme konštatovať, že chladničková teplota skladovania probiotického krmiva sa javí ako vhodná teplota pre udržanie čo najdlhšej životaschopnosti probiotických bakteriálnych buniek v krmive určenom pre vodné živočíchy.
Poďakovanie
Práca bola podporená z finančných prostriedkov Agentúry na podporu výskumu a vývoja na základe zmluvy č. APVV-19-0234 a Vedeckej grantovej agentúry – projekt VEGA 1/0731/21.
Stret záujmov: žiadny.
PharmDr. Adriána Fečkaninová, Ph.D.
Univerzita veterinárskeho lekárstva a farmácie Katedra farmaceutickej technológie, farmakognózie a botaniky Komenského 73, 041 81 Košice, SR
e-mail: adriana.feckaninova@uvlf.sk
J. Koščová, D. Mudroňová
Univerzita veterinárskeho lekárstva a farmácie v Košiciach, SR Katedra mikrobiológie a imunológie
A. Franc
Masarykova univerzita, Brno, ČR Farmaceutická fakulta, Ústav farmaceutické technologie
P. Popelka
Univerzita veterinárskeho lekárstva a farmácie v Košiciach, SR Katedra hygieny, technológie a zdravotnej bezpečnosti potravín
Došlo 25. októbra 2021 / Prijato 18. januára 2022
Zdroje
1. Sampels S. Kvalita a gastronomie ryb a rybích výrobků. Vodňany: Jihočeská univerzita v Českých Budějovicích 2014.
2. Cruz M. P., Ibáñez A. L., Hermosillo O. A. M., Saad H. C. R. Use of Probiotics in Aquaculture. ISRN Microbiology 2012; 2012, 1–13.
3. Sica G. M., Brugnoni L. I., Marucci P. A., Cubitto M. A. Characterization of probiotic properties of lactic acid bacteria isolated from an estuarine environment for application in rainbow trout (Oncorhynchus mykiss Walbaum) farming. Antonie van Leeuwenhoek 2012; 101, 869–879.
4. Austin A. D., Austin B. Bacterial Fish Pathogens: Diseases of Farmed and Wild Fish. London: Springer 2012.
5. Lara-Flores M. The use of probiotic in aquaculture: an overview. Inter. Res. J. Microbiol. 2011; 2, 471–478.
6. Smith P. Antimicrobial resistance in aquaculture. Rev. Sci. Tech. 2008; 27, 243–264.
7. Carvalho D. E., David S. G., Silva J. R. Health and environment in aquaculture. Rijeka: InTech 2012.
8. Newaj-Fyzul A., Al-Harbi A. H., Austin B. Review: Developments in the use of probiotics for disease control in aquaculture. Aquaculture 2014; 431, 1–11.
9. FAO/WHO. Guidelines for the evaluation of probiotics in food: joint fao/who working group meeting, London Ontario, Canada, 30 April-1 May 2002; 11 p. http:www. who.int/foodsafety/publications/fs_management/probiotics2/ en/index.html
10. Merrifield D. L., Dimitroglou A., Foey A., Davies S. J., Baker R. T. M., Bøgvald J., Castex M., Ringø E. The current status and future focus of probiotic and prebiotic applications for salmonids. Aquaculture 2010a; 302, 1–18.
11. Giraffa G., Chanishvili N., Widyastuti Y. Importance of lactobacilli in food and feed biotechnology. Res. Microbiol. 2010; 161, 480–487.
12. Amstrong O. D., Atamu D., Orhomedia E. H., Destiny A. Effect of different storage temperatures on the viabilities change of probiotics in the fish feed. Int. J. Biotechnol. Biochem. 2016; 5, 697–701.
13. Zheng J., Wittouck S., Salvetti E., Franz C. M. A. P., Harris H. M. B., Mattarelli P., Toole P., Pot B., Vandamme P., Walter J., Watanabe K., Wuyts S., Felis G. E., Gänzle M. G., Lebeer S. A taxonomic note on the genus Lactobacillus: Description of 23 novel genera, emended description of the genus Lactobacillus Beijerinck 1901, and union of Lactobacillaceae and Leuconostocaceae. Int. J. Syst. Evol. Microbiol. 2020; 70, 2782–2858.
14. Fečkaninová A., Koščová J., Mudroňová D., Schusterová P., Cingeľová Maruščáková I., Popelka P. Characterization of two novel lactic acid bacteria isolated from the intestine of rainbow trout (Oncorhynchus mykiss, Walbaum) in Slovakia. Aquaculture 2019; 506, 294–301.
15. Nikoskelainen S., Ouwehand A., Salminen S., Bylund, G. Protection of rainbow trout Oncorhynchus mykiss from furunculosis by Lactobacillus rhamnosus. Aquaculture 2001; 198, 229–236.
16. Brunt J., Austin B. Use of a probiotic to control lactococcosis and streptococcosis in rainbow trout, Oncorhynchus mykiss (Walbaum). J. Fish Dis. 2005; 28, 693–701.
17. Gildberg A., Mikkelsen H., Sandaker E., Ringø E. Probiotic effect of lactic acid bacteria in the feed on growth and survival of fry of Atlantic cod (Gadus morhua). Hydrobiologia. 1997; 352, 279–285.
18. Gildberg A., Ikkelsen H. Effects of supplementing the feed to Atlantic cod (Gadus morhua) fry with lactic acid bacteria and immuno-stimulating peptides during a challenge trial with Vibrio anguillarum. Aquaculture 1998; 167, 103–113.
19. Kim D. H., Austin B. Innate immune responses in rainbow trout (Oncorhynchus mykiss, Walbaum) induced by probiotics. Fish Shellfish Immunol. 2006; 21, 513–524.
20. Newaj-Fyzul A., Adesiyun A. A., Mutani A., Ramsubhag A., Brunt J., Austin B. Bacillus subtilis AB1 controls Aeromonas infection in rainbow trout (Oncorhynchus mykiss, Walbaum). J. Appl. Microbiol. 2007; 103, 1699–1706.
21. Merrifield D. L., Bradley G., Harper G. M., Baker R. T. M., Munn C. B., Davies S. J. Assessment of the effects of vegetative and lyophilized Pediococcus acidilactici on growth, feed utilization, intestinal colonization and health parameters of rainbow trout (Oncorhynchus mykiss Walbaum). Aquac. Nutr. 2011; 17, 73–79.
22. Merrifield D. L., Bradley G., Baker R. T. M., Davies S. J. Probiotic applications for rainbow trout (Oncorhynchus mykkis Walbaum) II. Effects on growth performance, feed utilisation, intestinal microbiota, and related health criteria postantibiotic treatment. Aquac. Nutr. 2010; 16, 496–503.
23. FAO (Food and Agriculture Organization of the United Nations). Rainbow trout – feed formulation. 2018; http://www.fao.org/fishery/affris/species-profiles/rainbow - trout/feed-formulation/en/
24. Krause D. O., Bhandari S. K., House J. D., Nyachoti C. M. Response of nursery pigs to a synbiotic preparation of starch and an anti-Escherichia coli K88 probiotic. Appl. Environ. Microbiol. 2010; 76, 8192–8200.
25. Huff G. R., Huff W. E., Rath N. C., El-Gohary F. A., Zhou Z. Y., Shini S. Efficacy of a novel prebiotic and a commercial probiotic in reducing mortality and production losses due to cold stress and Escherichia coli challenge of broiler chicks. Poult. Sci. 2015; 94, 918–926.
26. Kosin B., Rakshit S. K. Microbial and Processing Criteria for Production of Probiotics: A Review. Food Technology and Biotechnology 2006; 44, 371–379.
27. Ringø E., Bendiksen H. R., Gausen S. J., Sundsfjord A., Olsen R. E. The effect of dietary fatty acids on lactic acid bacteria associated with the epithelial mucosa and from faecalia of Arctic charr, Salvelinus alpinus (L.). J. Appl. Microbiol. 1998; 85, 855–864.
28. Turchini G., Ng W. K., Tochler D. Fish Oil Replacement and Alternative Lipid Sources in Aquaculture Feeds. Boca Raton: CRC Press 2010.
29. Wanka K. M., Damerau T., Costas B., Krueger A., Schulz C., Wuertz S. Isolation and characterization of native probiotics for fish farming. BMC Microbiology 2018; 18, 119.
30. Wirunpan M., Savedboworn W., Wanchaitanawong P. Survival and shelf life of Lactobacillus lactis 1464 in shrimp feed pellet after fluidized bed drying. Agric. Nat. Resour. 2016; 50, 1–7.
31. Ayo-Olalusi C. I., Adeiga A., Akintunde G. B., Oramadike C. E., Awoderu T. Viability of Lactobacillus brevis1, Lactobacillus plantarum and Pediococcus pentosaceus 2 isolated from fish gut after incorporation into the fish feed. Int. J. Biotechnol. Res. 2014; 2, 97–101.
32. Niu K. M., Kothari D., Lee W. D., Lim J. M., Khosravi S., Lee S. M., Lee B. J., Kim W. K., Han H. S., Kim S. K. Autochthonous Bacillus licheniformis: Probiotic potential and survival ability in low‐fishmeal extruded pellet aquafeed. MicrobiologyOpen 2019; 8, 767.
33. Ringø E., Zhou Z., Vecino J. L. G., Wadsworth S., Romero J., Krogdahl A., Olsen, R. E., Dimitroglou A., Foey A., Davies S., Owen M., Lauzon H. L., Martinsen L. L., De Schryver P., Bossier P., Sperstad, S., Merrifield D. L. Effect of dietary components on the gut microbiota of aquatic animals. A never-ending story? Aquac. Nutr. 2016; 22, 219–282.
34. Azevedo R. V., Filho J. C. F., Cardoso L. D., Mattos D. C., Vidal Junior M. V., Andrade D. R. Economic evaluation of prebiotics, probiotics and symbiotics in juvenile Nile tilapia. Rev. Ciên. Agron. 2015; 46, 72–79.
Štítky
Farmacie Farmakologie
Článek vyšel v časopiseČeská a slovenská farmacie
Nejčtenější tento týden
2022 Číslo 1- Psilocybin je v Česku od 1. ledna 2026 schválený. Co to znamená v praxi?
- Ukažte mi, jak kašlete, a já vám řeknu, co vám je
- Biomarker NT-proBNP má v praxi široké využití. Usnadněte si jeho vyšetření POCT analyzátorem Afias 1
-
Všechny články tohoto čísla
- Role fyzických osob, kterým je poskytována zdravotní péče – terminologické poznámky
- Barevnost a antioxidační aktivita medů
- Prežívateľnosť produkčných probiotických kmeňov vo vybranej aplikačnej forme
- Etické a zákonné požadavky na podstoupení očkování k prevenci nemoci COVID-19
- Cerebroprotektivní vlastnosti rekombinantního antagonisty receptoru pro interleukin-1 – experimentální studie
- Česká a slovenská farmacie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Etické a zákonné požadavky na podstoupení očkování k prevenci nemoci COVID-19
- Role fyzických osob, kterým je poskytována zdravotní péče – terminologické poznámky
- Prežívateľnosť produkčných probiotických kmeňov vo vybranej aplikačnej forme
- Barevnost a antioxidační aktivita medů
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



