-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Antioxidační aktivita extraktů a HPLC analýza flavonoidů Capsella bursa-pastoris (L.) Medik
Antioxidant activity of extracts and HPLC analysis of flavonoids from Capella bursa-pastoris (L.) Medik
The flavonoid profile of Capsella bursa-pastoris (L.) Medik. (Brassicaceae) and the antioxidant activity of its methanolic and aqueous extracts were studied. Glycosides of quercetin, chrysoeriol, kaempferol, and isorhamnetin were identified. Chrysoeriol O-glucoside and isorhamnetin O-rutinoside were detected in this species for the first time. The extracts presented an antioxidant activity against DPPH radicals, peroxyl radicals, hydroxyl radicals, and hydrogen peroxide.
Keywords:
Capsella bursa-pastoris • flavonoids • antioxidant activity
Autoři: Renata Kubínová; Věra Špačková; Emil Švajdlenka; Katarina Lučivjanská
Působiště autorů: Veterinární a farmaceutická univerzita, Farmaceutická fakulta, Ústav přírodních léčiv, Brno
Vyšlo v časopise: Čes. slov. Farm., 2013; 62, 174-176
Kategorie: Původní práce
Souhrn
Fytochemická analýza methanolického a vodného extraktu Capsella bursa-pastoris (L.) Medik. (Brassicaceae) zaměřená na polyfenoly prokázala přítomnost flavonoidů. Jde zejména o glykosidy kvercetinu, chrysoeriolu, kaempferolu a isorhamnetinu. Glykosidy chrysoeriolu a isorhamnetinu byly v rostlině identifikovány poprvé. Díky obsahu těchto polyfenolů vykazují extrakty antioxidační aktivitu.
Klíčová slova:
Capsella bursa-pastoris • flavonoidy • antioxidační aktivitaCapsella bursa-pastoris – kokoška pastuší tobolka je oblíbená léčivá rostlina, která se užívá jako gynekologikum a také pro svoji hemostyptickou aktivitu1). Tento účinek lze využít zevně k ošetření drobných oděrek na kůži nebo jako sedací koupele při hemoroidech. V lidovém léčitelství se využívá také jako antidiabetikum2). Byly publikovány práce o antioxidační, protinádorové a antitrombotické aktivitě extraktů1).
Fytochemické analýzy prokázaly, že extrakty Capsella bursa-pastoris jsou bohatým zdrojem flavonoidů a organických kyselin. Obsahují ale také aminokyseliny, mastné kyseliny, alkaloidy a glukosinoláty, které jsou typické pro čeleď Brassicaceae1). V semenech tohoto druhu byl identifikován sinigrin a methylsulfinyldecylglukosinolát3). Glukosinoláty jsou dnes velmi intenzivně zkoumány v souvislosti s chemoprotektivní aktivitou a byla u nich prokázána schopnost působit preventivně a snižovat možnost vzniku nádorových onemocnění4). Zajímavou obsahovou látkou v této souvislosti je také indolový derivát camalexin, fytoalexin s antiproliferativní aktivitou5).
Významnou skupinou rostlinných polyfenolů podílejících se na biologické aktivitě extraktů jsou flavonoidy. Z aglykonů byly identifikovány v rostlině tricin, kvercetin, kaempferol, apigenin a jejich glykosidy1, 2, 6), přičemž dominantní je kaempferol-3-O-rutinosid1).
V souvislosti s vědecko-výzkumnou prací na Ústavu přírodních léčiv, která je věnována přírodním polyfenolů a jejich biologické aktivitě, byly podrobeny fytochemické analýze extrakty Capsella bursa-pastoris a testována jejich antioxidační aktivita. Ta byla srovnána s extrakty druhu Agrimonia eupatoria L., která je silný antioxidant a je využívána v našich měřeních jako standard a také s přírodním antioxidantem kvercetinem. V prezentované práci se zaměřujeme na analýzu flavonoidů, které se ukázaly být dominantní složkou extraktů.
Pokusná část
Chemikálie a roztoky
Hydrogenfosforečnan sodný, dihydrogenfosforečnan sodný, hydroxid sodný, kyselina chlorovodíková (HCl), kyselina mravenčí, kyselina trifluoroctová (TCA), methanol, acetonitril, peroxid vodíku, síran železnatý, AAPH (2,2’́-azobis-2-amidinopropandihydrochlorid), luminol, DPPH (2,2-diphenyl-1-picrylhydrazyl radikál), isokvercitrin, kvercetin, glukosa. Všechny chemikálie byly zakoupeny u firmy Sigma-Aldrich (USA).
Přístroje a zařízení
HPLC/DAD/ESI-MS HP Agilent 1100 (Hewlett-Packard, USA) s kolonou Supelcosil ABZ+ Plus (150 × 4,6 mm, velikost částic 3 μm), HPLC YL9100 (Young Lin Instrument Co., Korea) s kolonou LiChrospher 100 DIOL (125 × 4 mm, velikost částic 5 μm), rotační vakuová odparka (Büchi Labortechnik, Švýcarsko), lyofilizátor Alpha 1-2LD (Martin Christ GmbH, Německo), mikrodestičkový reader (BioTek, USA).
Příprava vzorků
1 g sušené drogy (Bursae pastoris herba) byl extrahován 20 ml methanolu, resp. vody 24 hodin při pokojové teplotě. Získaný extrakt byl zahuštěn do tuhé konzistence a testovaný vzorek (CBPMeOH/CBPvoda) byl získán rozpuštěním extraktu v příslušném rozpouštědle, přičemž konečná koncentrace extraktů byla 30 μg/ml. Stejným způsobem byl připraven i extrakt z Agrimoniae herba (AMeOH/Avoda). Testované rostliny byly získány z Centra léčivých rostlin Kraví hora, Brno.
HPLC analýzy
Pro analýzu flavonoidů byla využita gradientová eluce: acetonitril (0 min. 10,0 %, 36 min. 100 %, 40 min. 100 %) a 40 mM kyselina mravenčí (0 min. 90 %, 36 min. 0 %, 40 min. 0 %) s průtokem 1 ml.min-1. UV detekce při 254 nm, hmotnostní detekce s elektrosprejovou ionizací (ESI/MS) v negativním módu. Analýza cukru po hydrolýze glykosidu (4M TFA, 60 min při 90 °C) byla provedena pomocí isokratické eluce: 91 : 9 – acetonitril : voda, průtok 2 ml.min-1. Detekce pomocí ELSD (evaporative light scattering detector).
Stanovení antioxidační aktivity
Metoda DPPH radikálu: reakční směs obsahovala 320 μl 60 μM DPPH a 10 μl extraktu. Byla měřena absorbance při 517 nm po 5 minutách7). Míra zhášení byla stanovena v % oproti kontrole, která obsahovala příslušné rozpouštědlo.
Zhášení peroxylového radikálu: reakční směs obsahovala 100 μl 0,1 M fosfátového pufru (pH 7,4),100 μl 0,1 M AAPH, 10 μl extraktu a 100 μl 1 mM luminolu8).
Zhášení hydroxylového radikálu: reakční směs obsahovala 140 μl 0,1 M fosfátového pufru (pH 7,4), 10 μl extraktu, 30 μl 50 μM FeSO4, 100 μl 1 mM luminolu a 50 μl 0,5 mM H2O29).
Zhášení peroxidu vodíku: reakční směs obsahovala 100 μl 0,1 M fosfátového pufru (pH 7,4), 10 μl extraktu, 100 μl 0,3 % H2O2 a 100 μl 1 mM luminolu10).
U chemiluminiscenčních metod byla měřena chemiluminiscence po dobu 30 minut při teplotě 37 0C a stanovena plocha pod křivkou. Míra zhášení byla stanovena v % oproti kontrole, která obsahovala příslušné rozpouštědlo.
Výsledky a diskuze
Fytochemická analýza zaměřená na polyfenoly prokázala, že spektrum flavonoidních glykosidů je v methanolickém a vodném extraktu velmi podobné. Methanolický extrakt je však bohatší o rostlinné polyfenolické kyseliny s retenčním časem 6–9,5 min (obr. 1). Extrakt byl hydrolyzován (11% HCl, 30 min, 90 °C) a přítomné aglykony (kaempferol, isorhamnetin, kvercetin a chrysoeriol) byly identifikovány na základě UV spektra srovnáním s knihovnou standardů.
Obr. 1. HPLC analýza flavonoidů methanolického extraktu Capsella bursa-pastoris 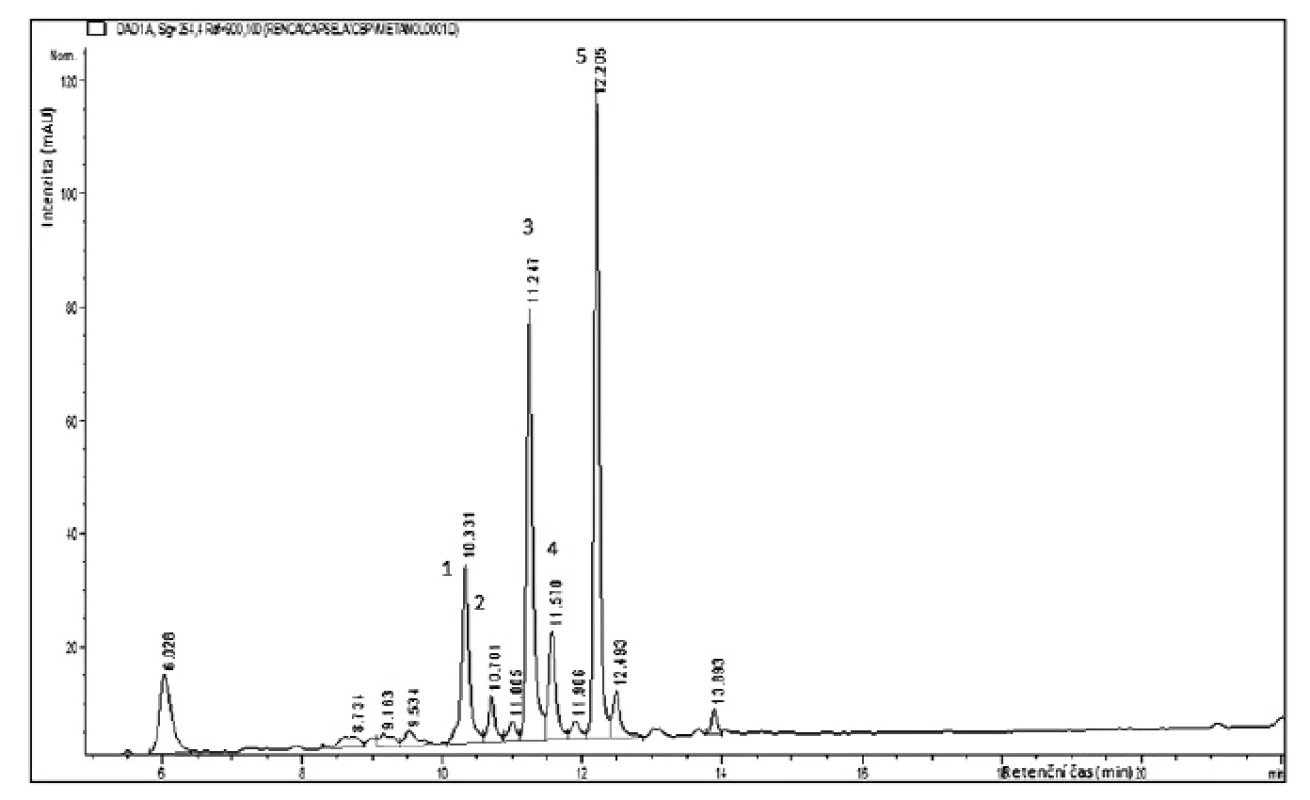
Analýza glykosidů byla provedena pomocí HPLC-ESI-MS. S retenčním časem 10–10,5 min byly eluovány glykosidy s rutinosou. Molekulární ionty [M-H] – v m/z 593 resp. v m/z 623 a následný fragment odpovídající odštěpení cukerné složky [M-H-308] – napovídají, že půjde o kaempferol-O-rutinosid (1) a isorhamnetin-O-rutinosid (2). Již dříve byl v rostlině identifikován kaempferol-3-O-rutinosid1). Retenční čas obou glykosidů je velmi podobný a byly eluovány v jednom píku, ESI-MS analýza však jednoznačně potvrdila i přítomnost isorhamnetin-O-rutinosidu, který byl v rostlině identifikován poprvé.
Retenční časy 11,2 min a 11,5 min odpovídají glykosidům kvercetinu. Kvercetin-3-O-glukosid (isokvercitrin) (3) byl potvrzen společným nástřikem se standardem, druhý glykosid (4) má molekulární fragment [M-H] – v m/z 609, následná fragmentace v m/z 463 odpovídá odštěpení methylpentosy (rhamnosa), aglykon kvercetin poskytuje fragment v m/z 301 a vzniká po odštěpení hexosy. Již dříve byly v rostlině identifikovány kvercetin-3-O-glukosid a kvercetin-3-O-glukosyl-7-O-rhamnosid5).
Chrysoeriol-O-glukosid (5) s retenčním časem 12,2 min poskytuje v MS spektru molekulární ion [M-H] – v m/z 461 a následnou fragmentaci v m/z 299, která odpovídá odštěpení hexosy [M-H-162]–. Eluovaný flavonoid byl zachycen a cukerná složka byla analyzována po kyselé hydrolýze za pomocí HPLC-ELSD. Srovnáním se standardem byla prokázána glukosa. Chrysoeriol-O-glukosid byl v rostlině identifikován poprvé.
Stanovení antioxidační aktivity extraktu ukázalo (tab. 1), že methanolický extrakt vykazuje vyšší antioxidační aktivitu než vodný extrakt, což je dáno širším spektrem obsahových látek včetně polyfenolických kyselin. Extrakty dobře zháší peroxylový a hydroxylový radikál, na což má velký vliv struktura obsažených flavonoidů. Silnými zhášeči peroxylových a hydroxylových radikálů jsou zejména flavonoidy s aglykonem kvercetinem a kaempferolem11). Ve srovnání se stejně připraveným extraktem Agrimonia eupatoria druh Capsella bursa-pastoris vykazuje mnohem nižší antioxidační potenciál. Nicméně široké spektrum obsahových látek1) (organické kyseliny, aminokyseliny, mastné kyseliny, glukosinoláty, flavonoidy, steroly) zaručují, že rostlina bude i nadále zkoumána a najde svoje uplatnění v lidovém léčitelství i v budoucnosti.
Tab. 1. Antioxidační aktivita extraktů Capsella bursa-pastoris a standardu kvercetinu (30 μg/μl), n = 3 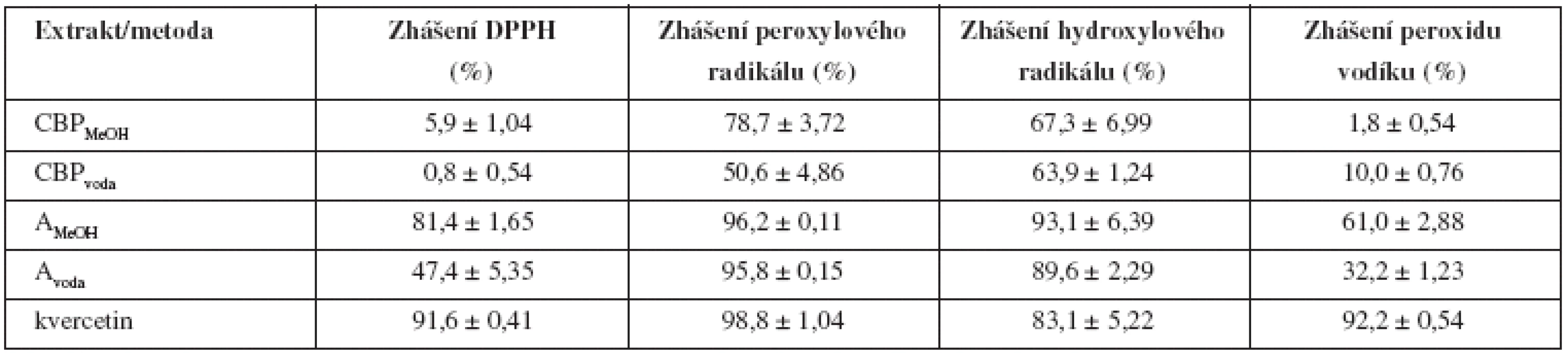
Střet zájmů: žádný.
Došlo 12. června 2013
Přijato 4. července 2013
PharmDr. Renata Kubínová, Ph.D. (∗) • PharmDr. Věra Špačková • Ing. Emil Švajdlenka
Veterinární a farmaceutická univerzita, Farmaceutická fakulta, Ústav přírodních léčiv
Palackého 1/3, 612 42 Brno
e-mail: kubinovar@vfu.cz
Katarina Lučivjanská
Univerzita veterinárskeho lekárstva a farmácie, Katedra farmakognósie a botaniky
Zdroje
1. Grosso C., Vinholes J., Silva L. R., de Pinho P. G., Gonçalves R. F., Valentão P., Jäger A. K., Andrade P. B. Chemical composition and biological screening of Capsellabursa-pastoris. Rev. Bras. Farmacogn. 2011; 21, 635–644.
2. Kweon M. H., Kwak J. H., Ra K. S., Sung H. Ch., Yang H. Ch. Structural characterization of a flavonoid compounds cavenging superoxide anion radica lisolated from Capsellabursa-pastoris. J. Biochem. Mol. Biol. 1996; 29, 423–428.
3. Griffithsa D. W., Deightona N., Bircha A. N. E., Patrianb B., Baurb R., Städler E. Identification of glucosinolates on theleafsurface of plants from the Cruciferae and other closely related species. Phytochemistry 2001; 57, 693–700.
4. Jugea N., Mithena R. F., Trakaa M. Molecular basis for chemoprevention by sulforaphane: a comprehensive review. Cell. Mol. Life Sci. 2007; 64, 1105–1127.
5. Glawischnig E. Camalexin. Phytochemistry 2007; 68, 401–406.
6. Onyilagha J., Bala A., Hallett R., Gruber M., Soroka J., Westcott N. Leaf flavonoids of the cruciferous species, Camelina sativa, Crambespp., Thlaspiarvense and several other genera of the family Brassicaceae. Biochem. Syst. Ecol. 2003; 31, 1309–1322.
7. Blois M. S. Antioxidant determinativ by the use of a stable free radical. Nature 1958; 181, 1199–1200.
8. Ritov B. R., Goldma R., Stoyanovsky A. D., Menshikova E. V., Kagan E. V. Antioxidant paradoxes of phenolic compounds: peroxyl radiál scavenger nad lipid antioxidant, etoposide (VP-16), inhibits sarcoplasmatic reticulum Ca2+ -ATPase via thiol oxidation by its phenoxyl radical. Arch. Biochem. Biophys. 1995; 321, 140–152.
9. Parejo I., Petrakis C. H., Kefalas P. J. A transition metal enhanced luminal chemiluminescence in the presence of a chelator. Pharmacol. Toxicol. Method 2000; 43, 183–190.
10. Guo S., Deng Q., Xiao J., Xie B., Sun Z. Evaluation of antioxidant aktivity and preventing DNA damage effect of pomegranate extracts by chemiluminiscence method. J. Agric. Food. Chem. 2007; 55, 3134–3140.
11. Cao G., Sofic E., Prior R. L. Antioxidant and prooxi dant behavior of flavonoids: structure-activity relationships. Free Radic. Biol. Med. 1997; 22, 749–760.
Štítky
Farmacie Farmakologie
Článek Nové knihy
Článek vyšel v časopiseČeská a slovenská farmacie
Nejčtenější tento týden
2013 Číslo 4- Psilocybin je v Česku od 1. ledna 2026 schválený. Co to znamená v praxi?
- Ukažte mi, jak kašlete, a já vám řeknu, co vám je
- Přerušovaný půst může mít významná zdravotní rizika
-
Všechny články tohoto čísla
- Vzácná onemocnění v Itálii: analýza nákladů a farmakoterapie
- Vývoj spoluúčasti pacienta na nákladech na farmakoterapii v letech 2008–2012
- Vplyv abiotickej elicitácie na produkciu sanguinarínu a aktivitu polyfenoloxidázy v suspenznej kultúre Eschscholtzia californica CHAM.
- Antioxidační aktivita extraktů a HPLC analýza flavonoidů Capsella bursa-pastoris (L.) Medik
- Obsahová stejnoměrnost směsí a tablet obsahujících warfarin
- Léky z barokní klášterní lékárny
-
XXXV. pracovní dny Radiofarmaceutické sekce
České společnosti nukleární medicíny ČLS JEP - Prof. RNDr. Ľudovít Krasnec – 100. výročie narodenia
- Prof. Ing. Jozef Lehotay, DrSc. – sedemdesiatnik
- Nové knihy
- Česká a slovenská farmacie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Léky z barokní klášterní lékárny
- Obsahová stejnoměrnost směsí a tablet obsahujících warfarin
- Antioxidační aktivita extraktů a HPLC analýza flavonoidů Capsella bursa-pastoris (L.) Medik
- Vplyv abiotickej elicitácie na produkciu sanguinarínu a aktivitu polyfenoloxidázy v suspenznej kultúre Eschscholtzia californica CHAM.
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



