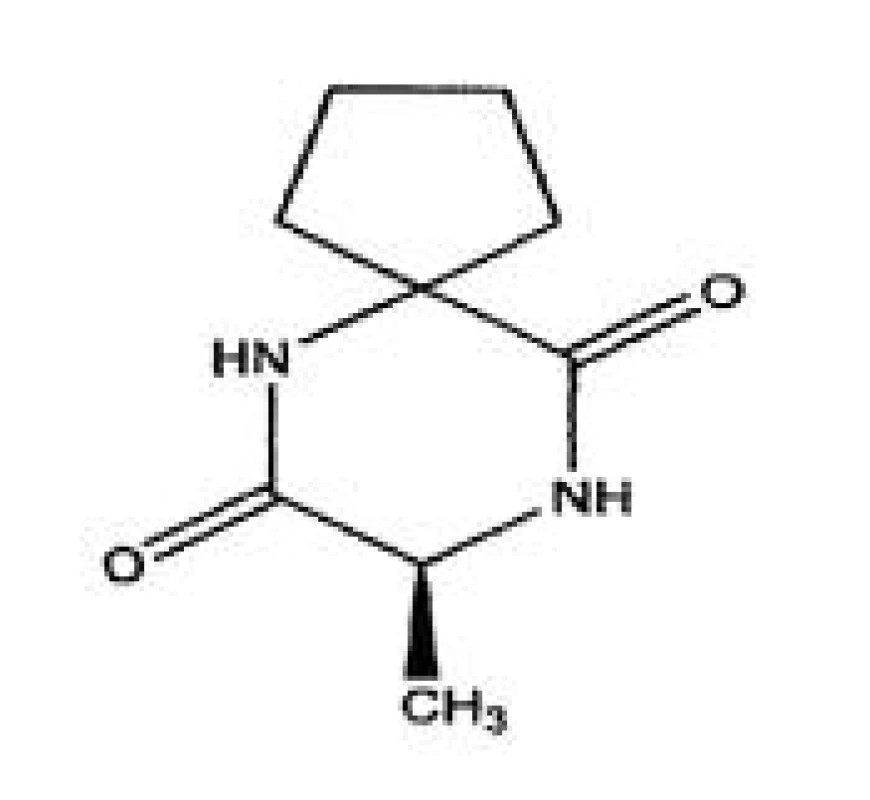
Vplyv membrán na permeáciu alaptidu z hydrogélov
Influence of membranes on alaptide permeation from hydrogels
The paper evaluates the liberation of alaptide from gels through various types of permeable membranes. The gels were prepared on the basis of three different polymers (3% chitosan; 2.5% hydroxypropyl cellulose; 3% hydroxyethyl cellulose) in different concentrations with additions of humectants (5 %; 15% propylene glycol and 10% glycerol) and the preserving agent, 0.3% Sepicide HBR with 1% alaptide, and finally without the drug. The permeation of the drug from gels into the acceptor solution was evaluated with the use of the following membranes: the hydrophilic membrane from Chemosvit, the chicken skin, the stripped snakeskin, and the wall of the small intestine. The measurements showed that the highest percentage of the drug penetrated through the small intestine, a smaller percentage through the chicken skin, and the smallest amount through the snakeskin. Rheological properties of the prepared hydrogels were evaluated as well. The pseudo-plastic flow was only confirmed for the hydrogel prepared on the basis of hydroxypropyl cellulose. An utterly opposite situation was with the hydrogels prepared on the basis of chitosan and hydroxyethyl cellulose. They showed a significant thixotropic character and the degree of thixotropy increased with time. Based on the results of the pH measurement, the samples prepared on the basis of chitosan and hydroxypropyl cellulose have been shown to be inconvenient because they reached a lower pH and had a potential of causing skin irritation. The hydroxyethyl cellulose hydrogel matched the physiological values of skin pH even after 14 days since its preparation.
Key words:
alaptide – hydrogel – permeable membrane – rheological properties
Autoři:
Zuzana Vitková; Veronika Šmunková; Petra Herdová; Marián Žabka
Působiště autorů:
Univerzita Komenského Bratislava, Farmaceutická fakulta, Katedra galenickej farmácie
Vyšlo v časopise:
Čes. slov. Farm., 2011; 60, 132-136
Kategorie:
Původní práce
Souhrn
Predmetom príspevku je hodnotenie liberácie liečiva alaptid z gélov a jeho permeácia cez rôzne typy permeačných membrán. Pripravili sa gély na báze troch rôznych polymérov (3 % chitosan; 2,5 % hydroxypropylcelulóza; 3 % hydroxyetylcelulóza) v rôznej koncentrácii s prísadou humaktantov (5 %; 15 % propylénglykol a 0 % glycerol) a konzervantu 0,3 % Sepicide HBR a liečiva 1 % alaptid a gély bez liečiva. Prestup liečiva z gélov do akceptorového roztoku sa hodnotil cez nasledovné membrány: celofán, kuracia koža, zvlečená hadia koža a stena tenkého čreva. Z výsledkov merania bolo zistené najväčšie percento uvoľneného alaptidu cez stenu tenkého čreva, menej cez kuraciu kožu a najmenej sa uvoľnilo cez hadiu kožu. V práci sa hodnotili aj reologické vlastnosti pripravených hydrogélov. Pseudoplastický tok bol zistený iba v prípade hydrogélu na báze hydroxypropylcelulózy. Naopak to bolo pri hydrogéloch na báze chitosanu a hydroxyetylcelulózy, ktoré vykazovali výrazný tixotropný charakter a miera tixotropie sa s časom zväčšovala. Na základe výsledkov merania pH boli vzorky na báze chitosanu a hydroxypropylcelulózy vyhodnotené ako nevyhovujúce, nakoľko dosahovali nižšie hodnoty pH a mohli by spôsobiť podráždenie pokožky. Fyziologickým hodnotám pH kože zodpovedal hydrogél na báze hydroxyetylcelulózy a to i po 14. dňoch po príprave.
Kľúčové slová:
alaptid – hydrogél – permeačná membrána – reologické vlastnosti
Úvod
Podanie liečiv cez kožu má niekoľko výhod. Sú to napríklad:
- liečivá, ktoré sa bežne podávajú p.o. cestou, pri transdermálnom prechode obchádzajú gastrointestinálny trakt, nepodliehajú zmenám pH a nie sú ovplyvnené prípadným príjmom potravy a nespomaľuje sa ich prechod cez črevo;
- liečivá sa prvotne vyhnú portálnemu obehu;
- konštantný a kontinuálny prívod liečiv;
- kontrolované množstvo prívodu liečiv môže znížiť nárazový výskyt nežiaducich účinkov liečiv;
- okamžité prerušenie prívodu liečiva v čase potreby (napr. pri transdermálnych náplastiach) 1).
Medzi fyzikálno-chemické faktory, ktoré ovplyvňujú vstrebávanie liečiv patrí hydratácia stratum corneum, teplota 2), pH 3), koncentrácia liečiva 1) a základ dermálného polotuhého lieku. Zloženie základu, v ktorom je liečivo aplikované na kožu, ovplyvňuje rýchlosť a rozsah absorpcie, ale zloženie lieku sa po aplikácii na kožu môže rýchlo meniť – vplyvom absorpcie niektorých pomocných látok a odparovaním vody 1, 4). Pri géloch dochádza vplyvom zvyšovania viskozity a zahusťovania základu k znižovaniu absorpcie liečiva kožou 5). Pri topickej aplikácii má pravdepodobne vplyv základu na dostupnosť liečiva väčší význam, ako pri iných cestách podania liekov. Základ, do ktorého je liečivo zapracované, by mal spĺňať niekoľko podmienok, konkrétne musí byť biokompatibilné, chemicky, mikrobiologicky a fyzikálne stabilné, musí mať schopnosť pohotovo uvoľniť liečivo do stratum corneum a byť kozmeticky prijateľné 4).
Peptidové liečivá sa stali v posledných rokoch neoddeliteľnou súčasťou modernej terapie. Ich široké využitie spočíva nielen samostatne (ako liečiva), ale aj v možnosti využitia ako nosičov iných liečiv nepeptidovej povahy. Výroba niektorých proteínových polymérov využíva DNA-rekombinantné technológie, pričom takto vyrobené proteíny majú dokonca lepšie vlastnosti, ako prírodné, ktoré sa stali ich základom. Majú termosenzitívne vlastnosti, reagujú na zmeny pH prostredia, sú biokompatibilné, majú dobré mechanické vlastnosti a využívajú sa v tkanivovom inžinierstve, alebo ako membrány. Snaha napodobniť vlastnosti prirodzených makromolekúl viedla k vývoju proteínových polymérov, ktoré aj napriek tomu, že sú peptidovej, resp. proteínovej povahy, sú biokompatibilné a imunitný systém ich nedeteguje 6).
Modelové liečivo alaptid, použité v tejto práci, má regeneračné a epitelizačné účinky, ktoré boli zatiaľ využité vo veterinárnej medicíne a v súčasnosti sa využívajú aj vo veterinárnej praxi (alaptid vo forme dermálneho polotuhého lieku) – krému. Po chemickej stránke je to synteticky pripravený, spirocyklický dipeptid. Je to chemický derivát prolyl-leucyl-glycín amidu 7), analóg melanostatínu (inhibítor melanokortín-stimulujúceho hormónu, ktorý je súčasťou fyziologického melanokortinového systému, ktorý sa podieľa na regulácii pigmentácie, zápalových procesov, energetickej homeostázy, analgézie, imunomodulácie, kardiovaskulárnej regulácie, neuromuskulárnej regenerácie a ovplyvnení sexuálnych funkcií)8).
V súčasnej terapeutickej praxi sa používa lokálne vo forme 2% masti, stimuluje rast granulačného tkaniva, urýchľuje epitelizačný proces a priebeh hojenia rán. Je indikovaný na lokálne ošetrenie kožných a slizničných lézií - popálenín, odrenín, omrzlín, dekubitov, vredov, pooperačných rán, postkastračných sutur a chronických recidivujúcich poranení a poleptaní od solí 10).
Rovnako ako aj v humánnej medicíne, aj vo veterinárnej sa čoraz viac začína uplatňovať biopolymér chitosan ako nosič rôznych druhov liečiv (napr. antibiotika, antiparazitika, anestetika, analgetika) 11). Okrem toho bolo experimentmi na zvieratách dokázané, že chitosanové gély vyvolávajú migráciu zápalových buniek a podporujú tvorbu nového tkaniva, čím sa urýchľuje proces hojenia a regenerácie 12).
POKUSNÁ ČASŤ
Použité chemikálie
Alaptid (ALA) – v mikronizovanej forme (Výzkumný ústav pro farmacii a biochemii (VÚFB), ČR); čistená voda (Aqua purificata SL 1- FaF UK, SR); chlorid sodný (Centrachem, Švajčiarsko); chitosan – stredná molekulová hmotnosť (CHIT) – (Sigma-Aldrich GmbH, Steinheim, Nemecko); glycerol 85% (GL) – (Galvex spol. s.r.o., Banská Bystrica, SR); Propylénglykol (PG) – (Merck, Darmstadt, Nemecko); hydroxyetylcelulóza – Natrosol 250 HR (HEC) – (Aqualon, USA); hydroxypropylcelulóza – Klucel MCS (HPC) – (Aqualon, USA); kyselina mliečna (Lachema, o. p., ČR); konzervant – Sepicide HBR (Sep. HBR) – (SEPPIC, Paríž, Francúzsko; zloženie: butylparabén, etylhydroxybenzoát, nátriummetylparabenát a propylparabén vo fenoxyetanole).
Použité prístroje
Analytické váhy – Kern & Sohn GmbH (Nemecko); elektrická miešačka – VEB ML W Prűfgeräte – Werk (Nemecko); Viskotester VT 500 – Haake Mess-Technik GmbH (Nemecko); pH meter – WTW Weilheim (Švajčiarsko); spektrofotometer – Philips Pye Unicam (Veľka Britania); permeačná aparatúra – vyrobená na Katedre galenickej farmácie FaF UK, Bratislava (SR);
permeačné membrány:
kuracia koža -– dodala predajňa Achberger mäso-údeniny, Bratislava, (SR),
polyetylénový celofán – Chemosvit, a.s., Svit, (SR),
sliznica bravčového tenkého čreva – Maspoma spol. s.r.o., Zvolen, (SR),
zvlečená hadia koža – dodal súkromný chovateľ hada užovky červenej (Elaphe guttata).
Zloženie hydrogélov
Pripravili sa gély tohto zloženia:
blank č. 1: 3% CHIT s prísadou: 15% PG + 0,3% Sep. HBR
blank č. 2: 2,5% HPC s prísadou: 5% PG + 0,3% Sep. HBR
blank č. 3: 3% HEC s prísadou: 10% GL + 0,3% Sep. HBR
vzorka č. 1: 3% CHIT s prísadou: 15% PG + 0,3% Sep. HBR + 1% ALA
vzorka č. 2: 2,5% HPC s prísadou: 5% PG + 0,3% Sep. HBR+ 1% ALA
vzorka č. 3: 3% HEC s prísadou: 10% GL + 0,3% Sep. HBR + 1% ALA
Liberácia liečiva alaptidu z hydrogélov
Liberácia liečiva z hydrogélu sa sledovala a hodnotila podľa postupu uvedeného v práci 13) po 15, 30, 45, 60, 90, 120 a 180 min. Obsah liečiva – alaptidu sa stanovil spektrofotometricky pri λ = 220 nm.
Stanovenie tokových vlastností
Reologické vlastnosti hydrogélov sa stanovili po 2, 7, 14 dňoch po príprave hydrogélov podľa práce 13).
Stanovenie pH gélov
pH sa meralo po 2, 7, 14 dňoch po príprave hydrogélov na pH-metri, ktorý bol kalibrovaný dvoma referenčnými tlmivými roztokmi- ftalanovým o pH 4 ± 0,02 a boritanovým o pH 9 ± 0,02 pri 20 ± 0,2 °C.
VýSLEDKY
Z literatúry je známe, že k ľudskej koži najbližšie stojí prasacia, pokiaľ ide o jej zloženie 14). V našich experimentoch sme mali k dispozícii hydrofilnú membránu a zo zvieracích membrán: prasacie tenké črevo, kuraciu a hadiu kožu. Našim cieľom bolo zistiť, ako ovplyvnia uvoľňovanie alaptidu z gélu a jeho permeáciu cez membrány.
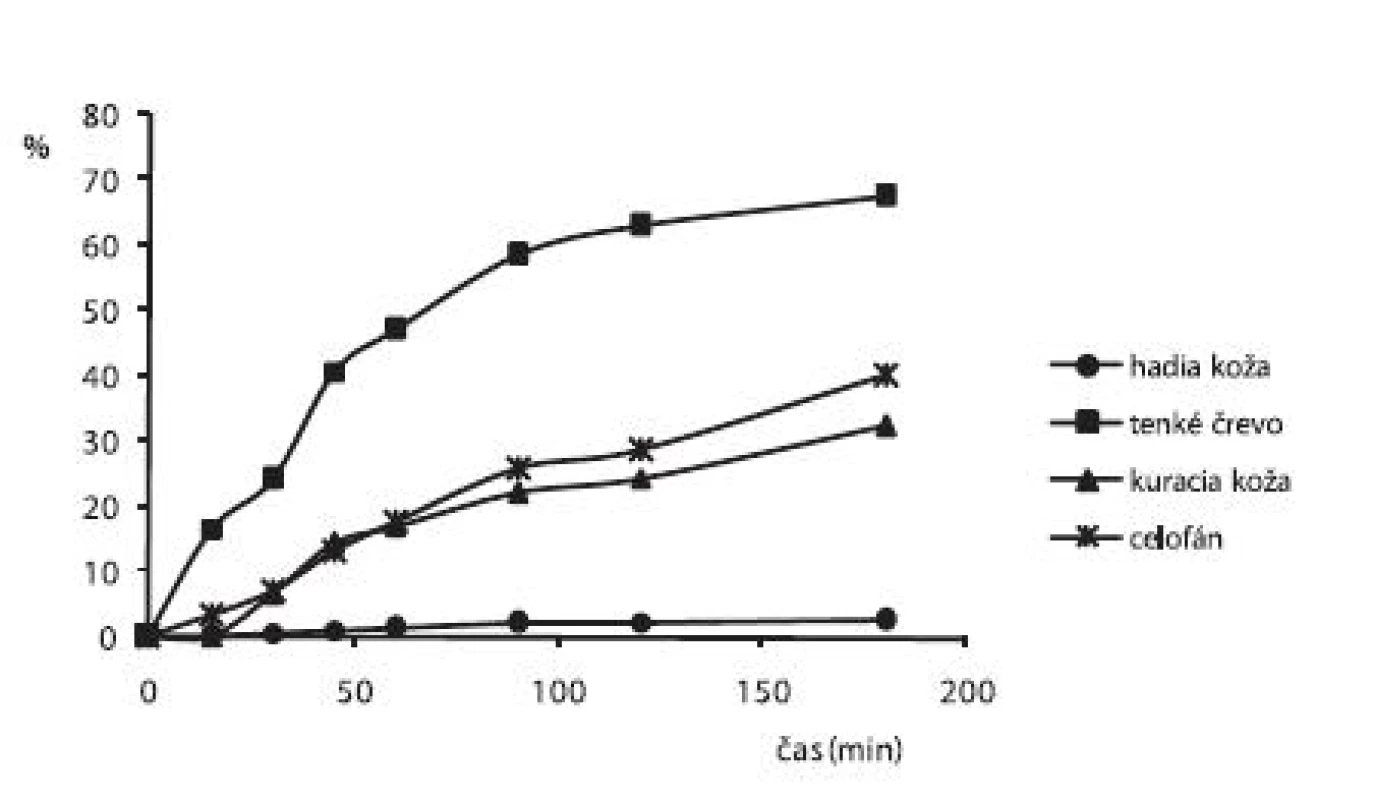
Liberácia alaptidu z 3% CHIT hydrogélov s obsahom 15% PG sa merala po 2. dňoch cez hadiu kožu, tenké črevo, kuraciu kožu a celofán. Z obrázku 2, ktorý zobrazuje priebeh liberácie ALA z týchto hydrogélov cez spomínané membrány vidieť, že najväčšie množstvo ALA (67,43 %) sa uvoľnilo cez tenké črevo. Najmenšie množstvo ALA (2,69 %) sa uvoľnilo cez hadiu kožu. Keďže zvlečená hadia koža je vrstva odumretých keratinocytov, ktoré majú podobne ako v ľudskej koži len malú permeabilitu pre liečivá, vysvetľuje sa tým aj najmenšie uvoľnené množstvo ALA v porovnaní s ostatnými použitými biologickými membránami.
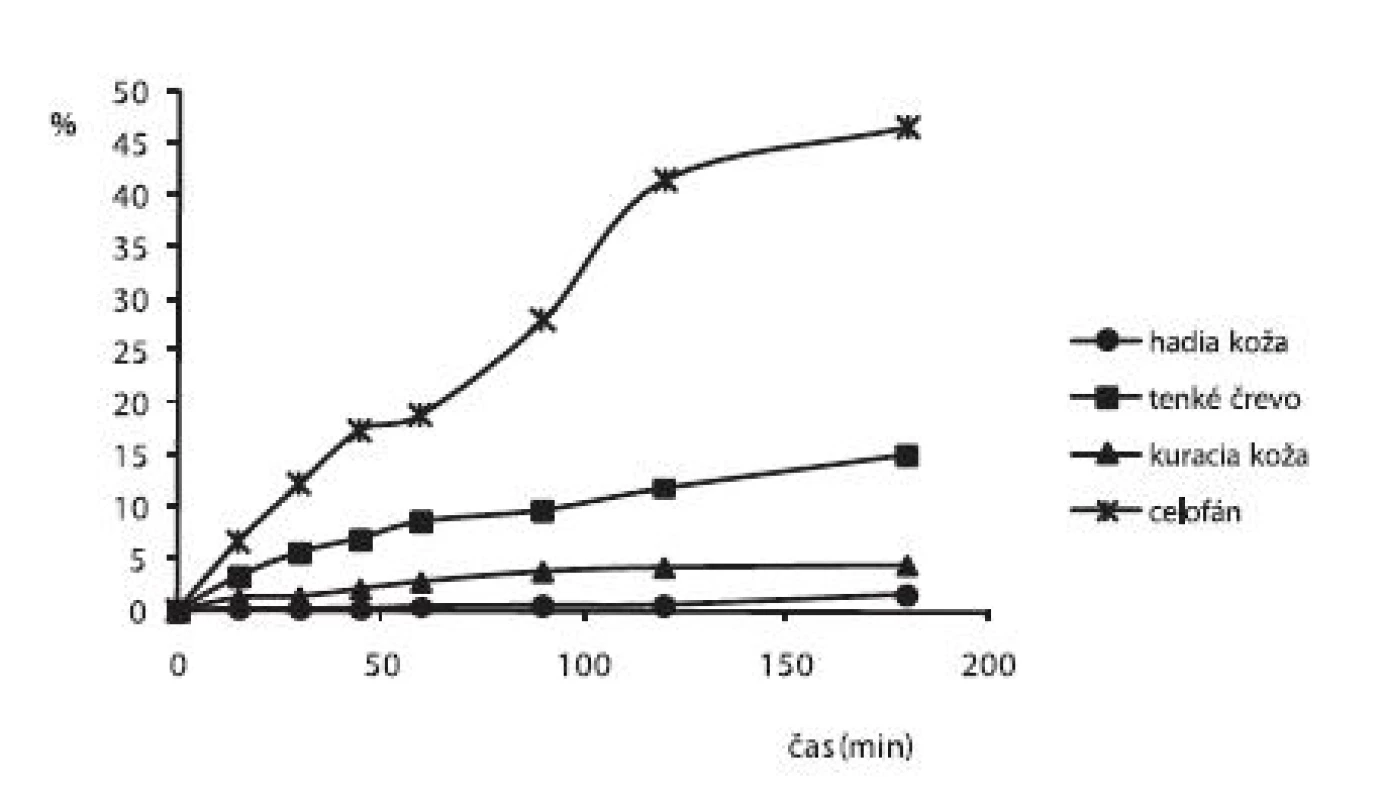
Na obrázku 3 je liberačný profil alaptidu z 3% HPC hydrogélov s obsahom 5% PG, meralo sa po 2. dňoch cez rovnaké druhy permeačných membrán ako pri predchádzajúcom hydrogéle. Z obrázku 3 vidieť, že najväčšie množstvo ALA (46,61 %) sa opäť uvoľnilo cez celofán, z biologických membrán najviac ALA do akceptorového roztoku prepustilo tenké črevo (15,10 %) a najmenej hadia koža (1,67 %).
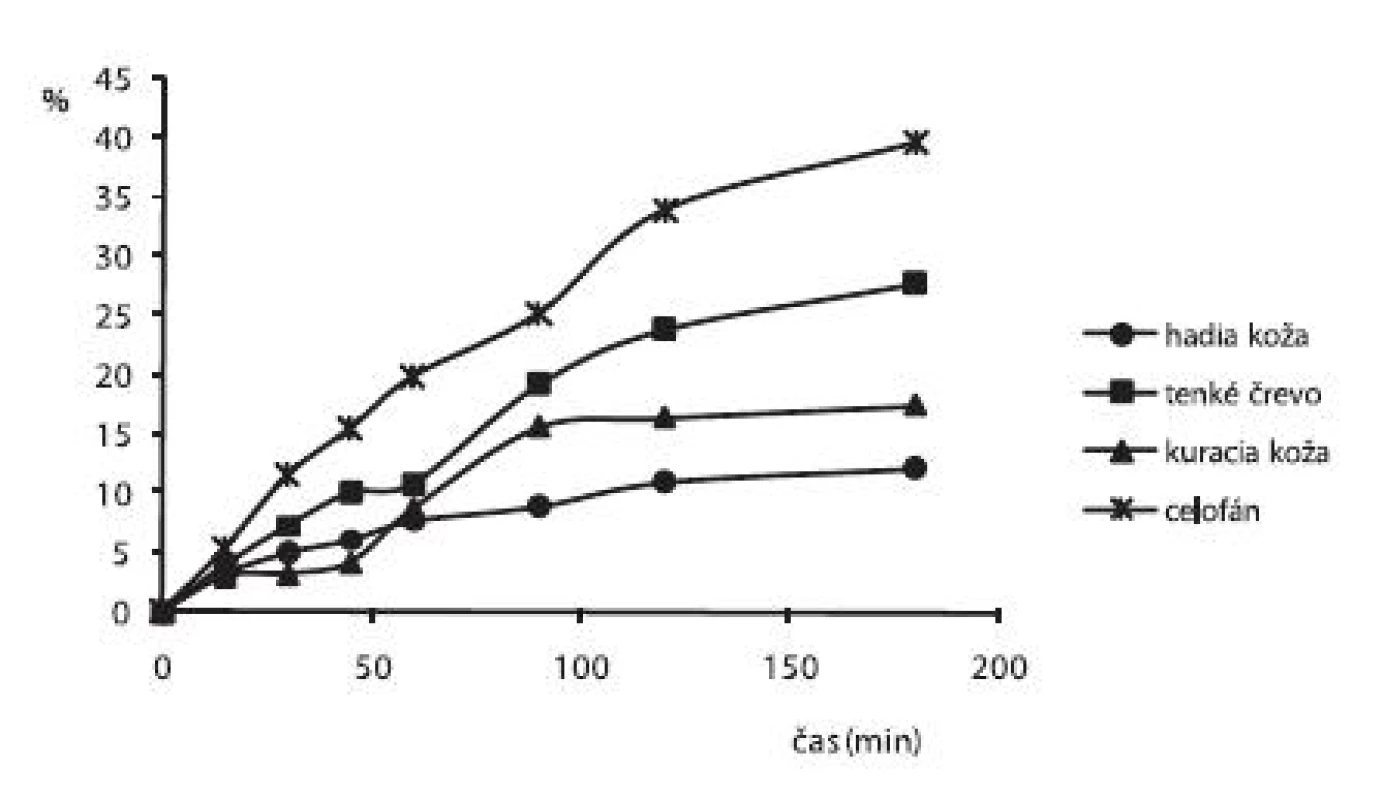
Obrázok 4 zobrazuje uvoľnené množstvá alaptidu z 3% HEC hydrogélov s obsahom 10% GL namerané po 2. dňoch cez rôzne druhy permeačných membrán. Najmenej priepustná pre ALA bola hadia koža (uvoľnilo sa len 12,12 % ALA), najlepšiu priepustnosť z biologických membrán malo tenké črevo, cez ktoré sa uvoľnilo 27,72 % ALA.
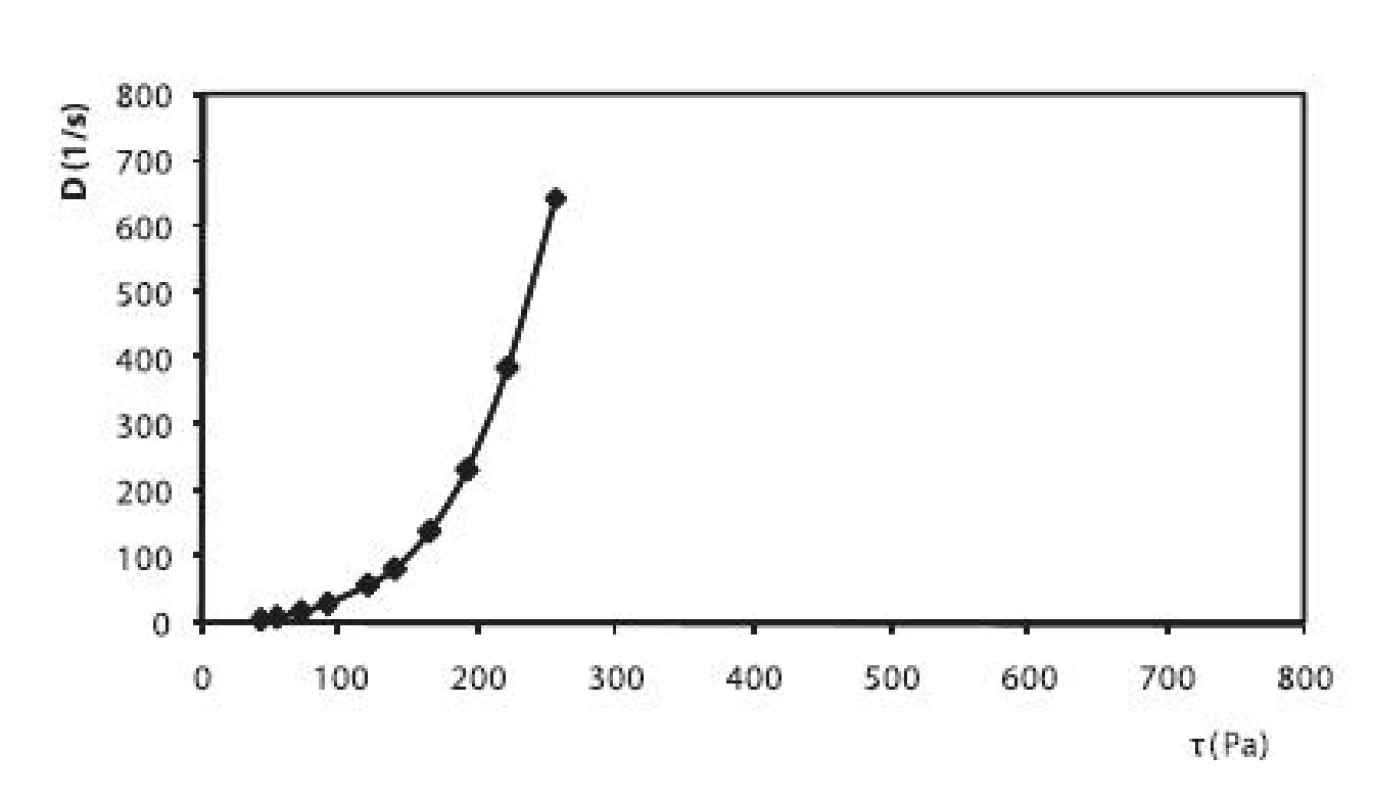
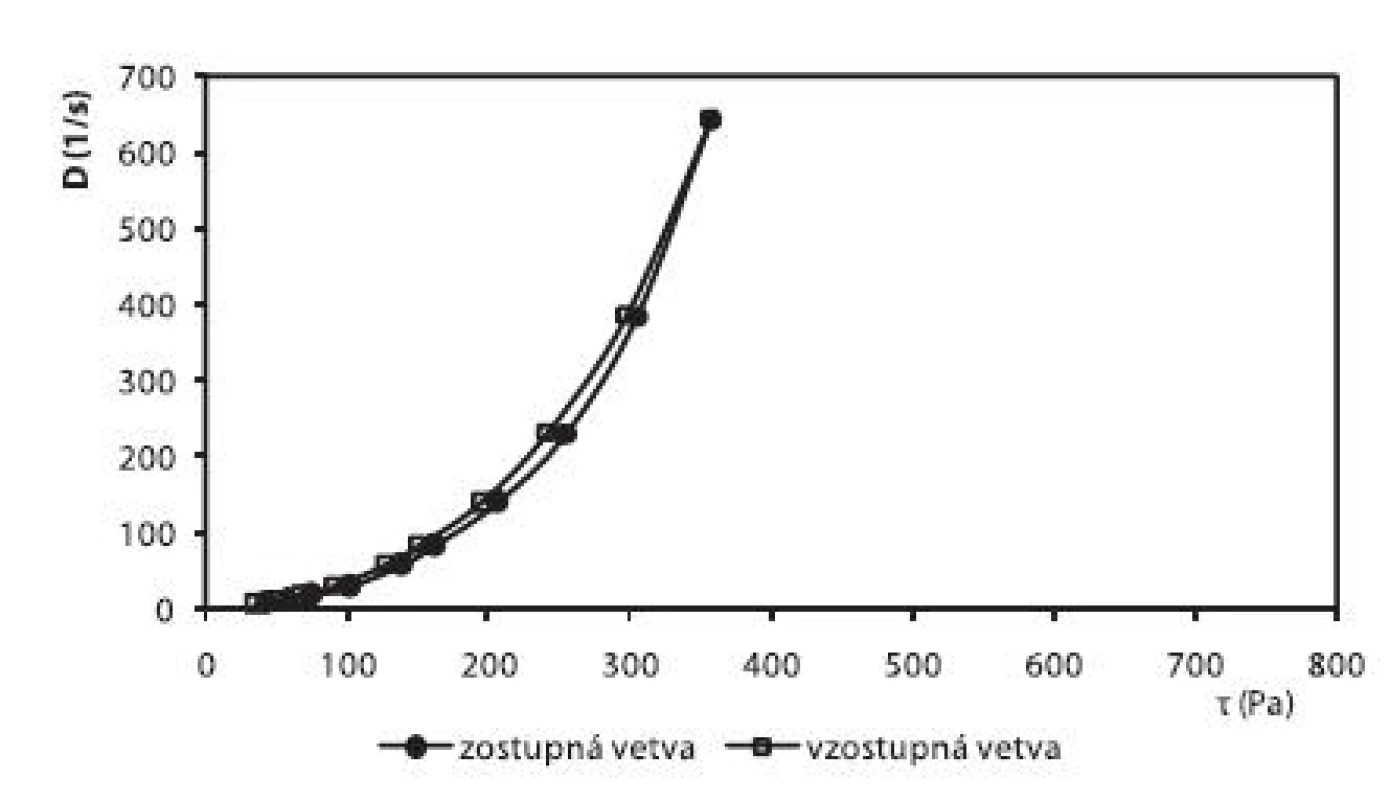
Okrem liberácie liečiva sa v práci hodnotili reologické vlastnosti pripravených hydrogélov. V prípade hydrogélu na báze HPC bol zistený pseudoplastický charakter sústavy (obr. 6). Hydrogély na báze CHIT (obr. 5) a HEC (obr. 7), ktoré obsahovali ALA, vykazovali výraznejší tixotropný charakter sústav v porovnaní s ich príslušnými blankami. Na základe tohto faktu sa dá predpokladať, že alaptid zvyšuje mieru tixotropie v hydrogéloch. Ďalšími meraniami sa zistilo, že miera tixotropie sa časom zväčšovala.
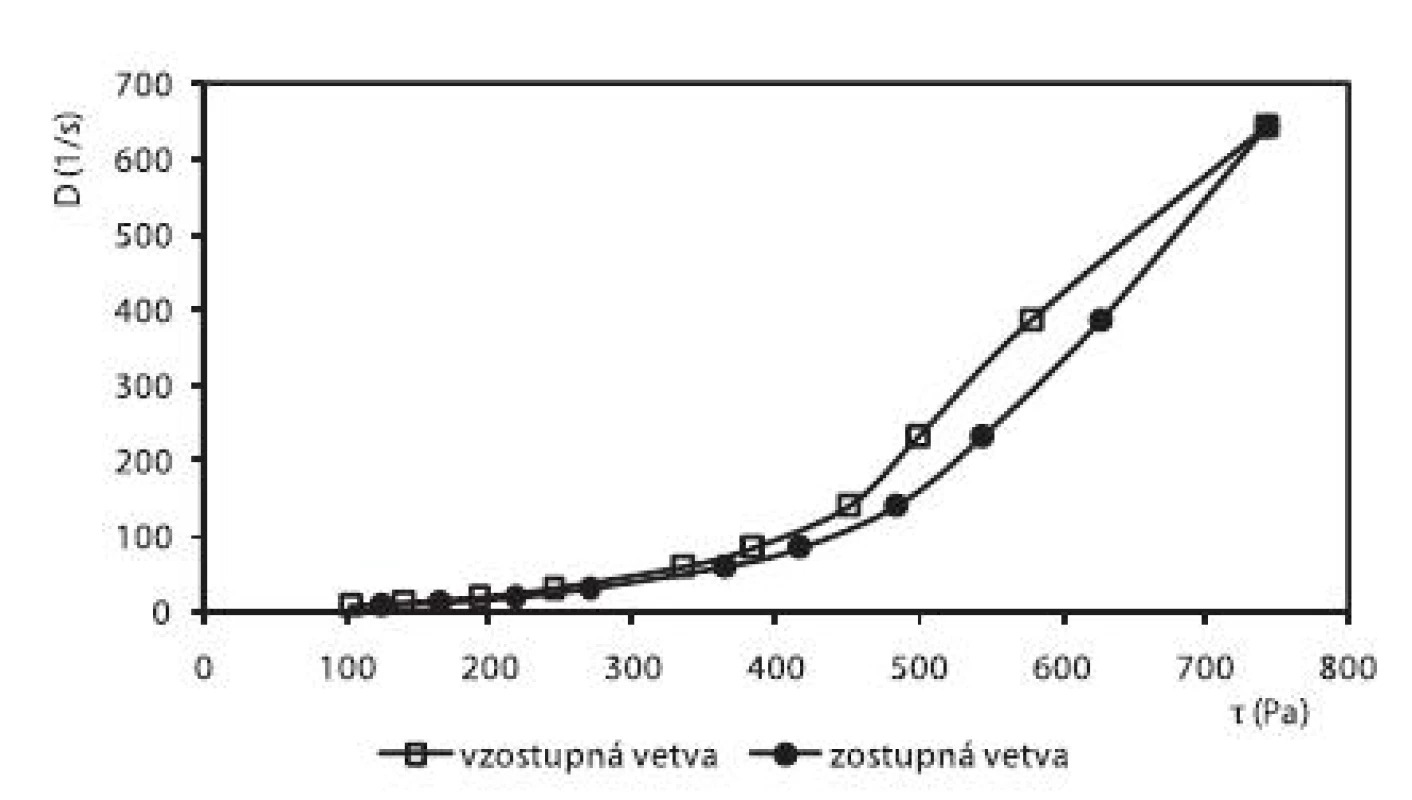
Z hľadiska problematiky pH – vzorka (č. 3) hydrogélu zloženia: 3% HEC s prísadou: 10% GL + 0,3% Sep. HBR + 1% ALA dosahovala hodnoty (5,8) zodpovedajúce fyziologickým hodnotám pH kože a to aj po 14. dňoch po príprave. V prípade hydrogélu (vzorka č. 2) 2,5% HPC s prísadou: 5% PG + 0,3% Sep. HBR + 1% ALA sa hodnoty pH pohybovali v rozmedzí 4,3–4,4. Podobné hodnoty pH dosahoval i hydrogél (vzorka č. 1) zloženia 3% CHIT s prísadou: 15% PG + 0,3 % Sep. HBR + 1% ALA (tab. 1). Nakoľko nízke hodnoty pH by mohli spôsobovať podráždenie postihnutého miesta, preto ich prípadné využitie v praxi nie je vhodné, aj keď množstvo uvoľneného alaptidu bolo porovnateľné s ostatnými hydrogélmi.

Počas skladovania u vzoriek s alaptidom, ani u blankov nedochádzalo k významnému poklesu alebo zvýšeniu viskozity. Z toho vyplýva, že použitý konzervant Sepicide HBR bol účinný a počas doby trvania experimentov zabránil mikrobiálnej kontaminácii, vplyvom ktorej by sa mohla radikálne zmeniť viskozita.
Na základe výsledkov merania bol celkovo vyhodnotený hydrogél (vzorka č. 3) zloženia: 3% HEC s prísadou: 10% GL + 0,3% Sep. HBR + 1% ALA ako najvhodnejší pre formuláciu liečiva. Hodnoty pH zodpovedali fyziologickým hodnotám kože a to i po 14 dňoch po príprave. Z hľadiska liberácie sa uvoľnilo z tohto gélu najvyššie percento alaptidu. Pri porovnaní reologických vlastností gélov, dosahoval gél tohto zloženia žiaduci tixotropný charakter, ktorý s časom narástol.
Zo získaných výsledkov možno konštatovať, že z hľadiska uvoľňovania a permeácie alaptidu cez membránu je najvýhodnejšia membrána – tenké črevo. V prípade ďalších membrán boli rozdiely výsledkov vysoko štatisticky významné (nízka permeácia alaptidu).
Výskum bol podporený grantom VEGA č. 1/0024/11 a FaF UK č. 2/2011
Adresa pre korešpondenciu:
PharmDr.
Petra Herdová
Katedra
galenickej farmácie, Farmaceutická fakulta UK
Odbojárov
10, 832 32 Bratislava, Slovenská republika
e-mail:
herdova@fpharm.uniba.sk
Zdroje
1. Attwood, D., Florence, A. T.: Physical Pharmacy. London: Pharmaceutical Press 2008; 86, 88, 98, 99, 109-110, 111-112, 115, 137, 146.
2. Park, J. H., Lee, J. W., Kim, Y. C., Prausnitz, M. R.: The effect of heat on skin permeability. Int. J. Pharm. 2008; 359 (1–2), 94–103.
3. Owen, D. H., Peters, J. J., Lavine, M. L., Katz, D. F.: Effect of temperature and pH on contraceptive gel viscosity. Contraception 2003; 67 (1), 57–64.
4. Bronaugh, R. L., Maibach, H. I.: Topical absorption of dermatological products. New York: Marcel Dekker, Inc Portions. 2001; 291, 317–318, 459, 516.
5. Gallagher, S. J., Trottet, L., Heard, C. M.: Ketoprofen: release from, permeation across and rheology of simple gel formulations that simulate increasing dryness. Int. J. Pharm. 2003; 268 (1–2), 37–45.
6. Galaev, I., Mattiasson, B.: Smart polymers, Applications in Biotechnology and Biomedicine. 2. vyd. Boca Raton: CRC Press, Taylor & Francis Group. 2008; 99, 101, 177–178, 204–205, 301, 367–370, 408, 428.
7. Nedvídková, J., Kasafírek, E., Nedvídek, J., Pacák, K., Schreiber, V.: An analog of MIF, alaptide: effect on serum prolactin, dopamine receptors and growth of rat adenohypophysis. Endocrine Res. 1994; 20(1), 39–46.
8. Jakubke, H. D., Sewald, N.: Peptides from A to Z Conscise Encyclopedia. Weinheim: WILEY-VCH Verlag GmbH & Co. KGaA. 2008; s. 217, 315.
9. Metodika řešení struktur organických látek z práškových dat. www.vscht.cz/.../Metodika_reseni_ struktrur_organickych_latek_uloha33a.doc [cit. 24-02-2011].
10. http://www.bioveta.sk/sortiment_dermatologika_alaptid. html [cit. 24-02-2011].
11. Senel, S., Mcclure, S. J.: Potential applications of chitosan in veterinary medicine. Advanc. drug deliv. Rev. 2004; 56(10), 1467–1480.
12. Boucard, N. a kol.: The use of physical hydrogels of chitosan for skin regeneration following third-degree burns. Biomaterials 2007; 28(24), 3478–3488.
13. Vitková, Z., Herdová, P., Šubová, M., Šimunková, V.: Formulácia chlórhexidínu do hydrogélov. Čes. slov. Farm. 2009; 58(3), 116–118.
14. Kurihara-Bergstrom, T., Woodworth, M., Feisullin, S., Beall, P.: Characterization of the Yucatan miniature pig and small intestine for pharmaceutical applications. http://www.ncbi.nlm.nih.gov/pubmed/3773450 [cit. 24-02-2011].
Štítky
Farmacie FarmakologieČlánek vyšel v časopise
Česká a slovenská farmacie

2011 Číslo 3
- Přerušovaný půst může mít významná zdravotní rizika
- Top zaměstnavatelé ve zdravotnictví si hýčkají už studenty
- Mikroplasty a jejich riziko pro zdraví: Co všechno víme?
Nejčtenější v tomto čísle
- Význam genetického polymorfizmu enzýmov cytochrómu P450 – časť I.Enzýmový systém cytochrómu P450 a cytochróm P450 1A2
- doc. RNDr. Eva Račanská, CSc. – laureátka Weberovej ceny SFS
- Vplyv membrán na permeáciu alaptidu z hydrogélov
- Farmaceutické aspekty živočíšnej lipoxygenázy
