-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Analytické metody pro stanovení vybraných psychofarmak
Analytical methods for the determination of selected psychopharmaceuticals
At present at our disposal there are more than one hundred psychopharmaceuticals with more or less specific effects on the symptoms of individual mental disorders. Despite new therapeutic and diagnostic possibilities there are still many patients whose response to treatment with psychopharmaceuticals is not satisfactory. Introduction of a routine therapeutic monitoring of some psychopharmaceuticals could help to individualize and optimize the treatment according to the needs of a individual patient. This paper describes the analytical methods which enable their determination with regard to antidepressants and antipsychotics. At present the principal techniques for the determination of the levels of psychopharmaceuticals are gas and liquid chromatography. The principal biological material for the determination is serum or plasma. Samples for analysis are prepared most frequently by means of extraction from a liquid to a liquid or extraction on a solid phase. The published literature presents the methods making it possible to determine one or several psychopharmaceuticals simultaneously, including their possible active metabolites.
Key words:
psychopharmaceuticals – therapeutic drug monitoring – high-performance liquid chromatography – mass spectrometry
Autoři: R. Uřinovská 1; M. Turjap 2; H. Brozmanová 1; M. Grundmann 1,3
Působiště autorů: Fakultní nemocnice Ostrava, Ústav klinické farmakologie 1; Ostravská univerzita Ostrava, FZS, Ústav klinické farmakologie 2; Fakultní nemocnice Ostrava, Lékárna 2
Vyšlo v časopise: Čes. slov. Farm., 2010; 59, 103-111
Kategorie: Přehledy a odborná sdělení
Souhrn
V současnosti máme k dispozici již více než sto psychofarmak s více či méně specifickými účinky na symptomy jednotlivých duševních poruch. Navzdory novým léčebným a diagnostickým možnostem je stále mnoho pacientů, jejichž odpověď na léčbu psychofarmaky není uspokojivá. Zavedení rutinního terapeutického monitorování některých psychofarmak by mohlo pomoci individualizovat a optimalizovat léčbu dle potřeb konkrétního pacienta. Tento článek popisuje analytické metody, které umožňují jejich stanovení se zaměřením na antidepresiva a antipsychotika. V současnosti jsou základními technikami pro stanovení hladin psychofarmak plynová a kapalinová chromatografie. Hlavním biologickým materiálem pro stanovení je sérum nebo plazma. Vzorky k analýze jsou připravovány nejčastěji pomocí extrakce z kapaliny do kapaliny nebo extrakcí na tuhé fázi. V literatuře byly publikovány metody umožňující stanovení jednoho nebo několika psychofarmak současně, včetně jejich případných aktivních metabolitů.
Klíčová slova:
psychofarmaka – terapeutické monitorování léčiv – vysokoúčinná kapalinová chromatografie – hmotnostní spektrometrieDeprese a antidepresiva
Afektivní poruchy, především deprese, představují zřejmě největší zdravotní zátěž společností moderního světa měřeno roky ztracenými předčasným úmrtím nebo strávenými pod negativním vlivem závažné nemoci. Poruchy nálady začínají v časné dospělosti (25–32 let) a postihují z celoživotního pohledu více než jednu pětinu obyvatelstva. Ani v nejvyspělejších státech světa však nejsou správně diagnostikovány a včas léčeny. V České republice bylo dle dat z roku 2000 adekvátně léčeno pouze 13,4 % pacientů trpících depresivními syndromy, přičemž depresivní porucha je ve většině případů chronickým onemocněním. Pacienti trpící depresí častěji čerpají zdravotní služby, častěji jsou v pracovní neschopnosti a 7–15 % z nich ukončí život sebevraždou 1).
Antidepresiva I. generace se používají již více než 40 let. Jedná se o látky, které zvyšují koncentraci biogenních aminů (serotoninu, noradrenalinu a dopaminu) v limbické oblasti CNS a dále ovlivňují celou řadu neurotransmiterových receptorů včetně histaminových, muskarinových a α1-adrenergních, z čehož vyplývá, že mohou vyvolat celou řadu nežádoucích účinků. Některé z těchto účinků jsou pro pacienty obtěžující (například tachykardie, zácpa, útlum, porucha akomodace, vzestup tělesné hmotnosti a sucho v ústech) a často mohou být důvodem špatné adherence k léčbě. Mezi závažné komplikace patří zmatenost, srdeční arytmie, posturální hypotenze a u mužů s hypertrofií prostaty močová retence. Doba nástupu antidepresivního účinku je zhruba 10–20 dnů od začátku terapie. Nevýhodou je zejména nutnost titrace dávky, nežádoucí účinky, vysoký interakční potenciál a úzké terapeutické rozmezí. Patří sem např. amitriptylin, nortriptylin, imipramin, klomipramin 2, 3).
Antidepresiva II. generace vykazují méně nežádoucích anticholinergních účinků, působí pouze na noradrenergní a serotoninergní systém, neovlivňují tedy histaminergní a α1-adrenergní receptory. Jsou pacienty lépe snášena a lze je použít i u pacientů s glaukomem, hypertrofií prostaty a ischemickou chorobou srdeční. Po zavedení III. generace antidepresiv má tato skupina poněkud menší význam, podobně jako první generace. Zástupci jsou např. maprotilin, mianserin 2, 3).
Antidepresiva III. generace jsou tvořena látkami selektivně inhibujícími zpětné vychytávání serotoninu (SSRI). Oproti předchozím generacím antidepresiv mají příznivější bezpečnostní profil, nepůsobí sedativně, nezvyšují tělesnou hmotnost a nepotencují účinek alkoholu. Protože mají výhodnější farmakokinetické vlastnosti, mohou se užívat pouze v jedné denní dávce. Negativem jsou zejména sexuální a gastrointestinální potíže. Účinek nastupuje zpravidla za 2–4 týdny. Všech šest zástupců SSRI jsou více či méně silnými inhibitory aktivity některých enzymů cytochromu P450 a zejména fluvoxamin, fluoxetin a paroxetin mají významný interakční potenciál. Patří sem citalopram a escitalopram, fluoxetin, fluvoxamin, paroxetin a sertralin 2, 3).
Antidepresiva IV. generacea další nová antidepresiva zastupují látky různých mechanismů účinku, jak bylo zmíněno výše, např. SNRI (duální inhibitory zpětného vychytávání serotoninu a noradrenalinu) (duloxetin, venlafaxin, milnacipran), NDRI (duální inhibitory zpětného vychytávání dopaminu a nordrenalinu) (bupropion), NASSA (noradrenergní a specifická serotonergní antidepresiva) (mirtazapin) a SARI (duální antagonisté/inhibitory zpětného vychytávání 5-HT) (trazodon) a další. Díky svým specifickým vlastnostem jsou jednotlivá léčiva používána nejen k léčbě deprese samotné, ale také deprese s komorbiditami, jako je algický syndrom, stresová inkontinence apod. Jinými indikacemi některých zástupců mohou být například generalizovaná úzkostná porucha, sociální fobie nebo bipolární afektivní porucha 2, 3).
Antipsychotika
Termíny antipsychotika a/nebo neuroleptika zahrnují skupinu léčiv, která mají příznivý vliv na psychické integrace. Jedná se o heterogenní skupinu léčiv, kterou běžně dělíme na antipsychotika I. generace, tzv. klasická nebo konvenční, a antipsychotika II. generace, tzv. atypická. Mezi antipsychotika I. generace patří například chlorpromazin, levomepromazin, flufenazin, haloperidol, zuklopentixol a další, k atypickým antipsychotikům řadíme například risperidon, paliperidon, klozapin, olanzapin, quetiapin a další 2, 3).
Terapeutické monitorování léčiv (TDM)
Psychofarmaka jsou široce používána jak v psychiatrii, tak v mnoha dalších oblastech medicíny. Prevalence psychických onemocnění dle epidemiologických studií stoupá a s tím je spojena i zvyšující se preskripce psychofarmak. Ovšem významný počet pacientů léčených psychofarmaky z nejrůznějších důvodů neodpovídá na léčbu nebo je jejich odpověď neuspokojivá. Kromě patrného úsilí vyvíjet nová psychofarmaka s novými mechanismy účinku je nezbytné především optimalizovat farmakoterapii dostupnými psychofarmaky. K tomuto účelu se jeví jako potenciálně vhodný nástroj terapeutické monitorování léčiv (TDM) 1, 4).
Obecně vhodná léčiva k TDM jsou ta, kde: a) je známá dobrá korelace mezi koncentrací léčiva v plazmě a účinkem léčiva, b) je dobře definované terapeutické rozmezí, c) léčivo vykazuje saturační kinetiku, d) je úzké terapeutické rozmezí, e) je tvořen aktivní metabolit, f) terapeutický efekt nemůže být popsán na základě klinických měření a g) kde je dostupná validovaná analytická metoda 5).
Z výše uvedeného je tedy zřejmé, že ne všechna psychofarmaka jsou pro TDM vhodná. U mnoha látek zatím nebyla prokázána jasná korelace mezi plazmatickou hladinou a účinkem, nejsou dostatečně stanovena a potvrzena terapeutická rozmezí a podobně. Přes tyto nedostatky pro využití TDM hovoří například poměrně vysoký interakční potenciál některých psychofarmak, běžná polyfarmakoterapie u pacientů léčených psychofarmaky, častá non-compliance, pomalý nástup účinku nebo vliv genetického polymorfismu biotransformujících enzymů na účinek některých látek. V roce 2003 byly expertní skupinou TDM při AGNP (Arbeitsgemeinschaft für Neuropsychopharmakologie und Pharmakopsychiatrie) vypracovány guidelines pro psychiatry, klinické farmakology, analytiky a další odborníky k optimalizaci využití TDM u psychofarmak. Pro širší využití TDM u psychofarmak je ovšem nutné mimo jiné provést další kontrolované klinické studie a také studie efektivnosti vynaložených nákladů 4).
Metody stanovení
Při léčbě psychofarmaky se používá jak monoterapie, tak polyterapie. Z toho důvodu je nutný vývoj metod umožňujících stanovení několika léčiv součastně, popřípadě i stanovení jejich aktivních metabolitů. Ke stanovení léčiv v biologických tekutinách se používají imunonochemické, elektromigrační či elektroforetické a chromatografické metody, které svou detekční citlivosti umožňují stanovení léčiv.
Úprava vzorku
Analýza léčiv v biologických tekutinách je často komplikována přítomností množství různých sloučenin v organické matrici, které vedou k interferenci matrice s léčivem, a dále jejich nízkou koncentrací ve vzorku. Imunochemické metody umožňují stanovení léčiv bez předchozí úpravy vzorku. Běžné postupy úpravy vzorku zahrnují precipitaci proteinů, extrakci na tuhé fázi (SPE) nebo extrakci kapalina-kapalina (LLE). K precipitaci se používají běžná organická rozpouštědla, jako je acetonitril nebo methanol 6).
Klasická extrakce z kapaliny do kapaliny je často používaná a velmi důležitá analytická separační metoda, přesto má své nevýhody, jako jsou interference matrice, používaní nebezpečných chemikálii a v některých případech i použití velkého objemu vzorku 7, 8). Základem této extrakce je kvalitativní pravidlo „podobné se rozpouští v podobném“. Nejčastěji se jako extrakční činidlo používá hexan, dichlormethan, diethylether, popřípadě směs jednotlivých rozpouštědel pro zvýšení extrakční účinnosti 9–11). SPE má několik výhod oproti tradiční LLE, jsou to vyšší selektivita, čistější extrakt, lepší reprodukovatelnost výsledků. SPE je omezena na relativně čisté biologické materiály, jako je plazma, sérum nebo moč. Je jen málo publikací, které popisují extrakci na tuhé fázi z plné krve 12). K separaci léčiv z biologických tekutin lze použít i modifikaci SPE mikroextrakci na tuhé fázi (SPME). In-tube SPME používá otevřené kapilární kolony jako extrakční zařízení. Organické složky ve vodném vzorku jsou přímo extrahovány a zkoncentrovány na stacionární fázi, následně jsou dopraveny na chromatografickou kolonu. In-tube SPME je vhodná technika přípravy vzorků, protože je rychlá, levná a lze ji snadno automatizovat. Obvykle je ve spojení s LC/MS 13). SPME má vysoký prekoncentrační faktor u hydrofobních látek, a proto není široce použitelná v analýze léčiv. Prekoncentrační faktor je definován jako poměr mezi konečnou koncentrací analytu v extrahovaném vzorku a počáteční koncentrací ve vzorku 14). Martínez 12) porovnával dvě SPE kolony (Chem Elut a Bond Elut Certify), které použil k extrakci šesti antidepresiv. Koncentrace léčiv byly následně změřeny pomocí plynové chromatografie s NP detektorem. Lepší výsledky byly dosaženy použitím SPE Bond Elut Certify 12).
Jako alternativa plazmy pro TDM různých léčiv byly také testovány sliny. Sliny mají několik výhod: bezbolestný a neinvazivní odběr, ke kterému není nutný kvalifikovaný personál. Sliny jako možný biologický materiál pro TDM mají i své nevýhody. Obvykle je možné odebrat jen malý objem a některé faktory: jako pH, ústní kontaminace, stimulovaný nebo nestimulovaný odběr, mohou ovlivnit difuzi léku z plazmy do slin. Z těchto důvodů by měla být před začátkem používání slin pro TDM zjištěna korelace mezi koncentrací léku v plazmě a ve slinách, protože ve slinách je přítomna jen volná, farmakologicky účinná frakce léčiva. De Castro 15) popisuje LC-MS/MS metodu pro stanovení devíti antidepresiv a některých jejich hlavních metabolitů ve slinách a v plazmě. Popisuje také studii korelace koncentrace venlafaxinu v obou matricích. Výsledky této studie neukázaly dobrou korelaci koncentrací venlafaxinu ve slinách a volné frakce v plazmě. Jako možný důvod zmiňují malý počet vzorků a jejich nedostatečnou homogenitu 15).
Také stanovení léčiv v mateřském mléce je důležité. Přítomnost léčiva v mléce může být potencionálním zdrojem nežádoucích účinku u kojeného dítěte. Kasper 16) publikoval stanovení olanzapinu v mateřském mléce metodou HPLC s elektrochemickým detektorem 16).
Stanovení léčiv v moči je méně důležité než v krvi, protože koncentrace je značně závislá na hydrataci organismu a na pH moče a využívá se především v toxikologii 17
Imunochemické metody
Imunochemické metody oproti chromatografickým metodám neumožňují stanovení léku a jeho metabolitu 18). Další nevýhodou jsou zkřížené reakce „cross-reactivity“, kdy protilátky reagují odlišně s různými léky a jejich metabolity, což znemožňuje přesnou kvantifikaci. Riziko interference stoupá se strukturní podobností 19). Chattergoon 20) popisuje falešně pozitivní nález tricyklických antidepresiv (TCA) u dvou pacientů, kteří nikdy neužívali TCA a přesto byly u nich naměřeny hladiny 80 ng/ml a 130 ng/ml při použití fluorescenčně polarizační imunoanalýzy (FPIA) 20). Dasgupta 21) potvrdil statisticky významně vyšší zkřížené reakce karbamazepinu a jeho metabolitu 10,11-epoxid karbamazepinu u 35 pacientů 21).
Imunochemické metody lze rozdělit na izotopové a neizotopové. Izotopové imunochemické metody jsou vývojově starší.
Izotopové imunochemické metody (Radio Immuno Assay – RIA, Immuno Radio Metric Assay – IRMA, Radio Enzymo Assay – REA, Radio Receptor Assay – RRA). RIA metody jsou vysoce citlivé. Ke značení antigenů se většinou používá radioaktivní izotop jodu 125I, ke značení haptenů tricium 3H 22).
V roce 1979 Brunswick 23) popsal specifickou radioimunoanalýzu na stanovení amitriptylinu a nortriptylinu. Jako radioaktivní značení bylo použito 3H 23). Tyto metody byly postupně nahrazeny metodami s jinak značenými reaktanty, např. enzymy nebo fluoroforem 24).
Mezi neizotopové imunochemické metody patří:
- Enzymové na fotometrických principech (Enzymo Immuno Assay – EIA, Enzyme Linked Immunosorbent Assay – ELISA, Immuno Enzymo Metric Assay – IEMA).
- Fluorescenční (Fluorescence Immuno Assay – FIA, Fluorescence Polarization Immuno Assay – FPIA, Time Resolved Fluorescence Immuno Assay – TR-FIA).
- Luminiscenční, popř. elektrochemiluniscenční (Lumino Immuno Assay – LIA, Immuno Lumino Metric Assay – ILMA, ElectroChemiLuminiscence – ECL) 22).
Neizotopové imunochemické metody většinou využívají vybavení běžných analytických, popřípadě biochemických laboratoří. Dorey 18) publikoval článek, ve kterém porovnávali výsledky stanovení tricyklických antidepresiv (TCA) kapalinovou chromatografií a enzymoimunoanalýzou (EMIT) 18).
Všeobecně lze říci, že imunochemické metody je vhodnější používat jako screening předávkování než pro terapeutické monitorování léku, jelikož mají relativní vysoký limit detekce 18, 19, 22).
Elektromigrační separační metody
V analýze psychofarmak se uplatňují i elektromigrační separační metody. Jejich předností je vysoká separační účinnost, nízká spotřeba vzorku i chemikálií. Jsou založeny na pohybu ionizovaných částic v elektrickém poli a lze je použít pro separaci nízkomolekulárních i vysokomolekulárních látek. Mezi elektromigrační separační metody patří kapilární elektroforéza (CE) a její ostatní módy, tj. kapilární zónová elektroforéza (CZE), micelární elektrokinetická kapilární chomatografie (MECC), kapilární elektrochromatografie (CEC), izotachoforéza (ITP), kapilární isoelektrická fokusace (CIEF) a kapilární gelová elektroforéza (CGE) 25). CZE v organických rozpouštědlech se označuje jako nevodná CZE (NACE). Umožňuje separaci hydrofobních látek, které jsou těžko dělitelné ve vodném prostředí. Vysoké rozlišení, krátký čas analýzy a možnost zvýšení rozpustnosti analytu jsou hlavními důvody pro použití organických rozpouštědel 26, 27).
Dell’Aquila 24) publikoval separaci tricyklických antidepresiv (TCAs) kapilární zónovou elektroforézou. N,N,N’,N’-tetramethyl-1,3-butanediamine byl použit jako účinný elektrolyt. TCAs mají podobnou strukturu, molekulovou hmotnost a pKa hodnoty. Jejich separace kapilární zónovou elektroforézou vyžaduje přesné pH a vhodné složení elektrolytu 24).
Flores 26) ve své práci popisuje snadnou, rychlou, senzitivní a robustní metodu nevodné kapilární elektroforézy s DAD detekcí pro stanovení paroxetinu a jeho tří metabolitů v moči. Moč byla extrahována pomocí C1826).
Schafroth 28) publikoval metodu na stanovení benzodiazepinů flunitrazepamu, diazepamu, midazolamu, klonazepamu, bromazepamu, temazepamu, oxazepamu a lorazepamu v moči pomocí micelární elektrokinetické kapilární chromatografie s UV detekcí. Vzorek byl připraven enzymatickou hydrolýzou a SPE 28).
Extrakci pomocí SPE publikoval také Tomita 29) na stanovení nitrazepamu a jeho metabolitů v moči micelární elektrokinetickou kapilární chromatografií s UV detekcí 29). Obě metody byly použity pro soudní a toxikologické analýzy.
Chromatografické metody
Z chromatografických metod se v posledních letech nejčastěji používá vysokoúčinná kapalinová chromatografie (HPLC) a plynová chromatografie (GC). Základním principem všech chromatografických metod je rozdělení složek směsi látek mezi stacionární a mobilní fázi. Obecné požadavky na detektory v HPLC jsou shodné s GC. K detekci se využívá analytická vlastnost systému, která je ve známém a reprodukovatelném vztahu ke koncentraci analytu 9).
Plynová chromatografie
Plynová chromatografie (GC) se používá pro stanovení antidepresiv, protože mnohé mají strukturu aminů. GC je jednoduchá, vysoce rozlišující, citlivá, reprodukovatelná a levná metoda. Aminy mají tendenci adsorbovat se na kyselou kolonu, kde také často dochází k jejich rozložení. Eluční píky aminů snadno chvostují a mají nízkou detekční citlivost. K odstranění všech těchto problémů se využívá derivatizace, čímž dojde ke snížení polarity aminoskupiny. Zlepšit selektivitu a citlivost je možné i použitím kapilární kolony 30, 31). GC se používají ve spojení s plamenově-ionizačním NP detektory a hmotnostními (MS) detektory 32). Počátek GC-MS je v roce 1970, kdy byl vyvinut pro biomedicínský výzkum i pro rutinní použití 33).
Torre 31) publikoval kvantitativní stanovení šesti tricyklických antidepresiv pomocí kapilární GC s NP detektorem. Jako vnitřní standard byl použit promazin a SPE k přípravě vzorků. Separace proběhla na 5% fenylmethylsilikonové kapilární koloně 31).
Fernandes 30) publikoval metodu stanovení fluoxetinu v plazmě pomocí plynové chromatografie s hmotnostní detekcí. K přípravě vzorku byla použita modifikace mikroextrakce na tuhé fázi SBSE (Stir Bar Sorptive Extraction) a desipramin jako vnitřní standard. Analýza probíhala při teplotním gradientu od 80 do 280 °C na HP5MS koloně. Jako nosný plyn bylo použito helium. MS detektor pracoval v EI modu a v SIM modu 30).
Langner 34) publikoval metodu GC/MS na stanovení oxazepamu v moči. Mnohé benzodiazepiny jsou metabolizovány na oxazepam a jsou eliminovány hlavně ledvinami. K hydrolýze glukuronidů oxazepamu v moči byla použita ß-glukoronidasa. Extrakce byla provedena pomocí SPE za použití d5-oxazepam jako vnitřního standardu 34).
Eap 35) publikoval GC/MS metodu na stanovení citalopramu, paroxetinu, sertralinu a jejich metabolitů v plazmě po derivatizaci. Jako vnitřní standard byl použit methylmaprotilin a separace proběhla na silikonové kapilární koloně (fused-silica Optima 5) 35).
Vysokoúčinná kapalinová chromatografie (HPLC)
HPLC je rychlá, účinná a spolehlivá metoda. Má širokou oblast použití, lze jí analyzovat ionty, látky polární i nepolární, málo těkavé, tepelně nestabilní i vysokomolekulární. Asi 80 % veškerých známých látek je možné analyzovat HPLC metodou. Mezi běžné detektory používané v HPLC patří spektrofotometrické, fluorimetrické, elektrochemické a hmotnostní. Spektrofotometrické jsou vhodné pro svou jednoduchost a provozní spolehlivost 14, 36–40).Fluorometrické detektory jsou selektivní pro látky, které mají přirozenou fluorescenci nebo je lze na fluoreskující deriváty převést. Jsou citlivější než spektrofotometrické detektory s detekčním limitem v pg/ml. Detektory s fluorescencí indukovanou laserem (LIFD) se vzhledem k malému objemu měrné cely uplatňují v kapilární HPLC a kapilární elektroforéze 9, 41–43).
Spojení hmotnostního spektrometru se separačními metodami, jako jsou LC a GC, výrazně zvyšuje selektivitu. Hmotnostní spektrometrie je fyzikálně chemická metoda k určování hmotnosti atomů, molekul a jejich částí po jejich převedení na kladné nebo záporné ionty. To umožňuje identifikovat a kvantifikovat analyt ve vzorku se složitou matricí (krev, plazma, sérum, moč), popřípadě i stanovit a kvantifikovat jeho metabolity. Hmotnostní spektrometr je iontově optické zařízení, které ionty vytvoří nebo je emituje do plynného stavu a z plynné směsi molekul, jejich nabitých fragmentů a iontů separuje nabité částice podle jejich efektivních hmotností m/z. Pro analýzu léčiv se nejčastěji používá ionizace elektrosprejem (ESI) a chemická ionizace za atmosférického tlaku (APCI). APCI je primárně určena pro ionizaci nízkomolekulárních látek do m/z < 1000. Mezi hmotnostní analyzátory používané při analýze léčiv patří trojitý kvadropólový analyzátor, iontová past nebo průletový analyzátor (TOF), popřípadě jejich kombinace 17).
HPCL-MS/MS se začala používat v bioanalytickém výzkumu již v roce 1980. V devadesátých letech 20. století našla své využití i v klinických laboratořích, kde se používala pro novorozenecký screening. HPLC-MS/MS se vyznačuje vysokou přesností a možností širokého uplatnění. Toto spojení umožňuje vývoj metod s krátkým retenčním časem. Příprava vzorku je obvykle jednoduchá a nezahrnuje derivatizaci. Z těchto důvodů má široké využití v terapeutickém monitorování léků, endokrinologii a toxikologii 33).
K vývoji metody je velmi důležitý výběr vhodného vnitřního standardu. Vnitřní standard musí být strukturně podobný stanovované látce a lze ho použít i pro více látek současně stanovovaných v jedné analýze. Mobilní fáze je ve většině případů složena ze směsi methanol, acetonitril a voda s přídavkem slabé kyseliny (kyselina mravenčí nebo octová) nebo kyselého pufru (mravenčan amonný nebo octan amonný). Slabé kyseliny se přidávají do mobilní fáze v koncentraci 0,005–0,05 % 33).
Kirchherr 44) popsal metodu kvantitativního stanovení 48 psychofarmak (amisulprid, amitriptylin, aripriprazol, benperidol, chlorpromazin, chlorprothixen, citalopram, klomipramin, klozapin, desipramin, doxepin, fluoxetin, flupentixol, flufenazin, fluvoxamin, haloperidol, hydroxyrisperidon, imipramin, levomepromazin, maprotilin, mianserin, mirtazapin, moklobemid, norklomipramin, nordoxepin, norfluoxetin, nortriptylin, O-desmethylvenlafaxin, olanzapin, opipramol, paroxetin, perazin, perfenazin, pimozid, pipamperon, quetiapin, reboxetin, risperidon, sertralin, sulpirid, thioridazin, trazodon, trimipramin, venlaflaxin, viloxazin, ziprasidon, zotepin, zuklopentixol). Jako vnitřní standard byl použit klonidin, dehydromethylrisperidon a methabenzthiazuron. Pomocí směsi acetonitrilu a methanolu byla provedena precipitace proteinů ve vzorku, po centrifugaci byl supernatant naředěn 100 μl mobilní fáze. Chromatografická separace proběhla na monolitické koloně (Chromolith Speed ROD C18). Mobilní fázi tvořila směs methanol a 5 mM octanový pufr. Průtok byl 1,0 ml/min. K detekci byl použit API 4000 tandemový hmotnostní spektrometr 44).
Příklady stanovení psychofarmak kapalinovou chromatografií s elektrochemickou, fluorescenční a UV detekcí jsou uvedeny v tabulce 1. Tabulka 2 obsahuje příklady stanovení psychofarmak kapalinovou chromatografií ve spojení s hmotnostní detekcí.
Tab. 1. Příklady stanovení psychofarmak kapalinovou chromatografií s elektrochemickou, fluorescenční a UV detekcí 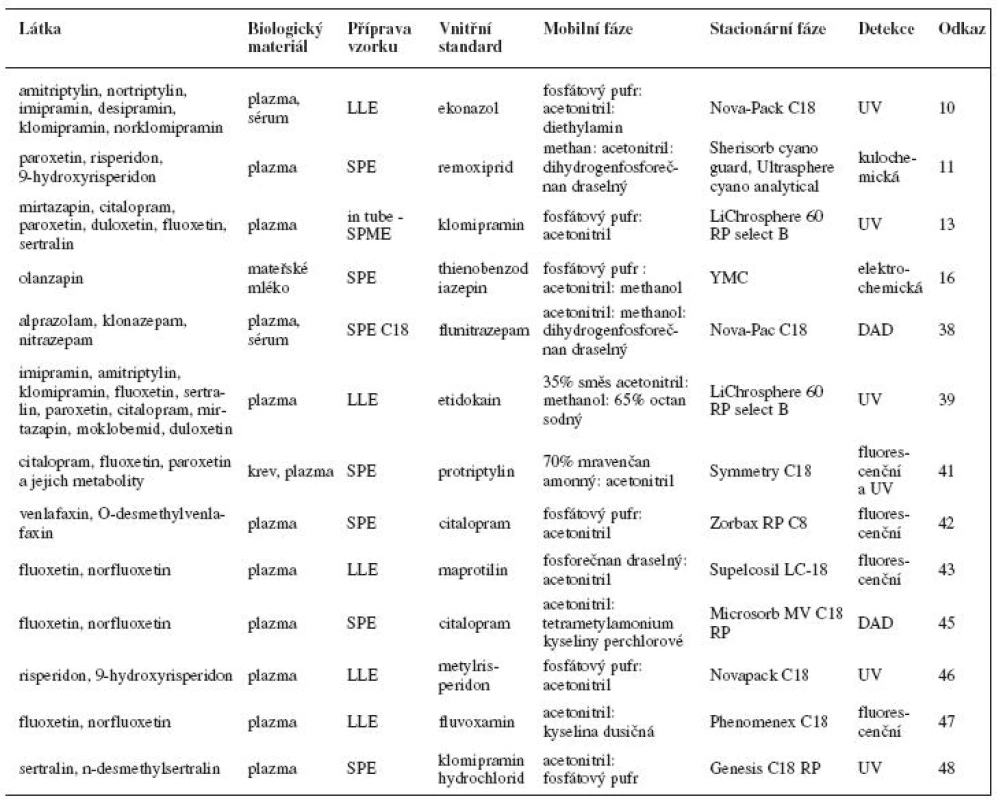
SPE – extrakce na tuhé fázi, LLE – extrakce kapalina-kapalina Tab. 2. Příklady stanovení psychofarmak LC-MS(/MS) 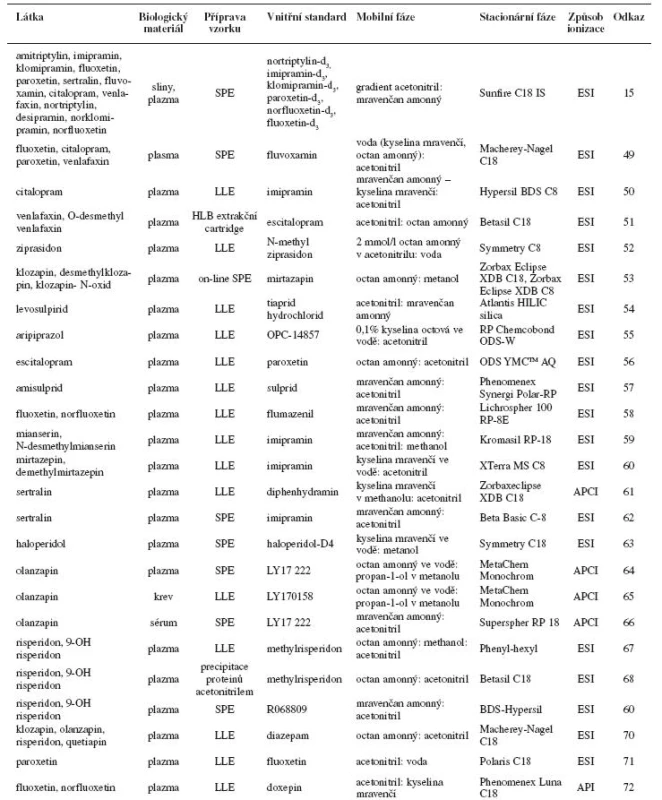
SPE – extrakce na tuhé fázi, LLE – extrakce kapalina-kapalina, ESI – elektrosprej, APCI – chemická ionizace za atmosferického tlaku, API – fotoionizace za atmosferického tlaku Závěr
Afektivní poruchy, především deprese představují zřejmě největší zdravotní zátěž moderní společnosti, která postihuje z celoživotního pohledu více než jednu pětinu obyvatelstva. Psychofarmaka jsou široce používána jak v psychiatrii, tak v mnoha dalších oblastech medicíny. Jelikož významný počet pacientů léčených psychofarmaky z nejrůznějších důvodů neodpovídá na léčbu, nebo je jejich odpověď neuspokojivá, jeví se jako potenciálně vhodný nástroj terapeutické monitorování těchto léčiv, především tam, kde je prokázána korelace mezi plazmatickou hladinou a účinkem a kde jsou stanovena a potvrzena terapeutická rozmezí.
Tento přehled shrnuje metody, včetně jednotlivých příkladů, které lze použít k TDM psychofarmak.
Spojení kapalinové chromatografie s hmotnostní spektrometrií má v rutinním terapeutickém monitorování léčiv zvyšující význam, protože zřejmě všechna léčiva lze takto stanovit. Velkou výhodou tohoto spojení je přesnost, široká oblast použití, výrazné zkrácení délky analýzy, možnost stanovit různé kombinace léčivých látek současně s jejich aktivními metabolity. Nevýhodou je vysoká pořizovací cena přístroje a vysoké nároky na obsluhu.
Adresa pro korespondenci:
Mgr. Romana Uřinovská
Ústav klinické farmakologie FN Ostrava
14. listopadu 1790, 708 52 Ostrava – Poruba
e-mail: romanaurinovska@seznam.cz
Zdroje
1. Vanek, D., Raboch, J., Vanek, J.: The prevalence of depression in the Czech Republic. Eur. Psychiat., 2000; 15, 397S–98S.
2. Suchopár, J. et al.: Remedia Compendium. 4. vyd. Praha: Panax, 2009; 242–262.
3. Bouček, J., Pidrman, V.: Psychofarmaka v medicíně. 1. vyd. Praha: Grada Publishing, 2005; 16–40, 49–63, 114–162.
4. Evans, W. E., Oellerich, M., Holt, D. W.: Therapeutic drug monitoring clinical guide. second edition. Cincinnati: Harvey Whitney Books Company, 1993; 2–10.
5. Baumann, P., Hiemke, C., Ulrich, S., Eckermann, G., Gaertner, I., Gerlach, M., Kuss, H. J., Laux, G., Muller-Oerlinghausen, B., Rao, M. L., Riederer, P., Zernig, G.: The AGNP-TDM expert group consensus guidelines: therapeutic drug monitoring in psychiatry. Pharmacopsychiat., 2004; 37, 243–265.
6. Shihabi, Z. K.: Sample matrix effects in capillary electrophoresis: II Acetonitrile deprotinization. J. Chromatogr. A, 1993; 652, 471–475.
7. Martinavarro-Domínguez, A., Capella-Peiró, M. E., Gil-Agustí, M., Marcos-Tomás, J. V., Esteve-Romero, J.: Therapeutic drug monitoring of antikonvulsant drugs by micellas HPLC with direct injection of serum samples. Clin. Chem., 2002; 48, 1696–1702.
8. Jasińska, A., Starczewska, B.: The use of the new SPE methods for isolation of some tricyclic antidepressant drugs from human serum. J. Pharm. Biomed. Anal., 2003; 31, 795–799.
9. Štulík, K., Bosáková, Z., Coufal, P., Jelínek, I., Pacáková, V., Ševčík, J.: Analytické separační metody. 1. vyd. Praha: Karolinum 2004; 136–166, 210–220.
10. Theurillat, R., Thormann, W.: Monitoring of tricyclic antidepressants in human serum and plasma by HPLC: characterization of a simple, laboratory developed method via external quality assessment. J. Pharm. Biomed. Anal., 1998; 18, 751–760.
11. Schatz, D. S., Saria, A.: Simultaneous determination of paroxetine, risperidone and 9-hydroxyrisperidone in human plasma by high-performence liquid chromatography with coulometric detection. Pharm., 2000; 60, 51–56.
12. Martínez, M. A., Torre, C. S., Almarza, E.: A comparative solid-phase extraction study for the simultaneous determination of fluvoxamine, mianserin, doxepin, citalopram, paroxetine, and etoperidone in whole blood by capillary gas-liquid chromatography with nitrogen-phosphorus detection. J. Anal. Toxicol., 2004; 28, 174–180.
13. Silva, B. J. C., Lancas, F. M., Queiroz, M. E. C.: In tube solid-phase microextraction coupled to liquid chromatography (in tube-SPME/LC) analysis of nontricyclic antidepressants in human plasma. J. Chromatogr. B, 2008; 862, 181–188.
14. Rasmussen, K. E., Pedersen-Bjergaard, S., Krogh, M., Ugland, H. G., Gronhaug, T.: Development of simple in-vial liquid-phase microextraction device for drug analysis compatible with capillary gas chromatography, capillary electrophoresis and high-performance liquid chromatography. J. Chromatogr. A, 2000; 873, 3–11.
15. Castro, A., Concheiro, M., Quintela, O., Cruz, A., López-Rivadulla, M.: LC-MS/MS method for the determination of nine antidepressants and some of their main metabolites in oral fluid and plasma Study of correlation between venlafaxine concentrations in both matrices. J. Pharm. Biomed. Anal., 2008; 48, 183–193.
16. Kasper, S. C., Mattiuz, E. L., Swanson, S. P, Chiu, J. A., Johnson, J. T., Garner, C. O.: Determination of olanzapine in human breast milk by high-performance liquid chromatography with electrochemical detection. J. Chromatogr. B, 1999; 726, 203–209.
17. Maurer, H. H.: Current role of liquid chromatography-mass spectrometry in clinical and forensic toxicology. Anal Bioanal Chem, 2007; 388, 1315–1325.
18. Dorey, R. C., Preskorn, S. H., Widener, P. K.: Results compared for tricyclic antidepressants as assayed by liquid chromatography and enzyme immunoassay. Clin. Chem., 1988; 34, 2348–2351.
19. Saint-Marcoux, F., Sauvage, F. L., Marquet, P.: Current role of LC-MS in therapeutic drug monitoring. Anal. Bional. Chem., 2007; 388, 1327–1349.
20. Chattergoon, D. S., Verjee, Z., Anderson, M., Johnson, D., McGuigan, M. A., Koren, G., Ito, S.: Carbamazepine interference with an immune assay for tricyclic antidepressants in plasma. Clin Toxicol, 1998; 36, 109–113.
21. Dasgupta, A., Mc Neese, C., Wells, A.: Interference of carbamazepin and carbamazepine 10,11-epoxide in fluorescence polarization immunoassay for tricyclic antidepressants. Am. J. Clin. Pathol., 2004; 121, 418–425.
22. Chromý, V., Fischer, J.: Analytické metody v klinické chemii. 1. vyd. Brno, Masarykova univerzita, 2000, s 96–97.
23. Brunswick, D. J., Needelman, B., Mendels, J.: Specific radioimmunoassay of amitriptyline and nortriptyline. J. Clin. Pharmac., 1979; 7, 343–348.
24. Dell’Aquila, C.: Separation of tricyclic antidepressants by capillary zone electrophoresis with N,N,N’,N’-tetramethyl-1,3-butanediamine (TMBD) as an effective electrolyte additive. J. Pharm. Biomed. Anal., 2002; 30, 341–350.
25. Pavlíková, L., Brozmanová, H., Kvasnička, F., Grundmann, M.: Terapeutické monitorování léků pomocí elektromigračních metod. Klin. Farmakol. Farm., 2007; 27, 45–49.
26. Flores, J. R., Nevado, J. J. B., Salcedo, A. M. C., Díaz, M. P. C.: Development and validation method for determination of paroxetine and its metabolites by nonaqueous capillary electrophoresis in human urine. Experimental design for evaluating the ruggedness of the method. Electrophoresis, 2004; 25, 454–462.
27. Tomita, M., Okuyama, T.: Application of capillary elecrophoresis to the simultaneous screening and quantitation of benzodiazepines. J. Chromatogr. Biomed Appl., 1996; 678, 331–337.
28. Schafroth, M., Thormann, W., Allemann D.: Micellar electrokinetic capillary chromatography of benzodiazepines human urine. Electrophoresis, 1994; 15, 72–78.
29. Tomita, M., Okuyama, T., Sato, S., Ishizu, H.: Simultaneous determination of nitrazepam and its metabolites in urine by micellar electrokinetic capillary chromatography. J. Chromatogr., 1993; 621, 249–255.
30. Fernandes, Ch., Hoeck, E., Sandra, P., Lancas. F. M.: Determination of fluoxetine in plasma by gas chromatography-mass spectrometry using stir bar sorptive extraction. Anal. Chim. Acta, 2008; 614, 201–207.
31. Torre, R., Ortuno, J., Pascual, J. A., González, S., Ballesta, J.: Quantitative determination of tricyclic antidepressants and their metabolites in plasma by solid-phase extraction (Bond-Elut TCA) and separation by capillary gas chromatography with nitrogen-phosphorous detection. Ther. Drug Monit., 1998; 20, 340–346.
32. Linder, M. W., Keck, P. E.: Standards of laboratory practice: antidepressant drug monitoring. Clin. Chem., 1998; 44, 1074–1084.
33. Vogeser, M., Seger, Ch.: A decade of HPLC-MS/MS in the routine clinical laboratory – Goals for further developments. Clin. Biochem., 2008; 41, 649–662.
34. Langner, J., Gan, B. K, Liu, R. H., Baugh, L. D., Chand, P., Weng, J. L, Edwards, C., Walia, A. S.: Enzymatic digestion, solid-phase extraction, and gas chromatography/mass spectrometry of derivatized intact oxazepam in urine. Clin. Chem., 1991; 37, 1595–1601.
35. Eap, C. B., Bouchoux, G., Amey, M., Cochard, N., Savary, L., Baumann, P.: Simultaneous determination of human plasma levels of citalopram, paroxeine, sertraline, and their metabolites by gas chromatography-mass spectrometry. J. Chromatogr. Sci., 1998; 36, 365–371.
36. Mercolini, L., Bugamelli, F., Kenndler, E., Boncompagni, G., Franchini, L., Raggi, M. A.: Simultaneous determination of the antipsychotic drugs levomepromazine and clozapine and their main metabolites in human plasma by a HPLC-UV method with solid-phase extraction. J. Chromatogr. B, 2007; 846, 273–280.
37. Llorca, P. M., Coudore, F., Corpelet, Ch., Buyens, A., Hoareau, M., Eschalier, A.: Integration of olanzapine determination in HLPC-diode array detection system for routine psychotropic drug monitoring. Clin. Chem., 2001;47, 1719–1721.
38. Akerman. K., Jolkkonen, J., Parviainen, M., Penttila, I.: Analysis of low-dose benzodiazepines by HPLC with automated solid phase extraction. Clin. Chem., 1996; 42, 1412–1416.
39. Malfará, W. R., Bertucci, C., Queiroz M. E. C., Carvalho, S. A. D., Bianchi, M. L. P., Cesarino, E. J., Crippa, J. A., Queiroz, R. H. C.: Reliable HPLC method for therapeutic drug monitoring of frequently prescribed tricyclic and nontricyclic antidepressants. J. Pharm. Biomed. Anal., 2007; 44, 955–962.
40. Carrillo, J. A., Ramos, S. I., Agundez, J. A. G., Martinez, C, Benitez, J.: Analysis of midazolam and metabolites in plasma by high-performance liquid chromatography: Probe of CYP3A. Ther. Drug Monit., 1998; 20, 319–324.
41. Kristoffersen, L., Bugge, A., Lundanes, E., Slordal, L.: Simultaneous determination of citalopram, fluoxetine, paroxetine and their metabolites in plasma and whole blood by high-performance liquid chromatography with ultraviolet and fluorescence detection. J. Chromatogr. B, 1999; 734, 229–246.
42. Mandrioli, R., Mercolini, L., Cesta, R., Fanali, S., Amore, M., Raggi, M. A.: Analysis of the second generation antidepressant venlafaxine and its main active metabolite O-desmethylvenlafaxine in human plasma by HPLC with spectrofluorimetric detection. J. Chromatogr. B, 2007; 856, 88–94.
43. Suckow, R. F., Zhang M. F., Cooper, T. B.: Sensitive and selective liquid-chromatographic assay for fluoxetine and norfluoxetine in plasma with fluorescence detection after precolumn derivatization. Clin. Chem., 1992; 38/9, 1756–1761.
44. Kirchherr, H., Kühn-Velten, W. N.: Quantitative determination of forty-eight antidepressants and antipsychotics in human serum by HPLC tandem mass spectrometry: A multi-level, single-sample approach. J. Chromatogr. B, 2006; 843, 100–113.
45. Sabbioni, C., Bugamelli, F., Varani, G., Mercolini, L., Musenga, A., Saracino, M. A., Fanali, S., Raggi, M. A.: A rapid HPLC-DAD method for the analysis of fluoxetine and norfluoxetine in plasma from overdose patients. J. Pharm. Biomed. Anal., 2004; 36, 351–356.
46. Titier, K., Déridet, E., Cardone, E., Abouelfath, A., Moore, N.: Simplified high-performance liquid chromatographic method for determination of risperidone and 9‑hydroxyrisperidone in plasma after overdose. J. Chromatogr. B, 2002; 772, 373–378.
47. Ertürk, S., Cetin, S. M., Atmaca, S., Ersoy, L., Baktir, G.: A Senzitive HPLC method for the determination of fluoxetine and norfluoxetine in human plasma with fluorescence detection. Ther. Drug Monit., 2005; 27, 38–43.
48. Mandrioli, R., Saracino, M. A., Ferrari, S., Berardi, D., Kenndler, E., Raggi, M. A: HPLC analysis of the second-generation antidepressant sertraline and its main metabolite N-desmethylsertraline in human plasma. J. Chromatogr. B, 2006; 836, 116–119.
49. Juan, H., Zhiling, Z., Huande, L.: Simultaneous determination of fluoxetine, citalopram, paroxetine, venlafaxine in plasma by high performance liquid chromatography-electrospray ionization mass spectrometry. J. Chromatogr. B, 2005; 820, 33–39.
50. Pistos, C., Panderi, I., Atta-Poltou, J.: Liquid chromatrography-positive ion electrospray mass spectrometry method for the quatification of citalopram in human plasma. J. Chromatogr. B, 2004; 810, 235–244.
51. Bhatt, J., Jangid, A., Venkatesh, G., Subbaiah, G., Singh, S.: Liquid chromatography-tandem mass spectrometry (LC-MS-MS) method for simultaneous determination of venlafaxine and its active metabolite O-desmethyl venlafaxine in human plasma. J. Chromatogr. B, 2005; 829, 75–81.
52. Al-Dirbashi, O. Y., Aboul-Enein, H. Y., Al-Odaib, A., Jacob, M., Rashed, M. S.: Rapid liquid chromatography-tandem mass spectrometry method for quantification of ziprasidone in human plasma. Biomed. Chromatogr., 2006; 20, 365–368.
53. Niederländer, H. A., Koster, E. H., Hilhorst, M. J., Metting, H. J., Eilders, M., Ooms, B., de Jong, G. J.: High throughput terapeutic drug monitoring of clozapine and metabolites in serum by on-line coupling of solid phase extraction with liquid chromatgraphy–mass spectrometry. J. Chromatogr. B, 2006; 834, 98–107.
54. Peak, I. B., Moon, Y., Ji, H. Y, Hui-Hyun, K., Hye, W. L., Yong-Bok, L., Hye, S. L.: Hydrophilic interaction liquid chromatography-tandem mass spectrometry for determination of levosulpirid in human plasma. J. Chromatogr. B, 2004; 809, 345–350.
55. Kubo, M., Mizooku, Y., Hirao, Y., Osumi, T.: Development and validation of an LC-MS/MS method for the quantitative determination of aripiprazole and its main metabolite, OPC-14857, in human plasma. J. Chromatogr. B, 2005; 822, 294–299.
56. Singh, S. S., Shah, H., Gupta, S., Jain, M., Sharma, K., Thakkar, P., Shah, R.: Liquid chromatography-electrospray ionisation mass spectrometry method for the determination of escitalopram in human plasma and its application in bioequivalence study. J. Chromatogr. B, 2004; 811, 209–215.
57. Gschwend, M. H., Arnold, P., Ring, J., Martin, W.: Selective and sensitive determination of amisulpride in human plasma by liquid chromatography-tandem mass spectrometry with positive electrospray ionisation and multiple reaction monitoring. J. Chromatogr. B, 2006; 831, 132–139.
58. Djordjevic, S., Kovacevic, I., Miljkovič, B., Vuksanovic, J., Pokrajac, M.: Liquid chromatographic-mass spectrometric method for the determination of flouxetine and norfluoxetine in human plasma: application to clinical study. Il. Farmaco, 2005; 60, 345–349.
59. Chauhan, B., Rani, S., Guttikar, S., Zope, A., Jadon, N., Padh, H.: Analytical method development and validation of miaserin hydrochloride and its metabolite in human plasma by LC-MS. J. Chromatogr. B, 2005; 823, 69–74.
60. Pistos, C., Koutsopoulou, M., Panderi I.: A validated liquid chromatographic tandem mass spectrometric method for the determination of mirtazapine and demethylmirtazapine in human plasma: application to a pharmacokinetic study. Anal. Chim. Acta, 2004; 514, 15–26.
61. Chen, X., Duan, X., Dai, X., Zhong, D.: Development and validation of liquid chromatographic/tandem mass spectrometric method for the determination of sertraline in human plasma. Rapid Commun. in Mass Spectrom., 2006; 20, 2483–2489.
62. Jain, D. S., Sanyal, M., Subbaiah, G., Pande, U. C., Shrivastav, P.: Rapid and sensitive method for the determination of sertraline in human plasma using liquid chromatography-tandem mass spectrometry (LC–MS/MS). J. Chromatogr. B, 2005; 829, 69–74.
63. Hempenius, J., Steenvoorden, R. J. J. M, Lagerwerf, F. M., Wieling, J. J., Jonkman, H. G.: „High throughput“ solid-phase extraction technology and turbo ionspray LC–MS–MS applied to the determination of haloperidol in human plasma. J. Pharm. Biomed. Anal., 1999; 20, 889–898.
64. Berna, M., Shugert, R., Mullen, J.: Determination of olanzapine in human plasma and serum by liquid chromatography/tandem mass spectrometry. J. Mass Spectrom., 1998; 33, 1003–1008.
65. Berna, M., Ackermann, B., Ruterbories, K., Glass, S.: Determination of olanzapin in human blood by liquid chromatography-tandem mass spectrometry. J. Chromatogr. B, 2002; 767, 163–168.
66. Bogusz, M. J., Krüger, K. D., Maier, R. D., Erkwoh, R., Tuchtenhagen, F.: Monitoring of olanzapine in serum by liquid chromatography-atmospheric pressure chemical ionization mass spectrometry. J. Chromatogr. B, 1999; 732, 257–369.
67. Aravagiri, M., Marder, S., R.: Simultaneous determination of risperidone and 9-hydroxyrisperidone in plasma by liquid chromatography/electorospray tandem mass spectrometry. J. Mass Spectrom., 2000; 35, 718–724.
68. Bhatt, J., Subbaiah, G., Singh, S.: Liquid chromatography/tandem mass spectrometry method for simultaneous determination of risperidone and its active metabolite 9-hydroxyrisperidone in human plasma. Rapid Commun. Mass Spectrom., 2006; 20, 2019–2114.
69. Remmerie, B. M. M., Sips, L. L. A., Vries, R., Jong, J., Schothuis, A. M., Hooijschuur, E. W. J., Merbel, N. C.: Validated method for the determination of risperidone and 9-hydroxyrisperidone in human plasma by liquid chromatography-tandem mass spectrometry. J. Chromatogr. B, 2003; 783, 461–472.
70. Zhou, Z., Li, X., Li, K., Xie, Z., Cheng, Z., Peng, W., Wang, F., Zhu, R., Li, H.: Simultaneous determination of clozapine, olanzapine, risperidone and quetiapine in plasma by high-performance liquid chromatography-electrospray ionization mass spectrometry. J. Chromatogr. B, 2004; 802, 257–262.
71. Massaroti, P., Cassioano, N. M., Duarte, L. F., Campos, D. R., Marchioretto, M. A. M., Bernasconi, G., Calafatti, S., Barros, F. A. P., Meurer, E. C., Pedrazzoli, J.: Validation of a selective method for determination of paroxetine i human plasma by LC-MS/MS. J. Pharm Pharmaceut. Sci., 2005; 8, 340–347.
72. Sutherland, F. C. W., Badenhorst, D., de Jager, A. D., Scanes, T., Hundt, H. K. L., Swart, K. J., Hundt, A. F.: Sensitive liquid chromatographic-tandem mass spectrometric method for the determination of fluoxetine and its primary active metabolite norfluoxetine in human plasma. J. Chromatogr A, 2001; 914, 45–51.
Štítky
Farmacie Farmakologie
Článek vyšel v časopiseČeská a slovenská farmacie
Nejčtenější tento týden
2010 Číslo 3- Psilocybin je v Česku od 1. ledna 2026 schválený. Co to znamená v praxi?
- Ukažte mi, jak kašlete, a já vám řeknu, co vám je
- Přerušovaný půst může mít významná zdravotní rizika
-
Všechny články tohoto čísla
- Analytické metody pro stanovení vybraných psychofarmak
- Vliv chloridu hlinitého na buněčný růst a produkci kumarinů v suspenzní kultuře Angelica archangelica L.
- Deriváty pyrazinkarboxylové kyseliny jako účinné abiotické elicitory produkce isoflavonoidů
- Vplyv druhu polyméru na liberáciu chlórhexidínu z hydrogélu
- Porovnanie retardačného účinku prírodných matricovotvorných polymérov so syntetickými polymérmi Kollicoatom SR a Eudragitom NE
-
XXXII. pracovní dny sekce radiofarmacie České společnosti nukleární medicíny ČLS JEP
Zlín, 9.–11. června 2010 - Tradiční setkání lékárníků v Malenovicích pod Lysou horou
- Životné jubileum RNDr. Viery Hermanovej
- Vybrané kurzy, stáže a semináře IPVZ – 2. pololetí roku 2010
- Neue Arzneimittel – Fakten und Bewertungen von 2005 bis 2007 zugelassenen Arzneimitteln, Band 18.
- Česká a slovenská farmacie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Analytické metody pro stanovení vybraných psychofarmak
- Porovnanie retardačného účinku prírodných matricovotvorných polymérov so syntetickými polymérmi Kollicoatom SR a Eudragitom NE
- Vplyv druhu polyméru na liberáciu chlórhexidínu z hydrogélu
- Deriváty pyrazinkarboxylové kyseliny jako účinné abiotické elicitory produkce isoflavonoidů
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



