-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Mikročástice na bázi oxycelulosy – vliv procesních proměnných na enkapsulační účinnost
Microparticles on the oxycellulose base – influence of processual variables on encapsulation efficiency
Microparticles have been a subject of intensive studies in pharmaceutical technology, their encapsulation efficiency being an important parameter in the preparation of microparticles. Higher values of encapsulation efficiency result in a more effective manufacturing process and subsequently in lower economic costs. This study aimed to prepare microparticles with the use of the method of outer gelation of the semisynthetic polymer oxycellulose with diclofenac using sodium salt as the model agent and to examine the influence of selected processual variables on the value of encapsulation efficacy. Processual variables included: the temperature of the hardening solution, the presence of the active ingredient in the hardening solution and the use of ultrasound waves in the process of hardening. The method with the use of which the hardening solution saturated with the active ingredient was cooled to the temperature of 4 °C was selected as the optimal one for the preparation of microparticles on the base of oxycellulose. The combination of these parameters resulted in the highest encapsulation efficiency (batch 4c – 75.24%). Hardening of microparticles by means of ultrasound waves proved to be unsuitable and resulted in a decrease in encapsulation efficiency.
Key words:
microparticles – oxycellulose – outer gelation – encapsulation efficiency – optimization of the process
Autoři: Marika Bajerová
; K. Dvořáčková; J. Gajdziok; R. Masteiková
Působiště autorů: Veterinární a farmaceutická univerzita Brno, Farmaceutická fakulta, Ústav technologie léků
Vyšlo v časopise: Čes. slov. Farm., 2010; 59, 67-73
Kategorie: Původní práce
Souhrn
Mikročástice jsou předmětem intenzivního studia ve farmaceutické technologii. Důležitým parametrem při přípravě mikročástic je jejich enkapsulační účinnost. Vyšší hodnoty enkapsulační účinnosti vedou k zefektivnění výrobního procesu a následně k menší ekonomické zátěži. Cílem této studie byla příprava mikročástic metodou vnější gelace polosyntetického polymeru oxycelulosy s diklofenakem sodnou solí jako modelovým léčivem. Sledoval se vliv zvolených procesních proměnných na hodnotu enkapsulační účinnosti. Procesními proměnnými byly: teplota tvrdícího roztoku, přítomnost léčiva v tvrdícím roztoku a použití ultrazvukových vln při procesu vytvrzování. Jako optimální byla při přípravě mikročástic na bázi oxycelulosy vybrána metoda, při které se tvrdící roztok nasycený léčivem ochladil na teplotu 4 °C. Kombinace těchto parametrů vedla k nejvyšší enkapsulační účinnosti (šarže 4c – 75,24 %). Tvrzení mikročástic pomoci ultrazvukových vln se ukázalo jako nevhodné a mělo za následek snížení enkapsulační účinnosti.
Klíčová slova:
mikročástice – oxycelulosa – vnější gelace – enkapsulační účinnost – optimalizace procesuÚvod
Studium mikročástic patří mezi perspektivní metody ve farmaceutické technologii. Mikročástice nabízejí ve srovnání s jednotkovými lékovými formami celou řadu výhod, mezi které patří: možnost řízeného uvolňování pro zajištění optimální terapeutické koncentrace léčiva v krevní plazmě, možnost kombinace více účinných látek, uvolňování léčiva nezávislé na příjmu potravy, podání inkompatibilních léčiv, ochrana léčiva před nežádoucími vlivy okolního prostředí, snížení dráždivosti gastrointestinálních sliznice působením některých léčiv, maskování nepříjemné chuti a vůně atd.1). Nověji se též uplatňuje možnost enkapsulace živých buněk do mikročástic2, 3).
Velikost mikročástic se pohybuje v intervalu jednotek až stovek μm. Zabudování řady těžce rozpustných léčiv do mikročásticových systémů může mít pozitivní vliv na jejich vstřebatelnost1). Podle výrobního procesu mohou mít mikročástice různý tvar a vnitřní strukturu. Základ mikrosfér tvoří polymerní matrice, v níž je účinná látka rovnoměrně dispergována. U mikrotobolek rozlišujeme jasně ohraničené jádro a polymerní obal. Oba typy mohou obsahovat léčivo v kapalné i pevné formě4, 5). Mikročástice se připravují četnými, často poměrně složitými technologickými postupy, které vedou k produkci částic nejrůznější struktury, složení a fyzikálně-chemických vlastností. Volba vhodné výrobní metody závisí především na vlastnostech polymerního nosiče a na rozpustnosti účinné látky6, 7). Známým a často používaným postupem vedoucím ke vzniku mikročástic jsou síťovací metody. Tyto metody mohou být rozděleny na chemické a fyzikálně-iontové. Chemické síťování je založeno na tvorbě kovalentních vazeb mezi polymerem a aktivní látkou. Mezi interakce založené pouze na fyzikálních (elektrostatických) silách patří iontová gelace (vnější nebo vnitřní), kdy dochází k zesíťování polyelektrolytů v přítomnosti polyvalentních iontů8). Vnější gelace spočívá v protlačování kapek polymerního roztoku s aktivní látkou tryskou do roztoku soli obsahující vícemocné ionty, např. Ca2+. Během procesu dochází ke smršťování kapek v důsledku utváření vysoce organizovaných struktur, tzv. „egg box“ 9). U vnitřní gelace se do polymerního roztoku s aktivní látkou přidává nerozpustný uhličitan vápenatý a vzniklá směs se emulguje v inertní olejové fázi. Okyselením emulze, např. přídavkem kyseliny octové, dochází k uvolnění iontů Ca2+ z nerozpustné soli, které způsobí následné síťování disperze polymeru s léčivem10). Mikročástice připravené těmito metodami se v řadě parametrů odlišují. Mikrosféry získané vnější gelací dosahují větších rozměrů a nižší homogenity ve srovnání s mikrosférami připravenými gelací vnitřní. V důsledku vyšší hustoty mikročástic připravených metodou vnější gelace dochází k pomalejšímu uvolňování inkorporovaného léčiva11, 12). Mezi další výhody vnější gelace patří vyšší enkapsulační účinnost (EE)13). Metoda se použila pro přípravu mikročástic na bázi solí kyseliny alginové pro enkapsulaci živých buněk, např. probiotických bakterií14, 15). Do alginátových mikročástic byl dále inkorporován endoteliální růstový faktor. Enkapsulační účinnost dosahovala hodnot 70 %16). V dalším experimentu se připravily alginátové matricové mikročástice s obsahem antibiotika polymyxinu B, kde se dosáhlo EE 12 %17). Další látkou používanou při přípravě mikročástic metodou iontové gelace je přírodní polysacharid gellan guma. Do polymeru byla inkorporována různá antibiotika, např. cefalexin s hodnotou EE 69,2 %18) nebo amoxicilin s EE 91 %19). Jinými polymerními systémy využívanými při vnější iontové gelaci mohou být: chitosan (síťovací činidlo – fosforečnanové ionty)20), karmelosa sodná sůl (síťovací činidlo – hlinité ionty)21), κ-karagenan (síťovací činidlo – draselné ionty)22) a pektin (síťovací činidlo – vápenaté ionty)23). Polymerem, který vykazuje podobnou strukturu jako algináty (obr. 1), je polosyntetický derivát oxycelulosa. Z důvodu této strukturní podobnosti byla zvolena oxycelulosa jako vhodný polymer pro přípravu mikročástic metodou vnější gelace pomoci Ca2+ iontů. Tato látka, připravená oxidací celulosy24), se v praxi na rozdíl od jiných celulosových derivátů neuplatňuje dosud tak široce, ale nové studie odhaluji její potenciál pro využití v moderních terapeutických systémech25).
Obr. 1. Strukturní vzorce (a) kyselina alginová, (b) oxycelulosa 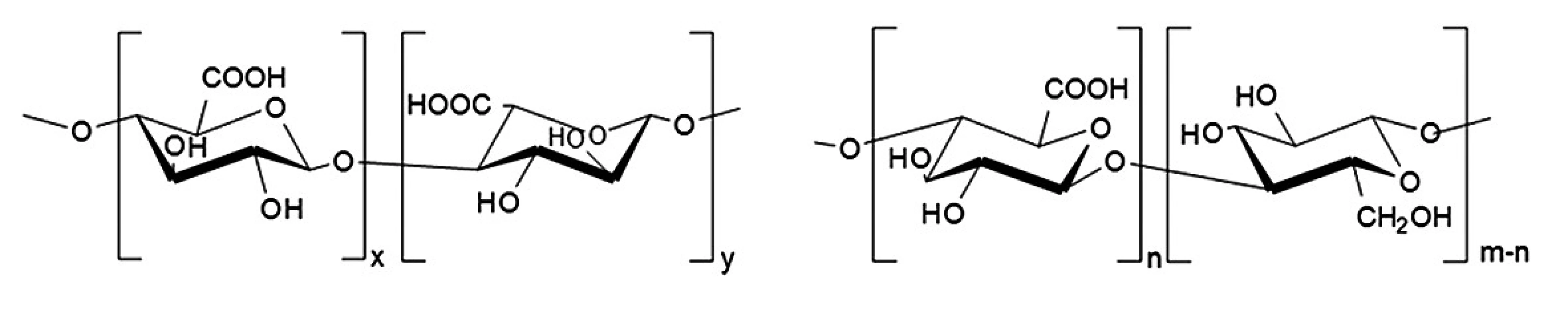
Enkapsulační účinnost je základním parametrem při formulaci mikročástic a znamená v podstatě podíl skutečného a teoretického obsahu léčiva v mikročásticích vyjádřená v procentech. Je závislá na celé řadě faktorů souvisejících s použitým polymerem, inkorporovaným léčivem, použitou metodou atd. Z výše zmíněných příkladů je patrné, že enkapsulační účinnost mikročástic připravených metodou vnější gelace se pohybuje v širokém rozmezí. Výhodná je co nejvyšší enkapsulační účinnost. Z tohoto důvodu je snaha změnou procesních podmínek zvýšit její hodnotu.
Cílem této experimentální práce byla příprava matricových mikročástic s obsahem sodné soli diklofenaku metodou vnější gelace oxycelulosy pomocí Ca2+ iontů. Sledoval se vliv vybraných procesních proměnných na enkapsulační účinnost mikročástic.
Pokusná část
Materiál
Modelovou léčivou látkou určenou k enkapsulaci byl diklofenak sodná sůl (DS) (Amoli Organics, Mumbai, Indie), polymerním nosičem byla oxycelulosa sodná sůl (NaOC) (Synthesia a.s., Pardubice – Semtín, Česká republika) a jako síťovací činidlo se použil chlorid vápenatý (RNDr. Jan Kulich, Hradec Králové, Česká republika).
Příprava mikročástic
Vnější gelace sodné soli oxycelulosy se použila jako metoda přípravy mikročástic. Při přípravě disperze se nejdříve navrstvilo 12 g oxycelulosy na čištěnou vodu a umístila se na 10 minut na magnetické míchadlo Ikamag (RT5 Power, IKA-Werke, Staufen, Německo) při teplotě 60 °C a rychlostí 600 otáček za minutu. Poté se disperze zhomogenizovala pomocí zařízení Ultra Turrax T25 Basic (IKA-Werke, Staufen, Německo) rychlostí 13 000 otáček za minutu. Dále se připravilo 30 g vodné suspenze jemnozrnného diklofenaku sodné soli s obsahem 2 g pevné látky, která se následně smíchala se zhomogenizovanou disperzí oxycelulosy a doplnila do 100 g čištěnou vodou. Výsledná disperze se protlačovala injekční stříkačkou o průměru jehly 0,4 mm, rychlostí 0,175 ml/min do Petriho misky s obsahem 120 ml tvrdícího roztoku tvořeného buď 1 M CaCl2 anebo 1 M CaCl2 nasyceného diklofenakem sodnou solí. Vzdálenost hladiny tvrdící lázně od ústí jehly byla 0,5 cm. Při odkapávání se tvrdící lázeň pravidelně otáčela rychlostí 4 otáčky za minutu, kvůli zamezení splývání formujících se mikročástic. Celkem se připravilo 5 šarží oxycelulosových mikročástic s obsahem diklofenaku sodné soli. Procesními proměnnými byly: složení tvrdícího roztoku, teplota tvrdícího roztoku a přítomnost či nepřítomnost ultrazvukových vln (UZ) při procesu tvrzení. Šarže 1 se připravila při teplotě místnosti odkapáváním disperze do 1 M CaCl2. Mikročástice se vytvořily okamžitě po styku s roztokem CaCl2 a pro dokonalé vytvrzení se ponechaly v této lázni po dalších 60 minut. Doba tvrzení mikročástic byla při přípravě všech šarží stejná. Šarže 2 se připravila odkapáváním disperze do tvrdícího roztoku ochlazeného na teplotu 4°C, ve které současně probíhalo i tvrzení mikročástic. Šarže 3 se lišila od šarže číslo 2 způsobem tvrzení, které probíhalo u šarže 3 v ultrazvukové lázni. Šarže 4 byla připravena odkapáváním disperze do tvrdícího roztoku 1 M CaCl2 ochlazeného na 4 °C s nasyceného diklofenakem sodnou solí. Důvodem je urychlení ztuhnutí formujících se gelových mikročástic. Šarže 5 pak vznikla úpravou podmínek šarže číslo 4. Mikročástice šarže 5 se tvrdily pomocí ultrazvukových vln. Vzniklé mikročástice šarží 1–5 se třikrát promyly čištěnou vodou a sušily se v sušárně po dobu 24 hodin při teplotě 30 °C. Podmínky přípravy shrnuje tabulka 1. Příprava každá šarže se pro reprodukovatelnost opakovala 3× a jednotlivé vzorky byly označeny písmeny a, b, c za číslem šarže.
Tab. 1. Podmínky přípravy mikročástic 
Stanovení velikosti mikročástic
Velikost připravených mikročástic se hodnotila stereoskopickým mikroskopem STM 902 (Opting, Ostrava, Česká republika) propojeným přes CCD kameru (Alphaphot, Nicon, Japonsko) s počítačem. Snímky se hodnotily s využitím softwaru pro obrazovou analýzu Ia32 (Leco Corporation, Michigan, USA). U každé šarže se vždy proměřilo 200 částic. Z naměřených hodnot se stanovil faktor kulatosti (SF), ekvivalentní průměr se vyjádřil jako aritmetický průměr ± směrodatná odchylka, distribuci velikosti částic charakterizují hodnoty d10, d50 a d90 vyjadřující hraniční mez (mm), do které svou velikostí spadá 10, 50, resp. 90 % proměřených částic. Na jejich podkladě se stanovila výpočtem šířka distribuce Y:
Skenovací elektronová mikroskopie
Vzorky mikročástic u vybrané šarže se upevnily na hliníkové válečky a potáhly se vrstvou zlata v naprašovacím zařízení SCD 005 Sputter Coater (BalTec Inc., Balzers, Švýcarsko). Vzhled a vlastnosti povrchů mikročástic se hodnotily pomocí skenovacího elektronového mikroskopu Hitachi S-4300 (Hitachi Scientific Instruments, Japonsko) operujícím při urychlovacím napěti 5,0kV.
Stanovení obsahu DS v mikročásticích a enkapsulační účinnosti (EE)
Přesně odvážené množství mikročástic se v odměrné baňce o objemu 100 ml doplnilo čištěnou vodou po rysku. Baňky se umístily do ultrazvukové lázně Sonorex (RK 52H, Bandelin, Berlin, Německo) na jednu hodinu pro lepší uvolnění léčiva z mikročástic. Poté se spektrofotometricky stanovila absorbance vzorků při vlnové délce 276 nm (Lambda 25, Perkin Elmer Instruments, USA). Obsah DS se stanovil s použitím odpovídající kalibrační křivky a u každé šarže mikročástic se opakoval 3×. Na základě získaných hodnost se vypočítala také enkapsulační účinnost (EE) podle vztahu:
kde cs představuje skutečný obsah DS v mikročásticích, ct odpovídá teoretickému obsahu DS.
Výsledky a diskuze
Mikroskopická analýza
Velikost mikročástic byla stanovena pomocí stereoskopického mikroskopu. Sledovanými parametry byly faktor kulatosti, ekvivalentní průměr, šířka distribuce, které jsou uvedeny v tabulce 2. Distribuce velikosti částic jednotlivých vzorků je graficky vyjádřena v obrázcích 3–7. Sfericita připravených mikročástic nabývala hodnotu v intervalu 0,76–0,81. V optimálním případě, tzn., je-li částice kulatá, SF nabývá hodnoty 1,0 (v případě optické analýzy, kde dochází k chybě vlivem převodu obrazu do pixelů, se velikost SF ideálně kulovité částice pohybuje okolo hodnoty 0,96). Z výsledků vyplývá, že nejvyšší kulatosti dosahovala vzorek 1 (SF = 0,81). Naopak nejnižších hodnot dosáhl vzorek 3 (SF = 0,76), kde byla enkapsulační účinnost nulová (tab. 3). Podle dostupné literatury se za přijatelnou považuje hodnota ≥ 0,8026). Této hodnoty dosahovala pouze vzorek 1. Snímek mikročástice vzorku 1 ze skenovacího elektronového mikroskopu (obr. 2) potvrzuje její vysokou sfericitu (obr. 2a). Na povrchu lze jasně pozorovat rekrystalizovaný diklofenak sodnou sůl (obr. 2b). Vliv enkapsulační účinnosti na hodnotu faktoru kulovitosti se nepotvrdil. Šířka distribuce velikosti částic se vypočítala podle vztahu 1. Její vysoká hodnota indikuje širokou distribuci, a tím i vysokou polydisperzitu27), zatímco hodnota blížící se nule ukazuje na monodisperzní systém. Například u granulátů je šířka distribuce menší než tři považována za přijatelnou28). Z vypočítaných hodnot tedy vyplývá poměrně úzká distribuce velikosti částic, která se u všech šarží mikročástic pohybovala v rozmezí 0,17–0,35 (viz tab. 2). Ekvivalentní průměr všech šarží mikročástic se pohyboval v intervalu 1,45–1,60 mm. Tato zjištění potvrzují i výsledky patrné z obrázků 3–7. Největší počet mikročástic spadal do třídy s velikostí střední hodnoty 1,6 mm.
Tab. 2. Vlastnosti připravených mikročástic 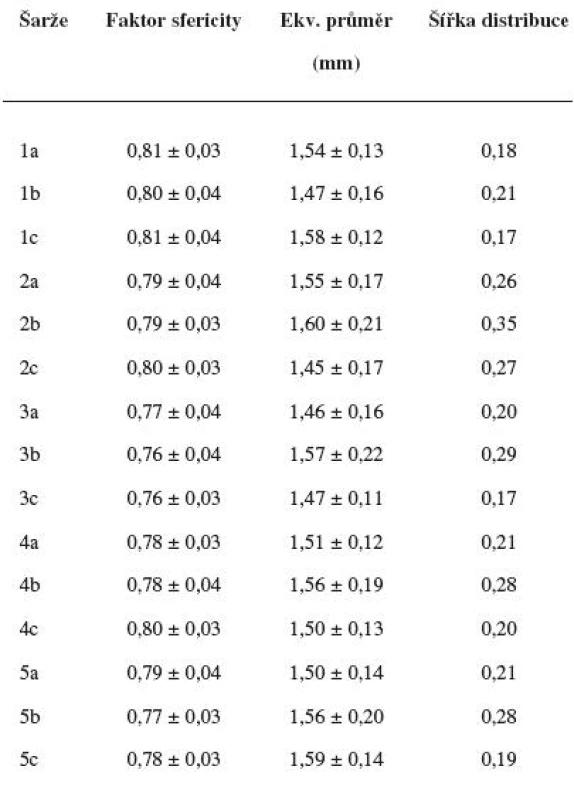
Tab. 3. Obsah diklofenaku sodné soli v připravených mikročásticích a jejich enkapsulační účinnost 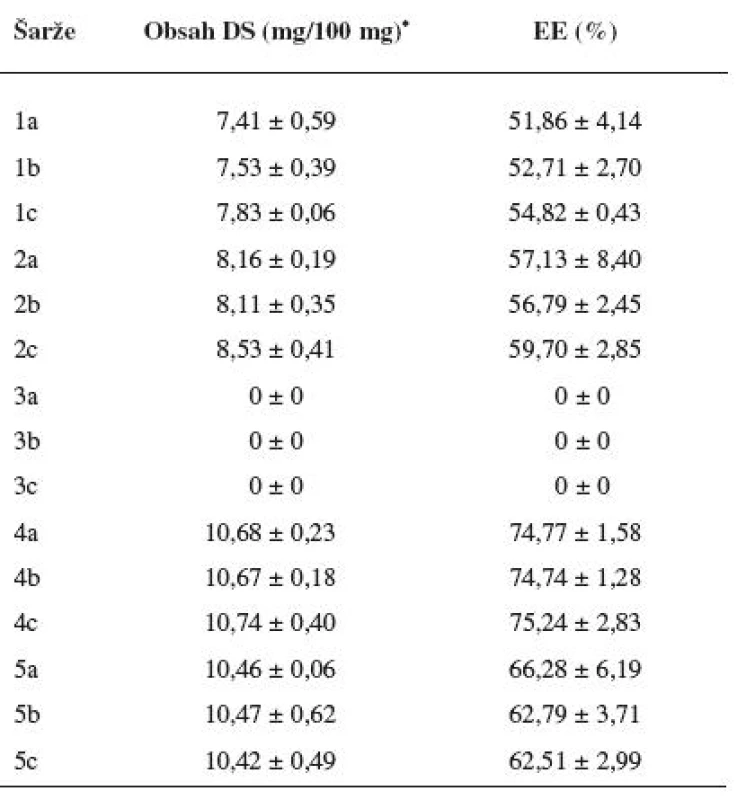
*Obsah DS uveden v mg na 100 mg mikročástic. Obr. 2. Snímek mikročástice šarže 1 z elektronového mikroskopu A – celá mikročástice, měřítko 200 μm, B – detail povrchu mikročástice, měřítko 100 μm 
Obr. 3. Distribuce velikosti částic – šarže 1 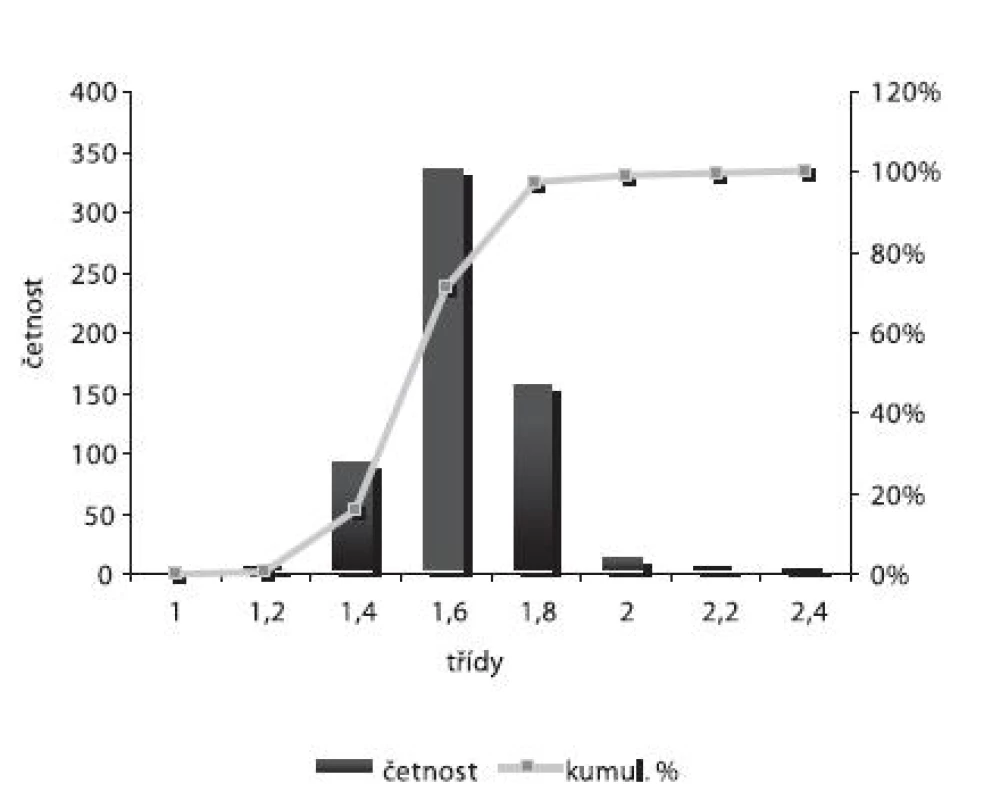
Obr. 4. Distribuce velikosti částic – šarže 2 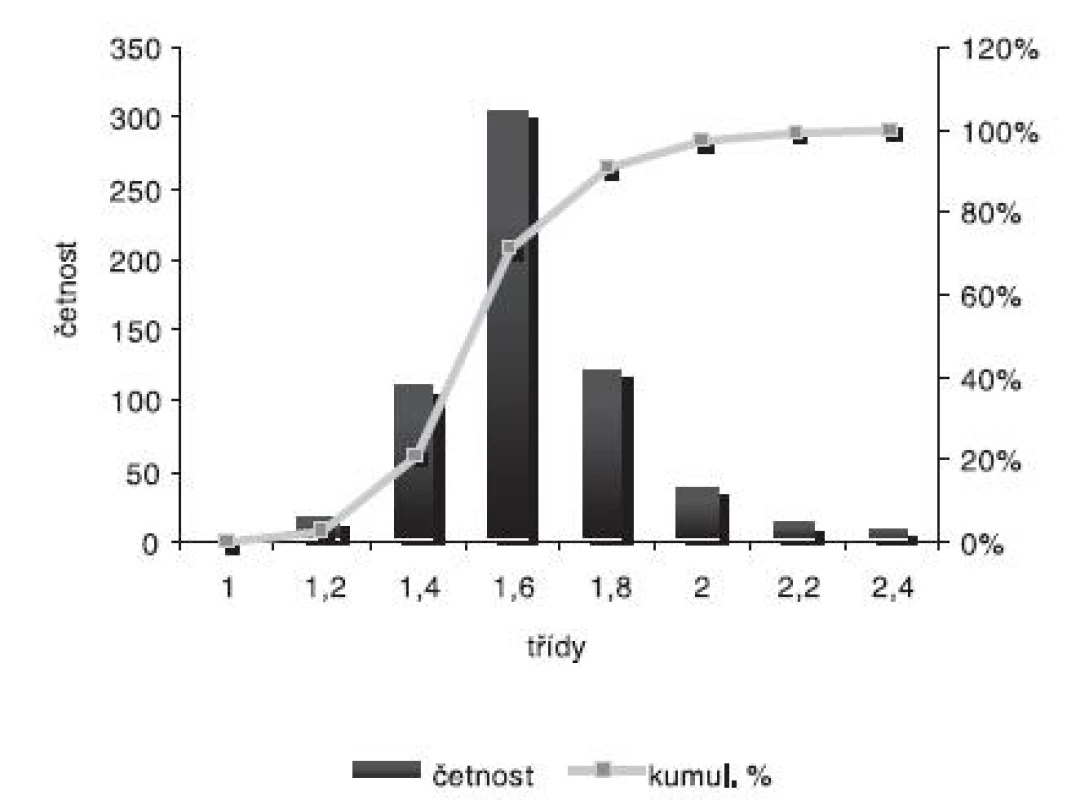
Obr. 5. Distribuce velikosti částic – šarže 3 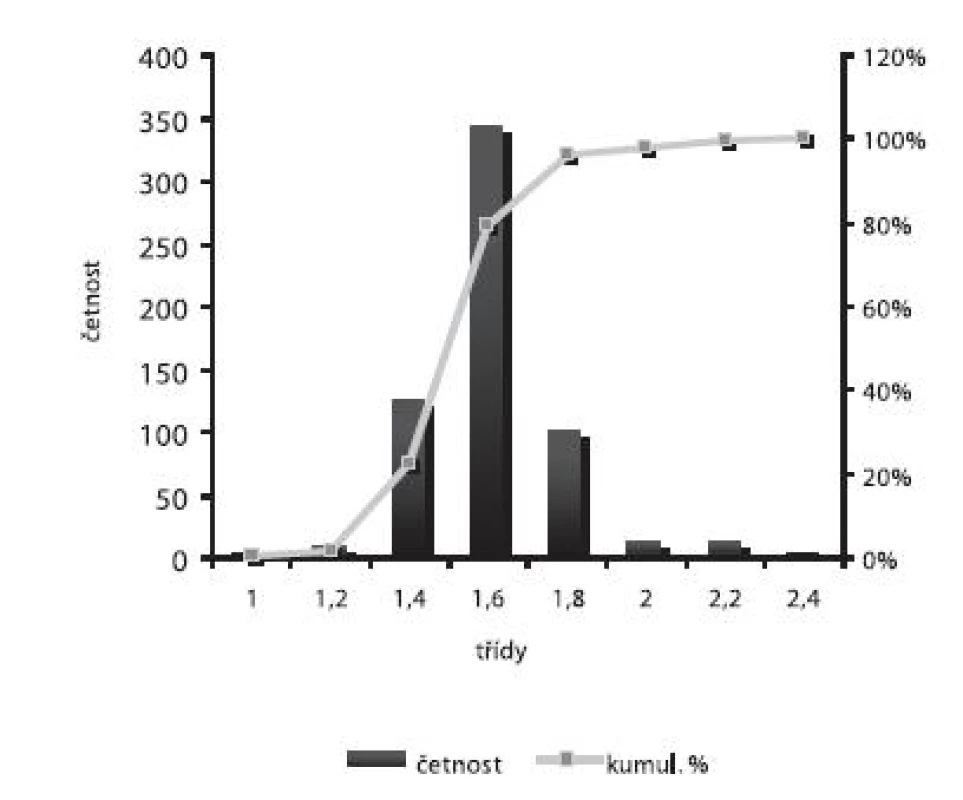
Obr. 6. Distribuce velikosti částic – šarže 4 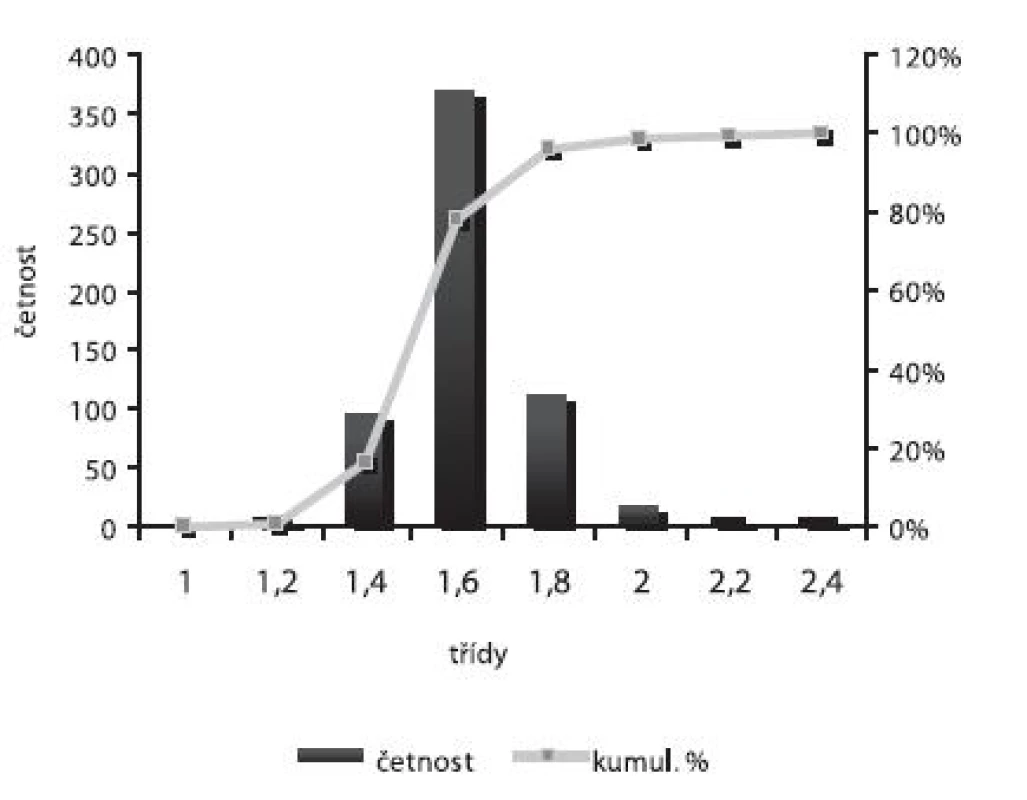
Obr. 7. Distribuce velikosti částic – šarže 5 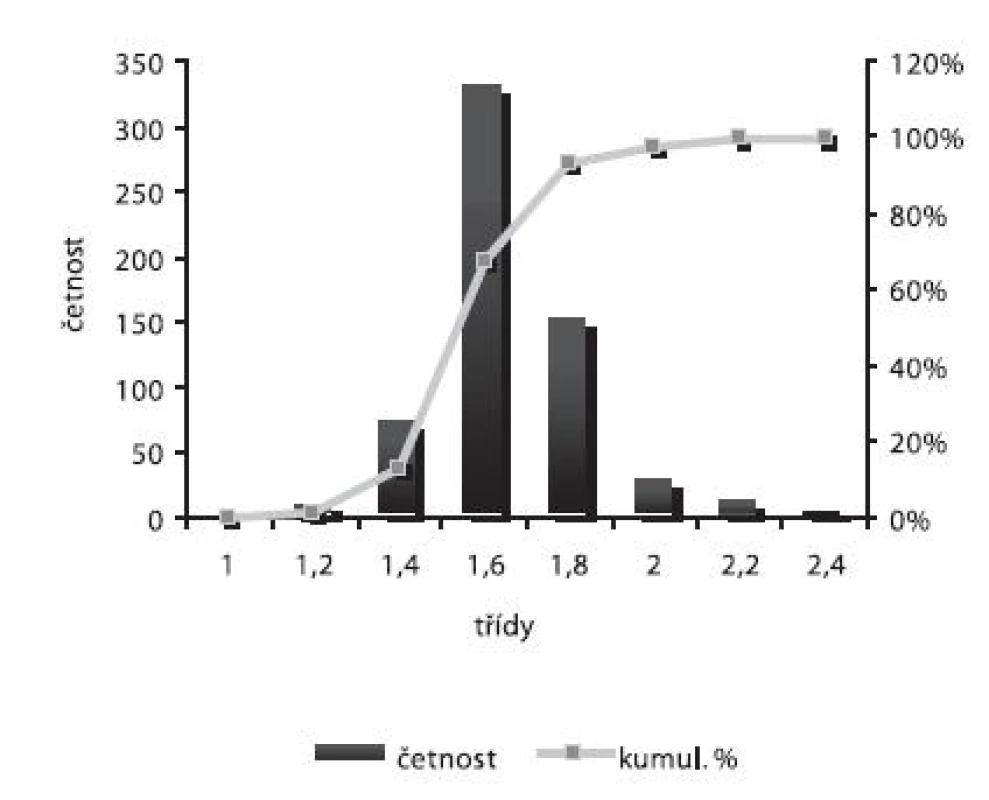
Enkapsulační účinnost
Enkapsulační účinnost mikročástic připravených metodou vnější gelace uváděná v literatuře se nejčastěji pohybuje mezi 50–55 %29, 30). Tato hodnota je ve srovnání s enkapsulační účinností mikročástic připravených jinými metodami relativně nízká. Je tedy žádoucí pokusit se změnou procesních podmínek tuto hodnotu zvýšit.
Při formování mikročástic se použilo modelové léčivo diklofenak sodná sůl. DS je látka mírně rozpustná ve vodě (14,18 mg/ml) při teplotě místnosti31). Rozpustnost DS klesá při nižším pH rozpouštěcího media a s rostoucí iontovou silou. Jak pH tvrdícího roztoku (pH = 4), tak jeho iontová síla způsobená CaCl2, posunují rozpustnost DS na úroveň těžké rozpustnosti. Z tohoto důvodu se předpokládala relativně vysoká enkapsulační účinnost. Tento předpoklad se však nepotvrdil.
První z procesních proměnných byla teplota tvrdícího roztoku. Při volbě této proměnné se vycházelo z předpokladu, že snížením teploty dojde ke snížení rozpustnosti enkapsulovaného léčiva, čímž se zamezí úniku léčiva difúzí do tvrdícího roztoku při formování mikročástic. Snížená teplota tvrdícího roztoku se použila u vzorků 2–5. Druhou proměnnou byla přítomnost enkapsulovaného léčiva v nasycené koncentraci v tvrdícím roztoku. Předpokládalo se, že nasycená koncentrace léčiva v tvrdícím roztoku by mohla vést ke zvýšení enkapsulační účinnosti vlivem snížení koncentračního gradientu (1. Fickův zákon) mezi tvrdící lázní a formující se mikročásticí. Tvrdící roztok nasycený DS se použil u vzorků 4 a 5. Třetí proměnnou bylo tvrzení vznikajících mikročástic v přítomnosti ultrazvukových vln nebo bez nich. Snahou bylo posoudit vliv přítomnosti ultrazvukových vln na jakostní parametry připravených mikročástic. Ultrazvukové vlny se použily při tvrzení mikročástic u vzorku 3 a 5. Kombinace proměnných uvádí tabulka 1.
Obsah léčiva v připravených mikročásticích a jejich enkapsulační účinnost jsou uvedeny v tabulce 3. EE se počítala dle vztahu 2. Obsah DS se lišil v závislosti na použité metodě a byl v přímé korelaci s hodnotou enkapsulační účinností. Enkapsulační účinnost u vzorku 1 připravené za normální teploty, bez přítomnosti diklofenaku sodné soli v tvrdící lázni a tvrzené bez ultrazvukových vln se pohybovala v rozmezí hodnot 51,86–54,82 %. Změnou jednoho ze tří parametrů, a to snížením teploty (šarže 2), se dosáhlo zvýšení enkapsulační účinnosti oproti vzorku 1. Hodnoty enkapsulační účinnosti se zvýšily u šarže 2 na hodnoty 56,79 až 59,7 %. U mikročástic šarže 3, které se připravily kombinací snížené teploty a použití ultrazvukových vln při tvrzení, byla zjištěna nulová enkapsulační účinnost. Obecně použití ultrazvukových vln urychluje různé chemické reakce – jako např. oxidace-redukce, hydrolýza, esterifikace a další. Ultrazvukové vlny se například používají pro enkapsulaci různých látek do lipozomů. Ačkoliv se mohou tvořit lipozomy samovolně, zřídka jsou termodynamicky stabilní. Proto se s výhodou využívá různé pomocné energie – jako např. mechanické míchání, elektrická energie, ultrazvuk nebo jejich kombinace32). Předpokládalo se, že použitím ultrazvukových vln dojde k urychlení chemických reakcí, které probíhají při gelaci uvnitř mikročástice. Ultrazvukové vlny však zřejmě narušily vnitřní strukturu mikročástic. Tento fakt pravděpodobně vedl k úniku léčiva do tvrdící lázně. K největšímu nárůstu enkapsulační účinnosti, a to na hodnoty 74,74–75,24 %, došlo u mikročástic šarže 4. Mikročástice šarže 4 se připravovaly za snížené teploty tvrdícího roztoku, který byl nasycený diklofenakem sodnou solí; ultrazvukové vlny použity nebyly. Kombinace dvou zmíněných parametrů byla tedy nejúčinnější. Použití ultrazvukových vln při tvrzení vedlo při jinak stejných podmínkách u šarže 5 k poklesu enkapsulační účinnosti mikročástic, a to na hodnoty v intervalu 62,51–66,28 %. UZ vlny pravděpodobně narušily vnitřní strukturu mikročástice tak jako při přípravě šarže 3, u které byla stanovená nulová enkapsulační účinnost. Vliv ultrazvukových vln na enkapsulační účinnost se však plně neprojevil z důvodu vysycení roztoku CaCl2 diklofenakem sodnou solí. Přítomnost DS v tvrdícím roztoku znemožnila únik léčiva z mikročástic v takovém rozsahu jako u šarže 3.
Závěr
Při přípravě mikročástic hraje velkou roli nejen volba polymeru a účinné látky určené k enkapsulaci, ale také výběr vhodných procesních proměnných. Jejich efekt lze sledovat na základním charakteristickém parametru mikročástic, kterým je enkapsulační účinnost. V tomto experimentu se hodnotu enkapsulační účinnosti podařilo zvýšit jak ochlazením tvrdícího roztoku, tak jeho nasycením léčivem – diklofenakem sodnou solí, nejvíce však kombinací obou parametrů. Kombinací snížené teploty tvrdícího roztoku s rozpuštěným diklofenakem sodnou solí (šarže 4) se podařilo dosáhnout těchto parametrů: enkapsulační účinnost ~ 75 %, faktor kulatosti 0,79 a střední průměr přibližně 1,52 mm. Tvrzení mikročástic působením ultrazvukových vln se ukázalo být nevhodné vzhledem k negativnímu vlivu na enkapsulační účinnost.
Adresa pro korespondenci:
PharmDr. Martina Bajerová
Ústav technologie léků FaF VFU
Palackého 1–3, 612 42 Brno
e-mail: martina.bajerova@seznam.cz
Zdroje
1. Manjanna, K. M., Kumar, T. M. P., Shivakumar, B.: Effect of manufacturing conditions on physico-chemical characteristics and drug release profile sof acoclefenac sodium microbeads. Drug InventionToday, 2009; 1(2), 98–107.
2. Park, K., Yeo, Y.: Microencapsulation Technology. In: Swarbrick, J. ed. Encyclopedia of Pharmaceutical Technology, 3rd ed. New York: Marcel Dekker Inc. 2007.
3. Scala Bertola, J., Gajdziok, J., Rabišková, M., Bonneaux, F., Lecompte, T., Sapin, A., Maincent, P.: Pellets for oral administration of low-molecular-weight heparin. Drug Develop. Ind. Pharm., 2009; 35(12), 1503–1510.
4. Rabišková, M.: Částicové lékové formy. Prakt. Lek., 2005; 1, 29–30.
5. Burgess, D. J., Hickey, A. J.: Microsphere Technology and Applications. In: Swarbrick, J., Boylan, J. C. ed. 2nd ed., Encyclopedia of Pharmaceutical Technology. New York: Marcel Dekker Inc. 2002.
6. Mathiowitz, E., Kreitz, M. R., Brannon-Peppas, L.: Microencapsulation. In: Mathiowitz, E. ed. Encyclopedia of Controlled Drug Delivery. New York: John Wiley & Sons, Inc. 1999.
7. Krejčová, K., Gryzcová, E., Rabišková, M.: Polymerové mikročástice pro perorální přívod diklofenaku. Chem. Listy, 2009; 103, 81–87.
8. Fernandes, J. C., Tiera, M. J., Winnik, F. M.: DNA-Chitosan Nanoparticles for Gene Therapy: Current Knowledge and Future Trends. In.: Kumar, Ch. S. S. R. ed. Biological and Pharmaceutical Nanomaterials. 1st ed, Weinheim: WILEY-VCH Verlag GmbH & Co. KGaA 2006.
9. Peretz, S., Cinteza, O.: Removal of some nitrophenol contaminants using alginate gel beat. Colloid Surface A, 2008; 319, 165–172.
10. Thies, C.: Microencapsulation: what it is and purpose. In: Vilstrup, P. ed. Microencapsulation of food ingredients. Surrey: Leathered Publishing, LFRA Lim. 2001.
11. Dulieu, C., Poncelet, D., Neufeld, R. J.: Encapsulation and Immobilization Techniques. In: Kühtreiber W. M., Lanza R. P., Chick W. L. ed. Cell Encapsulation Technology and Therapeutics, Boston: Birkhäuser 1999.
12. Poncelet, D., Markvicheva, E.: Multiple-Core Encapsulation: Microencapsulation and Alginate. In: Thies C., Vilstrup P. ed. Microencapsulation of food ingredients, Surrey: Leathered Publishig LFRA Lim. 2001.
13. Chan, L. W., Lee, H. Y., Heng, P. W. S.: Mechanisms of external and internal gelation and thein impact on the functions of alginate as a coat and delivery system. Carbohyd. Polym., 2006; 63(2), 176–187.
14. Capela, P., Hay, T. K. C., Shah, N. P.: Effect of homogenisation on bead size and survival of encapsulation probiotic bakteria. Food Res. Int., 2007; 40, 1261–1269.
15. Mokarram, R. R., Mortazavi, S. A., Najafi., M. B. N., Shahidi, F.: The influence of multi stage alginate rating on survivability of potential probiotic bakteria in simulated gastrin and intestinal juice. Food Res. Int., 2009; 42, 1040–1045.
16. Jay, S. M., Saltzman, W. M.: Controlled delivery of VEGF via modulation of alginate microparticle ionic crosslinking. J. Control. Release 2009; 134, 26–34.
17. Goppi, G., Sala, N., Bondi, M., Sergi, S., Iannuccelli, V.: Ex-vivo evaluation of alginate microparticles for Polymyxin B oral administration. J. Drug Targeting, 2006; 14(9), 599–606.
18. Agnihotri, S. A., Jawalkar, S. S., Aminabhavi, T. M.: Controlled repase of cephalexin through gellan gum beat: Effect of formulation parameters on entrapment effieciency, size, and drug repase. Eur. J. Pharm. Biopharm., 2006; 63, 249–261.
19. Babu, R. J., Sathigari, S., Kumar, M. T., Pandit, J. K.: Formulation of Controlled Release Gellan Gum Macro Beads of Amoxicillin. Curr. Drug Deliv., 2010; 7, 36–43.
20. Sinha, V. R., Singla, A. K., Wadhawan, S., Kaushik, R., Kumria, R., Bansal, K., Dhawan, S.: Chitosan microspheres as a potential carrier for drugs. Int. J Pharm., 2004; 274, 1–33.
21. Iannuccelli, V., Forni, F., Vandelli, M. A., Bernabei, M. T.: Effect of the loading method on the drug release from crosslinked carboxymethylcellulose bead. J Control. Release, 1993; 23, 13–20.
22. Sankalia, G. M., Mashru, C. R., Sankalia, M. J., Sutariya, B. V.: Stability improvement of alpha-amylase entrapped in kappa-carrageenan beads: Physicochemical characterizatio and optimization using composite index. Int. J. Pharm., 2006; 312, 1–14.
23. Si, L., Zhao, Y., Huang, J., Li, S., Zhai, X., Li, G.: Calcium Pectinate Gel Bead Intended for Oral Protein Delivery: Preparation Improvement and Formulation Development. Chem. Pharm. Bull. Tokyo, 2009; 57, 663–667.
24. Stilwell, R. L., Marks, M. G., Saferstein, L., Wiseman, D. M.: Oxidized Celulose: Chemistry, Processing and Medical Applications. In: Domb A. J., Kost J., Wiseman D. M. ed. Handbook of Biodegradable Polymers. Amsterdam: Harwood academic publishers 1997.
25. Gajdziok, J., Bajerová, M., Chalupová, Z., Masteiková, R.: Oxycelulosa – celulosový derivát s potenciálem účinné i pomocné látky. Ces. slov Farm., 2007; 6, 259–263.
26. Podoczek, F., Newton, J. M.: The evaluation of a three-dimensional shape factor for the quantitative assessment of the sphericity and surface roughness of pellets. Int. J. Pharm., 1995; 124, 253–259.
27. Silva, C. M., Ribeiro, A. J., Figueiredo, I. V., Gronćalves A. R., Veiga, F.: Alginate microspheres prepared by internal gelation: Development and effect on insulin stability. Int. J. Pharm., 2006; 311, 1–10.
28. Giry, K., Viana, M., Genty, M., Louvet, F., Wüthrich, P., Chulia, D.: Comparison of single pot and multiphase granulation. Part I. Effect of the high shear granulator on granule properties according to the drug substance and its concentration. Pharm. Dev. Technol., 2009; 14(2), 139–149.
29. Halder, A., Maiti, S., Sa, B.: Entrapment efficiency and release characteristics of polyethyleneimine-treated or -untreated calcium alginate beads loaded with propranolol-resin complex. Int. J. Pharm., 2005; 302, 84–94.
30. Yu, C.-Y., Yin, B.-Ch., Zhang, W., Cheng, A.-X., Zhang, X.-Z., Zhuo, R.-X.: Composite microparticle drug delivery systems based on chitosan, alginate and pectin with improved pH-sensitive drug release property. Colloid Surface B, 2009; 68, 245–249.
31. Kincl, M., Vrečer, F., Veber, M.: Characterization of factors affecting the repase of low-solubility drug from prolonged repase tablets, Anal. Chim. Acta, 2004; 502, 107–113.
32. Catro, M. D. L., Priego-Capote, F.: Ultrasound-assisted preparation of liquid samples. Talanta, 2007; 72, 321–334.
Štítky
Farmacie Farmakologie
Článek vyšel v časopiseČeská a slovenská farmacie
Nejčtenější tento týden
2010 Číslo 2- Psilocybin je v Česku od 1. ledna 2026 schválený. Co to znamená v praxi?
- Ukažte mi, jak kašlete, a já vám řeknu, co vám je
- Přerušovaný půst může mít významná zdravotní rizika
-
Všechny články tohoto čísla
- Výroba granulátů s obsahem silně účinných léčiv
- Studium lisovacího procesu a vlastností tablet ze dvou typů přímo lisovatelného sorbitolu
- Mikročástice na bázi oxycelulosy – vliv procesních proměnných na enkapsulační účinnost
- Zavedení radiofrekvenční identifikace (RFID) do procesu přípravy a aplikace léčiv – 2. část
- Identifikace a stanovení citlivosti kvasinek rodu Candida vzhledem k optimalizaci uvolňování ciclopiroxolaminu z mukoadhezivních orálních tablet
- Ze zasedání Výboru České farmaceutické společnosti
- Léčivé přípravky v českých lékárnách na konci 17. století
- 7. světový kongres farmaceutické technologie
- Doc. RNDr. Otto HELIA, CSc. – 70-ročný
- Česká a slovenská farmacie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Identifikace a stanovení citlivosti kvasinek rodu Candida vzhledem k optimalizaci uvolňování ciclopiroxolaminu z mukoadhezivních orálních tablet
- Výroba granulátů s obsahem silně účinných léčiv
- Léčivé přípravky v českých lékárnách na konci 17. století
- Mikročástice na bázi oxycelulosy – vliv procesních proměnných na enkapsulační účinnost
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání





