-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Péče o pacienty s nízkotraumatickou zlomeninou horního konce stehenní kosti.
II. Následná osteologická péče.
Doporučený postup České revmatologické společnosti, Společnosti pro metabolická onemocnění skeletu a České společnosti pro ortopedii a traumatologii
Management of proximal femoral fracture patiens and secondary prevention of fractures.
II. Secondary antiosteoporotic care.
Position Paper of the Czech Rheumatology Society, the Czech Society for Metabolic Bone Diseases, and Czech Society for Orthopedics and TraumatologyHip fractures disproportionately affect elderly male and female patients, and may result in impairment of mobility, loss of quality of life, increased health resource utilization and even in death. Despite strong evidence indicating that the occurrence of a hip fracture increases the risk of other osteoporotic fractures including recurrent hip fractures, secondary prevention of fractures in older patients with hip fractures is not adequately provided. One explanation for this decrease is the perception that it is too late to alter the course of the disease in its late stage. The management of such patients should include assessing clinical diagnosis, treating osteoporosis and preventing falls. Based on clinical trials and experience, this collective position of professional societies reviews the anti-fracture measures and efficacy and safety of antiosteoporotic agents in this high-risk elderly population of patients with recent low trauma hip fractures. Available pharmacological therapies for the treatment of osteoporosis include calcium and vitamin D, antiresorptive drugs such as bisphosphonates and denosumab, and the bone forming drug teriparatide. Many elderly patients with established osteoporosis have multiple comorbid conditions, and demonstrated drug safety in this frail population is critically important.
Key words:
Hip, osteoporosis, secondary prevention, fracture
Autoři: J. Štěpán 1; J. Vaculík 2; V. Palička 3; P. Dungl 2; doc. MUDr. Václav Vyskočil, Ph.D. 4; K. Pavelka 1
Působiště autorů: Revmatologický ústav, 1. lékařská fakulta UK, Praha 1; Ortopedická klinika IPVZ FN Na Bulovce, Praha 2; Osteocentrum, Fakultní nemocnice, Hradec Králové 3; Klinika ortopedie a traumatologie pohybového ústrojí Fakultní nemocnice, Plzeň 4
Vyšlo v časopise: Čes. Revmatol., 23, 2015, No. 2, p. 43-58.
Kategorie: Doporučené postupy
Souhrn
Ženy a muži starší 75 let s již prodělanou zlomeninou v oblasti kyčle mají vysoké riziko další zlomeniny. Důsledkem zlomeniny proximálního femuru je nejenom zhoršení mobility a kvality života, ale také zvýšené riziko úmrtí. Náklady na léčení těchto zlomenin jsou vysoké. Přesto není sekundární prevence fraktur u pacientů s prodělanou zlomeninou v oblasti kyčle dostatečně zajišťována. Onemocnění osteoporózou je často považováno za příliš pokročilé a neléčitelné. Rozhodování o nutných opatřeních je také ovlivňováno komorbiditami a očekávanou délkou života pacientů. V tomto společném stanovisku odborných společností jsou na základě výsledků klinických studií uvedeny možnosti antiosteoporotické a osteoanabolické léčby ke snížení rizika zlomenin u pacientů ve věku 75 let a vyšším, a to se zvláštním zaměřením na účinnost a bezpečnost opatření u nemocných se zlomeninou proximálního femuru. Ověřené farmakoterapeutické postupy u pacientů v této věkové skupině zahrnují antiresorpční přípravky (vápník, vitamin D, aminobisfosfonáty a denosumab) a osteoanabolický teriparatid. Vzhledem k častým komorbiditám u starých pacientů je nezbytné individuálně zvažovat bezpečnost léků.
Klíčová slova:
Kyčel, osteoporóza, sekundární prevence, zlomeninaZdůvodnění stanoviska
V České republice utrpí každoročně zlomeninu proximálního femuru kolem 9 300 žen a 3 500 mužů starších 50 let. S věkem stoupá prevalence osteoporózy a opakovaných pádů a exponenciálně se zvyšuje incidence zlomenin v oblasti kyčle. Tyto zlomeniny nepříznivě ovlivňují morbiditu a mortalitu (1), snižují kvalitu života (2,3) a zvyšují přímé i nepřímé zdravotní náklady (4,5). Během roku po zlomenině 20 % pacientů umírá, 27 % pacientů se dostává do zařízení dlouhodobé péče (6). Komplikacím, které jsou spojené se zlomeninami, lze předcházet včasnou identifikací osob ohrožených nízkotraumatickými zlomeninami (7) a zajištěním vhodných opatření dříve, než dojde k první zlomenině.
V Evropské unii se v r. 2010 uvádělo 43 000 úmrtí po prodělané zlomenině, z toho polovina v souvislosti s prodělanou zlomeninou v oblasti kyčle a 28 % po zlomenině obratle. Metaanalýza údajů o více než půl milionu osob s touto zlomeninou potvrdila, že mortalita zůstává zvýšená dvojnásobně u žen a 2,5x u mužů, a to po dobu nejméně 10 let od zlomeniny v oblasti kyčle (1). Následná medikamentózní péče o pacienty, kteří již prodělali nízkotraumatickou zlomeninu v oblasti kyčle, je zdůvodněna jednak závislostí dalšího osudu pacienta na jeho funkčním stavu po operaci (2), jednak vysokým rizikem, že pacient prodělá další obratlové nebo neobratlové zlomeniny (8, 9). Uvedené studie u těchto pacientů navíc zdůrazňují, že kontralaterální zlomeniny proximálního femuru utrpí už v prvních dvou letech po první fraktuře kolem 2 % pacientů (10). Podobné jsou i české zkušenosti. Z 5 102 mužů a žen (věk 81,2 roků, 72 % žen) se zlomeninou proximálního femuru utrpělo během dalších 18 měsíců kontralaterální zlomeninu 105 (2,1 %) pacientů (11). S dobou od první zlomeniny v oblasti kyčle roste pravděpodobnost kontralaterální zlomeniny. Ve Framinghamské studii bylo po dobu průměrně 4,2 roku sledováno 481 osob, které utrpěly frakturu v oblasti kyčle. Kontralaterální zlomeninu utrpělo do jednoho roku od zlomeniny 2,5 % pacientů, do 5 let 8,2 % pacientů (12). V domovech dlouhodobé péče je riziko prodělat zlomeninu prox. femuru 2–11krát vyšší, než v běžné populaci stejně starých osob, riziko úmrtí do jednoho roku po zlomenině v oblasti kyčle je až 40 % (13). Potvrzují to také studie z Kanady a ze Skandinávie (14). V dánské prospektivní kontrolované studii u 169 145 pacientů s první zlomeninou v oblasti kyčle (medián doby sledování 3,8 roku) prodělalo v období 1977–2001 druhou zlomeninu v oblasti kyčle 27 834 nemocných (15). V prvním roce od první zlomeniny byla kumulativní incidence této zlomeniny 9 %, po 5 letech 20 %. Mortalita po druhé zlomenině byla vždy významně vyšší než v populaci, během prvního roku u žen 21 % a u mužů 27 % (proti 10 % a 9 %), po 5 letech u žen 58 % a u mužů 64 % (proti 41 a 40 %).
Přestože u pacientů s prodělanou zlomeninou v oblasti kyčle je dostatek informací o rizikových faktorech a důsledcích další zlomeniny proximálního femuru, je systematická péče o tyto nemocné podceňována a neexistuje systematické sledování těchto pacientů (16–18). V mezinárodní studii u 86 202 pacientů se zlomeninou proxim. femuru ve věku 77–83 let (74–78 % žen) bylo pro osteoporózu léčeno jen 16–18 % pacientů. Během 3 měsíců po zlomenině dostalo plně hrazené léky 11 % (USA), 39 % (Korea) a 25 % (Španělsko) a z nich během prvního roku užívalo pravidelně léky 67 % (USA), 43 % (Korea) a 66 % (Španělsko) (19). Jako příčina se uvádí nedostatek informací o možnostech sekundární prevence zlomeniny založené na důkazech, komorbidity, vysoký věk a kratší očekávaná doba života. Přitom je známo, že riziko další zlomeniny v oblasti kyčle lze léčbou snížit (20–22).
Toto společné stanovisko českých odborných společností podává přehled vyšetření, doporučovaných pro diagnostiku a diferenciální diagnostiku kostního onemocnění u pacientů s prodělanou zlomeninou v oblasti kyčle. Jsou uvedeny výsledky klinických studií účinnosti antiosteoporotické a osteoanabolické léčby ke snížení relativního rizika zlomenin u pacientů ve věku 75 let a vyšším, a to se zvláštním zaměřením na účinnost a bezpečnost opatření u nemocných se zlomeninou proximálního femuru. Protože účinnost opatření ke snížení rizika zlomenin byla ověřována v malém počtu klinických studií, jsou zde použity také metaanalýzy, kohortové studie a post hoc analýzy. Protože riziko zlomenin se s věkem zvyšuje, je snížení relativního rizika zlomenin u starších osob zpravidla výraznější než v nižším věku. Tím je ovlivněno i farmakoekonomické rozhodování. Překážkou léčení není vyšší věk a překážkou zpravidla nejsou ani komorbidity (mírné nebo střední zhoršení renálních funkcí, centrální mozková příhoda apod.).
Strategie literární rešerše a vyjadřování výsledků
Protože v České republice je 80 % zlomenin v oblasti kyčle u žen a 57 % u mužů až ve věku ≥ 75 let, bylo pro účely tohoto Stanoviska omezeno elektronické vyhledávání v databázi Medline na publikace ověřující účinnost opatření ke snížení rizika zlomeniny v oblasti kyčle u pacientů v tomto věku. Elektronické vyhledávání nebylo omezeno na anglicky publikované studie. Vyhledávání studií o účinnosti vápníku, vitaminu D a stroncium ranelátu bylo omezeno na studie kontrolované placebem, jinak byly uvažovány jen studie kontrolované vápníkem nebo vápníkem a vitaminem D. Výsledky klinických studií jsou vyjadřovány jako relativní riziko (RR) a jeho 95 % konfidenční interval (95 % CI).
A. Doporučená diagnostická a diferenciálně diagnostická vyšetření
1. Anamnéza a klinické vyšetření poskytují údaje o genetické dispozici, stylu života (např. o nedostatečné fyzické aktivitě, kouření a o nedostatečné expozici slunečnímu záření), prodělaných onemocněních se vztahem ke stavu skeletu (např. resekci žaludku nebo střeva, intoleranci mléka, chronických zánětlivých onemocněních, průjmových stavech, častých nebo déletrvajících epizodách poruch menstruačního cyklu, ovariektomii) a o medikamentózní léčbě, která ovlivňuje stav a metabolismus kostní hmoty (např. užívání glukokortikoidů). Fyzikální vyšetření upozorní na Cushingův syndrom, hypogonadismus nebo hypertyreózu. Hepatomegalie svědčí o jaterním onemocnění a o možné hemochromatóze. Nejvýraznějším nálezem u pacientů s pokročilou osteoporózou je dorzální kyfóza a zmenšení tělesné výšky. Přesné měření výšky a rozpětí paží jsou dobrým ukazatelem pro hodnocení pokročilosti a progrese osteoporózy. Při kompresích obratlových těl se celková výška vzpřímené postavy snižuje, zatímco rozpětí paží zůstává nezměněno. Obvyklý poměr mezi rozpětím paží a výškou je 1,0 u zdravých jedinců bez přítomnosti kostní dysplazie či poruchy pojivové tkáně.
2. Hodnocení stupně úbytku kostní hmoty. Osteodenzitometrickým kritériem osteoporózy u žen i u mužů je denzita kostního minerálu (BMD) ≤ -2,5 T skóre, tedy snížení BMD o nejméně 2,5 směrodatné odchylky pod průměr BMD u mladých zdravých dospělých žen (23). Výpověď osteodenzitometrického vyšetření nelze zaměnit za klinickou diagnózu osteoporózy, ani ji užít k určení intervenčního prahu nebo dokonce způsobu terapie. Pětina až třetina pacientů se zlomeninou v oblasti kyčle nemá denzitometricky prokazatelnou osteoporózu (24). BMD se měří dvouenergiovou rentgenovou absorpciometrií (DXA) v bederní páteři nebo v proximálním femuru. Denzitometrické vyšetření bederní páteře v předozadní projekci zpravidla postačuje pro stanovení BMD až do 60–70 let věku pacientů. Interpretaci změn BMD páteře ve vyšším věku komplikují mj. degenerativní hyperostotické změny, deformity obratlů, těžká skolióza, cévní kalcifikace, osteoartróza, osteomalacie. Měření BMD v místech skeletu s převážně kortikální kostní hmotou (krček femuru) zpravidla není zkresleno degenerativními změnami, jeho výpovědní hodnota však není zaměnitelná s výpovědí měření míst skeletu s převážně trámčitou strukturou. Dalšími příčinami obtížné interpretace BMD mohou být malá postava, nedávné užití kontrastní látky, scintigrafie, léčba zlatem a nesprávná referenční data. Riziko zlomenin kyčle je nejpřesněji vyjádřeno cíleným denzitometrickým vyšetřením proximálního femuru. Výpověď rychlosti poklesu BMD proximálního femuru o riziku zlomeniny lze vzhledem k variabilitě opakovaných měření BMD posuzovat až s odstupem desítky let (25) a v některých studiích nebyla potvrzena (26). Výpovědní hodnota ultrazvukového vyšetření patní kosti, zatím jen na přístroji Achilles (Lunar, USA), byla dokumentována pro predikci rizika zlomenin u starých žen. Ultrazvuková vyšetření nenahrazují měření BMD, ani nejsou doporučena pro monitorování účinnosti léčby.
3. Radiologické vyšetření má nezastupitelnou roli v diagnostice i v diferenciální diagnostice osteoporózy; jako důvod nízké kostní denzity u starých lidí může odhalit osteomalacii, může přispět ke zjištění mnohočetného myelomu, hyperparatyreózy (subperiostální uzurace), nebo hyperkortizolismu jako příčiny osteoporózy. Identifikace prodělaných zlomenin a zhodnocení deformit obratlových těl má prognostický význam. Predilekčním místem pro zlomeniny obratlů jsou Th7, Th8, Th12 a L1, tedy ve vrcholu hrudní kyfózy a v oblasti Th/LS přechodu. Izolované fraktury od Th4 výše budí podezření na malignitu. Zlomeniny lze klasifikovat jako deformity mírné, střední nebo těžké (snížení výšky obratle o 20–25 %, o 25–40 %, a o > 40 %). Kvantitativní morfometrie obratlů se provádí na dvou RTG snímcích páteře v boční projekci centrovaných na Th7 a L2 (vzdálenost zdroje od filmu je zpravidla 120 cm), kdy se po digitalizaci měří výšky obratlů Th4 až L5 a hodnotí se stupeň jejich snížení. Lze také užít morfometrického software moderních osteodenzitometrů Hologic (VFA, Vertebral Fracture Assessment) anebo GE Lunar (LVA, Lateral Vertebral Assessment); takto zjištěnou mírnou deformitu obratle je však vhodné ověřit radiograficky. V indikovaných situacích mají cennou klinickou výpověď vyšetření MRI, CT a celotělová scintigrafie.
4. Hodnocení rizika zlomeniny podle klinických faktorů. Měření BMD metodou DXA neposkytuje informaci o kvalitě kosti. Většina zlomenin vzniká u osob, které mají jen osteopenii (20, 27, 28). Doporučuje se proto hodnotit individuální pravděpodobnost prodělat během dalších 10 let frakturu kyčle, případně kteroukoli osteoporotickou zlomeninu (29, 30). Nejde o nástroje pro diagnostiku osteoporózy. Odhad pravděpodobnosti (například podle systému FRAX) vychází z incidence zlomeniny v závislosti na věku v dané geografické oblasti a individuálně se koriguje podle údajů o prodělané zlomenině, zlomenině kyčle u rodičů, užívání glukokortikoidů, diabetes mellitus, BMI, sekundární osteoporóze, revmatoidní artritis, kouření cigaret a nadměrné konzumaci alkoholu a případně BMD. Závažná je zejména informace o prodělané zlomenině, kterou uvádí více než polovina pacientů se zlomeninou v oblasti kyčle.
5. Laboratorní diferenciálně diagnostická vyšetření. Základní klinické projevy osteoporózy (úbytek kostní hmoty), zlomeniny při nepřiměřeně nízkém traumatu a bolest kostí při nepřiměřeném zatížení se v různém stupni zjišťují i při jiných klinicky významných situacích. Některé jsou ve stáří poměrně časté (osteomalacie, Pagetova kostní choroba). Některé jsou méně časté (fibrózní dysplazie), ale mohou být závažné (osteomyelitis obratlů). Léčebné postupy při těchto onemocněních jsou zásadně odlišné od postupů při osteoporóze a diferenciální diagnostika stavů s uvedenými klinickými projevy je proto velmi významná.
Laboratorní vyšetření, která jsou zpravidla užívána při diferenciální diagnostice, jsou uvedena v tab. 1. Vedoucím příznakem při diferenciální diagnostice osteopatií může být například snížení aktivity kostního izoenzymu sérové alkalické fosfatázy (hypofosfatasemie), případně snížení koncentrace osteokalcinu, C - nebo N-terminálního peptidu prokolagenu I v séru při poruchách syntézy kolagenu typu I (osteogenesis imperfecta, hyperkortizolismus). Na rozdíl od kostní denzitometrie nevypovídají biochemické markery o množství kostního minerálu a nelze jich proto užít k diagnostice osteoporózy. Nicméně hodnoty biochemických markerů vyšší než trojnásobek normy činí diagnózu osteoporózy nepravděpodobnou a naopak svědčí pro vysokoobratovou osteopatii jinou než osteoporózu. Sérový 25hydroxyvitamin D se má stanovit u pacientů s podezřením na nedostatečnou exposici slunečnímu záření nebo na malabsorpci. U mužů s osteoporózou je vhodné stanovení testosteronu v séru, aby se vyloučil hypogonadismus jako příčina úbytku kostní hmoty. Nemocní s koncentracemi sérového kalcia a fosfátů mimo normální hodnoty, s hyperkalciurií, s celkovou aktivitou sérové ALP vyšší než dvojnásobek horní hranice normy, koncentrací osteokalcinu pod dolní hranicí normy, s hodnotami TSH mimo normální hodnoty a s nálezem paraproteinu nemají být bez dalšího vyšetření a případně konzultace se specialistou léčeni pro osteoporózu. Biochemické markery kostní remodelace vypovídají o zrychleném úbytku kostní hmoty při nadměrně zvýšené osteoresorpci anebo při utlumené novotvorbě kostní hmoty. Nepřímo tak svědčí pro zvýšení rizika zlomenin obratlových, neobratlových i zlomenin v oblasti kyčle (31). Jejich výpověď je však ovlivněna hojením zlomeniny. Výpověď markerů nelze u jednotlivých pacientů využít pro predikci nové zlomeniny a výpověď není směrodatná ani u pacientů s atypickými zlomeninami.
Tab. 1. Diferenciálně diagnostické testy. 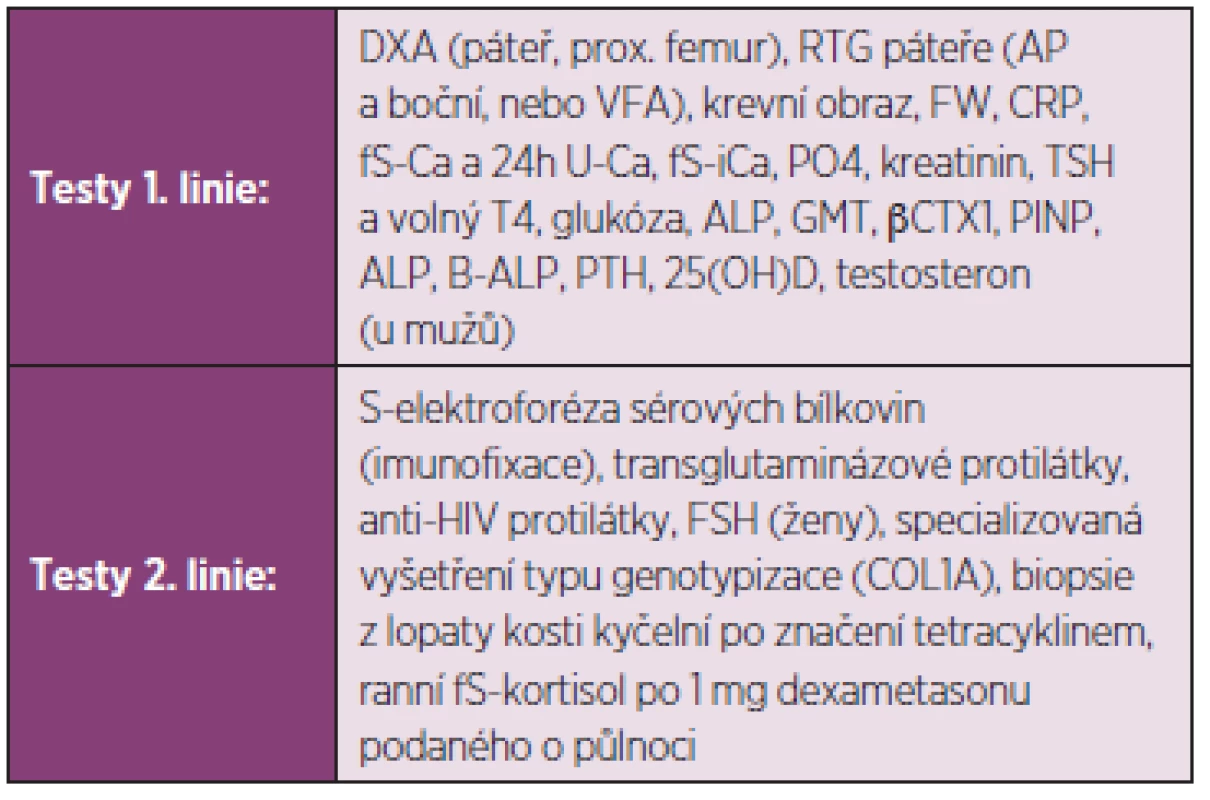
B. Medikamentózní sekundární prevence zlomenin u pacientů s frakturou proximálního femuru
1. Nutriční aspekty
Nedostatek bílkovin ve stravě zapříčiňuje úbytek svalové a kostní hmoty a zvyšuje riziko pádů a zlomenin (32). Zajištění dostatku bílkovin v dietě zlepšuje klinický průběh po operaci a úspěch rehabilitace (33).
2. Vápník a vitamin D
Při suplementaci samotným vápníkem (nebo při současně podávané denní dávce vitaminu D nižší než 400 IU) nebylo prokázáno snížení rizika neobratlových zlomenin ani zlomenin v oblasti kyčle (33, 34). Při nedostatečné suplementaci vápníkem a nízké hladiny vitaminu D není dostatečně účinná ani antiresorpční terapie (36). Na druhé straně se účinnost antiresorpční léčby nezlepšila, pokud se při již zajištěném příjmu vápníku a vitaminu D navíc podával ještě vápník v dávce 1000 mg denně.
Suplementace vápníkem a vitaminem D je účinnou prevencí sekundární hyperparatyreózy. Protože příjem vitaminu D v potravě je zanedbatelný a u starších osob je nedostatečná expozice slunečnímu záření a schopnost kůže tvořit vitamin D s věkem klesá (37), je pro prevenci zlomenin u osob se sérovou koncentrací 25hydroxyvitaminu D <50 nmol/l doporučeno zajistit saturaci vitaminem D pravidelným podáváním 800 IU vitaminu D denně (nebo 6 000 IU jednou týdně). Současně je třeba individuálně zohlednit příjem vápníku potravou (při vyloučení mléka a mléčných výrobků činí průměrně 400–500 mg) a potřebný denní příjem dalších 500–600 mg vápníku zajistit mléčnými výrobky nebo tabletou kalcia (s výhodou večer). Suplementaci vitaminem D a případně vápníkem může zajišťovat praktický lékař.
Po zlomenině v oblasti kyčle se těžká deficience vitaminu D (koncentrace 25hydroxyvitaminu D pod 25 nmol/l) prokazuje u většiny pacientů (38). Zajištění dostatečného příjmu vitaminu D, tak aby sérové koncentrace 25hydroxyvitaminu D dosáhly alespoň 75 nmol/l, snižuje u pacientů po zlomenině riziko pádů a upravuje sekundární hyperparatyreózu (39). Suplementace 800 IU vitaminu D denně se v prevenci zlomenin uplatňuje více, než suplementace 400 IU (40). V metaanalýze u osob v domovech dlouhodobé péče snižovala suplementace vápníkem a vitaminem D riziko zlomenin v oblasti kyčle statisticky významně (0,86; 0,74–0,98) (41). Jedním z vysvětlení lepší účinnosti této suplementace u osob v domovech dlouhodobé péče než v běžné populaci je výchozí nízký příjem vápníku ve srovnání s běžnou populací a lepší compliance (42, 43). Naopak v kontrolovaných studiích v běžné populaci, kde byla compliance nízká (40 %, resp. 60 %), nebyla účinnost suplementace vápníkem a vitaminem D prokázána (44). Metaanalýza dvanácti kontrolovaných studií suplementace vápníkem a vitaminem D prokázala významné snížení rizika neobratlových zlomenin (0,86; 0,77–0,96). V metaanalýze osmi kontrolovaných studií nebylo snížení rizika zlomenin prox. femuru průkazné (0,91; 0,78–1,05) (45). Pokud však byly uvažovány jen studie, kde se podával vitamin D v denní dávce vyšší než 400 IU, bylo snížení rizika zlomenin prox. femuru průkazné (0,82; 0,69–0,97). Důležitá je tedy optimální denní dávka vitaminu D 800 IU a dobrá dlouhodobá compliance. Již za 6 týdnů po vysazení suplementace vápníkem a vitaminem D se prokazuje zvýšená sérová koncentrace PTH a zvýšená osteoresorpce (46).
U starých osob bylo snížení rizika zlomeniny v oblasti kyčle průkazné při suplementaci vitaminem D a vápníkem (0,82; 0,71–0,94), ale nebylo průkazné při suplementaci samotným vitaminem D (1,10; 0,89–1,36) (47). Dvě metaanalýzy prokázaly, že suplementace vitaminem D a vápníkem snižuje riziko zlomeniny prox. femuru o 25 % (0,75; 0,58–0,96) v porovnání se suplementací samotným vitaminem D.
U pacientů, kteří již prodělali zlomeninu proximálního femuru, byla účinnost suplementace vápníkem (1 000 mg) a vitaminem D (800 IU) hodnocena v jedné kontrolované studii (48). Riziko neobratlových zlomenin u těchto pacientů bylo sníženo v průměru na polovinu. Výsledek nedosáhl statistické významnosti, protože bylo sledováno jen 150 pacientů. Přesto lze suplementaci vápníkem a vitaminem D v doporučených denních dávkách považovat za nezbytnou také u pacientů po zlomenině v oblasti kyčle.
Doporučení. U pacientů se zlomeninou v oblasti kyčle má být zajištěno dostatečné zásobení vitaminem D. Hned při hospitalizaci pro zlomeninu má pacient dostat 3 ml Vigantolu (1,5 mg, resp. 60 000 IU vitaminu D3) a potom podávat buď 800 IU vitaminu D denně, nebo 6000 IU vitaminu D jednou týdně (49). Účinnost suplementace lze ověřit stanovením sérové koncentrace 25hydroxyvitaminu D. Pokud je koncentrace 25hydroxyvitaminu D v séru nižší než 50 nmol/l, je vhodné opakovat podání vitaminu D3 (50).
3. Farmakologická léčba.
Udržení nebo zlepšení kvality kostní hmoty lze dosáhnout dvěma farmakologickými přístupy, zpomalením kostní remodelace antiresorpčními léky anebo stimulací novotvorby kostní hmoty. Pro volbu vhodného antiosteoporotického léku u pacientů se zlomeninou proximálního femuru je třeba zvažovat nejenom účinnost dlouhodobé léčby, ale také její bezpečnost pro kost i další tkáně a účinky na hojení zlomeniny (21, 22).
Antiresorpční (antiosteokatabolické) léky zpomalují úbytek kostní hmoty a zhoršování mikroarchitektury kosti. Při léčbě pokračuje sekundární mineralizace kosti. Přehled registrovaných antiresorpčních léků je uváděn v jiných doporučených postupech (51). Skupiny antiresorpčních léků se liší mechanismem účinku. Registrované aminobisfosfonáty se liší především způsobem podávání (alendronát v dávce 70 mg a risedronát v dávce 35 mg perorálně jednou za týden, ibandronát perorálně v dávce 150 mg jednou za měsíc, zoledronát v 15minutové infuzi jednou za rok. Rozdílný způsob podávání platí i pro další léky. Stroncium ranelát se podává perorálně večer nejméně 2 hodiny po posledním jídle, denosumab injekcí do podkoží jednou za 6 měsíců.
Pouze několik studií poskytlo data o účinnosti léků u pacientů starších 70–75 let, tedy ve věku, kdy se v klinické praxi zlomeniny v oblasti kyčle nejvíce uplatňují (tab. 2).
Tab. 2. Klinické studie účinků antiosteoporotických léků na riziko zlomenin u starších pacientů s osteoporózou. 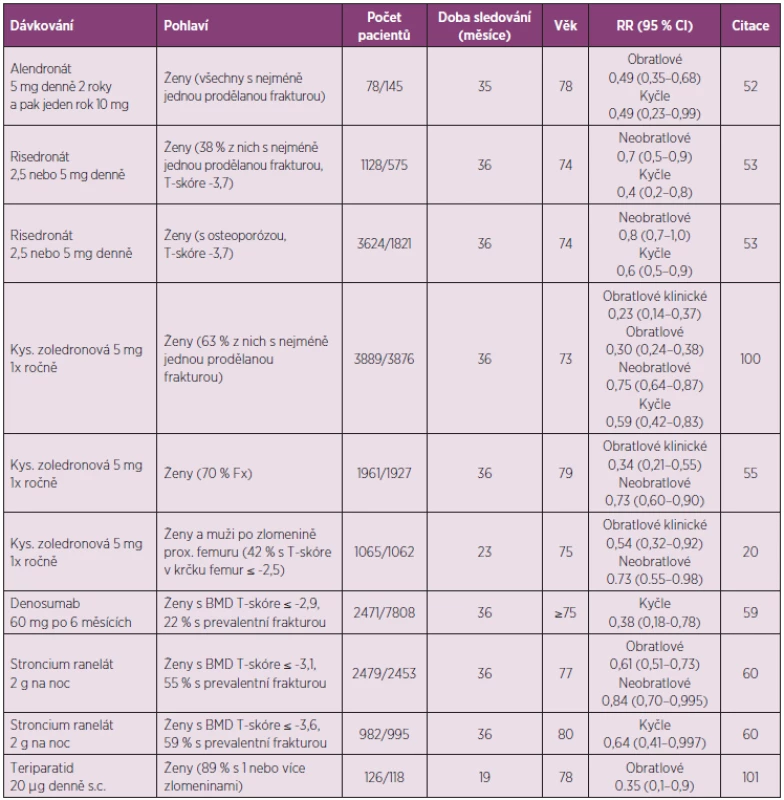
Léčba alendronátem při osteoporóze u žen ve věku nad 75 let snížila riziko zlomeniny proximálního femuru, nikoli však neobratlových zlomenin celkově (52). Léčba risedronátem po 3 letech průkazně snížila riziko neobratlových zlomenin i zlomenin proximálního femuru u žen ve věku 70–79 let, pokud měly prokázanou prevalentní zlomeninu. Riziko zlomenin proximálního femuru léčba risedronátem snižovala i u žen zařazených do studie, protože měly osteoporózu, ale snížení rizika neobratlových zlomenin bylo hraniční (p = 0,03). U starších žen (v průměru 83 let), zařazených do studie jen s přihlédnutím k přítomnosti jednoho z klinických rizikových faktorů zlomeniny, nebylo snížení rizika zlomenin průkazné (53). Risedronát průkazně (o 69 %) snížil incidenci rekurentní zlomeniny v oblasti kyčle (54). Kys. zoledronová u starších žen (prům. věk 79 let) průkazně snižovala riziko klinických zlomenin obratlů a neobratlových zlomenin (55). U žen a mužů se zlomeninou v oblasti kyčle (prům. věk 75 let) bylo po jednom roce od podání kys. zoledronové prokázáno snížení rizika neobratlových zlomenin (20). Mortalita byla u léčených pacientů nižší o 28 % než u pacientů kontrolní skupiny (p < 0,01). Účinnost ibandronátu na snížení rizika zlomenin byla v klinických studiích ověřena u žen v průměrném věku 66 let, ale a u pacientů ve věku 75 let nebo starších nebyla cíleně studována.
Před zahájením léčby aminobisfosfonáty je nezbytné zkontrolovat a případně upravit kalcémii a saturaci vitaminem D. Při léčbě musí být zajištěn doporučený denní příjem vápníku (1 200 mg) a vitaminu D (800 IU). Aminobisfosfonáty jsou kontraindikovány při alergii na tyto léky a nedoporučují se při kontraindikaci užívání vápníku nebo vitaminu D, při koncentraci vápníku v séru pod 2,1 mmol/l a nad 2,65 mmol/l, při insuficienci vitaminu D (S-25(OH)D pod 50 nmol/l), při leukopenii (pod 2 500 /µl), zvýšení ALT nad dvojnásobek normy, snížení S-albuminu pod 30 g/l a clearance kreatininu obvykle pod 0,5 ml/sec. Mezi jednotlivými bisfosfonáty jsou drobné rozdíly. U pacientů se zhoršenou funkcí jater nebo s clearance kreatininu ≥ 0,67 ml/sec není nutná úprava dávkování. První podání aminobisfosfonátů může navodit reakci akutní fáze, jejíž příznaky lze snížit podáváním paracetamolu (56).
Po 4–5 letech léčby aminobisfosfonáty je vhodné zvážit její pokračování. Incidence atypických zlomenin (3–50 na 100 000 pacient-roků) se zvyšuje s trváním léčby aminobisfosfonáty (22, 57). Incidence osteonekrózy čelisti u pacientů léčených aminobisfosfonáty se uvádí mezi 1 až 90 na 100 000 pacient-roků. Osteonekróza čelisti může být závažnou komplikací stomatochirurgických výkonů zejména u pacientů se špatnou ústní hygienou (58). Je výrazně častější při parenterálním podávání bifosfonátů, při současné kortikoterapii a především při vyšších dávkách, používaných v onkologické léčbě. Při zvažování léčby u pacientů se zlomeninou v oblasti kyčle je tedy velmi důležitá informace o předchozí antiosteoporotické terapii. Užívání perorálních aminobisfosfonátů není vhodné u pacientů neschopných zůstat ve vzpřímené poloze po dobu 30 minut, při krvácení do GIT v posledním roce a při zvýšeném riziku tohoto krvácení, u pacientů s rekurentní nebo aktivní vředovou chorobou gastroduodenální, gastroezofageálním refluxem, nebo pokud je prokázána striktura, achalasie nebo porucha motility jícnu.
Denosumab je účinnou léčbou osteoporózy také u žen ve věku 75 let nebo starších. Do klinické studie denosumabu bylo zařazeno 31,7 % žen této věkové skupiny a studie proto měla statistickou sílu hodnotit vliv léčby na riziko nových zlomenin obratlů i kyčle. Po 3 letech léčení denosumabem u žen ve věku ≥ 75 let průkazně snížila incidence zlomeniny prox. femuru (1,4 % absolutní snížení rizika, snížení relativního rizika o 62 %, p = 0,007) v porovnání se ženami, které dostávaly placebo (59). Zvýšení BMD a snížení rizika zlomenin obratlů nebylo významně ovlivněno funkcí ledvin (2 817 žen mělo GFR mezi 0,5–1 ml /sec a 73 žen mělo GFR mezi 0,25–0,5 ml/sec). Po podání 60 mg denosumabu pacientům s osteoporózou přetrvává antiresorpční účinek léku nejméně 6 měsíců, ale ke konci každého dávkovacího intervalu se sérové markery osteoresorpce v průměru upravují do dolního pásma referenčních mezí. Při pokračující léčbě denosumabem se BMD průběžně zvyšuje. Léčba nemá závažné nežádoucí účinky, ale kožní vyrážky a ekzémy byly častější u žen léčených denosumabem (3 %) než v placebové skupině (1 %, p < 0,001). Denosumab se nehromadí ve skeletu a jeho účinky na osteoklastickou osteoresorpci jsou po vysazení léku rychle reverzibilní. Útlum remodelace kosti v období mezi injekcemi léku a s dobou léčení odeznívá. U starších pacientů je výhodou léčby denosumabem nejenom způsob podání a nepřítomnost reakce akutní fáze, ale také možnost léčit osoby se sníženou funkcí ledvin. Clearance denosumabu není ovlivněna věkem ani renálními funkcemi a při podávání denosumabu se není třeba obávat nefrotoxicity.
Atypické zlomeniny nebyly v registrační studii denosumabu zjištěny, ale při dalším sledování došlo k této fraktuře u dvou ze 4 550 léčených žen. V post-marketingovém sledování bezpečnosti léčby byly u žen dříve léčených aminobisfosfonáty potvrzeny 4 atypické zlomeniny na 1,25 mil. pacient-roků. V post-marketingovém sledování bezpečnosti léčby denosumabem bylo hlášeno 32 případů ONJ na 1,25 mil. pacient /roků (z toho 29 žen dříve bralo bisfosfonát). Také před zahájením léčby denosumabem je vhodné ověřit saturování pacienta vitaminem D a během léčby trvale zajišťovat doporučený celkový denní příjem vápníku (1 200 mg) a vitaminu D (800 IU). Riziko hypokalcémie je zvýšené u pacientů s malabsorpcí a při snížení renálních funkcí (clearance kreatininu < 0,5 ml/sec).
Léčba stroncium ranelátem po 3 letech u žen ve věku průměrně 77 let hraničně snížila riziko neobratlových zlomenin, riziko zlomeniny v oblasti kyčle však průkazně neovlivnila. Hraniční snížení rizika zlomeniny v oblasti kyčle bylo prokazatelné až u žen, vybraných na základě velmi nízkého BMD T-skóre ≤ -3,6 (60). Po dalších dvou letech, kdy ve studii zůstalo 53 % žen, byly výsledky obdobné. Nedoporučuje se podávat stroncium ranelát pacientům se závažným poškozením funkce ledvin (clearance kreatininu < 0,5 ml/sec) a s rizikem tromboembolie, ischemickou chorobou srdeční a nekorigovanou hypertenzí. Závažnou komplikací zdravotního stavu může být DRESS syndrom (61).
Osteoanabolický teriparatid (PTH 1-34) je registrován pro léčbu postmenopauzální osteoporózy, osteoporózy u mužů a glukokortikoidy indukované osteoporózy po dobu 24 měsíců. Lék se aplikuje s.c. jednou denně pomocí injekčního péra. Zajištění dostatečného denního přívodu vápníku (1-1,5 g denně) a vitaminu D (800 IU denně) je nutným předpokladem pro plnou účinnost léčby. Účinnost teriparatidu na snížení rizika obratlových a neobratlových zlomenin, prokázaná v registrační klinické studii, byla ověřena údaji z klinické praxe, kde velká studie prokázala po 24 měsících také snížení rizika zlomeny v oblasti kyčle (v přehledu(62)).
V registrační klinické studii teriparatidu bylo riziko zlomenin obratlů sníženo také u osob ve věku 75 let nebo starších (o 65 %, p < 0,05), ale vzhledem k nízkému počtu osob starších 75 let nebylo u nich možné hodnotit účinnost léčby na snížení rizika neobratlových zlomenin (tab. 2). Léčba teriparatidem byla i u pacientů starších 75 let bezpečná a incidence hyperkalcemie je u nich nižší, než u mladších osob (63). Bylo to potvrzeno i údaji u 589 žen ve věku ≥ 75 let, které byly teriparatidem léčeny pro těžkou osteoporózu v běžné klinické praxi. Po 30 měsících sledování se riziko klinických zlomenin v porovnání s incidencí v prvních 6 měsících snížilo o 80 % (64). Léčba nemá být zahajována u pacientů s nevysvětleným zvýšením sérové alkalické fosfatázy, při osteomalacii, deficienci vitaminu D a Pagetově kostní chorobě, při alergii na lék, při hyperkalcémii, a u pacientů dříve léčených ozařováním skeletu a při nádorovém onemocnění. Protože podávání léku je omezeno na dva roky, je třeba dosažený účinek dlouhodobě udržovat antiresorpční léčbou.
Hojení zlomenin
Hojení zlomenin proximálního femuru je u starších pacientů s osteoporózou zpomaleno (65). Při insuficienci vitaminu D se hojení zlomenin podle některých studií výrazněji nezhoršuje, jiné studie ale uvádějí u pacientů se zlomeninou vhodnost suplementace vitaminem D (v přehledu (66)).
Aminobisfosfonáty ani denosumab nezhoršují hojení zlomenin (67, 68). V experimentálních modelech byla remodelace svalku zpomalena aminobisfosfonáty i denosumabem, ale mechanická síla svalku se proti kontrolám zlepšila (69, 70).
Při osteoanabolické terapii se hojení zlomenin podle preklinických studií, jedné klinické studie a řady kazuistik zrychluje (63, 71–74). Osteoanabolická léčba se také uvádí jako možné řešení při atypických zlomeninách proximálního femuru u pacientů s dlouhodobě utlumenou remodelací kosti při léčbě aminobisfosfonáty (57).
Doporučeni
Cílem léčby osteoporózy je snížit riziko zlomenin. U pacientů se zlomeninou proximálního femuru je třeba obnovit dříve ztracenou kostní hmotu, zlepšit mikroarchitekturu kosti a snížit tak pravděpodobnost další zlomeniny. Při koordinaci systematické péče o pacienty s prodělanou nízkotraumatickou (osteoporotickou) zlomeninou mají vedoucí úlohu ortopedičtí chirurgové, kteří se s pacienty setkávají jako první. Ortopedické pracoviště může potřebnou sekundární prevenci zlomenin zajišťovat samo, anebo může zhodnotit rizika další zlomeniny (slouží k tomu validovaný algoritmus FRAX). V propouštěcí zprávě má traumatolog doporučit další potřebná opatření (75). Čeští praktičtí lékaři, kteří tuto zprávu dostávají, však mohou pacientovi předepsat pouze vápník a vitamin D a případně mohou doporučit odborné osteologické vyšetření. Dostupnost těchto vyšetření je přitom z řady důvodů limitována. Česká úhradová vyhláška umožňuje ortopedickým chirurgům i dalším specialistům, aby pacientům s nízkotraumatickou zlomeninou zajišťovali účinnou antiosteoporotickou léčbu, aniž by byla nutná osteodenzitometrie. Lékař však má před zahájením léčby zajistit diferenciální diagnostiku kostních onemocnění, která jsou spojena se zvýšeným rizikem zlomenin. Lékař také má individuálně zvažovat účinky zvoleného léku na hojení prodělané zlomeniny, na budoucí bezpečnost léku pro kost i ostatní tkáně a jak bude lék tolerován. Je také vhodné zvážit, v jakém stupni lék snižuje u starých pacientů riziko obratlových a neobratlových zlomenin (v oblastech skeletu s převážně trámčitou nebo kortikální kostní hmotou).
Metodou první volby u pacientů se zlomeninou prox. femuru a vysokou pravděpodobností dalších zlomenin (hodnocenou nástrojem FRAX) by měla být osteoanabolická léčba, která obnovuje dříve ztracenou trámčitou i kortikální kostní hmotu. Navíc je při osteoanabolické léčbě zajištěna převaha novotvorby nad osteoresorpcí a proto se také stará a křehká kost nahrazuje novou a mechanicky kompetentní kostní hmotou. Osteoanabolická léčba je pacienty zpravidla dodržována, protože pacienti pozitivně vnímají její účinky (klesá bolest a zlepšuje se kvalita života) (76).
Pokud pro osteoanabolickou léčbu nejsou u daného pacienta splněny požadavky platné úhradové vyhlášky, lze antiresorpčními léky zpomalit zhoršování mikroarchitektury kosti a nárůst rizika nové zlomeniny s věkem. Na základě výsledků kontrolovaných klinických studií lze pacientům ve věku ≥75 let po zlomenině v oblasti kyčle doporučit alendronát, risedronát, kys. zoledronovou a denosumab. Parenterálně podávané léky, denosumab nebo kys. zoledronová, jsou vhodné zejména u pacientů, kteří netolerují nebo nemohou užívat perorální aminobisfosfonáty. U pacientů po zlomenině v oblasti kyčle je nezbytné zajištění vzpřímené polohy po dobu 30 minut po užití tablety aminobisfosfonátu. Klinické situace, kdy není vhodné podávání perorálních aminobisfosfonátů, jsou jednou z doporučených indikací parenterální léčby kys. zoledronovou nebo denosumabem. Parenterální podání uvedených léků zajišťuje 100 % compliance (lék je užíván předepsaným způsobem všemi nemocnými) a zlepšení perzistence k léčbě (doba od zahájení léčby do jejího ukončení). Při zajištěné saturaci vitaminem D a po vyloučení jiných metabolických onemocnění skeletu není třeba zahájení léčby denosumabem nebo kys. zoledronovou u pacientů nízkotraumatickou zlomeninou v oblasti kyčle odkládat na dobu po ukončení hospitalizace. Kys. zoledronová má být podána až za 6 týdnů po zlomenině proximálního femuru (77). Při antiresorpční i osteoanabolické terapii u pacientů s incidentní zlomeninou v oblasti kyčle je třeba respektovat indikační omezení SÚKL, podle kterého je dlouhodobá léčba podmíněna osteodenzitometrickým průkazem účinnosti léku.
Compliance a dlouhodobé setrvání pacientů na léčbě (78–80) je základní podmínkou, aby se při chronickém onemocnění osteoporózou zůstávalo riziko zlomenin nižší, než by tomu bylo bez léčby. I při plné compliance však zůstává riziko zlomenin zvýšené (81). Adherence (compliance a persistence) ≥ 80 % po dobu dvou let znamená nejméně o 16 % nižší incidenci zlomenin. Téměř polovina žen však ukončuje léčbu perorálními aminobisfosfonáty do 6 měsíců. Mezi příčinami nedostačující adherence k léčbě se uvádějí mj. neinformovanost pacienta o onemocnění a o přínosech a výsledcích léčby, ale také nežádoucí účinky léčby a složitý režim užívání léků, častá záměna lékových přípravků a další faktory. Perzistence (doba od zahájení léčby do jejího ukončení) se odvíjí od zkušenosti pacienta s předchozím podáním a závisí na intenzitě a trvání nežádoucích reakcí. Reakce akutní fáze, která může nastat po parenterálním i perorálním podání aminobisfosfonátů, je nejčastějším důvodem odmítnutí další aplikace ze strany pacienta. Perzistence závisí také na zlepšení kvality života pacient při léčbě a bývá nízká u pacientů, kteří po několika měsících nepociťují účinky užívání léku.
Parenterální podání léku zajišťuje celou doporučenou dávku (100 % compliance, tedy dodržení režimu léčby, užívání léku doporučeným způsobem) až do dalšího podání léku. Účinek podaného léku trvá v případě parenterálně podaného ibandronátu 3 měsíce, u denosumabu 6 měsíců, u kys. zoledronové nejméně jeden rok. Součástí compliance při parenterálním podání aminobisfosfonátu mají být opatření, která zmírňují příznaky reakce akutní fáze a zlepší tak persistenci k léčbě. Při léčbě perorálními aminobisfosfonáty se dodržováním režimu podání léku (nalačno, zapít, 30–60 minut nesnídat) zajišťuje nejenom účinnost, ale také se tím předejde nežádoucím gastrointestinálním komplikacím. Pokud se ale lék neužívá pravidelně doporučeným postupem, neklesá dostatečně riziko zlomenin a po nové zlomenině pak může pacient léčbu odmítat jako neúčinnou.
C. Opatření ke snížení rizika a následků pádů
Protektory kyčlí. Statisticky významné snížení rizika zlomeniny kyčle u osob, které pravidelně užívaly protektory kyčlí, je prokazováno staršími studiemi (82). Podle dalších studií jsou účinnost i ekonomický přínos tohoto opatření pochybné (83). Možný efekt protektorů kyčlí záleží na adherenci k tomuto opatření (84–86).
Úprava modifikovatelných rizikových faktorů v domácím prostředí (nerovných povrchů, úprava obuvi, osvětlení, poruch vidění) snižuje riziko pádů (87). V kontrolované studii utrpělo během roku pád 45 % kontrol a jen 36 % pacientů, kteří po návratu z nemocnice upravili své domácí prostředí podle odborného doporučení (88).
Cvičení ke zlepšení rovnováhy, svalové síly, nácvik chůze, pádů a zdvíhání těžších předmětů musejí být přiměřené věku a zdravotnímu stavu pacienta a při jejich indikaci je nutné zvažovat a eliminovat rizika traumatických fraktur, přetížení kostní hmoty a kloubních komplikací. Cvičení mají respektovat místa pohybového aparátu, kde jsou tato rizika zvýšená. Cvičení zlepšující rovnováhu pacientů prokazatelně snižují riziko pádů (89). Důležitý je dlouhodobý domácí cvičební program (90). V randomizované studii, kde byla zajištěna multidisciplinární péče s intenzivním tréninkem, se riziko pádů významně snižovalo se zlepšením adherence k rehabilitačnímu programu (91).
Úprava medikace a léčba jiných onemocnění, která může ovlivnit riziko pádů a zlomenin: katarakta, demence, glukokortikoidy, diuretika, antihypertenziva, blokátory protonové pumpy, léky s pro-arytmogenním účinkem (např. betablokátory, digitalis), anemizující léky (dikumariny, nesteroidní antirevmatika), hypnotika, neuroleptika, antidepresiva, některá antiepileptika, analgetika (opioidy včetně tramadolu a opiáty) (92).
Úprava výživy a zásobení vitaminem D (93, 94). Nedostatek vitaminu D je významným modifikovatelným faktorem rizika pádů. Uplatňovat se může nízká koncentrace kalcitriolu v krvi při nedostatečném zásobení organismu vitaminem D, nebo při nedostatečné schopnosti ledvin vytvářet kalcitriol, uplatňovat se může také počet nebo afinita receptorů vitaminu D ve svalové tkáni (95).
D. Souhrn, organizační zajištění sekundární prevence nízkotraumatických zlomenin
Cílem doporučených opatření u pacientů po zlomenině v oblasti kyčle je zabránit dalšímu zhoršování kvality kostní hmoty a snížit riziko dalších zlomenin.
1. Propuštění pacienta po chirurgickém ošetření zlomeniny prox. femuru (do domácího ošetření, zařízení následné péče nebo zpět do institucí) má být provázeno zhodnocením rizika další zlomeniny a doporučením léčby osteoporózy nebo dalších vhodných vyšetření. To má být uvedeno v propouštěcí zprávě při předání pacientů do domácího ošetření, zařízení následné péče nebo zpět do institucí (75).
2. Praktický lékař zná podrobně pacientovy anamnestické údaje (zlomeniny u pacienta a jeho rodičů, kouření, abúzus alkoholu), jeho funkční stav, komorbidity (chronická zánětlivá onemocnění, diabetes mellitus) a medikace, které mohou ovlivnit riziko pádů a zlomenin. Může proto na základě propouštěcí zprávy zajistit pro pacienty nejenom doporučený příjem vápníku a vitaminu D, ale také opatření k prevenci pádů, rehabilitaci a vyžádat doporučení nebo zajištění antiosteoporotické léčby specialistou. Domácí i zahraniční zkušenosti však zatím ukazují nízkou účinnost delegování opatření, potřebných pro sekundární prevenci zlomenin, na praktické lékaře (96, 97). Uplatnění sekundární prevence zlomenin v České republice komplikují také podmínky preskripce léků, nízká informovanost nebo nezájem praktických lékařů a nerespektování doporučených postupů (98).
3. Před zahájením léčby je vždy nezbytné diferenciálně diagnosticky vyloučit jako příčinu prodělané zlomeniny jiné metabolické nebo nádorové osteopatie, než osteoporózu. Při volbě léku u pacientů po zlomenině proximálního femuru je třeba zohlednit úhradu léčby v České republice. Diferenciálně diagnostická vyšetření a indikaci léčby pacientů po zlomenině prox. femuru má zajistit příslušné odborné pracoviště (zpravidla klinický osteolog, ortopéd, revmatolog, endokrinolog nebo internista). Osteoporóza je chronickým onemocněním, vyžadujícím dlouhodobou farmakoterapii, kterou je po nízkotraumatické zlomenině proximálního femuru třeba zahájit co nejdříve a kterou proto nelze u pacientů s recentní zlomeninou v oblasti kyčle podmiňovat osteodenzitometrickým vyšetřením. U pacienta s recentní zlomeninou je však třeba zajistit vyšetření pomocí DXA co nejdříve to umožní jeho zdravotní stav, nejpozději však do 6 měsíců a opakovat ho za 2 roky po zlomenině. Individuální pravděpodobnost dalších zlomenin u neléčeného pacienta lze posoudit pomocí nástroje FRAX i bez měření BMD (http://www.shef.ac.uk/FRAX/tool.aspx?country=39).
4. Pacienti mají být předáni do dlouhodobé odborné péče osteologického pracoviště nebo osteocentra (pokud to jeho kapacita umožňuje), zvláště pak všichni pacienti s komplikovaným průběhem choroby, diferenciálně diagnostickými problémy, sekundární osteoporózou, s poruchou funkce ledvin (clearance kreatininu ≤ 0,6 ml/sec) a s podezřením na hyperfunkci štítné žlázy, hyperkortizolismus, Pagetovu kostní nemoc, osteomalacii, prim. hyperparatyreózu nebo malignitu. Současné komorbidity je nutné léčit v úzké spolupráci s dalšími odborníky (nefrology, onkology, alergology a dalšími).
5. Pro indikaci osteoanabolické léčby mají být do dlouhodobé odborné péče osteocentra předáni a) pacienti, kteří již před zlomeninou prodělali více než jednu zlomeninu obratle, dostávali nejméně dva roky antiresorpční lék a mají při denzitometrii hodnotu BMD ≤ -3 T-skóre, b) všichni pacienti léčení glukokortikoidy s BMD ≤ -2,5 T-skóre.
6. Některé z výše uvedených problémů řeší systém, označovaný jako Fracture Liaison Service (99). Tento systém integruje standardy péče ortopedických chirurgů, praktických lékařů a specialistů (osteologů, endokrinologů, internistů) tak, aby se potřebné péče dostalo všem pacientům s nízkotraumatickou zlomeninou. V systému je klíčovou osobou sestra, která v daném zdravotnickém zařízení zajišťuje, aby u všech pacientů, kteří jsou pro zlomeninu ošetření na oddělení ortopedické chirurgie, bylo provedeno osteodenzitometrické a laboratorní vyšetření a posouzení rizika pádů pravděpodobnosti prodělat v dalších 10 letech zlomeninu (http://www.shef.ac.uk/FRAX), zajišťuje rehabilitace a edukační programy a preskripci léků, které zlepší kvalitu kostní hmoty a sníží riziko zlomenin. V Evropě je tento systém manažersky zajišťován projektem SCOPE (www.iofbonehealth.org/scope-scorecard-osteoporosis-europe), který monitoruje, jak je v zemích Evropské unie zajišťována péče o pacienty se zlomeninami a může proto být cenným vodítkem pro zdravotnické autority.
Práce vznikla v rámci Výzkumného záměru MZd ČR 0002384101 a MZd ČR 000237280
Článek bude současně publikován v časopise Osteologický bulletin 2015.
Adresa pro korespondenci:
Prof. MUDr. Karel Pavelka, DrSc.
Revmatologický ústav
a Revmatologická klinika 1. LF UK
Na Slupi 4
128 50 Praha 2
Tel. 234 075 244
e–mail: pavelka@revma.cz
Zdroje
1. Haentjens P, Magaziner J, Colon–Emeric CS, et al. Meta–analysis: excess mortality after hip fracture among older women and men. Ann Intern Med 2010; 152(6): 380–90.
2. Boonen S, Autier P, Barette M, Vanderschueren D, Lips P, Haentjens P. Functional outcome and quality of life following hip fracture in elderly women: a prospective controlled study. Osteoporos Int 2004; 15(2): 87–94.
3. Hallberg I, Bachrach–Lindstrom M, Hammerby S, Toss G, Ek AC. Health-related quality of life after vertebral or hip fracture: a seven–year follow–up study. BMC Musculoskelet Disord 2009; 10 : 135.
4. Štěpán J, Šmíd M, Prokeš M, et al. Ekonomicke aspekty osteoporózy. [Economic aspects of osteoporosis]. Čas Lék Česk 1998; 137(23): 707–15.
5. Burge R, Dawson–Hughes B, Solomon DH, Wong JB, King A, Tosteson A. Incidence and economic burden of osteoporosis–related fractures in the United States, 2005–2025. J Bone Miner Res 2007; 22(3): 465–75.
6. Cooper C. The crippling consequences of fractures and their impact on quality of life. Am J Med 1997; 103(2a): 12s–7s.
7. Johansson H, Kanis JA, Oden A, Johnell O, McCloskey E. BMD, clinical risk factors and their combination for hip fracture prevention. Osteoporos Int 2009; 20(10): 1675–82.
8. Klotzbuecher CM, Ross PD, Landsman PB, Abbott TA, 3rd, Berger M. Patients with prior fractures have an increased risk of future fractures: a summary of the literature and statistical synthesis. J Bone Miner Res 2000; 15(4): 721–39.
9. Omsland TK, Emaus N, Tell GS, et al. Ten-year risk of second hip fracture. A NOREPOS study. Bone 2013; 52(1): 493–7.
10. Vochteloo AJ, Borger van der Burg BL, Roling MA, et al. Contralateral hip fractures and other osteoporosis–related fractures in hip fracture patients: incidence and risk factors. An observational cohort study of 1,229 patients. Arch Orthop Trauma Surg 2012; 132(8): 1191–7.
11. Skála–Rosenbaum J, Dzupa V, Bartoška R, Říha D, Waldauf P, Bača V. Subsequent contralateral hip fractures: can at-risk patients be identified? An observational study of 5,102 patients. Int Orthop 2015 ; 39(4): 755–60.
12. Berry SD, Samelson EJ, Hannan MT, et al. Second hip fracture in older men and women: the Framingham Study. Arch Intern Med 2007; 167(18): 1971–6.
13. Papaioannou A, Wiktorowicz M, Adachi JD, Goeree R, Papadimitropoulos E. Mortality, independence in living, and re-fracture, one year following hip fracture in Canadians. J Soc Obstet Gynaecol Can 2000; 22 : 591–7.
14. von Friesendorff M, Besjakov J, Akesson K. Long-term survival and fracture risk after hip fracture: a 22-year follow-up in women. J Bone Miner Res 2008; 23(11): 1832–41.
15. Ryg J, Rejnmark L, Overgaard S, Brixen K, Vestergaard P. Hip fracture patients at risk of second hip fracture: a nationwide population–based cohort study of 169,145 cases during 1977–2001. J Bone Miner Res 2009; 24(7): 1299–307.
16. Papaioannou A, Kennedy CC, Ioannidis G, et al. The osteoporosis care gap in men with fragility fractures: the Canadian Multicentre Osteoporosis Study. Osteoporos Int 2008; 19(4): 581–7.
17. Roerholt C, Eiken P, Abrahamsen B. Initiation of anti-osteoporotic therapy in patients with recent fractures: a nationwide analysis of prescription rates and persistence. Osteoporos Int 2009; 20(2): 299–307.
18. Solomon DH, Johnston SS, Boytsov NN, McMorrow D, Lane JM, Krohn KD. Osteoporosis Medication Use after Hip Fracture in U.S. Patients between 2002 and 2011. J Bone Miner Res 2014; 29(9): 1929–37.
19. Kim SC, Kim MS, Sanfelix-Gimeno G, et al. Use of osteoporosis medications after hospitalization for hip fracture: a cross–national study. Am J Med 2015; 128(5): 519–26.
20. Lyles KW, Colon-Emeric CS, Magaziner JS, et al. Zoledronic acid and clinical fractures and mortality after hip fracture. N Engl J Med 2007; 357(18): 1799–809.
21. Misof BM, Fratzl-Zelman N, Paschalis EP, Roschger P, Klaushofer K. Long–term safety of antiresorptive treatment: bone material, matrix and mineralization aspects. BoneKEy Rep 2015; 4 : 634.
22. Reid IR. Efficacy, effectiveness and side effects of medications used to prevent fractures. J Intern Med 2015; 277(6): 690–706.
23. WHO. Assessment of fracture risk and its application to screening for postmenopausal osteoporosis. Report of a WHO Study Group. Geneva: World Health Organisation; 1994.
24. Bliuc D, Alarkawi D, Nguyen TV, Eisman JA, Center JR. Risk of Subsequent Fractures and Mortality in Elderly Women and Men With Fragility Fractures With and Without Osteoporotic Bone Density: The Dubbo Osteoporosis Epidemiology Study. J Bone Miner Res 2015; 30(4): 637–46.
25. Nguyen TV, Center JR, Eisman JA. Femoral neck bone loss predicts fracture risk independent of baseline BMD. J Bone Miner Res 2005; 20(7): 1195–201.
26. Leslie WD, Majumdar SR, Morin SN, Lix LM. Why does rate of bone density loss not predict fracture risk? J Clin Endocrinol Metab 2015; 100(2): 679–83.
27. Langsetmo L, Goltzman D, Kovacs CS, et al. Repeat low–trauma fractures occur frequently among men and women who have osteopenic BMD. J Bone Miner Res 2009; 24(9): 1515–22.
28. Siris ES, Miller PD, Barrett Connor E, et al. Identification and fracture outcomes of undiagnosed low bone mineral density in postmenopausal women: results from the National Osteoporosis Risk Assessment. JAMA 2001; 286(22): 2815–22.
29. WHO. Assessment of osteoporosis at the primary health care level. Report of a WHO Study Group. Sheffield: University of Sheffield Medical School, UK; 2007.
30. Leslie WD, Lix LM. Comparison between various fracture risk assessment tools. Osteoporos Int 2014; 25(1): 1–21.
31. Bauer DC, Garnero P, Harrison SL, et al. Biochemical markers of bone turnover, hip bone loss, and fracture in older men: the MrOS study. J Bone Miner Res 2009; 24(12): 2032–8.
32. Rizzoli R, Ammann P, Chevalley T, Bonjour JP. Protein intake and bone disorders in the elderly. Joint Bone Spine 2001; 68(5): 383–92.
33. Schurch MA, Rizzoli R, Slosman D, Vadas L, Vergnaud P, Bonjour JP. Protein supplements increase serum insulin–like growth factor–I levels and attenuate proximal femur bone loss in patients with recent hip fracture. A randomized, double-blind, placebo-controlled trial. Ann Intern Med 1998; 128(10): 801–9.
34. Murad MH, Drake MT, Mullan RJ, et al. Comparative Effectiveness of Drug Treatments to Prevent Fragility Fractures: A Systematic Review and Network Meta-Analysis. J Clin Endocrinol Metab 2012; 97 : 1871–80.
35. Reid IR, Bolland MJ. Calcium risk-benefit updated-new WHI analyses. Maturitas 2014; 77(1): 1–3.
36. Adami S, Giannini S, Bianchi G, et al. Vitamin D status and response to treatment in post–menopausal osteoporosis. Osteoporos Int 2009; 20(2): 239–44.
37. Lips P. Vitamin D deficiency and secondary hyperparathyroidism in the elderly: consequences for bone loss and fractures and therapeutic implications. Endocr Rev 2001; 22(4): 477–501.
38. Bischoff–Ferrari HA, Can U, Staehelin HB, et al. Severe vitamin D deficiency in Swiss hip fracture patients. Bone 2008; 42(3): 597–602.
39. LeBoff MS, Hawkes WG, Glowacki J, Yu–Yahiro J, Hurwitz S, Magaziner J. Vitamin D-deficiency and post-fracture changes in lower extremity function and falls in women with hip fractures. Osteoporos Int 2008; 19(9): 1283–90.
40. Bischoff–Ferrari HA, Willett WC, Wong JB, Giovannucci E, Dietrich T, Dawson–Hughes B. Fracture prevention with vitamin D supplementation: a meta-analysis of randomized controlled trials. JAMA 2005; 293(18): 2257–64.
41. Sawka AM, Ismaila N, Cranney A, et al. A scoping review of strategies for the prevention of hip fracture in elderly nursing home residents. PLoS ONE 2010; 5(3): e9515.
42. Avenell A, Gillespie WJ, Gillespie LD, O'Connell D. Vitamin D and vitamin D analogues for preventing fractures associated with involutional and post-menopausal osteoporosis. Cochrane Database Syst Rev 2009(2): CD000227.
43. Tang BM, Eslick GD, Nowson C, Smith C, Bensoussan A. Use of calcium or calcium in combination with vitamin D supplementation to prevent fractures and bone loss in people aged 50 years and older: a meta-analysis. Lancet 2007; 370(9588): 657–66.
44. Grant AM, Avenell A, Campbell MK, et al. Oral vitamin D3 and calcium for secondary prevention of low-trauma fractures in elderly people (Randomised Evaluation of Calcium Or vitamin D, RECORD): a randomised placebo–controlled trial. Lancet 2005; 365(9471): 1621–8.
45. Bischoff–Ferrari HA, Willett WC, Wong JB, et al. Prevention of nonvertebral fractures with oral vitamin D and dose dependency: a meta–analysis of randomized controlled trials. Arch Intern Med 2009; 169(6): 551–61.
46. Prestwood KM, Pannullo AM, Kenny AM, Pilbeam CC, Raisz LG. The effect of a short course of calcium and vitamin D on bone turnover in older women. Osteoporos Int 1996; 6(4): 314–9.
47. Boonen S, Lips P, Bouillon R, Bischoff–Ferrari HA, Vanderschueren D, Haentjens P. Need for additional calcium to reduce the risk of hip fracture with vitamin d supplementation: evidence from a comparative metaanalysis of randomized controlled trials. J Clin Endocrinol Metab 2007; 92(4): 1415–23.
48. Harwood RH, Sahota O, Gaynor K, Masud T, Hosking DJ. A randomised, controlled comparison of different calcium and vitamin D supplementation regimens in elderly women after hip fracture: The Nottingham Neck of Femur (NONOF) Study. Age Ageing 2004; 33(1): 45–51.
49. Bischoff Ferrari HA, Willett WC, Wong JB, Giovannucci E, Dietrich T, Dawson Hughes B. Fracture prevention with vitamin D supplementation: a meta-analysis of randomized controlled trials. JAMA 2005; 293(18): 2257–64.
50. van Groningen L, Opdenoordt S, van Sorge A, Telting D, Giesen A, de Boer H. Cholecalciferol loading dose guideline for vitamin D-deficient adults. Eur J Endocrinol 2010; 162(4): 805–11.
51. Rosa J. Doporučené postupy pro diagnostiku a terapii postmenopauzální osteoporózy II. Osteologický Bull 2007; 12(2): 74–81.
52. Ensrud KE, Black DM, Palermo L, et al. Treatment with alendronate prevents fractures in women at highest risk: results from the Fracture Intervention Trial. Arch Intern Med 1997; 157(22): 2617–24.
53. McClung MR, Geusens P, Miller PD, et al. Effect of risedronate on the risk of hip fracture in elderly women. Hip Intervention Program Study Group. N Engl J Med 2001; 344(5): 333–40.
54. Osaki M, Tatsuki K, Hashikawa T, et al. Beneficial effect of risedronate for preventing recurrent hip fracture in the elderly Japanese women. Osteoporos Int 2012; 23(2): 695–703.
55. Boonen S, Black DM, Colon–Emeric CS, et al. Efficacy and safety of a once-yearly intravenous zoledronic acid 5 mg for fracture prevention in elderly postmenopausal women with osteoporosis aged 75 and older. J Am Geriatr Soc 2010; 58(2): 292–9.
56. Thompson K, Rogers MJ. Statins prevent bisphosphonate-induced gamma,delta-T-cell proliferation and activation in vitro. J Bone Miner Res 2004; 19(2): 278–88.
57. Shane E, Burr D, Abrahamsen B, et al. Atypical subtrochanteric and diaphyseal femoral fractures: second report of a task force of the American society for bone and mineral research. J Bone Miner Res 2014; 29(1): 1–23.
58. Khan AA, Morrison A, Hanley DA, et al. Diagnosis and management of osteonecrosis of the jaw: a systematic review and international consensus. J Bone Miner Res 2015; 30(1): 3–23.
59. Boonen S, Adachi JD, Man Z, et al. Treatment with denosumab reduces the incidence of new vertebral and hip fractures in postmenopausal women at high risk. J Clin Endocrinol Metab 2011; 96(6): 1727–36.
60. Reginster JY, Seeman E, De Vernejoul MC, et al. Strontium ranelate reduces the risk of nonvertebral fractures in postmenopausal women with osteoporosis: Treatment of Peripheral Osteoporosis (TROPOS) study. J Clin Endocrinol Metab 2005; 90(5): 2816–22.
61. Jonville–Bera AP, Autret–Leca E. [Adverse drug reactions of strontium ranelate (Protelos((R)) in France]. Presse Med 2011; 40(10): e453–62.
62. Eriksen EF, Keaveny TM, Gallagher ER, Krege JH. Literature review: The effects of teriparatide therapy at the hip in patients with osteoporosis. Bone 2014; 67 : 246–56.
63. Aspenberg P, Genant HK, Johansson T, et al. Teriparatide for acceleration of fracture repair in humans: a prospective, randomized, double-blind study of 102 postmenopausal women with distal radial fractures. J Bone Miner Res 2010; 25(2): 404–14.
64. Walsh JB, Lems WF, Karras D, et al. Effectiveness of Teriparatide in Women Over 75 Years of Age with Severe Osteoporosis: 36–Month Results from the European Forsteo Observational Study (EFOS). Calcif Tissue Int 2012; 90(5): 373–83.
65. Nikolaou VS, Efstathopoulos N, Kontakis G, Kanakaris NK, Giannoudis PV. The influence of osteoporosis in femoral fracture healing time. Injury 2009; 40(6): 663–8.
66. Gorter EA, Hamdy NA, Appelman-Dijkstra NM, Schipper IB. The role of vitamin D in human fracture healing: a systematic review of the literature. Bone 2014; 64 : 288–97.
67. Gong HS, Song CH, Lee YH, Rhee SH, Lee HJ, Baek GH. Early initiation of bisphosphonate does not affect healing and outcomes of volar plate fixation of osteoporotic distal radial fractures. J Bone Joint Surg Am 2012; 94(19): 1729–36.
68. Adami S, Libanati C, Boonen S, et al. Denosumab treatment in postmenopausal women with osteoporosis does not interfere with fracture-healing: results from the FREEDOM trial. J Bone Joint Surg Am 2012; 94(23): 2113–9.
69. Gerstenfeld LC, Sacks DJ, Pelis M, et al. Comparison of effects of the bisphosphonate alendronate versus the RANKL inhibitor denosumab on murine fracture healing. J Bone Miner Res 2009; 24(2): 196–208.
70. Larsson S, Fazzalari NL. Anti–osteoporosis therapy and fracture healing. Arch Orthop Trauma Surg 2014; 134(2): 291–7.
71. Aspenberg P, Johansson T. Teriparatide improves early callus formation in distal radial fractures. Acta Orthop 2010; 81(2): 234–236.
72. Zhang D, Potty A, Vyas P, Lane J. The Role of Recombinant Pth in Human Fracture Healing: A Systematic Review. J Orthop Trauma 2014; 28(1): 57–62.
73. Ellegaard M, Kringelbach T, Syberg S, et al. The effect of PTH(1–34) on fracture healing during different loading conditions. J Bone Miner Res 2013; 28(10): 2145–55.
74. Peichl P, Holzer LA, Maier R, Holzer G. Parathyroid hormone 1–84 accelerates fracture-healing in pubic bones of elderly osteoporotic women. J Bone Joint Surg Am 2011; 93 : 1583–7.
75. Vaculík J, Dungl P, Malkus T, et al. Péče o pacienty se zlomeninou horního konce stehenní kosti. I. Ortopedická péče. Doporučené postupy České revmatologické společnosti a Společnosti pro metabolická onemocnění skeletu. Čes Revmatologie 2009; 17(3): 134–44.
76. Langdahl BL, Rajzbaum G, Jakob F, et al. Reduction in fracture rate and back pain and increased quality of life in postmenopausal women treated with teriparatide: 18-month data from the European Forsteo Observational Study (EFOS). Calcif Tissue Int 2009; 85(6): 484–93.
77. Eriksen EF, Lyles KW, Colon–Emeric CS, et al. Antifracture efficacy and reduction of mortality in relation to timing of the first dose of zoledronic acid after hip fracture. J Bone Miner Res 2009; 24(7): 1308–13.
78. Siris ES, Harris ST, Rosen CJ, et al. Adherence to bisphosphonate therapy and fracture rates in osteoporotic women: relationship to vertebral and nonvertebral fractures from 2 US claims databases. Mayo Clin Proc 2006; 81(8): 1013–22.
79. Ganda K, Schaffer A, Seibel MJ. Predictors of re-fracture amongst patients managed within a secondary fracture prevention program: a 7-year prospective study. Osteoporos Int 2015; 26(2): 543–51.
80. Eisenberg DF, Placzek H, Gu T, Krishna A, Tulsi BB. Cost and consequences of noncompliance to oral bisphosphonate treatment. Journal of managed care & specialty pharmacy 2015; 21(1): 56–65.
81. LeBlanc ES, Rosales AG, Balasubramanian A, et al. Risk factors for fracture among current, persistent users of bisphosphonates. Osteoporos Int 2015; 26(2): 713–25.
82. Kannus P, Parkkari J, Niemi S, et al. Prevention of hip fracture in elderly people with use of a hip protector. N Engl J Med 2000; 343(21): 1506–13.
83. Kiel DP, Magaziner J, Zimmerman S, et al. Efficacy of a hip protector to prevent hip fracture in nursing home residents: the HIP PRO randomized controlled trial. JAMA 2007; 298(4): 413–22.
84. Cryer C, Knox A, Stevenson E. Factors associated with hip protector adherence among older people in residential care. Inj Prev 2008; 14(1): 24–9.
85. Oliver D, Connelly JB, Victor CR, et al. Strategies to prevent falls and fractures in hospitals and care homes and effect of cognitive impairment: systematic review and meta-analyses. BMJ 2007; 334(7584): 82.
86. Cameron ID, Kurrle S, Quine S, et al. Increasing adherence with the use of hip protectors for older people living in the community. Osteoporos Int 2011; 22(2): 617–26.
87. Close JC. How can you prevent falls and subsequent fractures? Best Pract Res Clin Rheumatol 2013; 27(6): 821–34.
88. Cumming RG, Thomas M, Szonyi G, et al. Home visits by an occupational therapist for assessment and modification of environmental hazards: a randomized trial of falls prevention. J Am Geriatr Soc 1999; 47(12): 1397–402.
89. Madureira MM, Takayama L, Gallinaro AL, Caparbo VF, Costa RA, Pereira RM. Balance training program is highly effective in improving functional status and reducing the risk of falls in elderly women with osteoporosis: a randomized controlled trial. Osteoporos Int 2007; 18(4): 419–25.
90. Robertson MC, Devlin N, Gardner MM, Campbell AJ. Effectiveness and economic evaluation of a nurse delivered home exercise programme to prevent falls. 1: Randomised controlled trial. BMJ 2001; 322(7288): 697–701.
91. Singh NA, Quine S, Clemson LM, et al. Effects of high-intensity progressive resistance training and targeted multidisciplinary treatment of frailty on mortality and nursing home admissions after hip fracture: a randomized controlled trial. J Am Med Dir Assoc 2012; 13(1): 24–30.
92. Duque G, Troen BR. Understanding the mechanisms of senile osteoporosis: new facts for a major geriatric syndrome. J Am Geriatr Soc 2008; 56(5): 935–41.
93. Myint MW, Wu J, Wong E, et al. Clinical benefits of oral nutritional supplementation for elderly hip fracture patients: a single blind randomised controlled trial. Age Ageing 2013; 42(1): 39–45.
94. Wyers CE, Reijven PL, Evers SM, et al. Cost-effectiveness of nutritional intervention in elderly subjects after hip fracture. A randomized controlled trial. Osteoporos Int 2013; 24(1): 151–62.
95. Richy F, Dukas L, Schacht E. Differential effects of D-hormone analogs and native vitamin D on the risk of falls: a comparative meta-analysis. Calcif Tissue Int 2008; 82(2): 102–7.
96. Solomon DH, Finkelstein JS, Katz JN, Mogun H, Avorn J. Underuse of osteoporosis medications in elderly patients with fractures. Am J Med 2003; 115(5): 398–400.
97. Andrade SE, Majumdar SR, Chan KA, et al. Low frequency of treatment of osteoporosis among postmenopausal women following a fracture. Arch Intern Med 2003; 163(17): 2052–7.
98. Vytřísalová M, Fuksa L, Palička V, et al. Adherence to osteoporosis guideline: survey among Czech general practitioners. Cent Eur J Med 2014; 9(5): 687–93.
99. McLellan AR, Wolowacz SE, Zimovetz EA, et al. Fracture liaison services for the evaluation and management of patients with osteoporotic fracture: a cost-effectiveness evaluation based on data collected over 8 years of service provision. Osteoporos Int 2011; 22(7): 2083–98.
100. Black DM, Delmas PD, Eastell R, et al. Once-yearly zoledronic acid for treatment of postmenopausal osteoporosis. N Engl J Med 2007; 356(18): 1809–22.
101. Boonen S, Marin F, Mellstrom D, et al. Safety and efficacy of teriparatide in elderly women with established osteoporosis: bone anabolic therapy from a geriatric perspective. J Am Geriatr Soc 2006; 54(5): 782–9.
Štítky
Dermatologie Dětská revmatologie Revmatologie
Článek vyšel v časopiseČeská revmatologie
Nejčtenější tento týden
2015 Číslo 2- Kterým pacientům se SLE nasadit biologickou léčbu?
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Jak souvisí časné zahájení biologické léčby SLE/LN s prevencí nevratného poškození?
- Stillova choroba: vzácné a závažné systémové onemocnění
-
Všechny články tohoto čísla
-
Péče o pacienty s nízkotraumatickou zlomeninou horního konce stehenní kosti.
II. Následná osteologická péče.
Doporučený postup České revmatologické společnosti, Společnosti pro metabolická onemocnění skeletu a České společnosti pro ortopedii a traumatologii - Experimentální modely systémové sklerodermie – cesta k poznání a léčbě neléčitelné nemoci?
- Podkožní infekce Scedosporium apiospermum s postižením loketního kloubu u pacienta s revmatoidní artitidou
- Ze života časopisu
-
Péče o pacienty s nízkotraumatickou zlomeninou horního konce stehenní kosti.
- Česká revmatologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle-
Péče o pacienty s nízkotraumatickou zlomeninou horního konce stehenní kosti.
II. Následná osteologická péče.
Doporučený postup České revmatologické společnosti, Společnosti pro metabolická onemocnění skeletu a České společnosti pro ortopedii a traumatologii - Podkožní infekce Scedosporium apiospermum s postižením loketního kloubu u pacienta s revmatoidní artitidou
- Experimentální modely systémové sklerodermie – cesta k poznání a léčbě neléčitelné nemoci?
- Ze života časopisu
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



