-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Možnosti časné detekce závažných kardiovaskulárních projevů SLE
Possibilities of early detection of severe cardiovascular manifestations of SLE
Objective:
the aim of the study was to determine particular cardiovascular manifestations in systemic lupus erythematosus (SLE), to describe their type and severity, find out a relationship with particular SLE characteristics and suggest possibilities for early detection of those complications.Methods:
Twenty-nine patients with SLE and 15 healthy controls were investigated. Patients had extensive echocardiographic evaluation including exercise stress testing evaluation after 6 minutes of walk as well as Holter monitoring. Basic demographic data, type of immunosuppressive treatment and time-course of its administration, the dose of glucocorticoids, presence of autoantibodies (anti-dsDNA, anti-Ro, La, Sm, aCL), haemostatic parameters, lipid spectrum, presence of organ manifestations, pulmonary functions as well as activity of the disease according the SLEDAI score were evaluated. The association between particular cardiovascular pathologies and SLE parameters was studied.Results:
Presence of cardiovascular manifestations in our group was relatively small. The difference between standard and exercise stress testing echocardiography was found. After the 6 minute-walk test, several heart pathologies appeared. No significant changes were found during echocardiographic examination. Higher levels of Tei index significantly differentiated between control individuals and patients with SLE. Moderate difference, however not statistically significant, was also observed between SLE patients with high and low disease activity. PG max on tricuspidal valve according to echocardiography and systolic excursion (TAPSE) were not different from those in healthy controls. Those values did not differ also between patients with different disease activity of SLE. Biochemistry and haemostatic parameters revealed statistically significant differences between healthy controls and SLE patients for D-dimers that are significantly increased in SLE patients and correlate with the disease activity. The value of DLCO, on the contrary, decreases with the disease activity of SLE patients. The significance of evaluating the ratio of FVC/DLCO index for the diagnosis of pulmonary hypertension was not confirmed. Significantly lower values of DLCO were associated with increased PG max in the exercise stress testing. DLCO was of greater importance than the FVC/DLCO index. Exercise stress testing echocardiography was beneficial for the diagnosis of early forms of pulmonary hypertension particularly in the evaluation of PG max on tricuspidal valve that increased after the exercise up-to the borderline levels of detectable pulmonary hypertension. Increase of Tei after the exercise stress testing did not correlate with the increase of PG max in patients with the risk of pulmonary hypertension. Pericardial effusion was diagnosed in 17.3 % of patients.Conclusion:
Exercise stress testing echocardiography demonstrated benefit for the detection of potential onset of pulmonary hypertension. Patients with SLE and higher risk of cardiovascular manifestation should be regularly monitored by echocardiography. More specific examination for cardiovascular pathologies is exercise stress testing echocardiography. Another reasonable and beneficial examination is DLCO.Key words:
SLE, cardiovascular manifestation, echocardiography, exercise stress testing echocardiography, pulmonary hypertension, SLE activity
Autoři: D. Tegzová 1; D. Ambrož 1; P. Jansa 1; T. Paleček 1; L. Dušek 2
Působiště autorů: Revmatologický ústav Praha, 1II. interní klinika kardiologie a angiologie VFN 1. LF UK v Praze ; Institut biostatistiky a analýz v Brně 2
Vyšlo v časopise: Čes. Revmatol., 15, 2007, No. 3, p. 131-141.
Kategorie: Původní práce
Souhrn
Cíl:
Cílem práce bylo zjistit výskyt jednotlivých kardiovaskulárních projevů systémového lupus erythematodes (SLE), popsat jejich typ, stupeň závažnosti, zjistit vztah k jednotlivým charakteristickám SLE a posoudit možnosti časné detkce těchto komplikací.Metodika:
Bylo vyšetřeno 29 nemocných se SLE a 15 zdravých kontrol. Pacienti absolvovali podrobné echokardiografické vyšetření včetně pozátěžového po absolvovaném testu šestiminutové chůze a 24hodinové monitorování dle Holtera. Byla hodnocena základní demografická data, typ imunosupresivní léčby a délka její aplikace, dávka kortikosteroidů, kterou nemocní užívali, přítomnost autoprotilátek (anti ds DNA, anti Ro, La, Sm, ACLA), hemokoagulační parametry, spektrum lipidů, přítomnost orgánových projevů, plicní funkce a byla měřena aktivita nemoci dle skóre SLEDAI. Byl zjišťován vztah mezi jednotlivými nalezenými kardiologickými patologiemi a parametry SLE.Výsledky:
Výskyt kardiovaskulárních projevů v našem souboru byl celkově relativně nízký. Byl zjištěn rozdíl při vyšetření v klidové a pozátěžové echokardiografii, po zátěži testem šestiminutové chůze došlo k odkrytí některých srdečních patologií. Sledované echokardiografické parametry nevykázaly při vyšetření v klidovém stavu žádné významné nálezy. Zvýšené hodnoty indexu Tei významně odlišovaly kontrolní skupinu od nemocných se SLE a na hranici statistické významnosti byly jeho rozdíly u nemocných s nízkou a vyšší aktivitou SLE. Klidové echokardiografické hodnoty trikuspidálního Pg max a TAPSE u nemocných se SLE nebyly odlišné od skupiny zdravých kontrol ani mezi pacienty s odlišnou aktivitou SLE. Biochemická a hemokoagulační vyšetření prokázala statisticky významné rozdíly mezi zdravými kontrolami a SLE pouze ve výši D-dimérů, jejichž hodnota je významně zvýšena u nemocných se SLE a narůstá s aktivitou. Hodnota DLCO naopak významně klesala v závislosti na nárůstu aktivity SLE. Význam hodnocení poměru indexu FVC/DLCO pro diagnostiku plicní hypertenze jsme nepotvrdili. Významně snížené hodnoty DLCO byly spojeny s nárůstem Pg max v zátěžovém testu. DLCO mělo větší výtěžnost než poměr FVC/DLCO. Přínosná pro diagnostiku časných forem plicní hypertenze byla pozátěžová echokardiografie hlavně v hodnocení parametru trikuspidálního Pg max, který po zátěží vzrůstal až k hodnotám na hranici prokazatelné plicní hypertenze. Pozátěžový nárůst hodnot indexu Tei nekoreloval se vzestupem hodnot Pg max u nemocných s rizikem plicní hypertenze. Perikardiální výpotek byl diagnostikován u 17,3 % nemocných.Závěr:
Pozátěžová echokardiografie prokázala přínos při detekci možné počínající plicní hypertenze. Nemocní se SLE s vyšším rizikem vzniku kardiovaskulárních komplikací by měli být pravidelně echokardiograficky sledováni a možností zpřesnění detekce srdečních patologií je pozátěžová echokardiografie. Dalším dostupným a přínosným vyšetřením je posouzení změn DLCO.Klíčová slova:
SLE, kardiovaskulární projevy, echokardiografie, zátěžový test, plicní hypertenze, aktivita SLEÚvod
Systémový lupus erythematodes (SLE) je závažné systémové onemocnění pojiva, které postihuje zejména ženy ve věku 20–50 let. Choroba se vyskytuje s prevalencí 20 na 100 000 obyvatel. Pro SLE je typický bimodální průběh, přičemž prvé, akutní období nemoci, trvající přibližně 3–5 let, je vystřídáno druhou fází choroby, kdy v popředí jsou spíše důsledky proběhlé prvé fáze včetně vývoje orgánového poškození, jež bývá často ireverzibilní. Právě v této druhé fázi se objevují i kardiologické komplikace (1). I přes veškerý pokrok v léčbě v posledních desetiletích zůstává zásadním problémem vyšší morbidita a mortalita nemocných se SLE ve srovnání se zdravou populací (2). Podstatný podíl na vyšší mortalitě mají i kardiovaskulární komplikace, a to zejména v důsledku akcelerované aterosklerózy a plicní arteriální hypertenze (3). Počet úmrtí v souvislosti s důsledky kardiovaskulárních komplikací pravděpodobně dokonce převyšuje počet úmrtí v souvislosti s vlastní aktivitou choroby. Asi 13 % nemocných se SLE má manifestní projevy akcelerované aterosklerózy (angina pectoris, infarkt myokardu, projevy ischémie v důsledku postižení periferních cév) (1, 4). Roční incidence infarktu myokardu u žen v běžné populaci se odhaduje na 0,001, zatímco roční incidence se SLE je zhruba 0,005. Riziko akcelerace aterosklerózy zvyšuje také léčba SLE pomocí kortikosteroidů, především v důsledku indukované hyperlipoproteinémie (5–7). Zájem se pochopitelně soustředí vedle pečlivého ovlivňování rizikových faktorů na časnou detekci asymptomatické aterosklerózy neinvazivními vyšetřovacími metodami (bicyklová ergometrie, měření tloušťky intimy a médie, měření RR variability). Pro rutinní screeningové vyšetřování asymptomatické akcelerované aterosklerózy však zatím schází evidence. Plicní arteriální hypertenze (PAH) se vyskytuje ve 4–14 % případech nemocných se SLE. Podkladem rozvoje této komplikace je pravděpodobně dysfunkce endotelu plicních cév u geneticky disponovaného jedince (9–11). U familiární a idiopatické plicní arteriální hypertenze je známa mutace v genu BMPR2 (bone morphogenetic protein), kódujícího receptor pro růstové faktory ze skupiny transformujícího růstového faktoru (12). Četnost této mutace u nemocných se SLE a PAH není známa. Stejně není známa četnost mutace v genu pro endoteliální NO syntázu (eNOS). Mortalita PAH u SLE je do dvou let od stanovení diagnózy 25–50 % (13). Podle doporučení WHO sympozia o PAH z roku 1998 a 2003 mají být nemocní se SLE screeningově echokardiograficky vyšetřeni v případě manifestace příznaků, které mohou souviset s plicní hypertenzí (14). V případě symptomatické plicní hypertenze je však již postižení plicních cév mnohdy obtížně terapeuticky ovlivnitelné (15). Na přítomnost latentní plicní hypertenze může upozornit zátěžové echokardiografické vyšetření a dále snížení difuzní kapacity plic pro CO (DLCO) při relativně dobrých ventilačních parametrech (17). Zvýšený poměr FVC (%)/DLCO (%) může svědčit pro plicní hypertenzi a lze jej považovat za jednoduché screeningové vyšetření. V současné době není jednoznačně jasné, co je predilekčním faktorem vývoje a závažnosti průběhu kardiovaskulárních komplikací u SLE (13, 18). Proto není ani k dispozici jasně formulované doporučení pro metodiku preventivního vyšetřování a časného záchytu těchto komplikací (16, 18).
V Revmatologickém ústavu jsme ve spolupráci s II. klinikou kardiologie a angiologie 1. LF UK v Praze realizovali grantový projekt zaměřený na včasnou detekci kardiovaskulárních komplikací u SLE.
Cíl práce
Cílem projektu bylo popsat výskyt jednotlivých kardiovaskulárních komplikací u SLE ve srovnání se zdravou populací. Byl zjišťován vztah mezi jejich výskytem a charakterem onemocnění SLE (demografická data, délka trvání choroby a její aktivita, výskyt orgánové manifestace nemoci, přítomnost jednotlivých vybraných autoprotilátek, hemokoagulační parametry, způsob léčby). Byly studovány možnosti časné detekce plicní arteriální hypertenze u nemocných se SLE. Také byly sledovány možnosti detekce echokardiografických parametrů souvisejících s plicní hypertenzí při zátěžové echokardiografii ve srovnání s vyšetřením provedeným v klidu a byl tak zhodnocen význam stanovení těchto parametrů při zátěžové echokardiografii. Byla zjišťována souvislost echokardiografických parametrů plicní hypertenze při zátěži a v klidu s poměrem FVC (%)/DLCO (%), a tím byla ověřována i možnost využití hodnocení tohoto poměru při screeningovém vyšetření plicní hypertenze.
Metodika
Bylo vyšetřeno 30 pacientů se SLE podle kritérií Americké revmatologické společnosti (ACR) po podepsání informovaného souhlasu. Pacienti byli rekrutování z registru Revmatologického ústavu a z Celonárodního registru zánětlivých revmatických chorob, vypracovaného Revmatologickým ústavem v rámci projektu Výzkumných záměrů MZ ČR. V rámci skupiny zdravých kontrol bylo vyšetřeno 15 zdravých dobrovolníků. Všichni absolvovali klinické vyšetření, laboratorní vyšetření autoprotilátek ANA, anti ds -DNA, anti Ro, La, ACLA, hodnot komplementu, spektra lipidů a hemokoagulační vyšetření (aPTT, INR, fibrinogen, antitrombin III, D-diméry, von Wilebrantův faktor, trombin-antitrombin III komplexy. Aktivita SLE byla stanovena pomocí skórovacího indexu SLEDAI.
Při echokardiografii byly hodnoceny tyto parametry: změny v perikardu, PK (šíře pravé komory v mm), PS (šíře pravé síně v mm), IVSd (šíře septa), ZSd (šíře zadní stěny v diastole), LKs/m2 (systolický rozměr levé komory), Lkd/m2 (diastolický rozměr levé komory), EDV/m2 (enddiastolický objem), ESV/m2 (endsystolický objem), EF (ejekční frakce), přítomnost významné regurgitace na trikuspidální chlopni hodnocené semikvantitativně, Pg max (vrcholový gradient regurgitační trysky na trikuspidální chlopni), Tei index (globální parametr funkce PKS vypočítávající její funkci dopplerovskou metodou dle průtokových charakteristik) a TAPSE (parametr PK, který vyjadřuje výchylku pohybu trikuspidálního anulu v M-mode). Vyšetření bylo provedeno v klidu a bezprostředně po absolvované zátěži při testu šestiminutové chůze. Test šestiminutové chůze byl prováděn podle doporučení Americké hrudní společnosti (ATS). Bylo provedeno 24hodinové monitorování EKG s hodnocením variability RR intervalu a funkční vyšetření plic se spirometrií a DLCO.
Hodnoty parametrů klidového a zátěžového echokardiografického vyšetření byly srovnány se záměrem určit ty parametry, které nejpřesněji predikují rozvoj PAH a umožňují sledovat její vývoj. Ze srovnání výsledků klidového a zátěžového echokardiografického vyšetření byla stanovena role zátěžové echokardiografie v časné detekci rizika rozvoje PAH. Výsledky echokardiografických parametrů a parametrů funkčního vyšetření plic byly korelovány se záměrem určit význam stanovení poměru FVC (%)/DLCO (%) pro screening rizika vzniku PAH u SLE.
Statistická analýza dat
Statistické zpracování dat bylo provedeno Institutem biostatistiky a analýz Masarykovy Univerzity v Brně. Veškeré statistické testy byly aplikovány na celý soubor primárních dat bez předchozího vylučování hodnot a pacientů. Hodnota α < 0,05 byla aplikována jako hranice statistické významnosti změn a rozdílů ve všech použitých testech. Primární data všech proměnných byla hodnocena standardními robustními statistickými parametry (medián a percentily, hodnocení relativních četností). Vztahy mezi dvěma nebo více kategoriemi kategoriálních parametrů byly posuzovány ML testem dobré shody a Fisherovým exaktním testem. Srovnání dvou nebo více skupin pacientů v echokardiografických parametrech bylo provedeno pomocí standardního t-testu a analýzy rozptylu (ANOVA), model jednoduchého třídění. Hodnocení výsledků zátěžového testu bylo provedeno párovým srovnáním posunu hodnot před a po zátěži standardním párovým t-testem (19, 20).
Výsledky
1. Úvodní popis souboru a klasifikace onemocnění podle obtížnosti (tab. 1 a 2)
Soubor pacientů se SLE reprezentativně pokrývá širokou škálu kategorií obtížnosti onemocnění, od neaktivního a dlouhodobě stabilizovaného onemocnění až po velmi aktivní formu spojenou s vícečetným postižením vnitřních orgánů. Typický pacient v našem souboru vymezený mediánovými hodnotami vykazuje index SLEDAI = 4 a onemocnění u něj trvá 7 let, což odpovídá i skutečným středovým hodnotám v populaci. Všichni pacienti byli léčeni prednisonem s mediánem dávky 10 mg denně. Onemocnění SLE je spojeno s řadou klinických symptomů a ukazatelů, které mohou být velmi komplexně kombinovány. I v našem prezentovaném souboru odhalila analýza dat relativně komplexní korelaci řady atributů, což vedlo ke kategorizaci nemocných do dvou skupin, definovaných v tabulce 2. Prvá skupina č. I je zastoupena nemocnými s neaktivním onemocněním (SLEDAI méně nebo rovno 4), která je korelována se sníženou incidencí všech dalších parametrů aktivity onemocnění (imunologické parametry, především pozitivita anti ds-DNA a ANA protilátek, bez přítomnosti orgánové manifestace). Druhá skupina nemocných č. II je naopak charakterizována zvýšenými hodnotami SLEDAI ve spojení s postižením alespoň jednoho vnitřního orgánu (ledviny, srdce, plíce, CNS). Analýza složek komplementu odhalila stejné hodnoty komponenty C3 mezi oběma takto definovanými skupinami nemocných (data nejsou ukázána). Naopak komponenta C4 zásadně přispívá k rozlišení různě aktivního onemocnění v tom smyslu, že pacienti s aktivním SLE mají častěji normativně sníženou hodnotu C4 (56 % pacientů) než lidé s neaktivním onemocněním ve skupině I (15 %) – viz tabulka 2. K rozlišení obou skupin pacientů nijak nepřispívají kategorie pohlaví ani současný věk a věk při diagnóze SLE (tab. 2). Pacienti s aktivním onemocnění SLE vykazují v souboru kratší dobu trvání onemocnění (medián = 6 let) než pacienti s méně aktivním onemocněním (medián = 10 let), nicméně statisticky v době trvání nemoci rozdíl není (p = 0,625). V obou skupinách nemocných se tedy vyskytují krátkodobá i dlouhotrvající onemocnění. Stejný závěr platí i pro dobu trvání imunosupresivní terapie a pro výskyt prokazatelných kardiologických patologií (chlopenní regurgitace, perikardiální výpotek).
Tab. 1. Vstupní charakteristiky zkoumaného souboru (pacienti se SLE, n = 29). 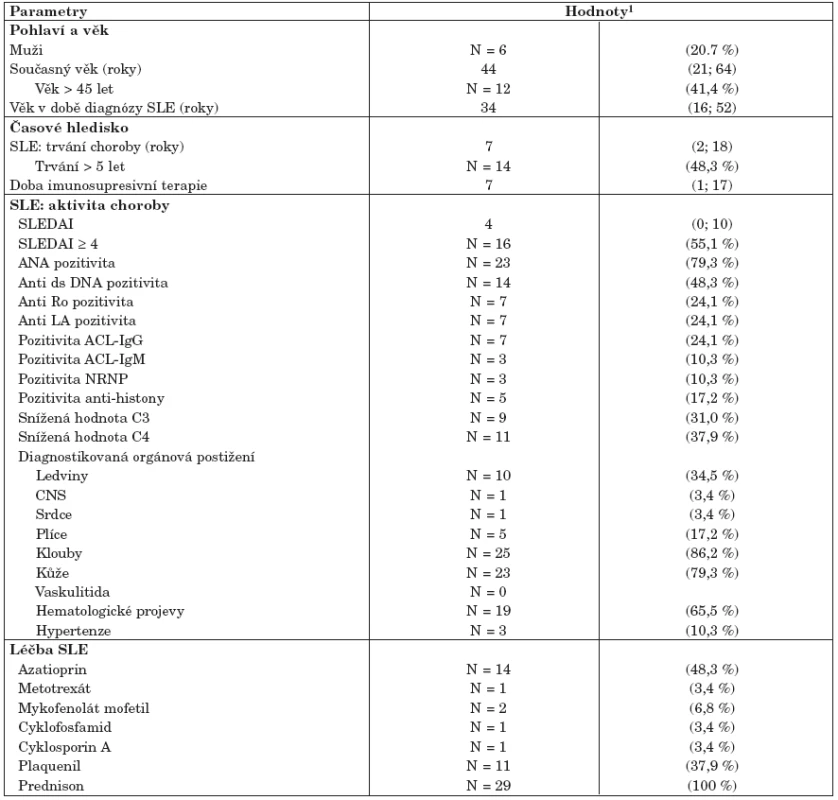
1Spojité znaky jsou vyhodnoceny odhadem mediánu a 5 % – 95 % percentilů (v závorkách). Binární parametry jsou vyjádřeny hodnotou N a % pro pojmenovanou kategorii. Tab. 2. Klasifikace pacientů se SLE podle závažnosti onemocnění. 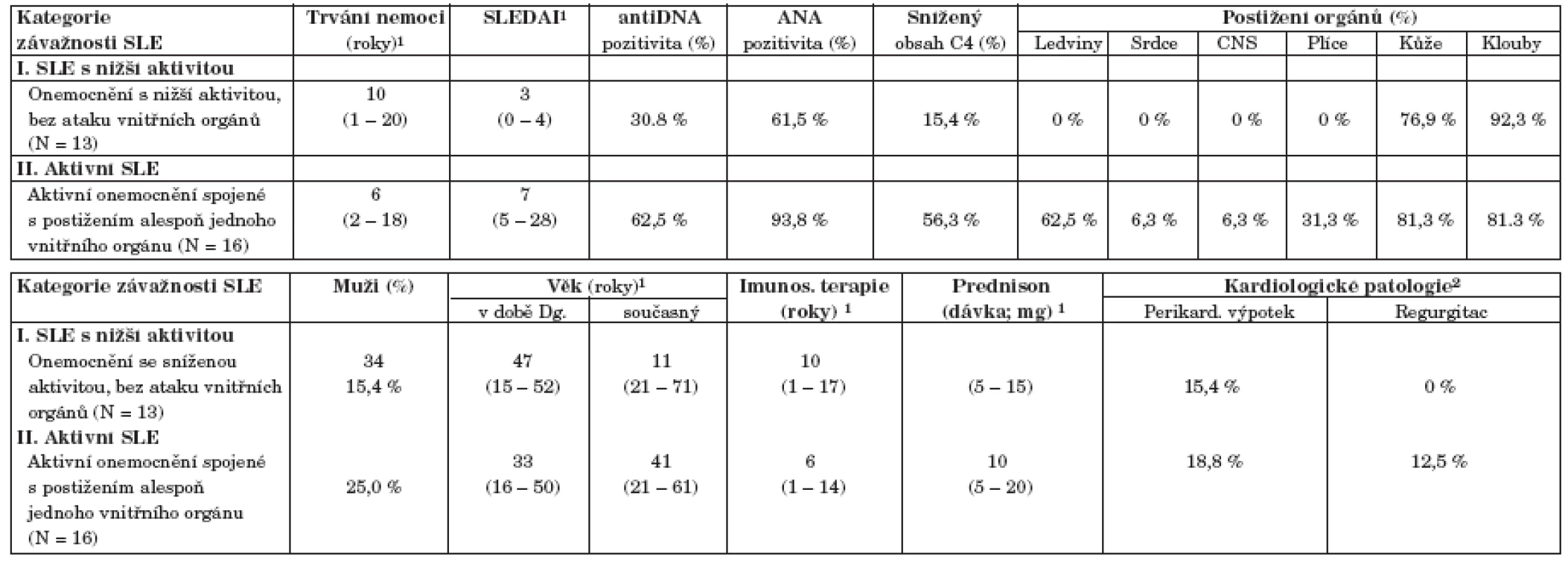
1Medián doplněný 5 % – 95 % percentily (v závorce) 2Bylo zaznamenáno celkem 5 pacientů s lupusem a s perikardiálním výpotkem a dále 2 pacienti s regurgitací (1 aortální a 1 mitrální) Závěrem této popisné části lze konstatovat, že korelační analýza provedená na charakteristikách nemocných se SLE úspěšně odhalila dvě komplexní kategorie pacientů lišící se především aktivitou choroby. Tyto kategorie byly poté využity i pro následné korelační hodnocení s různými vyšetřeními, neboť odrážejí stav pacienta komplexněji než jednotlivě analyzované parametry.
2. Srovnání zdravých kontrol a pacientů se SLE dle provedených vyšetření (tab. 3)
Kontrolní skupina byla srovnávána s pacienty se SLE rozdělenými do dvou komplexních kategorií I a II dle aktivity choroby (tab. 2). Statistické testy byly provedeny jednak ke zjištění celkového rozdílu mezi zdravými lidmi a pacienty se SLE, jednak i pro detailní testování rozdílu mezi různě aktivní formou onemocnění. Výsledky lze sumarizovat následovně:
a) Veškeré kardiologické parametry nevykázaly při vyšetření v klidovém stavu žádné významné patologie vybočující z normativních hodnot a jejich kvantitativní hodnoty jsou tedy porovnávány v rámci normy:
- zvýšené hodnoty indexu Tei významně odlišují kontrolní skupinu od nemocných se SLE a mírně diferencují i méně aktivní a aktivní onemocnění, zde je ale existující rozdíl na hranici statistické významnosti;
- dalšími parametry, které odlišují kontrolní skupinu od nemocných se SLE, jsou LKs, LKd a PK. Opět jde o hodnoty, které nemají prokazatelnou statistickou sílu odlišit pacienty s různě aktivním onemocněním (tab. 3);
Tab. 3. Srovnání zdravých kontrol a pacientů se SLE dle provedených vyšetření. 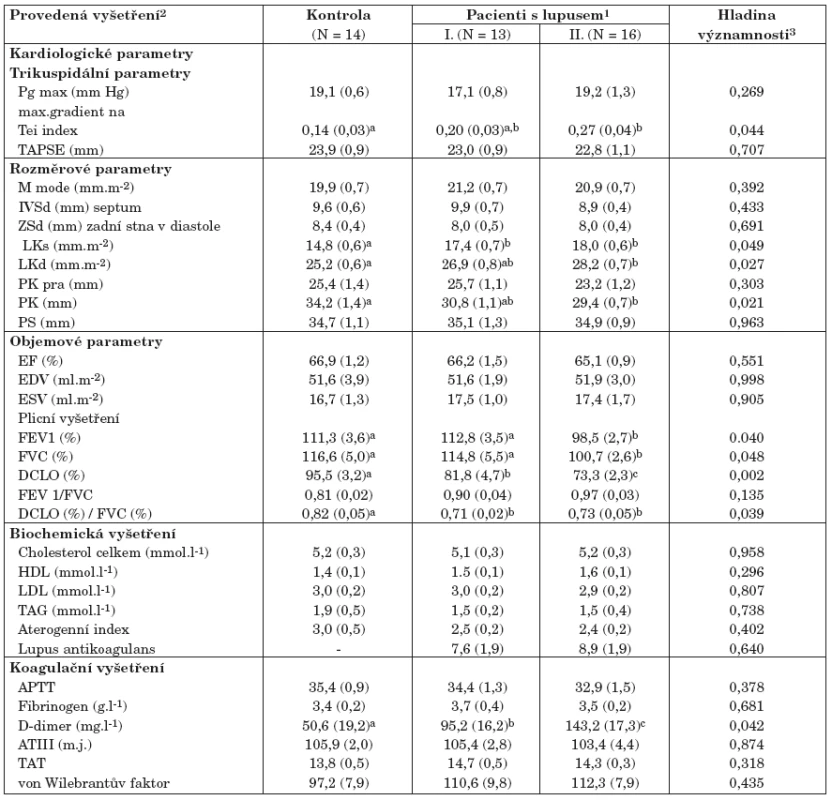
klidové hodnoty trikuspidálního Pg max a TAPSE neodlišují ani zdravé kontroly, ani různě aktivní formy SLE, což platí i pro všechny další hodnocené kardiologické parametry.
b) Biochemická a hemokoagulační vyšetření neprokázala žádné statisticky významné rozdíly mezi zdravými kontrolami a nemocnými se SLE s jedinou výjimkou u parametru D-dimery. Již kvantitativní obsah D-dimerů je velmi významně zvýšený u nemocných se SLE jako celku oproti kontrole a dále narůstá s rostoucí aktivitou choroby. Mezi všemi provedenými laboratorními vyšetřeními jde o jediný parametr, který v klidovém stavu významně separuje nemocné s méně a více aktivním SLE. U nemocných se SLE byl také prokázán zvýšený výskyt nadnormativně zvýšených hodnot D-dimerů (N = 11, 37,9 %).
c) Blok parametrů plicních vyšetření vykázal velmi významný potenciál k rozlišení zdravých kontrol a nemocných se SLE, výsledné hodnoty lze shrnout následovně:
- statisticky významně snížené hodnoty FEV a FVC odlišují pacienty s aktivním SLE (skupina II), ale jsou téměř shodné u onemocnění s nízkou aktivitou a u zdravých kontrol;
- parametr DLCO má největší diskriminační potenciál a odlišuje jak zdravé kontroly od nemocných se SLE, tak i statisticky významně klesá u pacientů s aktivním onemocněním SLE ve srovnání se skupinou s nízkou aktivitou choroby;
- významně snížené hodnoty DLCO u nemocných se SLE se také odrazily ve změnách hodnot indexu FVC/DLCO, nicméně tento index pouze separuje kontrolní zdravou skupinu od nemocných se SLE, ale již nijak neodlišuje nemocné s různě aktivním onemocněním.
3. Vyhodnocení zátěžového testu na celém souboru zdravých kontrol a pacientů se SLE (tab. 4)
Klidová vyšetření kardiologických parametrů sumarizovaná v tabulce 3 byla dále doplněna zátěžovým testem s cílem identifikovat pacienty potenciálně ohrožené vývojem patologických stavů, především plicní hypertenze. Ze všech hodnocených parametrů zátěžový test vykázal statisticky významný posun hodnot u následujících tří proměnných:
- trikuspidální Pg max neodlišuje zdravé a nemocné jedince v klidovém stavu, nicméně při zátěži statisticky významně narůstá u těch pacientů s aktivním SLE, kteří mají postiženy vnitřní orgány (skupina II, tabulka 4). Zachycený průměrný nárůst + 8,1 mm Hg je vysoce statisticky významný (p< 0,001, párový test), což znamená, že se takto zvedají hodnoty u většiny pacientů v této skupině. Dále bylo zaregistrováno N = 6 pacientů, které zátěžové zvýšení Pg max posunulo k rizikovým hodnotám na hranici prokazatelné plicní hypertenze (> 30 mmHg). Tato riziková skupina byla dále identifikována (tab. 5, 6). V důsledku těchto změn separují zvýšené hodnoty Pg max po zátěži statisticky významně skupinu s aktivním SLE od ostatních.
- zvýšené hodnoty indexu Tei odlišují pacienty s aktivním SLE od zdravých kontrol, ale nikoli od forem SLE s nízkou aktivitou nemoci. Rovněž rozdíl mezi pacienty s neaktivním onemocněním a zdravými kontrolami není statisticky významný. Tento výsledek platí jak pro klidové, tak i zátěžové hodnoty. U pacientů s aktivním SLE index Tei v důsledku zátěže statisticky významně narůstá (v průměru + 0,04), v tomto smyslu se Tei chová podobně jako Pg max.
- parametr PK je v klidovém stavu statisticky významně snížený u pacientů s aktivním SLE oproti ostatním skupinám v souboru, v důsledku zátěže se však v této skupině zvětšuje a po zátěži tedy již nevykazuje statisticky významné rozdíly ani mezi nemocnými a kontrolami, ani v rámci pacientů se SLE.
Tab. 4. Vyhodnocení zátěžového testu na celém souboru kontrol a pacientů se SLE. 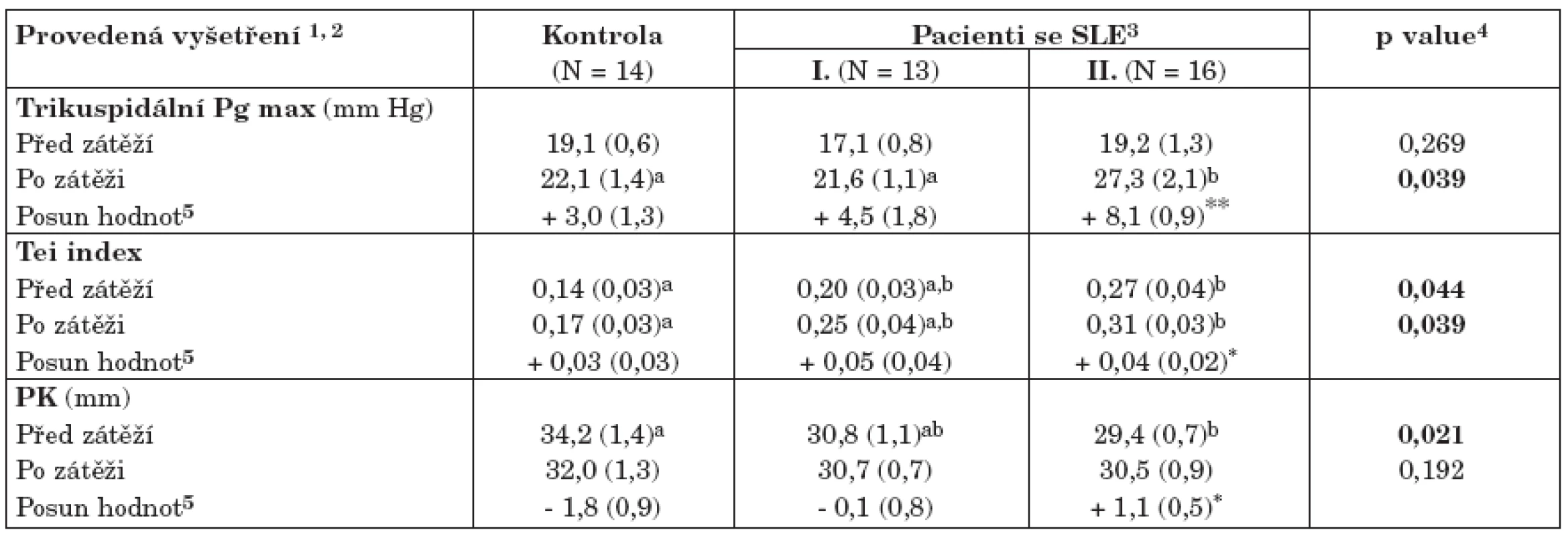
1Uvedeny jsou pouze parametry, které při testu vykázaly statisticky významný posun hodnot 2Aritmetický průměr doplněný standardní chybou odhadu průměru (v závorce) 3Dvě kategorie pacientů s různou aktivitou choroby (tab. 2) 4Hladina významnosti pro test srovnávající hodnoty ve skupinách (kontroly, SLE I a SLE II; ANOVA; p< 0,05) 5Párově hodnocený posun hodnot před a po zátěži. Statistická významnost těchto změn byla posuzována párovým t-testem a označena * (p< 0,05) nebo ** (p< 0,01). a,bDetailní označení statisticky významných rozdílů mezi srovnávanými variantami, doplněno jen u parametrů vykazujících významné rozdíly. Dva odhady průměru označené různým písmenem jsou vzájemně statisticky významně rozdílné (p< 0,05). 1Dvě kategorie pacientů s různou aktivitou choroby (tab. 2) 2Aritmetický průměr doplněný standardní chybou odhadu průměru (v závorce) 3Hladina významnosti pro test srovnávající hodnoty ve skupinách (kontroly, SLE I a SLE II; ANOVA; p < 0,05) a,b Detailní označení statisticky významných rozdílů mezi srovnávanými variantami, doplněno jen u parametrů vykazujících významné rozdíly (p<0,05). Vždy dva odhady průměru označené různým písmenem jsou vzájemně statisticky významně rozdílné. Závěrem této části lze konstatovat, že zátěžový test se prokázal jako velmi funkční pro odhalení potenciálního rizika vážných patologií především u pacientů s aktivním SLE. Zvýšení hodnoty Pg max a Tei indexu napomohlo identifikovat pacienty potenciálně ohrožené vývojem plicní hypertenze, těchto N = 6 pacientů (20,7 % celé skupiny a 37,5 % v rámci skupiny pacientů s aktivním SLE) je dále identifikováno analýzou v tabulce 5.
4. Výskyt kardiologických patologií a dalších zjištěných komplikací ve vztahu k vybraným parametrům SLE (tab. 5)
Tabulka 5 sumarizuje výskyt prokázaných patologií a rizikových stavů, které byly komplexním testováním pacientů se SLE prokázány, a dává je do souvislosti s vybranými parametry a aktivitou onemocnění SLE. Konkrétně jde o tato zjištění: diagnostikovaný perikardiální výpotek (N = 5; 17,3 %) nadnormativně zvýšené hodnoty D-dimerů (N = 11; 27,9 %) pacienti potenciálně ohrožení plicní hypertenzí (N = 6; 20,7 %) jsou definováni jako pacienti se zátěžově zvýšenou hodnotou Pg max (> 30 mm Hg), v korelaci se zvýšenou hodnotou Tei indexu a sníženou hodnotou DLCO v %.
Tab. 5. Výskyt kardiologických patologií a dalších zjištěných komplikací ve vztahu k parametrům SLE1. 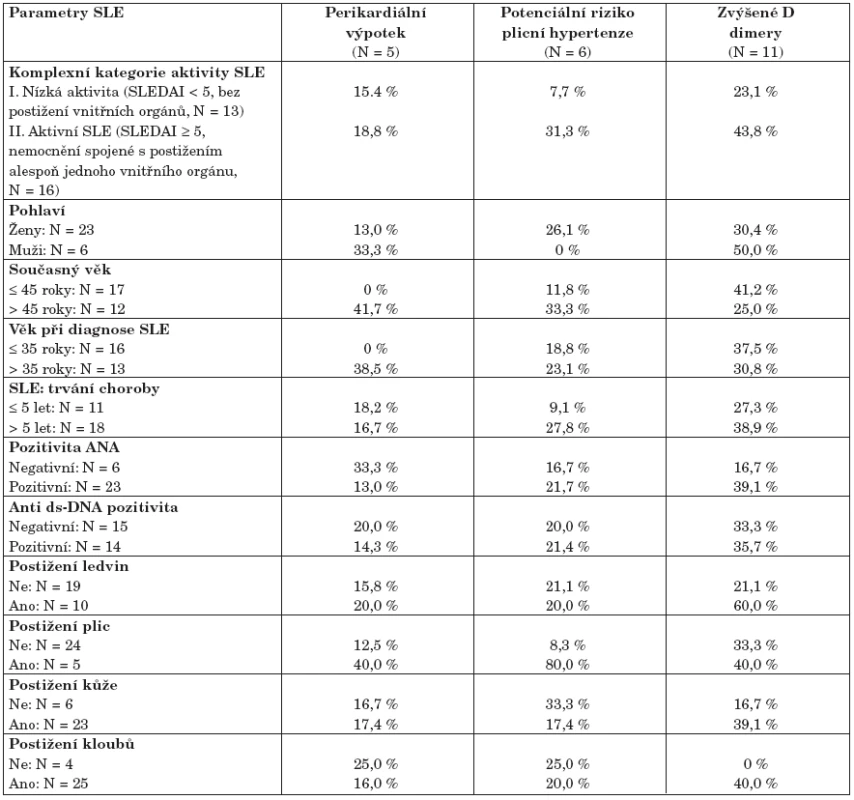
1Jelikož závažnější komplikace nebyly v kontrolní skupině zaznamenány, analýza zahrnuje pouze pacienty se SLE (N = 29). Vzhledem k malému počtu zachycených komplikací nejsou rozdíly v tabulce statisticky testovány. Analýza prokázala, že perikardiální výpotek se ve vyšším procentu vyskytuje u starších pacientů (> 45 let), u kterých byl také SLE diagnostikován ve věku vyšším než 35 let. Podobné asymetrie ve výskytu perikardiálního výpotku nebyly pozorovány u žádného jiného parametru SLE ani u jeho aktivity. Zvýšené hodnoty D-dimerů byly nalezeny u pacientů s postižením vnitřních orgánů, především ledvin, což je logicky doprovázeno jejich zvýšenými hodnotami u pacientů s obecně zvýšenou aktivitou SLE (skupina II definovaná pro tento soubor). Pacienti se zvýšeným rizikem plicní hypertenze jsou opět ve shodě se všemi dříve popsanými výsledky kumulováni ve skupině pacientů s aktivním SLE a s postižením vnitřních orgánů. Velmi výrazná vazba je především u postižení plic – všichni pacienti v této rizikové skupině mají postižené plíce a hodnotu indexu SLEDAI nad 10. Naopak nebyla pozorována žádná relativní vazba k postižení dalších orgánů, kloubů a kůže (tab. 5). Pacienti potenciálně ohrožení plicní hypertenzí jsou rovněž všichni ženského pohlaví a onemocnění SLE u nich probíhalo převážně dlouhodoběji (nad 5 let).
Všechny výsledky popsané v tomto bloku mají spíše popisný charakter, neboť výskyt prokázaných patologií je příliš malý a neumožňuje exaktní statistické analýzy.
5. Srovnání kvantitativních hodnot parametrů určujících potenciální riziko plicní hypertenze v relaci k charakteristikám SLE (tab. 6)
Kromě definovaných pacientů, kteří jsou přímo ohroženi potenciálním rizikem plicní hypertenze (popis v tab. 5), lze pozorovat i změny v kvantitativních hodnotách parametrů, které se k této komplikaci přímo vztahují – tedy především DLCO (%), a dále parametrů měřených na trikuspidální chlopni (Pg max a TEI index). Z výsledků popsaných v tabulce 6 je evidentní, že komplexní kategorizace nemocných se SLE (dělení dle aktivity onemocnění na skupiny I a II, tab. 2) koreluje významně i s těmito parametry. Konkrétně pacienti se zvýšenou aktivitou SLE (skupina II) vykazují statisticky významně snížené hodnoty DLCO, zvýšené hodnoty Pg max a významné zvýšení hodnot Pg max při zátěžovém testu, což u 6 z nich vedlo až k hodnotám blížícím se hranici plicní hypertenze (tab. 5). Ze všech hodnocených parametrů v tabulce 6 pouze poměr FVC/DLCO nevykázal žádné statisticky významné rozdíly ve vazbě na zařazené parametry SLE. Lze konstatovat, že primární hodnoty DLCO mají z hlediska informačního přínosu výrazně větší výtěžnost. Dále platí, že statisticky významně snížené hodnoty DLCO jsou většinou spojeny se statisticky významným nárůstem Pg max v zátěžovém testu. Tato vazba byla pozorována u pacientů se SLE, kteří mají doba trvání nemoci nad 5 let, pozitivitu anti ds-DNA a postižení plic intersticiální plicní fibrózou. Tuto kategorii nemocných lze tedy označit za rizikovou.
Všechny tyto kategorie jsou sloučeny ve skupině II pacientů s aktivním SLE s orgánovým postižením (tab. 6). Hodnota DLCO je dále významně snížena u pacientů s pozitivitou ANA, přičemž tento fakt není nijak korelován s vývojem parametru Pg max.
Tab. 6. Srovnání kvantitativních hodnot parametrů určujících potenciální riziko plicní hypertenze v relaci k charakteristikám SLE1. 
Legenda k tabulce 6 1Analýza provedena pouze na souboru pacientů se SLE (N = 29) 2Čísla udávají aritmetický průměr a standardní chybu odhadu průměru (závorky). * značí statisticky významný rozdíl mezi dvěma kategoriemi danými parametry lupusu (t-test; p < 0,05) 3Průměrný rozdíl hodnot před a po zátěži doplněný standardní chybou. † značí statistickou významnost tohoto rozdílu (párový t-test; p < 0,05). Diskuse
Výskyt kardiovaskulárních projevů v našem souboru byl celkově relativně nízký oproti údajům z literatury (1, 2). Zaznamenali jsme značný rozdíl při vyšetření v klidové a pozátěžové echokardiografii, kdy po absolvování zátěže ve formě testu šestiminutové chůze došlo k odkrytí a tedy i nalezení některých srdečních patologií. Sledované echokardiografické parametry nevykázaly při vyšetření v klidovém stavu žádné významné patologie vybočující z běžných očekávaných hodnot. Zvýšené hodnoty indexu Tei významně odlišovaly kontrolní skupinu od nemocných se SLE a na hranici statistické významnosti byly jeho rozdíly u nemocných s nízkou a vyšší aktivitou SLE. Rovněž tak parametry velikosti obou srdečních komor se významně nelišily u nemocných s různou aktivitou SLE. Klidové echokardiografické hodnoty trikuspidálního Pg max a TAPSE u nemocných se SLE v našem souboru nejen nepomohly odlišit různě aktivní formy SLE, ale nebyly odlišné ani od skupiny zdravých kontrol. Provedená biochemická a hemokoagulační vyšetření překvapivě prokázala statisticky významné rozdíly mezi zdravými kontrolami a nemocnými se SLE pouze v parametru výše hodnot D-dimerů, přičemž jejich hodnota je statisticky významně zvýšena u nemocných se SLE jako celku oproti zdravým kontrolám a narůstá s rostoucí aktivitou SLE. Mezi všemi provedenými laboratorními vyšetřeními jde v našem sledovaném souboru o jediný významný laboratorní parametr, který je významně závislý na aktivitě nemoci, přičemž tyto změny jsme předpokládali rovněž např.u lipidového spektra nebo antifosfolipidových protilátek, ale zejména u anti ds DNA protilátek (3, 7). Ty sice byly u skupiny nemocných se SLE přítomny, ale korelace s aktivitou nebyla znatelná, což neodpovídá známým charakteristikám průběhu SLE (1, 10). Statisticky významné změny v závislosti na SLE a jeho aktivitě oproti zdravým kontrolám byly v našem souboru dále zjištěny u plicních parametrů, zejména u DLCO, jehož hodnota významně klesala v závislosti na nárůstu aktivity SLE ve srovnání se skupinou s nízkou aktivitou choroby nebo zdravými kontrolami. Přínos studovaného poměru indexu FVC/DLCO pro diagnostiku aktivity nemoci nebo přítomnosti plicní hypertenze jsme v našem souboru oproti našemu očekávání nepotvrdili. Zátěžový test s následnou echokardiografií vykázal u našeho souboru významný přínos při diagnostice vážných kardiovaskulárních patologií, konkrétně incipientní plicní hypertenze, hlavně v parametru hodnoty trikuspidálního Pg max, která po zátěži vzrostla až k hodnotám na hranici prokazatelné plicní hypertenze (12, 15). Statisticky významně zvýšené hodnoty Pg max po zátěži byly ve sledovaném souboru nalezeny rovněž u skupiny s aktivním SLE oproti ostatním, tedy zdravým kontrolám nebo méně aktivním případům SLE. Pozátěžový nárůst hodnot indexu Tei v závislosti na nárůstu aktivity SLE byl v našem souboru popsán obdobně jako u hodnot Pg max, ale nebyla zjištěna jeho korelace se vzestupem hodnot Pg max při zátěžovém testu u nemocných s rizikem PAH, nebyl tudíž prokázán ani jeho přínos při diagnostice časných forem plicní hypertenze.
Perikardiální výpotek byl diagnostikován u 17,3 % nemocných, což je méně oproti údajům z literatury, kdy je obecně výskyt udáván od 20 % výše (1, 9). Výskyt chlopenních vad, resp. regurgitací, odpovídá výskytu v běžné populaci. Zvýšené hodnoty D-dimerů byly v našem souboru nalezeny u pacientů s postižením vnitřních orgánů, především ledvin. Při hodnocení přínosu vyšetření DLCO bylo popsáno, že statisticky významně snížené hodnoty jsou většinou spojeny s významným nárůstem Pg max v zátěžovém testu. Bylo překvapivé, že samotné hodnoty DLCO měly v našem souboru z hlediska přínosu při diagnostice plicní hypertenze výrazně větší výtěžnost než poměr FVC/DLCO, přičemž očekáváno bylo zjištění opačné (2). Rizikovou kategorií nemocných pro vznik PAH byla i skupina nemocných s dobou trvání choroby nad 5 let, s pozitivitou anti ds-DNA a postižením plic intersticiální plicní fibrózou, což odpovídá i známým faktům z literatury, kdy vyšší riziko pro PAH je právě u takto charakterizovaných nemocných (12, 13).
Závěr
Pro onemocnění SLE v různém stupni pokročilosti a závažnosti je typický i vývoj kardiovaskulárních komplikací. Běžné patologie, jako jsou chlopenní vady a perikarditida, jsou dobře detekovatelné při echokardiografii (1, 2). Relativně méně častou, ale ne vzácnou a hlavně velice závažnou komplikací, je plicní hypertenze, která bývá často zjištěna až v době klinické manifestace, kdy je již v pokročilejším stadiu, které je jen obtížně ovlivnitelné léčbou (12,13). Problémem diagnostiky je, že běžné klidové echokardiografické vyšetření nemusí odhalit ty pacienty, u nichž je vyšší riziko vývoje plicní hypertenze.
Naše sledování mimo jiné upozorňuje na nutnost pečlivého sledování, které by mělo být zaměřeno i na vznik a přítomnost kardiovaskulárních komplikací. Na základě našich pozorování se domníváme, že nemocní s vyšším rizikem vzniku kardiovaskulárních komplikací, zejména plicní hypertenze, by měli být pravidelně echokardiograficky sledováni, nejlépe zřejmě každý rok, a to i v případě, že nejsou přítomny symptomy podezřelé z plicní hypertenze. Mezi tyto rizikové nemocné patří zejména ženy s vyšší aktivitou SLE, delším trváním onemocnění nad 5 let a přítomností intersticiální plicní fibrózy (11, 16). Vzhledem k tomu, že pozátěžová echokardiografie v našem souboru prokázala významný přínos při detekci možné počínající plicní hypertenze, je jistě vhodné tuto metodiku do vyšetřovacího programu začlenit, tím spíše, že se jedná o v zásadě jednoduše proveditelné a neinvazivní vyšetření. Rovněž jednoduše dostupným a pravděpodobně i přínosným vyšetřením je posouzení změn, resp. poklesu difuzní kapacity plic pro CO, tedy DLCO.
Podporováno grantem IGA MZ ČR NR /7886–3
MUDr. Dana Tegzová
Revmatologický ústav Praha
Na Slupi 4
128 50 Praha 2
e-mail: tegz@revma.cz
Zdroje
1. Gordon C. Long-term complications of systemic lupus erythematosus. Rheumatology 2002, 41 : 1095–1100.
2. Manger K, Manger B, Repp R, et al. Definition of risk factors for death, and stage renal disease, and thromboembolic events in a monocentric cohort of 338 patients with systemic lupus erythematosus. Ann Rheum Dis 2002; 61 : 1065–1070.
3. Manzi S. Systemic lupus erythematosus: a model for atherogenesis? Rheumatology 2000; 39 : 353–359.
4. Manzi S, Meilahn EN, Rairie JE, et al. Age-specific incidence rates of myocardial infarction and angina in women with systemic lupus erythematosus: comparison with the Framingham study. Am J Epidemiol 1997; 145 : 408–415.
5. Nuttall SL, Heaton S, Piper MK, et al. Cardiovascular risk in systemic lupus erythematosus – evidence of increased oxidative stress and dyslipidaemia. Rheumatology 2003; 42 : 758–762.
6. Raza K, Thambyrajah J, Townend JN, et al. Suppression of inflammation in primary systemic vasculitis restores vascular endothelial function: lessons for atherosclerotic disease? Circulation 2000; 102 : 1470–1472.
7. Schattner A, Liang MH. The cardiovascular burden of lupus. Arch Intern Med 2003; 163(13): 1507–1510.
8. Selzer F, Sutton-Tyrrell K, Fitzgerald S, et al. Vascular stiffness in women with systemic lupus erythematosus. Hypertension 2001; 37 : 1075–1082.
9. Svenungsson E, Sensen-Urstad K, Heimbuerger M, et al. Risk factors for cardiovascular disease in systemic lupus erythematosus. Circulation 2001; 104 : 1887–1893.
10. Thiagarajan P. Atherosclerosis, autoimunity and systemic lupus erythematosus. Circulation 2001; 104 : 1876–1877.
11. Asherson RA, Mackworth-Young CG, Boey ML, et al. Pulmonary hypertension in systemic lupus erythematosus. B M J 1983; 287 : 1024–1025.
12. Petri 1992, Sturfet 1992, Quismorio 1993, Winslow 1995,Word Symposium -Primary Pulmonary Hypertension 1998, 2003)
13. Gaine SP. Pulmonary hypertension. JAMA 2000; 284 : 3160–3168
14. Yokoi T, Tomita Y, Fukaya M, et al. Pulmonary hypertension associated with systemic lupus erythematosus: predominantly thrombotic arteriopathy accompanied by plexiform lesions. Arch Pathol Lab Med 1998; 122(5): 467–70
15. Hoeper M, Galie N, Simonneau G, Rubin LJ. Pulmonary perspective: New treatments for pulmonary arterial hypertension. Am J Resp Crit Care Med 2002; 165 : 1209–16
16. Galie N, Torbicki A. Pulmonary arterial hypertension: new ideas and perspectivers. Heart 2001; 85 : 475–480.
17. Nowak J, Nilsson T, Sylvén C, et al. Potential of carotid ultrasonography in the diagnosis of coronary artery disease. Stroke 1998; 29 : 439–446.
18. Urowitz MB, Gladman DD. How to improve morbidity and mortality in systemic lupus erythematosus. Rheumatology 2000; 39 : 238–244.
19. Altman DG. Practical Statistics for Medical Research. London: Chapman and Hall, 619p, 1991.
20. Zar JH. Biostatistical Methods. 2nd ed. London: Prentice Hall, 556p, 1984.
Štítky
Dermatologie Dětská revmatologie Revmatologie
Článek Komentář k článku
Článek vyšel v časopiseČeská revmatologie
Nejčtenější tento týden
2007 Číslo 3- Kterým pacientům se SLE nasadit biologickou léčbu?
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Stillova choroba: vzácné a závažné systémové onemocnění
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
-
Všechny články tohoto čísla
- Možnosti časné detekce závažných kardiovaskulárních projevů SLE
- Artroskopická synovektomie zápěstí
- Význam S100A4 proteinu v patogenezi revmatoidní artritidy
- Vápník a vitamin D v léčbě osteoporózy Doporučení ESCEO – European Society for Clinical and Economic Aspects
- Komentář k článku
- Rizikové faktory maligní lymfoproliferace u Sjögrenova syndromu
- Za profesorem MUDr. Miroslavem Vykydalem, DrSc.
- ABSTRAKTA PŘEDNÁŠEK ZE VII. SLAPSKÉHO SYMPOSIA (24.–26. května 2007, VZ Měřín)
- ABSTRAKTA PŘEDNÁŠEK ZE VII. SLAPSKÉHO SYMPOSIA (24.–26. května 2007, VZ Měřín) - pokračování
- ABSTRAKTA PŘEDNÁŠEK ZE VII. SLAPSKÉHO SYMPOSIA (24.–26. května 2007, VZ Měřín) - pokračování
- Česká revmatologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Artroskopická synovektomie zápěstí
- Rizikové faktory maligní lymfoproliferace u Sjögrenova syndromu
- Možnosti časné detekce závažných kardiovaskulárních projevů SLE
- Vápník a vitamin D v léčbě osteoporózy Doporučení ESCEO – European Society for Clinical and Economic Aspects
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



