-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Cékální ligace a punkce u miniprasat – metoda studia sepse
Autoři: Robert Gürlich 1; Eva Kieslichová 2; Dušan Merta 2; Michal Kudla 3; Jiří Čáp 2; Igor Šplíchal 4; Jana Malušková 5; Milan Ročeň 2
Působiště autorů: Univerzita Karlova v Praze, 3. lékařská fakulta, Chirurgická klinika FNKV 1; Klinika anesteziologie, resuscitace a intenzivní péče, Transplantcentrum, IKEM Praha 2; Klinika transplantační chirurgie, Transplantcentrum, IKEM Praha 3; Mikrobiologický ústav AV ČR Praha, Oddělení imunologie a gnotobiologie 4; Pracoviště klinické a transplantační patologie, Transplantcentrum, IKEM Praha 5
Vyšlo v časopise: Čas. Lék. čes. 2012; 151: 248-253
Kategorie: Původní práce
Souhrn
Východisko.
Sepse je závažné onemocnění zatížené vysokou mortalitou. Experimentální modely sepse na zvířecím modelu patří k základním metodám sledování patofyziologických mechanismů reakce organismu.Metody a výsledky.
Šestnáct dospělých miniprasat se shodnými vstupními parametry bylo rozděleno do dvou skupin. V septické skupině (n = 10) byla vyvolána sepse metodou cékální ligace a punkce (CLP). Kontrolní skupina (n = 6) podstoupila laparotomii bez CLP. Byly porovnány vybrané klinické a laboratorní parametry a histologické nálezy mezi skupinou se sepsí a kontrolní skupinou.Výsledky.
U všech zvířat s CLP došlo k rozvoji difuzní peritonitidy a septického stavu. Oproti kontrolní skupině byl v septické skupině zaznamenán významný nárůst tělesné teploty, vzestup srdeční frekvence, pro udržení perfuzního tlaku bylo nutné podávání noradrenalinu. Nebyly zaznamenány významné rozdíly ve sledovaných biochemických parametrech (včetně hodnoty CRP) mezi septickou a kontrolní skupinou. Histologické nálezy v septické skupině odpovídaly orgánovým změnám při sepsi, byly nalezeny centrolobulární nekrózy jater, akutní tubulární nekróza ledvin, fibro-purulentní exsudát na serózách, myomalacie v myokardu, edematózní změny plic.Závěr.
Experimentální metoda ligace céka s definovanou velikostí otvoru ve stěně střeva je vhodným modelem pro sledování rozvoje patofyziologických změn organizmu při sepsi.Klíčová slova:
sepse, cekální ligace, experimentální sepse.ÚVOD
Sepse, těžká sepse a septický šok je závažným diagnostickým a terapeutickým problémem na jednotkách intenzivní péče. Sepse je druhou nejčastější nekoronární příčinou smrti na jednotkách intenzivní péče a v posledních dvou desetiletích pozorujeme každoroční nárůst incidence (1). Nitrobřišní sepse patří k nejzávažnějším stavům na chirurgických odděleních. Pozdní diagnostika a léčba je rozhodujícím klinickým faktorem stále vysoké morbidity a mortality těchto stavů. Septický šok je charakterizován z hlediska reakce organismu imunitní deregulací s organismem nastartovanou mediátorovou „bouří“ vedoucí k mikrovaskulární dysfunkci a konečnému selhání orgánů a smrti organismu (2). Dosavadní poznatky o mediátorové odpovědi organismu jsou dílčí, a proto je sepse stále aktuálním tématem základního i klinického výzkumu. Zvířecí modely nitrobřišní sepse patří k základním nástrojům, na kterých je možné reprodukovatelným způsobem sledovat celý průběh rozvoje nitrobřišního zánětu. V současnosti jsou užívány tři modely sepse: modely s podáním exogenních toxinů, modely exogenní bakteriální infekce a modely s narušením bariéry hostitele. V našem článku uvádíme vlastní výsledky na modelu sepse u velkého laboratorního zvířete (miniprase), u něhož byla sepse vyvolána cékální ligací s perforací céka.
Studie byla povolena Komisí na ochranu zvířat proti týrání v IKEM. Experimenty byly prováděny na akreditovaném pracovišti experimentální medicíny IKEM v souladu s platnými evropskými předpisy a předpisy České republiky ohledně chovu a využití pokusných zvířat.
SOUBOR ZVÍŘAT A POUŽITÉ METODY
Zvířata
V experimentu bylo užito celkem 19 dospělých miniprasat o průměrné hmotnosti 39,5 kg (medián 37 kg). Dvě zvířata byla užita v přípravné fázi experimentu. Zvířata ve vlastním experimentu byla rozdělena do dvou skupin. V septické skupině (n = 10) byla vyvolána sepse metodou cekální ligace a punkce (CLP). U kontrolní skupiny (n = 6) byla provedena laparotomie bez CLP (sham operace). 1 zvíře bylo vyřazeno pro známky plicní infekce na začátku experimentu. Byly porovnány vybrané klinické a laboratorní parametry a histologické nálezy mezi skupinou se sepsí a kontrolní skupinou.
Přípravná fáze experimentu
Protože úspěšné užití funkčního modelu sepse vyžaduje zkušenosti se zvolenou technikou, které jsou přímo úměrné složitosti postupu, byla technika výkonu včetně monitorace zvolených parametrů vyzkoušena na dvou zvířatech v úvodní části studie. Účelem přípravné fáze bylo ověřit účinnost chirurgické techniky CLP na rozvoj septického stavu. Byly užity dvě varianty modelu CLP, každý z nich vedl k rozvoji peritonitidy a septické reakce. Pro jednoduchou a přesnou reprodukovatelnost modelu byla vybrána alternativa s punkcí céka pomocí trokaru.
Operace
V celkové anestezii byla chirurgicky indukována sterkorální peritonitida provedením CLP. Byla provedena střední laparotomie, podvaz céka v 1/4 délky (5 cm od Bauhinské chlopně). Cévní zásobení bylo přerušeno v rozsahu podvazu céka. Před podvazem céka do něj byl vmasírován střevní obsah z colon ascendens. Na antimezenteriální straně v oblasti tenie byla provedena bodová perforace céka trokarem, incize byla rozšířena na celkem 3 cm (obr. 1). Dutina břišní byla kontaminována střevním obsahem (obr. 2). Byla zavedena gastrostomie a cystostomie. U kontrolní (sham) skupiny byla provedena pouze laparotomie, gastrostomie a cystostomie.
Obr. 1. Model CLP: perforace céka trokarem 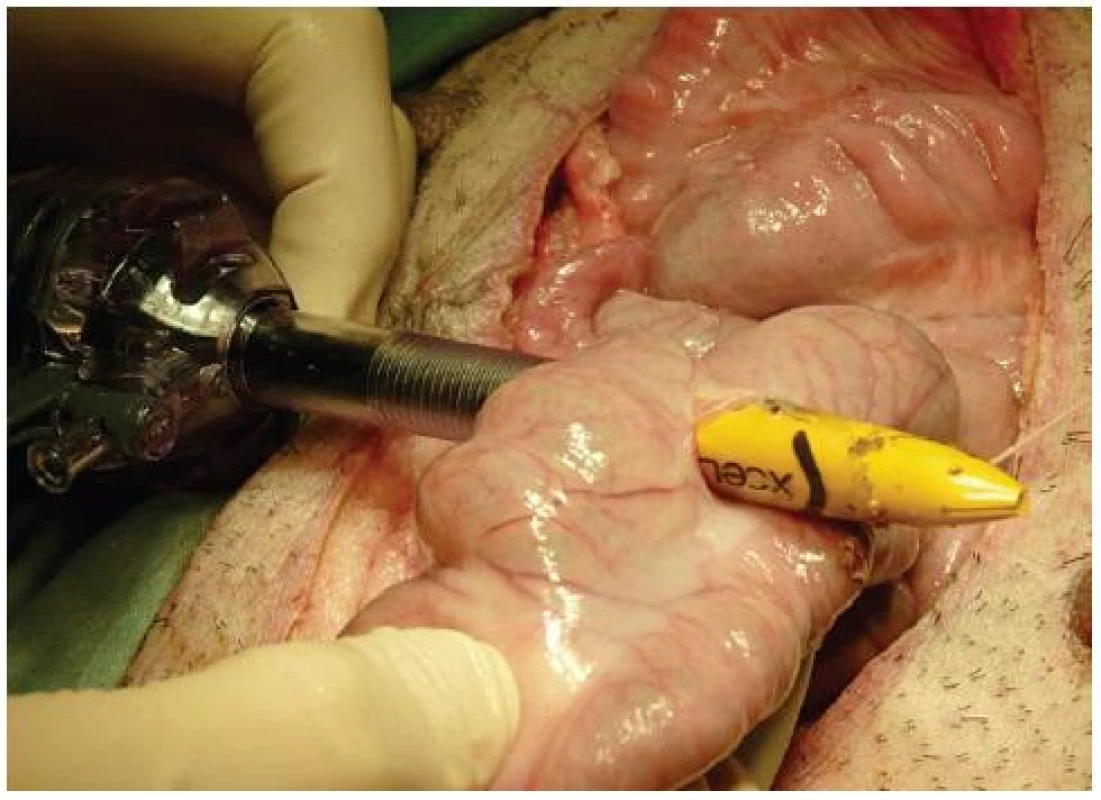
Obr. 2. Kontaminace dutiny břišní střevním obsahem 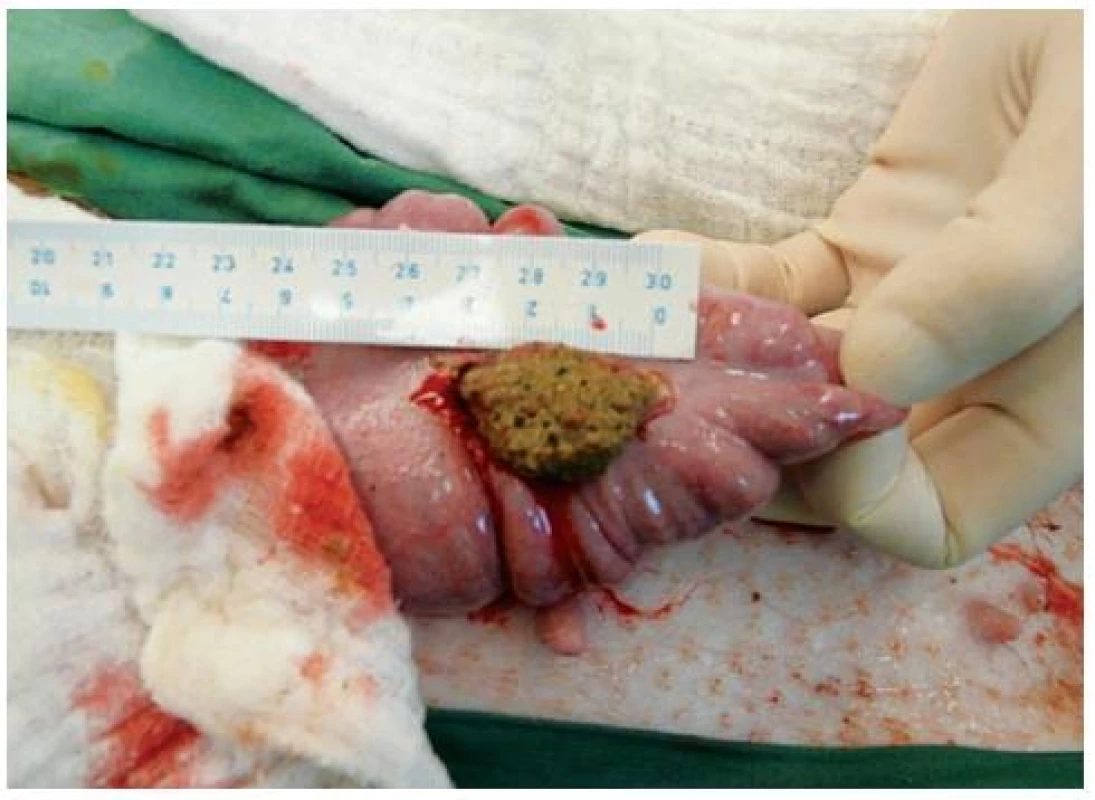
Anestezie
Zvířata lačnila 12 hodin před výkonem, byly podávány pouze tekutiny. V den operace byla intramuskulárně podána premedikace: ketamin 10 mg/kg (Narketan, Vetoquinol), azaperon 5 mg/kg (Stresnil, Janssen) a atropin 0,1 mg/kg (Atropin, Biotica). Anestezie byla indukována intravenózním podáním propofolu v dávce 2 mg/kg (Propofol 1%, Fresenius) a fentanylu v dávce 100 μg (Fentanil, Torrex) do ušní žíly. Zvířata byla intubována a řízeně ventilována (Servoventilator, Siemens, Sweden, FiO2 0,4, PEEP 5 cm H20, dechový objem 10 ml/kg). Ventilace byla nastavena s ohledem na cílové arteriální PCO2 v rozmezí 4,0–5,0 kPa. K relaxaci bylo užito vecuronium (Norcuron, Organon) v úvodní dávce 0,1 mg/kg, dále 0,8 μg/kg/min do konce operace. Anestezie byla vedena intravenózně fentanylem (10 až 15 μg/kg/hod.) a propofolem (6–10 mg/kg/hod.). Byl zaveden katétr (18 G, Braun) do femorální tepny k monitoraci krevního tlaku a odběru vzorků krve, trojcestný centrální žilní katétr (7 Fr, Arrow) do levé jugulární žíly k podávání infuzí a farmak a termodiluční katétr (7 Fr, Arrow) do pulmonální arterie cestou pravé jugulární žíly k měření hemodynamických parametrů a tělesné teploty. Ztráty tekutin byly hrazeny infuzním roztokem v dávce 10 až 15 ml/kg/hod. (Plasmalyte, Baxter).
Pooperační ošetřování
Po uzavření laparotomie byla všechna zvířata dále řízeně ventilována a analgosedována kontinuální infuzí thiopentalu (5 mg/kg/hod.) a fentanylu (5–10 μg/kg/hod.) až do ukončení experimentu. Byly podávány infuzní roztoky (Plasmalyte 10 ml/kg/hod. v kontinuální infuzi a 6% hydroxyetylškrob 130 kD/0.4,Voluven, Fresenius bolusově). Při poklesu středního arteriálního tlaku (MAP) pod 65 mm Hg nereagujícího na volumoterapii byl nasazen noradrenalin (Noradrenalin, Zentiva) v kontinuální infuzi. Tělesná teplota byla ovlivňována chlazením a ohříváním s cílovými hodnotami 37–39 °C. Glykémie byla udržována v rozmezí 4,0 až 7,0 mmol/l infuzí 20% glukózy.
Experiment byl u skupiny zvířat se sepsí ukončen po nástupu septického šoku, minimálně 24 hodin po výkonu, u kontrolní skupiny po 24 hodinách po operaci. Na konci experimentu byla provedena revize dutiny břišní s odběrem vzorků tkání. Zvířata byla poté utracena podáním bolusu anestetik.
Monitorace
Byly monitorovány vybrané parametry (Marquette, USA): elektrokardiogram, střední arteriální tlak (MAP), centrální žilní tlak (CVP), tělesná teplota, saturace kyslíku v periferní krvi. Byl zaznamenáván srdeční výdej (CO) a tlak v zaklínění (PCWP) a počítán srdeční index (CI) a indexovaná systémová vaskulární rezistence (SVRI). Měření byla prováděna na začátku experimentu (čas T0), na konci operace (čas T1), dále po 8 hodinách (T8), po 16 hodinách (T16) a po 24 hodinách (T24) po výkonu.
Odběry a hodnocení vzorků krve, plazmy a histologického materiálu
Na začátku experimentu a dále v 6hodinových intervalech po operaci byly odebírány vzorky arteriální krve k biochemickému vyšetření (urea, kreatinin, AST, ALT, bilirubin, ALP, GMT), stanoven počet leukocytů a protrombinový čas. Po úvodu do anestezie, po 1 hodině po operaci a dále vždy po 3 hodinách byly odebírány vzorky arteriální krve k analýze plazmatické koncentrace C-reaktivního proteinu (CRP); TA 901 (Tridelta Development Ltd.) – porcine C-reactive protein assay).
Na konci experimentu byly odebrány vzorky krve k mikrobiologickému vyšetření.
Histologická analýza
Biopsie z jater, ledviny, sleziny, tlustého střeva byla odebrána po laparotomii a revizi dutiny břišní a následně před ukončením experimentu. Při ukončení pokusu byla navíc odebrána biopsie ze srdce a plic. Tkáně byly fixovány v 10% pufrovaném formolu a zality do parafinu. Tkáně zalité do parafinu byly nakrájeny na 3–4 μm silné řezy a nabarveny hematoxilin-eosinem, Sirius-red s elastikou, PAS a Gramovým barvením. Řezy byly vyhodnoceny na mikroskopu Olympus BX41.
Statistické zpracování
Data byla zpracována programem Statistica verze 8 (StatSoft). Číselné hodnoty jsou uváděny ve tvaru průměr ± směrodatná odchylka. Ke srovnání septické a kontrolní skupiny byl použit neparametrický Mannův-Whitneyův test.
VÝSLEDKY
Na začátku experimentu nebyl prokázán signifikantní rozdíl mezi oběma skupinami ve sledovaných klinických a laboratorních parametrech, nelišily se ani histologické nálezy, které odpovídaly obrazu normálních tkání.
V pooperačním období byla kontrolní skupina hemodynamicky stabilní, ve srovnání se skupinou septickou vykazovala významně nižší spotřebu koloidních roztoků (graf 1). (Pozn.: Vzhledem k tomu, že mezi hodnotami naměřenými v čase T0 a T1 nebyly u jednotlivých zvířat zachyceny rozdíly, je v grafech 1 až 4 znázorněn pouze čas T1). U žádného zvířete v kontrolní skupině nebylo nutné podávání noradrenalinu k udržení perfuzního tlaku. Naopak u všech zvířat s vyvolanou nitrobřišní sepsí pomocí CLP byl v rozmezí 15–36 hodin od operace vyvolán septický šok s febrilní reakcí, tachykardií a hypotenzí vyžadující kontinuální přívod noradrenalinu k udržení MAP na hodnotě nad 65 mm Hg. Průměrná dávka noradrenalinu u septických zvířat byla 0,7 ± 0,6 μm/kg/min.
Graf 1. Srovnání průměrné spotřeby koloidů mezi skupinou septických (88,0 ± 69,0 ml/hod.) a kontrolních zvířat (32,3 ± 20,3 ml/hod.) (p = 0,04) 
Tepová frekvence u zvířat septické skupiny oproti zvířatům kontrolní skupiny v průběhu sledování významně stoupla (graf 2).
Graf 2. Tepová frekvence ve skupině septických a kontrolních zvířat v časovém průběhu 
Rozdíly v hodnotách indexovaného srdečního výdeje a v hodnotách indexované systémové vaskulární rezistence nedosahovaly v jednotlivých časech statistické významnosti (graf 3).
Graf 3. Srdeční index (a) a indexovaná systémová vaskulární rezistence (b) v průběhu experimentu u septických a kontrolních zvířat 
Byl zaznamenán významný rozdíl v tělesné teplotě mezi oběma skupinami v pooperačním průběhu. Průměrná tělesná teplota zvířat kontrolní skupiny se významně neměnila, naopak u septické skupiny vystoupala na 40,8 ± 0,96 °C (graf 4).
Graf 4. Průměrná tělesná teplota v kontrolní a septické skupině v časovém průběhu 
Sérové koncentrace ALT, AST, bilirubinu, GMT, ALP, urey a kreatininu ani hodnoty protrombinového času se v průběhu experimentu významně nelišily mezi oběma skupinami. Nebyl prokázán statisticky významný rozdíl mezi oběma skupinami v hladinách laktátu v arteriální krvi. V kontrolní skupině byla úvodní průměrná hodnota laktátu 2,4 ± 1,9 mmol/l, v septické skupině 3,6 ± 1,5 mmol/l (p = 0,44). Na konci experimentu dosahovaly průměrné hodnoty laktátu u kontrolních zvířat 1,0 ± 0,2 mmol/l a u zvířat se sepsí 1,9 ± 0,7 mmol/l (p = 0,49), rozdíl mezi změnou hodnot laktátu na začátku a na konci experimentu nedosahoval při porovnání mezi skupinami statistické významnosti (p = 0,62).
Úvodní průměrný počet leukocytů byl v kontrolní skupině 9,2 ± 4,9 × 109/l, ve skupině septické 8,4 ± 5,1 × 109/l, rozdíl nebyl statisticky významný (p = 0,32). Počet leukocytů se v kontrolní skupině v časovém průběhu neměnil (7,3 ± 3,7 × 109/l), u septických zvířat došlo k rozvoji leukopenie (3,5 ± 3,2 × 109/l), rozdíl mezi oběma skupinami na konci experimentu ale nebyl statisticky významný (p = 0,69).
Nebyly nalezeny statisticky významné rozdíly mezi oběma skupinami v rozdílu hodnot CRP (delta CRP) na začátku a na konci experimentu (p = 0,67) (graf 5).
Graf 5. Porovnání rozdílu CRP mezi hodnotami na začátku a na konci experimentu (delta CRP) u zvířat septické a kontrolní skupiny 
V hemokulturách septických zvířat byla na konci experimentu prokázána směs střevních bakterií (Escherichia coli, Enterococcus species, Pseudomonas aeruginosa, Klebsiella pneumoniae, Burgholderia cepacia, Acinetobacter species, Enterobacter cloacae, stafylokoky).
Na konci experimentu byla u všech miniprasat s CLP oproti kontrolní skupině nalezena peritonitida s přítomností séropurulentního sekretu v dutině břišní, na céku byly známky ischemické nekrózy (obr. 3).
Obr. 3. Obraz peritonitidy v septické skupině 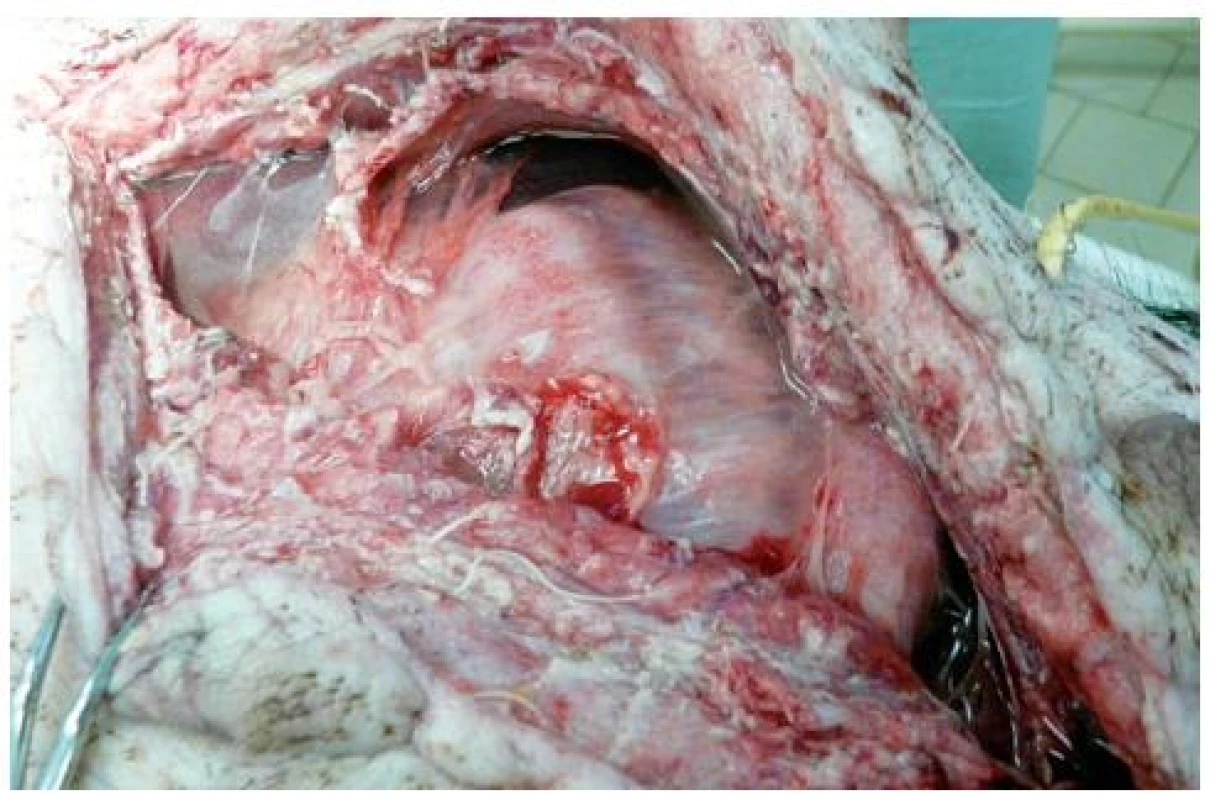
Histologický obraz vzorků odebraných orgánů byl na začátku experimentu u obou skupin fyziologický. Na konci experimentu byly ve všech vzorcích v septické skupině oproti skupině kontrolní popsány změny odpovídající vlivu sepse: centrolobulární nekrózy jater, akutní tubulární nekróza a zvýšená perfuze ledvin, edém a fibro-purulentní exsudát na serózách, v myokardu byly přítomny myomalacie a na plicích edém (obr. 4).
Obr. 4. Histologické nálezy v orgánech na konci experimentu u skupiny septických a kontrolních zvířat 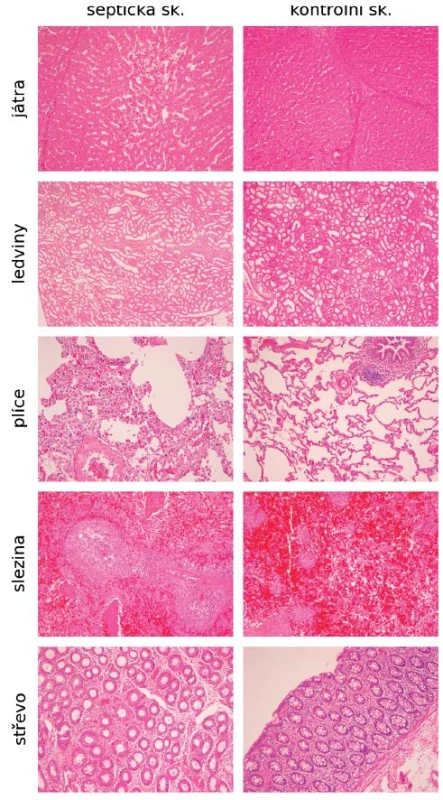
DISKUZE
Sepse stále patří mezi nejzávažnější akutní stavy v medicíně. Pozdní diagnostika výrazně zhoršuje výsledky léčby. Rozpoznání dynamiky patofyziologických změn je jedinou možností, která vede k časné diagnostice s následnou cílenou léčbou. Výzkum změn při sepsi v humánní medicíně je složitý z mnoha důvodů metodologických. U zvířecích modelů sepse můžeme řadu těchto faktorů odstranit. Proto se tento model stává homogenním, opakovatelným a lépe reprodukovatelným. Na druhou stranu není přesně převoditelný do humánní medicíny (3).
V současnosti jsou užívány tři experimentální zvířecí modely sepse – model přijetí exogenního toxinu, model exogenní bakteriální infekce a model porušení hostitelských bariér. Žádný z těchto modelů není optimální; každý z těchto modelů má výhody, ale i nevýhody ve srovnání s přirozeným rozvojem sepse.
Model s požitím endotoxemie
V roce 1940 Andre Boivin první izoloval endotoxin z Gram negativních bakterií. Bordon a Hall později popsali, že právě endotoxin indukuje lidský ekotoxický šok (4). V současnosti je lipopolysacharid (LPS) nejčastěji užívaný endotoxin k vyvolání experimentální sepse.
Model sepse způsobený endotoxemií je poměrně jednoduchý a dobře sledovatelný model. Na druhou stranu v podrobnostech tento model není totožný se septickým stavem. Hemodynamické změny po aplikaci LPS u lidí nejsou identické změnám pozorovatelným v sepsi (5). Hemodynamické změny v endotoxemickém modelu plně nenapodobují změny u septických pacientů, zejména není jasně vyjádřena hyperdynamická a hypodynamická fáze (6).
Exogenní infekční model
Infekce způsobená exogenními bakteriemi má řadu nevýhod. Mezi hlavní nevýhody patří přesné stanovení letální dávky bakterií. Signifikantní rozdíly byly nalezeny v mediátorové odpovědi organismu v závislosti na bakteriální zátěži (7). Cytokinovou odpověď modifikuje i infikovaný kompartment (krevní řečiště – peritoneální dutina). Proto je v současnosti tento model využíván zejména ke studiu hostitelské odpovědi na přesně známý patogen v daném tělesném kompartmentu.
Model porušené hostitelské bariéry
Tento model využívá hostitelskou fyziologickou smíšenou bakteriální flóru jako infekční inzult při artificiálně navozené poruše přirozené bariéry. Nejčastější model je model ligace céka s incizí (CLP) a model využívající založený stent do vzestupného tračníku (CASP).
Model ligace céka
Prvně byl popsán v roce 1980 Irshadem Chaudrym v publikaci Wichtermanna (8) jako model ligace céka bez poranění stěny střeva u myší. Následně byl tento model doplněn punkcí stěny střeva, kdy otvorem ve stěně střeva byl zajištěn průnik bakterií do peritoneální dutiny. Tento model napodobuje klinický průběh u perforované apendicitidy nebo divertikulitidy. Byl považován za „zlatý standard“ pro studium časné fáze sepse. Výhodou tohoto modelu je snadná reprodukovatelnost, relativní ekonomická dosažitelnost a možnost použití na malých i velkých zvířatech. Mezi nevýhody tohoto způsobu vyvolání sepse je uváděna schopnost organismu ohraničovat infekční fokus, a tvoři tak abscesová ložiska bez vývoje generalizovaného septického stavu.
Model CASP – založení stentu do vzestupného tračníku
Ve srovnání s předchozím modelem literatura uvádí, že přes zavedený stent do vzestupného tračníku nepřetržitě proniká infekční obsah do peritoneální dutiny a minimální možnost vytvoření abscesového ložiska (9).
V našem experimentu jsme využili model ligace céka s definovanou velikostí artificiálního otvoru v céku. Tento model jsme si vybrali jako stav, který se nejvíce blíží patologickým stavům v humánní medicíně (perforace slepého střeva, perforace divertikulitidy). Punkční porušení celistvosti stěny střeva jsme nahradili perforací céka trokarem 12 mm v průměru. Tím jsme umožnili i standardizaci velikosti perforačního otvoru.
Ze sledovaných klinických ukazatelů sepse se srdeční výdej a systémová vaskulární rezistence mezi oběma skupinami významně nelišily, dle protokolu byla snaha o udržení středního arteriálního tlaku, srdečního výdeje a vaskulární rezistence v rozmezí cílových hodnot podáváním koloidních roztoků a noradrenalinu.
Přes prokazatelný rozvoj sepse nedošlo k významné elevaci hodnot laktátu v arteriální krvi, zřejmě díky časné tekutinové resuscitaci septických zvířat.
Nedošlo k významným změnám biochemických parametrů u septických zvířat v průběhu sledování. Nedošlo ani k významné elevaci CRP u zvířat septické skupiny. Toto zjištění je možné vysvětlit tím, že délka experimentu (minimálně 24 hodin) nebyla pro rozvoj těchto změn dostatečná.
Opakovaně bylo prokázáno, že prokalcitonin je lepším prediktorem bakteriální sepse než CRP. Specifické diagnostické kity pro stanovení prokalcitoninu u prasat ale nejsou k dispozici (10).
ZÁVĚR
V naší experimentální sestavě jsme prokázali, že metoda ligace céka s definovanou velikostí otvoru ve stěně střeva je možným modelem septického stavu. U všech experimentálních zvířat s CPL došlo k rozvoji difuzní peritonitidy, bez známek tvorby abscesového ložiska a s postupným rozvojem sepse. Proto považujeme tento model jako optimální pro další studium rozvoje septického stavu na experimentálních zvířatech.
Zkratky
ALP – alkalická fosfatáza
ALT – alaninaminotransferáza
AST – aspartátaminotransferáza
CASP – založení stentu do vzestupného tračníku
CI – srdeční index
CLP – cekální ligace a punkce
CO – srdeční výdej
CRP – C-reaktivní protein
CVP – centrální žilní tlak
GMT – gama-glutamyltransferáza
LPS – lipopolysacharid
MAP – střední arteriální tlak
PCWP – tlak v zaklínění
SVRI – systémová vaskulární rezistence indexovanáPodpořeno grantem IGA NS10556-3/2009 MZ ČR.
Adresa pro korespodenci:
prof. MUDr. Robert Gürlich, CSc.
Chirurgická klnika 3. LF UK a FNKV
Šrobárova 50, 100 34 Praha 10
e-mail: robert.gurlich@fnkv.cz
Zdroje
1. Angus DC, et al. Epidemiology of severe sepsis in the United States: Analysis of incidence, outcome, and associated costs of care. Crit Care Med 2001; 29 : 1303.
2. Dellinger PD, et al. for the International Surviving Sepsis Campaign Guidelines Committee. Surviving Sepsis Campaign: International Guidelines for Management of Severe Sepsis and Septic Shock: Crit Care Med 2008; 36 : 296–327.
3. Rittirsch D et al. The disconnect between animal models of sepsis and human sepsis. Leukoc Biol 2007; 81 : 137–143.
4. Borden CW, et al. Fatal transfusion reactions from massive bacterial contamination of blood. N Engl J Med 1951; 245 : 760–765.
5. Meng G, et al. Antagonistic antibody prevents toll-like receptor 2-driven lethal shock-like syndromes. Clin Invest. 2004; 113 : 1473–1481.
6. Riedemann NC, et al. The enigma of sepsis. J Clin Invest 2003; 112 : 460–467.
7. Deitch EA. Animal models of sepsis and shock: a review and lessons learned. Shock 1998; 9 : 1–11.
8. Wichterman KA, et al. Sepsis and septic shock: a review of laboratory models and a proposal. J Surg Res 1980; 29 : 189–201.
9. Conn PM. Sourcebook of models for biomedical research. Totowa, New Jersey: Humana Press 2008.
10. Simon L, et al. Serum procalcitonin and C-reactive protein levels as markers of bacterial infection: a systematic review and meta-analysis. Clin Infect Dis 2004; 15 : 206–217.
Štítky
Adiktologie Alergologie a imunologie Angiologie Audiologie a foniatrie Biochemie Dermatologie Dětská gastroenterologie Dětská chirurgie Dětská kardiologie Dětská neurologie Dětská otorinolaryngologie Dětská psychiatrie Dětská revmatologie Diabetologie Farmacie Chirurgie cévní Algeziologie Dentální hygienistka
Článek vyšel v časopiseČasopis lékařů českých
Nejčtenější tento týden
- Psilocybin je v Česku od 1. ledna 2026 schválený. Co to znamená v praxi?
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejčastější nežádoucí účinky venlafaxinu během terapie odeznívají
-
Všechny články tohoto čísla
- Dlouhodobá udržovací léčba idiopatických střevních zánětů*
- Statíny do pitnej vody? Riziko vedľajších účinkov a nízkych hladín cholesterolu
- Cékální ligace a punkce u miniprasat – metoda studia sepse
- Cékální ligace a punkce u miniprasat – metoda studia sepse
- Plánované akce odborných složek ČLS JEP
- Lékař a svoboda svědomí
- Nekuřácký Nový Zéland 2025 – utopie nebo vzor?
- Plánované akce odborných složek ČLS JEP
- Česká dětská kardiochirurgie – historie a současnost
-
Mezikrajská konference pracovníků klinické biochemie a hematologie Plzeňského a Karlovarského kraje
Klatovy, 7. března 2012 -
11. medzinárodná konferencia o lyzozómových poruchách
Londýn, 2.–3. marec 2012 -
XXIV. dermatovenerologický seminář jihomoravského regionu
Brno, 15. března 2012 -
Kurz sanační a rekonstrukční chirurgie středního ucha ve Svitavách
Svitavy, 22. a 23. března 2012 -
Jarní hematologické sympozium regionu jižní Moravy a kraje Vysočina
Brno, 30. a 31. března 2012 -
Ostravský den preventivní pediatrie s mezinárodní účastí
Ostrava, 16. března 2012 - Psychologie Atkinsonové a Hilgarda
- Rodney Robert Porter
- Časopis lékařů českých
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Psychologie Atkinsonové a Hilgarda
- Česká dětská kardiochirurgie – historie a současnost
- Statíny do pitnej vody? Riziko vedľajších účinkov a nízkych hladín cholesterolu
- Dlouhodobá udržovací léčba idiopatických střevních zánětů*
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



