-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Akutní intermitentní porfyrie
9. 6. 2021
Jako porfyrie (nebo také porfyrická choroba) se označuje skupina vzácných dědičných metabolických nemocí způsobených získanou či vrozenou poruchou syntézy hemu. V důsledku každé konkrétní enzymatické poruchy dochází ke zvýšené tvorbě a akumulaci porfyrinů, porfyrinogenů či jejich prekurzorů.
Etiologie a prevalence
V případě akutní intermitentní porfyrie (AIP) se jedná o enzymatický defekt porfobilinogen deaminázy konvertující porfobilinogen na uroporfyrinogen I. Tento defekt vede k hromadění porfobilinogenu (PBG) v cytoplazmě hepatocytů. V játrech stoupá aktivita δ-aminolevulátsyntázy (δ-ALA syntázy) s následným zvýšením tvorby a vylučováním kyseliny δ-aminolevulové (ALA) a PBG močí.
Jde o autosomálně dominantní onemocnění s různou expresí. Častěji postihuje ženy. AIP se v Česku vyskytuje s prevalencí 5–10/100 000. Choroba se nejčastěji manifestuje v dospělosti, typicky v období mezi 20. a 40. rokem života, jen zřídka před pubertou (1).
InzerceKlinický obraz
Příznaky AIP jsou nespecifické. Základním rysem je, že se střídají období s různě těžkou symptomatologií (ataky AIP) s obdobím, kdy pacienti mohou být zcela asymptomatičtí nebo mají pouze velmi mírné nespecifické příznaky.
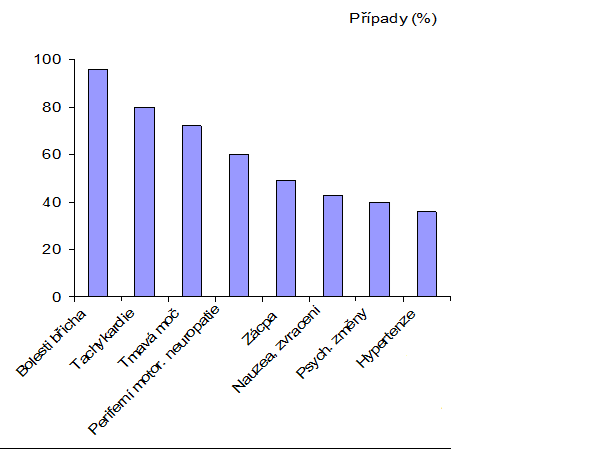
Klinické příznaky akutní ataky můžeme rozdělit na abdominální (bolest břicha, zácpa, zvracení, ileózní stavy), neurologické (poruchy autonomního nervového systému, bolesti hlavy, parestezie, parézy až plegie, poruchy vědomí, zmatenost, křeče, močová retence/inkontinence), psychiatrické (agitovanost, halucinace, neurózy), kardiologické (poruchy rytmu, změny na EKG) a poruchy elektrolytů (často hyponatrémie) (viz obr.).
Obr. Četnost výskytu symptomů ataky AIP (v %)
Diagnostika
Diagnózu potvrdí během akutního záchvatu výrazně zvýšené hladiny PBG a ALA v čerstvé ranní moči (která mívá temně rudou barvu) a zvýšený obsah celkových porfyrinů ve 24hodinovém sběru moči. Referenční rozmezí: PBG < 0,25 mg/dl, ALA < 0,45 mg/dl, celkové porfyriny v moči < 200 µg/24 hod. Vzorky jsou citlivé na světlo, proto je třeba moč transportovat v neprůhledných obalech. Během klidového období jsou ovšem hodnoty ALA, PBG i celkových porfyrinů v normě nebo pouze lehce zvýšené.
AIP je jednou z tzv. akutních porfyrií, proto se diagnostika nemůže opírat pouze o stanovení PBG a ALA, ale při klinickém podezření je indikace k provedení chromatografického vyšetření porfyrinů ve vzorku stolice a vyšetření emisního maxima plazmatických porfyrinů (dostupné v hepatologické laboratoři Ústavu lékařské biochemie a laboratorní diagnostiky 1. LF UK a VFN v Praze) (2). Do klinického obrazu AIP však nepatří chronické jaterní onemocnění. V posledních letech se spolu se zlepšením dlouhodobého přežití pacientů s AIP množí zprávy o vyšším riziku rozvoje hepatocelulárního karcinomu (HCC, primární nádor jater). Po mnoha letech opakovaných záchvatů mohou příznaky přejít do chronicity (1, 3).
Spouštěče atak
Ataky akutní intermitentní porfyrie mohou být spontánní, ale též vyvolané některými inzulty. Nejčastěji jsou spouštěčem ataky léky, zpravidla nově nasazené medikamenty (antibiotika, analgetika, kontraceptiva (podrobný seznam preparátů na webu www.drugs-porphyria.org).
U žen mohou být spouštěčem ataky hormonální změny v průběhu menstruačního cyklu. Studie uvádějí, že 10–30 % cyklických epizod AIP se vyskytuje v luteální fázi menstruačního cyklu [4, 5]. Pravděpodobně hlavním faktorem vyvolávajícím krizi je ovariální hormon progesteron. Progesteron je účinný induktor δ-ALA syntázy (5, 6).
Dalšími spouštěči ataky AIP mohou být alkohol, hladovění (cílené hubnutí, onemocnění zažívacího traktu), infekce, stresové situace nebo operační výkony (1).
Terapie
Strategie péče o pacienty s AIP zahrnuje léčbu akutních atak, prevenci vzniku další ataky, dlouhodobé sledování a léčbu komplikací.
Léčba akutní ataky je závislá na závažnosti stavu. Patofyziologickým cílem léčby je potlačit aktivitu δ-ALA syntázy v játrech. Pacienti s neurologickou symptomatikou, poruchami srdečního rytmu nebo těžkou hyponatrémii by měli být hospitalizování na monitorovaném lůžku (2).
V případě mírné ataky bez dalších komplikací (hyponatrémie, křeče, zvracení) je možné ataku zaléčit zvýšeným příjmem sacharidů (nejčastěji 10% roztok glukózy intravenózně) (7).
V případě závažnějších forem akutní ataky AIP by měla být zvážena terapie hemarginátem (Normosang®), který zpětnovazebně snižuje aktivitu δ-ALA syntázy. Hemarginát se podává i.v. infuzí v dávkování 3 mg/kg/den po dobu 4 dnů (8). S ohledem na to, že výrazně dráždí cévní stěnu, je preferenční cestou podání centrální žilní vstup, jinak jeho opakované použití vede k destrukci povrchových žil končetin. Naředěný roztok i infuzní set je třeba chránit před světlem. Vzhledem k rychlému klinickému zlepšení (často během 1–2 dnů) by měl být hemarginát použit co nejdříve, jakmile dojde k akutnímu záchvatu. Zejména v případě křečí, hyponatrémie, neuropatie či psychózy (9). Ačkoliv je terapie hemarginátem ve většině případů dobře snášena, opakované podání zvyšuje riziko jaterní fibrózy a přetížení organismu železem (dávka 250 mg hemarginátu obsahuje 22,7 mg železa) (7).
Novým lékem na poli terapie AIP se na základě pokroku ve výzkumu malých interferující RNA (siRNA) stal preparát givosiran (Givlaari®). Jedná se dvouvláknovou siRNA zaměřenou proti mRNA δ-ALA syntázy zabraňující její translaci a expresi (10, 11). Preparát se aplikuje subkutánně 1× měsíčně v dávce 2,5 mg/kg (12).
Slibnou se zdá být i možnost genové terapie za účelem zvýšení exprese deficientního proteinu porfobilinogen deaminázy. Všechny tyto preparáty jsou ovšem prozatím ve fázi vývoje a klinických studií (13).
Nedílnou součástí řešení ataky AIP je terapie symptomatická. V případě léčby bolestí se nejčastěji využívají nesteroidní antiflogistika, morfin a buprenorfin (14). Tyto léky jsou považovány za vhodné, ostatní analgetika v různé míře způsobují akumulaci PBG a ALA (15). V terapii nevolnosti a zvracení se nejčastěji užívají chlorpromazin a promethazin, jež zároveň pomáhající při zvládání úzkosti, neklidu, bolesti a snižování potřeby opioidních analgetik. Další možným lékem je ondansetron (16). V terapii kardiovaskulárních symptomů je možné používat betablokátory, blokátory kalciových kanálů nebo inhibitory angiotenzin konvertujícího enzymu (ACEi). Při neurologické symptomatologii je vhodné podávat gabapentin, vigabatrin, levetiracetam a pravděpodobně i bromidy nebo síran hořečnatý (17, 18). V případě hyponatrémie, která se vyskytuje až už 40 % nemocných, je třeba provádět korekci natrémie pozvolna, maximálně o 6 mmol/l za 24 hodin (19).
Prognóza
Prognóza pacientů s AIP je při časné diagnostice a správné terapii první ataky dobrá. Základním přístupem je doživotní vyvarování se expozici všem možným spouštěčům ataky. Každý nemocný by u sebe měl mít průkaz pacienta s AIP, který obsahuje základní informace či možné zdroje informací na internetu.
Příbuzní pacienta s AIP, u kterých byly zjištěné patologické mutace, by se měli též vyhýbat všem možným spouštěčům. Taktéž by měli být poučení o symptomech ataky.
Pacienti s AIP mají být dispenzarizování ve specializovaných centrech (2).
Závěr
AIP je vzácné metabolické onemocnění, které může představovat výzvu z hlediska diagnostiky a léčby. Klíčem ke stanovené diagnózy AIP není symptomatologie, ale podezření (temně rudá moč). Glukóza a hemarginát jsou specifické způsoby léčby akutních záchvatů. Kromě toho je nutná i symptomatická léčba. klíčem k prevenci dalších atak je samozřejmě edukace pacientů směřující k eliminaci vyvolávajících faktorů. Velký pokrok v léčbě AIP představuje givosiran cílený přímo na patofyziologii onemocnění.
Pacienti s AIP vyžadují dlouhodobé sledování, a to ideálně ve specializovaných centrech. Příbuzní pacientů by měli projít genetických screeningem. Všechny léky podávané pacientům s AIP by měli být zkontrolovány v mezinárodní databázi bezpečných léčiv (www.drugs-porphyria.org).
MUDr. Michal Koula
oddělení gastroenterologie, hepatologie a metabolismu, Interní klinika 1. LF UK a ÚVN – VoFN PrahaZdroje:
1. Bissell D. M., Anderson K. E., Bonkovsky H. L. Porphyria. N Engl J Med 2017; 377 (21): 2101.
2. Brůha R., Vítek L., Šperl J., Urbánek P. Doporučený postup České hepatologické společnosti ČLS JEP pro diagnostiku a léčbu akutních porfyrií. Gastroenterologie a hepatologie 2017; 71 (2): 101–104.
3. Meyer U. A., Schuurmans M. M., Lindberg R. L. Acute porphyrias: pathogenesis of neurological manifestations. Semin Liver Dis 1998; 18 (1): 43–52.
4. Hift R. J., Meissner P. N. An analysis of 112 acute porphyric attacks in Cape Town, South Africa: evidence that acute intermittent porphyria and variegate porphyria differ in susceptibility and severity. Medicine (Baltimore) 2005; 84 (1): 48–60.
5. Tamay A. G., Guvenal T., Micili S. C. et al. Evaluation of the effects of gonadotropin-releasing hormone antagonist (GnRH-ant) and agonist (GnRH-a) in the prevention of postoperative adhesion formation in a rat model with immunohistochemical analysis. Fertil Steril 2011; 96 (5): 1230–1233.
6. Herrick A. L., McColl K. E., Wallace A. M. et al. LHRH analogue treatment for the prevention of premenstrual attacks of acute porphyria. Q J Med 1990; 75 (276): 355–363.
7. Balwani M. et al. Acute hepatic porphyrias: recommendations for evaluation and long-term management. Hepatology 2017; 66 (4): 1314–1322.
8. SmPC Normosang. Dostupné na: www.medicines.org.uk/emc/medicine/20795/SPC/normosang/#PRODUCTINFO
9. Mustajoki P., Nordmann Y. Early administration of heme arginate for acute porphyric attacks. Arch Intern Med 1993; 153 (17): 2004–2008.
10. Scott L. J. Givosiran: first approval. Drugs 2020; 80 (3): 335–339.
11. Chan A., Liebow A., Yasuda M. et al. Preclinical development of a subcutaneous ALAS1 RNAi therapeutic for treatment of hepatic porphyrias using circulating RNA quantification. Mol Ther Nucleic Acids 2015; 4: e263.
12. Agarwal S., Simon A. R., Goel V. et al. Pharmacokinetics and pharmacodynamics of the small interfering ribonucleic acid, Givosiran, in patients with acute hepatic porphyria. Clin Pharmacol Ther 2020; 108 (1): 63–72.
13. Fontanellas A., Ávila M. A., Anderson K. E., Deybach J. C. Current and innovative emerging therapies for porphyrias with hepatic involvement. J Hepatol 2019; 71 (2): 422–433.
14. Cardenas J. L., Guerrero C. Acute intermittent porphyria: general aspects with focus on pain. Curr Med Res Opin 2018; 34 (7): 1309–1315.
15. Lambrecht R. W., Gildemeister O. S., Williams A. et al. Effects of selected antihypertensives and analgesics on hepatic porphyrin accumulation: implications for clinical porphyria. Biochem Pharmacol 1999; 58 (5): 887–896.
16. Stein P., Badminton M., Barth J. et al.; British and Irish Porphyria Network. Best practice guidelines on clinical management of acute attacks of porphyria and their complications. Ann Clin Biochem 2013; 50 (Pt. 3): 217–223.
17. Rigor J., Pinto S. A., Martins-Mendes D. Porphyrias: a clinically based approach. Eur J Intern Med 2019; 67 : 24–29.
18. Zadra M., Grandi R., Erli L. C. et al. Treatment of seizures in acute intermittent porphyria: safety and efficacy of gabapentin. Seizure 1998; 7 (5): 415–416.
19. Mrozek S., Rousset D., Geeraerts T. Pharmacotherapy of sodium disorders in neurocritical care. Curr Opin Crit Care 2019; 25 (2): 132–137.Preparation time: April 2021. Code: AS1-CZE-00005
Líbil se Vám článek? Rádi byste se k němu vyjádřili? Napište nám − Vaše názory a postřehy nás zajímají. Zveřejňovat je nebudeme, ale rádi Vám na ně odpovíme.
Štítky
Genetika Kardiologie Neurologie
Přihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání




