-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Primární hyperoxalurie – aktuální možnosti diagnostiky a léčby
1. 12. 2022
Primární hyperoxalurie (PH) je vzácná autosomálně recesivně dědičná porucha glyoxylátového metabolismu vedoucí k nadprodukci oxalátu a jeho ukládání jako šťavelanu vápenatého do tkání, predispozičně do ledvin (1, 2). Následující článek shrnuje poznatky k etiopatogenezi a klinickému obrazu choroby i k aktuálním diagnostickým a terapeutickým postupům a možnostem, jež se změnily zejména po nástupu lumasiranu – inovativního léčiva na bázi malé dvouvláknové interferující RNA (siRNA).
PH1
Etiopatogeneze
Prevalence primární hyperoxalurie 1. typu (PH1) činí v Evropě a Severní Americe 1–3 na 1 milion obyvatel.
PH1 je způsobena deficitem jaterní peroxisomové alanin-glyoxylát aminotransferázy, která konvertuje glyoxylát na glycin. To vede ke zvýšení poolu glyoxylátu a jeho konverzí laktátdehydrogenázou k nadprodukci oxalátu. Gen kódující alanin-glyoxylát aminotransferázu je lokalizován na krátkém raménku 2. chromosomu a je známo asi 150 jeho mutací (3), což vede ke 3 různým variantám aktivity enzymu (4):
Inzerce- absence imunoreaktivního proteinu a jeho katalytické aktivity
- přítomnost imunoreaktivního proteinu a absence jeho katalytické aktivity
- přítomnost imunoreaktivního proteinu a jeho aktivity, ale lokalizované v mitochondriích, ne peroxisomech – mistargeting
Nadbytek oxalátu je vylučován ledvinami, exkrece přesahuje 1 mmol/1,73 m2/24 hod. (norma < 0,5 mmol/1,73 m2/24 hod.), dochází k agregaci krystalů kalciumoxalátu, urolitiáze a nefrokalcinóze. S pokračujícím poškozením ledvin klesá glomerulární filtrace (GF) – poklesne-li pod 30–40 ml/min/1,73 m2, dochází k ukládání oxalátu do tkání (sítnice, myokard, kůže, kosti...), což vede k extrarenální manifestaci choroby (6).
Klinický obraz
Renální manifestace může mít několik podob (1, 7):
- Infantilní oxalóza (26 %) – k projevům nefrokalcinózy a poruše renálních funkcí dochází v prvních 6 měsících života dítěte.
- Opakovaná urolitiáza (30 %) – u dětí jsou symptomy spojeny s urolitiázou: hematurie, renální kolika, infekce močových cest, vzácně akutní renální selhání při oboustranné obstrukci.
- Náhodně zjištěná urolitiáza v dospělosti (30 %).
- Diagnóza po selhání štěpu po transplantaci ledviny (10 %).
- Diagnóza při screeningu v rodině (13 %).
Projevy systémové oxalózy (1, 6) závisejí na tkáni, v níž dochází k ukládání kalciumoxalátu:
- Myokard – poruchy převodní činnosti, které mohou vést až k zástavě srdce.
- Cévy – porucha periferního prokrvení vedoucí ke gangrénám, často komplikuje vytvoření shuntu pro hemodialýzu.
- Klouby – synovitida, omezení hybnosti, bolest.
- Sítnice – ukládání depozit vede ke zhoršení vizu.
- Hypotyreóza.
- Periferní neuropatie.
- Kůže – livedo reticularis, calcinosis cutis metastatica.
Diagnostika
Ke stanovení diagnózy tedy vede opakovaná kalciumoxalátová urolitiáza, případně nefrokalcinóza, významná hyperoxalurie při absenci onemocnění GIT, nadměrného příjmu oxalátu či vitaminu C (1, 9).
V laboratoři potom hyperoxalurie > 1 mmol/1,73 m2/24 hod., zvýšený poměr oxalát/kreatinin v jednorázovém vzorku moči, jehož fyziologické hodnoty se mění s věkem (kojenci ve věku do 6 měsíců < 0,32–0,36; děti od 6 měsíců do 2 let 0,13–0,17; děti od 2 do 5 let 0,098–0,1; děti od 6 do 12 let 0,07–0,08; pacienti starší 16 let < 0,04), a zvýšená exkrece glykolátu v moči (6). Na UZ ledvin je hyperechogenní parenchym, případně urolity, které je možno diagnostikovat i na prostém rtg snímku břicha. K definitivnímu potvrzení diagnózy je potom zapotřebí genetické vyšetření (4, 8).
Diferenciální diagnostika
K odlišení jednotlivých typů PH slouží stanovení zvýšeného renálního odpadu látek v závislosti na enzymatickém defektu patognomickém pro daný typ (zvýšený odpad glykolátu u PH1, kyseliny L-glycerové u PH2 a 4-hydroxy-2-oxoglutarátu u PH3).
Diferenciálně diagnosticky je třeba odlišit jiné poruchy glyoxylátového metabolismu, zvýšený příjem oxalátů ve stravě (čokoláda, kakao, rebarbora, špenát, černý čaj, ořechy...), zvýšenou střevní absorpci při malabsorpci tuků (cystická fibróza, syndrom krátkého střeva). Raritně potom absenci Oxalobacter formigenes – bakterie, která ve střevě degraduje oxalát (10).
Terapie
Úspěšnost léčby (1, 9) závisí na časnosti diagnózy, která umožňuje oddálit konečné stadium chronického onemocnění ledvin (ESRD) i extrarenální manifestaci. Důležitý je zvýšený příjem tekutin (> 3 l/1,73 m2/24 hod.), který snižuje koncentraci kalciumoxalátu v primární moči a jeho ukládání do intersticia ledvin. Dále je třeba omezit potraviny s vysokým obsahem oxalátu (viz výše).
Konvenční farmakoterapie
Ve farmakoterapii lze využít vysoké dávky pyridoxinu (6). Ten je koenzymem alanin-glyoxylát aminotransferázy, která konvertuje glyoxylát na glycin namísto oxalátu. Asi 30 % pacientů s PH1 reaguje na terapii pyridoxinem, tato léčba by tedy měla být zahájena u všech a být podávána po dobu 3–6 měsíců. Počáteční dávka činí 5 mg/kg/den; není-li adekvátní odpověď, potom je možno dávky zvyšovat až na 20 mg/kg/den. Terapie je ukončena, pokud nedojde k signifikantnímu poklesu oxalurie.
Alkalizace moči inhibuje precipitaci kalciumoxalátu – používá se kalium-citrát (0,15 g/kg/den) a magnézium (500 mg/m2/den).
Lumasiran
Novou modalitu léčby představuje lumasiran – malá dvouvláknová interferující RNA (siRNA). Snižuje hladinu glykolátoxidázy díky RNA interferenci – siRNA se navazuje na RISC, ribonukleoprotein, který se váže na mRNA, což vede k její degradaci. Díky tomu dochází k posttranskripčnímu „umlčení“ (silencing) genu pro glykolátoxidázu 1, a tím ke snížení množství glykolátoxidázy, což snižuje hladinu glyoxylátu – tedy substrátu pro vznik oxalátu. Výsledkem je snížení plazmatických i močových hladin oxalátu. Vzhledem k zacílení siRNA na glykolátoxidázu je mechanismus účinku lumasiranu nezávislý na mutaci genu pro alanin-glyoxylát aminotransferázu (AGXT) (13–15).
Lumasiran se podává subkutánně, dávkování je závislé na hmotnosti. Děti mající < 10 kg začínají dávkou 6 mg/kg měsíčně po dobu 3 měsíců, následovanou dávkou 3 mg/kg/měsíc. Děti o hmotnosti 10–20 kg mají úvodní dávku 6 mg/kg měsíčně po dobu 3 měsíců, následně 6 mg/kg každé 3 měsíce. Pro pacienty s hmotností > 20 kg činí úvodní dávka 3 mg/kg měsíčně po dobu 3 měsíců a následně 3 mg/kg každé 3 měsíce.
Urologické intervence, hemodialýza, transplantace
Urologická intervence je indikovaná při obstrukci kamenem – nejčastěji se provádí nefrostomie nebo je zaveden stent. Konvenční hemodialýza nevede k dostatečné eliminaci oxalátu (max. 950–1440 μmol/den, zatímco produkce oxalátu dosahuje 3500–7500 μmol/den). Intenzivní hemodialýza se provádí před transplantací ke snížení plazmatické hladiny oxalátu.
Transplantace jater je u PH1 kurativní metodou (11). Vzhledem k tomu, že pacienti většinou zároveň mají ESRD, lze provést kombinovanou transplantaci jater a ledvin. Druhou možností je transplantace jater následovaná ve druhé době transplantací ledvin. Odstranění depozit kalciumoxalátu z tkání po úspěšné transplantaci ovšem může trvat i více než 2 roky.
Transplantace s sebou samozřejmě nese značná rizika a zátěž, navíc má pacient doživotní imunosupresi po zbytek života. Jako vhodná alternativa nabízející pacientům s PH dobrou prognózu bez nutnosti podstoupit tento zákrok se nyní jeví právě podávání lumasiranu.
PH2 a PH3
Primární hyperoxalurie 2. typu (6) má většinou mírnější průběh než PH1. Je dána deficitem glyoxylát reduktázy/hydroxypyruvát reduktázy, která není přítomná pouze v játrech. Vede ke zvýšenému vylučování glyoxylátu a hydroxypyruvátu, tyto jsou následně konvertovány na oxalát a kyselinu L-glycerovou. Patognomické je zvýšené vylučování L-glycerátu močí, zatímco u PH1 je typické zvýšené vylučování glykolátu (12). V terapii se uplatňuje zvýšený příjem tekutin a alkalizace moči; pyridoxin je vzhledem k patogenezi bez efektu. ESRD u PH2 není tak časté; pokud k němu ovšem pacient dospěje, je indikovaná transplantace ledvin.
Primární hyperoxalurie 3. typu je způsobena defektem zatím neobjasněného genu lokalizovaného na 10. chromosomu. Mohlo by se jednat o defekt 4-hydroxy-2-oxoglutarát aldolázy, která katalyzuje přeměnu oxalátu na hydroxyprolin (1, 3).
Kazuistika
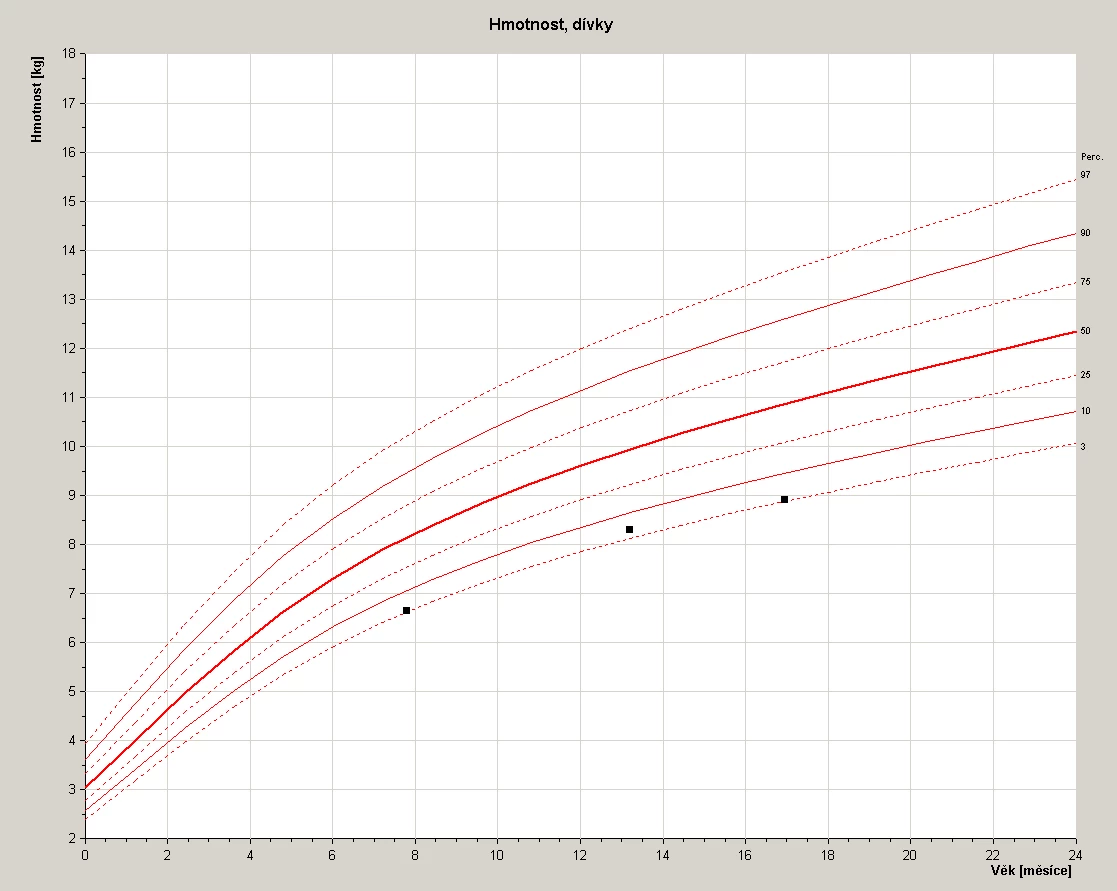
4,5letá dívka byla přijata na oddělení pro febrilie a bolesti hlavy. Do té doby byla zdravá, ovšem pouze hraničně prospívající, hmotnostně na 3. percentilu (viz obr. 1).
Obr. 1 Růstový graf pacientky
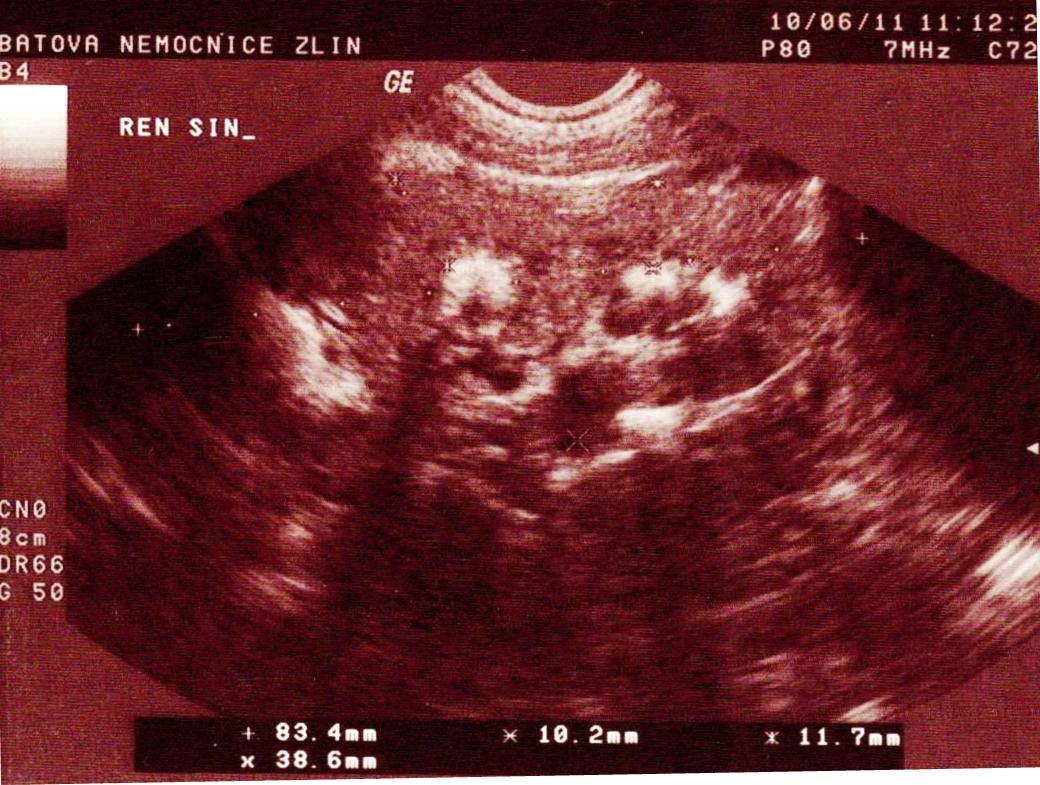
Klinický nález byl při příjmu chudý. Pacientka ameningeální, v laboratoři elevace CRP 119 mg/l, kreatinin 75 μmol/l, leukocytóza 13,6×109, jinak v normě. V moči byl diagnostikován pyurický nález, proto byla zahájena intravenózní antibiotická terapie cefuroximem. Kultivačně v moči prokázána E. coli haemolytica > 105 citlivá na podávaná ATB. Na ultrazvuku (UZ) ledvin popsáno zvětšení a edematózní prosáknutí parenchymu levé ledviny, překvapivě i hyperechogenita papil oboustranně (viz obr. 2).
Obr. 2 Hyperechogenní ledvinný parenchym a papily na UZ při první hospitalizaci
V kontrolní laboratoři pokles zánětlivých parametrů, kontrolní kultivace moči opakovaně sterilní, na UZ ledvin před propuštěním přetrvávaly hyperechogenní papily. Pro podezření na poruchu kalciového metabolismu byl odebrán jednorázový vzorek moči pro screening urolitiázy, matka však žádala propuštění do ambulantní péče ještě před obdržením výsledků. Dívka tedy byla propuštěna s terapií cefuroximem ve formě sirupu, doporučeny kontroly moči a klinického stavu praktickým lékařem, další došetření cestou nefrologické ambulance.
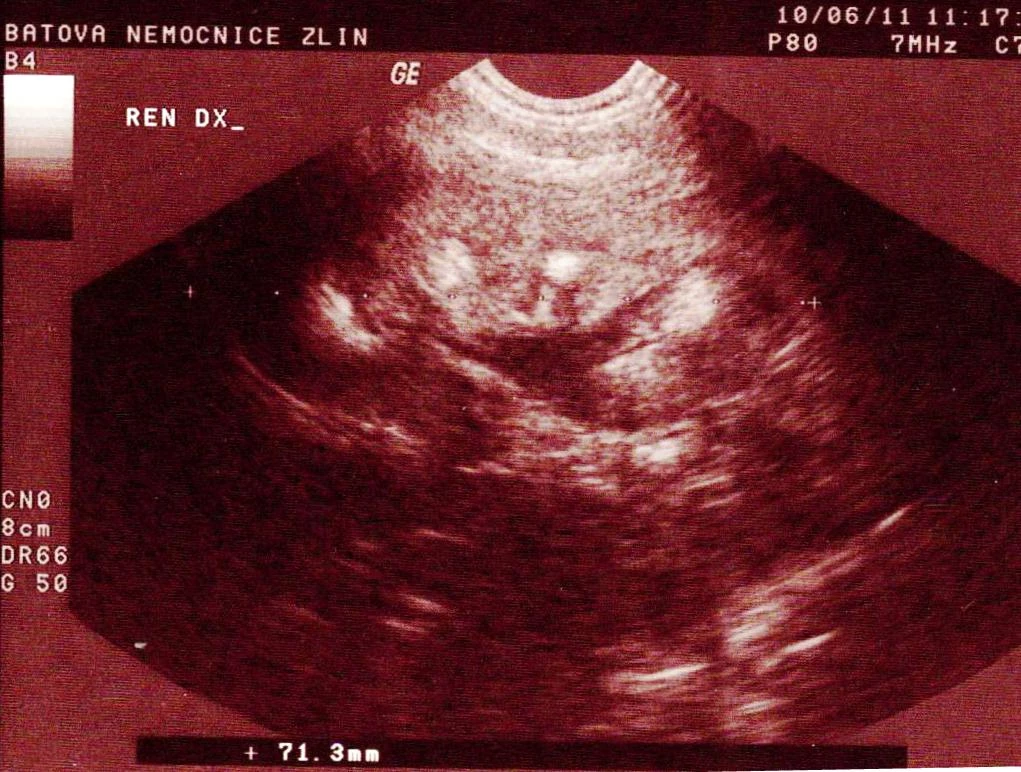
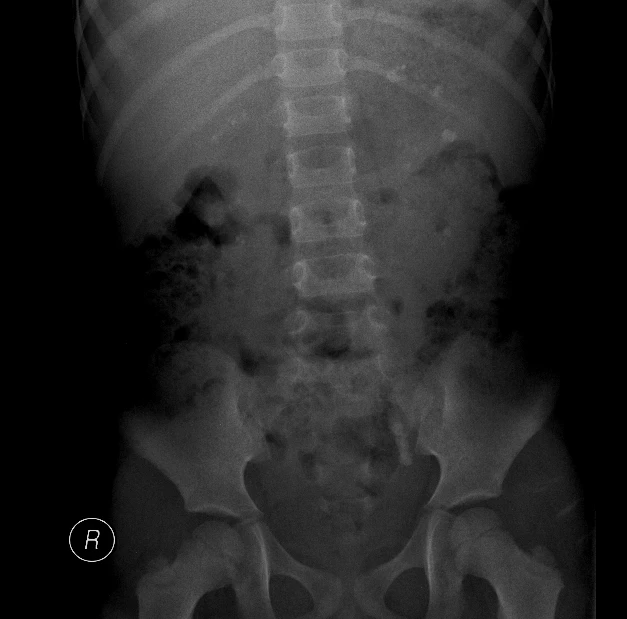
Po týdnu v domácí péči, kdy byla unavená a subfebrilní, přichází k rehospitalizaci pro febrilie a bolesti břicha. V laboratoři opět elevace zánětlivých parametrů, CRP 157,4 mg/l. V moči pyurie, proto zahájena ATB léčba gentamicinem. Kultivačně byla v moči prokázána Klebsiella pneumoniae, kmen s širokou produkcí betalaktamáz, citlivá na gentamicin. V jednorázovém vzorku moči odebraném při předcházející hospitalizaci byla zjištěna výrazná hyperoxalurie 1,72 mmol/l, poměr oxaláty/kreatinin 0,782. Na UZ ledvin oboustranně hyperechogenní parenchym, vpravo redukován na 6 mm, vlevo na 7,6 mm, navíc známky levostranné pyelonefritidy a nově dilatace kalicho-pánvičkového systému (KPS) vlevo (viz obr. 3). Pro podezření na urolitiázu jsme doplnili nativní rtg snímek břicha, kde byly popsány mnohočetné kalcifikace projikující se do stínů obou ledvin, navíc vlevo podél sakroiliakálního (SI) skloubení se zobrazoval řetízkovitý stín, v.s. 3 urolity průměru 4–5 mm (viz obr. 4). Hladiny Ca, P a Mg v séru i parathormon (PTH) byly v normě.
Obr. 3 Dilatace dutého systému a redukce parenchymu levé ledviny při rehospitalizaci
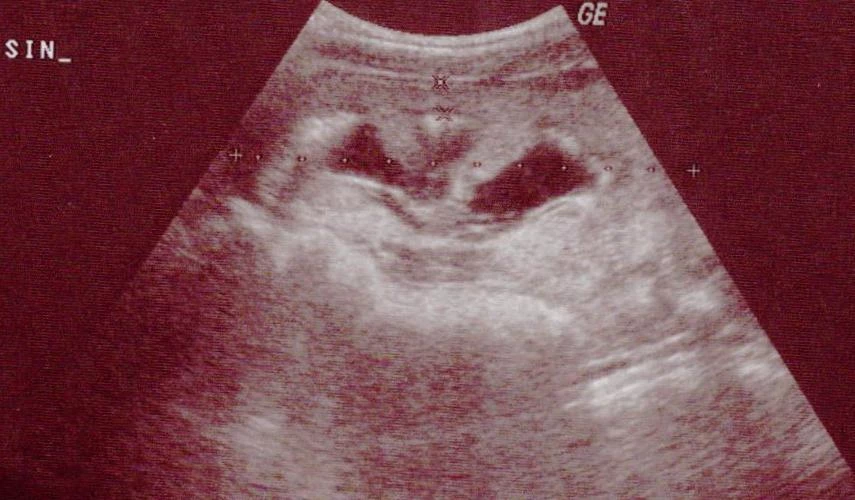
Obr. 4 Prostý rtg snímek břicha s mnohočetnými kalcifikacemi
Vzhledem k podezření na hyperoxalurii jsme zahájili podávání pyridoxinu. V laboratoři však docházelo ke zhoršování parametrů ledvinných funkcí (viz tab. 1), bilance tekutin vyrovnaná, diuréza 3,7 ml/kg/hod., glomerulární filtrace dle cystatinu C 0,62 ml/s/1,73 m2.
Tab. 1 Vývoj laboratorních výsledků během hospitalizací
Datum
4. 6.
10. 6.
17. 6.
21. 6.
urea (mmol/l)
6,3
12,7
13,7
kreatinin (μmol/l)
75
152
185
kyselina močová (μmol/l)
507
540
450
CRP (mg/l)
109
14,1
157
88
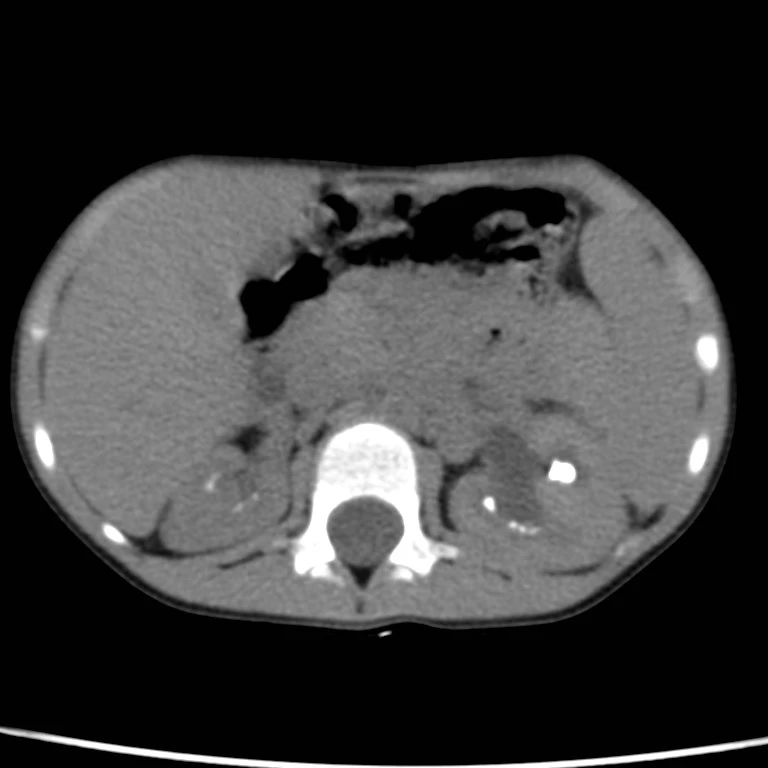
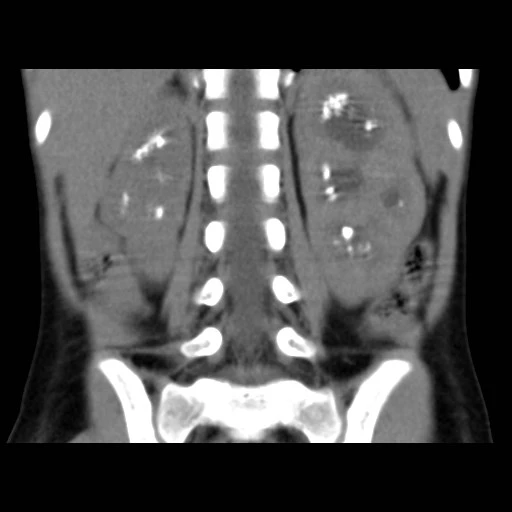
Proto byla dívka po 3 dnech hospitalizace přeložena k dalšímu došetření na vyšší pracoviště. Zde bylo doplněno nativní CT ledvin s nálezem dřeňových kalcifikací charakteru nefrokalcinózy, mírné levostranné dilatace KPS vlevo (viz obr. 5). Rtg hrudníku bez kalcifikací, echokardiografie s normálním nálezem.
Obr. 5 Nativní CT břicha s mnohočetnými urolity (snímky poskytnuty laskavostí MUDr. Lucie Horáčkové, Klinika dětské radiologie LF MU a FN Brno)
Pokračovala ATB terapie, při které došlo k poklesu zánětlivých parametrů. Vzhledem k tomu, že na našem pracovišti byla zahájena terapie pyridoxinem, byl tímto ovlivněn 24hodinový sběr moči na litogenní soubor. Proto byla pacientka konzultována se zahraničním pracovištěm (Mayo Clinic) a bylo schváleno genetické vyšetření jako rozhodující pro určení diagnózy. V průběhu 2. týdne hospitalizace byl v moči opakovaně nález drobných konkrementů, biochemicky oxalátová litiáza. V laboratoři přetrvával stacionární nález zhoršené glomerulární filtrace, hyperazotémie, pokles oxalurie na 0,92 mmol/l.
Dívka byla propuštěna do domácí péče s terapií pyridoxinem a Vitar sodou k alkalizaci moči, byla jí doporučena strava bez oxalátů. Následně u ní byla geneticky potvrzena hyperoxalurie I. typu, hyperazotémie byla stacionární, chronické onemocnění ledvin (CKD) 2. stupně s postupnou progresí – od 10/2013 byla dialyzována a zařazena na waiting list k transplantaci. V lednu 2014 byla provedena úspěšná kombinovaná transplantace jater a ledviny ve FN Motol.
MUDr. Dagmar Uvírová
ordinace PLDD, Uherské HradištěLiteratura:
- Watts R. W. Primary hyperoxaluria type I. QJM 1994; 87 : 593–600.
- Cochat P. Primary hyperoxaluria type 1. Kidney Int 1999; 55 : 2533–2547.
- Danpure C. J, Jennings P. R., Fryer P. et al. Primary hyperoxaluria type 1: genotypic and phenotypic heterogeneity. J Inherit Metab Dis 1994; 17 : 487–499.
- Danpure C. J. Advances in the enzymology and molecular genetics of primary hyperoxaluria type 1. Prospects for gene therapy. Nephrol Dial transplant 1995; 10 (Suppl. 8): 24–29.
- Seargeant L. E., deGroot G. W., Dilling L. A. et al. Primary oxaluria type 2 (L-glyceric aciduria): a rare cause of nephrolithiasis in children. J Pediatr 1991; 118 : 912–914.
- Hoppe B., Beck B. B., Milliner D. S. The primary hyperoxalurias. Kidney Int 2009; 75 : 1264–1271.
- Cochat P., Koch Nogueira P. C., Mahmoud M. A. et al. Primary hyperoxaluria in infants: medical, ethical, and economic issues. J Pediatr 1999; 135 : 746–750.
- Milliner D. S., Harris P. C., Sas D. J. et al. Primary hyperoxaluria type 1. GeneReviews, 2022 Feb 10.
- Cochat P., Hulton S. A., Acquaviva C. et al. Primary hyperoxaluria type 1: indications for screening and guidance for diagnosis and treatment. Nephrol Dial Transplant 2012; 27 : 1729–1736.
- Hoppe B., Groothoff J. W., Hulton S. A. et al. Efficacy and safety of Oxalobacter formigenes to reduce urinary oxalate in primary hyperoxaluria. Nephrol Dial Transplant 2011; 26 : 3609–3615.
- Bergstralh E. J., Monico C. G., Lieske J. C. et al. Transplantation outcomes in primary hyperoxaluria. Am J Transplant 2010; 10 : 2493–2501.
- Milliner D. S. The primary hyperoxalurias: an algorithm for diagnosis. Am J Nephrol 2005; 25 : 154–160.
- Liebow A., Li X., Racie T. et al. An investigational RNAi therapeutic targeting glycolate oxidase reduces oxalate production in models of primary hyperoxaluria. J Am Soc Nephrol 2017; 28 : 494–503.
- Milliner D. S. SiRNA therapeutics for primary hyperoxaluria: a beginning. Mol Ther 2016; 24 : 666–667.
- Wood K. D., Holmes R. P., Knight J. RNA interference in the treatment of renal stone disease: current status and future potentials. Int J Surg 2016; 36 : 713–716.
- Jaklevic M. C. First drug approved for rare genetic disorder affecting kidneys. JAMA 2021; 325 : 214.
- FDA approval of lumasiran for treatment of primary hyperoxaluria type 1. U.S. Food and Drug Administration, 2020 Nov 23. Dostupné na: www.fda.gov/news-events/press-announcements/fda-approves-first-drug-treat-rare-metabolic-disorder
- Garrelfs S. F., Frishberg Y., Hulton S.-A. et al. Lumasiran, an RNAi therapeutic for primary hyperoxaluria type 1. N Engl J Med 2021; 384 : 1216–1226.
- Frishberg Y., Van’t Hoff W. G., Hulton S.-A. et al. A phase 1/2 trial of lumasiran (ALN-GO1), an investigational RNA interference (RNAi) therapeutic for primary hyperoxaluria type. Pediatr Nephrol 2018; 33 : 1807–2008.
- Sas D. J., Magen D., Hayes W. et al. Phase 3 trial of lumasiran for primary hyperoxaluria type 1: a new RNAi therapeutic in infants and young children. Genet Med 2022; 24 : 654–662.
- SPC Oxluma. Dostupné na: www.ema.europa.eu/en/documents/product-information/oxlumo-epar-product-information_cs.pdf
Líbil se Vám článek? Rádi byste se k němu vyjádřili? Napište nám − Vaše názory a postřehy nás zajímají. Zveřejňovat je nebudeme, ale rádi Vám na ně odpovíme.
Štítky
Genetika Kardiologie Neurologie
Přihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



