-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Protonová radioterapie v léčbě solidních nádorů
Proton radiation therapy in the treatment of solid tumours
Proton radiotherapy is a form of ionizing radiation treatment using accelerated protons. The basic physical property of proton radiation is that they deliver most of their energy at the end of their path in the tissue, which is final and its depth is given by the initial energy of the protons. This leads to a dose distribution of radiation, which, compared to modern photon radiation Therapy, places less burden on healthy tissues, especially in the middle and low dose range. The first irradiation of the proton took place in 1954 and the method is technologically mature. Indications are discussed – we describe indications most common in proton centres as well as published results.
Keywords:
proton radiotherapy – pencil beam scanning – solid tumours
Autoři: J. Kubeš 1,2; V. Vondráček 1; J. Abrahámová 1,3
Působiště autorů: Proton Therapy Center Czech s. r. o., Praha, Primář: MUDr. Jiří Kubeš, PhD. 1; Onkologická klinika 2. LF UK a FN Motol, Praha, Přednostka: doc. MUDr. Jana Prausová, PhD., MBA 2; Komplexní onkologické centrum Nemocnice Na Bulovce ve spolupráci se Všeobecnou fakultní nemocnicí v Praze a Thomayerovou nemocnicí, Vedoucí: prof. MUDr. Jitka Abrahámová, DrSc. 3
Vyšlo v časopise: Prakt. Lék. 2019; 99(1): 3-10
Kategorie: Postgraduální vzdělávání
Souhrn
Protonová radioterapie je formou léčby ionizujícím zářením, využívající urychlených protonů. Základní fyzikální vlastností protonového záření je skutečnost, že předávají většinu své energie při konci své dráhy ve tkáni, která je konečná a její hloubka je dána počáteční energií protonů. Tato skutečnost vede k dávkové distribuci záření, která ve srovnání s moderní fotonovou radioterapií méně zatěžuje zdravé tkáně, zejména v oblasti středních a nízkých dávek. První ozařování protony proběhlo v roce 1954 a metoda je technologicky zralá. O indikacích je vedena diskuze – popisujeme indikace obvyklé v protonových centrech a publikované výsledky.
Klíčová slova:
protonová radioterapie – pencil beam scanning – solidní nádory
ÚVOD
Radioterapie je nedílnou součástí komplexní onkologické léčby. Léčba ionizujícím zářením je však vždy spojena s určitým rizikem vzniku nežádoucích účinků, které se mohou projevovat v horizontu měsíců až desítek let od provedeného ozáření. Třicet let po provedené radioterapii se procento pacientů ozařovaných v dětství nebo juvenilním věku s velmi závažnými nežádoucími účinky radioterapie (stupně 3 až 5 dle CTCAE) pohybuje mezi 30–50 % (1). Z těchto důvodů je v oboru radiační onkologie snahou vyvíjet technologie, které umožní redukovat radiační zátěž zdravých tkání při zachování kvalitního ozáření nádorového ložiska. Zdokonalují se technologie fotonové radioterapie, kde jsou k dispozici přístroje pro vysoce konformní radioterapii, jako je CyberKnife, tomoterapie nebo lineární urychlovače s rotačním IMRT (obr. 1). Jiným směrem je využití částicové radioterapie (protonů nebo jader uhlíku), která má z fyzikální podstaty řadu výhodných vlastností.
Obr. 1. Demonstrace rozdílu mezi rozdělením dávky fotonového (vlevo) a protonového (vpravo) svazku, experiment za použití kapalného scintilátoru ukazuje fakt, že protonový svazek ozáří minimálně tkáň před cílovou oblastí (označeno červeným ohraničením) a žádnou za ní, kdežto svazek fotonů prozáří celý objem jak před ní, tak i za ní. V případě pacienta se zde nachází zdravá tkáň. 
Fyzikální podstata protonové radioterapie
Zatímco u fotonové radioterapie je využíváno ozařování z mnoha směrů tak, aby se potřebná dávka v cílovém objemu z těchto směru sečetla a zároveň nežádoucí dávka do zdravých tkání byla co nejnižší, částicová (v našem případě protonová) radioterapie umožňuje dosáhnout dostatečné dávky do cílového ložiska při současné výrazné minimalizaci celkového ozářeného objemu okolních struktur. Je to důsledek jiného mechanismu interakce s materiálem mezi protony a fotony. Léčebný fotonový svazek je tkání systematicky zeslabován, nejvíc svojí energie odevzdává u povrchu a prochází celým tělem (obr. 2). Naproti tomu protonový svazek předává u povrchu malou část dávky. Intenzita předávání roste do hloubky, maxima nabývá v cílové oblasti (v oblasti tzv. Braggova píku) a za ní již k předávání energie nedochází. Z uvedeného plyne, že protonové ozáření je mnohem šetřivější z pohledu celkové radiační zátěže zdravých tkání a stejně efektivní v oblasti nádorového ložiska.
Obr. 2. Příklad srovnání ozáření pomocí pokročilé fotonové techniky IMRT (vlevo) a ozáření protonovým svazkem. Cílový objem je označen červeně, v oblasti přítomné kritické struktury pak ostatními barvami. Dávková distribuce je znázorněna barevným spektrem, oblasti s nejvyšší dávkou jsou zobrazeny červeně a postupné snižování dávky směrem k modré barvě. Pokud danou část anatomie nepokrývá žádná barva z barevného spektra (tzv. colorwash), pak není dodávaná dávka žádná. Z obrázku je patrný výrazně větší objem zdravé tkáně, který při fotonovém ozáření ozářen je a při protonovém nikoliv. 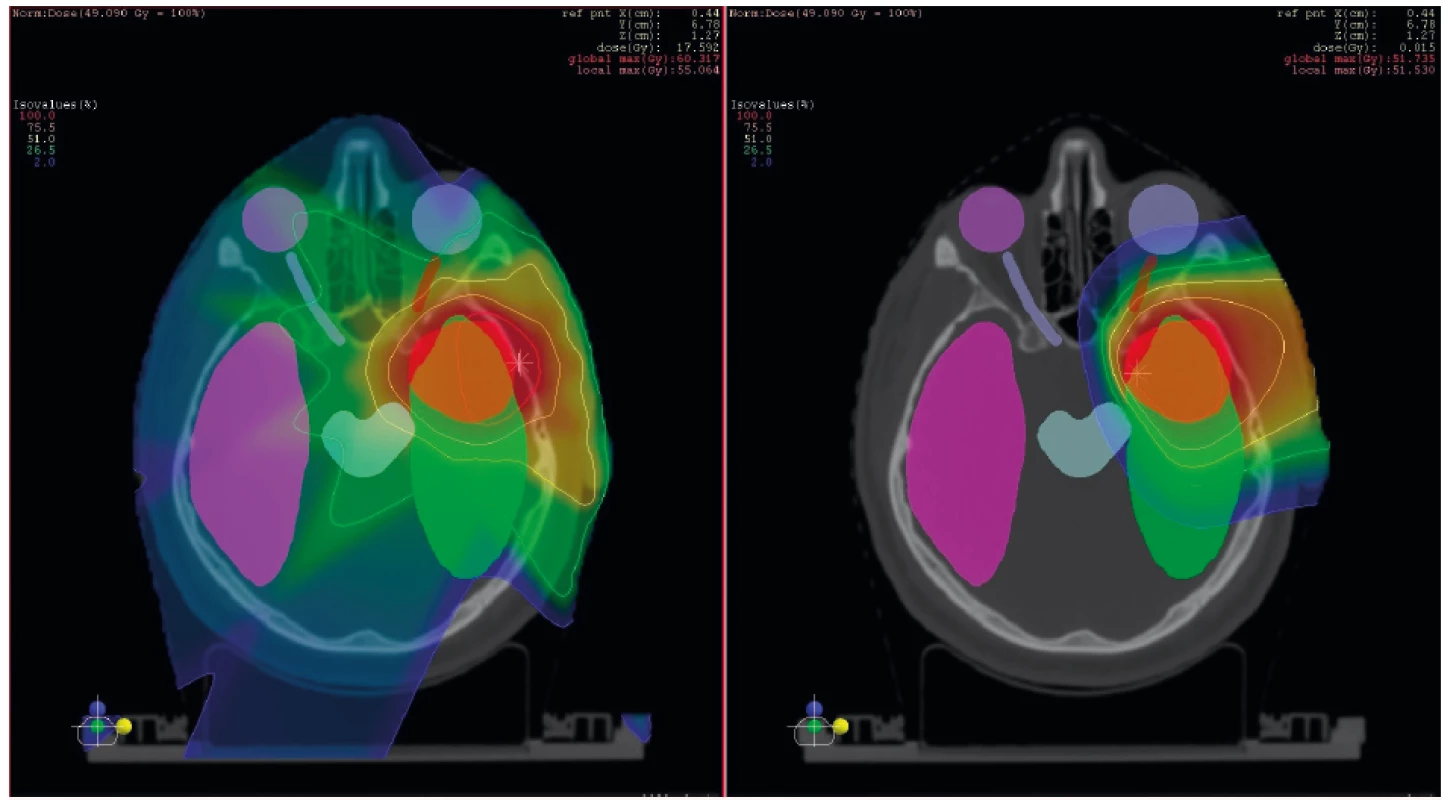
Technologie PBS (pencil beam scanning, skenování tužkovým svazkem)
Moderní protonová centra používají techniku tužkového skenovaného svazku. Jedná se o nejefektivnější způsob doručení požadované dávky do cílového objemu při minimalizaci dávek do okolních kritických struktur. Při tomto způsobu ozařování je cílový objem rozdělen do mřížky, kde do každého bodu této mřížky je směrován individuálně vážený paprsek protonů. Výsledkem je vysoce konformní ozáření cílového objemu a vzhledem k tomu, že žádný svazek není směrován mimo tento objem, i minimalizace dávek na zdravé tkáně.
Radiobiologická východiska
Další skutečností, kterou je při využití částicové terapie nutné brát v úvahu, je vyšší radiobiologická účinnost protonového svazku ve srovnání s referenčním fotonovým svazkem. Po valnou většinu letu protonů je tato účinnost 1,1násobkem účinnosti fotonové radioterapie a s tímto poměrem se kalkuluje při předpisu dávky. Vzhledem k tomu je možné při uvedeném přepočtu použít protonů stejným způsobem z hlediska dávek a frakcionací, jako fotonů. V posledních letech vyšlo najevo, že na samém závěru letu protonů se radiobiologická účinnost zvyšuje na 1,2–1,6násobek účinnosti fotonů. Jedná se přibližně o poslední 2 mm letu a ve většině případů nemá tato skutečnost klinický význam. Za určitých okolností (například při ozařování nádorů mozku a použití jediného ozařovacího pole) je však třeba modifikovat standardní postupy tak, aby tato skutečnost byla brána v úvahu.
KLINICKÉ POUŽITÍ PROTONOVÉ TERAPIE
Historie
Využití lepší dávkové distribuce v důsledku existence Braggova píku navrhl americký fyzik Robert R. Wilson v roce 1946 a v roce 1954 proběhlo první klinické ozáření. V dalších dekádách se postupně zdokonalovala technologie a v roce 1991 byla otevřena první klinika určená výlučně pro klinické využití protonového svazku (Loma Linda, Kalifornie, USA). Nyní již ve světě existuje 81 center a Particle Therapy Collaborative Group eviduje více než 160 000 nemocných léčených touto modalitou.
Protonová radioterapie původně využívala techniku pasivního rozptylu protonů. V praxi to znamenalo, že svazek protonů byl homogenní, měl energii odpovídající nejhlouběji uloženému ložisku a musel být před vstupem do těla pacienta modifikován. Modifikace laterálně se prováděla individuálně připravenými kolimátory (z mosazných kotoučů se vysoustružily pro každého pacienta individuální tvary) a dosah do hloubky se modifikoval tzv. kompenzátory (opět individuálně soustružené prvky z plastu, které modifikovaly distální tvar ozařovacího pole). Tato technologie měla řadu nevýhod. Neumožňovala ozařování složitějších a větších objemů, neumožňovala adaptaci techniky změnám velikosti a tvaru nádoru během radioterapie, byla extrémně pracná pro personál a neumožňovala modifikaci dávek v proximálním směru od ložiska. Další nevýhodou byla interakce protonů s kovy v kolimátorech, která způsobovala poměrně významnou neutronovou kontaminaci, která částečně rušila výhodu nízké integrální dávky záření. Z výše uvedených důvodů bylo možné dříve používat protony pouze pro radioterapii poměrně malých, stabilních a v čase neměnných cílových objemů, tedy nádorů. Příkladem jsou nádory báze lební (chordomy a chondrosarkomy) nebo karcinom prostaty.
Metoda skenování tužkovým svazkem (pencil beam scanning – PBS) zásadním způsobem změnila použití a možnosti protonové radioterapie. Při této metodě je nádorové ložisko rozděleno na jednotlivé vrstvy a ty jsou rozděleny na jednotlivé body. Svazek je velmi tenký (ve vzduchu 3–4 mm), postupně se reguluje jeho energie a tím hloubka dosahu, a je směrován do jednotlivých bodů nádoru pomocí skenovacích magnetů umístěných v hlavici ozařovače. Velikost ozařované oblasti není potom omezena. Je možné ozařovat velmi složité tvary, adaptace na změny je poměrně rychlá a neutronová kontaminace je výrazně menší než pro techniky fotonové radioterapie s modulovanou intenzitou (IMRT) s energiemi nad 10 MeV. První pracoviště používala PBS na počátku milénia, ale masivnějšího rozšíření tato technologie doznala až po roce 2010. V současnosti lze říci, že PBS již nahrazuje dřívější metodu a nová centra pasivní rozptyl nevyužívají.
Indikace
O indikacích k protonové radioterapii se v komunitě radiačních onkologů vedou intenzivní diskuze. Procento pacientů indikovaných k protonové radioterapii se z celkového počtu pacientů indikovaných k radioterapii liší od 1 % zastávanými jejími odpůrci až po 50 % zastávanými jejími propagátory. Tento problém nemá pouze medicínský aspekt, ale též aspekt ekonomický Je třeba si uvědomit, že ročně je v ČR indikováno k radioterapii okolo 25 000 pacientů. Některé státy jdou cestou výpočtu přínosu protonové radioterapie ve srovnání s radioterapií fotonovou. Příkladem může být Holandsko, které svůj „model based“ přístup opakovaně publikovalo a na základě analýzy se rozhodlo vybudovat 12 ozařovacích místností ve čtyřech centrech pro populaci 16 mil. obyvatel (2).
V současnosti neexistuje jasný výčet indikací pro protonovou radioterapii. Jednotlivá centra léčí ty diagnózy, které jim umožní technologie a úhrada ze zdravotních systémů. Existují indikace, které jsou pro protonovou radioterapii z technických důvodů nevhodné. Do této skupiny patří všechny diagnózy, kde nelze zajistit reprodukovatelnou polohu a tvar orgánů v ozařované oblasti. Příkladem může být karcinom žaludku nebo karcinom močového měchýře. Do této skupiny se ve většině center řadí též nádory dělohy a děložního čípku nebo karcinom rekta, i když v některých centrech jsou tyto indikace léčeny. U jiných diagnóz spočívá benefit protonové léčby zejména v redukci integrální dávky (celkového objemu ozářené tkáně), nikoliv v zásadní redukci dávek na kritické orgány. Příkladem takové diagnózy je například karcinom hypofaryngu nebo pravostranný karcinom prsu. Další možnou limitací je použití velmi přesné radioterapie bez možnosti přesného stanovení potřebné ozařované oblasti, tedy cílového objemu. Přes výše uvedená úskalí existuje řada diagnóz, kde je protonová radioterapie proveditelná a přináší dozimetrickou výhodu ve srovnání s IMRT. Je nutné podotknout, že s výjimkou maligního melanomu sítnice, kde byla výhoda protonové radioterapie potvrzena, neexistují randomizované studie srovnávající výsledky protonové a fotonové radioterapie. Některé studie probíhají (například pro karcinom prostaty nebo pro nádory ORL oblasti), jiné pravděpodobně z etických důvodů nebudou nikdy iniciovány (pediatrické malignity, maligní lymfomy). Na protonovou radioterapii je nahlíženo jako na nový lék, který musí být ověřen podle zásad evidence based medicine (EBM). Dle našeho názoru se o nový lék nejedná; jde stále o léčbu ionizujícím zářením, ale za použití jiného prostředku a technologie. Protonová radioterapie nemá v současnosti stanoveny jasně vymezené indikace. Diagnózy uvedené níže je nutné považovat za možné indikace protonové radioterapie.
Nádory oka
Oční nádory, zejména uveální melanom, jsou uznávanou indikací protonové radioterapie, kde je její výhoda potvrzena dlouhodobými výsledky. Hlavní výhoda vychází z možnosti zastavit v oblasti uvey a nijak nezasáhnout tkáně lokalizované hlouběji. Chang et al. provedli metaanalýzu zaměřenou na srovnání různých modalit, včetně enukleace a brachyterapie, s částicovou radioterapií a zjistili, že částicová radioterapie má nejvyšší lokální kontrolu i přesto, že má větší velikost nádorů (3). Kromě vysoké lokální kontroly umožňuje protonová radioterapie též zachování zraku u vysokého procenta pacientů (4).
Nádory mozku
Indikovaní k protonové radioterapii pro nádory CNS mohou být pacienti s nízce maligními gliomy, dále pacienti s meningeomy indikovaní k ozáření a pacienti s chordomy nebo chondrosarkomy (5). Při příznivé prognóze těchto nemocných je žádoucí redukovat možné pozdní následky radioterapie, ať již jde o endokrinopatie, kognitivní dysfunkce, poruchy zraku nebo sluchu, přičemž při nepříznivé lokalizaci a nutné vysoké dávce (chordomy) jde také mnohdy o jedinou možnou léčbu (6).
Dále jsou také tito nemocní vystaveni riziku sekundárních tumorů (meningeomů) vznikajících s odstupem někdy až desetiletí od primární léčby, kdy je prokázáno, že se snížením integrální dávky toto riziko klesá (7).
Nejčastější indikaci protonové terapie jsou chordomy a chondrosarkomy, kde se uplatňuje možnost bezpečnější aplikace vyšší dávky záření (nad 68 Gy u chondrosarkomů a nad 74 Gy u chordomů). Lokální kontrola v 5 letech, při využití adjuvantní protonové terapie, dosahuje u chordomů 73 % a chondrosarkomů 94 % v 10 letech (8). Další práce uvádí až 81 % lokální kontrolu v 5 letech u chordomů a 100 % u pacientů s chondrosarkomem (9).
U nízce maligních gliomů je hlavním cílem použití protonové terapie redukce neurokognitivní a neuroendokrinní toxicity. V tomto případě byly prokázány dozimetrické výhody protonové terapie v retrospektivním hodnocení 74 pacientů s LGG a bylo potvrzeno nižší zatížení vnitřního ucha, optických struktur, hipokampů, amygdaly, thalamu a subventrikulární zóny u mladistvých a dospělých pacientů (10). Více se rozdíl projevil u kontralaterálních (s ohledem na uložení nádoru) struktur. Dalším důvodem k nutnosti maximálního šetření zdravé hemisféry u těchto relativně dlouho přežívajících pacientů je oddálení nástupu demence (11). Klinický dopad šetření okolních struktur u nádorů CNS se v současné době intenzivně zkoumá.
U high-grade gliomů je prokázána dozimetrická výhoda více na kontralaterální struktury v porovnání s moderními fotonovými technikami (12). Protonová terapie se též využívá v kombinaci s fotonovou terapií k aplikaci dosycovací dávky na nádorové ložisko při minimalizaci toxicity (13). Je nutné uvést, že v této indikaci se protonová terapie používá méně často, a to spíše u mladších pacientů s přítomností příznivějších prognostických faktorů (menší velikost postiženi, IDH1 mutace) vzhledem k nutnosti aplikace vysoké dávky do rozsáhlé oblasti makro - či mikroskopického postižení a omezenému celkovému přežití pacientů bez významnějšího vlivu celkového zvýšení dávky do oblasti nádoru. Chybné je uvažování o prospěšnosti méně ostrého spadu dávky u fotonové terapie ve směru od oblasti ozařování – do současné doby nebylo prokázáno odlišné procento marginálních recidiv u fotonového a protonového ozařování.
Protonová terapie se využívá i v případě nutnosti opakovaného ozařování (reiradiaci) u maligních nádorů v oblasti CNS, kde protonová terapie umožňuje snížit oblast opakovaně exponované vysoké dávce záření s potenciálem nižší postiradiační toxicity (14).
V léčbě adenomů hypofýzy se protonová terapie používá v případě selhání chirurgické a medikamentózní léčby. Výborné výsledky frakcionované protonové terapie s lokální a funkční kontrolou 93 % popisují autoři z Kalifornie (15).
Zvláštní pozornost si zaslouží možnost aplikace protonové terapie v ozařování velkých objemů – například kraniospinální osy u dospělých pacientů s meduloblastomy nebo anaplastickými ependymomy s možností redukce až eliminace dávky na nitrobřišní, nitrohrudní a krční orgány se snížením akutní a pozdní toxicity. Snížení akutní gastrointestinální a hematologické toxicity je popsáno v práci autorů Brown et al. (16).
U meningeomů protonová terapie umožňuje snížit dávku na bilaterální hipokampy, vnitřní ucho, integrální dávku na mozek a další struktury a také o polovinu snížit riziko vzniku sekundárních nádorů (7). Lokální kontrola v případě použití frakcionované protonové terapie dosahuje v 5 letech 100 % u Grade I meningeomů a 84,8 % u Grade II–III.
Zároveň je prokázán přínos navýšení dávky u meningeomů Grade II–III na zvýšení lokální kontroly. Zkušenosti z Indiana University (17) uvádějí dosažení pětileté lokální kontroly v 88 % při dávce vyšší než 60 Gy (RBE) v porovnání s 50 % při dávce pod 60 Gy (RBE).
Benefit protonové radioterapie pro pacienty s high-grade gliomy (glioblastoma multiforme) bývá vzhledem k typicky rozsáhlému cílovému objemu (danému kromě samotného objemu tumoru i nutnými bezpečnostními lemy) a nepříznivé prognóze marginální. Bývá zvažována v rámci léčby relapsu těchto onemocnění, indikace je však přísně individuální.
Pediatrické malignity
Cílem využití protonové radioterapie v léčbě dětských nádorů je obvykle minimalizace toxicity léčby, a to zejména pozdní a velmi pozdní. Platí obvykle, že čím mladší dítě léčíme, tím vyšší jsou rizika z radioterapie plynoucí. Typickými příklady jsou nádory centrálního nervového systému, kdy je ztráta kognitivních funkcí při stejné aplikované dávce nepřímo úměrná věku dítěte (18).
Dalšími častými poléčebnými komplikacemi jsou endokrinopatie, poruchy sluchu, zraku a riziko indukce sekundárních tumorů, kdy opět díky vyšší konformitě protonové radioterapie klesá individuální riziko těchto nežádoucích účinků (19). V případě ozařování kraniospinální osy a v závislosti na lokalizaci také u sarkomů nebo chordomů, klesá při užití protonové radioterapie riziko tyreopatie, kardiální, renální nebo pulmonální toxicity. V případě nepříznivě uložených sarkomů nebo chordomů se pak může jednat o situaci, kdy protonová ra dioterapie nejen snižuje toxicitu, ale je také jedinou možností, jak zajistit aplikaci dostatečně vysoké dávky.
Nádory ORL oblasti
Radioterapie nádorů ORL oblasti je ve většině případů léčbou na hranici tolerance lidského organismu. Následky radioterapie (RT) pak mohou negativně ovlivnit kvalitu života i v dlouhodobém horizontu. Jedná se především o trvalé polykací obtíže, xerostomie, poruchy sluchu a zraku, kognitivní deficit. U části ORL nádorů (především inoperabilních objemných tumorů) navíc často dochází k selhání radioterapie jako definitivní léčby. Z tohoto důvodu byly ORL nádory jednou z prvních diagnóz, kde byl zkoumán přínos protonové RT. Indikace protonové RT lze teoreticky rozdělit na tři okruhy.
U první skupiny pacientů poskytuje protonová RT možnost navýšení celkové dávky při zachování akceptovatelného rizika toxicity (nedojde k překročení limitních dávek). Teoreticky se tak zvyšuje šance na vyléčení nádorového onemocnění. Do této skupiny diagnóz patří především nádory vyžadující vyšší celkovou dávku záření, kterou není možné bezpečně dodat standardní fotonovou léčbou vzhledem k blízkosti radiosenzitivních kritických orgánů (optické struktury, nervový systém, vnitřní ucho). Konkrétně se jedná nádory vedlejších dutin nosních, nádory báze lební, adenoidně cystický karcinom slinných žláz (20, 21).
Do druhého okruhu diagnóz vhodných pro protonovou RT patří nádory, kde je záměrem snížení zátěže okolních rizikových orgánů, a to při zachování „standardní“ celkové dávky záření. U této skupiny pacientů je přínosem protonové RT zejména zachování dobré kvality života po absolvování RT. Do této skupiny diagnóz lze zařadit nádory nosohltanu, nádory orofaryngu, nádory velkých slinných žláz, benigní nádory (paragangliom, meningeom, schwannom a další). Například u nádorů nosohltanu, které jsou vysoce kurabilní i u pokročilých nálezů, stoupá důraz na pozdní nežádoucí účinky radioterapie, jako jsou kognitivní dysfunkce, které jsou důsledkem ozáření mozku (22), nebo poruchy sluchu, které po léčbě IMRT postihují více než 40 % nemocných (23). U nádorů orofaryngu bylo po léčbě protonovou RT popsáno menší procento nemocných dlouhodobě závislých na výživě perkutánní endoskopickou gastrostomií či nazogastrickou sondou (24).
Třetí skupinou jsou pacienti doporučeni k opakovanému ozáření ORL oblasti, tzv. reiradiaci. U vybraných případů je možné provést opakované ozařování s šancí na lokální kontrolu onemocnění, protonová RT je pak často šetrnější technikou ve srovnání s fotonovou RT.
Ostatní nádory ORL oblasti se obvykle k protonové léčbě neindikují. Důvodem bývá většinou nedostatečná možnost reprodukovat polohu v ozařované oblasti, Jedná se především o pohyblivé druhy nádorů: karcinom laryngu, tumor pohyblivé části jazyka, nádory štítné žlázy.
Nádory jícnu
Z nádorů jícnu je možné protonovou radioterapií léčit onemocnění lokalizované v horní a střední třetině jícnu. Důvodem je opět variabilita v poloze a náplni dolní třetiny jícnu a gastroezofageální junkce, která znemožňuje přesnou aplikaci protonové radioterapie. V oblasti horní a střední třetiny přináší protonová radioterapie výhodu snížení dávek na plíce a srdce, které korelují s incidencí kardiopulmonální toxicity, zejména má-li následovat operační výkon (25).
Maligní lymfomy
Problematika ozařování maligních lymfomů jako radiosenzitivního onemocnění spočívá ve většině případů v redukci dávky na okolní rizikové orgány. Z dlouhodobého hlediska pacienty po léčbě ohrožuje zejména vývoj sekundárních malignit a kardiovaskulárních onemocnění (26, 27).
Bylo potvrzeno 14 studiemi, že protonová RT signifikantně snižuje radiační zátěž rizikových orgánů (28). Protonová RT by měla být zvažována u vybraných pacientů, u nichž je schopná významně snížit dávky na rizikové struktury (29).
Velkou skupinu pacientů indikovaných k RT pro lymfom tvoří pacienti s velmi dobrou dlouhodobou prognózou. Tito pacienti by měli být léčeni s vědomím dlouhodobých rizik onkologické terapie. Patří sem zejména mladí pacienti s Hodgkinovým lymfomem a prognosticky příznivým B-non-Hodgkinovým lymfomem (především agresivní podtypy difuzní velkobuněčný B-lymfom, primární mediastinální B-lymfom). Pro tyto pacienty by neměl být užíván přístup „limitních dávek“, měla by být vždy zvážena nejméně zatěžující technika RT.
Největším přínosem bývá protonová RT pro oblast mediastina. Aktuálně bylo publikováno doporučení International Lymphoma Radiation Oncology Group (ILROG) pro protonovou RT dospělých s mediastinální lokalizací lymfomu (30). Byli zde identifikováni pacienti, kteří mají maximální benefit z protonové RT. Jedná se především o situace, kdy je nutné ozáření mediastina a kde ozařovaný objem zasahuje pod úroveň odstupu levé koronární arterie. Dále mladé ženy s axilárním postižením, kde protonová RT více šetří prsní žlázu, a v neposlední řadě vysoce předléčení pacienti, kteří jsou ve vyšším riziku vývoje radiační toxicity (především plicní, kardiovaskulární toxicity a postižení kostní dřeně).
Méně početnou skupinu tvoří pacienti s refrakterními či relabujícími lymfomy s lokalizovaným postižením, nejčastěji objemným nálezem v mediastinu (31).
Zde bývá nutné navýšit celkovou dávku záření a standardní fotonová RT je zatížena velkým rizikem postiradiačních komplikací. Protonovou RT je v této situaci možné užít jako samostatnou kurativní metodu nebo jako „debulking“ před plánovanou další systémovou léčbou (například alogenní transplantací). Pro část nemocných tak může být protonová RT součástí kurativního léčebného přístupu v situacích, které byly dříve považovány za „inkurabilní“.
V podobné indikaci pak můžeme protonovou RT doporučit pro opakované ozáření, kdy jsou již rizikové orgány zatíženy dávkou z předchozí RT. I zde je možné při limitovaném postižení dosáhnout dlouhodobé kontroly onemocnění.
Nádory plic
U nádorů plic má protonová terapie teoretickou výhodu opět v šetření zdravých tkání před radiací, kdy tento faktor je limitujícím faktorem při jakékoliv radiační léčbě. Poměrně často nastává při fotonové radioterapii situace, kdy z důvodu zátěže plic nebo srdce není možné dodat kurativní dávku do nádorového ložiska. Na druhou stranu protonová léčba se musí nějakým způsobem vypořádat s pohybem nádoru v respiračním cyklu a s regresí nádorů v průběhu radioterapie. Problém pohybu se řeší buď technikou rescanningu (opakování ozáření v rámci jedné frakce), nebo se ozařování provádí v řízeném hlubokém nádechu. Jsou publikovány výsledky pro nemalobuněčný plicní karcinom stadií T1–T2, který byl léčen protonovou radioterapií akcelerovaným režimem. Například Nakayama et al. popisují na souboru 55 nemocných s plicními nádory T1–T2 léčenými pouze protonovou radioterapií dvouletou lokální kontrolu 97 % a dvouleté přežití bez progrese 88,7 % (32). Pro pokročilejší plicní nádory (stadia III) je dobře zdokumentována dozimetrická výhoda a na studiích fáze II slibná efektivita a toxicita. Sejpal et al. popsali významně nižší incidenci toxicity léčby pro protonové ozařování ve srovnání s IMRT (33).
Nguyen et al. publikovali v roce 2015 léčebné výsledky u NSCLC pro 134 pacientů. Pětileté přežití bez nemoci bylo 18% a medián doby přežití byl 30,4 měsíců, což jsou velmi slibné výsledky.
Liao et al. však publikovali v roce 2018 malou randomizovanou studii (celkem 149 pacientů), která srovnávala protonovou radioterapii pasivním rozptylem a fotonovou radioterapii IMRT. Tato studie sice doložila redukci dávek na srdce, ale incidence závažné toxicity i lokální kontrola byly v obou ramenech stejné (34). Indikace se bude jistě dále vyvíjet, zejména směrem k nemocným, u kterých nelze standardní radioterapie využít.
Nádory slinivky břišní
Za hlavní místo pro protonovou terapii je považován nemetastatický, inoperabilní karcinom pankreatu. V této situaci techniky fotonové radioterapie obvykle neumožňují dosažení dávek vyšších než 50 Gy a tyto dávky jsou z hlediska kontroly nádoru příliš nízké a přinášejí nezanedbatelnou toxicitu. Ve srovnání s IMRT je významná redukce dávek na tenké střevo, duodenum, žaludek, játra a ledviny (35). Terashima et al. eskalovali v této indikaci dávku na 67,5 GyE a dosáhli jednoletého přežití bez lokální progrese 82%, jednoleté přežití bez progrese 64% a celkové přežití v 1 roce bylo 77% (36). Toxicita stupně 3 a vyšší nebyla zaznamenána. Korejská skupina popsala výsledky u 37 nemocných léčených protonovou radioterapií. V 1 roce byla lokální kontrola 65% a celkové přežití 75,7%, bez výskytu toxicity stupně 3 a vyšší (37). Výsledky jsou značně limitovány nízkými počty nemocných, lze však říci, že díky významné dozimetrické výhodě protonů je možné aplikovat vyšší dávky na nádor a významně snížit toxicitu léčby. Klinické výsledky jsou slibné, dosud však na velmi malých počtech nemocných.
Hepatocelulární karcinom
Toto nádorové onemocnění je velmi dobře popsanou diagnózou vhodnou pro protonovou radioterapii. Zdůvodnění spočívá opět v lepší dozimetrii, tj. menší zátěži zdravé jaterní tkáně, což umožní navýšení dávky na nádorové ložisko, a tím zvýšení šance na lokální kontrolu. Její místo je zatím u inoperabilních, spíše rozsáhlejších nádorů. Přesto, že je používána u spíše prognosticky nepříznivých nemocných, je dvouletá lokální kontrola kolem 90 % a tříleté celkové přežití mezi 50–60 % (38, 39).
Metaanalýza 73 kohort ze 70 nekomparativních studií prokázala významně vyšší jedno-, tří - a pětileté celkové přežití pro částicovou radioterapii proti konvenční fotonové radioterapii. Při nejdelším sledování bylo významně vyšší také přežití bez progrese a lokoregionální kontrola. Oproti extrakraniální stereotaktické radioterapii (SBRT) byly tyto parametry při nejdelším sledování srovnatelné, ale výhodou částicové radioterapie proti konvenční radioterapii i SBRT bylo snížení high-grade akutní a pozdní toxicity léčby (40).
Průběžná analýza autorů Bush et al. z roku 2016 naznačuje podobné celkové přežití po radioterapii protonovým svazkem a pro transarteriální chemoembolizaci (TACE) u pacientů, kteří splňovali milánská nebo sanfranciská transplantační kritéria. Byl patrný trend ke zlepšení lokální kontroly nádoru a přežití bez progrese pro protonovou radioterapii oproti TACE. Po protonové léčbě měli autoři významně méně hospitalizací, což může značit snížení toxicity při terapii protony (41).
Sarkomy retroperitonea
Sarkomy retroperitonea jsou další diagnózou, kde je zjevný dozimetrický benefit protonové radioterapie. Toxicita spojená s fotonovou radioterapií je opět faktorem limitujícím dávku (42). Přes předpokládané výhody protonové radioterapie v této indikaci jsou zkušenosti zatím málo početné a publikované práce jsou limitované velmi malým počtem nemocných.
Karcinom prostaty
Karcinom prostaty je nejčastější diagnózou léčenou v protonových centrech a jedná se též o diagnózu, kde byl protony léčen největší počet pacientů v řádech mnoha desítek tisíc. Důvodem je relativní pravidelnost a malá velikost ozařovaného objemu a stabilita tkání, přes které musí protonový svazek projít (svaly a skelet). Jedná se o diagnózu značně diskutovanou v odborné komunitě, a proto je nutné sdělit, že v současnosti neexistují randomizované studie srovnávající fotonovou a protonovou radioterapii pro tuto diagnózu. Dle aktuálních guidelines se obě metody považují za použitelné (43). Protonová radioterapie se používá ve všech indikacích jako fotonová léčba v široké škále frakcionačních režimů. K dispozici jsou pětileté výsledky prospektivních studií na vysokých počtech nemocných. Například Bryant et al. popsali na skupině 1327 pacientů s karcinomem prostaty při mediánu doby sledování 5,5 roku pětileté přežití bez biochemického relapsu pro nízce rizikový karcinom 99 %, pro středně rizikový karcinom 94 % a pro vysoce rizikový karcinom 74 %. Kumulativní incidence pozdní toxicity 3. stupně dle CTCAE (tedy toxicity, která již vyžaduje náročnější výkony a péči) byla pro gastrointestinální systém 0,6 % a pro genitourinární systém 2,9 % (44). V podstatě stejně velké soubory pacientů při stejné době sledování a stejných výsledcích publikovali Takagi et al. (45) a Iwata et al. (46). Tato data se zdají být slibná z hlediska efektivity zejména pro vysoce rizikové karcinomy prostaty, z hlediska toxicity je přínos protonové radioterapie zejména v redukci pozdní močové toxicity. K dalším výhodám patří vysoká pravděpodobnost zachování erekce po protonové radioterapii (v případech, že není indikována androgen deprivační terapie, ADT). Ho et al. popsali na souboru nemocných léčených protonovou radioterapií, že 90 % pacientů bylo schopných sexuálního aktu před léčbou a toto procento kleslo na 67 % za 5 let po léčbě (47).
Karcinom prsu
Radioterapie karcinomu prsu má úskalí v tom, že při dlouhodobém přežívání, kterého je nyní dosahováno, se mohou projevit pozdní a velmi pozdní následky radioterapie. V případě nepokročilého levostranného karcinomu prsu ozařovaného adjuvantně se jedná o kardiotoxicitu (při levostranném postižení) a sekundární malignity. Darby et al. popsali na epidemiologické studii na 2168 ženách léčených pro karcinom prsu, že pravděpodobnost ICHS lineárně roste se střední dávkou na srdce a tento nárůst je o 7,4 % s každým 1 Gy (dávka záření) na srdeční sval (48). Yun-Jiu provedli metaanalýzu zaměřenou na zvýšení rizika morbidity a mortality po radioterapii pro karcinom prsu. Zjistili, že levostranná radioterapie má ve srovnání s pravostrannou poměr rizik 1,29 pro ICHS a 1,22 pro úmrtí z kardiálních příčin (49). Protonová radioterapie redukuje zátěž srdečního svalu ve všech parametrech. Střední dávku na srdeční sval snižuje z obvyklých 1–5 Gy na 0,1–0,5 Gy a co je patrně ještě důležitější, redukuje dávku i na levou sestupnou koronární arterii, která je nejčastější příčinou ICHS po radioterapii pro karcinom prsu (50). Existují velmi silné předpoklady, že redukce dávek právě v této oblasti sníží budoucí morbiditu indukovanou radioterapií.
Reiradiace
Díky významně lokalizovanější dávkové distribuci je možné protony použít v určitých případech i u opakovaného ozařování stejné oblasti v případě lokálních recidiv. Tyto situace však jsou vždy vysoce rizikové z hlediska závažné toxicity a musí být posuzovány velmi individuálně.
Protonová radioterapie ve světě
Dle údajů Particle Therapy Cooperative Group (PTCOG) je aktuálně v provozu 81 protonových center, ve výstavbě 51 center a ve stadiu plánování dalších 26 (51). O potřebnosti se vedou značné diskuze, analýza provedená v Holandsku vedla k rozhodnutí o výstavbě 12 ozařoven ve čtyřech centrech, pro populaci přibližně 16 mil. Obyvatel (52). Dlouhá doba mezi prvním protonovým ozářením a větším rozmachem metody je dána její technickou složitostí. Teprve moderní technologie zpřístupňují protonové ozáření čím dál většímu počtu pacientů. Nejdále je v realizaci částicové radioterapie Japonsko s velkým počtem center (celkem 19) a rovněž velkými objemy úspěšně léčených pacientů. Státem s největším počtem protonových center jsou USA s celkem 27 funkčními protonovými centry.
ZÁVĚR
Protonová radioterapie je moderní technikou léčby ionizujícím zářením, která ve srovnání s moderními technikami IMRT významně redukuje zátěž zdravých tkání zejména v oblasti středních a nízkých dávek. Lze ji použít v řadě indikací radioterapie a v případě dlouhých předpokládaných dob dožití nemocných je nutné ji – pokud je dostupná – brát v úvahu z hlediska radiační ochrany, a to i přes absenci randomizovaných studií. Sekundární malignity jsou problémem každé radioterapie a jejich indukce je bezprahová – požadavkem radiační ochrany je tedy minimalizace dávek na tak nízkou úroveň, jak je rozumně dosažitelné. Randomizované studie jsou nástrojem pro hodnocení nových léčebných metod – zde se však více než o novou metodu jedná o využití metody stávající, tj. léčby ionizujícím zářením, za použití lepšího nástroje. Randomizovaná data pro potvrzení predikovaného profitu protonové RT ve snížení pozdní toxicity navíc nejsou požadována ani v zahraničních doporučeních (NCCN guidelines). Při rozhodování o technice RT je doporučené zvážit užití klinicky nejvíce šetřící techniky se zachováním dostatečného pokrytí cílového objemu. Pacienti po protonové RT by pak měli být sledováni v registrech. Vzhledem k fyzikální charakteristice částicové RT, která je vhodnější pro část pacientů indikovaných k ozáření, a ke zlepšující se dostupnosti této techniky, bude protonová RT s největší pravděpodobností do budoucna nahrazovat určitou část radioterapie fotonové.
Konflikt zájmů: žádný.
ADRESA PRO KORESPONDENCI:
MUDr. Jiří Kubeš, PhD.
Proton Therapy Center Czech, s.r.o.
Budínova 2437/1a, 180 00 Praha 8
e-mail: jiri.kubes@ptc.cz
Zdroje
1. Oeffinger KC, Mertens AC, Sklar CA, et al. Chronic health conditions in adult survivors of childhood cancer. N Engl J Med 2006; 355(15): 1572–1582.
2. Langendijk JA, Lambin P, De Ruysscher D, et al. Selection of patients for radiotherapy with protons aiming at reduction of side effects: the model-based approach. Radiother Oncol 2013; 107(3): 267–273.
3. Chang MY, McCannel TA. Local treatment failure after globe-conserving therapy for choroidal melanoma. Br J Ophthalmol 2013; 97(7): 804–811.
4. Verma V, Mehta MP. Clinical outcomes of proton radiotherapy for uveal melanoma. Clin Oncol (R Coll Radiol) 2016; 28(8): e17–27.
5. Combs SE, Kessel K, Habermehl D, et al. Proton and carbon ion radiotherapy for primary brain tumors and tumors of the skull base. Acta Oncol 2013; 52(7): 1504–1509.
6. Dennis ER, Bussiere MR, Niemierko A, et al. Comparison of critical structure dose and toxicity risks in patients with low grade gliomas treated with IMRT versus proton radiation therapy. Technol Cancer Res Treat 2013; 12(1): 1–9.
7. Arvold, ND, Niemierko A, Broussard GP, et al. Projected second tumor risk and dose to neurocognitive structures after proton versus photon radiotherapy for benign meningioma. Int J Radiat Oncol Biol Phys 2012; 83(4): e495–500.
8. Munzenrider JE, Liebsch NJ. Proton therapy for tumors of the skull base. Strahlenther Onkol 1999; 175(Suppl 2): 57–63.
9. Ares C, Hug EB, Lomax AJ, et al. Effectiveness and safety of spot scanning proton radiation therapy for chordomas and chondrosarcomas of the skull base: first long-term report. Int J Radiat Oncol Biol Phys 2009; 75(4): 1111–1118.
10. Harrabi SB, Bougatf N, Mohr A, et al. Dosimetric advantages of proton therapy over conventional radiotherapy with photons in young patients and adults with low-grade glioma. Strahlenther Onkol 2016; 192(11): 759–769.
11. Karunamuni R, Bartsch H, White NS, et al. Dose-dependent cortical thinning after partial brain irradiation in high-grade glioma. Int J Radiat Oncol Biol Phys 2016; 94(2): 297–304.
12. Adeberg S, Harrabi SB, Bougatf N, et al. Intensity-modulated proton therapy, volumetric-modulated arc therapy, and 3D conformal radiotherapy in anaplastic astrocytoma and glioblastoma: A dosimetric comparison. Strahlenther Onkol 2016; 192(11): 770–779.
13. Adeberg S, Bernhardt D, Harrabi SB, et al. Sequential proton boost after standard chemoradiation for high-grade glioma. Radiother Oncol 2017; 125(2): 266–272.
14. Mizumoto M, Okumura T, Ishikawa E, et al. Reirradiation for recurrent malignant brain tumor with radiotherapy or proton beam therapy. Technical considerations based on experience at a single institution. Strahlenther Onkol 2013; 189(8): 656–663.
15. Ronson BB, Schulte RW, Han KP, et al. Fractionated proton beam irradiation of pituitary adenomas. Int J Radiat Oncol Biol Phys 2006; 64(2): 425–434.
16. Brown AP, Barney CL, Grosshans DR, et al. Proton beam craniospinal irradiation reduces acute toxicity for adults with medulloblastoma. Int J Radiat Oncol Biol Phys 2013; 86(2): 277–284.
17. McDonald MW, Plankenhorn DA, McMullen KP, et al. Proton therapy for atypical meningiomas. J Neurooncol 2015; 123(1): 123–128.
18. Merchant TE, Schreiber JE, Wu S, et al. Critical combinations of radiation dose and volume predict intelligence quotient and academic achievement scores after craniospinal irradiation in children with medulloblastoma. Int J Radiat Oncol Biol Phys 2014; 90(3): 554–561.
19. Greenberger, BA, Pulsifer MB, Ebb DH, et al. Clinical outcomes and late endocrine, neurocognitive, and visual profiles of proton radiation for pediatric low-grade gliomas. Int J Radiat Oncol Biol Phys 2014; 89(5): 1060–1068.
20. Patel SH, Wang Z, Wong WW, et al. Charged particle therapy versus photon therapy for paranasal sinus and nasal cavity malignant diseases: a systematic review and meta-analysis. Lancet Oncol 2014; 15(9): 1027–1038.
21. Takagi M, Demizu Y, Hashimoto N, et al. Treatment outcomes of particle radiotherapy using protons or carbon ions as a single-modality therapy for adenoid cystic carcinoma of the head and neck. Radiother Oncol 2014; 113(3): 364–370.
22. McDowell LJ, Ringash J, Xu W, et al. A cross sectional study in cognitive and neurobehavioral impairment in long-term nasopharyngeal cancer survivors treated with intensity-modulated radiotherapy. Radiother Oncol 2018; pii: S0167-8140(18)33495-9.
23. Wu LR, Liu YT, Jiang N. Ten-year survival outcomes for patients with nasopharyngeal carcinoma receiving intensity-modulated radiotherapy: An analysis of 614 patients from a single center. Oral Oncol 2017; 69 : 26–32.
24. Blanchard P, Garden AS, Gunn GB, et al. Intensity-modulated proton beam therapy (IMPT) versus intensity-modulated photon therapy (IMRT) for patients with oropharynx cancer - A case matched analysis. Radiother Oncol 2016; 120(1): 48–55.
25. Chuong MD, Bhooshan N, Allen PK, et al. A multi-institutional analysis of acute toxicity after neoadjuvant chemoradiation using photons or protons in trimodality esophageal cancer patients. Int J Radiat Oncol Biol Phys 2015; 93(3 Suppl): S220.
26. Hull MC, Morris CG, Pepine CJ, et al. Valvular dysfunction and carotid, subclavian, and coronary artery disease in survivors of hodgkin lymphoma treated with radiation therapy. JAMA 2003; 290(21): 2831–2837.
27. Cellai E, Magrini SM, Masala G, et al. The risk of second malignant tumors and its consequences for the overall survival of Hodgkin‘s disease patients and for the choice of their treatment at presentation: analysis of a series of 1524 cases consecutively treated at the Florence University Hospital. Int J Radiat Oncol Biol Phys 2001; 49(5): 1327–1337.
28. Tseng YD, Cutter DJ, Plastaras JP, et al. Evidence-based review on the use of proton therapy in lymphoma from the Particle Therapy Cooperative Group (PTCOG) Lymphoma Subcommittee. Int J Radiat Oncol Biol Phys 2017; 99(4): 825–842.
29. National Comprehensive Cancer Network. NCCN Clinical Practice Guidelines in Oncology. Hodgkin lymphoma. Version 3.2018 [online]. Dostupné z: https://www.nccn.org/professionals/physician_gls/pdf/hodgkins.pdf [cit. 2018-11-02].
30. Dabaja BS, Hoppe BS, Plastaras JP, et al. Proton therapy for adults with mediastinal lymphomas: The international lymphoma radiation oncology group (ILROG) guidelines. Blood 2018; 32(16): 1635–1646.
31. Tseng YD, Hoppe BS, Miller D, et al. Rates of toxicity and outcomes after mediastinal proton therapy for relapsed/refractory lymphoma. Int J Radiat Oncol Biol Phys 2017; 99(2 Suppl): S62–S63.
32. Nakayama H, Sugahara S, Tokita M, et al. Proton beam therapy for patients with medically inoperable stage I non-small-cell lung cancer at the University of Tsukuba. Int J Radiat Oncol Biol Phys 2010; 78(2): 467–471.
33. Sejpal S, Komaki R, Tsao A, et al. Early findings on toxicity of proton beam therapy with concurrent chemotherapy for nonsmall cell lung cancer. Cancer 2011; 117(13): 3004–3013.
34. Liao Z, Lee JJ, Komaki R, et al. Bayesian adaptive randomization trial of passive scattering proton therapy and intensity-modulated photon radiotherapy for locally advanced non-small-cell lung cancer. J Clin Oncol 2018; 36(18): 1813–1822.
35. Jethwa KR, Tryggestad EJ, Whitaker TJ, et al. Initial experience with intensity modulated proton therapy for intact, clinically localized pancreas cancer: Clinical implementation, dosimetric analysis, acute treatment-related adverse events, and patient-reported outcomes. Adv Radiat Oncol 2018; 3(3): 314–321.
36. Terashima K, Demizu Y, Hashimoto N, et al. A phase I/II study of gemcitabine-concurrent proton radiotherapy for locally advanced pancreatic cancer without distant metastasis. Radiother Oncol 2012; 103(1): 25–31.
37. Kim TH, Lee WJ, Woo SM, et al. Effectiveness and safety of simultaneous integrated boost-proton beam therapy for localized pancreatic cancer. Technol Cancer Res Treat 2018; 17 : 533033818783879.
38. Nakayama H, Sugahara S, Tokita M, et al. Proton beam therapy for hepatocellular carcinoma: the University of Tsukuba experience. Cancer 2009; 115 : 5499–5506.
39. Bush DA, Kayali Z, Grove R, Slater JD. The safety and efficacy of high-dose proton beam radiotherapy for hepatocellular carcinoma: a phase 2 prospective trial. Cancer 2011; 117(13): 3053–3059.
40. Qi WX, Fu S, Zhang Q, Guo XM. Charged particle therapy versus photon therapy for patients with hepatocellular carcinoma: a systematic review and meta-analysis. Radiother Oncol 2015; 114 : 289–295.
41. Bush DA, Smith JC, Slater JD, et al. Randomized clinical trial comparing proton beam radiation therapy with transarterial chemoembolization for hepatocellular carcinoma: results of an interim analysis. Int J Radiat Oncol Biol Phys 2016; 95(1): 477–482.
42. Smith MJ, Ridgway PF, Catton CN, et al. Combined management of retroperitoneal sarcoma with dose intensification radiotherapy and resection: long-term results of a prospective trial. Radiother Oncol 2014; 110(1): 165–171.
43. National Comprehensive Cancer Network. NCCN Clinical Practice Guidelines in Oncology. Prostate cancer. Version 4.2018 [online]. Dostupné z: https://www.nccn.org/professionals/physician_gls/pdf/prostate.pdf [cit. 2018-11-02].
44. Bryant C, Smith TL, Henderson RH, et al. Five-year biochemical results, toxicity, and patient-reported quality of life after delivery of dose-escalated image guided proton therapy for prostate cancer. Int J Radiat Oncol Biol Phys 2016; 95(1): 422–434.
45. Takagi M, Demizu Y, Terashima K, et al. Long-term outcomes in patients treated with proton therapy for localized prostate cancer. Cancer Med 2017; 6(10): 2234–2243.
46. Iwata H, Ishikawa H, Takagi M, et al. Long-term outcomes of proton therapy for prostate cancer in Japan: a multi-institutional survey of the Japanese Radiation Oncology Study Group. Cancer Med 2018; 7(3): 677–689.
47. Ho CK, Bryant CM, Mendenhall NP, et al. Long-term outcomes following proton therapy for prostate cancer in young men with a focus on sexual health. Acta Oncol 2018; 57(5): 582–588.
48. Darby SC, Ewertz M, McGale P, et al. Risk of ischemic heart disease in women after radiotherapy for breast cancer. N Engl J Med 2013; 368(11): 987–998.
49. Cheng YJ, Nie XY, Ji CC. Long-term cardiovascular risk after radiotherapy in women with breast cancer. J Am Heart Assoc 2017; 6(5): pii: e005633.
50. Nilsson G, Holmberg L, Garmo H, et al. Distribution of coronary artery stenosis after radiation for breast cancer. J Clin Oncol 2012; 30(4): 380–386.
51. Particle Therapy Co-Operative Group. Particle therapy centers [online]. Dostupné z: www.ptcog.ch [cit. 2018-11-02].
52. Health Council of the Netherlands. Proton radiotherapy. Horizon scanning report.
The Hague: Health Council of the Netherlands, 2009; publication No. 2009/17E.
Štítky
Praktické lékařství pro děti a dorost Praktické lékařství pro dospělé Hematologie a transfuzní lékařství Chirurgie všeobecná Onkologie Otorinolaryngologie Urologie
Článek vyšel v časopisePraktický lékař
Nejčtenější tento týden
2019 Číslo 1- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- S MUDr. Štěpánem Budkou o rizicích obezity pro fertilitu ze všech úhlů pohledu
- S prof. Vladimírem Paličkou o racionální suplementaci kalcia a vitaminu D v každodenní praxi
-
Všechny články tohoto čísla
- Pracovní vytížení praktických lékařů pro děti a dorost v Česku pohledem samotných lékařů
- Chronický stres jako rizikový faktor výskytu a progrese rakoviny?
- Osobná dôstojnosť pacientky so sklerózou multiplex: interpretatívno fenomenologická analýza
- Přístup lékařů a manažerů ambulantních zdravotnických zařízení k obdrženým stížnostem
- Protonová radioterapie v léčbě solidních nádorů
- Zdravotní gramotnost romské minority v České republice
- Život s Crohnem – pohled z kožní ordinace + autentické sdělení pacientky
- Chirurgie a tělocvik
- Odešel nestor olomouckého tělovýchovného lékařství: prof. MUDr. Zdeněk Jirka, CSc. (1928–2018)
- Epidemie chytrých telefonů Nebezpečí pro zdraví, vzdělání a společnost
- Praktický lékař
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Chronický stres jako rizikový faktor výskytu a progrese rakoviny?
- Protonová radioterapie v léčbě solidních nádorů
- Osobná dôstojnosť pacientky so sklerózou multiplex: interpretatívno fenomenologická analýza
- Zdravotní gramotnost romské minority v České republice
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



